שאלות
שאלה 1 - תגובות אנדותרמיות ואנתלפיה
מה ההיגד הנכון עבור תגובה כימית שסופחת חום מהסביבה החיצונית?
- התגובה אקסותרמית והאנתלפיה חיובית
- התגובה אנדותרמית והאנתלפיה חיובית
- התגובה אנדותרמית והאנתלפיה שלילית
- התגובה אקסותרמית והאנתלפיה שלילית
תגובה שסופחת חום מהסביבה החיצונית היא אנדותרמית. תגובה אנדותרמית בעלת אנתלפיה חיובית.
שאלה 2 - חישוב טמפרטורה התחלתית במתכת בתהליך חילוף חום
דוגמה של מתכת אלומיניום במשקל 250 גרם מוכנסת למים בטמפרטורה של \( 25^\circ \text{C} \). בתהליך זה המים סופגים \( 264 \, \text{J} \) חום מהמתכת והטמפרטורה של המים עולה ל-\( 34.9^\circ \text{C} \). מה הייתה הטמפרטורה ההתחלתית של מתכת אלומיניום?
נתון:
-
\( C_{\text{Al}} = 0.900 \, \text{J/g°C} \) -
\( C_{\text{H2O}} = 4.18 \, \text{J/g°C} \) - מסה של מתכת האלומיניום: \( 250 \, \text{g} \)
חישוב:
הנוסחה לאנרגיית החום שנספגת על ידי המים או מתקבלת מהאלומיניום ניתנת על ידי:
במקרה הזה נתנו לנו במפורש:
מה שחשוב להבין זה שהחום שסופג האלומיניום שווה לחום שמועבר למים, כלומר:
- 11.2°C
- 46.6°C
- 64.31°C
- 36.10°C
- הנתון על קיבולת המים כנראה היה מיותר, להבנתי.
- צריך להיזהר לא להתבלב בין \( q \) שמסמן אנרגיית חום, לבין טמפרטורה.
שאלה 3 - אנרגיה כוללת לחימום קרח למים
חשבו את האנרגיה הכוללת הנדרשת לחימום של 40 גרם קרח מ־35°C־ למים ב־40°C.
נתון:
- \( C_{\text{Ice}} = 2.01 \, \text{J/g°C} \)
- \( C_{\text{Water}} = 4.18 \, \text{J/g°C} \)
- \( \Delta H_{\text{Fusion}} = 334 \, \text{J/g} \)
- 101.1kJ
- 22.9kJ
- 6688J
- 160kJ
הערות: הפתרון התקבל מפיצול התהליך לשלושה שלבים:
העלאת הקרח מטפרטורה של -35°C ל-0° \[ 40 \, \text{g} \cdot 2.01 \, \text{J/g°C} \cdot 35 \, \text{°C} = 2821 \, \text{J} \] המסת הקרח: \[ 40 \, \text{g} \cdot 334 \, \text{J/g} = 13360 \, \text{J} \] חימום המים מ-0°C ל-40°C: \[ 40 \, \text{g} \cdot 4.18 \, \text{J/g°C} \cdot 40 \, \text{°C} = 6688 \, \text{J} \] סך הכל: \( 22869\ \text{J} \approx 22.9 \, \text{kJ} \)
שאלה 4 - הגדרת פונקציית מצב בתרמוכימיה
איזה מהמשפטים הבאים מתאר פונקציית מצב בתרמוכימיה?
- אנרגיית החום שנבלעה על ידי מערכת בלחץ קבוע פחות העבודה שעשתה המערכת
- תכונה של מערכת שתלויה רק במצב הנוכחי של המערכת, ולא בעבודה שהמערכת עברה כדי להגיע למצב זה
- תכונה של מערכת שאינה תלויה במסלול שננקט בין המצב ההתחלתי למצב הסופי
- סכום האנרגיה הקינטית והפוטנציאלית הכלולה בתגובה כימית
השאלה הייתה מבלבלת לדעתי. ההגדרה של פונקציית מצב בשקפים איפשרה לדעתי לקבל יותר מתשובה אחת.
שאלה 5 - שינוי באנרגיה הפנימית של מערכת - חום ועבודה
מערכת כימית עוברת תהליך כימי בשני שלבים. בשלב הראשון המערכת קולטת מהסביבה \( 73 \, \text{J} \) ונעשית עליה עבודה של \( 35 \, \text{J} \). בשלב השני המערכת קולטת מהסביבה \( 35 \, \text{J} \) והמערכת עושה \( 72 \, \text{J} \) עבודה על הסביבה.
מה השינוי באנרגיה הפנימית?
- 71J
- 0J
- -72J
- לא ניתן לחשב ללא ידיעה של טמפרטורת המערכת
"Work is negative when energy is transferred out of the system and is positive when energy is transferred into the system. This is consistent with the signs associated with the heat of a reaction 1q2 during exothermic and endothermic processes."
| סוג | תנאי | תיאור |
|---|---|---|
| חום (q) | q > 0 | כאשר המערכת קולטת חום מהסביבה. |
| חום (q) | q < 0 | כאשר המערכת פולטת חום לסביבה. |
| עבודה (w) | w > 0 | כאשר נעשית עבודה על המערכת. |
| עבודה (w) | w < 0 | כאשר המערכת עושה עבודה על הסביבה. |
שאלה 6 - שימוש בחוק הס
\[ \text{H}_{2(g)} + \text{Cl}_{2(g)} \rightarrow 2\text{HCl}_{(g)} \quad \Delta H = -185 \, \text{kJ} \] \[ \text{C}_2\text{H}_{4(g)} + \text{HCl}_{(g)} \rightarrow \text{C}_2\text{H}_5\text{Cl}_{(l)} \quad \Delta H = -65 \, \text{kJ} \] \[ \text{C}_2\text{H}_3\text{Cl}_{(g)} + \text{H}_{2(g)} \rightarrow \text{C}_2\text{H}_{5}\text{Cl}_{(l)} \quad \Delta H = -140 \, \text{kJ} \]
על בסיס הנתונים, חשבו את האנרגיה של התגובה: \[ \text{C}_2\text{H}_{4(g)} + \text{Cl}_{2(g)} \rightarrow \text{C}_2\text{H}_3\text{Cl}_{(g)} + \text{HCl}_{(g)} \quad \Delta H = ? \]
נחבר את הריאקציה הראשונה והשנייה כדי שייצטמצם HCl אחד: \[ \text{H}_{2(g)} + \text{Cl}_{2(g)} + \text{C}_2\text{H}_{4(g)} \rightarrow \text{HCl}_{(g)} + \cancel{\text{C}_2\text{H}_{5}\text{Cl}_{(l)}} \quad \Delta H = -185 + \left(-65\right) = -250\, \text{kJ} \] נהפוך את הריאקציה השלישית כדי שיהיה בתוצרים \( \text{C}_2\text{H}_3\text{Cl}_{(g)} \): \[ \cancel{\text{C}_2\text{H}_{5}\text{Cl}_{(l)}} \rightarrow \text{C}_2\text{H}_3\text{Cl}_{(g)} + \text{H}_{2(g)} \quad \Delta H = +140\, \text{kJ} \] נחבר את מה שקיבלנו ואז הנוזל והמימן יצטמצמו: \[ \cancel{\text{H}_{2(g)}} + \text{Cl}_{2(g)} + \text{C}_2\text{H}_{4(g)} \rightarrow \text{HCl}_{(g)} + \text{C}_2\text{H}_{3}\text{Cl}_{(g)} + \cancel{\text{H}_{2(g)}} \quad \Delta H = -250 + \left(+140\right) = -110\, \text{kJ} \]
- -65kJ
- +125kJ
- 148kJ
- -110kJ
הסוג הזה של השאלות יכול לקחת הרבה זמן, הייתי מציע לדלג עליהן ולחזור בהמשך.
שאלה 7 - מבנה רזוננס
באיזה מבין המולקולות הבאות יש מבנה רזוננס (resonance)?
- NO3
- CH2Cl2
- CH4
- NH3
מבנה רזוננס מתקבל כאשר יש כמה חלופות למבנה של המולקולה. במקרה של NO3 יש כמה חלופות למבנה של המולקולה.
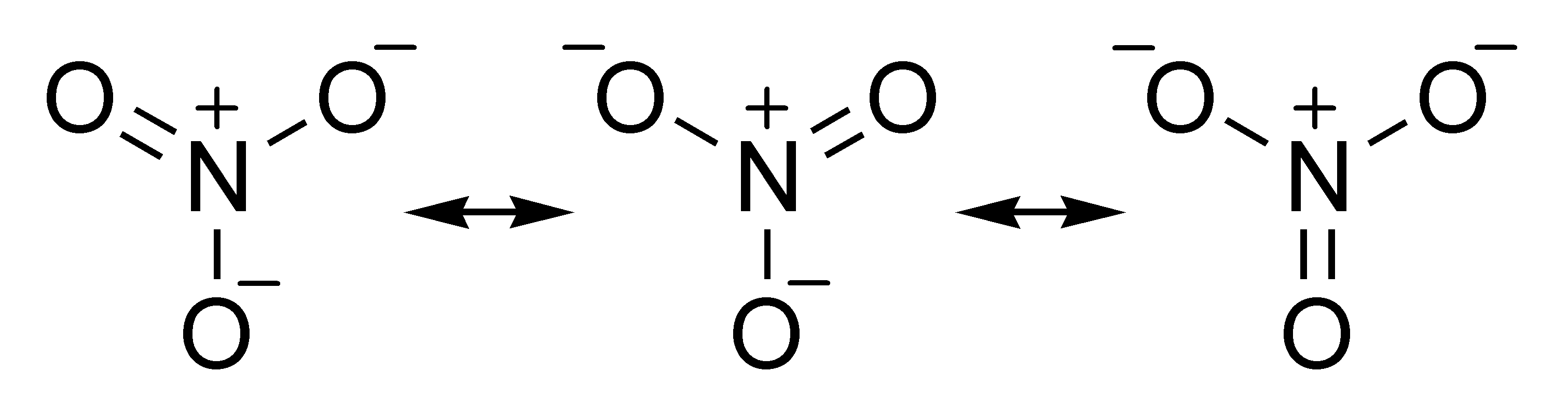
שאלה 8 - מבנה לואיס
מהו מבנה לואיס הנכון עבור המולקולה HCN?
\[ \text{H} - \text{C} \equiv \text{N:} \]
שאלה 9 - היברידיזציה
מה ההיברידיזציה (hybridization) של האטום המרכזי במולקולה AlBr3?
- sp
- sp3
- sp2
- sp3d
תשומת הלב שיש כאן חריגה מכלל האוקטט. \[ \begin{array}{ccc} & \Large{\cdot\cdot} & \\[-16pt] & \mathbf{:} \text{Br} \mathbf{:}& \\[-6pt] & | & \\ & \text{Al} & \\[-6pt] & / \ \ \backslash & \\ \mathbf{:}\text{Br}\mathbf{:} & & \mathbf{:}\text{Br}\mathbf{:} &\\[-16pt] \Large{\cdot\cdot} & & \Large{\cdot\cdot} \end{array} \]
שאלה 10 - מטען פורמלי
מה ההיגד הנכון לגבי המטען הפורמלי במולקולה CO?
- המטען הפורמלי על פחמן אפס והמטען הפורמלי על חמצן אפס
- המטען הפורמלי על פחמן 1- והמטען הפורמלי על חמצן 1+
- המטען הפורמלי על פחמן 1+ והמטען הפורמלי על חמצן 1-
- המטען הפורמלי על פחמן 2- והמטען הפורמלי על חמצן 2+
הנוסחה למטען פורמאלי היא:
\[ \text{Formal Charge} = \text{Valence Electrons} - \text{Nonbonding Electrons} - \frac{1}{2} \times \text{Bonding Electrons} \]מבנה לואיס של CO מבלבל לדעתי, יש קשר משולש בין פחמן לחמצן ולכל אטום זוג אלקטרונים:
\[ \text{:C}\equiv\text{O:} \]נציב בנוסחה: \[ \text{FC}_{\text{C}} = 4 - 2 - \frac{1}{2} \times 6 = -1 \] \[ \text{FC}_{\text{O}} = 6 - 2 - \frac{1}{2} \times 6 = 1 \]
שאלה 11 - קוטביות
איזה מבין המולקולות הבאות אינה קוטבית?
- H2O
- CO2
- NH3
- H2S
"\( \text{CO}_2 \). Carbon dioxide molecules are nonpolar. To understand this observa- tion, we need to distinguish between the displacement of electron charge density in a particular bond and in the molecule as a whole. The elec- tronegativity difference between C and O causes a displacement of elec- tron charge density toward the O atom in each carbon-to-oxygen bond and gives rise to a bond dipole. However, because the two bond dipoles are equal in magnitude and point in opposite directions, they cancel each other and lead to a resultant dipole moment of zero for the molecule. The symmetrical nature of the electron charge density is clear in the electrosta- tic potential map for \( \text{CO}_2 \) shown in the margin. OCOm50 The fact that \( \text{CO}_2 \) is nonpolar is experimental proof that the three atoms in the molecule lie along a straight line in the order O¬C¬O. Of course, we can also predict that \( \text{CO}_2 \) is a linear molecule with the VSEPR theory, based on the Lewis structure OCO"
שאלה 12 - מבנה מרחבי
איזה מבין המולקולות הבאה יש לה מבנה מרחבי של ביפירמידה טריגונלית?
- NF3
- SF6
- XeF4
- PF5
PF₅
שאלה 13 - קוטביות
מה ההיגד הנכון לגבי המולקולה CS2?
- המולקולה לינארית ואינה קוטבית
- המולקולה במבנה משולש מישורי ואינה קוטבית
- המולקולה במבנה טטראדר וקוטבית
- המולקולה לינארית וקוטבית
CS₂
שאלה 14 - לחץ אוסמוטי
חשבו את הלחץ האוסמוטי בתמיסה כאשר 50 גרם אנזים במשקל מולקולרי של \( 98,000 \, \text{g/mol} \) מומסים בתמיסה מימית בנפח של \( 2,600 \, \text{mL} \) ב-30°C.
- 2.48mmHg
- 1.68mmHg
- 3.77mmHg
- 0.484mmHg
הנוסחה ללחץ אוסמוטי היא: \[ \pi = \text{MRT}_{\text{K}} \] כאשר קבוע הגזים הוא \( \text{R}=0.0821 \, \text{L} \cdot \text{atm} \cdot \text{K}^{-1} \cdot \text{mol}^{-1} \).
נחשב את המולים בתמיסה: \[ \text{Moles} = \frac{50 \, \text{g}}{98,000 \, \text{g/mol}} = 0.00051 \, \text{mol} \] מכאן שהמולליות בתמיסה היא \[ \frac{0.00051 \, \text{mol}}{2.6 \, \text{L}} \approx 0.0002 \, \text{mol/L} \] נחשב את הלחץ האוסמוטי: \[ \pi = 0.0002 \, \text{mol/L} \cdot 0.0821 \, \text{L} \cdot \text{atm} \cdot \text{K}^{-1} \cdot \text{mol}^{-1} \cdot 303 \, \text{K} = 0.0048 \, \text{atm} \] נמיר למיליליטר כספית דרך הכפלה ב-760: \[ 0.0048 \, \text{atm} \cdot 760 \, \text{mmHg/atm} \approx 3.7 \, \text{mmHg} \]
שאלה 15 - שבר מולרי
אצטון ומתנול יוצרים תמיסה אידאלית. לחץ האדים ב-25°C של אצטון טהור הוא \( 0.342 \, \text{atm} \) ושל מתנול טהור \( 0.188 \, \text{atm} \). חשבו את השבר המולרי של מתנול בתמיסה כאשר לחץ האדים מעל התמיסה הוא \( 0.248 \, \text{atm} \).
- 0.125
- 0.610
- 0.401
- 0.500
שאלה 16 - סדר קשר
מה הוא סדר הקשר (bond order) על פי תורת האורביטלים המולקולריים עבור המולקולה O2+?
- 2
- 2.5
- 3.5
- 1.5
\( \text{BO}_{\text{O}_2^{+}} = \frac{8 - 3}{2} = 2.5 \)
שאלה 17 - אנתלפיית התאדות
חשבו את אנתלפיית ההתאדות \(\Delta H_{\text{vap}}\) של אתנול אם ידוע כי בטמפרטורה של 40°C לחץ האדים שלו הוא \( 150 \, \text{mmHg} \) ונקודת הרתיחה הנורמלית של אתנול היא 78°C.
- 42 J/mol
- 39 kJ/mol
- 20 kJ/mol
- 0.02 kJ/mol
שאלה 18 - נקודת רתיחה
תמיסה של 10 גרם של נתרן כלורי (NaCl) מומסת ב-100 גרם מים. מה תהיה נקודת הרתיחה של התמיסה? הניחו התמוססות מלאה.
נתון: \( K_b \) (קבוע עלייה ברתיחה של מים) הוא \( 0.52^{\circ} C/m \).
- 101.78°C
- 99.78°C
- 102.78°C
- 100.0078°C
נחשב את דלטה בי (boiling) בעזרת הנוסחה: \[ \Delta T_b = i \cdot K_b \cdot m \] נחשב את המולליות של התמיסה (m): המשקל המולארי של NaCl הוא 58.5 גרם/מול. בעזרת ערך משולש נקבל: \[ 1 \, \text{mol} \, \text{NaCl} = 58.5 \, \text{g} \] \[ x \, \text{mol} \, \text{NaCl} = 10 \, \text{g} \] \[ x = \frac{10}{58.5} \approx 0.17 \, \text{mol} \]
נעבור למולליות: \[ m = \frac{0.17 \, \text{mol}}{0.1 \, \text{L}} = 1.7 \, \text{mol/L} \]
נשים לב ש \( i = 2 \) משום שהתמיסה היא של NaCl, שמתפרק לשני יונים. אז נציב בנוסחה ונקבל: \[ \Delta T_b = 2 \times 0.52 \times 1.7 \approx 1.77 \]
נציב בנוסחה: \[ 100 + 1.77 \approx 101.78 \]
שאלה 19 - שבר מולרי ומולליות
מכינים תמיסה המכילה 0.850 גרם אמוניה (NH3) ב-125 גרם מים. חשבו את השבר המולרי (mole fraction) והמלליות (molality) של התמיסה.
- שבר מולי של 0.00714 ומולליות של 0.399
- שבר מולי של 0.00714 ומולליות של 3.99
- שבר מולי של 0.714 ומולליות של 0.399
- שבר מולי של 0.714 ומולליות של 0.0039
השאלה בעיקר מצריכה לדעתי הבחנה בין המושגים:
- שבר מולי (mole fraction \( X_i \)) - מציין את היחס בין כמות של חומר i (במולים) לכמות כל החומרים בתמיסה: \[ X_i = \frac{\text(Amount of component i (in moles)}{\text{Total amount of all components (in moles)}} \]
- מולליות (molality) - מציין את כמות המומס (במולים) ביחס למסת התמיסה (בק״ב): \[ m = \frac{\text{Amount of solute (in moles)}}{\text{Mass of solvent (in kg)}} \]
נתחיל מחישוב מספר המולים של האמוניה: \[ \text{Molar mass of NH}_3 = 17 \, \text{g/mol} \] \[ \text{Moles of NH}_3 = \frac{0.850 \, \text{g}}{17 \, \text{g/mol}} = 0.05 \, \text{mol} \] נחשב את מספר המולים של המים: \[ \text{Moles of H}_2\text{O} = \frac{125 \, \text{g}}{18 \, \text{g/mol}} = 6.94 \, \text{mol} \] נחשב את השבר המולרי: \[ X_{\text{NH}_3} = \frac{0.05}{0.05 + 6.94} = 0.00714 \] נחשב את המולליות: \[ m = \frac{0.05}{0.125 + 0.000850} = 0.399 \]