מבוא: התהליך ההפוך לאקסוציטוזה
אנדוציטוזה מהווה תהליך תאי יסודי המאפשר הכנסת חומרים מהסביבה החיצונית אל תוך התא. בניגוד לאקסוציטוזה, שבה חומרים מופרשים מהתא החוצה, אנדוציטוזה מאפשרת לתאים לקלוט מולקולות גדולות שאינן יכולות לחצות את הממברנה באמצעות טרנספורטרים או תעלות יוניות. כל תא פעיל מבצע אנדוציטוזה באופן מתמיד, כאשר התהליך חיוני לקליטת חלבונים, ליפידים, וחומרים מורכבים אחרים.
התהליך כרוך ביצירת שלפוחיות (וזיקולות) מהממברנה הפלסמטית, כאשר חלק מהממברנה מתקפל פנימה ונסגר ליצירת שלפוחית המכילה חומרים מהסביבה החיצונית. חשוב להבין כי תהליך זה גורע משטח הממברנה, ולכן מתקיים באופן מתמיד איזון עדין עם תהליכי אקסוציטוזה להחזרת ממברנה לפני השטח של התא.
סוגי אנדוציטוזה: פינוציטוזה ופגוציטוזה
שימו לב: בדרך כלל היה בצד שמאל את ה-ER או הגרעין בצד שמאל ואת הממברנה של התא בצד ימין. כאן הופכים את הכיוון - הפעם הממברנה בצד שמאל ושאר האברונים בצד ימין.
פינוציטוזה - “שתייה תאית”
פינוציטוזה (מהמילה הלטינית “pino” - לשתות) מייצגת את התהליך הנפוץ ביותר של אנדוציטוזה. בתהליך זה נוצרות שלפוחיות (בועיות) קטנות יחסית, בקוטר של כ-150-100 ננומטר, העטופות בחלבון קלתרין (clathrin).
התהליך מתרחש באופן קונסטיטוטיבי בכל התאים, כאשר קצב הפינוציטוזה משתנה בהתאם לסוג התא ולתפקידו הפיזיולוגי.
מאפיינים מרכזיים של פינוציטוזה:
- יצירת שלפוחיות קטנות עטופות קלתרין
- תהליך מתמשך וקבוע
- קליטת נוזלים וחומרים מומסים
- מנגנון סלקטיבי באמצעות רצפטורים
פגוציטוזה - “אכילה תאית”
פגוציטוזה (מהמילה הלטינית “phago” - לאכול) מאופיינת בקליטת חלקיקים גדולים במיוחד, כגון חיידקים, תאים מתים, או שברי תאים. בניגוד לפינוציטוזה, השלפוחיות הנוצרות בפגוציטוזה גדולות משמעותית (מעל מיקרומטר בקוטר) ואינן עטופות בקלתרין. תהליך זה מתרחש בעיקר בתאים פגוציטיים מקצועיים כגון מקרופאגים ונויטרופילים.
המנגנון המולקולרי של פינוציטוזה
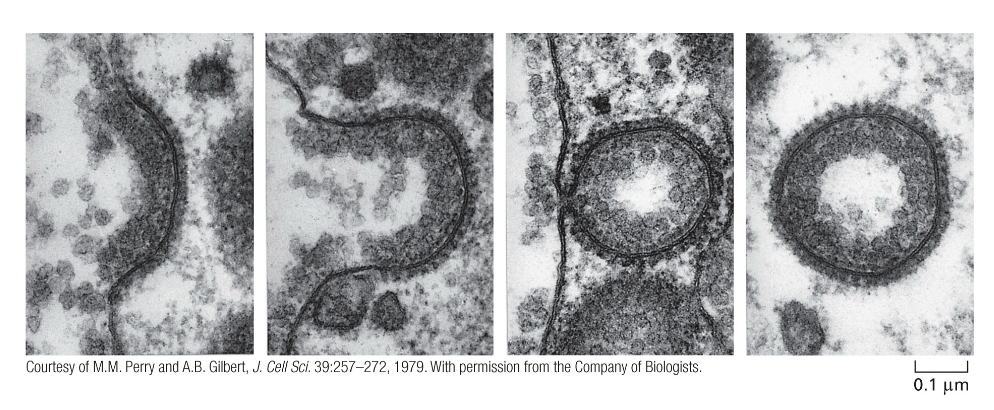
תפקיד הקלתרין ביצירת שלפוחיות
קלתרין מהווה חלבון מפתח בתהליך יצירת השלפוחיות. מולקולות הקלתרין מתארגנות ליצירת מבנה כלוב תלת-ממדי סביב הממברנה המתקפלת, תוך סיוע בעיקול הממברנה וביצירת צורת הכדור של השלפוחית. לאחר היווצרות השלפוחית והיפרדותה מהממברנה, מעטפת הקלתרין מתפרקת במהירות, מה שמאפשר לשלפוחית להתמזג עם אברונים תוך-תאיים.
דינמיקה של ממברנות במקרופאגים
מקרופאגים מדגימים את העוצמה של תהליכי האנדוציטוזה: תאים אלה ממחזרים כ-25% משטח הממברנה שלהם מדי חצי שעה. משמעות הדבר היא שתוך מספר שעות, כל שטח הממברנה של המקרופאג עובר מחזור מלא של אנדוציטוזה ואקסוציטוזה. יכולת זו חיונית לתפקודם כתאים פגוציטיים המסלקים פתוגנים ופסולת תאית.
אנדוציטוזה מתווכת-רצפטור
עקרון הסלקטיביות
תאים אינם קולטים חומרים באופן אקראי מהסביבה. במקום זאת, קיים מנגנון מתוחכם של זיהוי וקליטה סלקטיבית באמצעות רצפטורים ספציפיים. רצפטורים אלה הם חלבונים טרנסממברנליים המסוגלים לזהות ולקשור ליגנדים ספציפיים בדיוק רב. כאשר רצפטור קושר את הליגנד שלו, נוצר אות להתחלת תהליך האנדוציטוזה באזור זה של הממברנה.
דוגמה קלאסית: קליטת LDL
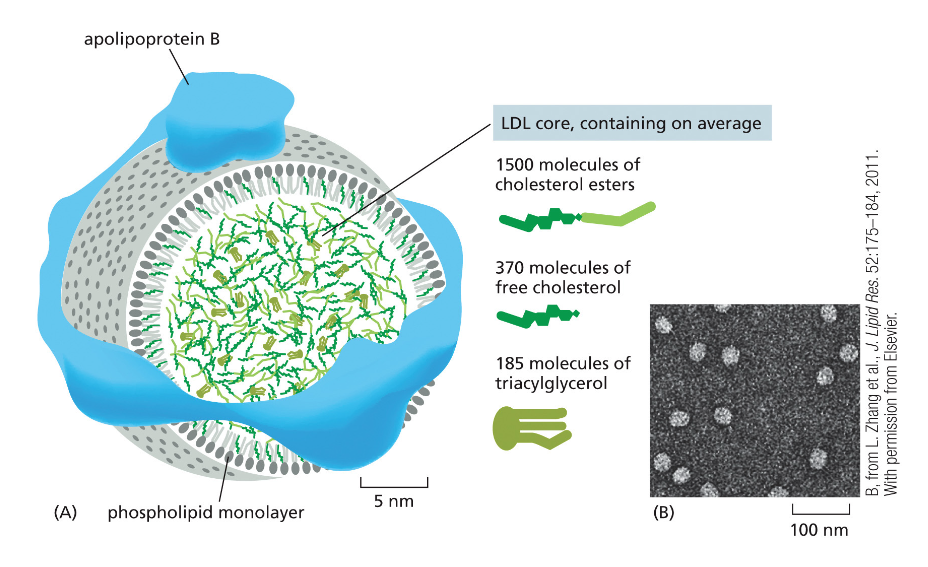
מנגנון קליטת הליפופרוטאין בצפיפות נמוכה (LDL - Low Density Lipoprotein) מהווה דוגמה מצוינת לאנדוציטוזה מתווכת-רצפטור. LDL משמש כנשא עיקרי של כולסטרול בזרם הדם, כאשר הכולסטרול ארוז בתוך מיצלה חד-שכבתית ומוקף בחלבון ApoB (Apolipoprotein B).
התהליך מתרחש בשלבים הבאים (ראינו סרטון):
-
קישור הרצפטור: רצפטורי LDL על פני התא מזהים וקושרים את חלקיקי ה-LDL באמצעות אינטראקציה ספציפית עם החלבון ApoB.
-
יצירת שלפוחית עטופת קלתרין: לאחר הקישור, האזור הממברנלי המכיל את קומפלקס הרצפטור-LDL מתחיל להתקפל פנימה, תוך יצירת שלפוחית עטופת קלתרין.
-
היפרדות מהממברנה: השלפוחית נסגרת ומשתחררת לציטופלסמה, כאשר ה-LDL נמצא כעת בתוך התא.

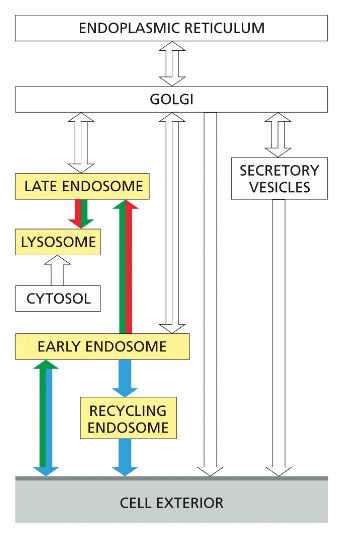
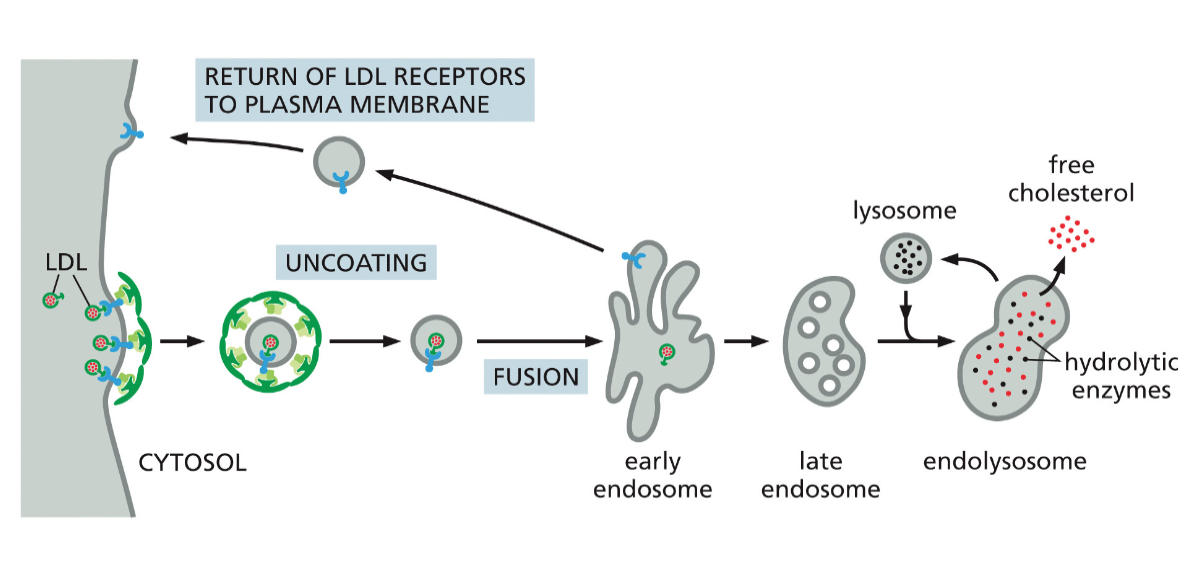
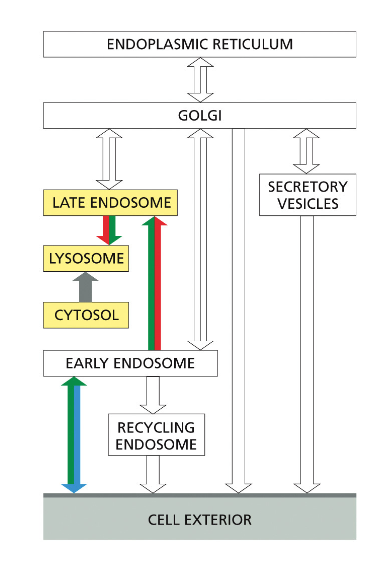
מסלול האנדוזומים והחשיבות של pH
האנדוזום המוקדם ותהליך ההבשלה
האנדוזום זה גופיף ביניים שעוזר לנו לעשות סדר: להחזיר חומרים שצריכים לחזור לגולג׳י, להחזיר רצפטורים לממברנה, ולשלוח חומרים לליזוזום לפירוק.
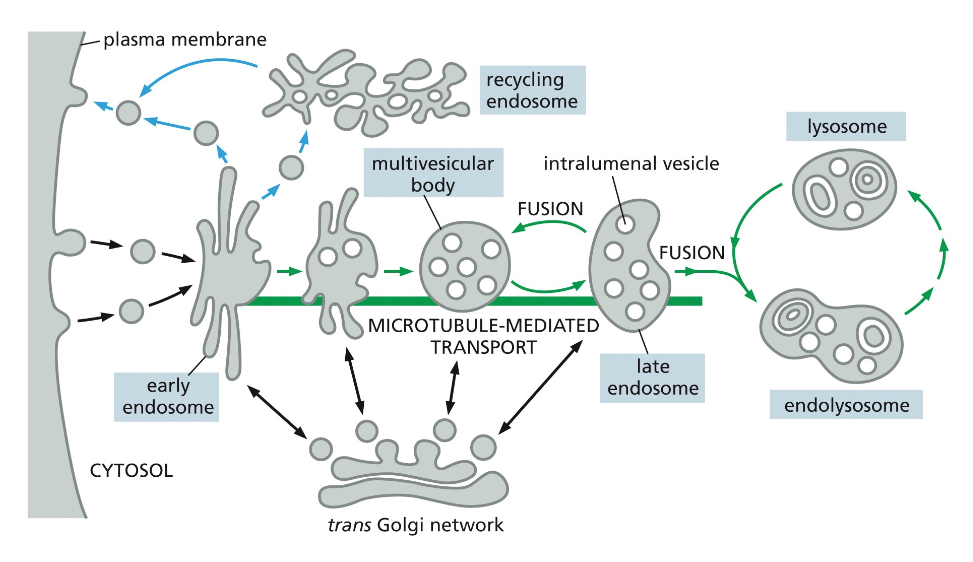
לאחר היווצרות השלפוחית האנדוציטית והסרת מעטפת הקלתרין, השלפוחית מתמזגת עם האנדוזום המוקדם (early endosome). אברון זה משמש כתחנת מיון מרכזית, שבה מתקבלות החלטות לגבי גורל החומרים השונים שהוכנסו לתא.
האנדוזום המוקדם עובר תהליך הבשלה (maturation) הדרגתי, במהלכו הוא הופך לאנדוזום מאוחר (late endosome). תהליך זה כולל:
- ירידה הדרגתית ב-pH מ-6.5 ל-5.5
- החלפת חלבונים ממברנליים אופייניים
- שינויים במורפולוגיה הפנימית
מנגנון ה-pH וההיפרדות רצפטור-ליגנד
אחד המנגנונים החשובים ביותר במערכת האנדוזומלית הוא השימוש בשינויי pH להפרדת רצפטורים מהליגנדים שלהם. ירידת ה-pH באנדוזום גורמת לשינויים קונפורמציוניים ברצפטורים רבים, מה שמוביל לירידה בזיקה לליגנד ולשחרורו.
בדוגמת ה-LDL:
- ב-pH ניטרלי (7.4) - הרצפטור קושר LDL בחוזקה
- ב-pH חומצי (5.5-6.0) - הרצפטור משחרר את ה-LDL
- ה-LDL החופשי ממשיך לליזוזום לפירוק
- הרצפטור ממוחזר חזרה לממברנה דרך האנדוזום הממחזר
מחזור רצפטורים ויעילות תאית
מחזור הרצפטורים מהווה מנגנון חיוני לשמירה על יעילות התא. במקום לייצר רצפטורים חדשים לאחר כל מחזור אנדוציטוזה, התא ממחזר את הרצפטורים הקיימים. רצפטור LDL בודד יכול לבצע מאות מחזורי קליטה במהלך חייו, מה שמדגיש את היעילות של המערכת.
האנדוזום הממחזר (recycling endosome) משחק תפקיד מרכזי בתהליך זה, כאשר הוא מפריד בין חומרים המיועדים לפירוק בליזוזום לבין רצפטורים וחלבונים אחרים שצריכים לחזור לממברנה.
טרנסציטוזה: מעבר חומרים דרך התא
מנגנון ייחודי להעברת נוגדנים
טרנסציטוזה מייצגת תהליך ייחודי שבו חומרים נקלטים בצד אחד של התא ומופרשים בצד הנגדי, ללא פירוק בליזוזום. דוגמה קלאסית לתהליך זה היא העברת נוגדנים מחלב האם לתינוק דרך תאי האפיתל במעיים.
בתינוקות יונקים, המערכת החיסונית האדפטיבית טרם התפתחה במלואה. כפיצוי, נוגדנים מסוג IgG מועברים מהאם לתינוק דרך חלב האם. תהליך זה מתאפשר הודות לרצפטורים ספציפיים על תאי האפיתל במעי התינוק.
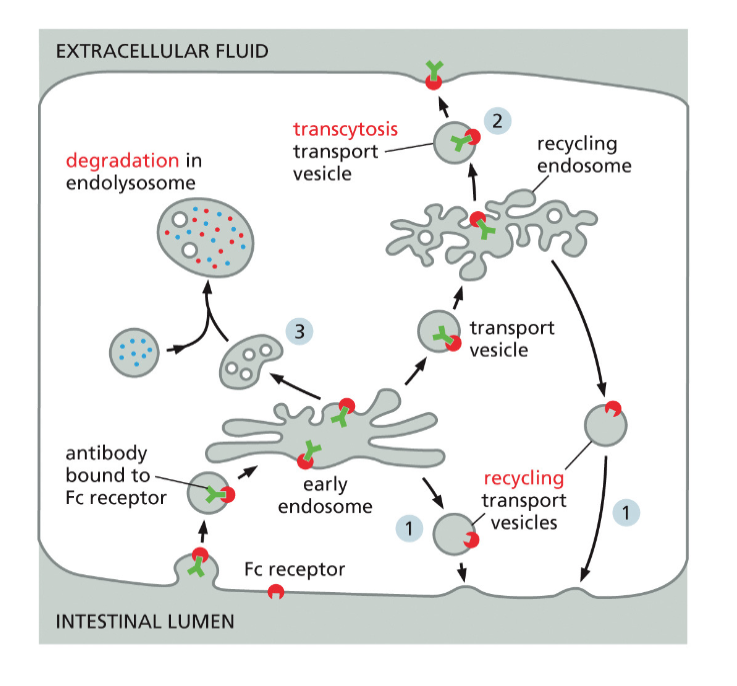
תפקיד ה-pH בטרנסציטוזה
המנגנון המולקולרי של טרנסציטוזה מדגים שימוש מתוחכם בשינויי pH:
בחלל המעי (צד אפיקלי): ה-pH חומצי (כ-6.0) בשל הפרשת חומצת הקיבה. בתנאים אלה, הנוגדנים נקשרים בחוזקה לרצפטורים שלהם. הקישור החזק בתנאי pH חומצי מנוגד למה שראינו במקרה של LDL, ומדגיש את המגוון של מנגנוני הרגולציה התאית.
במהלך הטרנספורט התוך-תאי: השלפוחית האנדוציטית שומרת על ה-pH החומצי לאורך כל מסלולה דרך התא. זה קריטי למניעת שחרור מוקדם של הנוגדנים.
בצד הבזולטרלי: כאשר השלפוחית מתמזגת עם הממברנה הבזולטרלית (הפונה לזרם הדם), היא נחשפת ל-pH הניטרלי של הנוזל הבין-תאי (pH 7.4). השינוי ב-pH גורם לשחרור הנוגדנים מהרצפטור, והם משתחררים לזרם הדם של התינוק.
מחזור הרצפטור: לאחר שחרור הנוגדן, הרצפטור חייב לחזור לצד האפיקלי להמשך תפקודו. תהליך זה מדגים את הקוטביות התפקודית של תאי אפיתל ואת החשיבות של מיון חלבונים לממברנות שונות.
ויסות דינמי של רצפטורים ממברנליים
עקרון הדסנסיטיזציה
תאים משתמשים באנדוציטוזה ככלי לוויסות רגישותם לגירויים חיצוניים. על ידי הכנסת רצפטורים מהממברנה לאנדוזומים, התא יכול להפחית את תגובתו לליגנד מסוים. תהליך זה, המכונה דסנסיטיזציה, חיוני למניעת גירוי-יתר של התא.
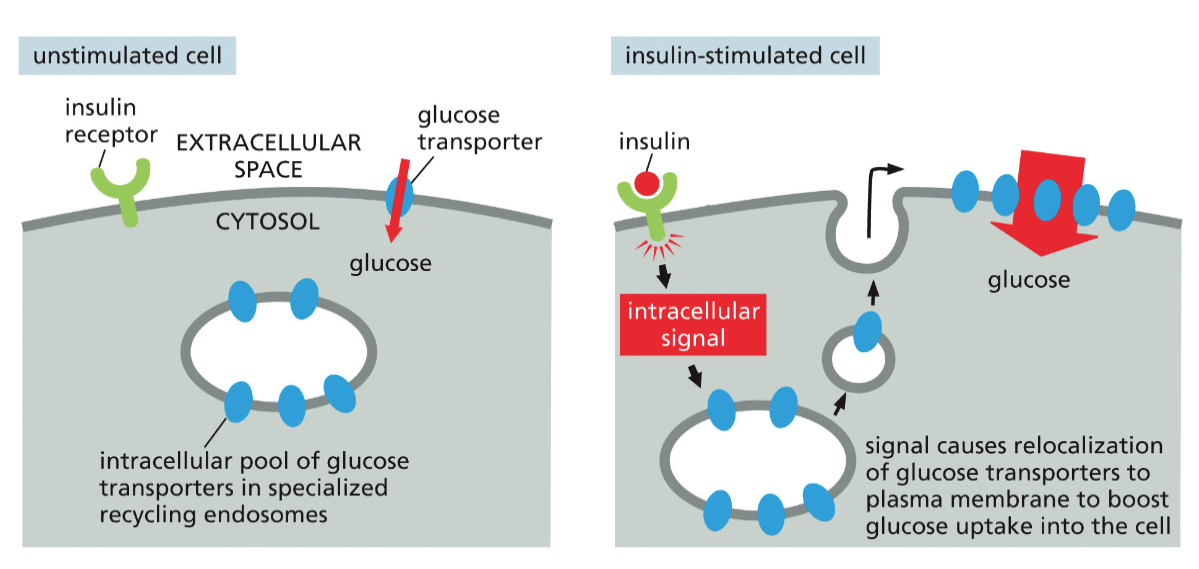
דוגמה: ויסות טרנספורטרים לגלוקוז
אחת הדוגמאות המרשימות ביותר לוויסות דינמי של רצפטורים היא השליטה על קליטת גלוקוז בתאי שריר ורקמת שומן:
במצב צום: רוב הטרנספורטרים לגלוקוז (GLUT4) מאוחסנים בשלפוחיות אנדוזומליות בתוך התא. רמת הגלוקוז בדם נשמרת על ידי הכבד, ותאי השריר והשומן קולטים מינימום גלוקוז.
לאחר ארוחה: עליית רמת הגלוקוז בדם גורמת להפרשת אינסולין מתאי בטא בלבלב. האינסולין נקשר לרצפטורים שלו על תאי המטרה ומפעיל מסלול איתות תוך-תאי.
תגובת התא: מסלול האיתות גורם לשלפוחיות המכילות GLUT4 לנוע לממברנה ולהתמזג איתה. תוך דקות, מספר הטרנספורטרים לגלוקוז על פני התא עולה פי 20-10, מה שמאפשר קליטה מהירה של גלוקוז מהדם.
חזרה למצב בסיסי: כאשר רמות האינסולין יורדות, הטרנספורטרים עוברים אנדוציטוזה חזרה לתוך התא, ומאוחסנים עד לארוחה הבאה.
מנגנון זה חיוני לשמירה על הומאוסטזיס של גלוקוז. פגיעה בו (כמו בסוכרת סוג 2) גורמת להיפרגליקמיה ולסיבוכים מטבוליים חמורים.
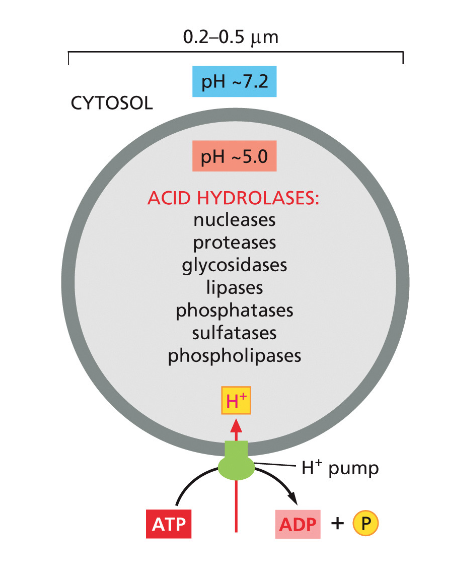
הליזוזום: מרכז הפירוק התאי
מאפיינים ביוכימיים
הליזוזום מכיל מעל 50 אנזימי הידרוליזה שונים, המסוגלים לפרק כמעט כל מקרומולקולה ביולוגית:
- נוקלאזות: מפרקות DNA ו-RNA
- פרוטאזות: מפרקות חלבונים לחומצות אמינו
- ליפאזות: מפרקות ליפידים
- גליקוזידאזות: מפרקות פחמימות
כל האנזימים הליזוזומליים פועלים באופן אופטימלי ב-pH חומצי (5.0-4.5). תכונה זו משמשת כמנגנון בטיחות - אם הליזוזום נפרץ והאנזימים משתחררים לציטופלסמה (pH 7.2), פעילותם מופחתת משמעותית.
מנגנון שמירת ה-pH החומצי
משאבת ה-ATPase V-type (משאבות פרוטונים ($\ce{H^+}$)) אחראית לשאיבת פרוטונים לתוך הליזוזום תוך ניצול אנרגיה מ-ATP. המשאבה יוצרת ריכוז פרוטונים גבוה פי 1000-100 מהציטופלסמה.
הגנה על האנזימים הליזוזומליים
אנזימי הליזוזום עצמם מוגנים מפירוק על ידי גליקוזילציה נרחבת. שרשראות הסוכר הארוכות יוצרות מעטפת מגן סביב האנזימים, המונעת מפרוטאזות אחרות לגשת לאתרי החיתוך. זהו פתרון אלגנטי לבעיה של “מי מפרק את המפרקים”.
אוטופגיה: מיחזור תוך-תאי
מנגנון האוטופגיה
אוטופגיה (מיוונית: “אכילה עצמית”) היא תהליך שבו התא מפרק ומחזר את מרכיביו הפנימיים. בניגוד לאנדוציטוזה, הקולטת חומרים חיצוניים, אוטופגיה מטפלת באברונים פגומים, צברי חלבונים, ומרכיבים תוך-תאיים אחרים.
יצירת האוטופגוזום
התהליך מתחיל ביצירת ממברנה כפולה ייחודית (double membrane) המקיפה את החומר המיועד לפירוק. מבנה זה, הנקרא אוטופגוזום, מכיל שתי ממברנות ביליפיד - סך הכל ארבע שכבות ליפידיות. המורפולוגיה הייחודית נובעת מתהליך היווצרות מיוחד שבו ממברנה שטוחה מתעקלת ונסגרת על עצמה.
חשיבות פיזיולוגית של אוטופגיה
אוטופגיה חיונית לתפקוד תקין של התא:
-
מיחזור אברונים: מיטוכונדריה פגומות, פרוקסיזומים ישנים, וחלקי רשת אנדופלסמית יכולים להיות מפורקים ומרכיביהם ממוחזרים.
-
סילוק צברי חלבונים: חלבונים שלא התקפלו כראוי או צברים גדולים של חלבונים אינם יכולים להיות מפורקים בפרוטאזום. אוטופגיה היא הדרך היחידה לסלק אותם.
-
הישרדות בתנאי רעב: בהיעדר חומרי מזון, התא יכול לפרק חלבונים ואברונים לא חיוניים כדי לספק אבני בניין לסינתזה של חלבונים חיוניים.
אוטופגיה ומחלות נוירודגנרטיביות
הקשר בין פגמים באוטופגיה למחלות נוירודגנרטיביות נובע ממספר גורמים:
-
נוירונים הם תאים פוסט-מיטוטיים: בניגוד לרוב תאי הגוף, נוירונים בוגרים אינם מתחלקים. הם חייבים לתפקד לאורך כל חיי האורגניזם ולכן תלויים במיוחד במנגנוני ניקוי יעילים.
-
הצטברות צברי חלבונים: במחלות כמו אלצהיימר ופרקינסון, נוצרים צברי חלבונים (פלאקים של בטא-עמילואיד, גופיפי לואי) שרק אוטופגיה יכולה לסלק.
-
נזק מצטבר: פגיעה חלקית באוטופגיה גורמת להצטברות איטית של נזקים. התסמינים הקליניים מופיעים רק לאחר שכ-50% מהנוירונים באזור מסוים מתו - עדות לכושר הפיצוי המרשים של המוח.
מחלות אוטופגיה ומעי
מחקרים עדכניים מצביעים על קשר בין פגמים באוטופגיה למחלות מעי דלקתיות. תאי פאנת (Paneth cells) במעי, האחראים להפרשת פפטידים אנטי-מיקרוביאליים, משתמשים באוטופגיה גם כמנגנון הפרשה חלופי כאשר מסלול הגולג׳י נפגע על ידי פתוגנים. פגיעה ביכולת זו עלולה לתרום להתפתחות מחלות כמו קרוהן.
סיכום: רשת משולבת של מסלולי הובלה
מערכת האנדוציטוזה, הליזוזומים והאוטופגיה יוצרות רשת משולבת המאפשרת לתא לקלוט חומרים מהסביבה, למחזר מרכיבים פנימיים, ולשמור על הומאוסטזיס. ההבנה המעמיקה של מנגנונים אלה חיונית להבנת פתולוגיות רבות ולפיתוח טיפולים חדשניים למחלות ניווניות, מטבוליות ודלקתיות.
דור פסקל