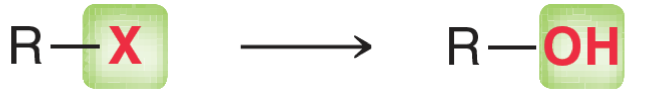
הוספנו סיכומים ערוכים וממוקדים בראשי השיעורים והתרגולים הרלוונטיים.
מומלץ לעיין בנוסחים המעודכנים בדפי התרגולים, למשל בדפים הבאים:
בהצלחה!
שיעורים 2-1: חומצות ובסיסים, משפחות חומרים אורגניים ואלקנים (Alkanes & Alkenes) חומציות גורם השפעה דוגמה הסבר אלקטרושליליות ↑ אלקטרושליליות = ↑ חומציות $\ce{HF > H2O > NH3 > CH4}$ אטום אלקטרושלילי מייצב אניון גודל אטום ↑ גודל = ↑ חומציות $\ce{HI > HBr > HCl > HF}$ אטום גדול מפזר מטען טוב יותר רזוננס ↑ רזוננס = ↑ חומציות פנול (10) > אלכוהול (16) דלוקליזציה מייצבת אניון אפקט אינדוקטיבי קבוצות מושכות $e^-$ = ↑ חומציות $\ce{CCl3COOH}$ (0.7) < $\ce{ClCH2COOH}$ (2.9) < $\ce{CH3COOH}$ (4.7) משיכת אלקטרונים מייצבת אניון היברידיזציה $sp > sp^2 > sp^3$ $\ce{HC≡CH}$ (25) > $\ce{H2C=CH2}$ (44) > $\ce{CH3CH3}$ (50) יותר אופי s = אלקטרונים קרובים לגרעין
ערכי pKa תרכובת pKa הערות לזיכרון 1,3-דיקרבוניל $\sim 9$ החומצי ביותר - רזוננס כפול אלכוהול 15-17 זכור: ROH α-H בקרבוניל 17-20 חומציות בינונית אלקין טרמינלי $\sim 25$ HC≡CH - sp חומצי יותר אמוניה 38 NH3 אלקן 44 H2C=CH2 אלקאן 50 CH4 - הכי פחות חומצי
כלל מפתח : יותר אופי s = יותר חומצי (sp > sp² > sp³)
תרכובת pKa הערות $\ce{HI}$ $-10$ חומצה חזקה מאוד $\ce{HCl}$ $-7$ חומצה חזקה $\ce{H3O^+}$ $-1.7$ הידרוניום $\ce{CH3COOH}$ $4.7$ חומצה אצטית $\ce{H2CO3}$ $6.4$ חומצה פחמנית $\ce{NH4^+}$ $9.3$ אמוניום פנול $10 $ חומצי מאלכוהול $\ce{H2O}$ $15.7$ מים אלכוהול $15-17$ $\ce{ROH}$ α-H בקרבוניל $17-20$ חומציות α $\ce{HC≡CH}$ $25$ אלקין טרמינלי $\ce{NH3}$ $38$ אמוניה $\ce{H2C=CH2}$ $44$ אלקן $\ce{CH4}$ $50$ אלקאן
משפחות תרכובות אורגניות משפחה נוסחה כללית היברידיזציה זווית קשר pKa אופייני תכונות מיוחדות אלקאנים $\ce{C_nH_{2n+2}}$ $sp^3$ 109.5° ~50 רוויים, אינרטיים יחסית אלקנים $\ce{C_nH_{2n}}$ $sp^2$ 120° ~44 קשר כפול, איזומריה גיאומטרית אלקינים $\ce{C_nH_{2n-2}}$ $sp$ 180° ~25 קשר משולש, חומציים יחסית אלקיל הלידים $\ce{R-X}$ $sp^3$ 109.5° - X = F, Cl, Br, I כוהלים $\ce{R-OH}$ $sp^3$ 109.5° ~16 קשרי מימן, 1°/2°/3° אתרים $\ce{R-O-R’}$ $sp^3$ ~110° - ממס אינרטי אלדהידים $\ce{R-CHO}$ $sp^2$ 120° ~17 $\ce{C=O}$ קוטבי קטונים $\ce{R-CO-R’}$ $sp^2$ 120° ~19 $\ce{C=O}$ קוטבי חומצות קרבוקסיליות $\ce{R-COOH}$ $sp^2$ 120° 3-5 חומצות חלשות אסטרים $\ce{R-COOR’}$ $sp^2$ 120° - נגזרת חומצה אמידים $\ce{R-CONH2}$ $sp^2$ 120° - נגזרת הכי יציבה אמינים $\ce{R-NH2}$ $sp^3$ 107° ~35 ($\ce{RNH3+}$: ~10) בסיסיים
דרגת אי-רוויון נוסחה לחישוב משמעות DU = (2C + 2 + N - H - X)/2 C=פחמן, N=חנקן, H=מימן, X=הלוגן DU = 0 רווי לחלוטין DU = 1 קשר כפול אחד או טבעת DU = 2 2 קשרים כפולים או קשר משולש או 2 טבעות DU = 4 טבעת בנזן
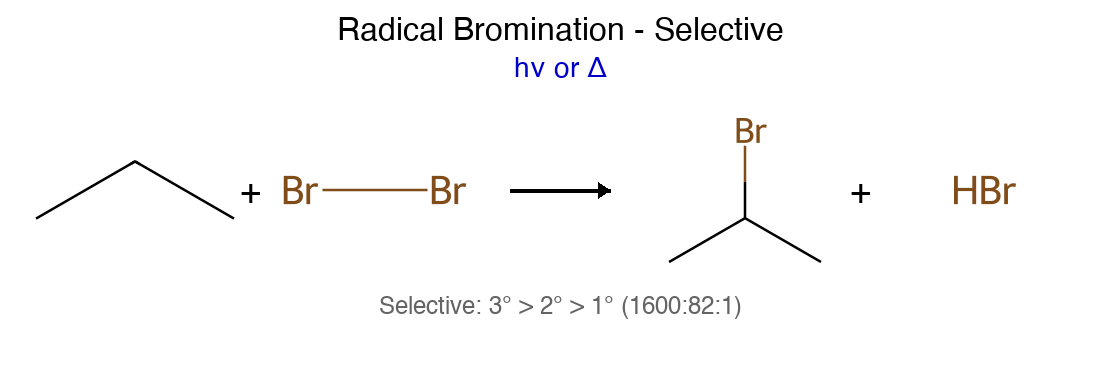
שיעור 3: נומנקלטורה, אינטראקציות בין-מולקולריות ומבנה מרחבי (Stereochemistry) סדרי יציבות וסלקטיביות קטגוריה סדר יציבות/חוזק הסבר קרבוקטיונים 3° > בנזילי ≈ אלילי > 2° » 1° > מתיל היפר-קוניוגציה + רזוננס רדיקלים 3° > בנזילי ≈ אלילי > 2° > 1° > מתיל דומה לקרבוקטיונים קרבאניונים מתיל > 1° > 2° > 3° אפקט אינדוקטיבי הפוך קבוצות עוזבות $\ce{I^- > Br^- > Cl^- > TsO^- » F^- > OH^-}$ בסיסיות חלשה = עוזבת טובה נוקלאופיליות (פרוטי) $\ce{I^- > Br^- > Cl^- > F^-}$ גודל ופולריזביליות נוקלאופיליות (אפרוטי) $\ce{F^- > Cl^- > Br^- > I^-}$ צפיפות מטען סלקטיביות הלוגנציה $\ce{Br2 » Cl2}$ 3°:2°:1° = 1600:80:1 (Br) vs 5:4:1 (Cl)
סדר יציבות 3° > בנזילי ≈ אלילי > 2° » 1° > ויניל > מתיל
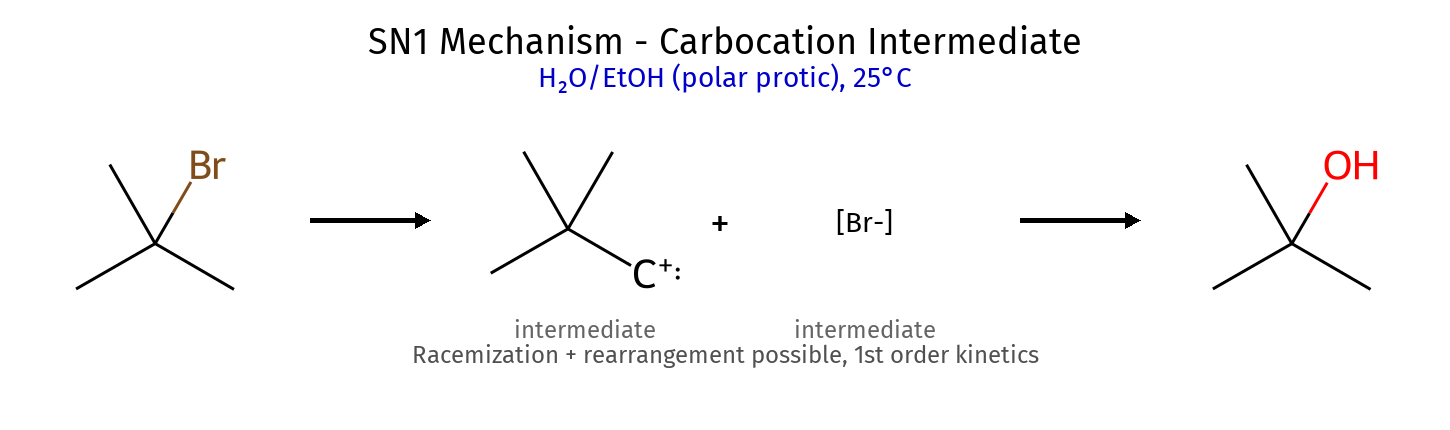
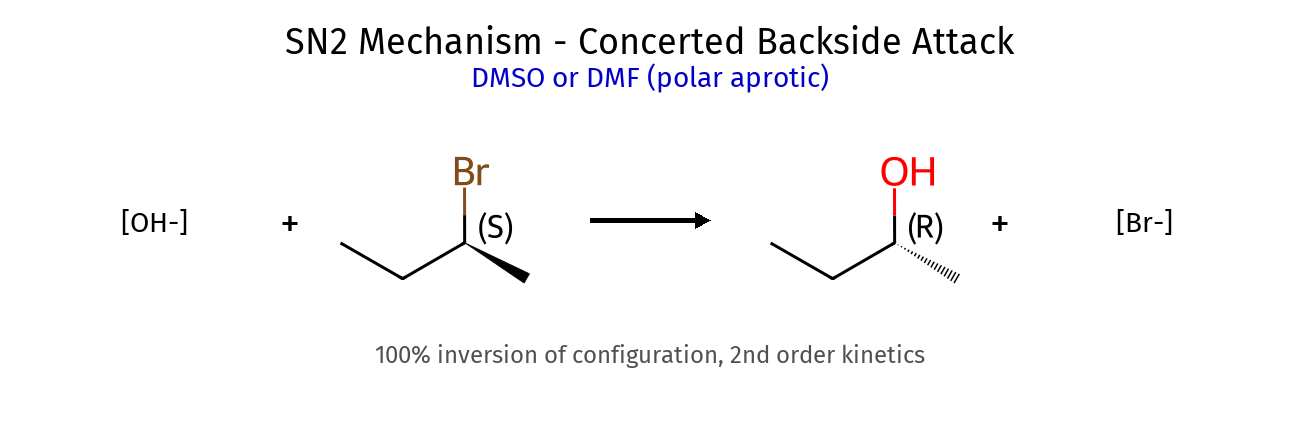
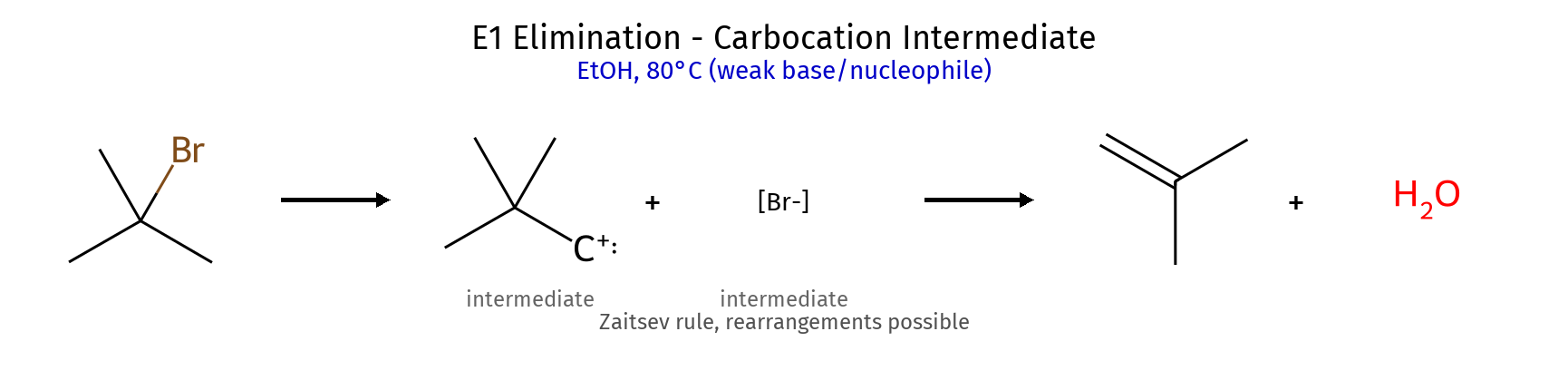
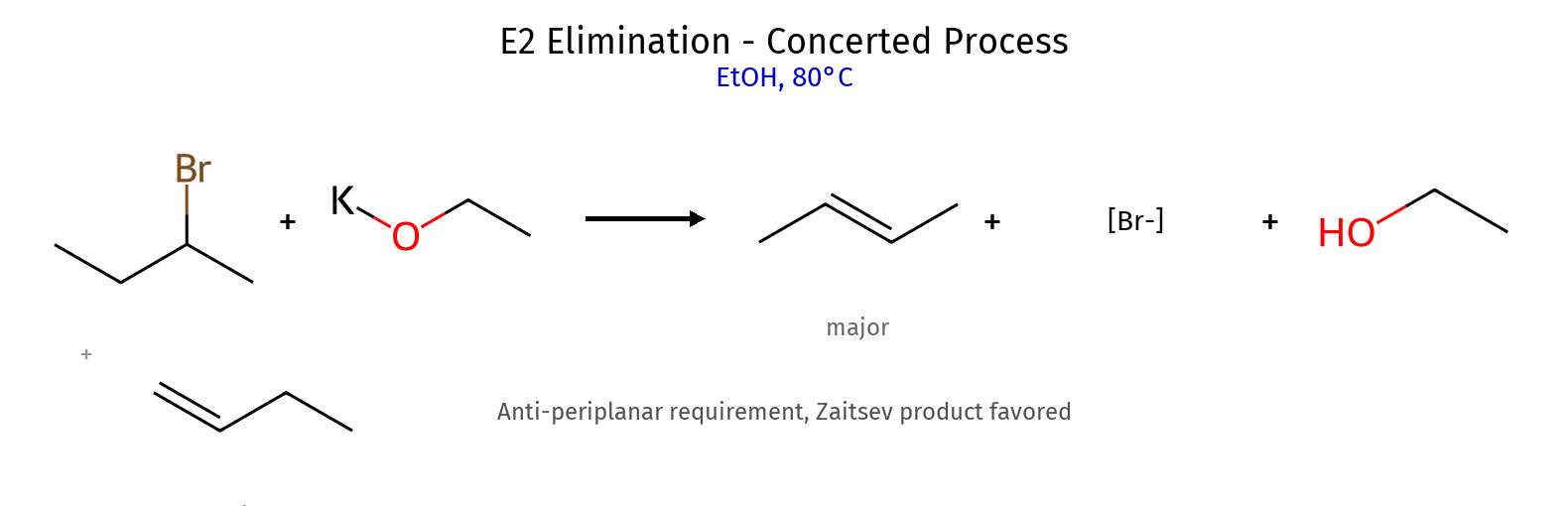
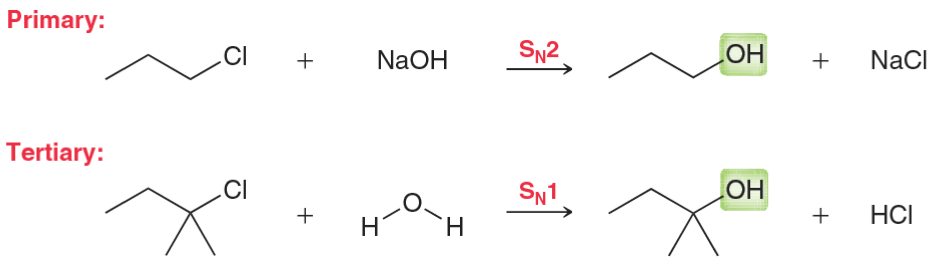
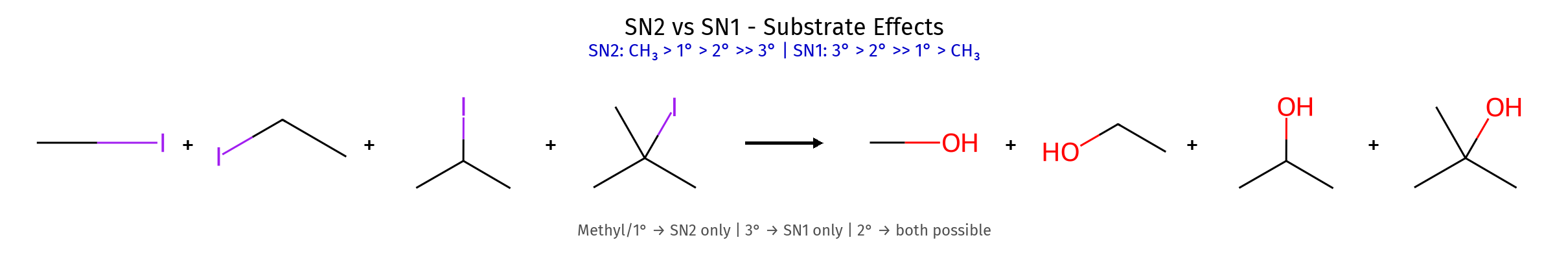
גורמי ייצוב היפר-קוניוגציה (יותר קבוצות אלקיל) רזוננס (אלילי, בנזילי) אינדוקציה שלבי קביעת קונפיגורציה מספור עדיפויות (Cahn-Ingold-Prelog): מספר אטומי גבוה = עדיפות גבוהה קשרים כפולים נספרים כ-2 קשרים יחידים מיקום הקבוצה בעדיפות נמוכה : אם לא על קו מקווקו (אחורה) - הפוך את התוצאה! כיוון הסיבוב : עם כיוון השעון = R נגד כיוון השעון = S דיאסטריאומרים vs אננטיומרים אננטיומרים : שונים בכל המרכזים הכיראליים (תמונת מראה)דיאסטריאומרים : שונים בחלק מהמרכזים הכיראליים כללים למבני רזוננס תקינים אסור להזיז אטומים - רק אלקטרונים!אסור להזיז פרוטונים בין מבני רזוננסשמור על אוקטט מלא (פרט לקרבוקטיונים) מטענים על אטומים מתאימים (O⁻ יציב, C⁺ פחות) סדר יציבות של קונפורמציות Staggered > Eclipsed (תמיד!)Anti (180°) > Gauche (60°) > Eclipsed קבוצות גדולות מעדיפות להיות רחוקות בציקלוהקסן Chair > Boat (תמיד!)קבוצות גדולות מעדיפות מיקום equatorial cis/trans קובע אם שתי קבוצות באותו צד או בצדדים מנוגדים שיעור 4: אלקיל הלידים, אלכוהלים, אתרים - התמרות נוקלאופיליות השוואה בין מנגנוני $\mathrm{S_N1}$ ו-$\mathrm{S_N2}$ מאפיין $\mathrm{S_N1}$ $\mathrm{S_N2}$ מנגנון דו-שלבי חד-שלבי (concerted) חומר ביניים קרבוקטיון מצב מעבר קינטיקה סדר ראשון: $k[\ce{RX}]$ סדר שני: $k[\ce{RX}][\ce{Nu}]$ סטריאוכימיה רצמיזציה היפוך מלא סובסטרט מועדף 3° > בנזילי > אלילי > 2° » 1° מתיל > 1° > 2° » 3° נוקלאופיל חלש ($\ce{H2O}$, $\ce{ROH}$) חזק ($\ce{OH^-}$, $\ce{CN^-}$, $\ce{I^-}$) ממס פולרי פרוטי פולרי אפרוטי קבוצה עוזבת חשובה מאוד חשובה שחלופים אפשריים לא אפשריים
תנאי תגובה / סובסטרט $1^\circ$ $2^\circ$ $3^\circ$ מתיל $\ce{CH3X}$ בסיס חזק $\mathrm{S_N2}$ (עיקרי) E2 (עיקרי) E2 בלבד $\mathrm{S_N2}$ בלבד בסיס חזק E2 (עיקרי) E2 E2 $\mathrm{S_N2}$ בלבד בסיס חלש $\mathrm{S_N2}$ $\mathrm{S_N2}$ $\mathrm{S_N1}$ $\mathrm{S_N2}$ בלבד בסיס חלש $\mathrm{S_N2}$ $\mathrm{S_N1}$/E1 $\mathrm{S_N1}$ וגם E1 $\mathrm{S_N2}$ (איטי) תוצר עיקרי התמרה (בד”כ) תלוי בתנאים אלימינציה (בד”כ) התמרה תמיד
הערות:
חימום (Δ) מעודד אלימינציה בכל המקרים ממס פולרי אַפרוטי (אצטון, DMSO) מעודד $\mathrm{S_N2}$ ממס פולרי פרוטי (מים, אלכוהול) מעודד $\mathrm{S_N1}$/E1 בסיס חזק נוקלאופיל חזק: \(\ce{NaOCH2CH3}, \ce{KOC(CH3)3}, \ce{NaNH2}, \ce{NaOCH3}\)
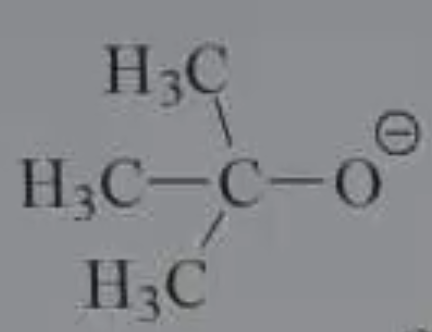
$\ce{OH-}$ Hydroxide $\ce{RO-}$ Alkoxide, including $\ce{CH3O-}$ (Methoxide) and $\ce{C2H5O-}$ (Ethoxide) $\ce{NH2-}$ Amide Bulky bases like $\ce{tert-BuO-}$ (tert-butoxide) that favor elimination גדול ונפחי:
נקוקלאופיל חזק בסיס חלש (בפחמן ראשוני ושניוני-$\mathrm{S_N2}$): \(\ce{CN-}, \ce{Br-}, \ce{I-}, \ce{SH-}, \ce{SR-}, \ce{N3-}, \ce{CH3COO-}, \ce{SH2}, \ce{RSH}, \ce{NRH2}\)
בסיס חלש נוקלאופיל חלש :
\[\ce{H2O}, \ce{CH3OH}, \ce{CH3CH2OH}\] כללי רגיוסלקטיביות E2 : כלל זייצב (אלקן יותר מותמר)SN2 : היפוך סטריאוכימי מלאSN1 : רצמיזציה מהירות תגובת $\mathrm{S_N2}$ תלויה בכמה גורמים:
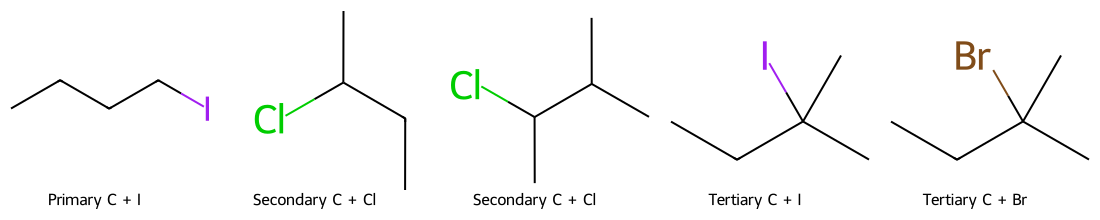
סוג סובסטרט : מתיל > 1° > 2° » 3°חוזק נוקלאופיל : חזק יותר = מהיר יותר דוגמה לסובסטרים מסודרים משמאל לימין לפי מהירות תגובת $\mathrm{S_N2}$ (שמאל הכי מהיר):
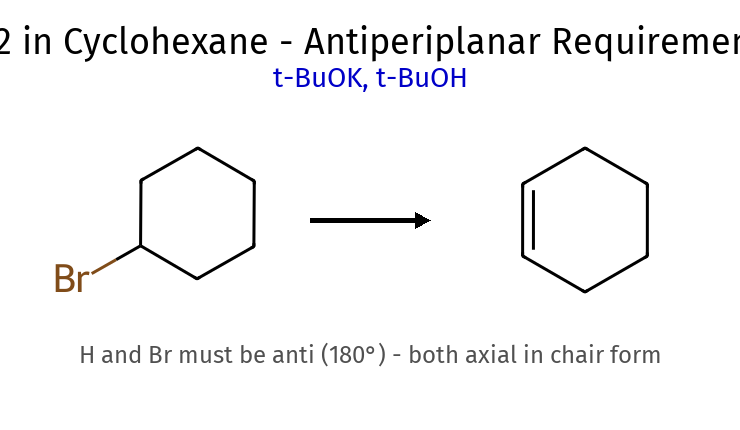
שיעור 5: תגובות אלימינציה השוואה בין E1 ו-E2 מאפיין E1 E2 מנגנון דו-שלבי חד-שלבי חומר ביניים קרבוקטיון מצב מעבר קינטיקה סדר ראשון: $k[\ce{RX}]$ סדר שני: $k[\ce{RX}][\text{Base}]$ גיאומטריה נדרשת לא ספציפית אנטי-פריפלנרית בסיס חלש חזק רגיוסלקטיביות זייצב (תערובת) זייצב (או הופמן עם בסיס נפחי) סובסטרט מועדף 3° > 2° > 1° 3° > 2° > 1° תחרות עם $\mathrm{S_N1}$ $\mathrm{S_N2}$
הערות:
חימום (Δ) מעודד אלימינציה בטמפרטורה רגילה - התמרה מועדפת סדר בדיקה מומלץ זיהוי סוג התגובה התמרה או אלימינציה? יוני או רדיקלי? ניתוח התנאים סוג הפחמן (1°/2°/3°) חוזק הבסיס/נוקלאופיל סוג הממס בדיקת דרישות מיוחדות אנטי-פריפלנרי ב-E2 שיחלופים בקרבוקטיונים סטריאוכימיה ממסים ותפקידם סוג ממס דוגמאות מעודד מדכא פולרי פרוטי $\ce{H2O}$, $\ce{ROH}$ $\mathrm{S_N1}$, E1 $\mathrm{S_N2}$ פולרי אפרוטי DMSO, DMF, $\ce{CH3CN}$ $\mathrm{S_N2}$ $\mathrm{S_N1}$ לא פולרי הקסן, בנזן - כל התגובות היוניות
שיעור 8: תגובת הלוגנציה רדיקלית המנגנון בשלושה שלבים שלב תגובה הסבר Initiation $\ce{Cl2 ->[h\nu][\Delta] 2 Cl^{\bullet}}$ פירוק הומוליטי של הלוגן Propagation 1 $\ce{Cl^{\bullet} + CH4 -> CH3^{\bullet} + HCl}$ הרדיקל תולש מימן Propagation 2 $\ce{CH3^{\bullet} + Cl2 -> CH3Cl + Cl^{\bullet}}$ יצירת התוצר + רדיקל חדש Termination \(\begin{aligned}\ce{Cl^{\bullet} + Cl^{\bullet} &-> Cl2} \\ \ce{CH3^{\bullet} + CH3^{\bullet} &-> C2H6} \\ \ce{Cl^{\bullet} + CH3^{\bullet} &-> CH3Cl}\end{aligned}\) סיום התגובה
סלקטיביות ברום מול כלור עקרון ריאקטיביות-סלקטיביות: יותר ריאקטיבי (כלור) = פחות סלקטיבי
שיעור 9: תגובות סיפוח באלקֵנים הידרציה חומצית (H⁺/H2O) פרוטונציה של הקשר הכפול יצירת קרבוקטיון על הפחמן היותר מותמר תקיפת מים דה-פרוטונציה תוצר : כוהל לפי כלל מרקובניקוב (OH על הפחמן היותר מותמר)
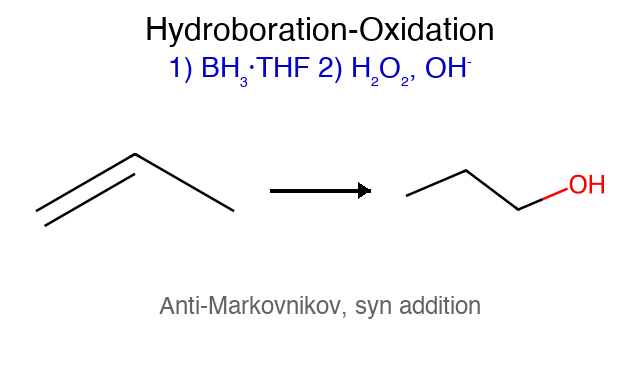
הידרובורציה-חמצון (לא למדנו) שבירת קשר כפול $\ce{C=C}$ מאפשרת הוספת קבוצות שונות, עם מנגנונים שונים. התגובה יכולה להיות חד-שלבית או דו-שלבית, תלוי בריאגנטים ובתנאים.
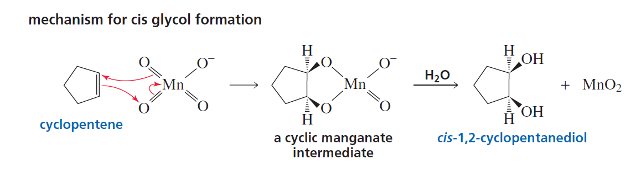
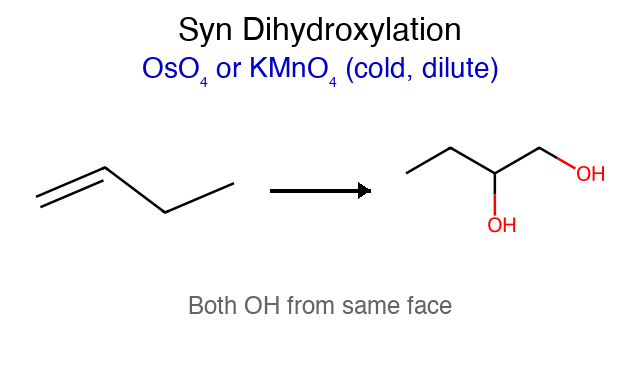
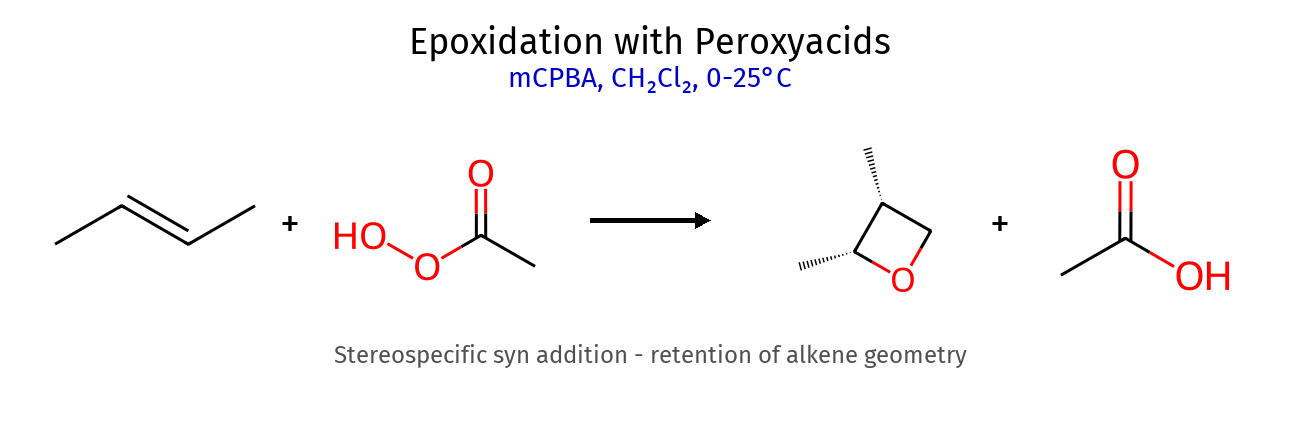
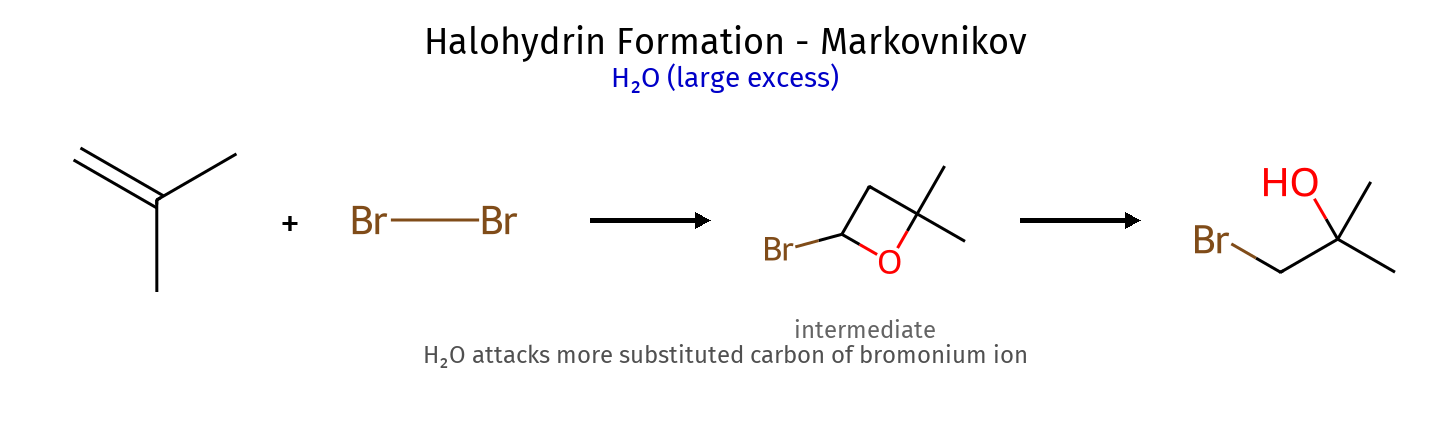
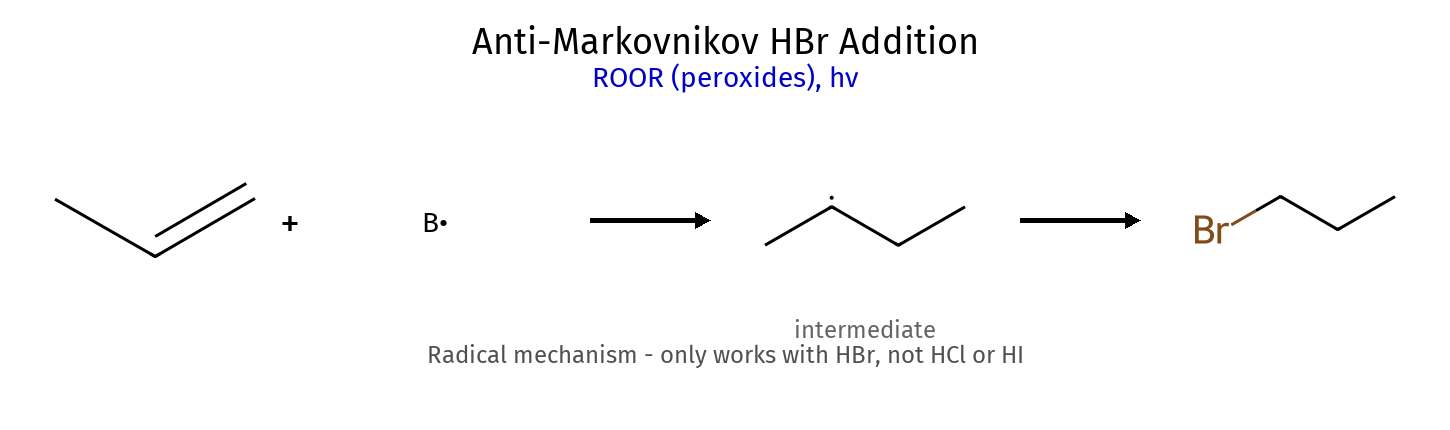
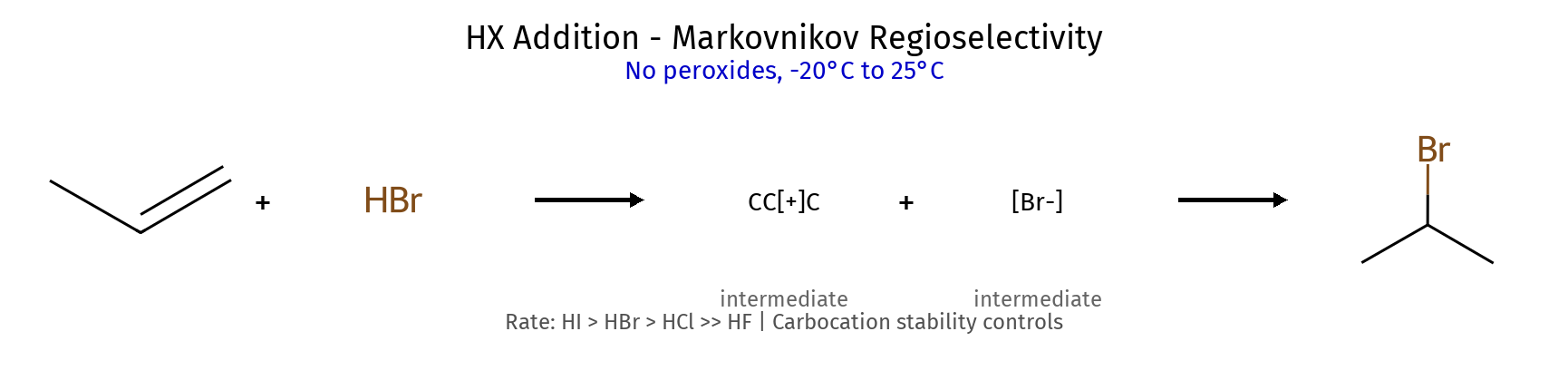
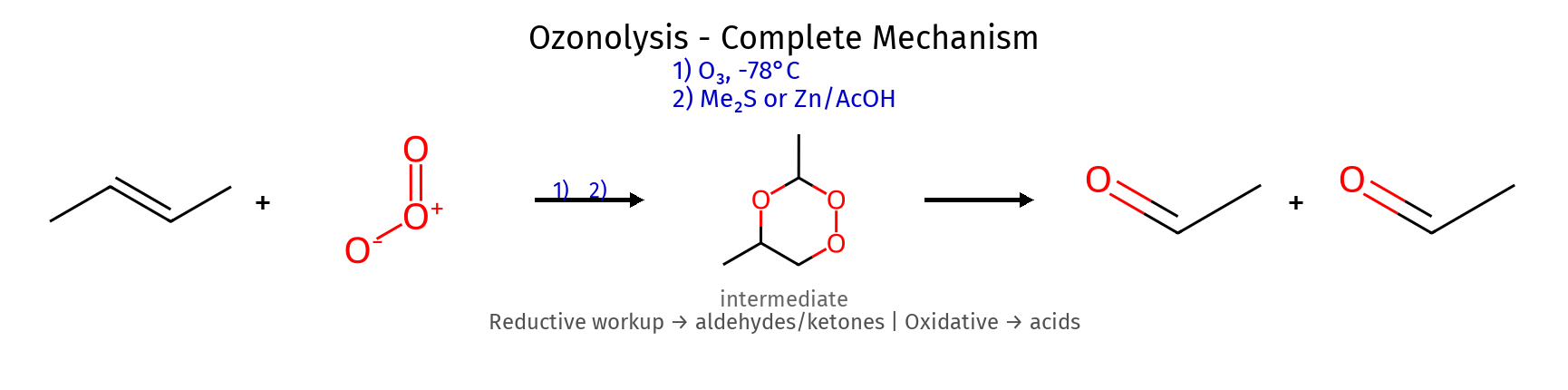
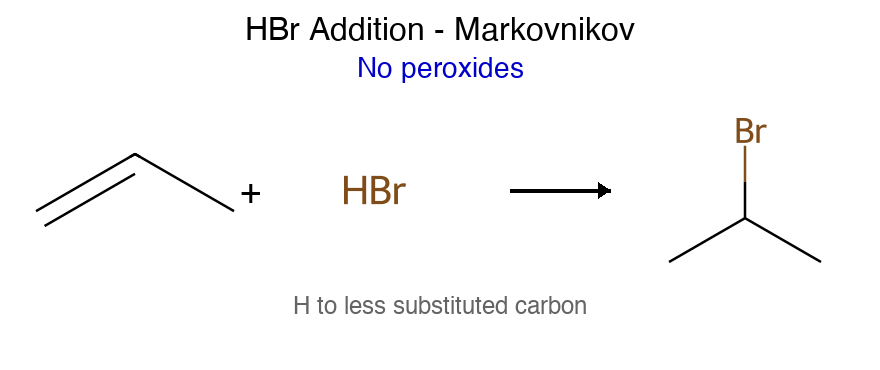
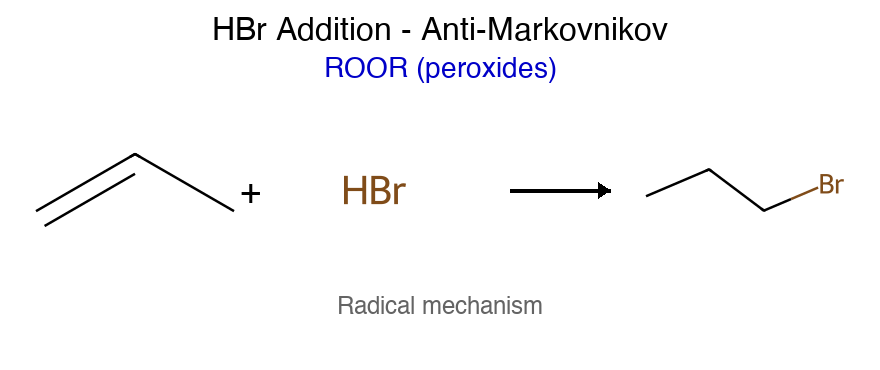
תגובה ריאגנטים תוצר רגיוסלקטיביות סטריאוכימיה מנגנון הידרוגנציה $\ce{->[H2][Pd/Pt/Ni]}$ אלקאן - סין חד-שלבי על משטח מתכת הידרוהלוגנציה רגילה $\ce{HX like HBr}$ אלקיל הליד מרקובניקוב - דרך קרבוקטיון הידרציה (מים וחומצה) $\ce{R-C=C-R + H2O ->[H2SO4]}$ כוהל מרקובניקוב - דרך קרבוקטיון הידרציה (עם מתנול - אלכוהוליזה) $\ce{R-C=C-R + CH3OH ->[H2SO4]}$ אתר (למשל MTBE) מרקובניקוב - דרך קרבוקטיון הלוגנציה $\ce{X2 like C2 Br2}$ ויק-דיהליד - אנטי דרך יון הלוניום הלוהידרין $\ce{X2->[H2O]}$ הלוהידרין $\ce{OH}$ ליותר מותמר אנטי דרך יון הלוניום הידרוהלוגנציה אנטי מרקובניקוב (רדיקלית) $\ce{->[HBr][ROOR/h\nu]}$ אלקיל ברומיד אנטי-מרקובניקוב - מנגנון רדיקלי חמצון $\ce{->[KMnO4,OH^-,H2O][cold]}$ דיול - סין דרך אסטר ציקלי אוזונוליזה בסביבה מחזרת 1) $\ce{O3}$ אלדהידים/קטונים - - ביקוע מלא אוזונוליזה בסביבה חומצית 1) $\ce{O3}$ חומצות/קטונים - - ביקוע + חמצון אפוקסידציה $\ce{RCO3H}$ אפוקסיד - סין? חד-שלבי
כללי כיווניות כלל תיאור יישום מרקובניקוב H לפחמן עם יותר H הידרוהלוגנציה, הידרציה אנטי-מרקובניקוב H לפחמן עם פחות H $\ce{HBr/ROOR}$, הידרובורציה זייצב אלקן יותר מותמר E2 עם בסיס קטן הופמן אלקן פחות מותמר E2 עם בסיס נפחי
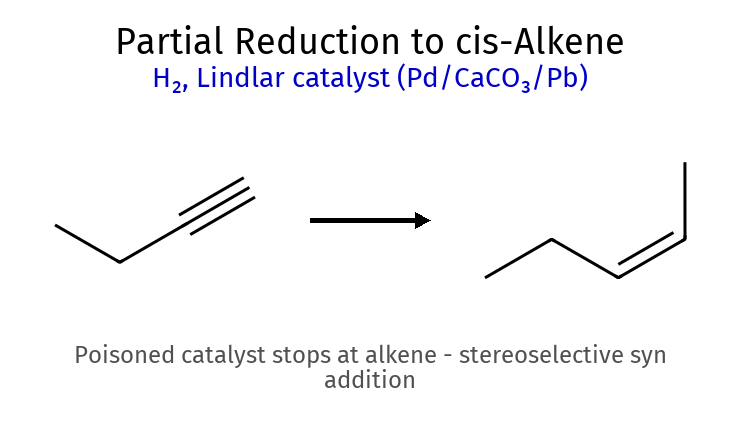
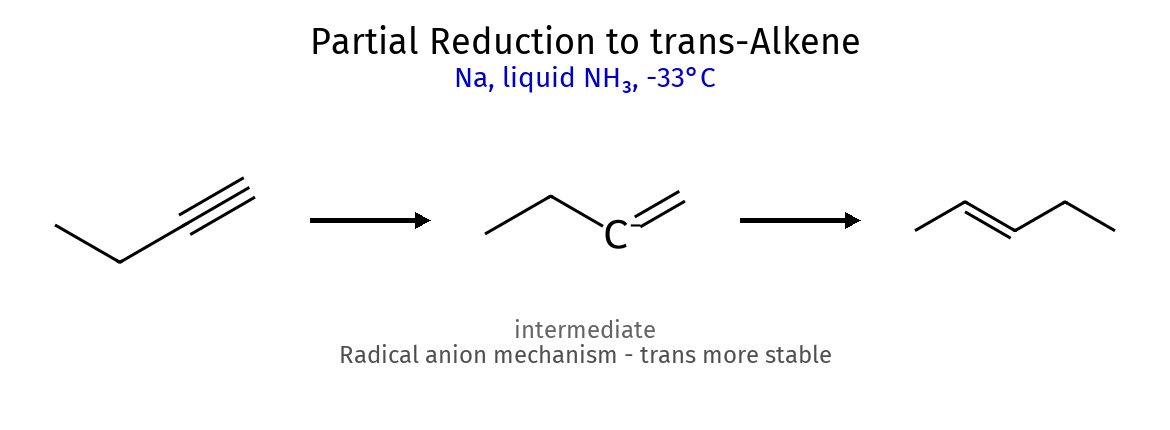
שיעור 10: תגובות אלקינים, אתרים ואלכוהולים אלקינים ($\ce{R–C≡C–R’}$) 1. חיזור אלקינים (הידרוגנציה) סוג תגובה ריאגנטים תוצר מספר סיפוחים סטריאוכימיה הערות מפתח הידרוגנציה מלאה $\ce{->[H2][Pd/Pt/Ni]}$ אלקאן 2 - לא ניתן לעצור באמצע הידרוגנציה חלקית $\ce{->[H2][Lindlar]}$ cis-אַלקֵן 1 cis בלבד עוצר באלקן, זרז לינדלר
באחת השאלנו נתקלנו גם בתגובה עם $\ce{NaNH2,NH3}$, ששימשה כדי להאריך שרשרת.
2. תגובות סיפוח לאלקינים 2.1 סיפוח הלוגנידי מימן (HX) כמות ריאגנט ריאגנטים תוצר מספר סיפוחים כלל הערות 1 מול $\ce{HX}$ ויניל הליד 1 מרקובניקוב עצירה באלקן עודף $\ce{HX}$ דיהליד ג׳מינלי 2 מרקובניקוב שני X על אותו פחמן
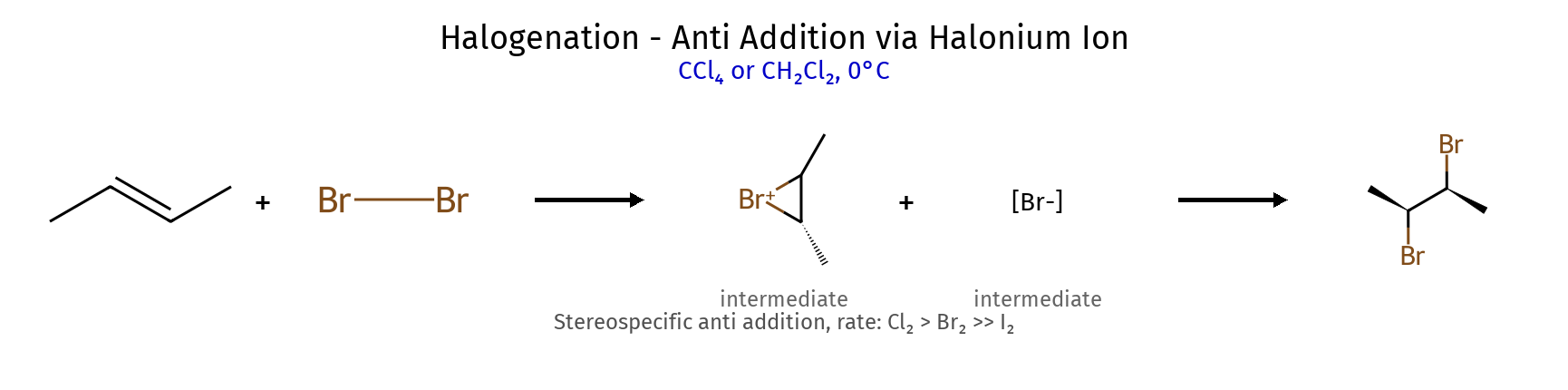
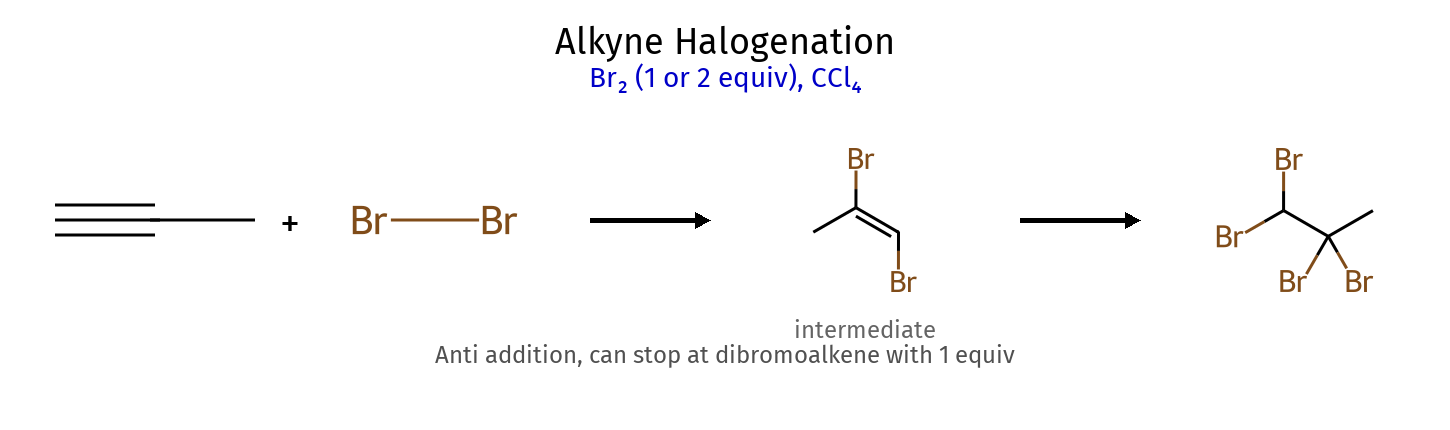
2.2 סיפוח הלוגנים (X₂) כמות ריאגנט ריאגנטים תוצר מספר סיפוחים סטריאוכימיה הערות 1 מול $\ce{X2}$ דיהליד ויציניאלי 1 אנטי trans-דיהליד עודף $\ce{X2}$ טטרההליד 2 אנטי ארבע X סה”כ
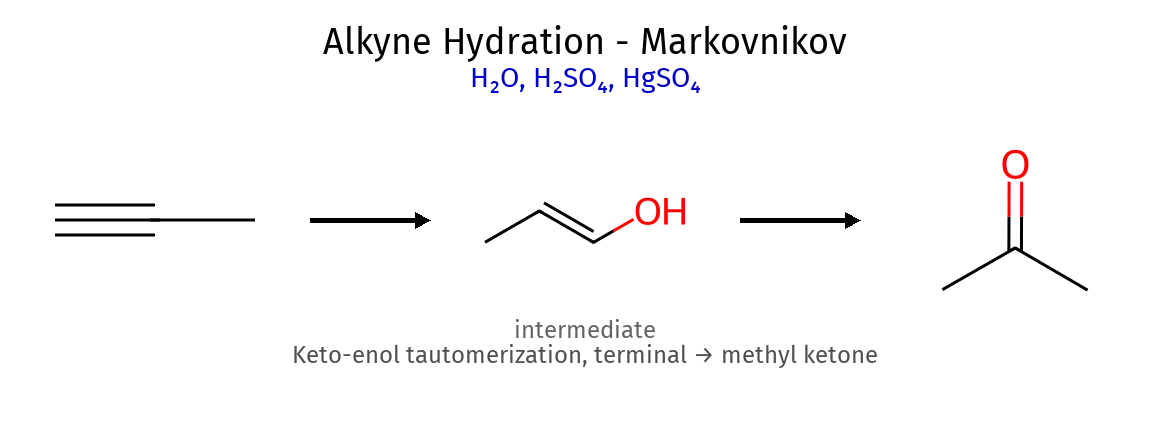
2.3 תגובות עם מים וחמצן תגובה ריאגנטים תוצר מספר סיפוחים מנגנון מיוחד הערות הידרציה $\ce{->[H2O][H2SO4, HgSO4]}$ קטון 1 מרקובניקוב + טאוטומריזציה דרך אנול ביניים
3. תגובות של אלקינים טרמינליים ($\ce{R-C≡C-H}$) 3.1 חומציות ויצירת אצטילידים תכונה ערך השוואה הסבר pKa של אלקין טרמינלי ~25 אלקאן: ~50, אלקן: ~44 אופי s גבוה (50%) באורביטל sp ריאגנט לדה-פרוטונציה $\ce{NaNH2}$ $\ce{NH3}$ pKa = 38 בסיס חזק מספיק
3.2 אלקילציה (הארכת שרשרת) שלב ריאגנטים תוצר מנגנון הגבלות 1 $\ce{NaNH2}$ יון אצטיליד $\ce{R-C≡C^-}$ חומצה-בסיס - 2 $\ce{R’-X}$ (1° בלבד) אלקין מותמר $\ce{R-C≡C-R’}$ $\mathrm{S_N2}$ אלקיל הליד ראשוני בלבד
⚠️ אזהרה: אלקיל הליד 2° או 3° יוביל לתגובת E2 במקום $\mathrm{S_N2}$!
4. מנגנונים חשובים באלקינים 4.1 מנגנון טאוטומריזציה קטו-אנול שלב תגובה הסבר גורם מניע פרוטונציה $\ce{R-C(OH)=CH2 + H^+ -> R-C(OH2^+)=CH2}$ החמצן קוטף פרוטון חומציות התווך העברת פרוטון $\ce{R-C(OH2^+)=CH2 -> R-C^+(OH)-CH3}$ שבירת קשר π יציבות קרבוקטיון יצירת קטון $\ce{R-C^+(OH)-CH3 -> R-C(=O)-CH3 + H^+}$ יצירת קשר C=O C=O חזק מ-C=C
שיווי משקל: קטון » אנול (יחס ~99:1)
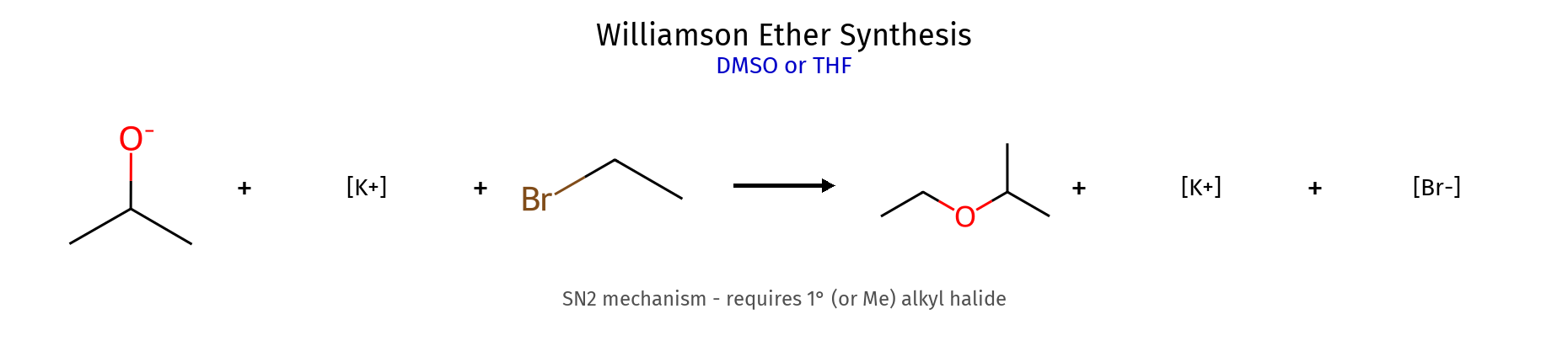
🌐 אתרים ($\ce{R-O-R’}$) 5. שיטות סינתזת אתרים 5.1 סינתזת וויליאמסון (Williamson Synthesis) רכיב דרישות מנגנון דוגמה הגבלות נוקלאופיל אלקוקסיד $\ce{R-O^-}$ $\mathrm{S_N2}$ $\ce{CH3O^-}$ יווצר מאלכוהול + בסיס אלקטרופיל אלקיל הליד 1° $\mathrm{S_N2}$ $\ce{CH3CH2Br}$ חייב להיות ראשוני! תוצר אתר - $\ce{CH3-O-CH2CH3}$ -
5.2 שיטות נוספות שיטה ריאגנטים תנאים דוגמה סיפוח לאלקן $\ce{R-OH + \text{אלקן}}$ חומצי, מרקובניקוב $\ce{CH3OH + CH2=CH2}$
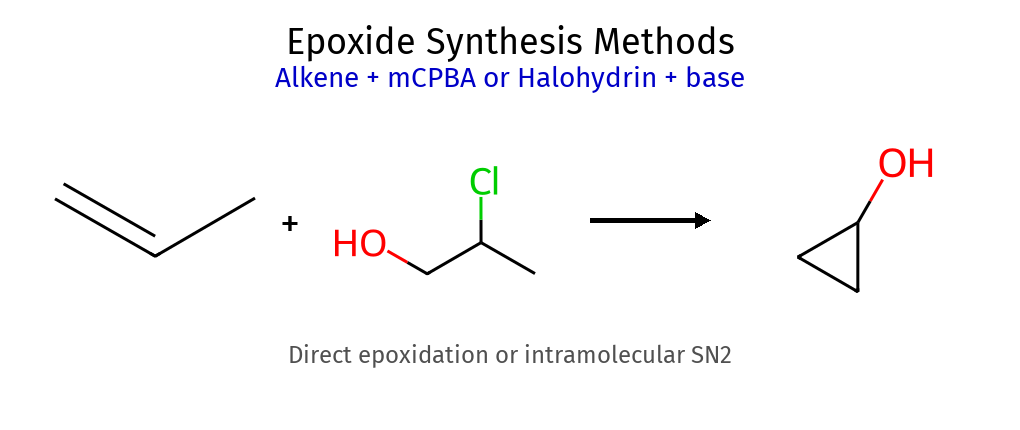
6. אפוקסידים - אתרים ציקליים מתמתים 6.1 יצירת אפוקסידים (פחות חשוב) ריאגנט מבנה מנגנון סטריאוכימיה פר-חומצה $\ce{R-CO3H}$ (כמו mCPBA) סיפוח syn נשמרת מהאלקן
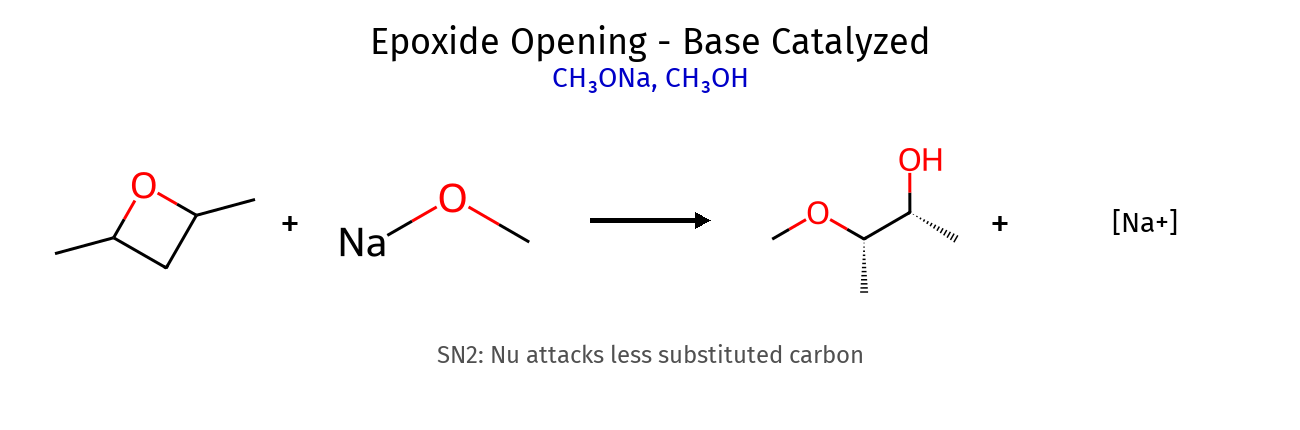
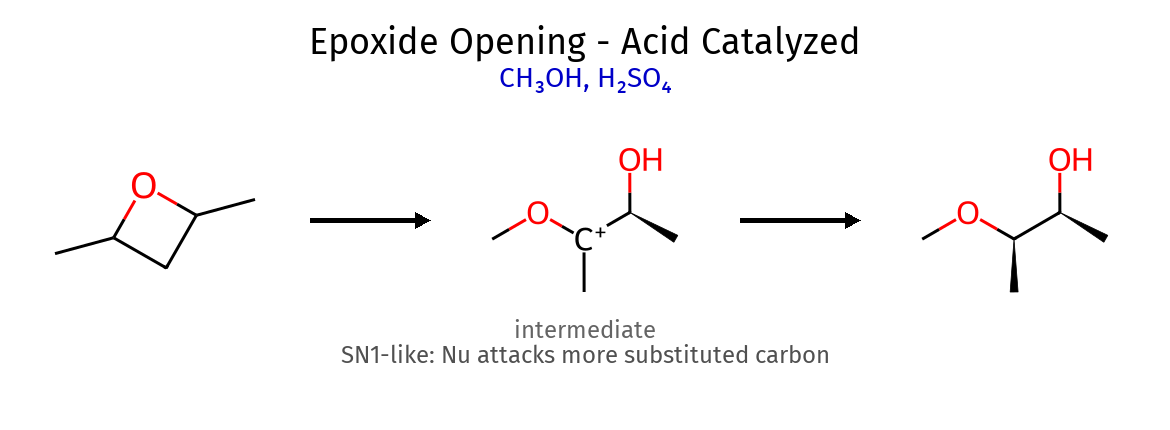
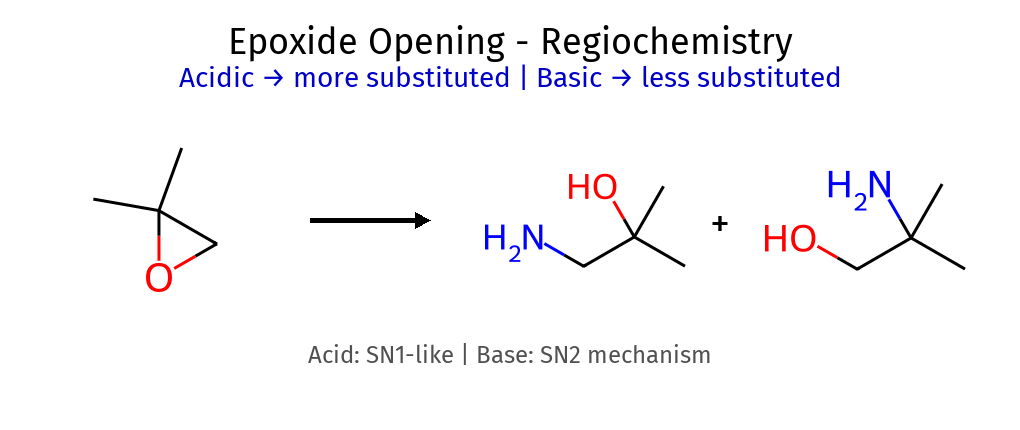
6.2 פתיחת אפוקסידים - חשוב! תנאים מנגנון דומה ל- נוקלאופיל תוקף ב- סטריאוכימיה תוצר זיהוי התנאים בסיסיים $\mathrm{S_N2}$ פחמן פחות מותמר אנטי Nu-C-C-OH אין $\ce{H^+}$ בתגובה חומציים $\mathrm{S_N1}$ פחמן יותר מותמר אנטי HO-C-C-Nu יש $\ce{H^+}$ בתגובה
דוגמאות לריאגנטים בסיסיים: $\ce{OH^-, RO^-, NH3}$חומציים: $\ce{H^+/H2O, H^+/ROH}$ ⚠️ טיפ : אם רואים $\ce{H^+}$ או $\ce{H2SO4}$ ← תנאים חומציים!
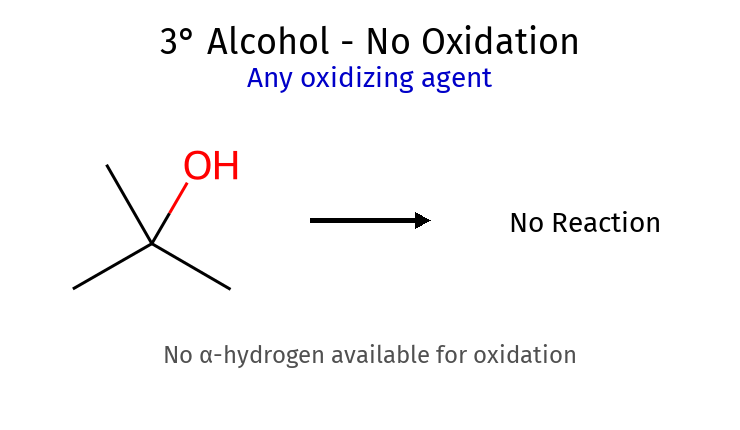
אלכוהולים ($\ce{R-OH}$) 7. סיווג וזיהוי אלכוהולים סוג מבנה דוגמה מספר פחמנים על C-OH יכולת חמצון ראשוני (1°) $\ce{RCH2OH}$ אתנול 1 ✅ לאלדהיד/חומצה משני (2°) $\ce{R2CHOH}$ איזופרופנול 2 ✅ לקטון שלישוני (3°) $\ce{R3COH}$ tert-בוטנול 3 ❌ אין $\ce{H-\alpha}$
יצירת אלכוהולים דרך התמרה או סיפוח:
ריאגנטים תוצר מנגנון $\mathrm{S_N2}$ $\ce{R-R-Cl + NaOH ->[S_N2] R-OH + NaCl}$ אלכוהול ראשוני $\mathrm{S_N1}$ $\ce{R-…R-X + H2O ->[S_N1] R-OH + HCl}$ אלכוהול שלישוני
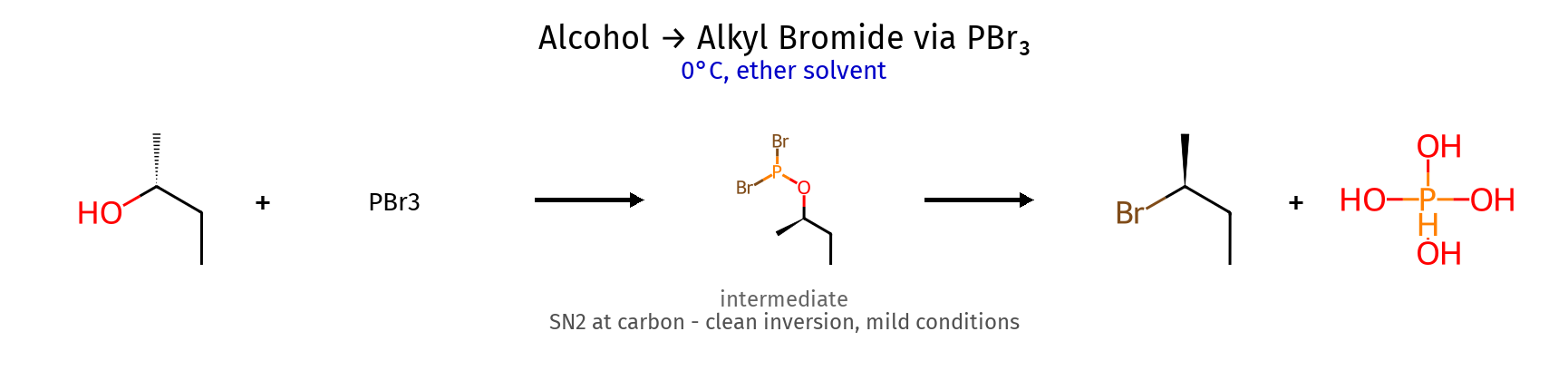
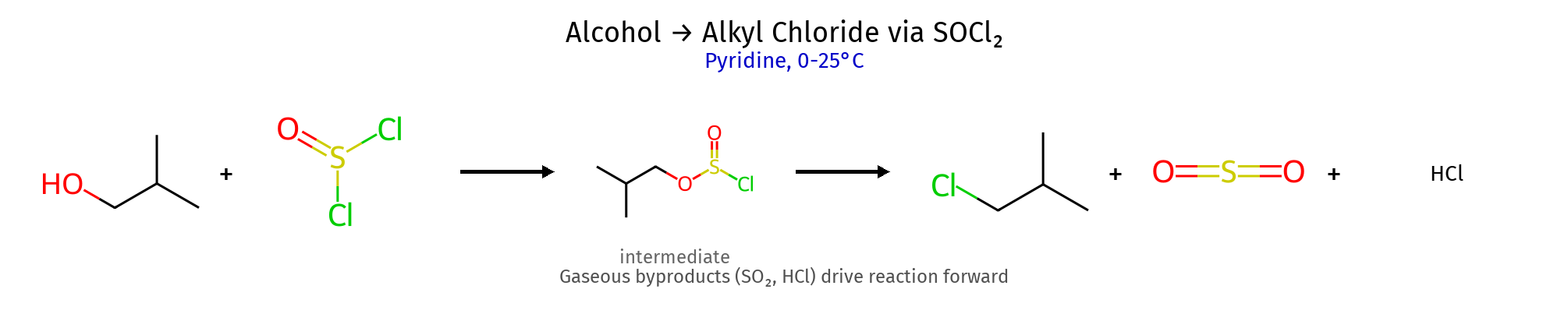
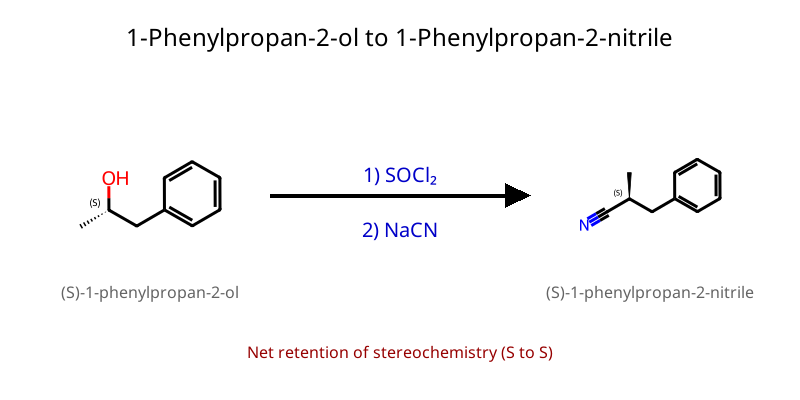
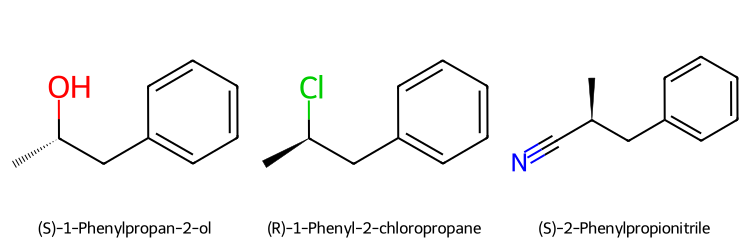
8. המרת אלכוהולים לאלקיל הלידים ריאגנט תנאים מנגנון סטריאוכימיה מתאים ל- תוצרי לוואי יתרונות $\ce{HX}$ חומצי + חימום $\mathrm{S_N1}$ (3°) רצמיזציה (3°) כל הסוגים $\ce{H2O}$ פשוט, זול $\ce{PBr3}$ ניטרלי $\mathrm{S_N2}$ היפוך מלא 1°, 2° בלבד $\ce{H3PO3}$ סטריאוספציפי $\ce{SOCl2}$ + בסיס (כגון פירידין או טריאתילאמין) היפוך קונפיגורציה היפוך 1°, 2° בלבד $\ce{SO2↑, HCl↑}$ תוצרי לוואי נדיפים
מנגנונים מפורטים $\ce{PBr3}$ $\ce{R-OH + PBr3 -> R-O^+-PBr2 + Br^-}$ (התקפת זרחן) $\ce{Br^- + R-O^+-PBr2 -> Br-R + O=PBr2}$ ($\mathrm{S_N2}$ עם היפוך) $\ce{SOCl2}$ $\ce{R-OH + SOCl2 -> R-O-SO-Cl + Cl^-}$ (יצירת כלורוסולפיט) $\ce{R-O-SO-Cl -> R-Cl + SO2↑}$ (עם היפוך) אם יש בבסיס נוקלאופיל (למשל התגובה עם $\ce{NaCN}$): תתרחש התקפה נוקלאופילית על הכלור, ויתקבל $\ce{R-O-SO-CN}$. הקונפיגורציה תישמר, כי מדובר ב-$\mathrm{S_N2}$.
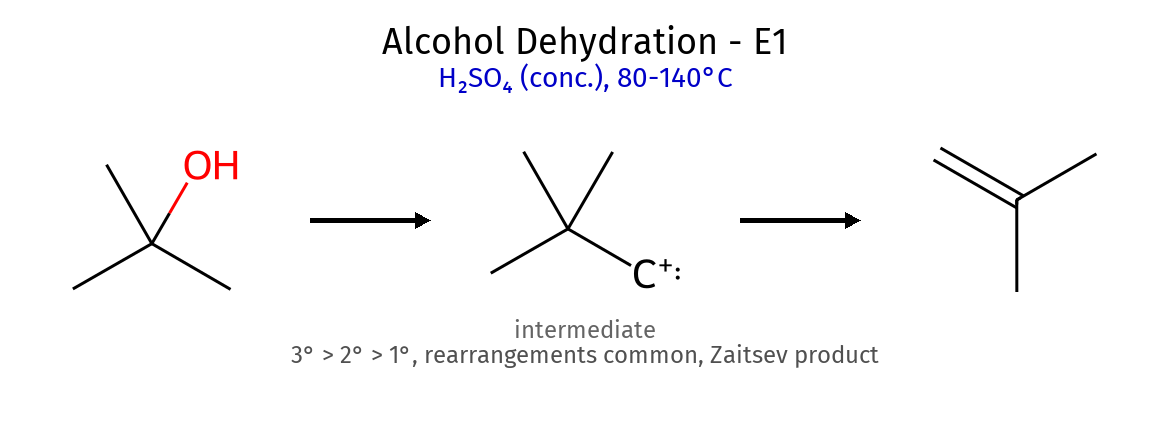
9. דהידרציה של אלכוהולים (יצירת אלקנים) שלב תגובה הסבר גורמי השפעה פרוטונציה $\ce{R-OH + H2SO4 -> R-OH2^+ + HSO4^-}$ הפיכת OH לקבוצה עוזבת טובה חומציות יציאת מים $\ce{R-OH2^+ -> R^+ + H2O}$ יצירת קרבוקטיון יציבות: 3° > 2° > 1° שיכלול אפשרי רידודים (rearrangements) יצירת קרבוקטיון יציב יותר הגירת H או קבוצות אלקיל אלימינציה $\ce{R^+ ->[Base] \text{אלקן} + H^+}$ קטיפת פרוטון β כלל זייצב - האלקן היציב ביותר
תנאים: חימום + חומצה חזקה (H₂SO₄)
10. חמצון אלכוהולים - טבלת הסלקטיביות פתיחת אפוקסידים תנאים נוקלאופיל תוקף מנגנון בסיסיים (RO⁻)פחמן פחות מותמר SN2 חומציים (H⁺)פחמן יותר מותמר דמוי-SN1
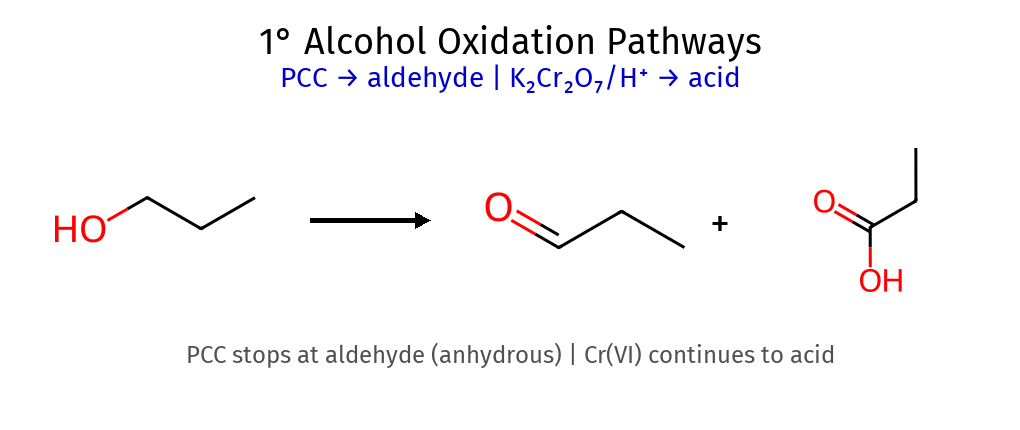
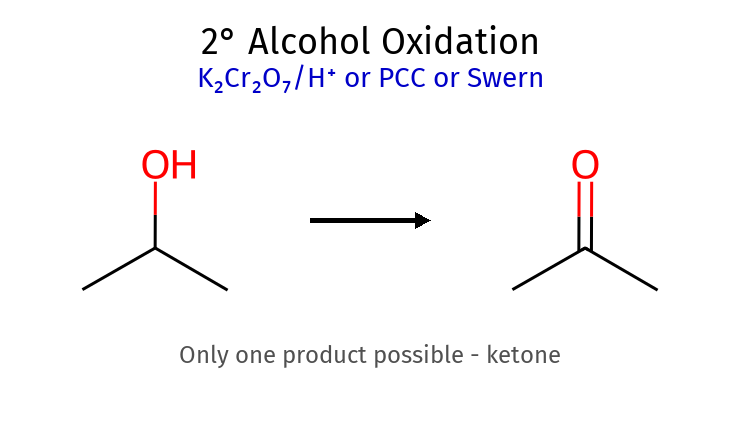
חמצון אלכוהולים PCC : עוצר באלדהיד (מאלכוהול 1°)H2CrO4 : ממשיך לחומצה קרבוקסיליתאלכוהול 3° : לא מתחמצן (אין H-α) סוג אלכוהול מבנה תוצר עם $\ce{H2CrO4}$ (מימי) תוצר עם PCC (יבש) דרישת $\ce{H-\alpha}$ ראשוני (1°) $\ce{RCH2OH}$ חומצה קרבוקסילית $\ce{RCOOH}$אלדהיד $\ce{RCHO}$✅ יש 2 H משני (2°) $\ce{R2CHOH}$ קטון $\ce{R2C=O}$קטון $\ce{R2C=O}$✅ יש 1 H שלישוני (3°) $\ce{R3COH}$ אין תגובה אין תגובה ❌ אין H
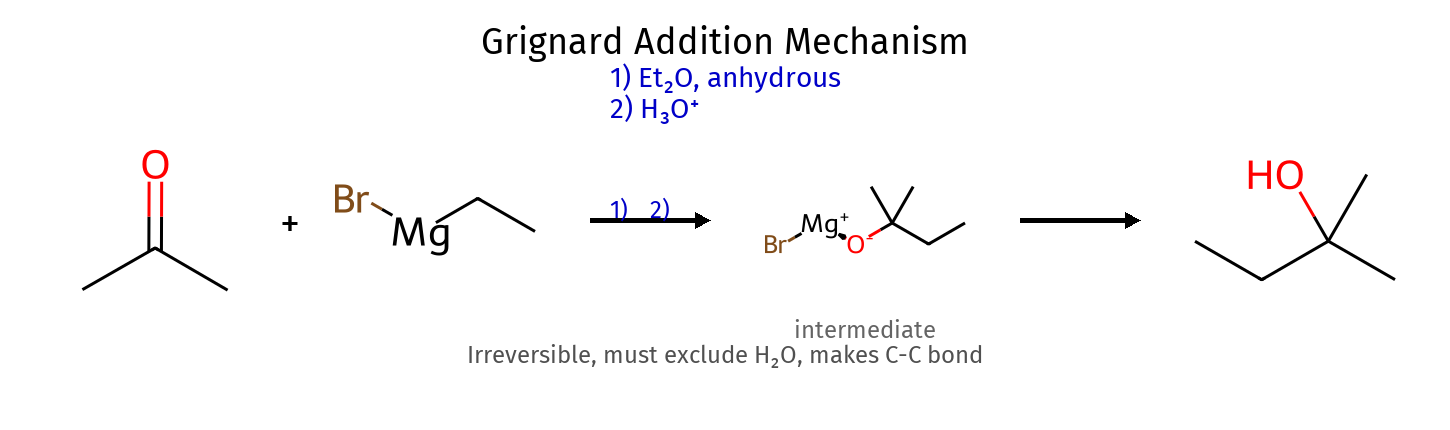
מנגנון חמצון ($\ce{H2CrO4}$) $\ce{R2CH-OH + H2CrO4 -> R2CH-O-CrO3H + H2O}$ (יצירת אסטר כרומי) $\ce{R2CH-O-CrO3H -> R2CH-O-CrO3^- + H^+}$ (דה-פרוטונציה) $\ce{R2CH-O-CrO3^- -> R2C=O + HCrO3^-}$ (אלימינציה E2 - קובע קצב ) בקרת סלקטיביות $\ce{H2CrO4}$ (מימי): חמצון מלא - אלדהיד ← חומצה דרך הידרטPCC (יבש): עצירה באלדהיד - אין מים, אין הידרט 11. ריאגנט גריניאר ($\ce{R-MgX}$) 11.1 יצירת ריאגנט גריניאר שלב תגובה הסבר אופי הקשר העברת אלקטרון $\ce{R-X + Mg -> R-X^{\bullet-} + Mg^{\bullet+}}$ מגנזיום מעביר אלקטרון רדיקלי שבירת קשר $\ce{R-X^{\bullet-} -> R^{\bullet} + X^-}$ יצירת רדיקל פחמן הומוליטי יצירת קשר C-Mg $\ce{R^{\bullet} + Mg^{\bullet+} -> R-Mg^+}$ קשר אורגנומתכתי יוני/קוולנטי התארגנות סופית $\ce{R-Mg^+ + X^- -> R-Mg-X}$ מבנה סופי קוולנטי קוטבי
11.2 שימושי ריאגנט גריניאר תפקיד ריאגנט נפגש תוצר דוגמה בסיס חזק $\ce{H2O, ROH}$ אלקאן $\ce{R-MgX + H2O -> R-H}$ נוקלאופיל קרבונילים (C=O) אלכוהול $\ce{R-MgX + R’CHO -> R-CH(OH)-R’}$ נוקלאופיל אפוקסידים אלכוהול עם הארכה יצירת קשר C-C חדש
⚠️ דרישות קריטיות:
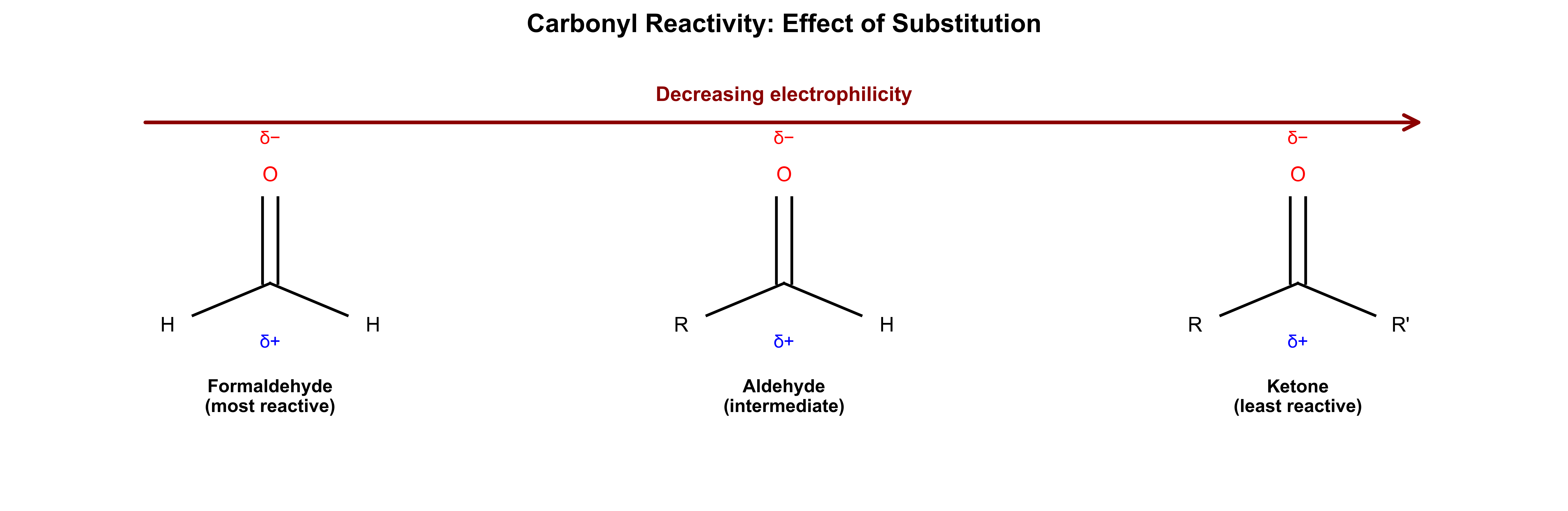
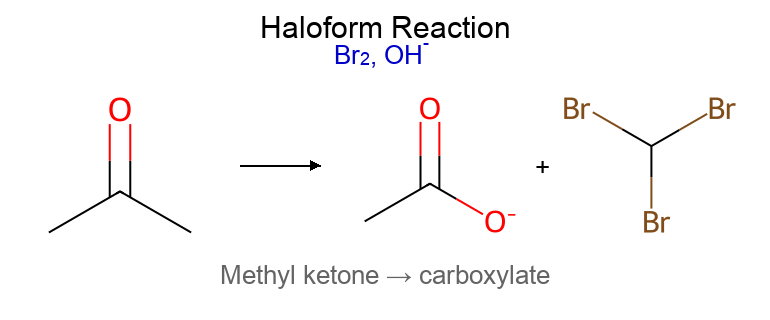
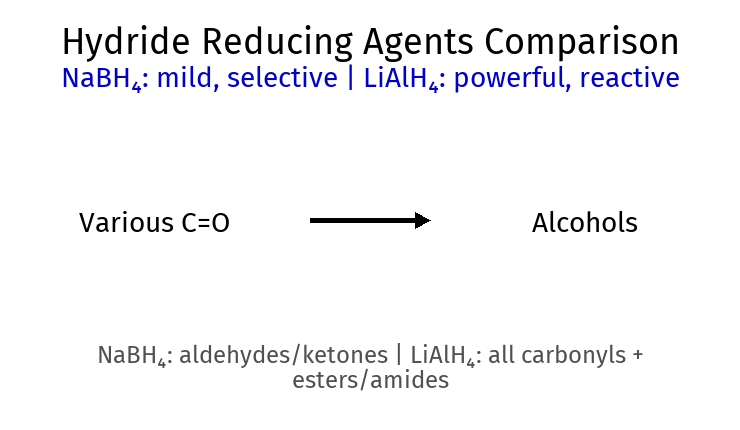
תנאים יבשים לחלוטין (אנהידריים)שני שלבים נפרדים: 1) תקיפה נוקלאופילית 2) הוספת H₂O לנטרול כללי אצבע Lindlar ← cis -אלקןNa/NH₃ ← trans -אלקןPCC ← אלדהיד (עוצר )$\ce{H2CrO4}$ ← חומצה (חמצון מלא )אפוקסיד + $\ce{H^+}$ ← תקיפה ביותר מותמר אפוקסיד בלי $\ce{H^+}$ ← תקיפה בפחות מותמר מלכודות ⚠️ אלקיל הליד 2°/3° + אניון אצטיליד ← E2 (לא $\mathrm{S_N2}$!) ⚠️ ריאגנט גריניאר + H₂O ← חומצה-בסיס (לא נוקלאופילית!) ⚠️ אלכוהול 3° ← לא מתחמצן (אין $\ce{H-\alpha}$) ⚠️ סולפיט ($\ce{SOCl2}$) vs סולפט ← סולפיט נותן תוצרי לוואי נדיפים עקרונות כלליים מרקובניקוב: H ← פחות מותמר, X ← יותר מותמראנטי-מרקובניקוב: ההפך (רק בהידרובורציה או תנאים רדיקליים)$\mathrm{S_N2}$: היפוך קונפיגורציה, דורש נוקלאופיל חזק ואלקטרופיל לא מוגןE1: דרך קרבוקטיון, שיחלופים אפשריים, תוצר זייצב שיעור 11: אלדהידים וקטונים 🔬 מבוא לקבוצת הקרבוניל ($\ce{C=O}$) ריאגנטי חיזור ריאגנט קטון ← אלדהיד ← NaBH4 אלכוהול 2° אלכוהול 1° LiAlH4 אלכוהול 2° אלכוהול 1° H2/Pd לא מגיב לא מגיב
תגובות מיוחדות Wolff-Kishner (H2NNH2/KOH): קטון ← אלקאןSOCl2 : אלכוהול ← אלקיל כלוריד 1. מבנה ותכונות בסיסיות 1.1 סיווג קרבונילים סוג קרבוניל מבנה כללי דוגמה שם מאפיינים פורמלדהיד $\ce{H-CHO}$ $\ce{H2CO}$ מתנאל הריאקטיבי ביותר אלדהיד $\ce{R-CHO}$ $\ce{CH3CHO}$ אתנאל (אצטאלדהיד) H אחד על פחמן קרבונילי קטון $\ce{R-CO-R’}$ $\ce{CH3COCH3}$ אצטון (פרופנון) שתי קבוצות R על פחמן קרבונילי
1.2 מבנה אלקטרוני וגיאומטריה תכונה ערך/תיאור השלכות היברידיזציה $sp^2$ גיאומטריה מישורית זוויות קשר ~120° מבנה טריגונלי קוטביות קשר $\ce{C^{\delta+}=O^{\delta-}}$ פחמן אלקטרופילי, חמצן נוקלאופילי אורכי קשר C=O: 1.22 Å קצר מ-C=C (1.34 Å)
2. סדר ריאקטיביות קרבונילים 2.1 ריאקטיביות כלפי נוקלאופילים דירוג סוג קרבוניל ריאקטיביות יחסית סיבות עיקריות 1 פורמלדהיד הגבוהה ביותר אין קבוצות אלקיל דוחפות 2 אלדהידים גבוהה קבוצת אלקיל אחת + H קטן 3 קטונים בינונית שתי קבוצות אלקיל דוחפות 4 אסטרים נמוכה רזוננס עם חמצן 5 אמידים הנמוכה ביותר רזוננס חזק עם חנקן
2.2 גורמים המשפיעים על ריאקטיביות גורם השפעה על ריאקטיביות הסבר קבוצות דוחפות אלקטרונים מפחיתה מקטינות $\delta^+$ על פחמן קבוצות מושכות אלקטרונים מגבירה מגדילות $\delta^+$ על פחמן הפרעה סטרית מפחיתה קושי בגישת נוקלאופיל קטליזה חומצית מגבירה פרוטונציה יוצרת $\ce{C^+}$
סינתזה של אלדהידים וקטונים 3. הכנת אלדהידים שיטה ריאגנטים חומר מוצא תוצר תנאים חשובים חמצון אלכוהול 1° PCC $\ce{RCH2OH}$ $\ce{RCHO}$ ממס יבש - עוצר באלדהיד חמצון יתר $\ce{H2CrO4}$ מימי $\ce{RCH2OH}$ $\ce{RCOOH}$ ממשיך לחומצה אוזונוליזה מחזרת 1) $\ce{O3}$ $\ce{R-CH=CH-R’}$ $\ce{RCHO + R’CHO}$ תנאים מחזרים אוזונוליזה מחמצנת 1) $\ce{O3}$ אלקן $\ce{RCOOH}$ תנאים מחמצנים
4. הכנת קטונים שיטה ריאגנטים חומר מוצא תוצר הערות חמצון אלכוהול 2° $\ce{H2CrO4}$ או PCC $\ce{R2CHOH}$ $\ce{R2CO}$ לא ממשיך להתחמצן הידרציה אלקין $\ce{H2O/H^+/HgSO4}$ $\ce{R-C≡C-R’}$ $\ce{R-CO-CH2-R’}$ דרך טאוטומריזציה אוזונוליזה 1) $\ce{O3}$ אלקן קטון אם פחמן מותמר בשניים
תגובות קרבונילים - תוספת נוקלאופילית 5. חיזור קרבונילים (Reduction of Carbonyls) ריאגנט חזור חוזק סלקטיביות תוצר מאלדהיד תוצר מקטון תנאים $\ce{LiAlH4}$ חזק מאוד נמוכה אלכוהול 1° אלכוהול 2° אתר יבש $\ce{NaBH4}$ בינוני גבוהה אלכוהול 1° אלכוהול 2° פרוטיק או אפרוטיק $\ce{H2/Pd}$ בינוני בינונית אלכוהול 1° אלכוהול 2° לחץ ותמפרטורה
מנגנון חיזור עם הידרידים תוספת $\ce{H^-}$: $\ce{R2C=O + H^- -> R2CHO^-}$פרוטונציה: $\ce{R2CHO^- + H^+ -> R2CHOH}$ 6. תגובות עם ריאגנט גריניאר 6.1 סוגי תוצרים לפי קרבוניל קרבוניל מקורי ריאגנט תוצר אלכוהול דוגמה פורמלדהיד $\ce{RMgX}$ ראשוני $\ce{HCHO + CH3MgBr -> CH3CH2OH}$ אלדהיד אחר $\ce{RMgX}$ שניוני $\ce{CH3CHO + CH3MgBr -> (CH3)2CHOH}$ קטון $\ce{RMgX}$ שלישוני $\ce{(CH3)2CO + CH3MgBr -> (CH3)3COH}$
6.2 מנגנון תגובת גריניאר תוספת נוקלאופילית: $\ce{RMgX + R’2C=O -> R’2C(R)OMgX}$הידרוליזה: $\ce{R’2C(R)OMgX + H3O^+ -> R’2C(R)OH + Mg^{2+}}$ 7. הידרציה - יצירת הידרטים (gem-diols) 7.1 שיווי משקל הידרציה קרבוניל שיווי משקל % הידראט סיבה פורמלדהיד ← >99% אלקטרופיליות גבוהה אצטאלדהיד ⇌ ~58% בינוני אצטון ← <1% אלקטרופיליות נמוכה קטונים גדולים ← ~0% הפרעה סטרית
7.2 מנגנון הידרציה תנאים מנגנון שלבים בסיסיים התקפה ישירה $\ce{OH^- + C=O -> C(OH)O^- ->[H2O] C(OH)2}$ חומציים הפעלה ואז התקפה $\ce{C=O + H^+ -> C=OH^+ ->[H2O] C(OH)2}$
אצטלים וקטלים - קבוצות הגנה 8. יצירת אצטלים וקטלים 8.1 תנאים ותוצרים חומר מוצא ריאגנט תוצר תנאים שימוש אלדהיד 2 $\ce{ROH}$ + $\ce{H^+}$ אצטל $\ce{RCH(OR’)2}$-$\ce{H2O}$ קבוצת הגנה קטון 2 $\ce{ROH}$ + $\ce{H^+}$ קטל $\ce{R2C(OR’)2}$-$\ce{H2O}$ קבוצת הגנה קרבוניל דיול + $\ce{H^+}$ אצטל/קטל ציקלי -$\ce{H2O}$ יציב יותר
8.2 מנגנון יצירת אצטל (2 שלבים) שלב תגובה תוצר ביניים הערות 1 $\ce{RCHO + ROH ->[H^+] RCH(OH)(OR)}$ המי-אצטל יציב יחסית 2 $\ce{RCH(OH)(OR) ->[ROH/-H2O] RCH(OR)2}$ אצטל מלא דרך קרבוקטיון
8.3 יתרונות כקבוצות הגנה תכונה יציבות תנאי הסרה יתרון בפני בסיסים יציב לא מגיב מאפשר תגובות בסיסיות בפני נוקלאופילים יציב לא מגיב מאפשר $\mathrm{S_N2}$, גריניאר בפני מחזרים יציב לא מגיב מאפשר חיזור אתרים אחרים הסרה רגיש $\ce{H3O^+}$ הסרה קלה וסלקטיבית
תגובות עם תרכובות חנקן 9. יצירת אימינים (בסיסי שיף) 9.1 סוגי אמינים ותוצרים אמין מבנה תוצר שם התוצר יציבות אמוניה $\ce{NH3}$ $\ce{R2C=NH}$ אימין ראשוני נמוכה אמין ראשוני $\ce{RNH2}$ $\ce{R2C=NR}$ אימין שניוני בינונית הידרוקסילאמין $\ce{HONH2}$ $\ce{R2C=NOH}$ אוקסים גבוהה הידרזין $\ce{H2NNH2}$ $\ce{R2C=NNH2}$ הידרזון גבוהה
9.2 מנגנון יצירת אימין שלב תגובה תוצר ביניים גורם מניע 1 $\ce{C=O + RNH2 -> C(NHR)OH}$ קרבינולאמין התקפה נוקלאופילית 2 $\ce{C(NHR)OH ->[H^+] C(NHR)OH2^+}$ פרוטונציה הפיכה לקבוצה עוזבת 3 $\ce{C(NHR)OH2^+ -> C^+(NHR) + H2O}$ קרבוקטיון יציאת מים 4 $\ce{C^+(NHR) ->[- H^+] C=NR}$ אימין אלימינציה
10. יצירת אנמינים 10.1 תנאים ותוצרים אמין קרבוניל תוצר מאפיינים אמין שניוני אלדהיד/קטון אנמין קשר C=C + קבוצת NR₂ דוגמה $\ce{(CH3)2NH + CH3CHO}$ $\ce{CH2=CHN(CH3)2}$ נוקלאופיל בפחמן β
10.2 הבדל מאימין תכונה אימין אנמין קשר כפול C=N C=C מיקום חנקן על קשר כפול סמוך לקשר כפול ריאקטיביות אלקטרופילי נוקלאופילי
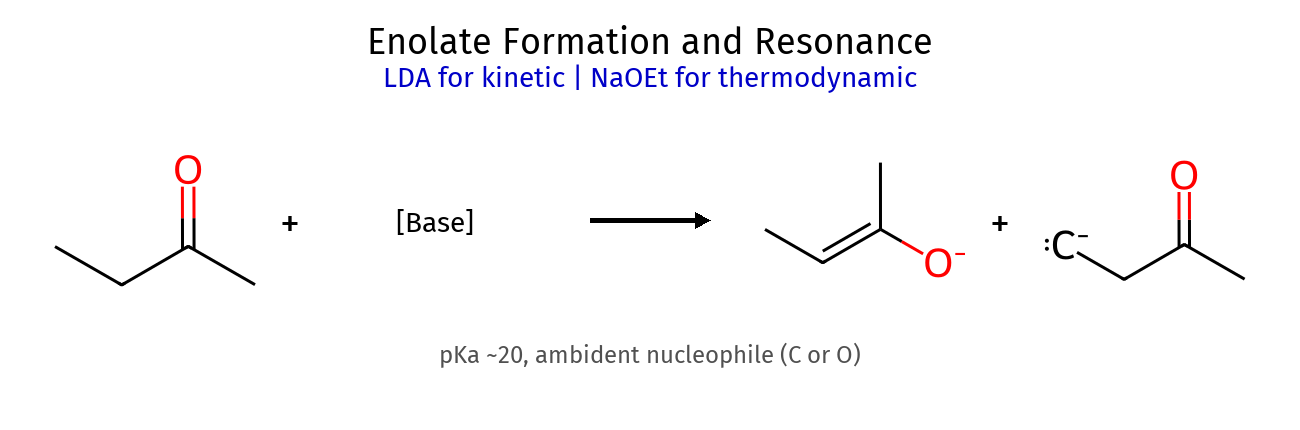
חומציות מימני אלפא 11. חומציות ויצירת אנולטים 11.1 השוואת חומציות תרכובת pKa חומציות יחסית מיוצב על ידי מתן רגיל ~50 חלש מאוד אין מימן α לקטון ~19-20 בינוני רזוננס עם C=O מימן α לאסטר ~25 חלש רזוננס חלש יותר מימן α לניטריל ~25 חלש רזוננס עם C≡N
11.2 מבנה אנולט צורת רזוננס מבנה תרומה אנולט $\ce{R-CH^- -CO-R’}$ מטען על פחמן אוקסי-אניון $\ce{R-CH=CO^- -R’}$ מטען על חמצן היברידי ביניים מטען מחולק
תגובות חמצון והפחתה 12. חמצון קרבונילים 12.1 התנהגות בחמצון סוג קרבוניל ריאגנט חמצון תוצר הסבר אלדהיד $\ce{K2Cr2O7}$ או $\ce{KMnO4}$ חומצה קרבוקסילית יש H על פחמן קרבונילי קטון חומרי חמצון רגילים אין תגובה אין H על פחמן קרבונילי קטון תנאים קשים שבירת קשרים פירוק לחומצות קטנות
12.2 בדיקת טולנס (מראה כסף) מגיב תוצר תצפית מסקנה אלדהיד חומצה + Ag מתכתי מראה כסף חיובי לאלדהיד קטון אין תגובה לא משתנה שלילי אלכוהול אין תגובה לא משתנה שלילי
נקודות מפתח 13. כללי אצבע 13.1 זיהוי מהיר של תגובות ריאגנט תוצר צפוי זיכרון $\ce{NaBH4}$ אלכוהול “הידריד = מוסיף מימנים” $\ce{RMgX}$ אלכוהול + הארכה “גריניאר = מוסיף פחמנים” $\ce{ROH + H^+}$ אצטל “הגנה הפיכה” $\ce{RNH2 + H^+}$ אימין “C=N במקום C=O”
13.2 מלכודות ⚠️ אצטון vs אצטאל: אצטון זה קטון, אצטל זה קבוצת הגנה!
⚠️ PCC vs K₂Cr₂O₇: PCC עוצר באלדהיד, K₂Cr₂O₇ ממשיך לחומצה
⚠️ אימין vs אנמין: אימין יש C=N, אנמין יש C=C ליד חנקן
⚠️ שיווי משקל אצטל: צריך להסיר מים כדי לדחוף קדימה
13.3 אסטרטגיות פתרון זיהוי קבוצות פונקציונליות:
חפש C=O (קרבוניל) זהה H או R על פחמן קרבונילי בדוק מימני α (חומציים) תכנון סינתזה:
אלדהיד ← אלכוהול 1° (PCC) קטון ← אלכוהול 2° (חמצון) אלכוהול ← קרבוניל (חיזור) הגנה ← קרבוניל ← אצטל 14. דוגמאות מיישומיות 14.1 רצף תגובות נפוץ Copy Run אלכוהול 1° --[PCC]--> אלדהיד --[RMgX]--> אלכוהול 2°
↓
[ROH/H⁺]
↓
אצטל (הגנה)
14.2 זיהוי תוצרים שאלה טיפוסית: “מה התוצר של אצטון + מתנול + חומצה?”
פתרון:
אצטון = קטון מתנול = אלכוהול חומצה = קטליזטור תוצר = קטל (קבוצת הגנה) שיעור 12: תגובות אלפא לקרבוניל 🔄 חומציות מימני אלפא ויצירת אנולטים השוואת חומציות לפי מיקום מיקום המימן pKa טיפוסי חומציות יחסית יציבות הבסיס המצומד מיוצב על ידי פחמן רגיל ~50 חלש מאוד נמוכה אין פחמן α לקטון 17-19 בינוני-חזק גבוהה רזוננס עם C=O פחמן α לאסטר ~25 בינוני בינונית רזוננס חלש יותר פחמן β לקרבוניל ~50 חלש מאוד נמוכה אין 1,3-דיקטון ~9 חזק מאוד גבוהה מאוד שני קרבונילים
מבנה אנולטים - רזוננס צורת רזוננס מבנה תרומה יחסית מאפיינים אנולט $\ce{R-CO-CH^–R’}$ בינונית מטען על פחמן (נוקלאופיל) אוקסי-אניון $\ce{R-C(O^-)=CH-R’}$ גבוהה מטען על חמצן (יציב יותר) היברידי ביניים - מטען מחולק בין C ו-O
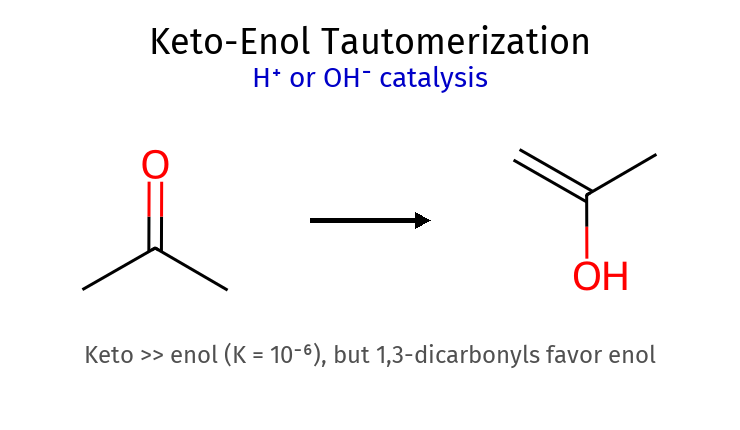
⚖️ שיווי משקל אנול-קטון (טאוטומריזציה) גורמים המשפיעים על שיווי המשקל מקרה כיוון שיווי משקל סיבה דוגמה קטונים רגילים ← קטון C=O יציב מ-C=C אצטון: >99% קטון 1,3-דיקטון אנול ←קשרי מימן תוך-מולקולריים אצטילאצטון: ~80% אנול פנולים אנול ←יצירת מערכת ארומטית 100% אנול α-הלוקטון ← קטון אפקט מושך אלקטרונים עדיפות לקטון
מנגנונים לפי סוג קטליזה קטליזה שלב ראשון שלב שני חומר ביניים מהירות חומצית פרוטונציה C=O דה-פרוטונציה α $\ce{R-C(OH^+)-CH2-R’}$ איטית בסיסית דה-פרוטונציה α פרוטונציה O אנולאט $\ce{R-CO-CH^–R’}$ מהירה
הלוגנציה באלפא ($\alpha$-Halogenation) השוואה בין תנאים חומציים ובסיסיים תנאי קטליזה חומר ביניים מספר H מוחלפים מנגנון אלקטרופיליות לאחר החלפה חומצי אנול אחד בלבד דרך אנול מיקטן (Br מושך e⁻) בסיסי אנולאט כל מימני α דרך אנולאט מגביר חומציות ← החלפות נוספות
מנגנון בקטליזה חומצית שלב תגובה תוצר ביניים הערות 1 $\ce{R-CO-CH2-R’ + H^+ \rightleftharpoons R-C(OH^+)-CH2-R’}$ קרבוניל מפרוטן הפעלה 2 $\ce{R-C(OH^+)-CH2-R’ \rightleftharpoons R-C(OH)=CH-R’ + H^+}$ אנול דה-פרוטונציה α 3 $\ce{R-C(OH)=CH-R’ + Br2 -> R-C(OH^+)-CHBr-R’ + Br^-}$ אלקטרופיליות התקפת אנול על Br₂ 4 $\ce{R-C(OH^+)-CHBr-R’ -> R-CO-CHBr-R’ + H^+}$ α-הלוקטון דה-פרוטונציה
מגבלה: Br מושך אלקטרונים ← מקשה על יצירת אנול נוסף
מנגנון בקטליזה בסיסית שלב תגובה תוצר ביניים הערות 1 $\ce{R-CO-CH2-R’ + OH^- -> R-CO-CH^–R’ + H2O}$ אנולאט דה-פרוטונציה 2 $\ce{R-CO-CH^–R’ + Br2 -> R-CO-CHBr-R’ + Br^-}$ α-הלוקטון התקפה נוקלאופילית 3 $\ce{R-CO-CHBr-R’ + OH^- -> R-CO-CBr^–R’ + H2O}$ אנולאט חדש Br מגביר חומציות 4 חזרה על שלבים 2-3 $\ce{R-CO-CBr3-R’}$ טרי-הלוגנציה
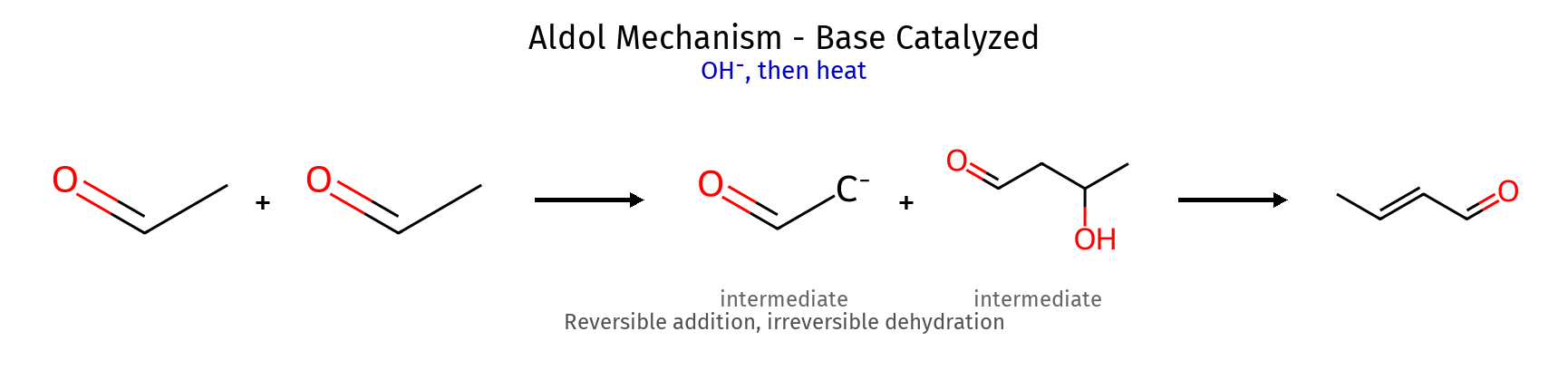
תגובת אלדול - יצירת קשרי C-C סוגי תגובות אלדול סוג תגובה חומרי מוצא תנאים תוצר ראשוני תוצר סופי (עם Δ) אלדול פשוט קרבוניל זהה $\ce{OH^-}$ $\ce{R-CH(OH)-CH2-CO-R}$ $\ce{R-CH=CH-CO-R}$ אלדול מעורב קטון + אלדהיד $\ce{OH^-}$ קטון-CH(OH)-CHO אלפא,בטא-בלתי רווי תוך-מולקולרי דיקרבוניל $\ce{OH^-}$ מולקולה ציקלית טבעת 5-6 איברים
כללי סלקטיביות באלדול מעורב קרבוניל תפקיד סיבה דרישה קטון נוקלאופיל פחות אלקטרופילי חייב H באלפא אלדהיד אלקטרופיל יותר אלקטרופילי לא חייב H באלפא פורמלדהיד אלקטרופיל בלבד הריאקטיבי ביותר אין H באלפא
מנגנון אלדול בקטליזה בסיסית שלב תגובה תוצר ביניים גורם מניע 1 $\ce{CH3CHO + OH^- -> CH2^-CHO + H2O}$ אנולאט דה-פרוטונציה 2 $\ce{CH2^-CHO + CH3CHO -> CH3CH(O^-)CH2CHO}$ אלקוקסיד התקפה C-C 3 $\ce{CH3CH(O^-)CH2CHO + H2O -> CH3CH(OH)CH2CHO}$ אלדול פרוטונציה 4 $\ce{CH3CH(OH)CH2CHO ->[Δ] CH3CH=CHCHO + H2O}$ α,β-בלתי רווי אלימינציה
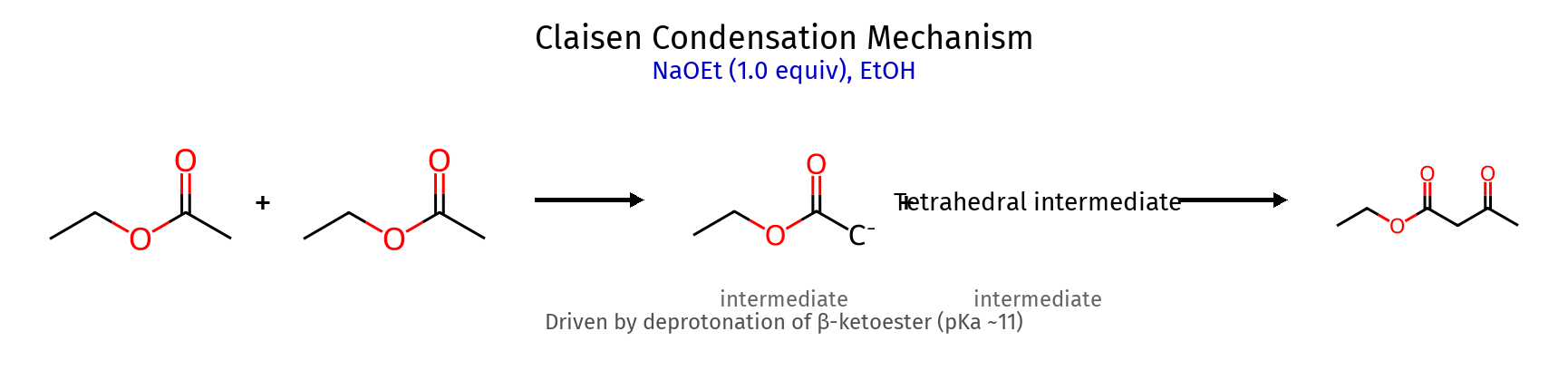
תגובת קלייזן - דחיסת אסטרים השוואה: קלייזן vs אלדול תכונה תגובת אלדול תגובת קלייזן חומרי מוצא קרבונילים אסטרים בסיס $\ce{OH^-}$ $\ce{RO^-}$ (אלקוקסיד) שלב מפתח פרוטונציה O⁻ אלימינציה OR⁻ תוצר α,β-הידרוקסי-קרבוניל β-קטו-אסטר
מנגנון קלייזן מפורט שלב תגובה הסבר קבוצה עוזבת 1 $\ce{CH3CO2Et + EtO^- -> CH2^-CO2Et + EtOH}$ יצירת אנולאט - 2 $\ce{CH2^-CO2Et + CH3CO2Et -> CH3C(O^-)(CH2CO2Et)OEt}$ התקפה על אסטר - 3 $\ce{CH3C(O^-)(CH2CO2Et)OEt -> CH3COCH2CO2Et + EtO^-}$ אלימינציה EtO⁻
הבדל מהותי: באלדול אין קבוצה עוזבת, בקלייזן יש אלימינציה של אלקוקסיד!
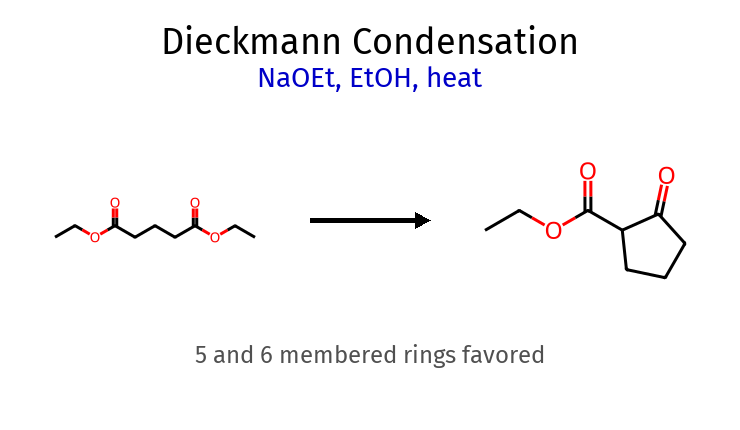
תגובת דיקמן (קלייזן תוך-מולקולרי) גודל טבעת יעילות סיבה דוגמה 5 איברים גבוהה יציבות מקסימלית גלוטרט ← ציקלופנטנון 6 איברים גבוהה יציבות גבוהה אדיפט ← ציקלוהקסנון 7+ איברים נמוכה מתח זוויות לא מועדף
דקרבוקסילציה של β-קטו-חומצות תנאים מבניים לדקרבוקסילציה מבנה יכולת דקרבוקסילציה טמפרטורה נדרשת מנגנון β-קטו-חומצה ✅ ספונטנית חימום בסיסי מעבר ציקלי 6-איברים α-קטו-חומצה ❌ לא - אין יציבות γ-קטו-חומצה ❌ לא - מרחק גדול מדי חומצה רגילה ❌ לא - אין קטון סמוך
מנגנון דקרבוקסילציה - מעבר ציקלי שלב תיאור מבני תוצר גורם מניע 1 יצירת מצב מעבר ציקלי 6-איברים $\ce{R-CO-CH2-COOH -> [מעבר]}$ יציבות ציקלית 2 הגירת פרוטון ושבירת C-C $\ce{R-C(OH)=CH2 + CO2}$ יצירת אנול 3 טאוטומריזציה $\ce{R-CO-CH3}$ יציבות קטון
\[\ce{R-CO-CH2-COOH ->[Δ] R-CO-CH3 + CO2}\] זיהוי במולקולות: חפש קרבוניל וחומצה המופרדים על ידי פחמן אחד בדיוק .
אמינים - בסיסיות ותגובות סיווג אמינים סוג אמין מבנה כללי דוגמה מספר קבוצות R ראשוני $\ce{R-NH2}$ מתילאמין 1 שניוני $\ce{R2NH}$ דימתילאמין 2 שלישוני $\ce{R3N}$ טרימתילאמין 3
סדר בסיסיות אמינים דירוג סוג אמין pKa של $\ce{BH^+}$ בסיסיות יחסית סיבות עיקריות 1 שניוני ~11 הגבוהה ביותר אפקט אינדוקטיבי אופטימלי + הפרעה מינימלית 2 ראשוני ~10.7 גבוהה אפקט אינדוקטיבי חיובי 3 שלישוני ~10.8 בינונית הפרעה סטרית בפרוטונציה 4 אמוניה 9.25 הנמוכה ביותר אין אפקט אינדוקטיבי
מקרים מיוחדים בבסיסיות תרכובת pKa בסיסיות גורם מכריע אנילין ~4.6 חלשה מאוד רזוננס עם טבעת ארומטית פירידין 5.2 חלשה היברידיזציה sp² אמיד <0 אין רזוננס חזק עם C=O
תגובות עיקריות של אמינים תגובה ריאגנטים תוצר מנגנון הערות אלקילציה $\ce{RX}$ אמין מותמר יותר $\mathrm{S_N2}$ עם אלקיל הליד 1° יצירת אימין קרבוניל + $\ce{H^+}$ $\ce{R2C=NR’}$ תוספת-אלימינציה תגובת שיף יצירת אנמין קרבוניל + אמין 2° $\ce{R2C=CHR + NR2}$ שונה מאימין C=C במקום C=N אמינציה חוזרת 1) אימין 2) חיזור אמין שניוני הידרוגנציה $\ce{H2/Pd}$
השוואת מנגנונים - תקיפה באלפא תגובה נוקלאופיל אלקטרופיל תוצר תכונה ייחודית הלוגנציה α אנול/אנולאט $\ce{X2}$ α-הלוקטון בסיסי = כל ה-H אלדול אנולאט קרבוניל α,β-הידרוקסי + אלימינציה בחימום קלייזן אנולאט אסטר β-קטו-אסטר אלימינציה של OR⁻ אלקילציה אנולאט $\ce{RX}$ α-אלקיל קרבוניל $\mathrm{S_N2}$ עם הליד 1°
זיהוי מהיר רואים בשאלה חושבים על ריאגנט מפתח $\ce{Br2}$ + בסיס הלוגנציה α בסיסית כל מימני α $\ce{Br2}$ + חומצה הלוגנציה α חומצית מימן α אחד $\ce{OH^-}$ + חימום אלדול + דהידרציה α,β-בלתי רווי $\ce{EtO^-}$ + אסטר קלייזן β-קטו-אסטר β-קטו-חומצה + Δ דקרבוקסילציה קטון + CO₂
נקודות מפתח כללי אצבע - חומציות ותגובות נושא כלל זהב מלכודת נפוצה חומציות α pKa ~17-19 (רזוננס עם C=O) לא לבלבל עם β הלוגנציה בסיסי = הכל, חומצי = אחד חומצי לא ממשיך! אלדול קטון = נוקלאופיל, אלדהיד = אלקטרופיל רק H באלפא יכול להיות נוקלאופיל קלייזן אלימינציה OR⁻ (לא פרוטונציה!) שונה מאלדול! דקרבוקסילציה רק β-קטו (פחמן אחד הפרש) לא α או γ בסיסיות אמינים 2° > 1° > 3° > NH₃ רזוננס באנילין הורס
אסטרטגיות פתרון זיהוי מהיר של תגובות:
ראית Br₂? ← הלוגנציה α (בדוק חומצי/בסיסי)ראית $\ce{OH^-}$ + חימום? ← אלדול עם דהידרציהראית EtO⁻? ← קלייזן (אסטרים)ראית β-קטו-חומצה + Δ? ← דקרבוקסילציהראית אמין + קרבוניל? ← אימין או אנמין תכנון סינתזה:
α-הלוקטון ← הלוגנציה α,β-בלתי רווי ← אלדול + Δ β-קטו-אסטר ← קלייזן קטון ← דקרבוקסילציה של β-קטו-חומצה שיעור 13: חומצות קרבוקסיליות ונגזרותיהן נגזרות חומצות קרבוקסיליות - סדר ריאקטיביות נגזרה ריאקטיביות יחסית קבוצה עוזבת סינתזה מחומצה תגובות אופייניות אציל כלוריד הכי גבוהה $\ce{Cl^-}$ $\ce{SOCl2}$ או $\ce{PCl5}$ ← כל הנגזרות האחרות אנהידריד גבוהה $\ce{RCOO^-}$ חימום 2$\ce{RCOOH}$ ← אסטר, אמיד אסטר בינונית $\ce{RO^-}$ $\ce{ROH + H^+}$ או $\ce{RCOCl}$ ← חומצה, אמיד אמיד נמוכה $\ce{NH2^-}$ (גרועה) $\ce{RNH2 + RCOCl}$ הכי יציב
תגובות של נגזרות חומצה חומר מוצא ריאגנט תוצר מספר התקפות הערות אציל כלוריד $\ce{LiAlH4}$ כוהל 1° 2 דרך אלדהיד אציל כלוריד $\ce{2 RMgX}$ כוהל 3° 2 דרך קטון אסטר $\ce{LiAlH4}$ כוהל 1° + כוהל 2 דרך אלדהיד אסטר $\ce{2 RMgX}$ כוהל 3° 2 דרך קטון אסטר $\ce{OH^-}$ קרבוקסילט 1 ספוניפיקציה אמיד $\ce{LiAlH4}$ אמין - חיזור, לא החלפה
סינתזה של חומצות קרבוקסיליות שיטת סינתזה ריאגנטים מנגנון הערות חמצון כוהל ראשוני $\ce{K2Cr2O7/H+}$ חמצון דו-שלבי $\ce{R-CH2OH -> R-CHO -> R-COOH}$ קרבוקסילציה של גריניאר $\ce{RMgX + CO2}$ ואז $\ce{H3O+}$ התקפה נוקליאופילית על $\ce{CO2}$ הארכת שרשרת באטום פחמן אחד
סדר ריאקטיביות נגזרות חומצה קרבוקסילית סדר ריאקטיביות נגזרת סיבת הריאקטיביות קבוצה עוזבת 1 (הכי ריאקטיבי) אציל הליד הלוגן מושך אלקטרונים אינדוקטיבית $\ce{X^-}$ (מצוין) 2 אנהידריד אפקט אינדוקטיבי מקרבוניל שני $\ce{RCOO^-}$ (טוב) 3 אסטר רזוננס מחמצן מפחית אלקטרופיליות $\ce{RO^-}$ (גרוע) 4 (הכי פחות ריאקטיבי) אמיד רזוננס חזק מחנקן $\ce{R2N^-}$ (גרוע מאוד)
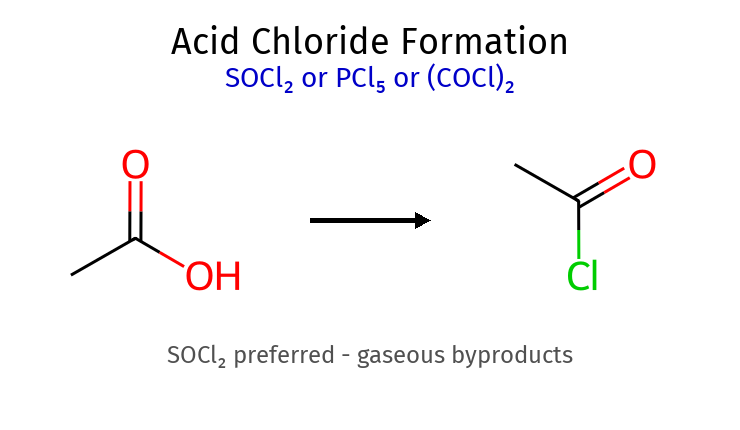
סינתזה של אציל הלידים ריאגנט תגובה תוצרי לוואי יתרונות תיוניל כלוריד $\ce{R-COOH + SOCl2 -> R-COCl + SO2 + HCl}$ גזיים (מתנדפים) בידוד קל של התוצר פוספור טריברומיד $\ce{3R-COOH + PBr3 -> 3R-COBr + H3PO3}$ נוזלי יצירת אציל ברומידים
תגובות אציל הלידים - המרכז הסינתטי נוקליאופיל תוצר מנגנון הערות מיוחדות מים $\ce{R-COCl + H2O -> R-COOH + HCl}$ החלפה נוקליאופילית אצילית הידרוליזה כוהל $\ce{R-COCl + R’OH -> R-COOR’ + HCl}$ החלפה נוקליאופילית אצילית יצירת אסטר אמין $\ce{R-COCl + 2R’2NH -> R-CON(R’)2 + R’2NH2^+Cl^-}$ החלפה נוקליאופילית אצילית נדרשות 2 מולקולות אמין קרבוקסילט $\ce{R-COCl + R’COO^- -> R-CO-O-CO-R’ + Cl^-}$ החלפה נוקליאופילית אצילית יצירת אנהידריד
תגובות רדוקציה ותוספת של אציל הלידים ריאגנט תוצר מספר התקפות הערות $\ce{LiAlH4}$ $\ce{R-COCl -> R-CH2OH}$ שתיים (דרך אלדהיד)כוהל ראשוני ריאגנט גריניאר $\ce{R-COCl + 2R’MgX -> R-C(OH)(R’)2}$ שתיים (דרך קטון)כוהל שלישוני
תגובות אנהידרידים תגובה ריאגנטים תוצר קבוצה עוזבת הידרוליזה $\ce{(RCO)2O + H2O}$ $\ce{2RCOOH}$ $\ce{RCOO^-}$ אלכוהוליזה $\ce{(RCO)2O + R’OH}$ $\ce{RCOOR’ + RCOOH}$ $\ce{RCOO^-}$ אמינוליזה $\ce{(RCO)2O + 2R’NH2}$ $\ce{RCONHR’ + RCOO^-NH3R’^+}$ $\ce{RCOO^-}$ רדוקציה $\ce{(RCO)2O + LiAlH4}$ $\ce{2RCH2OH}$ -
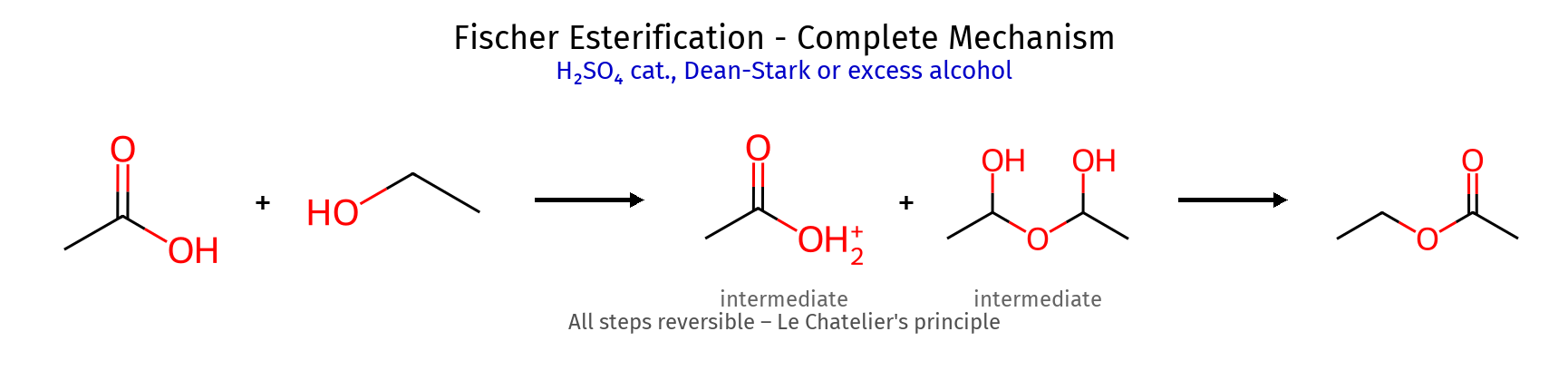
סינתזה של אסטרים - שלוש שיטות עיקריות שיטה ריאגנטים יתרונות מגבלות דרך אציל הליד $\ce{R-COOH ->[SOCl2] R-COCl ->[R’OH] R-COOR’}$ מהיר, יעיל שני שלבים, $\ce{HCl}$ קורוזיבי אלקילציה של קרבוקסילט $\ce{R-COOH ->[base] R-COO^- ->[R’X] R-COOR’}$ שלב אחד רק עם אלקיל הלידים ראשוניים אסטריפיקציה של פישר $\ce{R-COOH + R’OH <=>[H+] R-COOR’ + H2O}$ ישיר, זול שיווי משקל, איטי
מנגנון אסטריפיקציה של פישר - 5 שלבים שלב תהליך תוצר ביניים הערה 1 פרוטונציה של קרבוניל $\ce{R-C(=OH^+)-OH}$ הגברת אלקטרופיליות 2 התקפת כוהל $\ce{R-C(OH)(OH)(OR’H^+)}$ תוצר ביניים טטרהדרלי 3 העברת פרוטון $\ce{R-C(OH)(OH2^+)(OR’)}$ הכנת קבוצה עוזבת 4 סילוק מים $\ce{R-C(=OH^+)(OR’)}$ שחזור קרבוניל 5 דה-פרוטונציה $\ce{R-C(=O)(OR’)}$ אסטר סופי
תגובות אסטרים תגובות עם נוקליאופילים חלשים (דורשות קטליזה חומצית) תגובה תנאים תוצר שיווי משקל הידרוליזה חומצית $\ce{H2O/H+}$ $\ce{R-COOH + R’OH}$ הפיך טרנסאסטריפיקציה $\ce{R’‘OH/H+}$ $\ce{R-COOR’’ + R’OH}$ הפיך
תגובות עם נוקליאופילים חזקים ריאגנט תוצר מספר התקפות מנגנון אמין $\ce{R-COOR’ + R’‘NH2 -> R-CONHR’’ + R’OH}$ אחת החלפה נוקליאופילית $\ce{LiAlH4}$ $\ce{R-COOR’ -> R-CH2OH + R’OH}$ שתיים דרך אלדהיד ריאגנט גריניאר $\ce{R-COOR’ + 2R’‘MgX -> R-C(OH)(R’‘)2 + R’OH}$ שתיים דרך קטון
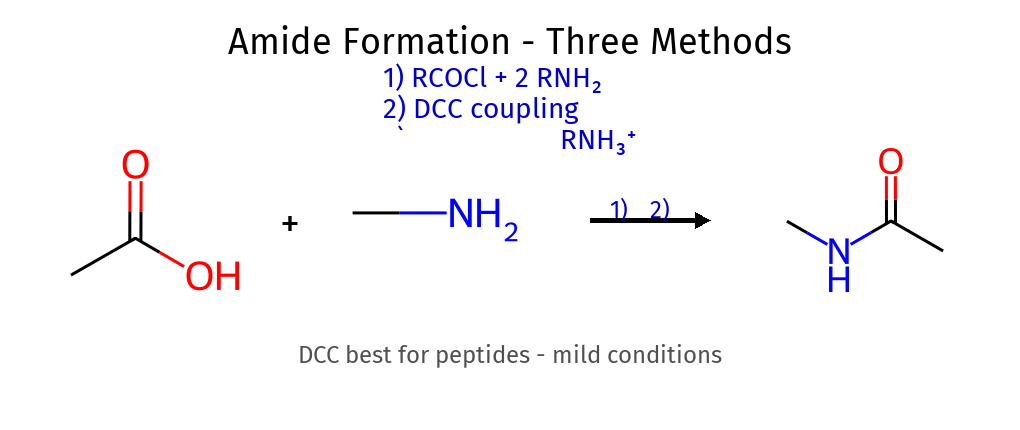
סינתזה של אמידים שיטה ריאגנטים יעילות הערות מאציל הליד $\ce{R-COCl + 2R’2NH}$ גבוהה נדרשות 2 מולקולות אמין מאנהידריד $\ce{(RCO)2O + 2R’NH2}$ בינונית פחות קורוזיבי מאסטר $\ce{R-COOR’ + R’‘NH2}$ נמוכה איטי צימוד DCC $\ce{R-COOH + R’NH2 + DCC}$ גבוהה תנאים עדינים
מנגנון צימוד DCC שלב תהליך תוצר ביניים 1 הפעלת חומצה $\ce{R-CO-O-DCC}$ 2 התקפת אמין $\ce{[R-C(O^-)(NHR’)(O-DCC)]}$ 3 העברת פרוטון $\ce{[R-C(O^-)(NR’)(O-DCC-H)]}$ 4 סילוק DCU $\ce{R-CO-NR’ + DCU}$
יישומים ביולוגיים מרכזיים טריגליצרידים תגובה תנאים תוצר חשיבות סיפון (הידרוליזה בסיסית) $\ce{טריגליצריד + 3OH^- -> גליצרול + 3RCOO^-}$ סבון ניקוי עיכול (הידרוליזה אנזימטית) ליפזות גליצרול + חומצות שומן מטבוליזם
סיווג חומצות שומן - השפעה על בריאות סוג מבנה תכונות פיזיקליות השפעה בריאותית רוויות ללא קשרים כפולים מוצקות בט”ח מעלות LDL בינונית בלתי רוויות cis קשרים כפולים cis נוזליות בט”ח מועילות - מורידות LDL בלתי רוויות trans קשרים כפולים trans מוצקות יחסית מזיקות מאוד - מעלות LDL
קשרים פפטידיים מאפיין ערך השלכה רזוננס C-N $\ce{R-C(=O)-NR’2 <-> R-C^+(-O^-)-NR’2}$ מגבלת סיבוב גיאומטריה מישורית מבנה חלבון יציב קשרי מימן חזקים מבנה משני של חלבונים
כללים מנחים לפתרון תרגילים זיהוי תבניות תגובה מרכזיות תבנית בתוצר ריאגנט מתאים מספר התקפות נגזרת חומצה ← כוהל ראשוני $\ce{LiAlH4}$ שתיים נגזרת חומצה ← כוהל שלישוני ריאגנט גריניאר שתיים קטון/אלדהיד ← כוהל $\ce{LiAlH4}$ או גריניאר אחת
עקרונות מפתח נוקליאופילים חזקים ($\ce{LiAlH4}$, גריניאר) - לא דורשים הפעלה חומציתנגזרות חומצה - תמיד שתי התקפות עם נוקליאופילים חזקיםאציל הלידים - הריאקטיביים ביותר, מרכז סינתטיDCC - לצימוד עדין של חומצה ואמיןאסטריפיקציה - הפיכה, דורשת הסטת שיווי משקל מגבלות חשובות גריניאר + חומצה קרבוקסילית = תגובת חומצה-בסיס (לא צימוד)אמידים = הכי פחות ריאקטיביים (רזוננס חזק)קבוצות הגנה = נדרשות לתגובות סלקטיביות זיהוי מהיר ראית אתוקסיד + אלקיל הליד 2° ? ← E2 (זייצב) ראית H⁺/H2O + אלקן ? ← הידרציה מרקובניקוב ראית Newman עם קבוצות גדולות ? ← חפש anti/gauche ראית pKa ? ← זכור: דיקרבוניל < אלקין < אלקן < אלקאן בדיקת תשובות בסטריאוכימיה - בדוק שכל המרכזים מסומנים בקונפורמציות - staggered תמיד יציב יותר במנגנונים - SN2 = היפוך, SN1 = רצמיזציה בחומציות - חפש רזוננס וייצוב המטען השלילי דור פסקל 20 ביולי 2025