מבוא
בשיעור זה נלמד על עקרונות יסוד בכימיה אורגנית, בדגש על חומצות ובסיסים, משפחות של תרכובות אורגניות, ואלקנים. נדון בגורמים המשפיעים על חומציות ובסיסיות, ונלמד כיצד לזהות ולקרוא בשמות תרכובות אורגניות שונות.
חומצות ובסיסים בכימיה אורגנית
הגדרות בסיסיות
בכימיה אורגנית, רוב התגובות מבוססות על יחסי חומצה-בסיס. נהוג להגדיר:
- חומצה: חומר שיכול לתת פרוטון ($\ce{H+}$)
- בסיס: חומר שיכול לקבל פרוטון
- חומצה מצומדת: הבסיס שנוצר לאחר שחומצה איבדה פרוטון
- בסיס מצומד: החומצה שנוצרת לאחר שבסיס קיבל פרוטון
חשוב לציין שכל חומר יכול להיות גם חומצה וגם בסיס, תלוי בקונטקסט ובחומר שאיתו הוא מגיב. הקביעה האם חומר הוא חומצה או בסיס תלויה בהשוואה לחומר השני בתגובה.
לדוגמה:
- מים (H₂O) יכולים להיות חומצה כאשר הם מגיבים עם NH₃
- מים יכולים להיות בסיס כאשר הם מגיבים עם HCl
קבוע שיווי משקל (K) ו-pKa
כשחומצה מגיבה עם בסיס, התגובה מגיעה לשיווי משקל. חוזק החומצה נקבע על ידי קבוע שיווי המשקל (K):
K = [תוצרים] / [מגיבים]
בתגובה של חומצה עם מים:
\[\ce{HA + H2O <=> A- + H3O+}\]קבוע שיווי המשקל יהיה:
\[K = \frac{[A^-][H_3O^+]}{[HA][H_2O]}\]ככל שהקבוע Ka גדול יותר, החומצה חזקה יותר. לנוחות המדידה והשימוש, משתמשים בערך ה-pKa:
\[pKa = -log(Ka)\]ככל שערך ה-pKa נמוך יותר, החומצה חזקה יותר.
דוגמאות לערכי pKa:
- חומצות חזקות מאוד: pKa < 0
- חומצות חזקות: pKa 0-4
- חומצות בינוניות: pKa 4-9
- חומצות חלשות: pKa 9-15
- חומצות חלשות מאוד: pKa > 15
pH ו-pKa
ה-pH של תמיסה הוא מדד לריכוז יוני מימן ($\ce{H+}$) בתמיסה:
\[\text{pH} = -\log[\ce{H+}]\]דוגמאות לחישוב pH:
- עבור חומצה חזקה כמו HCl בריכוז 1M:
- HCl מתפרק באופן מלא ל-$\ce{H+}$ ו-Cl⁻
- ריכוז ה-$\ce{H+}$ הוא 1M
- pH = -log(1) = 0
- עבור חומצה חלשה כמו חומצה אצטית (CH₃COOH) בריכוז 1M:
- החומצה מתפרקת חלקית: $\ce{CH3COOH <=> CH3COO- + H+}$
- אם נסמן את ריכוז ה-$\ce{H+}$ ב-x, נקבל:
- Ka = x²/(1-x)
- פתרון המשוואה נותן pH של כ-2.38
“pH יכול להיות גם מספר שלילי. זה ממש בסדר ולא צריך ליפול מהרגליים. זה פשוט אומר שהחומצה חזקה מאוד.”
גורמים המשפיעים על חוזק חומצה
קבוע שיווי המשקל (Ka) מושפע ממספר גורמים:
- טמפרטורה
- הסולבנט (הממס)
- אפקטים יוניים
ריכוז החומצה אינו משפיע על ערך הקבוע, אבל משפיע על שיווי המשקל של התגובה.
קבוצות דוחפות ומושכות אלקטרונים
האפקט האינדוקטיבי
קבוצות במולקולה יכולות להשפיע על החומציות באמצעות האפקט האינדוקטיבי:
קבוצות דוחפות אלקטרונים (Electron Donating Groups):
- תורמות אלקטרונים למערכת
- מייצבות את הבסיס המצומד
- מורידות את החומציות של המולקולה
- מעלות את הבסיסיות
- דוגמאות: קבוצות אלקיליות ($\ce{CH3}$, $\ce{CH2CH3}$, וכו’)
קבוצות מושכות אלקטרונים (Electron Withdrawing Groups):
- מושכות אלקטרונים מהמערכת
- מייצבות את החומצה ולא את הבסיס המצומד
- מעלות את החומציות של המולקולה
- מורידות את הבסיסיות
- דוגמאות: NO₂, C=O, CN, הלוגנים
דוגמה להשוואה:
חומצה אצטית (CH₃COOH) וחומצה פורמית (HCOOH):
- ההבדל ביניהן הוא קבוצת המתיל בחומצה אצטית לעומת מימן בחומצה פורמית
- קבוצת המתיל היא קבוצה דוחפת אלקטרונים, המייצבת את הבסיס המצומד
- לכן, חומצה פורמית היא חומצה חזקה יותר מחומצה אצטית
 |  |
|---|---|
| חומצה אצטית (CH₃COOH) | חומצה פורמית (HCOOH) |
| pKa ≈ 4.76 | pKa ≈ 3.75 |
אפקט הרזוננס
אפקט הרזוננס מתרחש כאשר ניתן לצייר מספר מבנים רזוננטיים למולקולה:
- רזוננס מאפשר לפזר את המטען השלילי (או החיובי) על פני המולקולה
- ככל שיש יותר מבנים רזוננטיים, המולקולה יציבה יותר
- חומצות קרבוקסיליות חזקות יותר מאלכוהולים בגלל האפשרות לרזוננס בבסיס המצומד
דוגמה: חומצה קרבוקסילית
 \[\ce{R-COOH <=> R-COO- + H+}\]
\[\ce{R-COOH <=> R-COO- + H+}\] הבסיס המצומד ($\ce{R-COO-}$) יכול לפזר את המטען השלילי בין שני אטומי החמצן באמצעות רזוננס, מה שמייצב אותו.
\[\begin{array}{ccccccccccc} \ce{H} & \ce{:\ddot{O}:^-} & & \ce{H} & \ce{O} & \\ \mid & \mid & & \mid & \parallel & \\ \ce{H-C}-- & \ce{C} & \ce{=O} \ \xleftrightarrow{} &\ \ce{H-C}-- & \ce{C} & \ce{-O^-} \\ \mid & & & \mid & & & \\ \ce{H} & & & \ce{H} & & \end{array}\]משפחות חומרים אורגניים
אלכוהולים
אלכוהולים מאופיינים בקבוצת הידרוקסיל (OH) המחוברת לשלד פחמימני.
כאשר אלכוהול מגיב כחומצה הקבוצה ההידרוקסילית נותנת פרוטון:
\[\ce{R-OH + B- -> R-O- + BH}\]כאשר אלכוהול מגיב כבסיס:
\[\ce{R-OH + HA -> R-OH2+ + A-}\]ה-pKa של אלכוהולים פרוטוניים ($\ce{ROH2+}$) הוא בין -2 ל-3, מה שהופך אותם לחומצות חזקות יחסית.
חומצות קרבוקסיליות
חומצות קרבוקסיליות מכילות קבוצת COOH. הן חומצות חזקות יותר מאלכוהולים בגלל יכולתן לייצב את הבסיס המצומד באמצעות רזוננס.
\[\ce{R-COOH + H2O <=> R-COO- + H3O+}\]ה-pKa של חומצות קרבוקסיליות הוא בסביבות 5-4, מה שהופך אותן לחומצות בינוניות.
אמינים
אמינים מכילים חנקן עם זוג אלקטרונים לא קושר. במרבית התגובות, אמינים מתנהגים כבסיסים.
- אמינים ראשוניים: $\ce{R-NH2}$
- אמינים שניוניים: $\ce{R-NH-R’}$
- אמינים שלישוניים: $\ce{R-N(R’)(R’’)}$
כאשר אמין מגיב כבסיס:
\[\ce{R-NH2 + H+ -> R-NH3+ + A-}\]היברידיזציה והשפעתה על חומציות
היברידיזציה משפיעה על החומציות של מולקולות אורגניות:
- sp היברידיזציה: האלקטרונים קרובים יותר לגרעין (50% אורביטל s), מה שהופך את הפחמן ליותר אלקטרושלילי ואת החומצה לחזקה יותר.
- $sp^2$: 33% אורביטל s, חומציות בינונית
- $sp^3$: 25% אורביטל s, חומציות נמוכה יותר
דוגמאות:
- אצטילן (HC≡CH, sp): pKa ≈ 25
- אתילן (H₂C=CH₂, sp²): pKa ≈ 44
- אתאן (H₃C-CH₃, sp³): pKa ≈ 50
“למרות שחומצה עם היברידיזציית sp היא החומצה החזקה ביותר בהשוואה ל-sp² ו-sp³, היא עדיין נחשבת לחומצה חלשה בהשוואה לחומצות אחרות כמו HCl או חומצה אצטית.”
השוואה בין משפחות חומרים
השפעת האלקטרושליליות
לאורך שורה בטבלה המחזורית, האלקטרושליליות עולה מימין לשמאל:
\[\ce{C < N < O < F}\]חומצה שבה המרכז החומצי קשור לאטום אלקטרושלילי יותר תהיה חזקה יותר.
דוגמה:
- HF > H₂O > NH₃ > CH₄ (החומציות יורדת)
השפעת גודל האטום
לאורך טור בטבלה המחזורית, גודל האטום עולה מלמעלה למטה:
\[\ce{F < Cl < Br < I}\]אטומים גדולים יותר (בטור) יכולים לפזר טוב יותר את המטען השלילי:
דוגמה משפחת ההלוגנים:
- HI > HBr > HCl > HF (החומציות עולה)
השפעת המרחק מהמרכז החומצי
ככל שהקבוצה המושכת אלקטרונים רחוקה יותר מהמרכז החומצי, השפעתה קטנה:
דוגמה:
- BrCH₂COOH > BrCH₂CH₂COOH > BrCH₂CH₂CH₂COOH

המורה מסביר: “ככל שהברום רחוק יותר, האפקט שלו יורד. הוא לא נמצא קרוב לתמוך במטען השלילי.”
חומצות אמיניות
מבנה כללי
חומצות אמיניות הן אבני הבניין של חלבונים ובעלות מבנה בסיסי משותף:
- קבוצת אמין ($\ce{NH2}$)
- קבוצת קרבוקסיל ($\ce{COOH}$)
- פחמן אלפא (פחמן מרכזי)
- קבוצת צד (R) ייחודית לכל חומצה אמינית
סוגי חומצות אמיניות
חומצות אמיניות מסווגות לפי תכונות קבוצת הצד שלהן:
הידרופוביות (לא פולאריות):
- אלנין, ולין, לאוצין, איזולאוצין, מתיונין, פנילאלנין, טירוזין, טריפטופן
פולאריות (לא טעונות):
- סרין, תראונין, אספרגין, גלוטמין
מיוחדות:
- גליצין (ללא קבוצת צד), פרולין (אמין שניוני במקום ראשוני), ציסטאין (קבוצת SH)
טעונות חיובית:
- ארגינין, היסטידין, ליזין
טעונות שלילית:
- אספרטיק אסיד, גלוטמיק אסיד
חומצות אמיניות גם מסווגות ל:
- חיוניות (Essential): חייבים לקבל מהמזון כי הגוף לא מייצר אותן
- לא חיוניות (Non-essential): הגוף יכול לייצר אותן
המורה מציין שיש 20 חומצות אמיניות סטנדרטיות, אך תיתכנה גם תשובות של 22 או יותר, תלוי בהגדרות.
מצב יוני בהתאם ל-pH
חומצות אמיניות יכולות להיות במצבים יוניים שונים בהתאם ל-pH:
דוגמה: גלוטמיק אסיד:
- pKa של קבוצת קרבוקסיל אלפא: 2.19
- pKa של קבוצת קרבוקסיל בשרשרת הצד: 4.3
- pKa של קבוצת אמין: 9.7
ב-pH 7.2 (קרוב ל-pH פיזיולוגי), גלוטמיק אסיד תהיה במצב שבו:
- קבוצת הקרבוקסיל האלפא טעונה שלילית ($\ce{R-COO-}$)
- קבוצת הקרבוקסיל בשרשרת הצד טעונה שלילית ($\ce{R-COO-}$)
- קבוצת האמין טעונה חיובית ($\ce{R-NH3+}$)
סך הכל: מטען כולל של -1
חומצה לפי ברונסטד-לאורי וחומצה לפי לואיס
קיימות שתי הגדרות עיקריות לחומצות ובסיסים:
חומצת ברונסטד-לאורי:
- חומר שנותן פרוטון ($\ce{H+}$)
- דוגמאות: HCl, H₂SO₄, CH₃COOH
 |  |
|---|---|
| חומצה מלחית (HCl) | חומצה אצטית (CH₃COOH) |
בסיס ברונסטד:
- חומר שמקבל פרוטון
- דוגמאות: $\ce{H2O}$, $\ce{NH3}$, $\ce{CH3COO-}$
 |
|---|
| אמוניה (NH₃) |
חומצת לואיס:
- חומר שמקבל זוג אלקטרונים
- דוגמאות: $\ce{BF3}$, $\ce{AlCl3}$, $\ce{Fe^3+}$
 |  |
|---|---|
| בורון טריפלואורי (BF₃) | אלומיניום כלוריד (AlCl₃) |
בסיס לואיס:
- חומר שנותן זוג אלקטרונים
- דוגמאות: $\ce{H2O}$, $\ce{NH3}$, זוגות אלקטרונים לא קושרים
 |  |
|---|---|
| מים (H₂O) | אמוניה (NH₃) |
דוגמה לתגובת חומצה-בסיס לואיס:
\[\ce{BF3 + NH3 -> F3B-NH3}\]המורה מציין שבכימיה אורגנית, רוב התגובות הן מסוג ברונסטד, אך חשוב להכיר גם את תגובות לואיס.
מסיסות ותכונות פיזיקליות
המסיסות של חומרים אורגניים תלויה במבנה שלהם ובמטען:
- חומרים טעונים נוטים להתמוסס במים (הידרופיליים)
- חומרים לא טעונים עם אזורים הידרופוביים נוטים להתמוסס בממסים אורגניים
בכימיה אורגנית, מפרידים בין חומרים באמצעות ממסים שונים:
- ממסים הידרופיליים (כמו מים)
- ממסים הידרופוביים (כמו אתר, ציקלוהקסן)
העיקרון המנחה הוא “like dissolves like” - דומה ממס דומה.
בופרים
בופרים הם תמיסות המתנגדות לשינויי pH:
- הם מכילים גם חומצה וגם בסיס
- אם מוסיפים חומצה, הבסיס מנטרל אותה
- אם מוסיפים בסיס, החומצה מנטרלת אותו
בגוף האדם יש מערכות בופר רבות השומרות על pH קבוע בטווח הפיזיולוגי.
אלקאנים ותרכובות אורגניות
מבנה ותכונות
אלקאנים הם שרשראות של פחמנים המחוברים בקשרים יחידים. הנוסחה הכללית שלהם היא CₙH₂ₙ₊₂.
דוגמאות:
- מתאן $\ce{CH4}$ Methane
- אתאן $\ce{C2H6}$ Ethane
- פרופאן $\ce{C3H8}$ Propane
- בוטאן $\ce{C4H10}$ Butane
- פנטאן $\ce{C5H12}$ Prntane
- הקסאן $\ce{C6H14}$ Hexane
- הפטאן $\ce{C7H16}$ Heptane
- אוקטאן $\ce{C8H18}$ Octane
- נונאן $\ce{C9H20}$ Nonane
- דקאן $\ce{C10H22}$ Decane
אלקנים יכולים להיות בעלי שרשרת ישרה או מסועפת, למרות שיש להם אותה נוסחה מולקולרית.
דוגמה:
- בוטאן (CH₃CH₂CH₂CH₃) - שרשרת ישרה
- איזובוטאן (CH₃CH(CH₃)₂) - שרשרת מסועפת
אלקילים ומתמירים
כאשר מסירים אטום מימן אחד מאלקן, מקבלים קבוצת אלקיל:
- מתאן (CH₄) ← מתיל (CH₃-)
- אתאן (C₂H₆) ← אתיל (C₂H₅-)
- פרופאן (C₃H₈) ← פרופיל (C₃H₇-)
אלקילים יכולים להיות חלק ממתמירים בתרכובות אורגניות שונות:
- אלכוהולים: R-OH
- אמינים: R-NH₂
- אלקיל הלידים: R-X (X = F, Cl, Br, I)
- אתרים: R-O-R’
פחמנים ראשוניים, שניוניים ושלישוניים
פחמנים מסווגים לפי מספר קבוצות הפחמן המחוברות אליהם:
פחמן ראשוני (Primary):
- מחובר לפחמן אחד בלבד
- שאר המתמירים אינם פחמנים (בדרך כלל מימנים)
פחמן שניוני (Secondary):
- מחובר לשני פחמנים
- שאר המתמירים אינם פחמנים
פחמן שלישוני (Tertiary):
- מחובר לשלושה פחמנים
- שאר המתמירים אינם פחמנים
אותה טרמינולוגיה משמשת גם עבור מימנים וחנקנים.
נומקלטורה של תרכובות אורגניות
כללי מתן שמות
המורה מסביר את הכללים למתן שמות לתרכובות אורגניות:
- מצא את השרשרת הארוכה ביותר של פחמנים וקבע את שם הבסיס (מתאן, אתאן, פרופאן וכו’)
- מספר את הפחמנים בכיוון שנותן את המספרים הנמוכים ביותר למתמירים
- אם יש כמה מתמירים באותו מרחק מהקצוות, בחר בכיוון שבו יש יותר מתמירים
- רשום את המתמירים בסדר אלפביתי, עם המספרים המציינים את מיקומם
דוגמאות מפורטות
$\text{2,2,4-trimethypantane}$
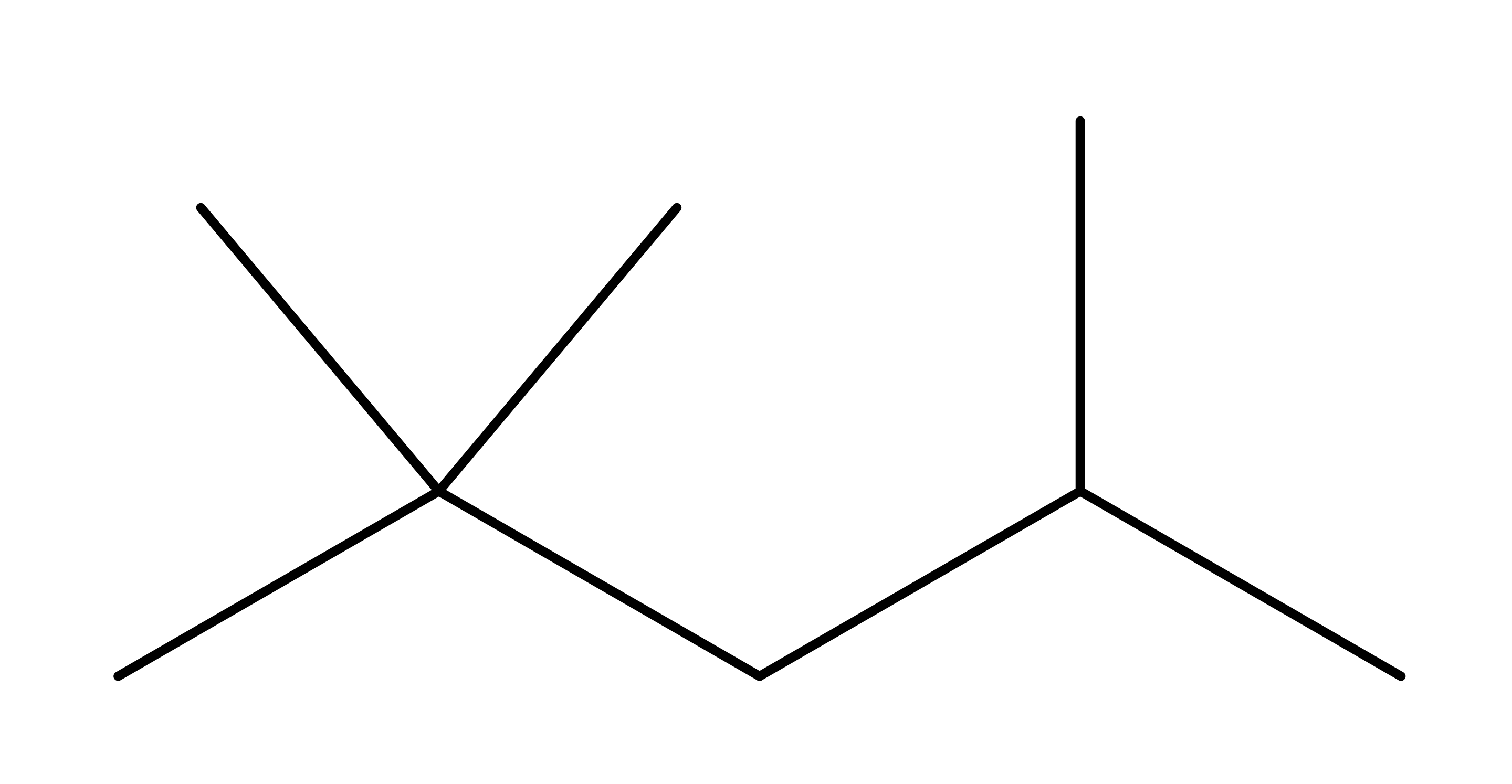
פתרון שלב אחר שלב:
- שרשרת הפחמנים הארוכה ביותר: 5 פחמנים (פנטאן)
- ספירה מהצד שנותן את המספרים הנמוכים ביותר למתמירים
- יש 3 מתמירי מתיל בעמדות 2, 2, 4
- לכן השם הוא: 2,2,4-טרימתילפנטאן
$\text{6-Ethyl-3,4-dimethyl-octane}$
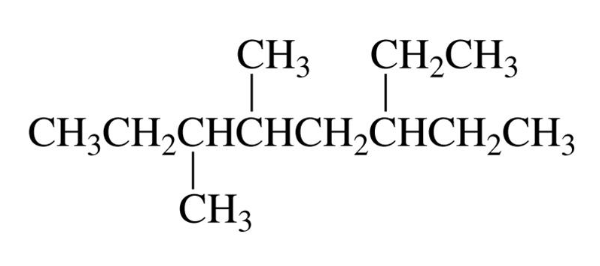
פתרון שלב אחר שלב:
- שרשרת הפחמנים הארוכה ביותר: 8 פחמנים (אוקטאן)
- ספירה מהצד השמאלי כי זה נותן מספרים נמוכים יותר למתמירים
- יש מתמירי מתיל בעמדות 3, 4, ו-6
- יש גם מתמיר אתיל בעמדה 6
- לכן השם הוא: 6-אתיל-3,4-דימתיל-אוקטאן (המתמירים מסודרים לפי סדר א׳-ב׳)
המורה מסיים את השיעור עם דגש על חשיבות הבנת הנומקלטורה ומציין שבהמשך הקורס הסטודנטים ילמדו איך להכין תרכובות אלו ואיך הן מגיבות.
“אנחנו גמרנו את ההקדמה של כימיה כללית בשביל ללמוד כימיה אורגנית, ועכשיו אנחנו בעצם נכנסים להקדמה של כימיה אורגנית בשביל ללמוד כימיה אורגנית.”
דור פסקל