כל התכנים בעמוד אחד
כל הסיכומים בקורס ביולוגיה של התא זמינים כאן להדפסה מרוכזת או ייצוא כ-PDF. התוכן מוצג בסדר כרונולוגי - מהסיכומים המוקדמים ביותר למאוחרים ביותר. אם חלק מהעמודים כוללים נוסחאות מתמטיות, ייתכן שייקח להן מספר שניות להיטען. למידה מהנה!
תוכן העניינים
- שיעור 1 - מושגי יסוד 16/03/2025
- שיעור 2 - עץ החיים והמבנה הבסיסי של התא 19/03/2025
- שיעור 3 - תאים חיים, אורגנלות, ATP, ציטוסקלטון ודינמיקה תאית 26/03/2025
- שיעור 4 - מיטוכונדריה והתיאוריה האנדוסימביוטית, תחילת כימיה 31/03/2025
- שיעור 5 - מטבוליזם, אנרגיה ומבוא לחלבונים (המשך מצגת 3) 02/04/2025
- שיעור 6 - מבנה ותפקוד של חלבונים 07/04/2025
- שיעור 7 - חלבונים מבנה ותפקוד 21/04/2025
- שיעור 8 - ממברנות וליפיד ביילר 23/04/2025
- שיעור 9 - טרנספורטרים ותעלות בממברנה 28/04/2025
- שיעור 10 - מבנה ותפקוד הגרעין 05/05/2025
- שיעור 11 - מבנה ותפקוד הגרעין (חלק 2) 07/05/2025
- שיעור 12 - הציטוסקלטון 12/05/2025
- שיעור 13 - הבשלה והכוונה של חלבונים 14/05/2025
- שיעור 14 - מעבר מגרעין ל-ER 19/05/2025
- שיעור 15 - מסלול ההפרשה והובלת וזיקולות בתאים 21/05/2025
- שיעור 16 - אקסוציטוזה ומסלולי הפרשה תאיים 28/05/2025
- שיעור 17 - אנדוציטוזה - מנגנונים תאיים להכנסת חומרים 04/06/2025
- שיעור 18 - שעתוק ועיבוד RNA - מהגנום לחלבון 09/06/2025
- שיעור 19 - עיבוד RNA ותרגום חלבונים 11/06/2025
- שיעור 20 - חלבונים לאחר תרגום 16/06/2025
- שיעור 21 - ויסות מולקולרי וחלוקת תאים 23/06/2025
- שיעור 22 - מוות תאי מבוקר 30/06/2025
שיעור 1 - מושגי יסוד
תאריך: 16/03/2025מבוא והיכרות עם הקורס
הקורס “ביולוגיה של התא” הוא הקורס הביולוגי הראשון והיחיד לסטודנטים לרפואה בשנה הראשונה. הקרוס מתחיל מרמה בסיסית מאוד של מושגי יסוד, בהתחשב בכך שיש הבדלים משמעותיים בין הסטודנטים - חלק למדו ביולוגיה בתיכון וחלק לא (כמוני).
מידע אדמיניסטרטיבי מפורט
הקורס מחולק בין שלושה מרצים:
- פרופ׳ אמנון הראל
- ד״ר שי בל
- פרופ׳ מיכאל בלנק
נוכחות בקורס נבדקת ברבע השעה הראשונה של כל שיעור. פרטי התקשורת של המרצים נמצאים בסילבוס ובאתר הפקולטה, כאשר שאלות כלליות עדיף להפנות דרך נציגי המחזור. השיעורים מוקלטים, ובמידת הצורך יתקיימו תגבורים.
מבחינת הערכה, בוחן אמצע יתקיים מיד אחרי פסח, ביום הראשון שחוזרים ללימודים, ויכסה את החומר של שלושת השבועות הראשונים בלבד. הבוחן הוא ציון מגן שאינו יכול לפגוע בציון הסופי, ומטרתו לעזור לסטודנטים להתרגל לסגנון המבחנים הרב-ברירתיים שילוו אותם עד השלב הקליני.
ספר הקורס
ספר הקורס משמש גם לקורס ביולוגיה מולקולרית. בספרייה קיימים עותקים של מהדורות 6 ו-7, אך קיימת גם גרסת PDF. העטיפה הירוקה מייצגת את הספרים בספרייה, ואילו העטיפה הסגולה היא גרסת ה-PDF הנפוצה.
חשוב לציין שהבחינה לא תכלול נושאים שמופיעים רק בספר ולא נדונו בהרצאות, אך עדיין מומלץ לעיין בספר לצד הלימוד בכיתה (בדיעבד - הופיעו בבחינה תרשימים מתוך הספר - מומלץ לעיין בו).
מבנה השיעורים והסילבוס
מצגות הקורס מסודרות לפי הרצאות, אם כי הן לא בהכרח תואמות בדיוק לשיעורים. מומלץ לעבור על הסיכום לפני ההגעה לשיעור הבא.
למרות שזהו קורס בביולוגיה של התא, במידה רבה הוא מהווה קורס מבוא לביולוגיה בכללותה. יש חמישה קורסים נוספים בשנה הבאה שהם המשך ישיר של הקורס הזה. בשנים קודמות הקורס בכימיה אורגנית התקיים קודם ונתן בסיס מסוים, אך כעת אין את היתרון הזה, ולכן הקורס מתחיל ממושגי יסוד בסיסיים.
מושגי יסוד בביולוגיה התאית
ציטוט פותח וחשיבות התא
“המפתח לכל בעיה ביולוגית בסופו של דבר צריך לחפש אותו ברמת התא הבודד.”
- א.בי. ווילסון
התמונה ההיסטורית הזו מציגה חלוקת תאים משנת 1900, שבה ניתן לראות כרומוזומים, את גרעין התא וסטרוקטורות תאיות נוספות.
יסודות הכימיה של DNA ו-RNA
מבנה מפורט של נוקלאוטיד
מבנה הנוקלאוטיד נראה בתחילה כמו קוביות לגו - זאת הצגה פשטנית שמקלה על ההבנה הבסיסית. בפרק 2 בספר ניתן למצוא הסבר מפורט יותר (ה״פנלים״).

נוקלאוטיד מורכב משלושה מרכיבים עיקריים:
- פוספט:
- מכיל מטענים שליליים ויכול להכיל אחד, שניים או שלושה פוספטים.
- סוכר:
- מורכב מחמישה פחמנים, כאשר הפחמן החמישי מחובר לפוספט. הסוכר יוצר מבנה מעגלי עם חמצן שסוגר בין הפחמנים.
- בסיס חנקני:
- כולל טבעות עם קשרים כפולים ומולקולות חנקן. חשיבותו העליונה היא בקשרים הכימיים שהוא מסוגל ליצור, המהווים את הבסיס לכל הביולוגיה.
מעניין לציין שלפני חודשיים התפרסמה ידיעה חדשותית על גששית שחזרה מהחלל ב-2020 עם דגימה מאסטרואיד. הממצא המדהים היה שהדגימה הכילה מולקולות המהוות בסיס ליצירת המולקולות האורגניות שכל החיים על פני כדור הארץ משתמשים באותו מנגנון.
בסיסים חנקניים
חמישה בסיסים חנקניים מהווים את אבני הבניין של ה- DNA וה-RNA. ב-DNA נמצא את התימין (T), ואילו ב-RNA נמצא את האורציל (U) שמחליף את התימין.

חמשת הבסיסים החנקניים הם:
- אדנין (A) - פורין
N—C—N ‖ ‖ C C—N | | N═C—N - גואנין (G) - פורין
O ‖ C—N ‖ \ N—C N | ‖ C═N—C | NH₂ - ציטוזין (C) - פירימידין
NH₂ | N═C | \ O═C N | H - תימין (T) - פירימידין (ב-DNA)
CH₃ | C═C | \ O═C N \ | N—H | O - אורציל (U) - פירימידין (ב-RNA)
H | C═C | \ O═C N \ | N—H | O
צוין כי אין צורך לזכור את כל השמות והמבנים המדויקים בעל פה, ושבמבחנים תמיד תינתן טבלה עם המידע הרלוונטי. העיקר הוא להבין את העקרונות הבסיסיים. בדיעבד - מוצע לשנן ככל הניתן.
נומנקלטורה של נוקלאוטידים
להלן טבלת נומנקלטורה שמסכמת את המונחים השונים:
| בסיס | נוקלאוזיד | נוקלאוטיד (עם פוספט) |
|---|---|---|
| אדנין (A) | אדנוזין | אדנוזין מונופוספט (AMP) |
| גואנין (G) | גואנוזין | גואנוזין מונופוספט (GMP) |
| ציטוזין (C) | ציטידין | ציטידין מונופוספט (CMP) |
| תימין (T) | תימידין | תימידין מונופוספט (TMP) |
| אורציל (U) | אורידין | אורידין מונופוספט (UMP) |
חשוב להבין את ההבחנה הבסיסית:
- נוקלאוזיד: בסיס חנקני המחובר לסוכר בלבד
- נוקלאוטיד: בסיס חנקני, סוכר ופוספט יחד
מניסיון, אפילו חוקרים ביולוגיים בכירים לא תמיד זוכרים את ההבדל המדויק בין גואנין לגואנוזין, אך את העיקרון הם מבינים היטב.
הבדלים בין DNA ל-RNA
קיימים שני הבדלים עיקריים בין DNA ל-RNA:
- בסוכר:
- ב-RNA הסוכר הוא ריבוז
- ב-DNA הסוכר הוא דיאוקסיריבוז (חסר חמצן בעמדה 2’)
- מכאן נגזרים השמות: DNA - דיאוקסיריבונוקלאיק אסיד, RNA - ריבונוקלאיק אסיד
- בבסיסים החנקניים:
- ב-DNA: A, G, C, T
- ב-RNA: A, G, C, U (אורציל במקום תימין)
פולימריזציה של נוקלאוטידים
יצירת שרשראות פולינוקלאוטידים
עיקרון מאוד בסיסי בביולוגיה הוא היכולת לחבר נוקלאוטידים זה לזה בשרשרת. התפתחות המנגנון הזה הייתה קריטית להיווצרות החיים על פני כדור הארץ.
בתהליך חיבור הנוקלאוטידים מתרחשת התקפה נוקלאופילית, שבה נוצר קשר פוספודיאסטרי בין עמדה 3’ של נוקלאוטיד אחד לעמדה 5’ של הנוקלאוטיד הבא. קשרים אלו הם שבונים את השרשרת הנוקלאוטידית.
התגובה הכימית נראית כך:
5' 5'
| |
-O-P=O -O-P=O
| |
O O
| |
CH₂ CH₂
| |
O בסיס₁ O בסיס₁
/ \ / \
| | | |
| | | |
O O + O O
| |
CH₂ CH₂
| |
O בסיס₂ O בסיס₂
/ \ / \
| | → | |
| | | |
O O O O
| |
H P=O
|
O
|
CH₂
|
O בסיס₃
/ \
| |
| |
O O
|
H
|
3'
כיווניות השרשרת
עיקרון יסודי בביולוגיה הוא שהחיבור של נוקלאוטידים תמיד מתבצע בכיוון 5’ אל 3’. כתוצאה מכך, השרשרת מתאפיינת בקצה 5’ חופשי בצד אחד וקצה 3’ חופשי בצד השני.
אורך השרשראות בגוף האדם הוא עצום. מולקולת DNA יכולה להגיע לאורך של מיליונים, עשרות מיליונים ואף מאות מיליונים של נוקלאוטידים. האורך מוגבל רק על ידי אורך הכרומוזום, שכן כל כרומוזום מכיל מולקולה אחת של DNA. מולקולות RNA בדרך כלל קצרות יותר - אלפים, עשרות אלפים, ובמקרים מסוימים גם מאות אלפים של נוקלאוטידים.
מבנה ה-DNA הדו-גדילי
הסליל הכפול (Double Helix)
מבנה ה-DNA מתאפיין בשני גדילים המגיבים ביניהם ונשמרים במרחק קבוע אחד מהשני באמצעות קשרי מימן. החיבור בין הבסיס החנקני לסוכר מתבצע תמיד על פחמן מספר אחד של הסוכר.
סוד היכולת להעברת מידע גנטי טמון בכך שגדיל אחד של DNA מכתיב את הרצף בגדיל השני. האפשרות להעביר את המידע הזה מבוססת על העובדה שגדיל אחד משלים את הגדיל השני.
מבחינה מספרית, תמיד מספר הנוקלאוטידים עם A בכל גדיל יהיה שווה למספר הנוקלאוטידים עם T, ומספר ה-G יהיה שווה למספר ה-C. זאת בשל זיווג הבסיסים הקבוע: G תמיד מזווג עם C ו-A עם T.
במונחים מתמטיים:
- $A = T$
- $G = C$
- $A + G = T + C$
- $\frac{A + T}{G + C}$ = יחס ייחודי לכל מין
שכפול ה-DNA (רפליקציה)
כל התאים החיים, מהפשוטים ביותר ועד לתאי גוף האדם, משכפלים את המידע הגנטי שלהם בתהליך המכונה “templated polymerization” - פולימריזציה לפי תבנית קיימת.
כאשר שני גדילי ה-DNA נפרדים, כל גדיל יכול לשמש כתבנית לבניית גדיל חדש ומשלים.
תהליך זה מכונה רפליקציה סמי-קונסרבטיבית (חצי-שמרנית), שכן הוא שומר על גדיל אחד בדיוק כפי שהוא ומשלים את החסר עם גדיל חדש.
בתנאי מעבדה, ניתן להפריד את שני גדילי ה-DNA על ידי חימום לטמפרטורה קרובה להרתחה, מבלי לפגוע בקשרים הקובלנטיים. אם מאפשרים לתמיסה להתקרר, הגדילים ימצאו בחזרה זה את זה וייצרו שוב את הסליל הכפול.
DNA מקורי:
5'-ATGCTAGCTAGCT-3'
3'-TACGATCGATCGA-5'
לאחר הפרדה:
5'-ATGCTAGCTAGCT-3'
+
3'-TACGATCGATCGA-5'
לאחר רפליקציה:
5'-ATGCTAGCTAGCT-3' (גדיל מקורי)
3'-TACGATCGATCGA-5' (גדיל חדש שסונתז)
5'-ATGCTAGCTAGCT-3' (גדיל חדש שסונתז)
3'-TACGATCGATCGA-5' (גדיל מקורי)
מזלג רפליקציה
בתהליך הרפליקציה בתאים חיים נוצר מה שמכונה “מזלג רפליקציה”. תהליך זה מתחיל כאשר אנזים מסוג הליקאז פותח את הסליל הכפול של ה-DNA.
באחד הגדילים, האנזים DNA פולימראז יכול לפעול ברציפות, ואילו בגדיל השני הוא פועל בקטעים קצרים המכונים קטעי אוקזקי, כיוון שגדיל זה נחשף רק כאשר מזלג הרפליקציה נפתח בהדרגה.
תהליך זה מתרחש באופן קבוע בכל תאי הגוף שמתחלקים. לפני חלוקת תא, חייבת להתבצע הכפלה של המידע הגנטי כדי לוודא ששני תאי הבת יקבלו בדיוק את אותו מידע.
5' --------------------------> 3'
| | | | | | | | |
A--T G--C C--G T--A G--C
| | | | | | | | |
3' <-------------------------- 5'
↓
↓ (הליקאז פותח את הסליל הכפול)
↓
5' -----------------> 3'
| | | | | |
A--T G--C C--G
| | |
| | |
3' <----------------- 5'
↓
↓ (DNA פולימראז מוסיף נוקלאוטידים)
↓
5' -----------------> 3'
| | | | | |
A--T G--C C--G
| | | | | |
T A C G G C
| | | | | |
3' <----------------- 5'
הדוגמה המרכזית של הביולוגיה
הדוגמה המרכזית של הביולוגיה היא מושג יסודי המתאר את זרימת המידע הגנטי בתאים חיים. זהו עיקרון מכונן בביולוגיה המולקולרית - הכל מתחיל ונגמר בזרימת המידע מ-DNA ל-RNA לחלבונים.
שלושת השלבים של הדוגמה המרכזית
- DNA → DNA (רפליקציה):
- שכפול ה-DNA, שבו מתרחשת הפרדת הגדילים ובנייה של גדילים חדשים ומשלימים.
- DNA → RNA (טרנסקריפציה):
- תהליך השיעתוק (או תיעתוק), שבו אנזים קורא את ה-DNA הדו-גדילי ויודע באיזה גדיל להשתמש כתבנית.
- RNA → Protein (טרנסלציה):
- תהליך התרגום, שבו המידע מה-RNA עובר לחלבון. חלבון הוא גם כן פולימר - שרשרת ארוכה עם כיווניות.
שכפול (רפליקציה)
↗ ↘
DNA -------→ DNA
|
| שעתוק (טרנסקריפציה)
↓
RNA
|
| תרגום (טרנסלציה)
↓
חלבון
יוצאים מן הכלל לדוגמה המרכזית
ישנם יוצאים מן הכלל לדוגמה המרכזית. דוגמה בולטת היא וירוס ה-HIV-1, שיש לו מעטפות שונות ובתוכן קפסיד (כספת פנימית). בתוך הקפסיד, הגנום של הווירוס הוא בצורה של RNA. בנוסף, יש בתוכו עותקים של אנזים מיוחד המקודד על ידי הווירוס, הנקרא “reverse transcriptase” (רברס טרנסקריפטאז). אנזים זה פועל בכיוון ההפוך לדוגמה המרכזית - הוא יוצר DNA מ-RNA.
השאלה האם וירוס הוא יצור חי היא שאלה מורכבת שנדונה בקורסים מתקדמים יותר כמו מיקרוביולוגיה. וירוסים מנצלים את המערכות התאיות של התא המארח אליו הם פולשים.
זרימה רגילה: DNA → RNA → חלבון
יוצא מן הכלל (HIV): RNA → DNA → RNA → חלבון
↑
רברס טרנסקריפטאז
היסטוריה של גילוי התא
התא התגלה לראשונה על ידי רוברט הוק באנגליה, במאה ה-17. ניתן למצוא את ספרו המקורי בפורמט PDF באינטרנט, כתוב באנגלית עתיקה.
המיקרוסקופ ששימש את הוק היה פשוט יחסית - עם מנורה ומכל מים להגדלה, שהשיג הגדלה מקסימלית של פי חמישים. הוק היה הראשון שזיהה תאים וקרא להם בשם זה.
הוק קיבל מינוי ממלך אנגליה, וספרו הפך לרב מכר. האצולה האנגלית התעניינה מאוד בתצפיותיו ובאה לצפות במיקרוסקופ שלו בדגימות שונות, כולל קרציות ותאים שהוא הצליח להגדיל.
שיעור 2 - עץ החיים והמבנה הבסיסי של התא
תאריך: 19/03/2025מבוא: יסודות ביולוגיה של התא
בקורס זה אנו עוסקים בהגדרות יסוד ובהכנסת הסטודנטים לעניינים הבסיסיים של התא. החומר של שלושת השבועות הראשונים הוא החומר לבוחן האמצע שיהיה אחרי פסח. באוניברסיטה מצפים מהסטודנטים לעבור על החומר אחרי ההרצאות, לעבור על סיכומים, להסתכל, לבדוק ולוודא הבנה. המרצה ממליץ לצפות בסרטון על DNA שהועלה לאתר הקורס, כיוון שהוא חוזר על דברים שהוזכרו בכיתה ומופיעים במצגת.
תגלית התא והתיאוריה התאית
רוברט הוק באמצע המאה ה-17 גילה תאים במיקרוסקופ די פרימיטיבי. הוא הכין חתכים דקים מאוד מקליפה של עץ וראה מבנים שהזכירו לו את המגורים של נזירים (חדרונים קטנים). לכן הוא קרא לזה “סל” (Cell). מה שהוא גילה היה למעשה את היחידה הבסיסית ביותר של החיים.
“התא הוא היחידה הבסיסית ביותר של החיים”
לקח עוד כמעט 200 שנה עד שהגדירו את התיאוריה התאית כהגדרה כללית. החוקרים בחצי הראשון של המאה ה-19 הסתכלו בעיקר על בעלי חיים וצמחים גדולים שהם ראו סביבם, ופחות שמו לב למיקרוביולוגיה, אך הבינו שזה משהו כללי - רקמות מורכבות מסוגי תאים מסוימים, ויחד הן מרכיבות גוף או אורגניזם שלם.
מודל בסיסי של התא

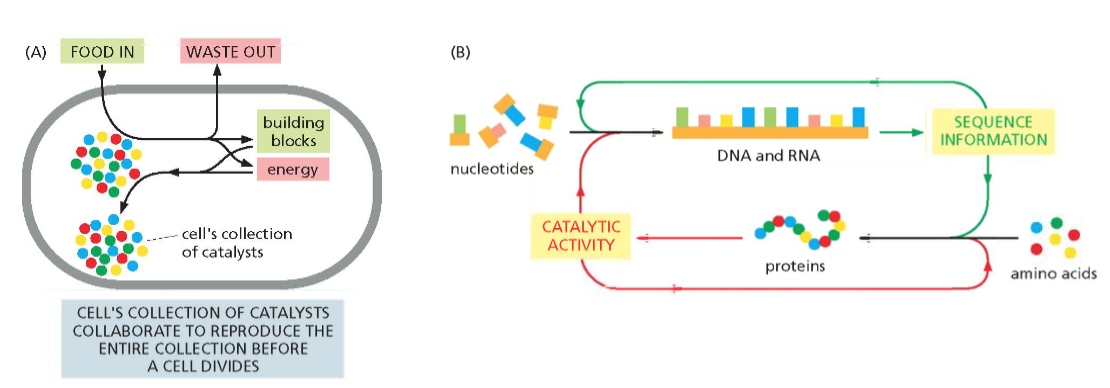
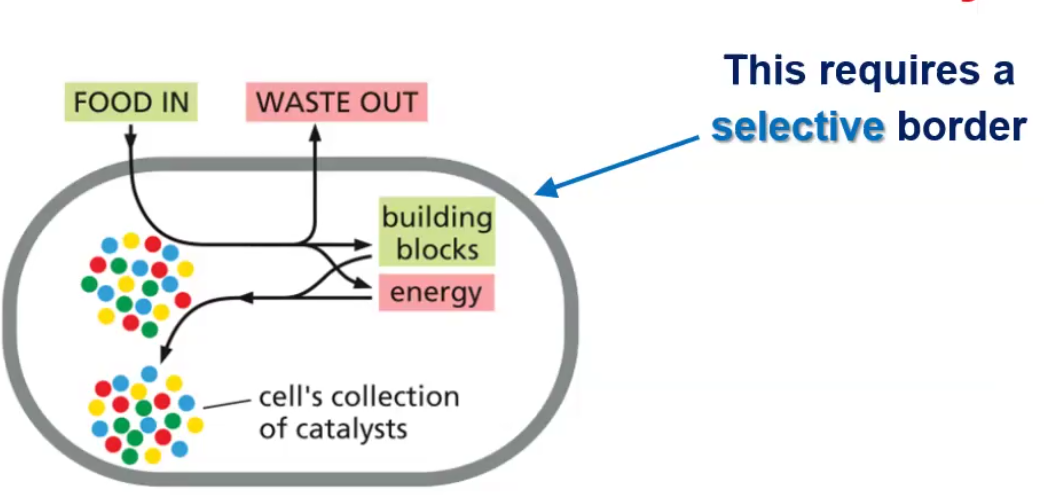
התא מוגדר כיחידת חיים שמחייבת:
- גבול חיצוני בררני - המאפשר כניסה של חומרי מזון והוצאה של חומרי פסולת
- אוסף של קטליזטים (אנזימים) - המבצעים את הריאקציות החיוניות לחיים בתנאי הסביבה התאית
- מנגנון לשימור המידע - כדי שכאשר התא יתחלק לשני תאי בת, לשניהם יהיה כל המידע הדרוש להמשיך הלאה
הקטליסטים (אנזימים) הם לרוב חלבונים המזרזים ומייעלים את התהליכים הביוכימיים של החיים. הגדרה של אנזים או קטליסט היא שהוא מבצע את הריאקציה והוא בעצמו לא משתנה בה. אנזימים מאפשרים ביצוע ריאקציות בטמפרטורת הגוף שללא נוכחותם היו דורשות טמפרטורות גבוהות במעבדה.
הדוגמה המרכזית של הביולוגיה
הדוגמה המרכזית של הביולוגיה מתארת את הזרימה של המידע הגנטי:
DNA → DNA (שכפול/רפליקציה)
DNA → RNA (תעתוק/טרנסקריפציה)
RNA → Protein (תרגום/טרנסלציה)
כל היצורים החיים על פני האדמה, מהווירוסים והחיידקים ועד ליצורים המורכבים ביותר כמו צמחים ובעלי חיים, משתמשים בדיוק באותו קוד ובדיוק באותו עיקרון כדי לשמר את המידע הזה מדור לדור.
לולאות פידבק במערכת הביולוגית
בתוך התא קיימות לולאות פידבק המבטיחות את המשך החיים:
- רצפים ב-DNA מאפשרים מחומר מוצא אחר (חומצות אמינו) לסנתז חלבונים
- DNA ל-DNA זה רפליקציה - משמר את המידע
- DNA ל-RNA - ה-RNA הוא המתווך (בעיקר mRNA)
- RNA משמש לסינתזה של חלבונים
- החלבונים ברובם הגדול הם אותם קטליסטים (אנזימים)
המרצה הזכיר שכדי לשכפל DNA יש לפתוח את מבנה הסליל הכפול, וזה קיים בכל היצורים - בחיידקים, בארכיאה ובאאוקריוטים.
המשורר יהודה עמיחי, שהיה מורה לספרות ולחינוך גופני בגימנסיה רחביה, כתב:
“כשאדם מת אומרים עליו נאסף אל אבותיו. כל זמן שהוא חי, אבותיו נאספים בו, כל תא ותא בגופו ובנפשו הוא נציג של אחת מרבבות אבותיו מתחילת כל הדורות.”
למרות שלא היה ביולוג, עמיחי הבין את העיקרון של המשכיות המידע הגנטי מדור לדור.
עץ החיים והמגוון הביולוגי
העץ בגרסה לא מועדפת:

שלוש הקבוצות הגדולות של החיים

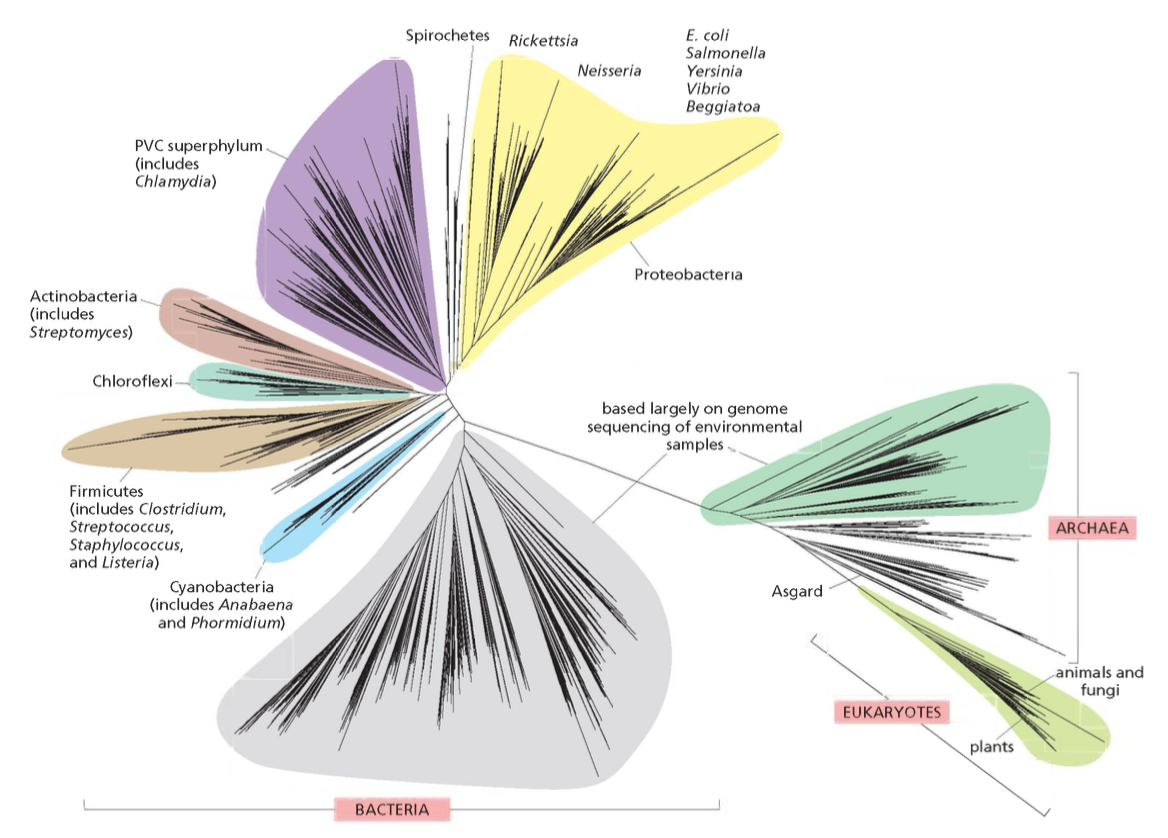
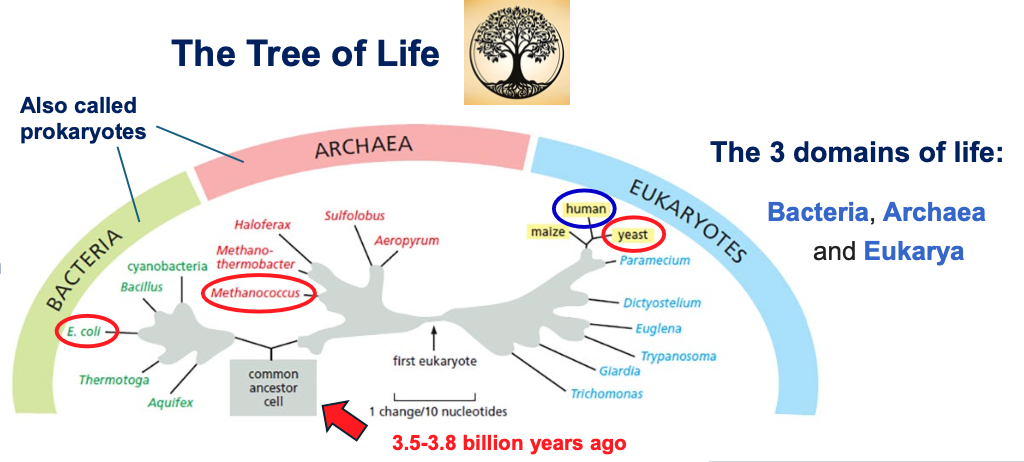
עץ החיים מסווג את כל היצורים החיים לשלוש קבוצות גדולות:
- בקטריה (חיידקים)
- ארכיאה (Archaea) - פעם קראו להם ארכיאובקטריה
- אאוקריוטה (Eukarya) - יצורים בעלי גרעין אמיתי
השערה מקובלת היא שלפני בין 3.5 ל-3.8 מיליארד שנה היה אב קדמון משותף לכל החיים שנקרא LUCA (Last Universal Common Ancestor).
המרצה ציין שיש גרסאות שונות לעץ החיים, וחלק מהענפים מבוססים על קריאת רצפים בלבד. זאת אומרת שחלק גדול מהמיקרואורגניזמים המופיעים בעץ לא ניתנים לגידול במעבדה, והמידע הקיים עליהם מגיע מריצוף DNA מהסביבה.
מתוך הקבוצה האאוקריוטית התפתחו היצורים הרב-תאיים כולל צמחים, פטריות ובעלי חיים. רוב היצורים האאוקריוטיים הם עדיין חד-תאיים, וחלק קטן יחסית התפתח להיות רב-תאי.
המרצה הדגיש כי רובם הגדול של האורגניזמים בסביבתנו (במספר, במינים השונים ובמסה) הם חד-תאיים. אנחנו נוטים לשכוח את החד-תאיים שגדלים אצלנו, אך המסה שלהם בעצם רצינית מאוד.
דוגמאות ליצורים חד-תאיים מכל קבוצה
- בקטריה: אשריכיה קולי (E. coli)
- גודל: כ-2-2.5 מיקרון (מיקרון = אלפית מילימטר)
- מסודרים כמוטות (בצילים)
- נחקרו במשך שנים רבות
- חוקרים צרפתים בשנות ה-60 טענו שכל מה שאנחנו צריכים לדעת לרפואה וביולוגיה ניתן ללמוד מאי-קולי
- ארכיאה: מתאנוקוקוס יאנשי (Methanococcus jannaschii)
- נשלף מקרקעית הים במפרץ מקסיקו בעומק של כ-2.5 קילומטר
- אוהב לחיות בטמפרטורה של 85 מעלות
- טרמופילי - אוהב חום
- מסוגל לנשום בסביבה חסרת חמצן (אנאירובי)
- הראשון מקבוצת הארכיאה שרוצף הגנום שלו
- הסקאלה במיקרוסקופ: חצי מיקרון
- התגלה גם אסגרד (Asgard) - קבוצת ארכיאה שהתגלתה ע”י מדענים סקנדינבים בעומק של 2.5 קילומטר
- אאוקריוטה: שמר האפייה (Saccharomyces cerevisiae)
- גדול יותר מהחיידקים והארכיאה (כ-10 מיקרון)
- משמש בתעשיית הבירה, היין והאפייה אלפי שנים
- חד-תא אאוקריוטי עם גרעין
- מסוגל להתרבות ברבייה מינית ואל-מינית
- בחתך רואים את הגרעין ומדורים פנימיים נוספים
דוגמאות נוספות לגודל תאים
- ביצית של צפרדע - כ-2 מילימטר (ניתן לראותה בעין בלתי מזוינת), עדיין תא אחד
- תאים עם תפקידים מיוחדים - תאי דם אדומים בוגרים בגוף האדם איבדו את הגרעין שלהם במהלך ההבשלה (יוצאים מהכלל) כדי לפנות מקום לנשיאת חמצן
השוואת רצפים וחשיבותה בביולוגיה מודרנית
השוואת רצפים היא חלק חשוב מאוד בביולוגיה המודרנית. היא חשובה גם לרופאי העתיד, שאולי לא יצטרכו להשוות רצפים בעצמם, אך יצטרכו לדעת לדבר עם ביואינפורמטיקאים או ביולוגים.
טכניקות מודרניות כוללות Next Generation Sequencing, ריצוף עמוק (Deep Sequencing), ו”שעון מוטציות” - ככל שעובר יותר זמן יש יותר שינויים ב-DNA, וזה העיקרון שלפיו משווים גנומים.
ההפתעה הגדולה שהתגלתה בשנות ה-80 הייתה שבעצם הארכיאה קרובים יותר לאאוקריוטים מאשר לבקטריה, וזה שינה את התפיסה על התפתחות החיים.
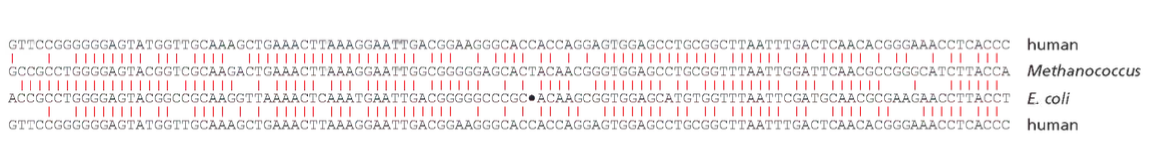
במהלך השוואת רצפים בין חיידקים, ארכיאה ואדם, ניתן לראות שלמרות מאות מיליוני שנים של אבולוציה יש אזורים מסוימים בגנום שבהם כמעט אין שינויים. אלה הם שרידים ברורים לאב הקדמון המשותף.
(סוף מצגת 1)
(תחילת מצגת 2)
נדבר על:
- Definitions: cell; organism, gene
- Cell boundaries
- Intracellular components (organelles, cytoskeleton)
- Cellular structure determines function
גנים וגנומים
הגדרת גן
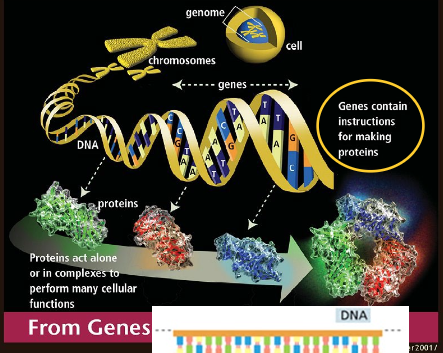
גן הוא מקטע או סגמנט של DNA שמקודד:
- בדרך כלל לחלבון אחד (אך לפעמים לכמה וריאנטים של אותו חלבון)
- או לסוג אחד של RNA קטליטי, רגולטורי או מבני
רוב הגנים מקודדים לחלבונים, אך יש גם גנים המקודדים לסוגים שונים של RNA שלא עוברים תרגום לחלבון, כגון:
- tRNA (transfer RNA)
- rRNA (ribosomal RNA)
- וסוגים אחרים של RNA פונקציונליים
גנום ומורכבותו
הגנום מכיל גנים ומכיל המון אינפורמציה שסובבת את הגנים ולפעמים אפילו מצויה בתוכם:
- הוראות הפעלה ליצירה של חלבונים
- הוראות הפעלה ליצירה של סוגים שונים של RNA
- רצפי בקרה רבים המסדירים את פעילות הגנים
בשנת 2000 הייתה מסיבת עיתונאים גדולה עם נשיא ארה”ב ופרנסיס קולינס, והודיעו על הטיוטה הראשונה של הגנום האנושי עם הבטחות גדולות לריפוי כל המחלות. 25 שנה אחרי, למדנו המון אך גם מבינים שיש המון שעדיין לא מבינים. אפילו עם כל המידע הגנטי, עדיין לא בטוחים בדיוק איך לקרוא את כולו.
דוגמה למיקופלזמה ג׳ניטליום (Mycoplasma genitalium)
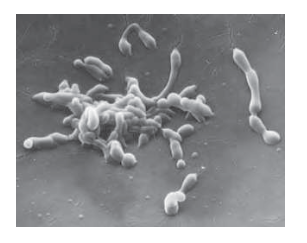
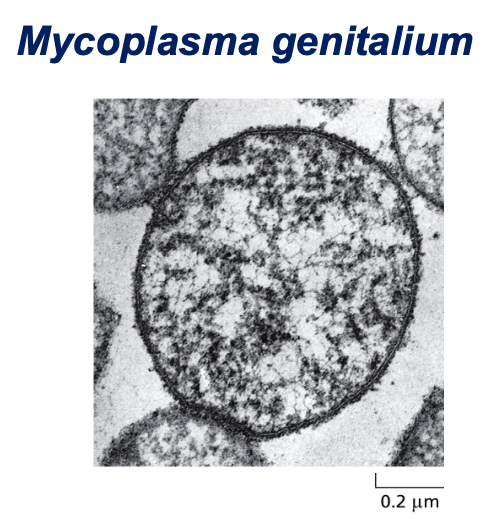
דוגמה ליצור שחי עם 500 גנים בלבד. אין לו דופן תא (בניגוד לאיקולי).
- פתוגן של אנשים שיכול לחיות כפרזיט ביונקים בעלי דם חם
- אין לו דופן תא בניגוד לחיידקים כמו אי-קולי
- כל הגנום שלו הוא 580,070 זוגות בסיסים (מולקולה אחת של DNA דו-גדילי עגולית)
- מכיל 525 גנים:
- 482 מקודדים לחלבונים
- 43 מקודדים ל-RNA (פחות מ-10%)
- לפי הספר, זה לא יותר ממה שהיה צריך כדי לשמר את כל הטקסט של פרק אחד בספר
גבול התא וממברנות
חשיבות הגבול התאי
גבול התא חייב להיות בררני ולאפשר הכנסה והוצאה מכוונת של חומרים. כל התאים מוקפים בממברנה חיצונית (קרום חיצוני) הנקראת פלזמה ממברנה.
בתאים אאוקריוטיים יש גם ממברנות פנימיות רבות, כולל ממברנת הגרעין. כל הפעילות של תאים אאוקריוטיים מבוססת על החלוקה למדורים, והפעילות מתחלקת בין מדורים שונים בתא.
במיקופלזמה, שמרים ותאי בעלי חיים - לכולם יש ממברנה. במקרה של השמר יש מסביבו גם דופן, וזה נכון גם באי-קולי ובצמחים.
המרצה הציג דוגמאות לתאים - כמו ביצים.
מבנה הממברנה
ממברנות תאים בנויות בעיקר מפוספוליפידים. לפוספוליפיד יש:
- ראש הידרופילי (אוהב מים)
- שני זנבות או שרשראות הידרופוביות (דוחה מים)
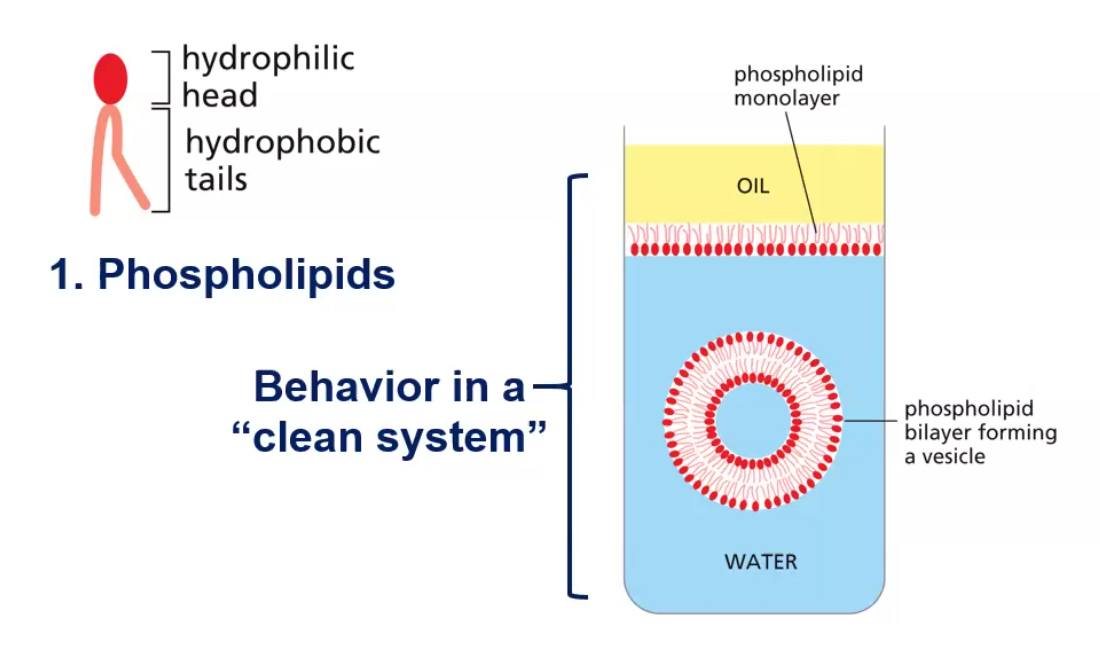
כאשר פוספוליפידים נמצאים בסביבה מימית, הם מתארגנים בשכבה כפולה (בילאייר) שבה:
- הראשים ההידרופיליים פונים לכיוון המים (בפנים ובחוץ)
- הזנבות ההידרופוביים פונים זה לזה באמצע
מבנה זה יוצר וזיקולות (שלפוחיות) שלוכדות בתוכן חלל מימי. לוזיקולות כאלה יש חשיבות רבה במדע המודרני וברפואה:
- חיסוני mRNA לקורונה כללו “ננו-חלקיקים” שהם וזיקולות מתוחכמות להובלת ה-RNA
- קשור גם לכל הסיפור של שומנים בגוף, כמו סטטינים, בדיקות קולסטרול, טריגליצרידים, LDL ו-HDL
תפקוד הממברנה
הממברנה היא “חצי-חדירה” (סמי-פרמאבילית):
- יש חומרים שיכולים לעבור דרכה ישירות
- חומרים רבים אחרים דורשים חלבוני הובלה מיוחדים
חלבונים בממברנה יכולים לשמש כ:
- טרנספורטרים - להעברת חומרים כמו גלוקוז, יונים, וחומצות אמינו
- קולטנים - לתקשורת בין תאים בגוף רב-תאי
תאים חיים משקיעים אנרגיה לעתים קרובות כדי:
- להעביר חומרים דרך הממברנה בניגוד למפל הריכוזים
- לאגור חומצות אמינו בניגוד למפל הריכוזים
- לסלק פסולת החוצה מהתא
סיכום וארגון הקורס
הקורס מתמקד ביסודות הביולוגיה התאית, מתחיל בהיסטוריה של תגלית התא ועובר למבנה ותפקוד בסיסי של תאים, כולל מושגי יסוד כמו DNA, RNA, חלבונים, המגוון הביולוגי ומבנה הממברנה.
בהמשך הקורס ידונו בנושאים כמו:
- מבנה הממברנה הביולוגית (בהרצאות של ד״ר שי)
- טרנספורט דרך ממברנות
- מנגנונים של טרנספורט
- מבנה התא האאוקריוטי ומדוריו
- עברונים תוך-תאיים (אורגנלות)
- השלד התוך-תאי (ציטוסקלטון)
- מושגי יסוד גנטיים
המרצה יפרסם תרגילי רשות לקראת בוחן האמצע כדי לסייע בהבנת החומר. התרגילים לא להגשה אלא לתרגול עצמי. בנוסף, יפורסמו דוגמאות לבוחן האמצע.
המרצה מעודד את הסטודנטים לשלוח אליו שאלות במייל, והוא יענה ואף יפרסם תשובות באתר. הוא מדגיש את חשיבות החזרה על החומר ומציין שאין צורך לשנן שמות חוקרים או מספרים, אלא להבין את העקרונות.
שיעור 3 - תאים חיים, אורגנלות, ATP, ציטוסקלטון ודינמיקה תאית
תאריך: 26/03/2025מאפיינים כלליים של היצורים החיים
זה נושא שכבר הזכרנו מוקדם יותר במצגת הקודמת. זה נושא מרכזי בפרק הראשון - המאפיינים הכלליים של כל היצורים החיים.
1. מבנה תאי וממברנות
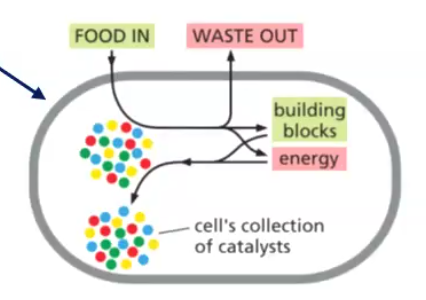
כל היצורים החיים, החל מחיידקים דרך ארכאה (שתי הקבוצות האלה הם מיקרואורגניזמים חד-תאיים שבהם התא האחד הוא גם כל האורגניזם), ועד ליצורים איוקריוטיים (אאוקריוטיים) - כולם מורכבים מתאים.
כל תא חי מוקף בממברנה (קרום בררני). הממברנה מאפשרת כניסה של חומרי מזון והוצאה של פסולת.
כשמדברים על יצור רב-תאי, יש סוגים שונים של תאים ורקמות שמתקשרות ביניהם.
כשמדברים על אאוקריוטים, מתחילים מאותן קבוצות של מיקרואורגניזמים חד-תאיים, אבל אחר כך מגיעים לצמחים ובעלי חיים שהם רב-תאיים.
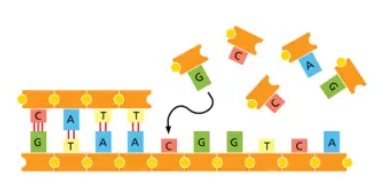
2. שכפול המידע הגנטי
 |
|---|
| דוגמה לזיווג בסיסים ($\text{A} \leftrightarrow \text{T}$, $\text{G} \leftrightarrow \text{C}$) |
כל התאים החיים משתמשים בעיקרון של שכפול המידע הגנטי שלהם והעברה שלו מתא לתא ומדור לדור.
דיברנו על עניין ה-DNA הדו-גדילי ועל הסינתזה של פולימר לפי תבנית קיימת (templated polymerization). עיקרון עבודה זה מבוסס על הפרדת שני גדילים ועל כל גדיל מסנתזים גדיל משלים. העיקרון הוא זיווג בסיסים - A תמיד מזווג עם T, ו-G עם C.
זהו תהליך מאוד מורכב ומבוקר, ויש מערכת שלמה של קטליזטורים (אנזימים) שתפקידה לבצע את הסינתזה לפי התבנית בצורה מדויקת.
3. אנרגיה בתאים

כל התאים החיים דורשים אנרגיה חופשית. בכל היצורים החיים, האנרגיה הזאת מגיעה בעצם מקשרים כימיים במולקולות מזון.
אבל יש גם כאלה שמייצרים - שמשתמשים באנרגיה של השמש, כמו צמחים, עצים ומיקרואורגניזמים שעושים פוטוסינתזה. יש גם “יצרנים ראשונים” שמכניסים את האנרגיה למערכת, וזה לא רק פוטוסינתטיים. יש גם נישות מסוימות שבהן אפשר לנצל אנרגיה תרמית או כימית.
ATP - מטבע האנרגיה
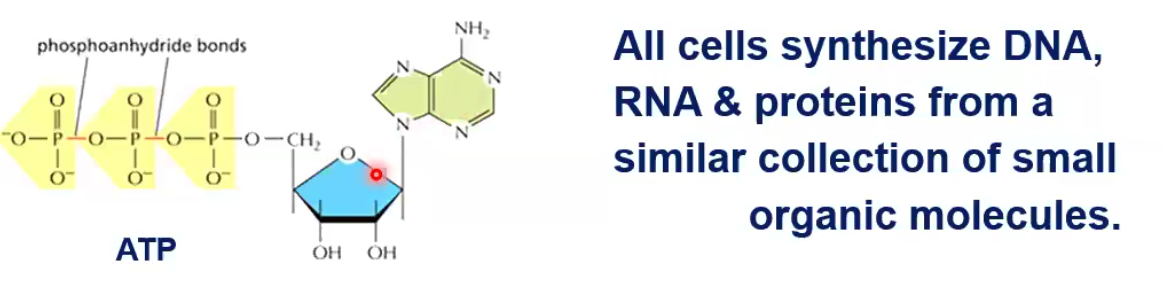
השחקן המרכזי בהעברת אנרגיה בתא הוא מולקולת ה-ATP. זהו נוקלאוטיד המורכב מ:
- בסיס חנקני (אדנין)
- סוכר ריבוז
- שלושה פוספטים מחוברים לפחמן בעמדה חמש
הקשרים בין הפוספטים (זרחנים) בעמדות 1-2 ו-2-3 הם קשרים עתירי אנרגיה (phosphoanhydride). כל העולם החי משתמש בעיקרון זה של העברת אנרגיה ממקום למקום, ממולקולה למולקולה, בתוך התא. ATP הוא “מטבע עובר לסוחר” במערכות ביולוגיות, אך הוא לא המטבע האנרגטי היחיד.
התא כמפעל
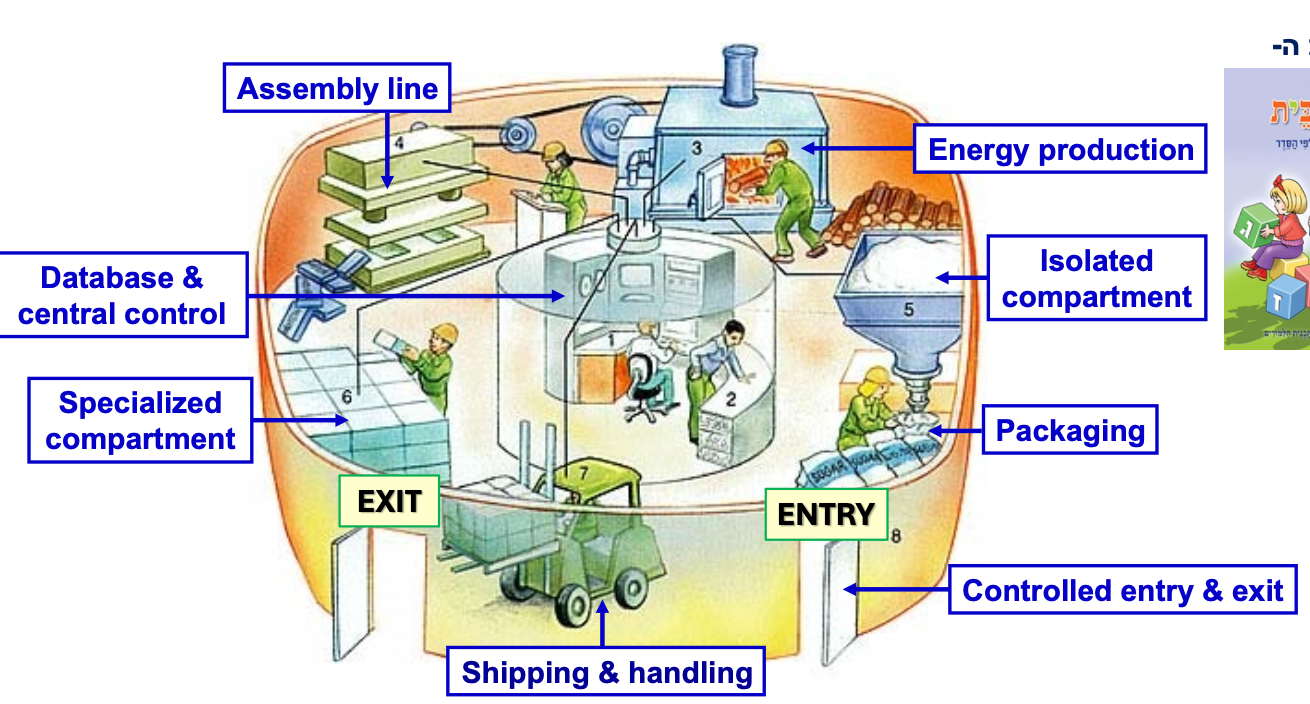
כל התאים החיים הם למעשה סוג של מפעל עם פעילות אנזימטית-ביולוגית. מעתה נתמקד יותר בתאים איוקריוטיים, ובפרט בתאים של בעלי חיים ובני אדם.
למה התא האיוקריוטי דומה למפעל?
- תאים איוקריוטיים מתאפיינים בחלוקה למדורים
- מדור אחד שכמעט תמיד קיים הוא הגרעין, שבתוכו הגנום
- יש “חדר בקרה” עם כל המידע (מעין מרכז נתונים/בסיס נתונים)
- יש מדור שאחראי על ייצור אנרגיה או קבלת אנרגיה מקשרים כימיים במולקולות מזון
- יש מדורים ספציפיים נוספים לפעולות שונות
- יש מערכות אריזה ושינוע
- כניסה ויציאה מהתא מבוקרים
מבנה התא האיוקריוטי
| מבנה התא האיוקריוטי - מקלוד |
תא איוקריוטי הוא תא בעל גרעין אמיתי - “כספת פנימית” שבתוכה שמור הגנום. אך זה לא בידוד מוחלט - חייב להיות מעבר מידע פנימה והחוצה.
מאפיינים עיקריים של תאים איוקריוטיים
-
גרעין תא - מוקף בשתי ממברנות. בתוכו יש מדור פנימי שלא מופרד בממברנה - הגרעינון (nucleolus).
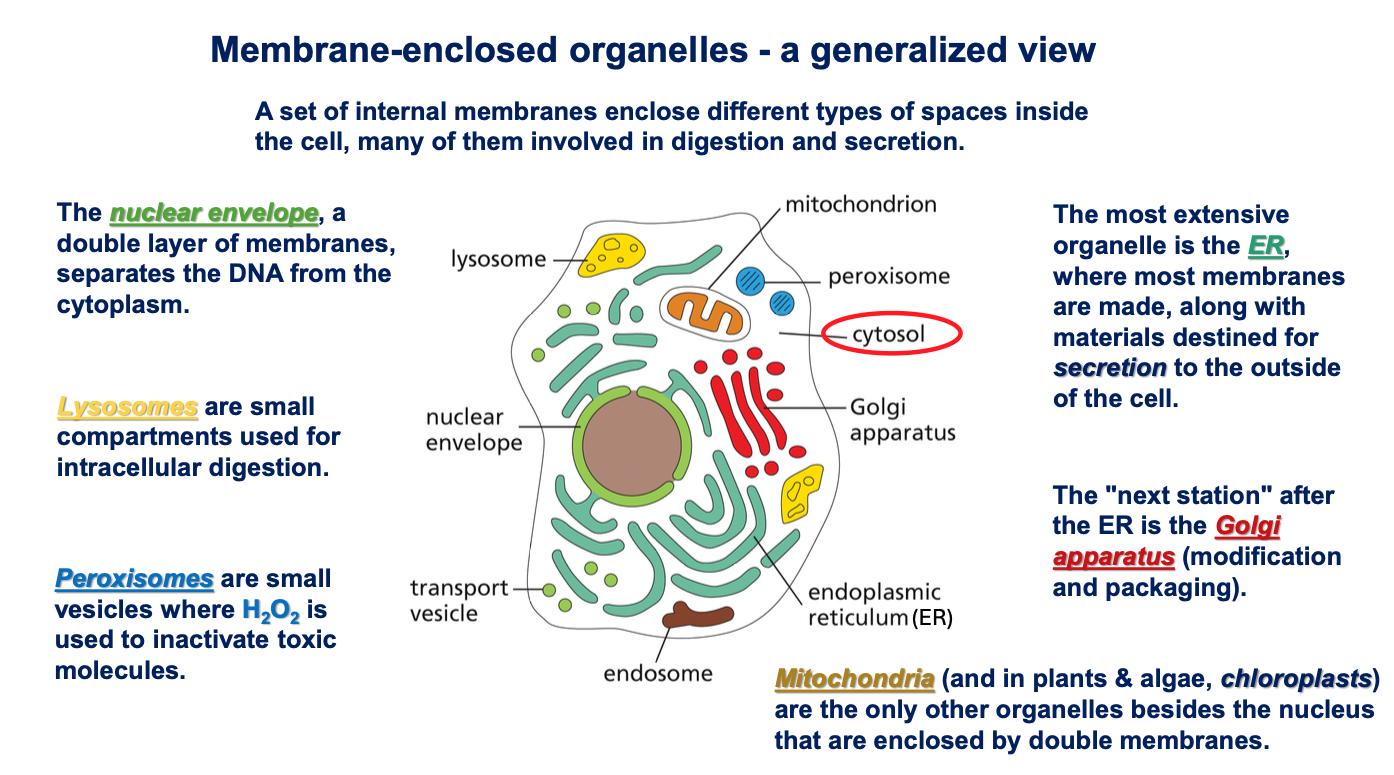
- אורגנלות - מדורים תוך-תאיים המוקפים בממברנה:
- מיטוכונדריה
- רשת אנדופלסמטית
- מערכת גולג׳י
- ליזוזומים
- ועוד
הערה: יש מדורים שאינם מופרדים בממברנה, כמו הגרעינון (nucleolus), שהוא מוגדר כאורגנלה למרות שאין לו ממברנה.
- ציטוסקלטון - רשת של סיבים חלבוניים שנותנים לתא את צורתו ותומכים בתנועה:
- מיקרוטובולים (microtubules) - הסיבים הירוקים והגדולים יותר
- אקטין (actin) - הסיבים האדומים והדקים ביותר
- סיבי ביניים (intermediate filaments) - הסיבים הכחולים
הסיבים האלה הם חלבונים עם נטייה להתפלמר (ליצור שרשרות ארוכות). הם דינמיים - מתארכים ומתקצרים. תא איוקריוטי לא יכול להתקיים בלי ציטוסקלטון ובלי הדינמיות הזאת של התארכות והתקצרות.
דינמיות בתא
הוצג סרטון על אמבה.
התא הוא לא רק מבנה סטטי אלא מערכת דינמית ביותר:
- האורגנלות נעות בתוך התא לאורך מסלולים שנבנים על ידי הציטוסקלטון
- תאים שזזים מראים דינמיות רבה
- הסביבה בתוך התא אינה רק מימית אלא צמיגה וצפופה
תמונות לא ברורות
הוצגו תמונות של מיטוכונדריה (מיטוכונדריון אחד, מיטוכונדריה רבים).
משהו על מבוך.
בצד הריבוזום - המכונה הביולוגית שמסנתזת חלבונים.
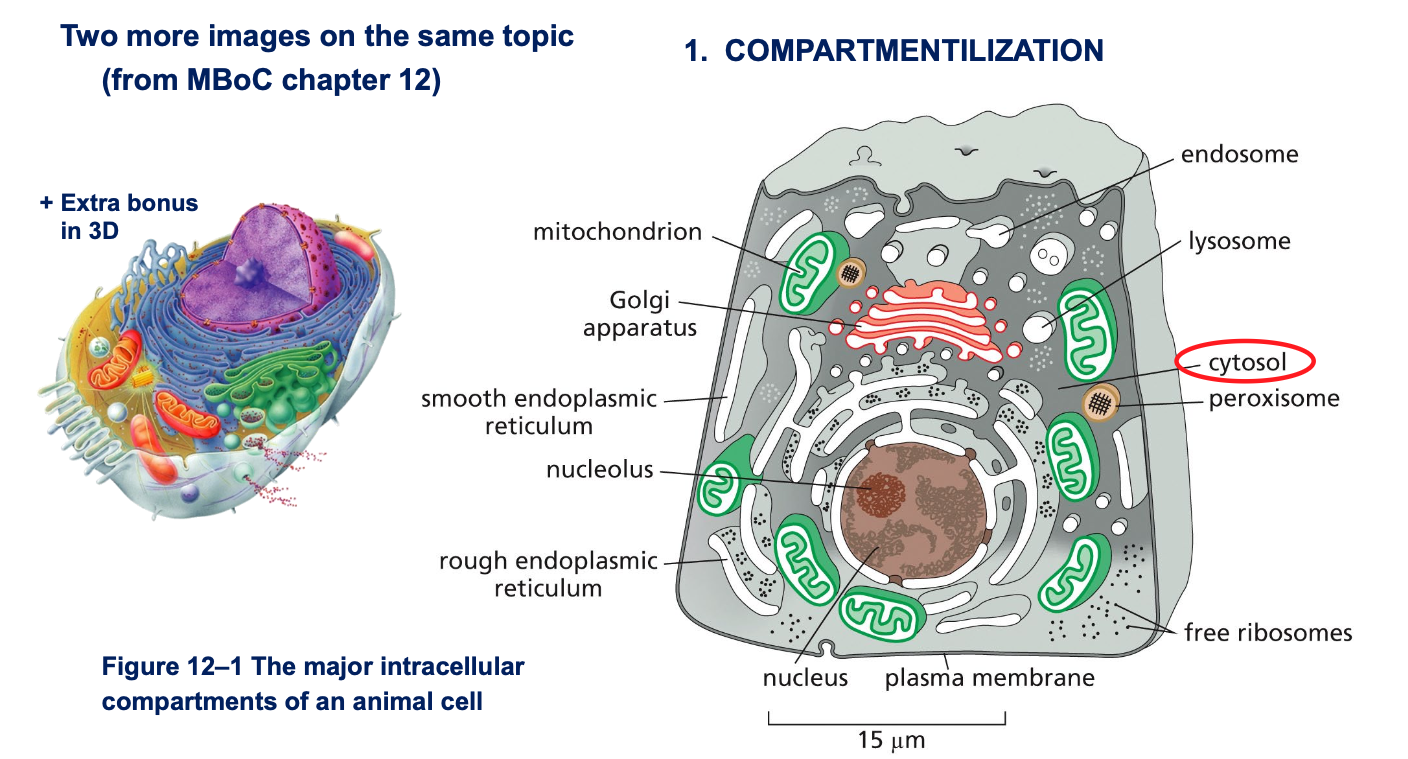
תשובות לשאלות - מה ההבדל בין ציטוסול לציטופלזמה?
ציטופלזמה וציטוסול
- ציטופלזמה - כל מה שנמצא בתוך התא ולא בגרעין
- ציטוסול - החלק הנוזלי של הציטופלזמה (החומר בין האורגנלות ומערכת השלד התוך-תאי)
- חשוב מאוד להבין: הציטוסול אינו “נוזל מימי דליל” אלא סביבה צמיגה וצפופה מאוד, “כמו דבש”
- הצפיפות הגבוהה הזו משפיעה על כל התהליכים המתרחשים בתא
מפה לא ברורה
זה מפגש ראשון שבו יש פירוט של המדורים העיקריים. המטרה היא בעיקר להציג.
…
ER
גולג׳י אפרטוס - אחראי על modification and packaging
תאים אפיתליאליים ופאגוציטוזה - דוגמאות לקשר בין מבנה ותפקוד
מהשיעור הקודם למדנו על מרכיבים בסיסיים של התא האיוקריוטי. כעת נסתכל על שתי דוגמאות ספציפיות המראות כיצד שינויים במרכיבים הבסיסיים האלה מאפשרים לתאים לבצע פעילויות ייחודיות. הדוגמאות הן:
- תאים אפיתליאליים עם ציטוסקלטון שעבר ארגון לצורה פולרית
- פאגוציטוזה - תהליך שבו תא “טורף” בולע תא “נטרף” (למשל חיידק)
דוגמה 1: תאים אפיתליאליים עם פולריות
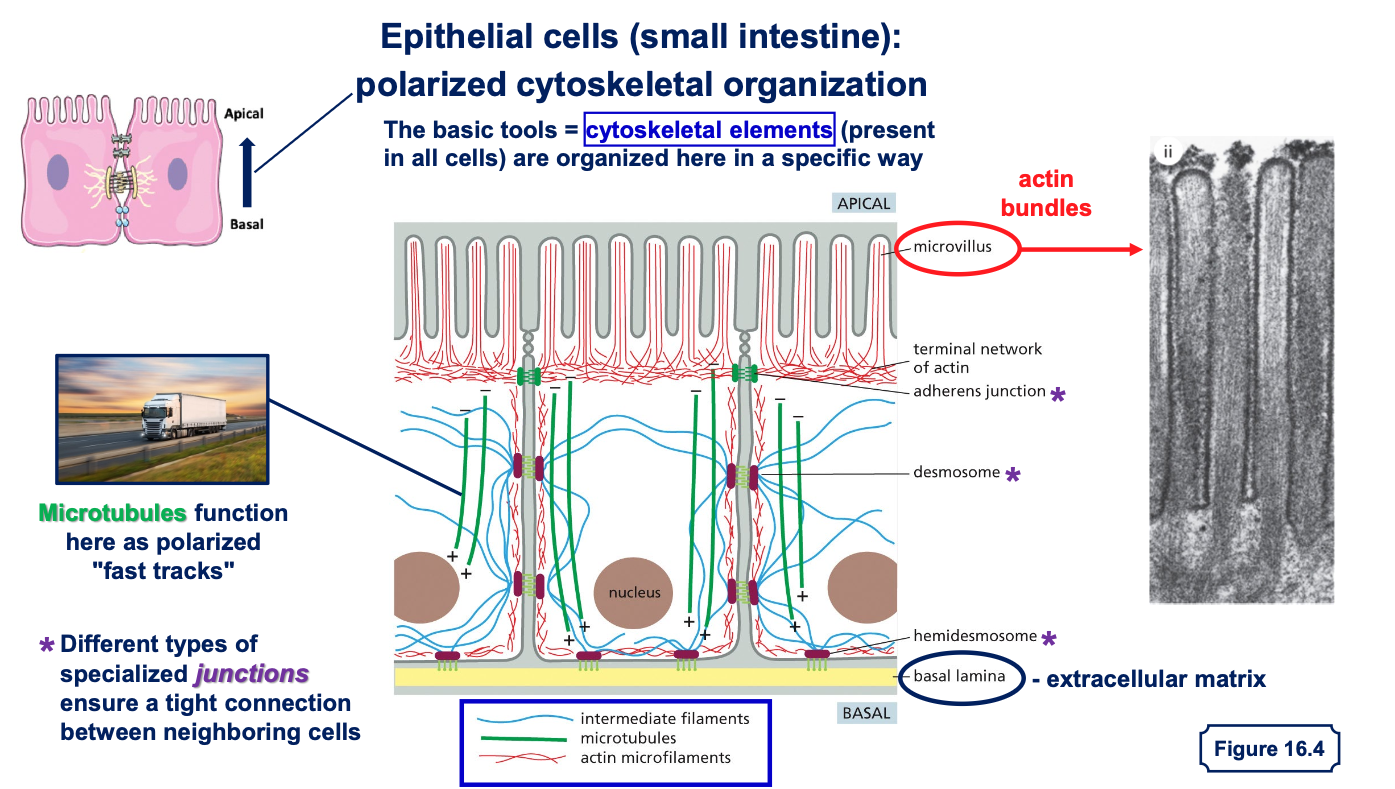
תאים אפיתליאליים מהווים שכבה חיצונית מגינה בגוף. הם נמצאים בעור (אפידרמיס), במעי, בריאות, ובמקומות רבים אחרים בגוף. מה שמאפיין תאים אלה הוא הפולריות שלהם - יש להם צד אפיקלי וצד בזאלי.
מבנה התאים האפיתליאליים
- צד אפיקלי - פונה לסביבה החיצונית או לחלל האיבר (כמו חלל המעי)
- מאופיין בפיתולים דמויי שערות שנקראים מיקרווילי (microvilli)
- הפיתולים מגדילים את שטח הפנים לספיגה
-
מכיל סיבי אקטין (הסיבים האדומים) מאורגנים באלומות שמאפשרות את יצירת המיקרווילי
- צד בזאלי - הצד הפונה לפנים הגוף
- מחובר למטריקס החוץ-תאי (חומר בין התאים)
- “בזאלי” = בסיסי, כמו קומת קרקע או מסד
- חיבורים בין התאים - התאים האפיתליאליים צמודים זה לזה בנקודות חיבור מיוחדות:
- יוצרים שכבת הגנה הרמטית שלא מאפשרת מעבר חופשי מהחלל החיצוני לתוך הגוף
-
מחוזקים על ידי סיבי הציטוסקלטון (במיוחד הסיבים הכחולים - סיבי הביניים) שעוברים מחיבור לחיבור
תפקיד הציטוסקלטון בתאים אפיתליאליים
-
אקטין (סיבים אדומים) - מאורגן באלומות בצד האפיקלי, מאפשר את יצירת המיקרווילי והגדלת שטח הפנים לספיגה
- מיקרוטובולים (סיבים ירוקים) - משמשים כ”אוטוסטרדה” להעברת חומרים מהצד האפיקלי לצד הבזאלי
- מאפשרים קליטה מבוקרת של חומרי מזון מהמעי והעברתם פנימה לשכבות הפנימיות של הגוף
- סיבי ביניים (סיבים כחולים) - מחברים בין נקודות הצמדה של התאים ומייצבים את המבנה
מטריקס חוץ-תאי
- בצד הבזאלי של התאים האפיתליאליים נמצא המטריקס החוץ-תאי
- זהו מבנה של סיבים חלבוניים חוץ-תאיים שמייצרים את ה”קומת מסד” שעליה בנוי האפיתל
- בתאים אחרים (כמו פיברובלסטים בעור) הסיבים החוץ-תאיים מפוזרים בסביבה, אך באפיתל הם מאורגנים רק בצד הבזאלי
דוגמה 2: פאגוציטוזה
פאגוציטוזה היא תהליך שבו תא “אוכל” גוף זר (מיוונית: “פאגו” = לאכול).
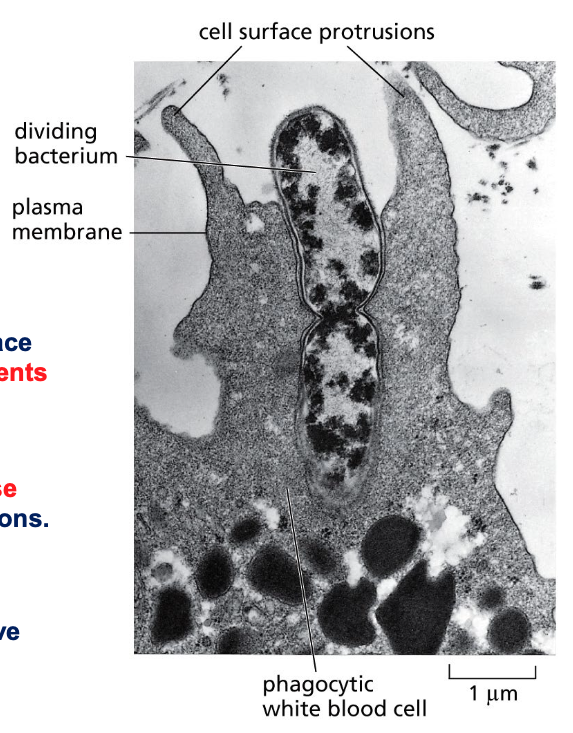
התמונה במצגת היא תצלום נדיר ממיקרוסקופ אלקטרונים, המראה שני אירועים שהתרחשו בו-זמנית:
- נויטרופיל (תא דם לבן מהמערכת החיסונית) בתהליך בליעה של חיידק
- החיידק נמצא בתהליך חלוקה לשני תאי בת
תהליך הפאגוציטוזה
-
זיהוי ורדיפה - הנויטרופיל מזהה את החיידק באמצעות רצפטורים על הממברנה החיצונית ומסוגל לרדוף אחריו (תוך שימוש בציטוסקלטון לתנועה)
- היצמדות - כאשר הנויטרופיל פוגש את הטרף:
- הוא נצמד אליו בצורה הדוקה
- הממברנה של התא הטורף יוצרת מגע ישיר עם הממברנה/דופן של החיידק
- בליעה - התא מקיף את החיידק באמצעות שלוחות של הממברנה החיצונית:
- פולימריזציה של אקטין דוחפת את הממברנה קדימה ויוצרת “רגליים מלאכותיות” (פסאודופודיות)
- התא מקיף את החיידק ויוצר מעין “מפרץ” סביבו
- עיכול - לאחר שהחיידק נבלע:
- הוא נכנס לתוך התא בתוך שלפוחית ממברנלית
- ליזוזומים (אורגנלות המכילות אנזימים מפרקים) מתמזגים עם השלפוחית
- החיידק מתעכל ומתפרק לחלוטין
הקשר בין מבנה לתפקוד בפאגוציטוזה
- ציטוסקלטון - מאפשר תנועה מכוונת ורדיפה אחרי הטרף
- רצפטורים על פני הממברנה - מזהים את החיידק הזר
- גמישות הממברנה - מאפשרת הקפה והצמדות לממברנה של הנטרף
- אורגנלות תוך-תאיות (ליזוזומים) - מבצעות את עיכול החיידק
סיכום ביניים - הקשר בין מבנה לתפקוד בתאים
הדוגמאות שראינו ממחישות עיקרון חשוב: אותם מרכיבים בסיסיים מתארגנים בצורה שונה בהתאם לפונקציה הייחודית של התא.
בתאים האפיתליאליים:
- הציטוסקלטון מאורגן בצורה פולרית (אפיקלי-בזאלי)
- האקטין יוצר מיקרווילי בצד האפיקלי להגדלת שטח הפנים
- המיקרוטובולים יוצרים “אוטוסטרדות” להעברת חומרים
- סיבי הביניים מייצבים את המבנה
בתאים פאגוציטיים:
- שימוש בציטוסקלטון לתנועה ורדיפה
- גמישות הממברנה להקפת הטרף
- תיאום בין שינויים בממברנה ותנועת הציטוסקלטון
- שימוש באורגנלות לעיכול הטרף
אנרגיה בתהליכים תאיים
(בתשובה לשאלה של עידן)
חשוב לציין שכל התהליכים הדינמיים האלה דורשים אנרגיה רבה:
- רוב האנרגיה בתאים חיים מושקעת בשני תהליכים עיקריים:
- תנועתיות והעברת חומרים ממקום למקום (כולל פולימריזציה של הציטוסקלטון)
- קליטה והוצאה של חומרים כנגד מפל הריכוזים (להתגבר על האנטרופיה)
- שימוש באנרגיה (ATP) מאפשר לשמור על הסדר הפנימי בתאים בניגוד לנטייה האנטרופית של מערכות ביולוגיות
מיטוכונדריה - “תחנת הכוח” של התא
היסטוריה וגילוי
- מיטוכונדריה (ביחיד: מיטוכונדריון) זוהו לראשונה כבר בשנת 1850, עוד לפני המצאת המיקרוסקופ האלקטרוני
- בשנת 1957 הוגדרו כ-“powerhouse of the cell” (תחנת הכוח של התא)
- במהלך השנים פענחו חוקרים את המבנה והתפקוד המדויק שלהן
תפוצה בעולם החי
- מיטוכונדריה נמצאות כמעט בכל התאים האיוקריוטיים ללא יוצא מן הכלל
- אפילו תאי זרע, שאיבדו את רוב האורגנלות שלהם, שמרו על המיטוכונדריה כי הם זקוקים לאנרגיה לצורך תנועה
- המיטוכונדריה הן האורגנלות האחראיות על ייצור אנרגיה בתא (כפי שהוצג בהסבר על “המפעל” התאי)
מבנה המיטוכונדריה
מערכת ממברנות ייחודית
- שתי ממברנות נפרדות:
- ממברנה חיצונית - עוטפת את כל האורגנלה
- ממברנה פנימית - יוצרת פיתולים רבים הנקראים “קריסטי” (Cristae בלטינית)
-
הפיתולים של הממברנה הפנימית מגדילים משמעותית את שטח הפנים, מה שמאפשר יותר פעילות מטבולית
-
בחתכים במיקרוסקופ אלקטרוני ניתן לראות בבירור את שתי הממברנות ואת הפיתולים של הממברנה הפנימית
- המרחב בין שתי הממברנות מופרד מהציטוזול (הנוזל התוך-תאי), מה שיוצר סביבה מבוקרת ומוגנת לתהליכים המטבוליים
תפקוד המיטוכונדריה
נשימה תאית
- המיטוכונדריה מקיימות נשימה אירובית - תהליך הפקת אנרגיה בסביבה עשירה בחמצן
- חשוב להבחין: כשמדברים על נשימה אירובית או אנאירובית, מדובר בתהליכים המתרחשים בתוך התאים
- השאלה המכרעת היא האם יש מספיק חמצן זמין במיקרו-סביבה התאית
הפקת אנרגיה
- המיטוכונדריה רותמות אנרגיה מקשרים כימיים במולקולות מזון
- האנרגיה הכימית הזו משמשת לייצור ATP (מטבע האנרגיה של התא)
- רוב הריאקציות הביוכימיות המעורבות בתהליך זה מתרחשות בממברנה הפנימית ובפיתולים שלה
- תהליכים אלה יילמדו לעומק בקורסי ביוכימיה
הדינמיות של מיטוכונדריה
תנועה ושינוי צורה
- בניגוד למה שנראה בתמונות סטטיות, מיטוכונדריה בתאים חיים הן אורגנלות דינמיות מאוד
- הן מסוגלות להתחלק ולהתמזג באופן קבוע
- בזכות טכניקות מיקרוסקופיה מתקדמות (כמו מיקרוסקופיה פלואורסנטית) ניתן לצפות בתהליכים אלה בתאים חיים
ניידות בתא
- מיטוכונדריה יכולות לנוע בתוך התא לאזורים שבהם יש צורך באנרגיה
- דוגמה טובה היא תאי עצב (נוירונים) - המיטוכונדריה נעות לאורך האקסון (הסיב העצבי) כדי לספק אנרגיה גם בקצוות המרוחקים של התא
- התנועה מתאפשרת לאורך “האוטוסטרדות” של התא - מערכת המיקרוטובולים (חלק מהציטוסקלטון)
- כך התא יכול לשנע את מקורות האנרגיה שלו למקומות בהם הם נדרשים ביותר
מקור המיטוכונדריה
תיאוריית האנדוסימביוזה
- אחת השאלות המרתקות היא: מאיפה הגיעו המיטוכונדריה?
- המיטוכונדריה נראות כמעט כמו חיידקים בתוך התא
- הן מכילות גנום משלהן ו-DNA משלהן
- למרות זאת, הן אינן עצמאיות ואינן מתפקדות באופן עצמאי מהתא המארח
המשך בשיעור הבא: תיאוריית האנדוסימביוזה.
שיעור 4 - מיטוכונדריה והתיאוריה האנדוסימביוטית, תחילת כימיה
תאריך: 31/03/2025מיטוכונדריה - המשך מהשיעור הקודם
מבנה המיטוכונדריה
- שתי ממברנות: ממברנה חיצונית חלקה וממברנה פנימית עם פיתולים רבים
- הפיתולים מגדילים את שטח הפנים של הממברנה הפנימית
- האתר של ייצור אנרגיה בתוך תאים
מקור האנרגיה
- ביצורים חד-תאיים (מיקרואורגניזמים), מקור האנרגיה הוא המיטוכונדריה
- גם בגוף שלנו, שהוא רב-תאי עם רקמות שונות, המיטוכונדריה היא מקור האנרגיה בתוך התא
דינמיות המיטוכונדריה
- כפי שראינו בסרטון “מיטוכונדריאל דיינמיקס”, המיטוכונדריה כל הזמן מתפצלות, מתחברות וזזות
- מתקבל רושם כאילו זה יצור חי קטן שחי בתוך התא הגדול יותר
התיאוריה האנדוסימביוטית
מהי התיאוריה?
- התיאוריה עוסקת בשאלה מאיפה הגיעו המיטוכונדריה
- זו תיאוריה מדעית מבוססת שהתפתחה במשך עשרות שנים
- “אנדוסימביוזה” או “סימביוג׳נסיס” = יצירה על ידי סימביוזה
מהי סימביוזה?
- יחסי גומלין בין יצורים שונים
- המערכת של אחד תורמת למערכת של השני ולהפך
- שני הצדדים מרוויחים (בניגוד לטפילות, שבה צד אחד מרוויח וצד אחד מפסיד)
המודל המוצע
- לפני כ-2 מיליארד שנה, בעולם שבו התקיימו רק פרוקריוטים (בקטריה וארכיאה)
- האטמוספרה הייתה ענייה מאוד בחמצן, אך החלה להתעשר בחמצן
- תא ארכיאה (ארכיאון) וחיידק (בקטריה) חיו יחד בסימביוזה ובסופו של דבר התמזגו לייצור אחד
- החיידק היה כנראה חיידק שידע להסתדר עם חמצן (יכול לבצע נשימה אירובית)
- ארכיאון לא יכל להשתמש בחמצן (אנאירובי), ולכן היחסים היו מועילים לשניהם
עדויות התומכות בתיאוריה
- דמיון בגודל - מיטוכונדריה דומות לחיידקים בגודלן
- דמיון באופן התרבות - מיטוכונדריה מתחלקות בצורה דומה לחיידקים
- קיום גנום עצמאי - למיטוכונדריה יש גנום משלהן
- מאפייני הגנום - הגנום המיטוכונדריאלי:
- קטן
- מעגלי
- דומה לכרומוזום של חיידק
- רצפי DNA דומים יותר לגנומים חיידקיים
- ריבוזומים ותרגום חלבונים - בתוך המיטוכונדריה מתרחש תרגום חלבונים בעזרת ריבוזומים ייחודיים
אסגארד ארכיאה - תגלית חדשה התומכת בתיאוריה
מהם אסגארד ארכיאה?
- תאים מקבוצת הארכיאה שהתגלו לאחרונה (לא הופיעו במהדורות קודמות של הספר)
- השם “אסגארד” מקורו במיתולוגיה הנורדית
- היה קשה מאוד לבודד ולגדל אותם בתרבית
הממצאים
- מדענים יפנים עבדו במשך 12 שנה לבידוד וגידול האורגניזם
- הדגימות נאספו מקרקעית האוקיינוס בעומק של 2.5 ק”מ
- בתנאים האופטימליים שנמצאו, התא מתחלק פעם ב-20 יום (לעומת חיידק רגיל שמתחלק כל 20 דקות)
- התא חי בסביבה כמעט נטולת חמצן
המבנה והקשר לתיאוריה האנדוסימביוטית
- לתא יש שלוחות דומות למה שמתואר במודל התיאורטי
- התא חי בסימביוזה עם שני סימביונטים חיצוניים (אקטוסימביונטים): חיידק וארכיאון
- אי אפשר לגדל את היצור ללא הסימביונטים שצמודים אליו
- הגנום שלו דומה יותר לאאוקריוטים מאשר לארכיאה פשוטים או חיידקים
- הממצא מציע שאסגארד ארכיאה יכולים להיות קרובים לאב הקדמון של האאוקריוטים
המכניזם האפשרי לאנדוסימביוזה
שלבים אפשריים
- ectosymbiont (סימביונט חיצוני) - החיידק חי צמוד לתא הארכיאה מבחוץ
- entangle (הסתבכות) - החיידק מסתבך בשלוחות של תא הארכיאה
- engulf (בליעה) - תא הארכיאה בולע את החיידק, יוצר מעין “מפרץ”
- endogenize (הפנמה) - החיידק נשאר בתוך מעטפת בתא המארח
- מיזוג - התמזגות לייצור אחד
הקשר לפאגוציטוזה
- התהליך מזכיר את הפאגוציטוזה שנצפתה בשיעור הקודם
- בפאגוציטוזה, תא ממערכת החיסון בולע חיידק פולש זר ואז מעכל אותו
- במקרה של אנדוסימביוזה, החיידק לא עבר עיכול אלא נשאר חי בתוך התא המארח
שאלות ואתגרים לתיאוריה
- התיאוריה עדיין משתנה ומתפתחת
- יש שאלות פתוחות לגבי המכניזם המדויק והזמן שבו התרחש האירוע
- במשך מיליארדי שנים חלו שינויים רבים, כולל העברת גנים מהמיטוכונדריה לגרעין
- תיאום בין הגנום המיטוכונדריאלי לגנום הגרעיני הוא אתגר מורכב
דוגמה לפאגוציטוזה בטבע: דידיניום
- דידיניום הוא יצור אאוקריוטי חד-תאי ענק (כ-100 מיקרון בגודלו)
- שוחה בשלוליות במהירות באמצעות סיליה (ריסים) שזזים כמו שוטונים
- יכולות מיוחדות של דידיניום:
- מסוגל לזהות סימנים כימיים בסביבה ולרדוף אחרי הטרף
- יכול לשחרר “חיצי הרדמה” שמשתקים את הטרף
- מבצע פאגוציטוזה - נצמד לטרף, יוצר מעין “מפרץ” (engulfment) עם הממברנה
- הטרף הנבלע מתחבר לליזוזומים/פרוקסיזומים ומעוכל לחלוטין
הקשר לתיאוריה האנדוסימביוטית
- התהליך מדגים כיצד תא אחד יכול לבלוע תא אחר
- בניגוד לפאגוציטוזה רגילה, באנדוסימביוזה התא הנבלע לא עוכל אלא נשאר חי בתוך התא המארח
- יצירת הקונטקסט להבנת כיצד אירוע אנדוסימביוטי יכול היה להתרחש
אירועי אנדוסימביוזה נוספים
- לא רק המיטוכונדריה נוצרו מאירוע אנדוסימביוטי
- כלורופלסטים - אורגנלות בתאי צמחים:
- נוצרו כנראה מחיידק שיכול לבצע פוטוסינתזה
- היתרון: ניצול אור השמש להפיכתו לאנרגיה כימית ויצירת מזון
- צמחים מודרניים מלאים בכלורופלסטים שהם כנראה תוצר של אירוע אנדוסימביוטי נוסף
- בטבע, יצרנים ראשוניים (אורגניזמים שמבצעים פוטוסינתזה) מהווים בסיס לשרשרת המזון
- תאים איוקריוטיים שמבצעים פוטוסינתזה נושאים עדות לשני אירועי אנדוסימביוזה:
- בליעת חיידק שהפך למיטוכונדריה
- בליעת חיידק פוטוסינתטי שהפך לכלורופלסט
התיאוריה האנדוסימביוטית ועץ החיים
- עץ החיים מראה את ההתפתחות של כל האורגניזמים מאב קדמון משותף
-
LUCA (Last Universal Common Ancestor) - האב הקדמון המשותף האחרון של כל החיים
- LECA (Last Eukaryotic Common Ancestor) - האב הקדמון המשותף האחרון של כל האיוקריוטים:
- התפתח מתא ארכיאה שעבר אירוע אנדוסימביוטי
- הנקודה שאחריה התפצלו הענפים לצמחים, פטריות ובעלי חיים
- התיאוריה גורסת שכנראה היה אירוע אנדוסימביוטי בודד (או מספר אירועים קרובים מאוד בזמן) שהביא ליצירת המיטוכונדריה:
- הוכחה: המיטוכונדריה בכל היצורים האיוקריוטיים (צמחים, בעלי חיים ופטריות) דומות מאוד זו לזו
- האירוע התרחש לפני כ-1.5-2 מיליארד שנה
הגנום ההיברידי של תאים איוקריוטיים
- תאים איוקריוטיים מאופיינים בגנום היברידי - תוצאה של האירוע האנדוסימביוטי:
- גנום גדול בגרעין התא
- גנום קטן במיטוכונדריה (בעל מאפיינים פרוקריוטיים)
- לגנים ממקור פרוקריוטי יש “חותמת”/מאפיינים ניתנים לזיהוי:
- הגנום המיטוכונדריאלי דומה יותר לגנום של חיידקים מודרניים
- רוב הגנים המיטוכונדריאליים המקוריים לא אבדו אלא נדדו לגרעין התא:
- תהליך שיילמד בהרחבה בקורסי ביולוגיה מולקולרית וגנטיקה
- מנגנוני בקרה מורכבים מוודאים שהחלבונים המיוצרים מגנים אלו בציטופלזמה יגיעו בחזרה למיטוכונדריה
- גם במיטוכונדריה יש ריבוזומים ומתרחש תרגום של חלבונים
- תופעה דומה קיימת גם בכלורופלסטים
סיכום ומעבר לנושא הבא
- הביולוגיה המודרנית אינה יכולה להתקיים ללא הבנת ה-DNA (“הדוגמה המרכזית של הביולוגיה”)
- הנושא הבא: הכימיה של החיים, קטליזה ושימוש באנרגיה (כולל ATP)
- קיימת חפיפה עם קורס הכימיה האורגנית, אך הסדר אינו בהכרח מתואם
- הנושאים הבאים הם עקרונות בסיסיים בביוכימיה ובאנרגטיקה של התא
הערות אדמיניסטרטיביות
- זהו חומר לבוחן האמצע
- ההרצאות והמצגות זמינות באתר הקורס (כולל בפורמט PDF)
- חשוב להתחיל להסתכל על החומר בספר, גם למי שקשה עם האנגלית
ביולוגיה של התא - כימיה של החיים
פתיחה ומבט כללי
בהרצאה זו (מצגת שלוש) אנו עוסקים בכימיה של החיים - הכימיה המתרחשת בתוך תאים, כולל יצורים חד-תאיים. נעסוק בנושאים הבאים:
- מקור האנרגיה בתאים
- קטליזה (זירוז תהליכים כימיים)
- מקרומולקולות ביולוגיות
אמנם קיימת חפיפה עם קורס הכימיה האורגנית, אך הסדר אינו בהכרח מתואם. אנו נבחן את העקרונות הכלליים בלבד, ללא כניסה לעומק של כל הריאקציות הביוכימיות.
הבסיס הכימי של החיים
הספר מדגיש שאין שום דבר בתאים חיים שמפר את חוקי הפיזיקה והכימיה. בעבר היו אמונות כמו “פריפורמציוניזם” (שבתא הזרע או הביצית יש כבר “אדם קטן” שפשוט גדל), אך המדע המודרן הראה שהכל ניתן להסבר באמצעות תהליכים כימיים.
עקרונות מרכזיים
- סביבה מימית - כל הריאקציות הכימיות בתאים מתרחשות בסביבה מימית
- תרכובות מבוססות פחמן - רוב החומרים בתאים הם תרכובות אורגניות
- מקרומולקולות - רוב אטומי הפחמן בביוספרה נמצאים במקרומולקולות ביולוגיות
היסודות הכימיים בתאים
יסודות מרכזיים
בטבלה המחזורית ניתן לראות היסודות החשובים לחיים:
- ארבעת היסודות העיקריים (99% מהאטומים בתאים):
- פחמן (C)
- חמצן (O)
- מימן (H)
- חנקן (N)
- יסודות חשובים נוספים:
- נתרן (Na), מגנזיום (Mg), אשלגן (K), סידן (Ca), זרחן (P)
- יסודות קורט (trace elements) נמצאים בכמויות זעירות
- מים מהווים כ-70% מכל יצור חי
תכונות המים
- למולקולת המים יש דיפול חזק
- נוצרים קשרי מימן בין מולקולות מים
- בטמפרטורת הגוף כ-15% ממולקולות המים עדיין קשורות ל-3-4 מולקולות מים אחרות
- תכונות המים קריטיות לתהליכים ביוכימיים
מולקולות אורגניות ומקרומולקולות
ארבע משפחות של מולקולות אורגניות בסיסיות
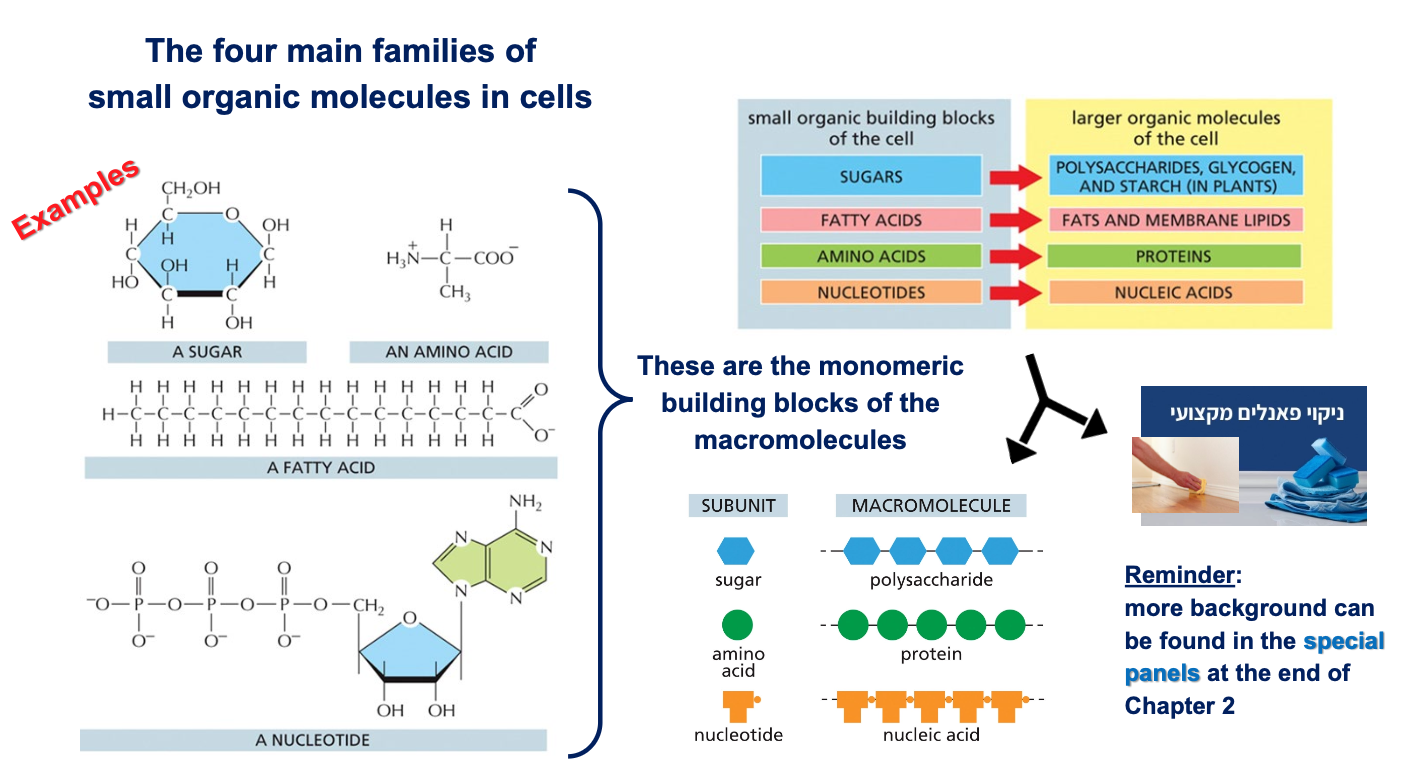
- סוכרים (כמו גלוקוז) - מבנה טבעתי עם שישה פחמנים
- חומצות אמיניות - עם מטענים נוגדים (בסיסי וחומצי)
- חומצות שומן - שרשרות ארוכות של פחמנים
- נוקלאוטידים - כמו ATP עם שלושה פוספטים
אלו הן המולקולות הקטנות (מונומרים) שמתחברות בשרשרות “ראש לזנב” ליצירת מקרומולקולות (פולימרים):
- סוכרים ← רב-סוכרים
- חומצות שומן ← ליפידים (כולל פוספוליפידים בממברנות)
- חומצות אמיניות ← חלבונים (שרשרות פוליפפטידיות)
- נוקלאוטידים ← DNA ו-RNA
הרכב התא
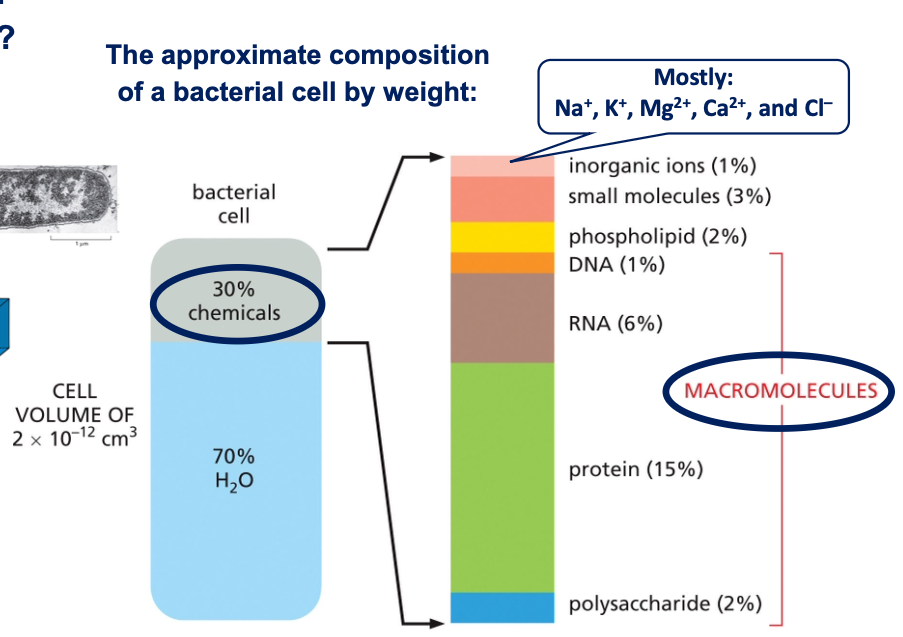
בתא חיידק טיפוסי:
- 70% מים
- 30% חומרים אחרים, מתוכם:
- איונים ומולקולות קטנות (מיעוט)
- מקרומולקולות: חלבונים (15%), DNA, RNA, פוספוליפידים, רב-סוכרים
ההרכב דומה מאוד בין תאי חיידקים לתאים איוקריוטיים, למרות הבדלי הגודל העצומים ביניהם (הבדל של כ-3 סדרי גודל בנפח).
ריאקציות ביוכימיות בסיסיות
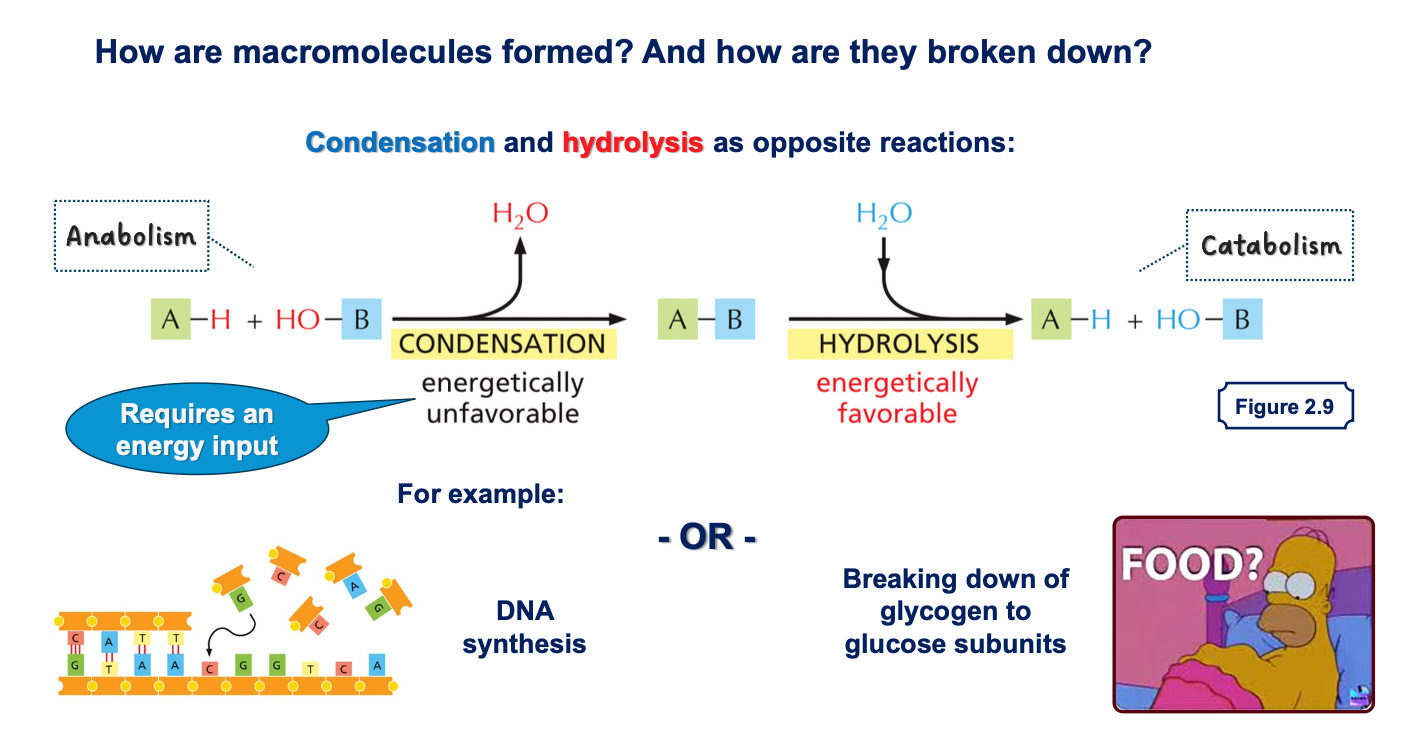
שני סוגים עיקריים של ריאקציות
- קונדנסציה (דחיסה) - חיבור של שתי מולקולות:
- כאשר שתי מולקולות מתחברות, משתחררת מולקולת מים
- דורשת השקעת אנרגיה (לא מועדפת אנרגטית)
- משמשת לבניית פולימרים
- הידרוליזה - פירוק באמצעות מים:
- מולקולת מים נכנסת ומבקעת קשר כימי
- ריאקציה ספונטנית (לא דורשת אנרגיה)
- מתרחשת באופן טבעי במבחנה בתנאים מתאימים
מטבוליזם
- אנבוליזם - תהליכי בנייה הדורשים אנרגיה (כמו סינתזה של DNA)
- קטבוליזם - תהליכי פירוק המשחררים אנרגיה (כמו פירוק גליקוגן לגלוקוז)
בתשובה לשאלה של בן בן: תאים חיים משקיעים אנרגיה רבה כדי לשמור על הסדר ולהתנגד לאנטרופיה (נטייה טבעית לאי-סדר). במצב של שיווי משקל, הנטייה היא לפירוק, ולכן יצורים חיים חייבים להשקיע אנרגיה כדי לבנות ולשמר מבנים.
מבנה ותפקוד של מקרומולקולות
קיפול חלבונים ו-RNA
- כדי לתפקד כאנזימים, חלבונים ו-RNA אינם יכולים להישאר כשרשרת פשוטה
- הם מתקפלים למבנה תלת-ממדי מורכב (קונפורמציה)
- המבנה התלת-ממדי מאפשר להם לבצע את תפקידם
- חלבונים ו-RNA יכולים לאבד את צורתם הטבעית בתנאים מסוימים (דנטורציה)
- דוגמה: חלבון ביצה עובר דנטורציה כשמחממים אותו (הופך מנוזלי למוצק)
קשר בין מבנה לתפקוד
מקרומולקולות ביולוגיות מתפקדות הודות למבנה המיוחד שלהן, כאשר:
- רוב האנזימים בעולם החי הם חלבונים
- גם RNA מסוים יכול לתפקד כאנזים
- הפונקציה של האנזימים תלויה בקיפול הנכון שלהם
ביולוגיה של התא - קיפול חלבונים, מבנה מרחבי ואנרגיה תאית
מבנה מרחבי של מקרומולקולות ביולוגיות
קיפול חלבונים ו-RNA
כאשר נוצרת שרשרת פולימרית (בין אם חלבון או RNA), היא מגיעה ללא מבנה מרחבי מוגדר. כדי לקבל את הפונקציה הביולוגית הנדרשת, השרשרת חייבת להתקפל למבנה תלת-ממדי (קונפורמציה) ספציפי:
- אם חלבונים או RNA לא “מטופלים יפה”, הם יאבדו את המבנה המרחבי שלהם ויאבדו את הפונקציה שלהם
- השרשרת בנויה ממונומרים המחוברים בקשרים קובלנטיים חזקים
- המבנה התלת-ממדי נשמר באמצעות קשרים לא-קובלנטיים חלשים יותר
- למרות שהקשרים הלא-קובלנטיים חלשים יחסית, הצטברות של הרבה קשרים כאלה מבטיחה את הקיפול התלת-ממדי
חשוב: בלי הקשרים הלא-קובלנטיים לא היו חיים. הם מבטיחים את הקיפול לצורה תלת-ממדית פעילה.
דנטורציה (איבוד המבנה)
כאשר קשרים לא-קובלנטיים נשברים (לדוגמה בעקבות חימום או שינוי pH):
- השרשרת הופכת גמישה יותר, חופשית יותר ופתוחה
- המבנה התלת-ממדי מתפרק
- המולקולה מאבדת את הפונקציה שלה
דוגמאות לחשיבות הקשרים הלא-קובלנטיים
- בחלבונים: קיפול לצורה פעילה
- ב-DNA: זיווג בסיסים (A-T, G-C)
- בהיברידים של DNA ו-RNA: גם כן באמצעות זיווג בסיסים
גמישות מבנית ופונקציונלית
בעוד שרוב החלבונים מתקפלים לצורה אחת יציבה, יש מקרים שבהם:
- חלבון מסוים יכול לתפקד בשתי צורות שונות (קונפורמציות שונות)
- בתנאי סביבה מסוימים הוא יקבל קונפורמציה אחת ויבצע פונקציה א׳
- בתנאים אחרים הוא יקבל קונפורמציה אחרת ויבצע פונקציה ב׳
זהו יתרון אבולוציוני שמאפשר להתאים את הפעילות לתנאי הסביבה.
הרכבה היררכית של מבנים ביולוגיים מורכבים
הריבוזום כדוגמה למכונה ביולוגית מורכבת
הריבוזום הוא מבנה מורכב:
- מורכב מתת-יחידה גדולה וקטנה
- בנוי מכמעט 90 מקרומולקולות שונות
- כולל 4 מולקולות RNA (בריבוזום איוקריוטי)
- כולל כ-85 חלבונים שונים, כל אחד באותק אחד
היררכיה של בנייה
בניית מבנים ביולוגיים מורכבים מתקדמת בשלבים היררכיים:
- מולקולות קטנות (נוקלאוטידים ב-RNA, חומצות אמינו בחלבונים)
- מקרומולקולות (RNA, חלבונים) - כל אחת מתקפלת למבנה תלת-ממדי משלה
- קומפלקסים - המקרומולקולות מתחברות יחד ליצירת מבנה גדול ומורכב (כמו הריבוזום)
הערה: הריבוזום עצמו מיוצר על-ידי ריבוזום שהיה קיים קודם, באמצעות המידע ב-mRNA (הדוגמה המרכזית של הביולוגיה).
אנרגיה בתאים חיים
ארגון לעומת אנטרופיה
- הטבע נוטה להגביר אי-סדר (אנטרופיה) - תהליך ספונטני
- ארגון (הקטנת אנטרופיה) דורש השקעת אנרגיה
- תאים חיים הם מערכות מאורגנות ביותר, ולכן חייבים להשקיע אנרגיה רבה לשמירה על הארגון
אנלוגיה: חדר מסודר ייהפך בצורה ספונטנית לחדר מבולגן (הגברת אנטרופיה). כדי לסדר את החדר (להוריד אנטרופיה) יש צורך בהשקעת אנרגיה. חלק מהאנרגיה המושקעת מתפזרת כחום.
אנרגיה וארגון תאי
כל הארגון התאי דורש השקעה מתמדת של אנרגיה:
- המדורים התוך-תאיים
- הציטוסקלטון
- התנועה התאית
- היצירה של מקרומולקולות חדשות והפנייתן למדורים השונים
סיכום והמשך הקורס
- בהמשך הקורס נתמקד באופן שבו המדורים השונים של התא האיוקריוטי מתפקדים
- על בסיס זה נדון בריאקציות הביוכימיות המתרחשות בהם
- בוחן האמצע יכלול את החומר משלושת השבועות הראשונים
- בשבוע הבא תפורסם דוגמת מבחן משנה שעברה ורשימת נושאים
שיעור 5 - מטבוליזם, אנרגיה ומבוא לחלבונים (המשך מצגת 3)
תאריך: 02/04/2025מחזור הפחמן והמערכת האקולוגית
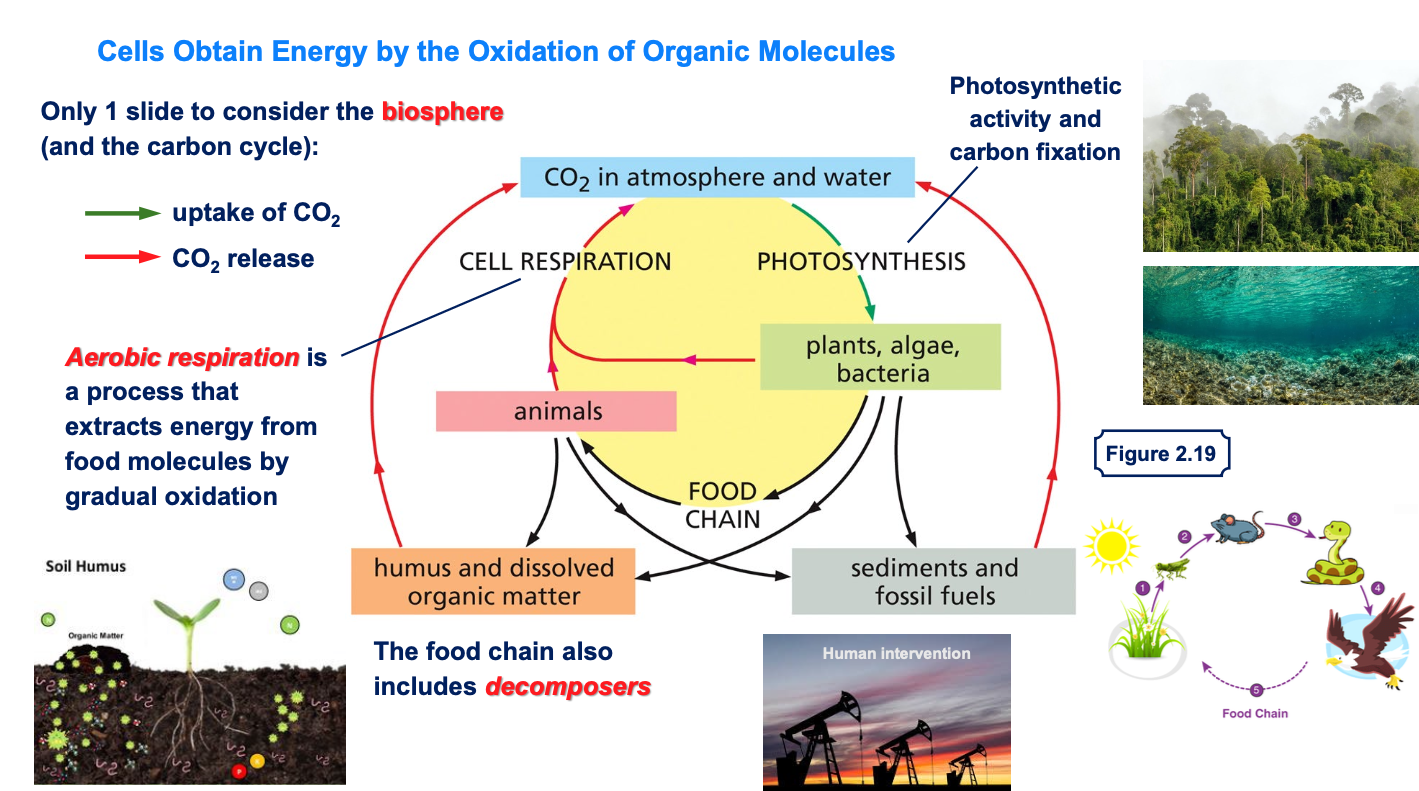
בחומר הקודם נדון נושא האנטרופיה והאנטלפיה, והאופן שבו תאים חיים משקיעים אנרגיה רבה בשמירה על מצב מאורגן. כעת נעסוק בכימיה וריאקציות של החיים ברמה בסיסית.
2.1 הגדרת הביוספירה
הביוספירה מורכבת מהחלק הביוטי (כל היצורים החיים) וגם מהחלק האביוטי על פני כדור הארץ. המונח מתייחס לקליפה החיצונית של כדור הארץ, השכבה החיצונית שבה קיימים תאים חיים.
2.2 היקף הביוספירה
הביוספירה כוללת את האטמוספירה עד לגובה מסוים וגם את מעמקי הים. ישנם יצורים שמתקיימים במעמקי הים באזורים חסרי חמצן.
3. מחזור הפחמן בטבע
3.1 עקרונות כלליים
החיים מתבססים על מולקולות עשירות בפחמן - ללא פחמן אין חיים.
3.2 פחמן במערכת הביוטית
רוב הפחמן במערכת הביוטית (של היצורים החיים) נמצא במקרומולקולות. עם זאת, קיים הרבה יותר פחמן בחלק האביוטי, בצורת CO₂ באטמוספירה.
3.3 כניסה ויציאה של פחמן מהמערכת
בתרשים, החץ הירוק מראה את הכניסה של פחמן לייצורים החיים, ביטוי לתהליך שקורה במקום אחד בלבד. החיצים האדומים מייצגים את שחרור ה-CO₂ חזרה לאטמוספירה.
3.4 יציבות כימית של פחמן וחמצן
באטמוספירה העשירה בחמצן, המצב היציב והמועדף של פחמן הוא בתרכובת עם חמצן (CO₂), ושל מימן הוא מים (H₂O).
4. פוטוסינתזה כשער כניסה עיקרי לפחמן
4.1 מקור הפחמן במערכת החיה
פוטוסינתזה היא הדרך העיקרית, אך לא היחידה, להכנסת פחמן למערכת הביוטית.
4.2 יצורים פוטוסינתטיים
מלבד צמחים ועצים, גם חיידקים ומיקרואורגניזמים מבצעים פוטוסינתזה. חשוב לזכור את המיקרואורגניזמים בימים ובאוקיינוסים, שהם חלק משמעותי מהיצורים הפוטוסינתטיים.
4.3 תפקיד הפוטוסינתזה
פוטוסינתזה ממלאת תפקיד כפול: רתימת אנרגיית אור השמש והכנסת פחמן למערכת. המיקרואורגניזמים בשכבה העליונה של הימים והאוקיינוסים מבצעים פוטוסינתזה ומשמשים כיצרנים ראשוניים, בדומה לצמחים.
5. שחרור פחמן דרך נשימה
5.1 פליטת פחמן דו-חמצני
שחרור CO₂ חזרה לאטמוספירה נעשה על ידי כל היצורים החיים בתהליך הנשימה האירובית.
5.2 נשימה אירובית
נשימה אירובית היא תהליך מיצוי האנרגיה ממולקולות מזון באמצעות חמצון הדרגתי.
6. שרשרת המזון וזרימת הפחמן
6.1 דוגמה פשוטה לשרשרת מזון
שרשרת מזון פשוטה כוללת יצרן ראשוני (צמח), אוכל הראשוני (חגב), אוכל שניוני (עכבר) וטורף-על (נץ).
7. מפרקים במחזור הפחמן
7.1 החוליה החסרה
מפרקים (Decomposers) הם חוליה חיונית במחזור הפחמן.
7.2 תפקיד המפרקים
כשיצורים חיים מתים ואינם מצליחים יותר לשמור על הסדר והארגון שלהם, המפרקים אחראים לפירוק המקרומולקולות ו”ארגון” הפגרים. בכך הם מאפשרים למחזור הפחמן לפעול.
7.3 מיקום המפרקים
המפרקים פועלים בעיקר בשכבה העליונה של הקרקע, אך לא רק שם.
8. התערבות אנושית במחזור הפחמן
8.1 השפעת האדם
ההתערבות האנושית היא גורם משמעותי במחזור הפחמן.
8.2 שריפת דלקים מאובנים
במאות השנים האחרונות האנושות משפיעה מאוד על המערכת האקולוגית דרך שריפת דלקים מאובנים, תהליך המשחרר CO₂ לאטמוספירה.
9. מיקוד הקורס
9.1 התמקדות בביוכימיה של החיים
הקורס יתמקד בביוכימיה של החיים - בתהליכים הביוכימיים המתרחשים בתוך המערכת הביוטית.
מאנזימים דרך ביואנרגטיקה ועד חלבונים
1. מבוא לאנזימים
אנזימים הוזכרו כבר בפרק הראשון של הספר. אין צורך לקרוא את כל הפרק - מספיק להסתכל בתמונות העיקריות, לקרוא את ההסבר מתחת לתמונה ואת החלק בטקסט המפנה אליה. זוהי צורת הלימוד האוניברסיטאית, השונה מהלימוד בתיכון שמתבסס על שינון.
בקורס הנוכחי אנזימים נלמדים בסיסית, והרחבה משמעותית על אנזימים, ריאקציות אנזימטיות, חישובי אנרגיה וקצב ריאקציה תינתן בקורס ביוכימיה בשנה הבאה.
2. הגדרה ומבנה של אנזימים
2.1 מהות האנזימים
ברוב המכריע של המקרים, אנזימים הם חלבונים. עם זאת, ישנן גם מולקולות RNA הפועלות כאנזימים, הנקראות “ריבוזים” (Ribozymes). ההגדרה המדויקת מתייחסת לאנזימים כחומר ביולוגי - חלבון או RNA או שילוב שלהם - הפועל כקטליזטור.
2.2 התפתחות אבולוציונית של אנזימים
התיאוריה המקובלת היא שבמרק הקדמון, ממנו התפתחו החיים, הייתה דומיננטיות של RNA. עם הזמן, התפקיד הקטליטי עבר יותר לחלבונים. עם זאת, עדיין לא ברור לחלוטין כיצד התפתחו חיים משלולית רדודה עם מולקולות אורגניות קטנות.
2.3 תפקוד האנזימים כקטליזטורים
אנזימים פועלים כקטליזטורים - אוסף של מזרזים ביוכימיים בכל יצור חי, מהחיידק הפשוט ביותר עם 500 גנים ועד לאדם. האנזים מבקר את קצב הריאקציה הכימית מבלי שהוא עצמו משתנה בתהליך - נקודה קריטית להבנת פעולתם.
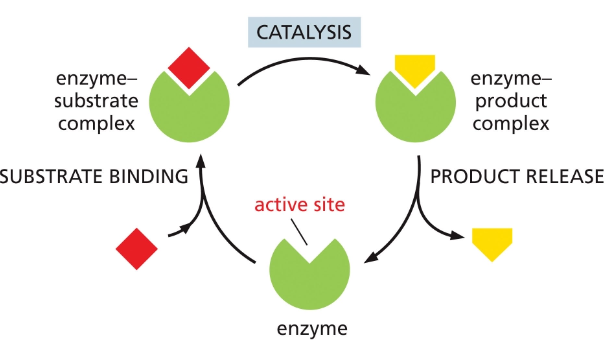
3. אתר פעיל וסובסטרט
3.1 מבנה האתר הפעיל
לאנזים יש אתר פעיל (Active site) המותאם לסובסטרט (חומר המוצא). באופן סכמטי, האנזים מיוצג בצבע ירוק והסובסטרט (האדום) נקשר אליו בהתאמה מדויקת.
3.2 מהירות ריאקציות אנזימטיות
תהליך הקשירה וההמרה הוא מהיר באופן יוצא דופן. ישנם אנזימים הפועלים בקצב של מאות אלפי ריאקציות בשנייה. הריאקציות מתרחשות בסביבה הצפופה של התא, מוקפות במולקולות רבות.
3.3 תהליך הריאקציה האנזימטית
תהליך הריאקציה האנזימטית כולל מספר שלבים:
- יצירת קומפלקס אנזים-סובסטרט
- העברת הסובסטרט למצב תוצר על ידי האנזים (קטליזטור)
- שינוי צורה גיאומטרית של הסובסטרט
- שחרור התוצר
- חזרת האנזים למצבו המקורי
ללא אנזימים, ריאקציות אלה לא היו מתרחשות בקצב מספק בטמפרטורות פיזיולוגיות כמו 37 מעלות.
4. מסלולים מטבוליים
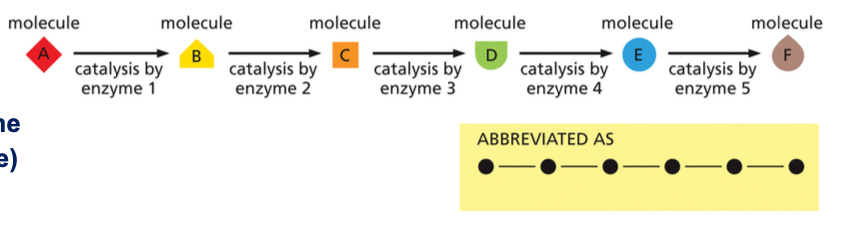
4.1 עיקרון המסלולים המטבוליים
מסלולים מטבוליים הם רצפים של ריאקציות המזורזות על ידי אנזימים עוקבים. התוצר של ריאקציה אחת משמש כסובסטרט לריאקציה הבאה. המסלולים מתרחשים במקומות שונים בתא: בציטוזול (הסביבה המימית בתוך התא), במיטוכונדריה, בגרעין, בגולג׳י, ובכל האברונים השונים.
4.2 אנבוליזם וקטבוליזם
המסלולים המטבוליים כוללים שני סוגי תהליכים עיקריים:
- אנבוליזם: בנייה של מולקולות מורכבות ממולקולות פשוטות יותר (דורש אנרגיה)
- קטבוליזם: פירוק של מולקולות מורכבות למולקולות פשוטות יותר (משחרר אנרגיה)
החיים מתבססים על מטבוליזם מאוזן של פירוק ויצירה, כמו שתי כפות מאזניים.
5. אנרגיית שפעול ופעילות אנזימטית
5.1 הורדת אנרגיית שפעול
אנזימים מורידים את אנרגיית השפעול - האנרגיה הדרושה להתחלת ריאקציה. ניתן להדגים זאת באמצעות אנלוגיה של כדור שצריך לעבור על פני גבעה: אותה ריאקציה כימית יכולה להתרחש בדרכים שונות, לכל אחת מהן יש סף אנרגטי אחר. ללא אנזים, יש צורך לחמם את המערכת (למשל ל-70 מעלות) כדי שהריאקציה תתרחש, אך האנזים מוריד את הסף האנרגטי הדרוש לריאקציה ספציפית.
6. מולקולות נושאות אנרגיה (Activated Carrier Molecules)
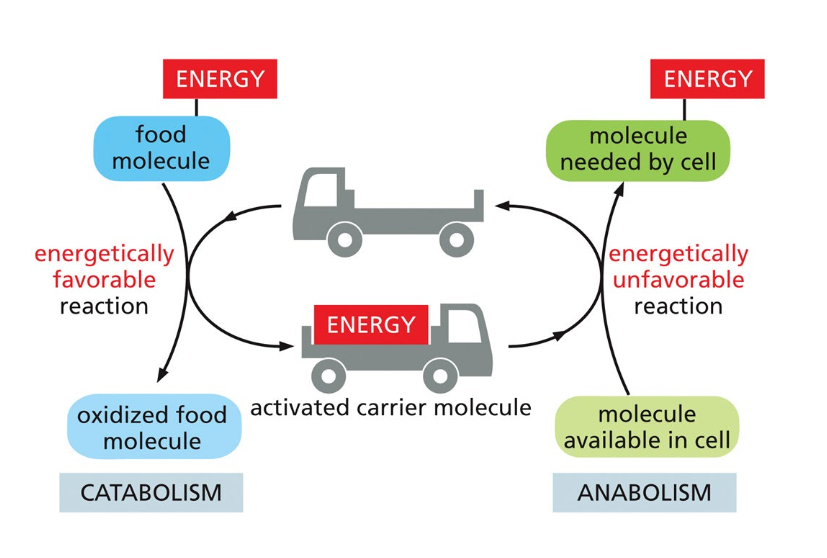
6.1 עיקרון פעולת המתווכים האנרגטיים
מולקולות נושאות אנרגיה פועלות כמתווכים בין תהליכי פירוק (קטבוליזם) לתהליכי בנייה (אנבוליזם). אלו הן מולקולות שיכולות לעבור בין שני מצבים: טעונות באנרגיה ולאחר שחרור האנרגיה.
6.2 ATP כנושא אנרגיה מרכזי
ATP (אדנוזין טרי-פוספט) הוא המולקולה הנושאת אנרגיה הנפוצה ביותר. המבנה שלו כולל אדנוזין (בסיס חנקני + ריבוז) ושלוש קבוצות פוספט. הקשרים בין קבוצות הפוספט, במיוחד בין הפוספט השני לשלישי, הם “עתירי אנרגיה”.
6.3 יתרונות מולקולות קטנות כנושאות אנרגיה
בסביבה הצפופה של התא, מולקולות גדולות וקטנות מתנגשות ללא הרף. היתרון של מולקולה קטנה כמו ATP הוא יכולתה לנוע בדיפוזיה בקלות יחסית. האנזים, למרות תנועתו ושינויי הקונפורמציה שלו, כמעט נייח בהשוואה ומותקף על ידי מולקולות קטנות.
ישנם חישובים המראים את הזמן הדרוש למולקולה קטנה כמו ATP לעבור מרחק של 10 מיקרון (גודל אופייני של תא איוקריוטי) בסביבה צפופה. מולקולות גדולות יותר מתנגשות זו בזו ומתקשות להגיע לכל פינה בתא.
6.4 מגוון מולקולות נושאות אנרגיה
מלבד ATP, קיימות מולקולות נוספות המשמשות כנושאות אנרגיה:
- GTP (גואנוזין טרי-פוספט) - מבנה דומה ל-ATP
- NADH/NADPH
- נושאי אנרגיה אחרים
קיים שימוש נרחב בעיקרון של מתווכים קטנים במערכות ביולוגיות.
7. מקורות אנרגיה במערכות ביולוגיות
7.1 מקורות אנרגיה חיצוניים
יצרנים ראשוניים רותמים את אור השמש כמקור אנרגיה עיקרי הנכנס למערכת. עם זאת, ישנם גם מקורות אחרים. דוגמה מעניינת היא “מתנוקוקוס” (ארכיאה) החיה בקרקעית האוקיינוס בתנאים חסרי חמצן. אורגניזמים אלה נמצאים ליד “ונטות” - פתחים בקרקעית האוקיינוס מהם יוצא חום ואנרגיה כימית. הם מנצלים אנרגיה מקרקעית האוקיינוס, מייצרים מתן, ובכך מכניסים אנרגיה ופחמן למערכת החיה.
7.2 טרמודינמיקה בתהליכים ביולוגיים
עקרונות הטרמודינמיקה נשמרים בכל תהליך ביולוגי: האנרגיה לא נוצרת ולא נעלמת, רק משנה צורה.
8. מחזור ATP-ADP
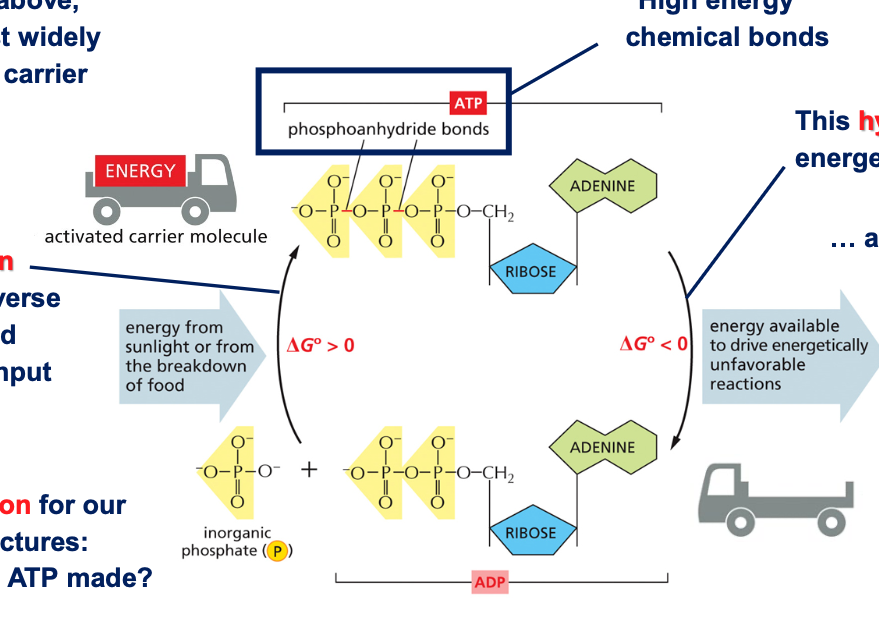
8.1 מבנה מפורט של ATP
ATP מורכב מאדנוזין (אדנין + ריבוז) ושלושה פוספטים. מבנה זה מוצג בפירוט בתמונה 33 בפרק הרלוונטי בספר.
8.2 מחזור האנרגיה באמצעות ATP/ADP
ATP הוא הנפוץ ביותר מבין נושאי האנרגיה. המעבר מ-ATP ל-ADP משחרר אנרגיה שיכולה לשמש לריאקציות אחרות. כאשר הפוספט השלישי משתחרר, מתקבלים ADP ופוספט אנאורגני (Pi), והאנרגיה המשתחררת מנוצלת לריאקציות שאינן מועדפות אנרגטית.
המחזור דורש את שתי הצורות - ATP ו-ADP. ה-ATP, עם שלושה פוספטים, הוא הצורה הטעונה באנרגיה. הוא שומר על האנרגיה בקשרים עתירי האנרגיה עד לרגע שבו האנרגיה נדרשת לדחיפת ריאקציה שאינה מועדפת אנרגטית.
8.3 נגזרות נוספות של נוקלאוטידים
מלבד המעבר הנפוץ ATP-ADP, קיים גם מעבר ל-AMP (אדנוזין מונופוספט) שיכול לשמש כאבן בנייה או ליצור Cyclic AMP (AMP ציקלי), שבו הפוספט מתארגן בצורה מעגלית. ל-Cyclic AMP יש תפקיד חשוב כמתווך בתאים.
9. אתר ייצור ה-ATP
9.1 מיטוכונדריה ותפקידה
ATP נוצר במיטוכונדריה, אברון שמשמש כאתר ייצור האנרגיה העיקרי בתא האיוקריוטי. במיטוכונדריה פועלת מכונה ביולוגית המכונה “הפטרייה” (ATP סינתאז או ATP synthase) שמסתובבת באופן דומה לגלגל תחנת מים. אנזים זה ממוקם בין שתי הממברנות של המיטוכונדריה.
9.2 מקור המיטוכונדריה והתנועה שלה
המיטוכונדריה נוצרה מאירוע סימביוזה עתיק שהתרחש לפני יותר ממיליארד שנה. חשוב לציין שמיטוכונדריות נעות בתוך התא ומגיעות לכל פינה, עובדה קריטית במיוחד בתאים עם שלוחות ארוכות, כמו תאי עצב. לדוגמה, תא עצב שמגיע מחוט השדרה עד לכף הרגל צריך לספק אנרגיה לכל חלקיו, כולל לסינפסות.
10. צימוד ריאקציות (Coupled Reactions)
10.1 עיקרון הצימוד
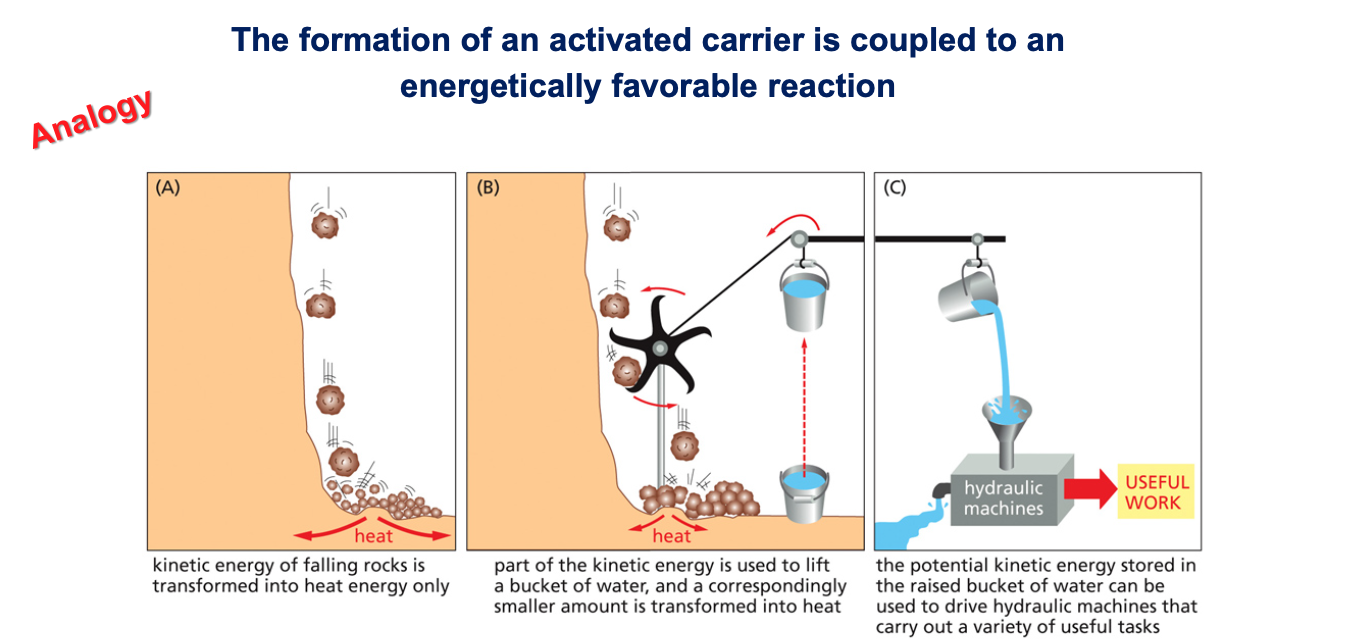
צימוד ריאקציות הוא עיקרון מרכזי בביוכימיה. לשם המחשה, ניתן לחשוב על אנלוגיה (שאינה ריאקציה ביוכימית): סלעים נופלים מצוק ומתרסקים, וכל האנרגיה שלהם מתבזבזת כחום. כאשר מציבים גלגל במסלול הסלעים, חלק מהאנרגיה נרתמת להרים דליי מים, פעולה שדורשת השקעת אנרגיה.
10.2 הקשר לחיי יומיום
המעבר בין ATP ל-ADP דומה למעבר מ”סחר חליפין” ל”כלכלת כסף” בחברה האנושית: במקום להחליף ישירות מוצרים או שירותים (פרה תמורת חפץ אחר), משתמשים באמצעי ביניים (כסף) שמקל על העברת הערך.
11. נומנקלטורה של נוקלאוטידים וסטריאוכימיה
11.1 מורכבות שמות הנוקלאוטידים
שמות (נומנקלטורה) הנוקלאוטידים עלולים להיות מבלבלים למי שלא נתקל בהם בעבר. אין צורך לזכור את כל השמות והנוסחאות הכימיות - בשאלות העוסקות במולקולות ספציפיות יופיע השם ולעתים גם תמונה של המולקולה.
11.2 מרכיבי הנוקלאוטידים
נוקלאוטידים בנויים מבסיס חנקני, סוכר (ריבוז או דאוקסיריבוז) וקבוצות פוספט. ההבדל בין נוקלאוזיד לנוקלאוטיד הוא שנוקלאוזיד מורכב רק מהריבוז והבסיס החנקני, בעוד שנוקלאוטיד כולל גם פוספטים.
11.3 הבדלים בין DNA ו-RNA
בין DNA ו-RNA קיימים שני הבדלים מרכזיים:
- בסוכר: דאוקסיריבוז ב-DNA לעומת ריבוז ב-RNA
- בבסיס החנקני: תימין (T) ב-DNA לעומת אוראציל (U) ב-RNA
11.4 סטריאוכימיה של מולקולות ביולוגיות
מולקולות ביולוגיות מאופיינות באננטיומרים (מולקולות תמונת ראי). בטבע יש בדרך כלל רק אננטיומר אחד, בעוד שבמעבדה אפשר לסנתז את שניהם. לדוגמה, כשמשתמשים ב-ATP במעבדה, רק אחד מהאיזומרים (D או L) יעיל במערכת ביולוגית.
12. תגובות דחיסה (Condensation Reactions)
12.1 עיקרון תגובות הדחיסה
תגובות דחיסה הן תהליכים מרכזיים בביוכימיה. בתגובה כזו, שתי מולקולות מתחברות תוך שחרור מולקולת מים.
12.2 השלבים בתגובת דחיסה מזורזת על ידי ATP
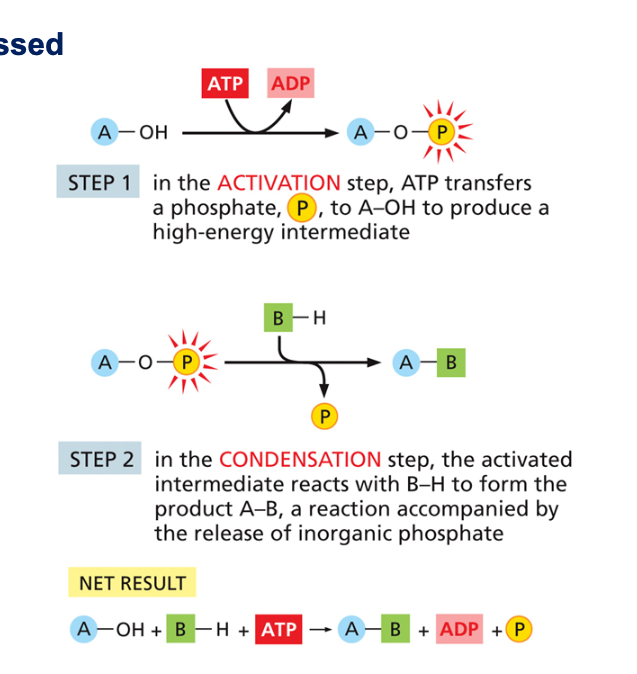
תגובת דחיסה כוללת מספר שלבים:
- יצירת מצב ביניים (Activated Intermediate) כאשר קבוצת פוספט מ-ATP עוברת לאחת המולקולות
- התקרבות המולקולה השנייה והתרחשות תגובת הדחיסה
- יצירת קשר חדש בין שתי המולקולות ושחרור מולקולת מים
12.3 דוגמה ספציפית: סינתזת גלוטמין
דוגמה מוחשית היא סינתזת גלוטמין מחומצה גלוטמית ואמוניה באמצעות האנזים גלוטמין סינתאז. התהליך כולל:
- שימוש באנרגיה מ-ATP ליצירת מצב ביניים של חומצה גלוטמית עם פוספט
- תגובה של אמוניה (NH₃) עם מצב הביניים
- יצירת גלוטמין ושחרור ADP ופוספט
שני השלבים מצומדים ומתרחשים במהירות רבה באתר הפעיל של האנזים.
13. תגובות דחיסה בסינתזת מקרומולקולות עיקריות
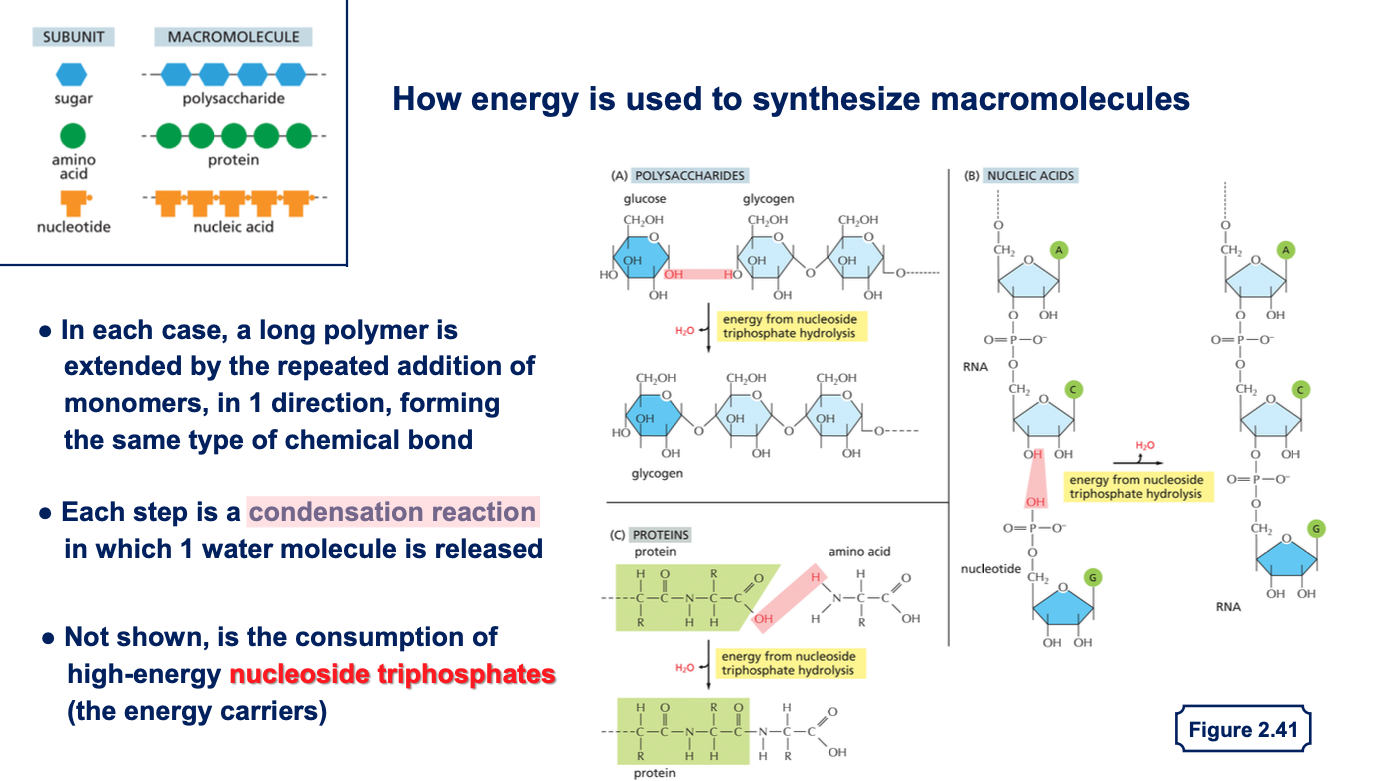
13.1 שלוש קבוצות עיקריות של מקרומולקולות
ישנן שלוש קבוצות חשובות של ריאקציות דחיסה בסינתזת מקרומולקולות:
- פוליסכרידים (רב-סוכרים) - יחידות סוכר (לרוב גלוקוז) מתחברות אחת לשנייה, כמו בגליקוגן
- פוליפפטידים (חלבונים) - חומצות אמינו מתחברות דרך קשר פפטידי
- חומצות גרעין (DNA/RNA) - נוקלאוטידים מתחברים בקשר פוספודיאסטרי
13.2 כיווניות בבניית מקרומולקולות
כל אחת מהמקרומולקולות נבנית בכיווניות מוגדרת:
- בחלבונים - מהקצה האמיני לקצה הקרבוקסילי
- בחומצות גרעין - מכיוון 5’ לכיוון 3’
בכל המקרים, הפולימרים הארוכים נבנים מחיבור מונומרים באותו סוג קשר ובאותה כיווניות.
13.3 יצירת DNA/RNA
בסינתזת חומצות גרעין, הנוקלאוטידים מגיעים בצורה של שלושה פוספטים (כמו GTP) והם כבר “טעונים באנרגיה” שהאנזים מנצל לחיבור. האנרגיה לטעינת הנוקלאוטידים הגיעה מתהליכים קודמים, ביטוי למחזור האנרגיה המתמיד בתא.
13.4 שחרור מולקולות מים
בכל תגובות הדחיסה משתחררת מולקולת מים. זוהי הפעולה ההפוכה לריאקציות הידרוליזה שבהן קשרים נשברים באמצעות מים.
14. מסלולים מטבוליים: גליקוליזה ומעגל החומצה הציטרית
14.1 גליקוליזה (Glycolysis)
הגליקוליזה היא מסלול מטבולי של 10 שלבים לפירוק גלוקוז. זהו נושא שסטודנטים לרפואה ולמדעי החיים לומדים בפירוט. הגליקוליזה מתרחשת בציטוזול ומהווה את החלק הראשון בתהליך הפקת האנרגיה מסוכרים.
14.2 מעגל החומצה הציטרית (מעגל קרבס)
מעגל החומצה הציטרית מתרחש במיטוכונדריה בתאים איוקריוטיים. זהו התהליך המרכזי בכל היצורים החיים המתרחש בסביבה עשירה בחמצן לחמצון סוכרים.
14.3 השוואה לשריפה ישירה
התהליך המטבולי המבוקר שונה משריפה ישירה של סוכר שבה כל האנרגיה משתחררת בבת אחת. היתרון בתהליך המטבולי הוא שהאנרגיה נשחררת בשלבים, ותוצרי ביניים יכולים לשמש למטרות אחרות בתא.
14.4 מסלולים אנאירוביים
קיימים גם תהליכי נשימה אנאירובית המתרחשים בהיעדר חמצן. דוגמה לכך היא פעילות אתלטים בעצימות גבוהה שבה נוצר מצב של חוסר חמצן בשרירים, המוביל ליצירת חומצת חלב. כמו כן, ישנם אורגניזמים כמו “מתנוקוקוס” (ארכיאון) המותאמים לסביבה אנאירובית במעמקי האוקיינוס.
14.5 המורכבות של רשת המסלולים המטבוליים
רשת המסלולים המטבוליים כוללת מעל 2,000 ריאקציות אנזימטיות. המטבוליזם אינו רק מקור אנרגיה, אלא גם מספק אבני בניין (מולקולות קטנות) המשמשות לתהליכי אנבוליזם - בניית מקרומולקולות.
15. חלבונים: מבנה ותפקוד
15.1 מרכזיות החלבונים בחיים
חלבונים הם מרכיב יסוד בכל היצורים החיים. הבנת הקשר בין מבנה החלבון לתפקודו היא מפתח להבנת תהליכים ביולוגיים.
15.2 אחוז החלבונים בגוף
כ-70% מהגוף האנושי הוא מים, אך מתוך החומר היבש, 15% הם חלבונים. ללא חלבונים, החיים כפי שאנו מכירים אותם לא היו אפשריים.
16. הקשר הפפטידי
16.1 מבנה ויצירת הקשר הפפטידי
הקשר הפפטידי מחבר בין חומצות אמינו בחלבון. זוהי דוגמה נוספת לריאקציית דחיסה - חיבור חומצה אמינית חדשה לסוף שרשרת החלבון.
16.2 כיווניות בחלבונים
בדומה לכיווניות ב-DNA וב-RNA, גם בחלבונים יש כיווניות קבועה: תמיד מהקצה האמיני לקצה הקרבוקסילי. הקשר הפפטידי, הנקרא לעתים גם “קשר אמידי”, ניתן לזיהוי על ידי פחמן הקשור בקשר כפול לחמצן וקבוצת אמין (NH).
17. תפקידים מגוונים של חלבונים
17.1 רשימת תפקידי חלבונים
חלבונים ממלאים מגוון רחב של תפקידים:
- אנזימים - מזרזים ריאקציות ביוכימיות
- חלבוני מבנה - מעניקים תמיכה מכנית
- משאבות ותעלות - מאפשרים מעבר חומרים דרך ממברנות
- ועוד תפקידים רבים אחרים
17.2 חשיבות בלימודים קליניים
חלבונים הם נושא מרכזי בלימודים פרקליניים ובהתמחויות רפואיות. בדיקות דם ביוכימיות שרופאים מזמינים לעתים קרובות בודקות פעילות אנזימטית או נוכחות חלבונים מסוימים.
17.3 דימוי של תא וחלבונים
תא חי מכיל אברונים שונים כמו גרעין, מיטוכונדריה, גולג׳י ורשתית אנדופלסמטית (ER). חברות ביוטכנולוגיות מייצרות סמנים שמאפשרים למדענים לעקוב אחרי חלבונים ספציפיים בתוך התא החי, כלי חיוני למחקר ביולוגי מודרני.
שיעור 6 - מבנה ותפקוד של חלבונים
תאריך: 07/04/2025מוכנים למבחן?
נסו 10 שאלות על מבנה ותפקוד של חלבונים, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא לחלבונים
- הנושאים מופיעים בפרק 3 בספר (אך בקורס נלמד רק חלק מהפרק)
- הקורס חופף חלקית עם ביוכימיה
- המבנה של חלבון נקבע על ידי רצף חומצות האמינו
- המידע על רצף חומצות האמינו מגיע מהגנים
- רוב הגנים קובעים רצף של חלבונים
- המידע עובר דרך מתווך - ה-mRNA
- ה-mRNA מגיע לריבוזום (מכונת התרגום) שמייצרת חלבונים
- סוד הקיום של היצורים החיים מתמקד בחלבונים ובפונקציות שלהם
חומצות אמינו
מבנה בסיסי של חומצת אמינו
- בספר בפרק 3 יש פאנל 3.1 בעמוד 118 המפרט את כל 20 חומצות האמינו השכיחות בחלבונים
- חפשו תמיד את פחמן אלפא (α-carbon) - הוא הפחמן שבאמצע
- מבנה בסיסי:
- פחמן אלפא במרכז
- בצד אחד יש קבוצה אמינית (+NH₃)
- בצד שני יש קבוצה קרבוקסילית (COO⁻)
- צד שלישי - מימן בודד (H)
- צד רביעי - שרשרת צדדית (R) ייחודית לכל חומצת אמינו
- בpH פיזיולוגי (בין 6-8, בד”כ סביב 7):
- הקבוצה האמינית טעונה חיובית
- הקבוצה הקרבוקסילית טעונה שלילית
- ישנה דינמיות בטעינה (המטענים הם on/off)
קבוצות של חומצות אמינו
חומצות האמינו מחולקות לקבוצות על פי תכונות השרשרת הצדדית (R):
- חומצות אמינו עם שרשרת צדדית טעונה חיובית (בסיסית):
- ליזין (Lys)
- ארגינין (Arg)
- היסטידין (His) - בpH נטרלי רק כ-40-50% מהמולקולות טעונות
- חומצות אמינו עם שרשרת צדדית טעונה שלילית (חומצית):
- חומצה אספרטית (Asp)
- חומצה גלוטמית (Glu)
- חומצות אמינו עם שרשרת צדדית פולארית (לא טעונה):
- טירוזין (Tyr) - בעלת טבעת ארומטית וקבוצה הידרוקסילית
- חומצות אמינו נוספות בקבוצה זו
- חומצות אמינו עם שרשרת צדדית לא פולארית (הידרופוביות):
- גליצין (Gly) - השרשרת הצדדית היא רק מימן נוסף
- אלנין (Ala) - השרשרת הצדדית היא CH₃
- חומצות אמינו נוספות בקבוצה זו
- נוטות לשבת יחד ולהימנע ממגע עם מים
דוגמה לפפטיד
- פפטיד של ארבע חומצות אמינו (מסומנות בצבעים שונים)
- קוראים פפטידים מהקצה האמיני לקצה הקרבוקסילי (N→C)
- הקשר בין חומצות האמינו נקרא “קשר פפטידי”
- יצירת קשר פפטידי היא ריאקציית דחיסה (קונדנסציה) עם שחרור מולקולת מים
- ריאקציה זו דורשת אנרגיה ומתרחשת על הריבוזום בעת תרגום החלבון
מבנה החלבון
ישנן ארבע רמות של ארגון בחלבונים:
מבנה ראשוני (Primary Structure)
- הרצף הלינארי של חומצות האמינו בשרשרת הפוליפפטידית
- קובע את כל המידע הדרוש ליצירת המבנה המרחבי של החלבון
- לדוגמה: פוליפפטיד כשרשרת פשוטה של חומצות אמינו המחוברות בקשרים פפטידיים
מבנה שניוני (Secondary Structure)
- מבנים מקומיים בחלבון הנוצרים עקב אינטראקציות בין חומצות אמינו קרובות
- דוגמה נפוצה: אלפא הליקס (α-helix) - סליל
- דוגמאות נוספות יפורטו בהמשך ההרצאה
- האזורים האלה הם מבנים מקומיים בתוך החלבון השלם
מבנה שלישוני (Tertiary Structure)
- המבנה המרחבי המלא של שרשרת פוליפפטידית שלמה
- נוצר כתוצאה מקיפול שרשרת החלבון במרחב
- דוגמה: אזור (“דומיין”) של ארבעה אלפא הליקסים המחוברים יחד
- דוגמה נוספת: המוגלובין (בחלק החלבוני שלו)
מבנה רביעוני (Quaternary Structure)
- קומפלקס של כמה תת-יחידות חלבוניות הפועלות יחד
- דוגמה: המוגלובין מורכב משתי שרשראות אלפא-גלובין ושתי שרשראות בטא-גלובין
- כולל גם חלקים לא-חלבוניים (כמו הם - טבעת סוכרית עם יון ברזל)
- רק המבנה הרביעוני המלא מאפשר פעילות מלאה של החלבון
אינטראקציות בין חומצות אמינו בחלבון
- קשרים לא קוולנטיים (חלשים) שיחד מייצבים את מבנה החלבון:
- קשרים אלקטרוסטטיים (בין מטענים חיוביים ושליליים)
- קשרי מימן
- אינטראקציות הידרופוביות
- ככל שיש יותר קשרים כאלה, המבנה יציב יותר
דוגמה: המוגלובין
- חלבון מוכר המצוי בכדוריות דם אדומות
- תפקידו: הובלת חמצן מהריאות לרקמות
- מורכב מחלק חלבוני וחלק לא חלבוני (הם - טבעת סוכרית המחזיקה יון ברזל)
- המבנה הרביעוני מורכב מארבע תת-יחידות
- המוגלובין מסוכר (בהקשר של סוכרת) - קשור לרמת הגלוקוז בדם
- המוגלובין מסוכר פחות יעיל בקליטת חמצן והובלתו
הערות נוספות
- החלבונים הם מקרומולקולות חיוניות לקיום החיים
- המבנה של חלבון קובע את תפקודו
- החלבון הגדול ביותר בתאי אדם נקרא טייטין (Titin) ומכיל כ-27,000 חומצות אמינו
- חלבונים מתפקדים רק במבנה המרחבי התקין שלהם
- דנטורציה של חלבון גורמת לאובדן פעילותו
אינטראקציות לא קוולנטיות בחלבונים
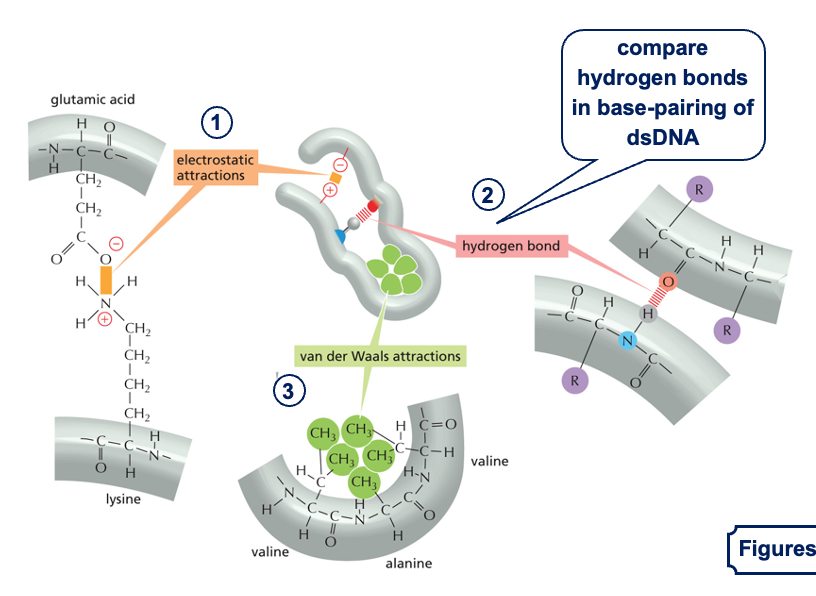
לאחר יצירת השרשרת הפפטידית עם קשרים קוולנטיים חזקים (הקשרים הפפטידיים), החלבון מתקפל למבנה התלת-מימדי שלו בעזרת אינטראקציות לא קוולנטיות:
סוגי קשרים לא קוולנטיים
- קשרים אלקטרוסטטיים:
- משיכה בין שיירים בעלי מטענים מנוגדים
- לדוגמה: ליזין (טעון חיובית) נמשך לחומצה גלוטמית (טעונה שלילית)
- מחזיקים חלקים שונים של החלבון קרובים זה לזה
- קשרי מימן:
- דומים לקשרי המימן שראינו ב-DNA וב-RNA
- בין קבוצות C=O ו-N-H בקשרים פפטידיים
- מייצבים את המבנה התלת-מימדי של החלבון
- קשרי ון דר ואלס:
- בין שיירים צדדיים לא פולריים
- לדוגמה: בין אלנין (CH₃) לולין (שיירים גדולים יותר)
- חלשים יחסית אך כוחם בכמות
- אינטראקציות הידרופוביות:
- שיירים הידרופוביים (כמו טריפטופן, פנילאלנין) נוטים להתקבץ יחד
- נטייה להימנע ממגע עם מולקולות מים
- בחלבונים גלובולריים: השיירים ההידרופוביים נוטים להתקבץ בליבת החלבון
- יתרון אנרגטי - מערכת יציבה יותר כשהחלקים ההידרופוביים מוסתרים מהמים
מאפייני הקשרים הלא קוולנטיים
- כל קשר בודד חלש הרבה יותר מקשר קוולנטי
- כוחם של קשרים אלה הוא במספרם הרב
- החלבון מתקפל לצורה המועדפת מבחינה אנרגטית
- המבנה אינו נוקשה לחלוטין אלא יש בו מידה מסוימת של גמישות (“נשימה” של המבנה)
מבנים שניוניים נפוצים
אלפא הליקס (α-helix)
- מבנה סלילי שנוצר בזכות קשרי מימן חוזרים בעמדות קבועות
- הקשרים הם בין קבוצות NH ו-CO של קשרים פפטידיים
- השיירים הצדדיים פונים החוצה מהסליל
- במבט מלמעלה נראה כמו סליל עם חלל באמצע
- מופיע ברוב החלבונים באזורים שונים
- הממדים שלו קבועים יחסית
ביטא שיט (β-sheet)
- מתואר לרוב כ”סרטים” הנמתחים במקביל
- יוצר מבנה דמוי משטח (לא שטוח לגמרי)
- יכול להיות מקבילי (parallel) או אנטי-מקבילי (anti-parallel)
- קשרי מימן בין קבוצות NH ו-CO של שתי שרשראות פפטידיות שונות
- מספר רצועות ה-β-sheet יכול להשתנות
הצגת מבנה חלבונים
ישנן מספר דרכים להציג את מבנה החלבון בתצוגות מחשב או בספרים:
- שלד פפטידי בלבד - מציג רק את החיבורים בין חומצות האמינו ללא שיירים צדדיים
- לעתים עם קוד צבעים מאדום לכחול
- מבנים שניוניים - מציג אלפא הליקס כגלילים וביטא שיט כחצים
- דרך נוחה לראות את הארגון הכללי של החלבון
- תצוגת מקלות (wireframe) - כולל שיירים צדדיים כמבנה של מקלות
- מאפשר לראות חומצות אמינו ספציפיות (כמו טירוזין, ליזין, ארגינין)
- מודל space-filling - מציג כל אטום בגודלו היחסי האמיתי
- נותן תחושה של הטופוגרפיה והמשטחים של החלבון
מבנים מורכבים
Coiled-coil (סליל מסולסל)
- מבנה מורכב יותר המבוסס על אלפא הליקס
- שני סלילי אלפא הליקס המתלפפים זה סביב זה
- מאופיין ברצף חוזר של 7 חומצות אמינו (a, b, c, d, e, f, g)
- בעמדות a ו-d נמצאות חומצות אמינו הידרופוביות
- השיירים ההידרופוביים יוצרים “פס” לאורך האלפא הליקס
- שני הסלילים נסגרים יחד כך שהאזורים ההידרופוביים מסתתרים מהמים
- רוב השיירים ההידרופוביים הם ולין, לאוצין ואיזולאוצין
לאוצין זיפר (Leucine zipper)
- סוג ספציפי של מבנה coiled-coil
- בעמדות a ו-d יש ריכוז גבוה של לאוצין
- מאפשר לשתי תת-יחידות זהות של חלבון להיצמד זו לזו
- נפוץ בחלבונים שנקשרים ל-DNA כדי להפעיל גנים
- הצמדת שתי תת-היחידות הכרחית לתפקוד החלבון
דומיינים בחלבונים
- דומיין (Domain) - אזור בחלבון בעל מבנה ותפקוד עצמאיים יחסית
- בדרך כלל בין 350-40 חומצות אמינו
- פועלים כמו “קוביות לגו” מודולריות בבניית חלבונים מורכבים
- ניתן למצוא אותם דומיינים בחלבונים שונים
דומיינים ואבולוציה
- באבולוציה התרחש “ערבוב” של דומיינים ליצירת חלבונים חדשים
- חלבונים שונים יכולים לכלול אותם דומיינים בסידורים שונים
- יש משפחות של חלבונים המבוססות על דומיינים משותפים
דוגמאות לדומיינים בחלבונים
- חלבונים פשוטים:
- EGF (Epidermal Growth Factor) - פקטור גדילה המשפיע על התחלקות תאים
- טריפסין (Trypsin) - אנזים עיכול המפרק חלבונים במעי
- חלבונים מורכבים:
- פקטורי קרישת דם (פקטור 8, 9, 10) - משלבים דומיינים מחלבונים שונים
- פרוטאזות - אנזימים המפרקים חלבונים אחרים
- חלבוני מטריקס חוץ-תאי:
- מכילים מספר עותקים חוזרים של אותו דומיין (inline repeats)
- דוגמה: פיברונקטין טיפוס III - סדרה של דומיינים מסוג β-sheet
סיכום ביניים
- רצף חומצות האמינו (מבנה ראשוני) קובע את הקונפורמציה המרחבית של החלבון
- אינטראקציות לא קוולנטיות רבות מתאגדות יחד ליצירת מבנה יציב
- המבנים השניוניים (אלפא הליקס וביטא שיט) הם אבני הבניין הבסיסיות
- דומיינים פועלים כיחידות מודולריות בבניית חלבונים מורכבים
- המבנה המרחבי של החלבון קובע את תפקודו
דינמיות וקונפורמציה של חלבונים
- מבנה החלבון אינו קבוע ונוקשה כמו קיר
- חלבונים יכולים להיות דינמיים ולעבור בין קונפורמציות שונות
- אזורים שונים של השרשרת יכולים להתקרב זה לזה במרחב
- קצה אמיני וקצה קרבוקסילי יכולים להיות קרובים במרחב לאחר קיפול החלבון
- המבנה התלת-מימדי של חלבון קובע את הפעילות שלו
מבנה ותפקוד של חלבונים
- חלבונים מתורגמים על הריבוזום ומוצאים את מבנם התלת-מימדי
- לעיתים עוברים מודיפיקציות לאחר התרגום (post-translational modifications)
- חלבונים מכוונים למדורים שונים בתא
- בתאים איקריוטיים, הפעילות ממודרת ומחולקת בין מדורים שונים
קומפלקסים חלבוניים
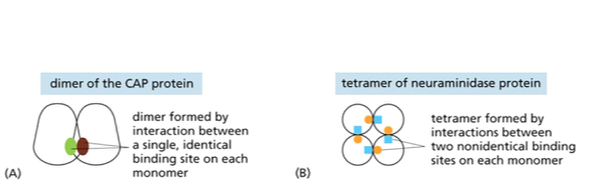
הומו-דימר (Homo-dimer)
- מורכב משתי תת-יחידות זהות של אותו חלבון
- אתר קישור זהה בכל תת-יחידה מאפשר להן להיצמד זו לזו
- יוצר משטח מגע באזור הקישור
- פעמים רבות החלבון פעיל רק כדימר ולא כמונומר
הומו-טטרמר (Homo-tetramer)
- מורכב מארבע תת-יחידות זהות של אותו חלבון
- כל תת-יחידה מכילה שני אתרי קישור שונים
- דוגמה: נוירו-אמינידאז - אנזים שפעיל רק במבנה הטטרמרי
חלבונים פולימריים
שלוש צורות ארגון בסיסיות של תת-יחידות חלבוניות זהות:
- דימר - שתי תת-יחידות בלבד
- הליקס - תת-יחידות רבות המסודרות במבנה סלילי ארוך
- טבעת - תת-יחידות היוצרות מבנה סגור (למשל, שמונה תת-יחידות בטבעת)
חלבונים סיביים
אקטין (Actin)
- כל מולקולה (מונומר) היא שרשרת פוליפפטידית אחת
- המונומרים מתפלמרים ליצירת סיבים ארוכים (אקטין פילמנטים)
- סיבי האקטין הם חלק מהשלד התוך-תאי (ציטוסקלטון)
- מבין שלושת סוגי השלד התוך-תאי, אקטין יוצר את הסיבים הדקים ביותר
סוגי שלד תוך-תאי נוספים
- מיקרוטובולים (Microtubules) - עבים יותר מאקטין, חלולים
- פילמנטים ביניים (Intermediate filaments) - בגודל ביניים בין אקטין למיקרוטובולים
מטריקס חוץ-תאי (Extracellular Matrix)
- תאים רבים מפרישים חלבונים אל מחוץ לממברנת התא
- החלבונים האלה מתפלמרים ויוצרים מבנים חזקים
- משמשים כ”דבק” המחזיק רקמות יחד
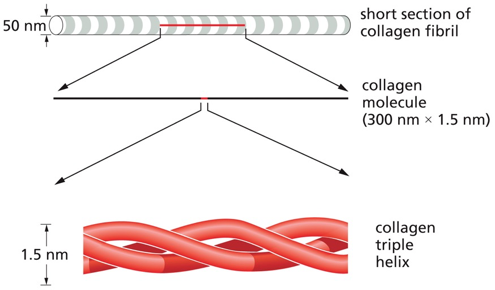
קולגן (Collagen)
- החלבון הנפוץ ביותר במטריקס החוץ-תאי
- מבחינת משקל, אחד החלבונים הנפוצים ביותר ביונקים
- יוצר סיבים בעלי חוזק מתיחה גבוה (“חוזק של פלדה”)
- מבנה מיוחד:
- סיבים באורך של עד 50 נאנומטר
- כל “מוט” באורך 300 נאנומטר, קוטרו פי 1/200 מאורכו
- מורכב משלוש שרשראות ארוכות של חלבון שמלופפות זו סביב זו (coiled-coil)
- השרשראות הן בעיקר אלפא-הליקסים
- בנוסף לקשרים לא קוולנטיים, יש מודיפיקציות ייחודיות היוצרות קשרים קוולנטיים בין השרשראות
- ניתן לראות “פספוס” אופייני במיקרוסקופ אלקטרונים
- נמצא בסחוס, גידים, עצמות ורקמות נוספות
הקולגן מורכב מ־שלוש שרשראות אלפא (α chains) המלופפות זו סביב זו במבנה שנקרא triple helix – זהו המבנה הקלאסי של קולגן מסוג I.
מבנים ביולוגיים מורכבים
חלבונים כאבני בניין
- חלבונים יכולים לשמש כאבני בניין בסיסיות למבנים גדולים מאוד
- לדוגמה: מבנה הקסגונלי - מרכז עם שישה “עלי כותרת” סביבו
- היתרון: שימוש באתרי קישור חוזרים מאפשר בנייה של מבנים מורכבים
- ניתן ליצור משטחים, גלילים חלולים ומבנים תלת-מימדיים מורכבים
- יתרון אבולוציוני: מעט מידע גנטי יכול לקודד למבנים מורכבים
וירוסים והרכבה עצמית
- וירוסים הם דוגמה בולטת למבנים מורכבים המורכבים מתת-יחידות חוזרות
- לדוגמה: אדנווירוס - אחראי לחלק גדול ממחלות החורף
- הקפסיד (מעטפת החלבון) מגן על הגנום הווירלי
- מעט מאוד מידע גנטי מקודד למבנה מורכב ומאורגן
- מנגנוני בקרת איכות מסלקים תת-יחידות פגומות
וירוס מוזאיקת הטבק (Tobacco Mosaic Virus)
- הווירוס הראשון שבודד (סוף המאה ה-19)
- תוקף צמחים רבים (לא רק טבק) וגורם לדפוס “מוזאיקה” אופייני בעלים
- מבנה פשוט יחסית: חלבון ו-RNA
- ניתן להרכיב וירוסים פעילים ממרכיבים מבודדים במבחנה
הרכבה עצמית והרכבה מתווכת
הרכבה עצמית (Self-assembly)
- מבנים ביולוגיים רבים מסוגלים להרכיב את עצמם
- כל המידע הדרוש להרכבה מקודד בחלבונים עצמם
- דוגמה: וירוס מוזאיקת הטבק - הרכבה מסודרת של חלבון ו-RNA
גורמי הרכבה (Assembly factors)
- במקרים רבים, נדרשים גורמים חיצוניים לסיוע בהרכבה
- גורמים אלה חיוניים לבנייה אך אינם חלק מהמבנה הסופי
- דומה לאנזים שנכנס ויוצא מהריאקציה באותו מצב
אינסולין - דוגמה להרכבה מתווכת
- האינסולין מורכב משתי שרשראות פוליפפטידיות (חרדל וירוק בתרשים)
- בתחילה מיוצר כשרשרת אחת ארוכה
- פרוטאזות (אנזימים) חותכות את השרשרת ומסלקות חלק ממנה
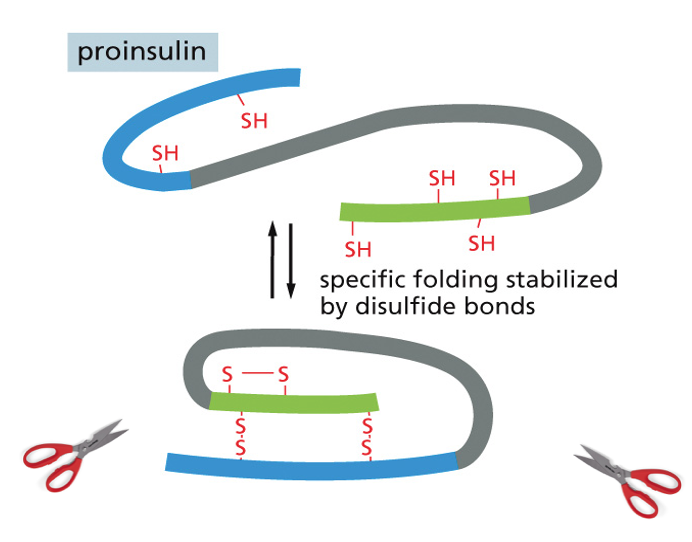
- התוצאה היא אינסולין פעיל
קשרים ייחודיים בחלבונים
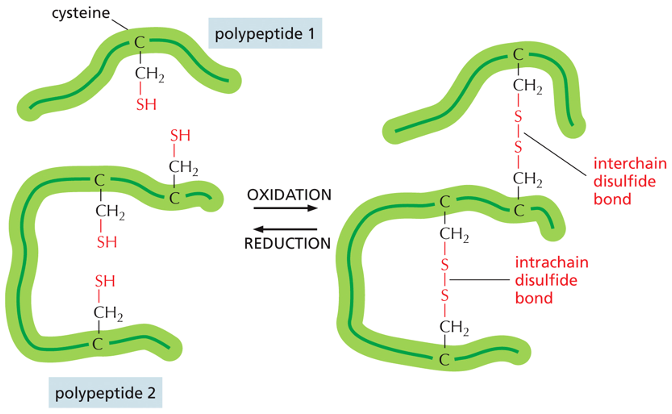
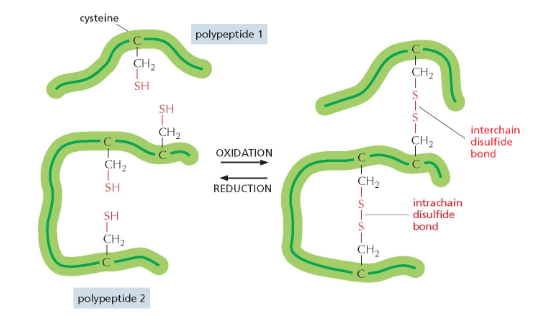
גשרים דיסולפידיים
- קשרים קוולנטיים בין שני אטומי גופרית
- נוצרים בין שיירי ציסטאין (חומצה אמינית עם קבוצת SH)
- יכולים לחבר אזורים שונים בתוך אותה שרשרת או בין שרשראות שונות
- מופיעים בחלבונים רבים, במיוחד אלה המופרשים מחוץ לתא (כמו נוגדנים)
- באינסולין, גשרים דיסולפידיים (מסומנים בצהוב בתרשים) מחברים את שתי השרשראות
שיעור 7 - חלבונים מבנה ותפקוד
תאריך: 21/04/2025חזקים בחלבונים?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא לחלבונים וגנטיקה
החומר על חלבונים הוא קריטי להמשך הקורס. חלק זה יתמקד במבנה ותפקוד חלבונים, ולאחר מכן יעבור לעקרונות יסוד בגנטיקה.
קשרים דיסולפידיים בחלבונים
קשרים דיסולפידיים (Disulfide) הם קשרים קוולנטיים הנוצרים בין שתי שרשראות צדדיות של חומצת האמינו ציסטאין. בניגוד לרוב הקשרים המייצבים את המבנה התלת-ממדי של חלבונים, שאינם קוולנטיים, קשרים דיסולפידיים הם יוצא דופן.
הקשר הדיסולפידי נוצר כאשר קבוצת SH בקצה השרשרת הצדדית של ציסטאין מגיבה עם קבוצת SH נוספת.
\[\text{R-SH + HS-R} \rightleftharpoons \text{R-S-S-R + 2H}^+ \text{ + 2e}^-\]יצירת קשר דיסולפידי תלוי במצב החמצון-חיזור של הסביבה. קשר כזה יכול להיווצר בין שתי שרשראות פוליפפטידיות שונות או בתוך אותה שרשרת, ובכך לייצב את המבנה השלישוני (הקיפול המרחבי) או הרביעוני (קומפלקס של מספר שרשראות) של החלבון.
סביבת חמצון-חיזור והשפעתה על קשרים דיסולפידיים
המעבר בין שני מצבי הקשר הדיסולפידי הוא תהליך חמצון-חיזור. בסביבה מחזרת, כמו הציטופלזמה של תאים, לא ייווצרו קשרים דיסולפידיים.
לעומת זאת, חלבונים המופרשים החוצה מהתא, כמו הורמון האינסולין, או חלבונים הממוקמים בממברנה החיצונית ופונים החוצה, נמצאים בסביבה מחמצנת. בסביבה מחמצנת, הקשרים הדיסולפידיים תורמים רבות ליציבות המבנה. דוגמה נוספת הם נוגדנים, שהמבנה שלהם מיוצב על ידי קשרים דיסולפידיים.
דוגמת האינסולין
אינסולין הוא דוגמה מצוינת לחלבון קטן (51 חומצות אמינו באדם) המיוצב על ידי קשרים דיסולפידיים. הוא מיוצר תחילה כפוליפפטיד ארוך, וחלק ממנו מסולק בתהליך ההבשלה לצורה הפעילה של ההורמון.
במבנה הסופי של אינסולין יש שלושה קשרים דיסולפידיים: אחד בתוך שרשרת ושניים בין השרשראות. כדי להגיע למבנה הסופי נדרשת עזרה של גורמי הרכבה (assembly factors) – פרוטאזות, חלבונים החותכים ברצף ספציפי של חומצות אמינו. זהו חלק מתהליך רב-שלבי הדרוש להבשלת אינסולין לצורתו הפעילה.
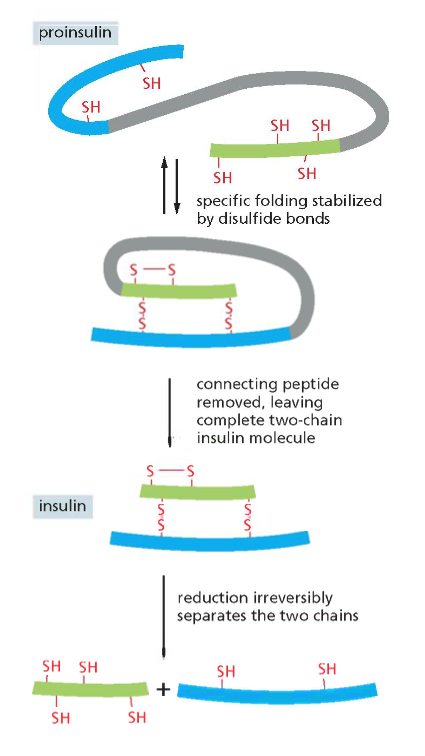
היכן נוצרים הקשרים הדיסולפידיים?
כפי שצוין, בציטופלזמה הסביבה היא מחזרת, ולכן קשרים דיסולפידיים אינם יכולים להיווצר שם. קשרים אלה נוצרים בתוך הרשתית האנדופלזמטית (ER), בחלל המימי (הלומן) הכלוא בממברנות ה-ER ומופרד מהציטופלזמה.
זוהי דוגמה ראשונה לעיקרון חשוב: חלבונים מגיעים לצורתם הבשלה והפעילה בתאים אאוקריוטיים דרך מדורים שונים. אם נחשוף אינסולין בשל לסביבה מחזרת, הקשרים הדיסולפידיים יתפרקו, והחלבון לא ידע ליצור מחדש את הקשרים בצורה הנכונה. כלומר, המבנה התלת-ממדי הסופי שלו תלוי ביצירה נכונה של הקשרים הדיסולפידיים ובפעילות חיצונית של גורמי ההרכבה.
אתרי קישור ומבנה תלת-ממדי
הפעילות הביולוגית של חלבונים תלויה בהיכרות מולקולרית ספציפית, והיכרות זו היא תלת-ממדית. עיקרון מרכזי בביולוגיה הוא שהמבנה התלת-ממדי של חלבונים קובע את פעולתם.
התאמה מדויקת במרחב
העיקרון המרכזי הוא של “Precise Fit” – התאמה תלת-ממדית מושלמת, כמו יד לכפפה או מפתח למנעול. אתרי קישור הם מקומות ספציפיים בחלבון המאפשרים אינטראקציה עם מולקולות אחרות. לעיתים, כל המידע לבניית המבנה הנכון כבר קיים ברצף החלבון, והקיפול נוצר בזכות התאמה תלת-ממדית.
ליגנדים ורצפטורים
באינטראקציות בין חלבונים למולקולות אחרות, משתמשים במונחים “ליגנד” (Ligand וגם ״קשיר״) ו”רצפטור”. ליגנד הוא מולקולה קטנה יחסית הנקשרת לחלבון. לדוגמה, אינסולין יכול להיחשב כליגנד כאשר הוא נקשר לרצפטור שלו. אתר הקישור בחלבון בנוי תלת-ממדית על ידי שיירים של חומצות אמינו הנמצאים במקומות שונים במבנה.
דוגמה: Cyclic AMP והחלבון הקושר אותו
הדוגמה במצגת מראה חלבון המכיר את המולקולה Cyclic AMP (cAMP), שליח משני חשוב בתא. החלבון יוצר כיס תלת-ממדי שבו הליגנד נקשר. חומצות האמינו היוצרות את הקשר יכולות להיות במקומות שונים לחלוטין ברצף הראשוני, אך הקיפול התלת-ממדי מקרב אותן ומאפשר את הקישור.
מבנה מולקולת ה-cAMP כולל בסיס חנקני (אדנין), סוכר ריבוז, וקבוצת פוספט הקשורה לפחמנים 5’ ו-3’ (יוצרת מבנה מעגלי).
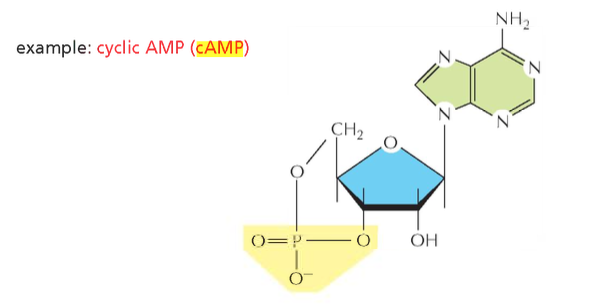
השפעת מוטציות על פעילות החלבון
מוטציה באחת מחומצות האמינו באתר הקישור עלולה לפגוע משמעותית בפעילות החלבון. לדוגמה, החלפת חומצת אמינו חיובית בשלילית עלולה ליצור דחייה אלקטרוסטטית שתפריע לאינטראקציה. לא תמיד ניתן לחזות במדויק את השפעת השינוי, אך השלב הראשון בניתוח הוא סימולציה תלת-ממדית, ולאחר מכן ניסויים לאימות התחזית.
אנזימים ופעילותם
ליזוזים - דוגמה לאנזים
ליזוזים הוא האנזים הראשון שהמבנה התלת-ממדי שלו פוענח (בשנות ה-60). זהו אנזים קטן, המהווה חלק ממערכת ההגנה מפני חיידקים. הוא חותך שרשראות של פפטידוגליקן, מרכיב עיקרי בדופן של חיידקים רבים. הליזוזים נמצא בחלבון ביצה, ברוק, בדמעות ובמוקוזה, שם הוא מופרש על ידי תאי אפיתל וגורם לליזיס (התפוצצות) של חיידקים.
מנגנון פעולה אנזימטי
האנזים ליזוזים פועל באופן הבא:
- הסובסטרט (שרשרת הרב-סוכר) נכנס לשקע (cleft) בחלבון.
- האנזים יוצר מתח (strain) על הסוכר במקום החיתוך, ובכך מתגבר על המחסום האנרגטי של הריאקציה.
- במהלך הריאקציה נוצר קשר קוולנטי זמני (transient) בין האנזים לסובסטרט.
- חומצת אמינו ספציפית באנזים קריטית לפעילות זו.
הריאקציה היא הידרוליזה (פירוק כימי בעזרת מים), המועדפת אנרגטית אך אינה מתרחשת ספונטנית עקב המחסום האנרגטי. האנזים מזרז את הריאקציה בכ-6 סדרי גודל (פי מיליון).
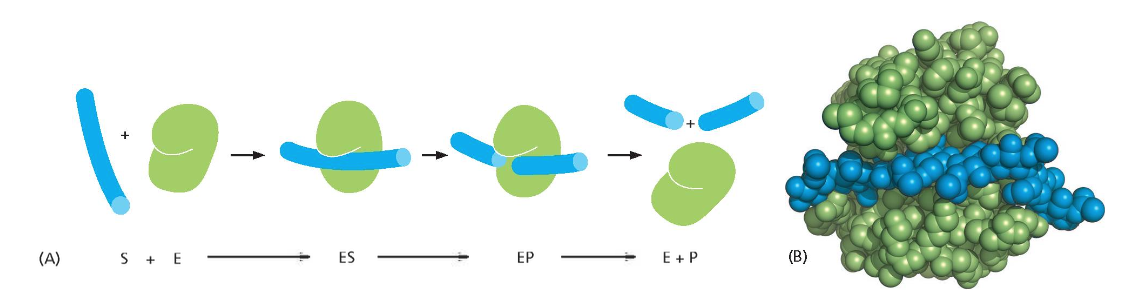
מנגנון פעולה אנזימטי - המשך
חומצות אמינו מסוימות בליזוזים הן קריטיות לא רק לקישור הסובסטרט אלא גם לריאקציה עצמה. במהלך הריאקציה נוצר מצב ביניים זמני וקצר-חיים. בשלב הבא, חומצת אמינו נוספת נכנסת לפעולה ומארגנת מולקולת מים בגיאומטריה מדויקת המאפשרת התקפה נוקלאופילית.
מצב הביניים נשבר, והאנזים חוזר למצבו המקורי. מולקולת המים מתחלקת בין שני צדי הקשר שנחתך, ונוצרים שני תוצרים המשתחררים מהאנזים. האנזים יכול לחזור על התהליך פעמים רבות, לבצע חיתוכים רבים במולקולות הפפטידוגליקן, עד שהחיידק אינו יכול לעמוד בנזק ועובר ליזיס. מכאן שמו של האנזים – ליזוזים.
חלבוני G - מתגים מולקולריים
חלבוני G הם משפחה של חלבונים הקושרים GTP (גואנוזין תלת-פוספט) ופועלים כאנזימים המפרקים אותו ל-GDP ופוספט. החלבון עובר בין שני מצבים: מצב “פעיל” (on) כאשר הוא קושר GTP, ומצב “כבוי” (off) כאשר הוא קושר GDP.
חלבונים אלו משמשים כמתגים מולקולריים (molecular switches). במצב “פעיל”, החלבון מפעיל שרשרת של חלבונים אחרים. המעבר בין המצבים אינו ספונטני ודורש חלבוני עזר.
דוגמה: חלבון RAS
RAS הוא חלבון מפורסם ממשפחה זו. מוטציות בגן המקודד ל-RAS נמצאות בכ-50% מהגידולים הסרטניים באדם. במבנה של RAS יש אתר קישור ל-GTP. ההידרוליזה של GTP ל-GDP גורמת לשינוי במבנה התלת-ממדי של החלבון, בעיקר באזורים הנקראים “switch helix”.
כאשר RAS במצב “פעיל”, הוא מעודד חלוקות תא. מוטציה הגורמת לו להישאר “תקוע” במצב הפעיל מובילה לחלוקות תאים בלתי מבוקרות – מאפיין מרכזי של סרטן. טעינה מחדש של החלבון ב-GTP דורשת אנרגיה, מה שמדגים את העיקרון שתאים משקיעים אנרגיה רבה בשמירה על סדר.
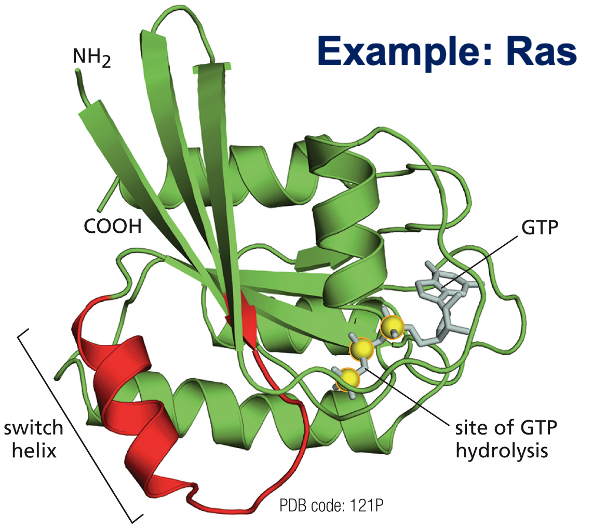
מערכת האוביקוויטין ופירוק חלבונים
בסיום פרק החלבונים, יש להזכיר את אברהם הרשקו ואהרן צ’חנובר, שקיבלו פרס נובל בשנת 2004 על גילוי מערכת האוביקוויטין.
אוביקוויטין הוא חלבון קטן (76 חומצות אמינו). מערכת שלמה בתא מחברת אוביקוויטין לחלבונים אחרים. האוביקוויטין נקשר לחלבונים דרך קבוצת צד של חומצת האמינו ליזין, בקשר הנקרא “קשר איזופפטידי” (isopeptide bond).
חיבור של מולקולות אוביקוויטין לחלבון מהווה מעין “קוד” נוסף, המשפיע על פעילותו. אחת הפעילויות החשובות של קוד זה היא סימון חלבונים לפירוק (degradation). לכל חלבון יש אורך חיים אופייני, והמערכת מסמנת חלבונים פגומים או כאלה שהגיע זמנם להתפרק. תגלית זו פתחה תחום שלם בביולוגיה.
מבוא לעקרונות בסיסיים בגנטיקה
חלק זה של הקורס יעסוק בעקרונות של תורשה, גנטיקה וחלוקת תא. זהו מבוא למושגי יסוד שיידרשו בהמשך.
הנזיר מנדל והתחלת הגנטיקה המודרנית
גרגור מנדל, נזיר שעסק בגנטיקה של צמחי אפון, הניח את היסודות לגנטיקה המנדלית הבסיסית. במשך מאות שנים, בני אדם ניסו להשביח זנים של בעלי חיים וצמחים מבלי להבין את עקרונות התורשה לעומק.
שלושה ענקי מדע שהניחו את היסודות לגנטיקה המודרנית
במחצית השנייה של המאה ה-19, שלושה מדענים הניחו את היסודות לגנטיקה ולביולוגיה מודרנית:
צ’רלס דרווין
דרווין פיתח את תורת האבולוציה, המהווה רקע לכל הקורסים הביולוגיים. תובנותיו התבססו על תצפיות, כמו אלו שערך באיי גלאפגוס על מיני הפרושים. עקרון הברירה הטבעית שהציע מסביר כיצד תכונות יעילות נוטות להישמר באוכלוסייה. הבעיה של דרווין הייתה חוסר ידע בגנטיקה, והוא לא הכיר את עבודתו של מנדל.
גרגור מנדל
מנדל עקב אחר שבע תכונות ברורות של צמחי אפון, תוך שימוש בזנים טהורים וגישה כמותית. הוא גילה שני חוקים חשובים:
- החוק הראשון של מנדל: שני האללים של כל גן נפרדים זה מזה בעת יצירת הגמטות.
- החוק השני של מנדל: גנים שונים מתנהגים באופן בלתי תלוי זה בזה.
תגליותיו נותרו לא ידועות במשך כ-30 שנה.
ולטר פלמינג
פלמינג ערך תצפיות מיקרוסקופיות וצייר תאים מתחלקים. הוא טבע את המונח “כל תא מקורו בתא קודם” (Omnis cellula e cellula) וזיהה את הכרומטין, הכרומוזומים והמיטוזה.
ספרות מומלצת לגנטיקה
לנושא הגנטיקה, ספר מומלץ הוא “Genetics” של Brooker.
מושגי יסוד בגנטיקה
- גונדות: (Gonads) בלוטות המין (שחלות, אשכים).
- גמטות: (Gametes) תאי המין (ביציות, זרעונים).
- זיגוטה: (Zygote) הביצית המופרית, התא הראשון של אורגניזם חדש.
- תאים סומטיים: (Somatic cells) כל תאי הגוף שאינם תאי מין.
הגונדות מייצרות את הגמטות. איחוי הגמטות יוצר את הזיגוטה. לפני איחוי הגמטות מתרחש שכפול DNA, עיקרון המבוסס על מבנה הסליל הכפול. המודל המתואר הוא של רבייה מינית.
גמטות והחוקים של מנדל
יצירת הגמטות והפרדת זוגות הגנים הם תהליכים שמנדל הבין, והקישור ביניהם הוא סיפורה של הביולוגיה המודרנית. החלוקה היוצרת את הגמטות מתרחשת בגונדות והיא חלוקה מיוחדת המפחיתה את המטען הגנטי.
מושגי יסוד נוספים
תאי גוף הם תאים סומטיים. מוטציות סומטיות (כמו ב-RAS) מתרחשות בתאי גוף ואינן עוברות בתורשה.
- רבייה לא מינית: יוצרת את התאים הסומטיים.
- רבייה מינית: מתרחשת בגונדות ויוצרת את הגמטות.
המושג “סומא” מתייחס לכל מה שאינו שייך לקו הנבט (germ-line cells). בקו הנבט מתרחשת חלוקה מיוחדת לפי חוקי מנדל. מושג חשוב נוסף הוא “אלל” – אחד משני העותקים של גן.
דוגמאות לתורשה מנדלית
מנדל עבד עם צמחי אפון, שבהם איברי מין זכריים ונקביים נמצאים באותו פרח, מה שמאפשר הפריה עצמית. הוא ביצע הכלאות מבוקרות בין זן סגול לזן לבן. לאחר שזרע את האפונים שנוצרו, הוא עקב אחר שלושה דורות.
דומיננטיות ורצסיביות
התכונה של צבע סגול נמצאה כדומיננטית על פני צבע לבן, מכיוון שבדור הראשון כל הפרחים היו סגולים. האלל הלבן לא נעלם, אלא הופיע מחדש בדור השני. זו הייתה פריצת הדרך של מנדל: קיימים “פקטורים” (גנים) שאינם מתערבבים. היחס בדור השני היה 3 סגולים לכל 1 לבן.
האם דומיננטי = חזק/טבעי ורצסיבי = חלש/פגום?
התכונה הדומיננטית היא זו הנראית חיצונית (פנוטיפ). הגנוטיפ כולל את שני האללים. אין להניח שתכונה דומיננטית היא “חזקה” או “טבעית” ושתכונה רצסיבית היא “חלשה” או “פגומה”. לדוגמה, עיניים כחולות הן תכונה רצסיבית.
במקרה של צבע הפרח, ייתכן שהגן מקודד לאנזים המייצר פיגמנט, ובפרח הלבן האנזים אינו פעיל. אך זה לא תמיד המצב. למעשה, ארבע מהתכונות שמנדל בדק הן רצסיביות והן הנפוצות ביותר בטבע בצמחי אפון.
דוגמה למלאנין והקשר בין גנטיקה וביולוגיה מולקולרית
דוגמה זו מחברת בין הדוגמה המרכזית של הביולוגיה ($\text{DNA} \rightarrow \text{RNA} \rightarrow \text{protein}$) לגנטיקה קלאסית. היא עוסקת ביצירת מלאנין, פיגמנט בעור, בעיניים ובשיער. בתא עור (מלנוציט) עם שני עותקים של האלל הדומיננטי (A):
- שני עותקי ה-DNA מתועתקים ל-RNA.
- נוצר פוליפפטיד המתקפל לאנזים פעיל (טירוזינאז).
- האנזים מייצר מלאנין מהסובסטרט טירוזין.
אם יש פגם באלל אחד בלבד (מצב הטרוזיגוטי), לרוב עדיין ייווצר מלאנין, מכיוון שהעותק השני של הגן תקין. רק כאשר שני העותקים של הגן פגומים (למשל, עקב מוטציה המשנה חומצה אמינית באתר הפעיל), לא נוצר אנזים פעיל כלל, ומלאנין לא נוצר.
זוהי הדוגמה של אלביניזם. במקרה זה, האלל המוטנטי הוא רצסיבי וגורם לחוסר פעילות של האנזים (loss of function).
חלוקת תא - מיטוזה ומיוזה
קיימת חלוקה לא מינית (סומטית) וחלוקה מינית, שהיא הבסיס לחוקי מנדל.
- הפלואידי (n): עותק אחד מכל גן בגנום.
- דיפלואידי (2n): שני עותקים מכל גן.
החלוקה המינית, מיוזה, מתרחשת בגונדות ויוצרת תאים הפלואידים (גמטות). לאחר הפריה, הזיגוטה חוזרת למצב דיפלואידי.
מיטוזה - חלוקה לא מינית
מיטוזה היא חלוקה לא מינית שבה תא אחד מתחלק לשני תאי בת זהים גנטית. לפני החלוקה, כל כרומוזום מוכפל בתהליך שכפול DNA. כל כרומוזום נכנס לחלוקה עם שתי זרועות זהות הנקראות “כרומטידות אחיות”. כל כרומטידה היא מולקולת DNA אחת. במהלך המיטוזה, הכרומטידות האחיות נפרדות. מטרת המיטוזה היא לשמר את המידע הגנטי הקיים.
מיוזה - חלוקה מינית
מיוזה כוללת שתי חלוקות עוקבות ללא שכפול DNA נוסף ביניהן. במיוזה מתרחשים שני תהליכים חשובים:
- הפחתת המטען הגנטי: מדיפלואידי להפלואידי.
- יצירת שונות גנטית.
במהלך המיוזה, כרומוזומים הומולוגיים (אחד מהאם ואחד מהאב) נצמדים זה לזה. בשלב זה יכול להתרחש תהליך של “שחלוף” (crossing over), שבו קטעים של כרומוזומים מוחלפים ביניהם, מה שיוצר ערבוב גנטי.
כך, אללים שונים של אותו גן (למשל, A ו-a) נפרדים זה מזה (החוק הראשון של מנדל). בנוסף, גנים שונים (למשל, A/a ו-B/b) יכולים להתנהג באופן בלתי תלוי (החוק השני של מנדל). השחלוף הוא מנגנון מורכב העומד בבסיס השונות הגנטית.
סיכום
לחלוקה המינית (מיוזה) שתי מטרות עיקריות: הפחתת המטען הגנטי ויצירת שונות גנטית רבה. זו הסיבה ששילובים של תכונות בצאצאים יכולים להיות שונים מהצפוי, במיוחד כאשר עוקבים אחר גנים רבים בו-זמנית.
| נושא | מונחים חשובים | תהליך עיקרי | דוגמה |
|---|---|---|---|
| קשר דיסולפידי | Cys, SH, S-S | חיזור/חמצון | אינסולין |
| חוקי מנדל | אלל, גנוטיפ | הפרדת אללים | אפונים: סגול/לבן |
| חלוקת תא | מיטוזה/מיוזה | שכפול כרומוזומים | זיגוטה ← הפלואידי |
| חלבון-ליגנד | אתר קישור, התאמה תלת ממדית | אינטראקציה ספציפית | cAMP |
| אנזימים | סובסטרט, אתר פעיל | הידרוליזה | ליזוזים |
| RAS | GTP ↔ GDP | מתג מולקולרי | סרטן |
| אוביקוויטין | ליזין, פירוק | isopeptide | הרשקו & צ’חנובר |
שיעור 8 - ממברנות וליפיד ביילר
תאריך: 23/04/2025מבוא לקורס
הקורס יכלול מספר הרצאות, עם הפוגות לשמירה על סדר נושאים קוהרנטי. כל מרצה מתמקד בתחום התמחותו.
הערה חשובה: לאורך ההרצאות, ייתכנו חזרות על נושאים שכבר נלמדו או שיילמדו בהמשך. החזרתיות מכוונת ומטרתה לחזק מושגים ולהציגם מכמה זוויות. הקורס מתמקד בעקרונות ובדוגמאות מרכזיות, מבלי להיכנס לעומק רב מדי בכל נושא.
מהו יצור חי?
[בשקופית מוצגים ארבעה פריטים ונשאלת השאלה מה יוצא דופן]
מה יוצא דופן בשקופית?
האבן היא היוצאת דופן כי היא אינה חיה.
הפעולה הזו, של זיהוי חיים, היא מורכבת. ביולוגים ופילוסופים יכולים לעסוק במשך שנים בשאלה: איך מגדירים מהו יצור חי ומה אינו חי? אין הגדרה מדויקת, כי לכל הגדרה יש יוצאים מן הכלל.
מהי ההגדרה של יצור חי?
“משהו שמתרבה” – זו תשובה נפוצה, אך יש יצורים חיים שאינם מתרבים. פרד, למשל, אינו יכול להתרבות, וברור שהוא חי. גם בני אדם לאחר גיל הפוריות הם עדיין יצורים חיים.
לכל הגדרה שתוצע – בין אם זו העברת מידע, מטבוליזם, או כל דבר אחר – תמיד ניתן למצוא יוצא מן הכלל שמראה שההגדרה אינה מספקת.
הבעיה בזיהוי חיים מחוץ לכדור הארץ היא הציפייה למצוא חיים כפי שהם מוכרים לנו. ייתכן שצורות חיים אחרות פועלות בצורה שונה לחלוטין. תיאוריה הנקראת “Assembly Theory” גורסת כי מה שמגדיר חיים הוא מורכבות – כאשר עוברים מספר מסוים של תגובות, ההסבר הסביר ביותר הוא קיום חיים, ולא תהליך אקראי.
חשיבות הממברנות
למרות הקושי להגדיר חיים באופן מדויק, יש דבר אחד משותף לכל היצורים החיים: כל אורגניזם וכל יצור חי, התאים שלו מוקפים בממברנה. מאפיין זה נפוץ ושמור בכל ממלכת החיים. הממברנות נראות דומות ופועלות בצורה דומה בכל היצורים החיים, מה שמרמז על התפתחות החיים מאב קדמון משותף.
מדוע ממברנות חיוניות לחיים?
התפקיד החשוב ביותר של הממברנה הוא הפרדה בין חוץ לפנים.
לא ניתן ליצור חיים ללא הפרדה זו. אם ניקח בריכה ענקית ונשפוך לתוכה DNA, DNA פולימראז וכל מה שדרוש לתא כדי לפעול – לא יקרה דבר, כי הבריכה גדולה מדי והחומרים לא ייפגשו זה את זה.
ההפרדה הזאת חיונית גם בתוך התאים. לדוגמה:
- ה-DNA נמצא בתוך הגרעין, מוקף בממברנה.
- מערכת החיסון מזהה DNA חופשי כסימן לפולש (כמו וירוס), ולכן חשוב שה-DNA יהיה מוקף ומוגן.
- המיטוכונדריה פועלת על מפל ריכוזים שנשמר הודות לממברנה.
- סינפסות עצביות משחררות וזיקולות (בועיות מוקפות ממברנה) עם נוירוטרנסמיטורים.
כל אלה מדגישים את חשיבות הממברנות לקיום החיים.
ליפיד ביילר (lipid bilayer) - המבנה הבסיסי של ממברנות
כעת נדון במאפייני הממברנות ולאחר מכן בחלבונים המשולבים בהן.
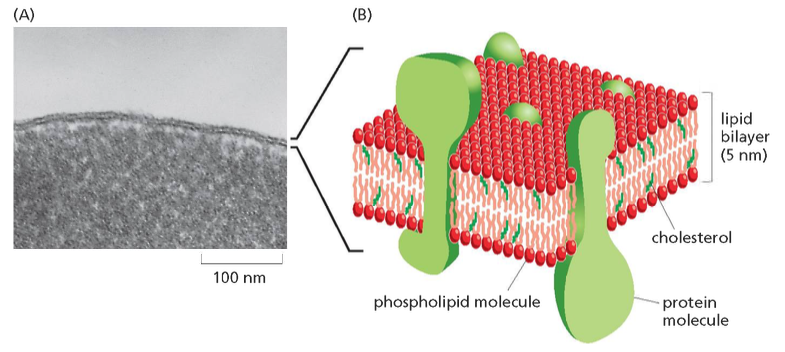
מבנה הליפיד ביילר
למרות שיש סוגים שונים של ממברנות עם תפקידים שונים, כולן נראות דומות למדי. המבנה הבסיסי הוא ליפיד ביילר (שכבה כפולה של ליפידים).
מה הרעיון כאן? רוב הגוף נמצא בסביבה מימית. הליפיד ביילר מורכב משתי שכבות:
- החלק החיצוני - פונה אל הסביבה המימית, הן מחוץ לתא והן בתוכו.
- החלק הפנימי - מורכב מהשומנים עצמם.
השומנים הם הידרופוביים (דוחים מים) ולכן אינם רוצים להיות בסביבה מימית. הם מעדיפים להיות בסביבה של שומנים אחרים. מבנה זה מסתדר בצורה ספונטנית: השומנים מתחברים זה לזה, והקבוצות הפולריות פונות לסביבה המימית.
כך זה נראה במיקרוסקופ אלקטרונים – ניתן לראות שתי שכבות כהות (אלקטרון-דנס) שהן שתי השכבות של הממברנה.
בגלל שהחלק הפנימי הוא שומני ודוחה מים, הממברנה אינה מאפשרת מעבר חופשי של מים ומולקולות מסיסות במים. זה מאפשר לממברנה לבצע את תפקידה העיקרי – הפרדה בין חוץ לפנים.
חלבוני ממברנה
הממברנות בתאים אינן מורכבות רק משומנים, אלא גם מחלבונים רבים שתקועים בתוכן. לחלבונים האלה יש מגוון גדול של תפקידים, והם חיוניים לתפקוד התא. התא זקוק לחלבוני הממברנה כדי לתקשר עם תאים אחרים, לשמור על מיקומו, ולבצע פעולות רבות אחרות.
פוספוליפידים - אבני הבניין של הממברנה
הליפיד ביילר מורכב בעיקר ממולקולות הנקראות פוספוליפידים. הן נקראות כך כי:
- יש להן אזור של קבוצת פוספט (בצבע צהוב בשקופית)
- יש להן אזור של ליפיד (שומן)
מהו בדיוק הליפיד? זוהי שרשרת של פחמימנים שהיא מאוד הידרופובית (דוחה מים). לעומת זאת, הראש של קבוצת הפוספט הוא פולרי, מרגיש בנוח בסביבה מימית, ואינו רוצה להיצמד לאזורים הידרופוביים.
פוספוליפידים - ראש פולרי (הידרופילי) וזנבות הידרופוביים
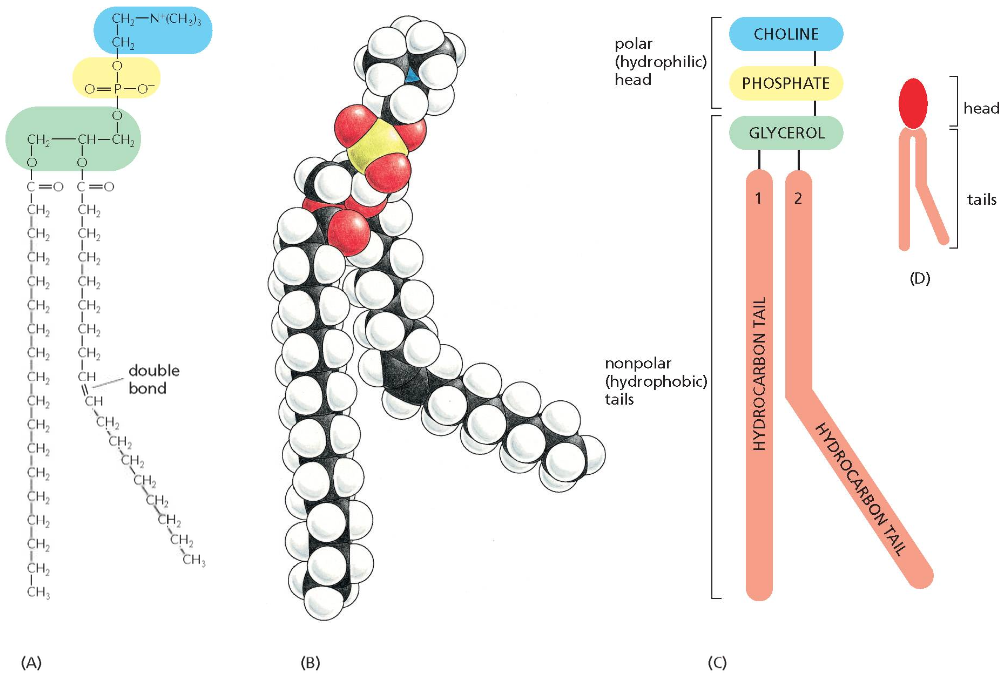
סוגי שרשראות שומן
הזנבות של הפוספוליפידים יכולים להיות משני סוגים עיקריים:
- שרשרת רוויה - אין בה קשרים כפולים והיא ישרה לחלוטין (שומן רווי במזון)
- שרשרת בלתי רוויה - יש בה קשרים כפולים והיא מעוקלת
ההבדל חשוב מאוד: כאשר השרשראות ישרות (רוויות), הן יכולות להיות מסודרות בצורה צפופה. זה יוצר ממברנה צמיגית, קשיחה ופחות גמישה.
\[\begin{array}{ccc} \vert & \hline & \\ \ce{CH2} & \ce{CH2} & \ce{CH2} \\ \vert & \hline & \\ \ce{CH2} & \ce{CH2} & \ce{CH2} \\ \end{array}\]לעומת זאת, כאשר השרשראות מעוקלות (בלתי רוויות), הן אינן יכולות להיות צפופות כל כך, מה שהופך את הממברנה לגמישה ולפלואידית יותר.
\[\begin{array}{ccc} & \ce{CH2} & \\ & \vert & \\ & \ce{CH2} & \\ & \vert & \\ & \ce{CH2} & \\ \end{array}\]יש לכך השלכות בריאותיות: צריכה של הרבה שומן רווי גורמת לכך שהתאים מכניסים לממברנה שומנים רוויים, ועל כן מאבדים מהגמישות שלהם. זה יכול לגרום לבעיות במעבר דם בעורקים, התקפי לב, שבץ ובעיות דומות.
כולסטרול בממברנה
בין הפוספוליפידים משתלבות גם מולקולות שומניות אחרות. הדוגמה הקלאסית היא כולסטרול.
הכולסטרול מורכב מחלק הידרופילי קטן וחלק שומני גדול. כאשר הכולסטרול נתקע בין הפוספוליפידים, הוא מוסיף להם חוזק. מדוע? כי השרשראות השומניות באופן טבעי נמצאות בתנועה מתמדת, והכולסטרול – שהוא קשיח יחסית – מונע מהן לזוז.
זו סיבה נוספת לכך שצריכת כולסטרול מופרזת או רמות גבוהות של כולסטרול בגוף עלולות להיות מסוכנות: הממברנות מאבדות מהפלואידיות שלהן, מה שמקשה על כדוריות הדם לעבור בנימי הדם הקטנים.
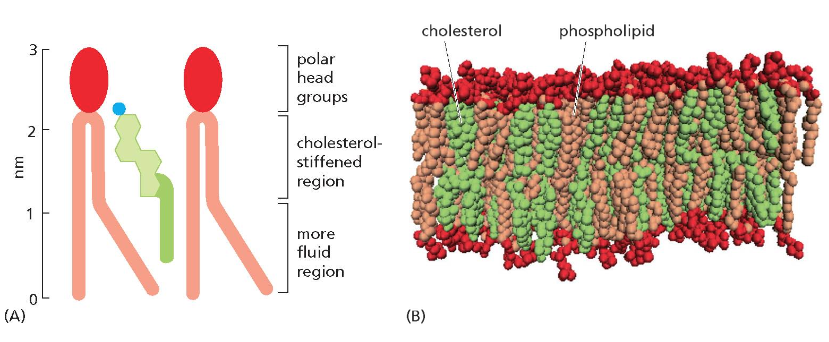
הכולסטרול מייצב את הממברנה
כולסטרול “טוב” וכולסטרול “רע”
חשוב להבין: ההבחנה בין כולסטרול “טוב” (HDL) וכולסטרול “רע” (LDL) נוגעת לאופן שבו הכולסטרול מועבר בזרם הדם, לא לכולסטרול עצמו.
הכולסטרול אף פעם לא מסתובב לבד בדם, אלא תמיד עם חלבונים. החלבונים הללו יכולים להופיע בצפיפות גבוהה (HDL) או בצפיפות נמוכה (LDL). ההבחנה בין טוב לרע מגיעה מקורלציה – אנשים בריאים בדרך כלל היו עם HDL גבוה, ואנשים חולים עם LDL גבוה.
HDL (High-Density Lipoprotein)
LDL (Low-Density Lipoprotein)
מערכת הכולסטרול בגוף מורכבת ומתוחכמת. היא התגלתה על ידי מייקל בראון וג׳וזף גולדשטיין בשנות ה-70 (זכו על כך בפרס נובל). הגוף מייצר כולסטרול וגם צורך אותו מהמזון. לפי כמות הכולסטרול בדם, התאים יודעים כמה כולסטרול לייצר או לפרק. כשיש יותר מדי כולסטרול, התא מאחסן אותו בבועיות שומן (ליפיד דרופלטס).
התארגנות עצמית של ממברנות
תכונה מדהימה של ממברנות, שמובילה חוקרים לחשוב שאולי חיים התחילו מממברנות ולא מ-DNA או RNA, היא שממברנות יכולות להיווצר באופן ספונטני.
כאשר יש מולקולה פולרית כמו אצטון, החמצן שבה מרגיש בנוח עם החמצן והמימנים של המים, ולכן אצטון מתערבב היטב במים. לעומת זאת, מולקולה הידרופובית כמו מתיל-פרופן לא תיצור אינטראקציה עם מים.
כלומר, כשיש מולקולות הידרופוביות בתוך מים, הן ינסו להתרחק ככל האפשר מהמים ולהתקרב זו לזו. זה קורה ללא השקעת אנרגיה – תהליך ספונטני.
בטבע, אורגניזמים תמיד שואפים להיות יעילים מבחינה אנרגטית. היעילות במערכת של ממברנות היא שלא צריך להשקיע אנרגיה כדי שהממברנות ייסגרו – הן פשוט מסתדרות מעצמן.
ניתן לראות זאת גם במערכות מלאכותיות כמו מיצלות (להלן), שבהן יש פוספוליפיד עם זנב אחד במקום שניים. כשמכניסים הרבה מולקולות כאלה למים, הן מסתדרות בצורת כדור שהצד הפנימי שלו הידרופובי והצד החיצוני פולרי. התהליך קורה מעצמו.
תכונה זו חשובה גם לתעשיית התרופות, שבה משתמשים בעקרון זה ליצירת מערכות להובלת תרופות.
מערכות שומניות מלאכותיות ושימושיהן
ליפוזומים ויישומים רפואיים
בתעשיית התרופות קיים אתגר משמעותי: לא ניתן לתת לבני אדם חומר שאינו מסיס במים. אם תרופה אינה מסיסה במים, יש שתי אפשרויות:
- להמיס אותה בשמן (פתרון בעייתי).
- למצוא דרך אחרת להעביר את התרופה.
אחד הפתרונות המוצלחים הוא שימוש במיצלות (micelles) – מבנים כדוריים המורכבים מפוספוליפידים עם זנב אחד. כאשר מכניסים תרופה הידרופובית למיצלה, היא נכנסת לחלק השומני הפנימי וכך ניתן להעביר אותה בגוף.
המיצלות נוצרות בתהליך של “מניפולציה” – לוקחים מולקולות פוספוליפידיות עם זנב אחד, ובתהליכים של חימום, קירור וניעור, המולקולות מוצאות זו את זו ומסתדרות באופן ספונטני למבנה כדורי.
לעומת זאת, כאשר משתמשים בפוספוליפידים עם שני זנבות, נוצר הליפיד ביילר (שכבה כפולה של שומנים) כמו שיש בממברנת התאים שלנו.
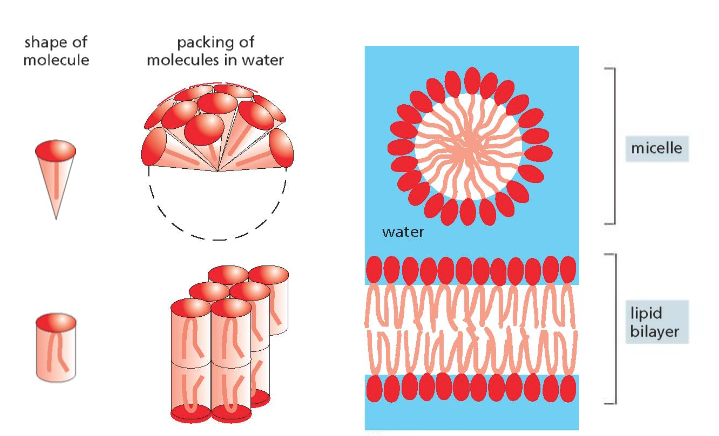
ליפוזומים
ליפוזום הוא מבנה מלאכותי לחלוטין המשמש בתעשיית התרופות. בניגוד למיצלה, שבה המרכז הוא הידרופובי (שומני), בליפוזום המרכז מכיל מים. הליפוזום מורכב משכבה כפולה של פוספוליפידים (ליפיד ביילר), בדומה לממברנה תאית, אך ללא חלבונים.
הליפוזומים שימושיים במיוחד כאשר רוצים להכניס לגוף חומרים הידרופיליים (מסיסים במים) שלא רוצים שיתפרקו בדרך. לדוגמה, בחיסון הקורונה, ה-mRNA מוכנס לתוך ליפוזומים כדי למנוע את פירוקו על ידי אנזימי RNase הנמצאים בזרם הדם. הליפוזומים מגנים על ה-mRNA עד שהם מתמזגים עם ממברנת התא ומשחררים את תוכנם לתוך התא.
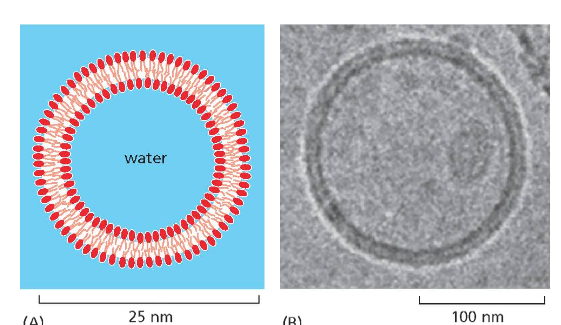
הליפוזומים שימשו גם למחקר בסיסי על ממברנות. בניגוד לתאים חיים, שהם מורכבים ודורשים תנאים מיוחדים, ליפוזומים הם מערכת פשוטה ומלאכותית שקל לחקור.
| מיצלה | ליפוזום |
|---|---|
| בנויה מפוספוליפידים עם זנב אחד | בנוי מפוספוליפידים עם שני זנבות |
| מרכז הידרופובי (שומני) | מרכז הידרופילי (מימי) |
מאפיינים פיזיקליים של ממברנות
פלואידיות של ממברנות
ממברנות מתנהגות כמו נוזל צמיג (fluid-like). זה נראה בניסוי עם “פינצטת לייזר” (Laser tweezers) – שיטה שזכתה בפרס נובל, המאפשרת לתפוס חלקיקים בסקאלה ננומטרית באמצעות קרן לייזר.
כאשר תופסים חלק מממברנה עם פינצטת לייזר ומושכים אותה, הממברנה נמתחת ואינה נשברת. זה מעיד על תכונות נוזליות של הממברנה – המולקולות בממברנה יכולות לנוע זו ביחס לזו. אם הממברנה הייתה מוצק, היא הייתה נשברת כשמושכים אותה.
הפלואידיות של הממברנה חשובה להבנת התנהגות החלבונים והמולקולות שנמצאות בה - הם אינם קבועים במקום, אלא יכולים לנוע בתוכה.
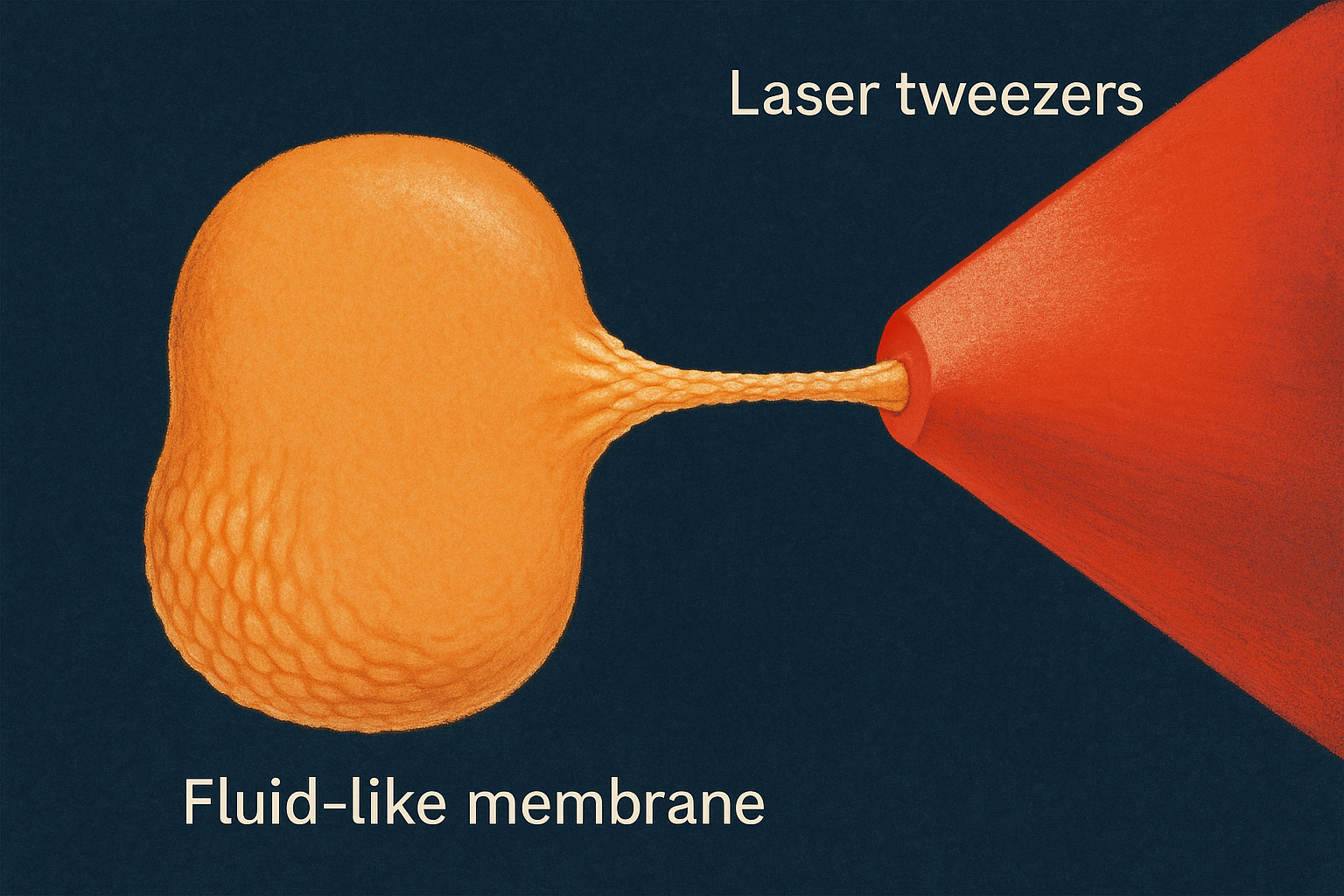
תנועת פוספוליפידים בממברנה
הדמיות מחשב מראות שפוספוליפידים בממברנה נמצאים בתנועה מתמדת. הם יכולים:
- לנוע אופקית בתוך אותו מישור של הממברנה.
- להסתובב במקומם.
- לעבור בין המישור החיצוני והפנימי של הממברנה (אם כי זה נדיר).
בנוסף, הממברנה אינה מישורית לגמרי – יש בה בליטות וכיפופים, והיא דינמית ונמצאת בתנועה מתמדת.
למה תאים לא מתמזגים באופן ספונטני?
אם פוספוליפידים נמשכים זה לזה, והממברנות נוטות להיסגר באופן ספונטני, מדוע תאים אינם מתמזגים ספונטנית זה עם זה?
הסיבה: כאשר תא מייצר פוספוליפידים, החלק הפולרי שלהם מיד נעטף במולקולות מים. כדי להזיז את מולקולות המים האלה, נדרשת השקעת אנרגיה. לכן, אם נביא שתי ממברנות קרובות זו לזו, לא יקרה דבר – שכבת המים תמיד מפרידה בין הראשים הפולאריים.
מיזוג ממברנות בתאים דורש תהליך אקטיבי, עם חלבונים מיוחדים והשקעת אנרגיה. טוב שכך, כי מיזוג ספונטני של ממברנות היה קטסטרופלי לחיים.
התאמת הממברנה לתפקיד ולסביבה
גודל התא וקביעתו
אחת השאלות המעניינות בביולוגיה היא: איך תא “יודע” באיזה גודל עליו להיות?
אין תשובה חד-משמעית לשאלה זו. הגודל הוא תוצאה של שילוב גורמים:
- יציבות אנרגטית
- הפעולה שהתא צריך לבצע
- סביבת התא
לדוגמה, בגוף האדם, התא הגדול ביותר הוא הביצית והקטן ביותר הוא תא דם אדום – שניהם תאים בודדים, אך בגדלים שונים מאוד. הגודל נקבע על ידי שיווי משקל בין המגבלות הפיזיקליות, הסביבה, והתפקיד שהתא צריך למלא.
התאמת הממברנה לטמפרטורה
יונקים משקיעים אנרגיה רבה כדי לשמור על טמפרטורה יציבה (כ-37 מעלות צלזיוס). לעומת זאת, צמחים, חיידקים ופטריות חשופים לשינויי טמפרטורה קיצוניים – מקפיאה בלילה ועד 40 מעלות ביום.
יצורים אלה צריכים להתאים את הרכב השומנים בממברנה שלהם בהתאם לסביבה:
- ארכאונים שחיים בתנאים קיצוניים (כמו בגייזרים של ילוסטון) בעלי שרשראות שומן ארוכות ורוויות, המעניקות לממברנה חוזק ועמידות לטמפרטורות גבוהות.
- יצורים שחיים מתחת לקרח באנטארקטיקה בעלי יותר חומצות שומן בלתי רוויות, המונעות מהממברנה לקפוא.
זאת דוגמה יפה להתאמה אבולוציונית של מבנה מולקולרי לסביבה.
הדמיית מחשב של ממברנות
הדמיות מחשב של ממברנות הן משימה מורכבת מאוד מבחינה חישובית. המערכת כוללת מספר עצום של מולקולות, וכל מולקולה יכולה להתנהג במספר דרכים. יצירת מודל מדויק דורשת כוח מחשוב אדיר.
ההדמיות מראות כי:
- חומצות שומן יכולות לנוע בחופשיות יחסית.
- מולקולות מים בדרך כלל אינן חודרות דרך הממברנה, אך לפי ההדמיה, מולקולה בודדת עשויה לעבור מדי פעם – אך הקצב איטי מאוד.
- ממברנות המכילות כולסטרול הן יציבות יותר, כיוון שמולקולות הכולסטרול מגבילות את תנועת השרשראות השומניות.
חשוב להבין שהסימולציות האלה מדמות רק כמה ננו-שניות של פעילות בזמן אמיתי. הדמיית שנייה אחת של פעילות ממברנה דורשת כוח מחשוב עצום!
הרכב הממברנה בסוגי תאים שונים
הטבלה שהוצגה מראה את הרכב הליפידים בממברנות של תאים שונים בגוף ומשווה אותם לחיידק האי-קולי (E. coli).
תאים שונים משלבים שומנים שונים בממברנה בהתאם לתפקידם ולסביבתם:
- תא פלזמה בכבד
- תא דם אדום
- מיאלין (העוטף נוירונים)
- מיטוכונדריה
- הרשתית האנדופלסמטית (ER)
- חיידק אי-קולי (E. coli)
נקודה מעניינת: באי-קולי אין כולסטרול כלל! זה אומר שהחיידק צריך למצוא דרכים אחרות להתמודד עם הצורך לייצב את הממברנה ולבודד אותה ממים.
מחקר על ספציפיות של חלבונים אנטי-מיקרוביאליים
דוגמה למחקר שבוצע על חלבונים אנטי-מיקרוביאליים שהגוף מייצר כדי להרוג חיידקים. השאלה הייתה: איך החלבונים האלה יודעים לפגוע דווקא בחיידקים ולא בתאי הגוף?
בניסוי ייצרו ליפוזומים מלאכותיים עם הרכבי שומנים שונים:
- ליפוזומים עם מטען חיובי (דומים לממברנות חיידקים)
- ליפוזומים עם מטען שלילי (דומים לממברנות של תאי הגוף)
בתוך הליפוזומים הוכנס חומר פלואורסצנטי שניתן למדידה. כאשר הוסיפו את החלבון האנטי-מיקרוביאלי (REG3α), רק הליפוזומים עם המטען החיובי נפגעו ושחררו את החומר הפלואורסצנטי. זה מסביר את הספציפיות של החלבון – הוא מזהה ממברנות עם מטען חיובי (כמו של חיידקים) ולא פוגע בממברנות עם מטען שלילי (כמו של תאי האדם).
סידור עצמי של פוספוליפידים
למרות שנאמר שפוספוליפידים אינם קשורים זה לזה ויכולים לנוע בחופשיות, יש תופעה מעניינת שמראה שהם יכולים ליצור סדר מסוים.
בניסוי לקחו שלושה סוגים שונים של פוספוליפידים וצבעו רק סוג אחד בצבע אדום. כאשר יצרו ליפוזום מסוג אחד בלבד, הצביעה האדומה הייתה אחידה בכל מקום.
אם פוספוליפידים נעים באופן רנדומלי לחלוטין, כשמוסיפים עוד שני סוגים לא צבועים, היינו מצפים לראות את אותו פיזור, רק בעוצמת צבע נמוכה יותר. אך במקום זאת, הליפידים הסתדרו במעין נקודות מרוכזות.
זה מעיד שפוספוליפידים יכולים ליצור סידור עצמי בצורה מסוימת. עדיין אין הסבר מלא לתופעה זו.
אחסון שומנים בתאים - אגלי שומן (Lipid Droplets)
תאים משתמשים בשומן למספר מטרות:
- כמקור אנרגיה
- ליצירת ממברנות
- כמולקולות להעברת אותות
כאשר יש בתאים יותר מדי שומן ואין להם מה לעשות איתו, הם אינם יכולים להשאיר אותו חופשי בציטופלזמה – הוא ייצור בעיות בגלל ההידרופוביות שלו. הפתרון: התא מכניס את השומן לתוך מבנים מיוחדים הנקראים “אגלי שומן” (Lipid Droplets).
אגלי שומן דומים למיצלות – יש להם שכבה חיצונית של פוספוליפידים עם זנבות הפונים פנימה, והחלק הפנימי מלא בשומן. זו דרך יעילה לאחסן שומן בתא.
הכבד, שמקבל את כל השומן מהמזון דרך וריד השער (Portal Vein), הוא האיבר העיקרי שמאחסן שומן. כאשר צופים בכבד במיקרוסקופ, אפשר לראות נקודות של שומן בתאים.

אסימטריה של ממברנות
עד כה דובר על ליפיד ביילר (שכבה כפולה של שומנים) מבלי להדגיש מספיק את ההבדלים בין החלק החיצוני לחלק הפנימי של הממברנה.
למעשה, שני צדי הממברנה אינם זהים – יש להם תכונות שונות. הסיבה לכך ברורה: הם חשופים לסביבות שונות לחלוטין.
- בתוך התא (הציטוזול): תנאים קבועים יחסית של pH וריכוז חומרים.
- מחוץ לתא (הנוזל הבין-תאי): סביבה שיכולה להשתנות מאוד ממקום למקום בגוף (מוח, לב, שריר וכו’).
התא מתמודד עם השוני בין הסביבות באמצעות מודיפיקציות שונות של הפוספוליפידים בכל צד של הממברנה.
גליקוליפידים ותפקידם במערכת החיסון
מבנה ותפקיד הגליקוליפידים
דוגמה קלאסית לשימוש בגליקוליפידים (ליפידים עם סוכרים) היא במערכת החיסון. כאמור, יש פוספוליפידים שיש להם סוכרים במקום קבוצות מסוימות.
מדוע הסוכרים האלה חשובים? המערכת החיסונית יודעת לזהות את הסוכרים האלה, והם משמשים כ”תעודת זהות” עבור המקרופאגים. הסוכרים מסמנים למקרופאגים “אל תאכל אותי” – כלומר, הם מסמנים את התאים כתאים של הגוף עצמו ולא כפולשים.
מנגנון “פליפ-פלופ” במוות תאי מתוכנן
כאשר תא עובר מוות תאי מתוכנן (אפופטוזיס) כי הוא מבין שעליו להתאבד כדי להציל את האורגניזם כולו, הממברנה מבצעת תהליך נקרא “פליפ-פלופ”: החלק החיצוני שלה הופך להיות פנימי, והחלק הפנימי הופך להיות חיצוני. כתוצאה מכך, הסוכרים נעלמים מהצד החיצוני של התא.
כאשר מקרופאג רואה ממברנה ללא סוכרים, הוא מיד מזהה זאת כסימן שעליו לבלוע את התא הזה ולפרק אותו. זוהי התנהגות אלטרואיסטית של התא – הוא מתאבד כדי להגן על האורגניזם כולו.
הגנה מפני וירוסים
נניח שתא נדבק בווירוס. וירוס מחוץ לתא לא יכול לעשות דבר; הוא אינו מתרבה או מבצע מטבוליזם לבד, וזו אחת הסיבות שווירוסים אינם נחשבים ליצורים חיים. הסכנה מתחילה כשהווירוס חודר לתא ומשתמש במערכות התא כדי לשכפל את עצמו.
כאשר וירוס נכנס לתא, קיימות מערכות שמזהות DNA ו-RNA זר בציטופלזמה. זיהוי כזה מפעיל שרשרת העברת אותות שגורמת לתא לבצע “פליפ-פלופ” בממברנה, להתאבד, ולאפשר למקרופאג לבלוע אותו ולחסל את הווירוס.
גם אם לפעמים נדבקים בווירוסים ונעשים חולים, זה לא אומר שהמערכת לא עובדת. למעשה, התחושות של מחלה (חום, עייפות וכו’) מעידות על כך שהמערכת החיסונית כן עובדת. העובדה שרוב האנשים מחלימים מהדבקות ויראליות מעידה על כך שהמערכת פועלת היטב.
יש לציין שאין הרבה תרופות נגד וירוסים, ואלה שיש (כמו תרופות ל-HIV) לא הורגות וירוסים אלא רק מעכבות את התרבותם. בדרך כלל ההחלמה מתרחשת הודות למערכת החיסון.
סוכרים על פני הממברנה
מיקום הגליקוליפידים
גליקוליפידים נמצאים רק בחלק החיצוני של הממברנה. זוהי תכונה נפוצה בכל היצורים האאוקריוטיים, אך אינה קיימת בחיידקים.
ישנם סוגים שונים של גליקוליפידים. לחלקם יש ראש מורכב עם הרבה סוכרים, ולאחרים יש רק סוכר אחד. הסוכרים יכולים להיות מסוגים שונים, כמו גלקטוז או חומצה סיאלית. תחום שלם בביולוגיה, הנקרא “גליקומיקס”, עוסק בחקר הסוכרים שנמצאים על תאים. תחום הגליקומיקס נמצא יחסית בחיתוליו, אך הבנה טובה יותר של הסוכרים הללו עשויה לשפוך אור על מחלות רבות.
מדוע הגליקוליפידים נמצאים רק בצד החיצוני?
הגליקוזילציה (הוספת סוכרים) נעשית רק בחלק הפנימי של הגולג׳י, אברון שבו מתבצעות מודיפיקציות לחלבונים ולשומנים לפני שהם נשלחים מחוץ לתא. בגלל האופן שבו בועיות מהגולג׳י מתמזגות עם ממברנת התא, הסוכרים תמיד מופנים כלפי חוץ. אין אפשרות שהם יופנו כלפי פנים.
דוגמה מהמעי
דוגמה מעניינת היא ממברנת תאי האפיתל במעי. תאי האפיתל של המעי מכוסים במיקרו-וילי, מבנים דמויי אצבע המגדילים את שטח הפנים כדי לספוג יותר נוטריינטים מהמזון.
על גבי הממברנה של תאי האפיתל יש סוכרים רבים (נראים בצבע מגורען בתמונות מיקרוסקופיות). הסוכרים האלה חשובים מאוד כי במעי יש טריליוני חיידקים, וירוסים ופטריות, ובכל זאת רוב האנשים אינם סובלים מדלקות כרוניות במעי. הסוכרים על הממברנה של תאי האפיתל יוצרים מעין מחסום, שמונע מחיידקים להגיע קרוב מספיק לממברנה כדי לפרוץ אותה.
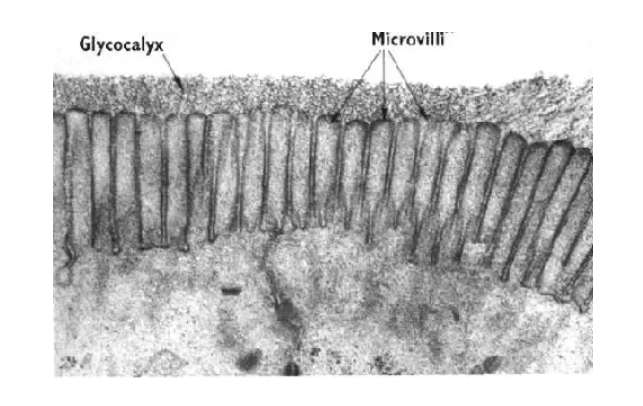
חלבוני ממברנה - מבוא
תפקיד החלבונים בממברנה
הממברנה עצמה היא בעיקר חיץ, מחסום בין פנים התא לסביבתו החיצונית. היא אינה מבצעת פעולות אנזימטיות או קטליטיות בעצמה. כדי לבצע פעולות אקטיביות, התא זקוק לחלבונים שמשולבים בממברנה.
ישנן סיבות רבות מדוע התא זקוק לחלבוני ממברנה:
- כדי שהתאים יישארו במקומם הנכון ולא ינדדו באופן אקראי (חלבוני עיגון)
- כדי לחוש ולהגיב לשינויים בסביבה (רצפטורים)
- כדי להעביר חומרים דרך הממברנה (תעלות וטרנספורטרים)
מבנה חלבוני ממברנה
חלבונים טרנס-ממברנליים הם חלבונים שחודרים דרך הממברנה מצד אחד לצד השני. לכל החלבונים הטרנס-ממברנליים יש אזור שנקרא “דומיין טרנס-ממברנלי” שנמצא בתוך הממברנה (״תחום טרנס-ממברנלי״).
כפי שלמדנו, יש חומצות אמינו הידרופיליות וחומצות אמינו הידרופוביות. כאשר חלבון צריך להיות טרנס-ממברנלי, האזורים שיוצרים מבנים הידרופוביים יהיו תקועים בין הליפידים בממברנה, ואילו האזורים שיוצרים מבנים הידרופיליים יהיו בצד התוך-תאי או החוץ-תאי.
חלבוני ממברנה יכולים להיות בצורת אלפא-הליקס או בטא-ברל (״חבית״ בטא - β barrel). הצורה תלויה בתפקוד החלבון. כאשר יש מספר אזורים הידרופוביים והידרופיליים לסירוגין, זה בדרך כלל מצביע על חלבון שיוצר תעלה דרך הממברנה.
ישנם גם חלבונים שאינם חלבוני טרנס-ממברנליים, אך הם עדיין נחשבים לחלבוני ממברנה כי הם מקושרים אליה. למשל, חלבונים שמקושרים לממברנה על ידי סוכרים, או חלבונים שמקושרים לחלבונים אחרים שנמצאים בממברנה.
סוגים שונים של חלבוני ממברנה
ישנם חלבונים שעוברים את הממברנה פעם אחת, ויש כאלה שעוברים אותה מספר פעמים. מדען יכול לנבא מהרצף של החלבון האם הוא טרנס-ממברנלי וכמה פעמים הוא יעבור את הממברנה.
הניבוי נעשה באמצעות “אינדקס הידרופובי” – סולם שמודד את מידת ההידרופוביות של חומצות האמינו. כל מה שנמצא מעל הערך 0 הוא הידרופובי (צריך אנרגיה כדי להיות במים), וכל מה שנמצא מתחת ל-0 הוא הידרופילי.
כך, למשל, חלבונים עם אזור הידרופובי אחד יעברו את הממברנה פעם אחת, ואילו חלבונים עם מספר אזורים הידרופוביים יעברו את הממברנה מספר פעמים.
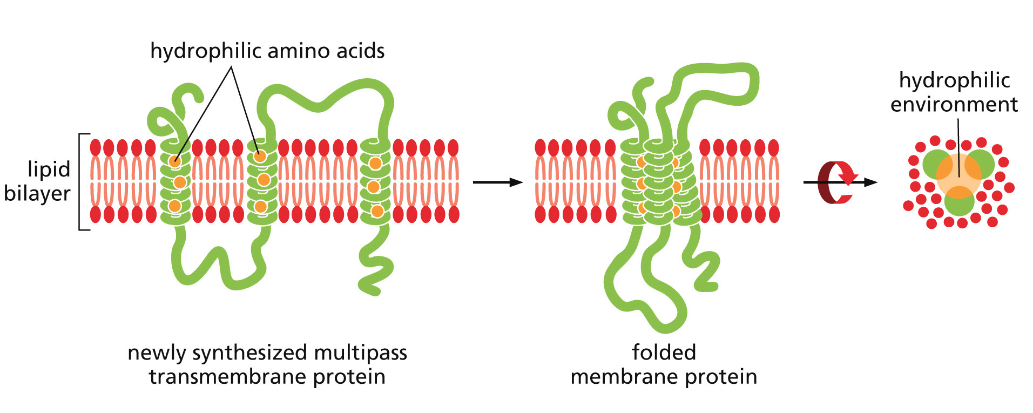
תעלות מים (אקוואפורינים)
למרות שהממברנה הידרופובית, מים בכל זאת עוברים דרכה. איך זה קורה?
התשובה היא תעלות חלבון מיוחדות שנקראות אקוואפורינים. בתעלות אלה יש חומצות אמינו פולריות שנמצאות במקום מסוים בתעלה.
כאשר מסתכלים על חתך של אקוואפורין, רואים שלושה סלילים (אלפא-הליקסים) ובכל סליל יש כמה שיירים (צדדים של חומצות אמינו) שכולם פונים לאותו כיוון. כאשר החלבון מתקפל בתוך הממברנה, האזורים ההידרופוביים נמצאים בחוץ (באינטראקציה עם הליפידים), והשיירים ההידרופיליים נמצאים בפנים, בתוך התעלה. כך נוצר מסלול בטוח למעבר מים.
רודופסין - חלבון ממברנה שמגיב לאור
רודופסין הוא חלבון שנמצא בחיידקים ומגיב לאור. הוא עובר את הממברנה מספר פעמים, ובמרכזו יש שייר שנקרא רטינל.
כאשר פוטון של אור פוגע ברטינל, אחת מחומצות האמינו של הרטינל עוברת שינוי מבני, וכתוצאה מכך משתנה צורת המולקולה כולה. השינוי של הרטינל גורם לשינויים קונפורמציוניים בצורת החלבון.
בשינוי צורה זה, החלבון משחרר פרוטון (יון מימן) לצד אחד של הממברנה ואז יכול לקלוט פרוטון אחר מהצד השני.
רודופסין משמש גם בטכניקה מחקרית שנקראת אופטוגנטיקה. בשיטה זו, מייצרים למשל עכבר טרנסגני שנוירונים מסוימים שלו מבטאים את הרודופסין. כאשר מאירים על האזור הזה באור באורך גל מסוים, התעלה נפתחת והנוירון יורה. כך אפשר לבדוק האם הנוירונים האלה אחראים על התנהגות מסוימת, כמו רצון לאכול, התמכרות או דיכאון.
איך חלבוני ממברנה מגיעים לממברנה?
חלבונים ממברנליים לא נוצרים בציטופלזמה ואז מגיעים לממברנה. הם עוברים סינתזה ישירות בממברנה של הרשתית האנדופלסמטית (ER), ומשם הם עוברים על גבי וזיקולות דרך הגולג׳י ומגיעים לממברנת התא כשהם כבר תקועים בתוך הממברנה של הבועית.
גליקוזילציה של חלבונים וסוגי דם
סוכרים על חלבונים וזיהוי עצמי
כפי שנאמר שעל פוספוליפידים יכולים להיות סוכרים, גם על חלבונים יכולים להיות סוכרים. כאשר סוכרים אלה פונים החוצה, הם עוזרים לגוף לזהות האם מדובר בתא שלו או לא.
דוגמה קלאסית לכך היא סוגי הדם במערכת ABO. מה זה בעצם ABO? אלו סוכרים שונים שנמצאים על גבי חלבונים בממברנת תאי הדם האדומים, ומאפשרים למערכת החיסונית לזהות האם התא הזה הוא של הגוף או לא.
מערכת הדם ABO היא דוגמה טובה לכך שהסוכרים עוזרים להבחין בין תאים של הגוף לתאים זרים. הבעיה היא שזה מקשה כאשר רוצים לעשות תרומת דם, כי אם נקבל דם מסוג שונה משלנו, המערכת החיסונית תזהה אותו כזר ותתקוף אותו.
ניידות חלבונים בממברנה
ניסויי פיוז’ן (מיזוג תאים)
כפי שנאמר, הפוספוליפידים יכולים לנוע בצורה יחסית חופשית בממברנה, אך לפעמים הם גם יוצרים צברים (אגרגטים). באופן דומה, גם חלבוני ממברנה יכולים לנוע בצורה חופשית בממברנה – אם כי לא כולם.
כדי להוכיח זאת, נערך ניסוי שבו לקחו תא אנושי ותא עכבר וביצעו מיזוג (פיוז’ן) ביניהם. את חלבוני הממברנה של התא האנושי צבעו באדום, ואת אלו של העכבר בירוק.
מיד לאחר המיזוג, ניתן היה לראות בבירור את החלק של התא שהגיע מהאדם ואת החלק שהגיע מהעכבר, כל אחד בצבע אחר. אך לאחר כמה שניות, הצבע האדום והירוק התפשטו בכל היקף התא הממוזג. זה מעיד על כך שהחלבונים יכולים לנוע בצורה חופשית בממברנה, ולאחר המיזוג הם התפזרו בכל שטח הממברנה.
ניסויי FRAP
טכניקה נוספת להדגמת ניידות חלבונים בממברנה היא FRAP (Fluorescence Recovery After Photobleaching).
בשיטה זו מייצרים חלבונים ממברנליים שמחוברים למולקולה פלואורסצנטית (מפיקה אור). באמצעות קרן לייזר מדויקת, מבצעים “הלבנה” (photobleaching) – שריפה של היכולת של החלבונים באזור מסוים לפלוט אור.
אם החלבונים יכולים לנוע בחופשיות בממברנה, יתרחש תהליך של “התאוששות” (recovery) – חלבונים פלואורסצנטיים מאזורים אחרים בממברנה ינועו לאזור ה”הלבנה” וימלאו את ה”חור” שנוצר.
בסרטון שהוצג, ניתן לראות תא לפני ההלבנה, אחרי ההלבנה (כשנוצר אזור חשוך), ואז אחרי כמה שניות רואים שחלבונים מאזורים אחרים הגיעו וסגרו את החור.
חשוב להבהיר: הלייזר לא פגע בכל החלבונים בממברנה, רק באלו שבאזור ממוקד. החלבונים שעברו הלבנה עדיין מתפקדים, הם רק איבדו את היכולת לפלוט אור. מה שרואים בהתאוששות הוא חלבונים אחרים, שלא עברו הלבנה, שהגיעו לאזור בגלל תנועה חופשית (דיפוזיה).
מדידת קצב ההתאוששות מאפשרת לחוקרים לחשב את מקדם הדיפוזיה של החלבון, כלומר כמה מהר הוא יכול לנוע בממברנה.
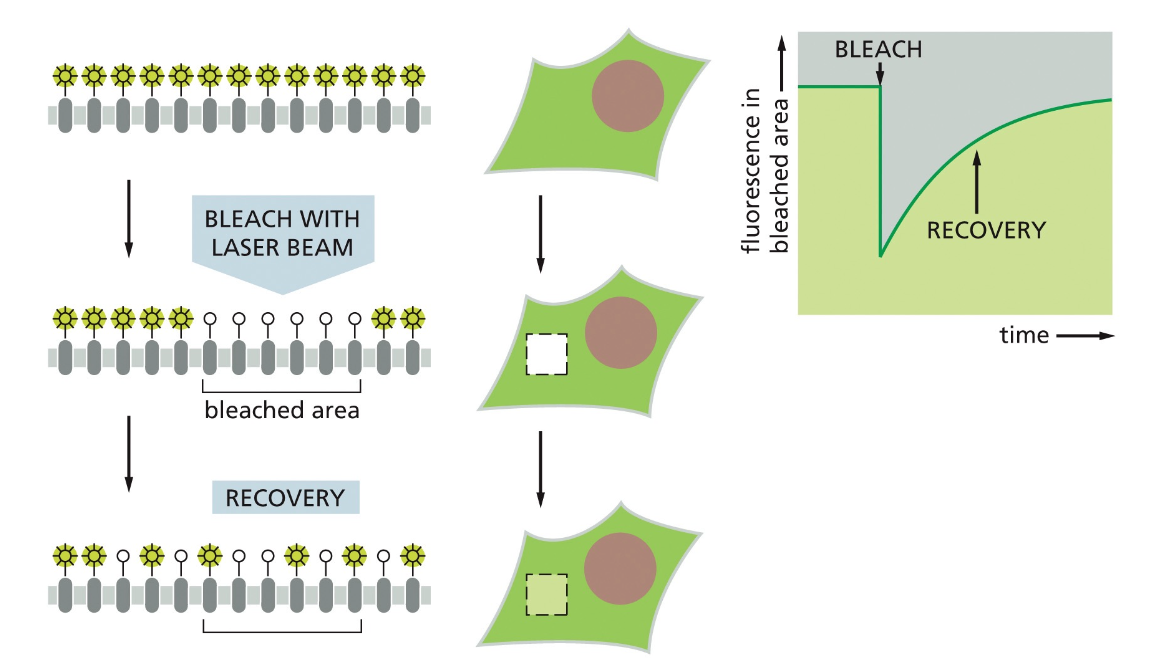
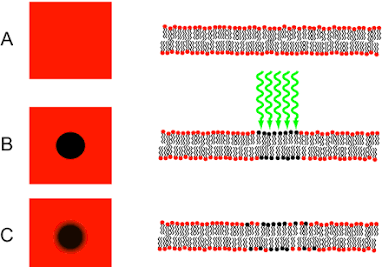
שיעור 9 - טרנספורטרים ותעלות בממברנה
תאריך: 28/04/2025מבוא: חשיבות הממברנה והצורך במעבר סלקטיבי
בשיעור הקודם דיברנו על ממברנות ועל התפקיד החיוני שלהן ביצירת הפרדה בין פנים התא לסביבתו החיצונית. הממברנות עושות עבודה מעולה בכך שהן לא מאפשרות לחומרים לעבור דרכן באופן חופשי. היכולת הזאת להפריד בין פנים לחוץ - בין אם בתאים, באברונים או בכל מבנה ביולוגי אחר - היא חיונית לתפקוד נכון של האורגניזם.
עם זאת, תאים חייבים גם להכניס ולהוציא חומרים ולתקשר עם הסביבה שלהם. מכאן שנדרש מנגנון שיאפשר מעבר מבוקר של חומרים דרך הממברנה. המנגנונים האלה חייבים לפעול תחת בקרה קפדנית - אי אפשר לאפשר לתא להכניס ולהוציא כל מה שהוא “רוצה”.
הדרך העיקרית שבה תאים מעבירים מולקולות קטנות דרך הממברנה היא באמצעות טרנספורטרים ותעלות, שהם נושא השיעור היום. הנושא הזה יחסית אינטואיטיבי, והמנגנונים האלה פועלים פחות או יותר כפי שהיינו מצפים שיפעלו.
חשיבות טרנספורטרים ותעלות בתאים
עד כמה טרנספורטרים ותעלות חשובים לתאים? התשובה משתנה מאורגניזם לאורגניזם, אך בדרך כלל כ-15% עד 30% מהגנום מקודד לטרנספורטרים ולתעלות. כלומר, כמעט שליש מהגנום שלנו מוקדש אך ורק להכנסה ולהוצאה של חומרים מהתא ולשליטה על מעבר של מולקולות בין פנים התא לסביבתו החיצונית. זה מעיד על החשיבות העצומה של תהליכים אלה.
יש תאים שרוב האנרגיה שלהם מושקעת בתהליכי העברת חומרים, למשל:
- נוירונים משקיעים את רוב האנרגיה שלהם בהכנסה ובהוצאה של יונים, שכן עיקרון הפעולה שלהם מבוסס על העברת מטען חשמלי (יונים שנכנסים ושיוצאים מהתא).
- תאי כליה וכבד שתפקידם לסנן את מה שאנחנו אוכלים ושותים, עוסקים רוב הזמן בהכנסה ובהוצאה של חומרים.
ריכוזי יונים בפנים התא ומחוצה לו
נתון מדהים הוא שריכוזי היונים בפנים התא ומחוצה לו נשמרים ברמות דומות כמעט בכל היונקים. למרות שכל יונק חי בסביבה שונה והגוף שלו מתפקד בצורה שונה, התאים עדיין שומרים על ריכוזי יונים כמעט קבועים, מה שמרמז על כך שזוהי הסביבה האופטימלית שהאבולוציה פיתחה לתפקוד תאי.
להלן ריכוזי היונים העיקריים בפנים התא ומחוצה לו:
| יון | ריכוז מחוץ לתא | ריכוז בתוך התא | יחס (בערך) |
|---|---|---|---|
| $\text{Na}^+$ (נתרן) | גבוה | נמוך | פי 50-10 יותר בחוץ |
| $\text{Ca}^{2+}$ (סידן) | גבוה | נמוך מאוד | פי 10,000 יותר בחוץ |
| $\text{K}^+$ (אשלגן) | נמוך | גבוה | פי 30-10 יותר בפנים |
| $\text{Mg}^{2+}$ (מגנזיום) | משתנה | משתנה | משתנה |
| $\text{Cl}^-$ (כלור) | גבוה | נמוך | משתנה |
משמעות ההפרשים הגדולים בריכוזים היא שככל שהפרש הריכוזים גדול יותר, כך החומר יעבור מהר יותר כשיתאפשר לו לעבור. לדוגמה, סידן משמש כאחת המולקולות החשובות ביותר להעברת אותות במערכת העצבים בדיוק בשל פער הריכוזים העצום (פי 10,000) בין חוץ התא לפנים התא. כשתעלת סידן נפתחת, היונים זורמים במהירות רבה, מה שחיוני לפעולות מהירות של מערכת העצבים.
התא משקיע אנרגיה רבה כדי לשמר את הפרשי הריכוזים האלה.
חדירות הממברנה לחומרים שונים
הממברנה כמעט בלתי חדירה להרבה חומרים, אך יש חומרים שכן יכולים לעבור דרכה באופן חופשי או מוגבל:
-
מולקולות לא פולריות: גזים (חמצן, פחמן דו-חמצני, חנקן) והורמונים סטרואידים יכולים לעבור בחופשיות דרך הממברנה. לכן, התא אינו זקוק למנגנון מיוחד כדי להכניס חמצן או להוציא $\ce{CO2}$.
-
מולקולות כמו מים וגליצרול: יכולות לעבור דרך הממברנה, אך זה ייקח זמן רב. מולקולות מים יכולות טכנית לעבור דרך הממברנה השומנית, אך התהליך איטי מדי לצרכי התא.
-
סוכרים ויונים: כמעט שלא יעברו את הממברנה ללא מנגנוני העברה ייעודיים. ליונים, ללא עזרה של טרנספורטרים או תעלות, ייקח זמן בלתי סביר לעבור את הממברנה.
הסיבה הכימית לכך היא שהממברנה עשויה מליפידים (שומנים) עם ראש פוספט וזנב ליפידי. מולקולות פולריות כמו מים או יונים טעונים לא יעברו בקלות דרך השכבה השומנית של הממברנה. לעומת זאת, גזים כמו חמצן ו-$\ce{CO2}$ הם אטומים קטנים ולא פולריים, ולכן יכולים לעבור בקלות.
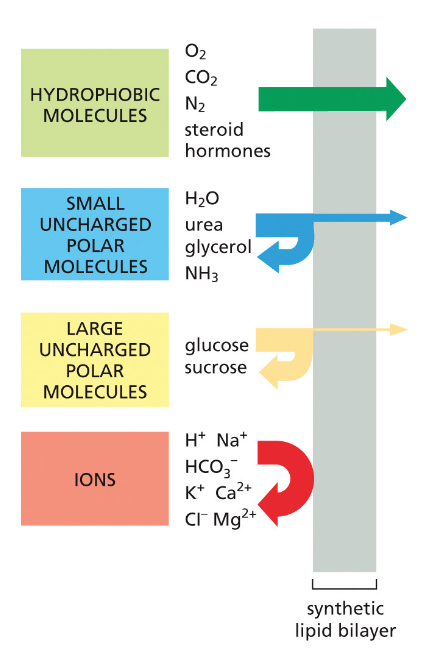
סוגי חלבונים להעברת חומרים דרך הממברנה
יש שני סוגים עיקריים של חלבונים שמשמשים להעברת חומרים דרך הממברנה:
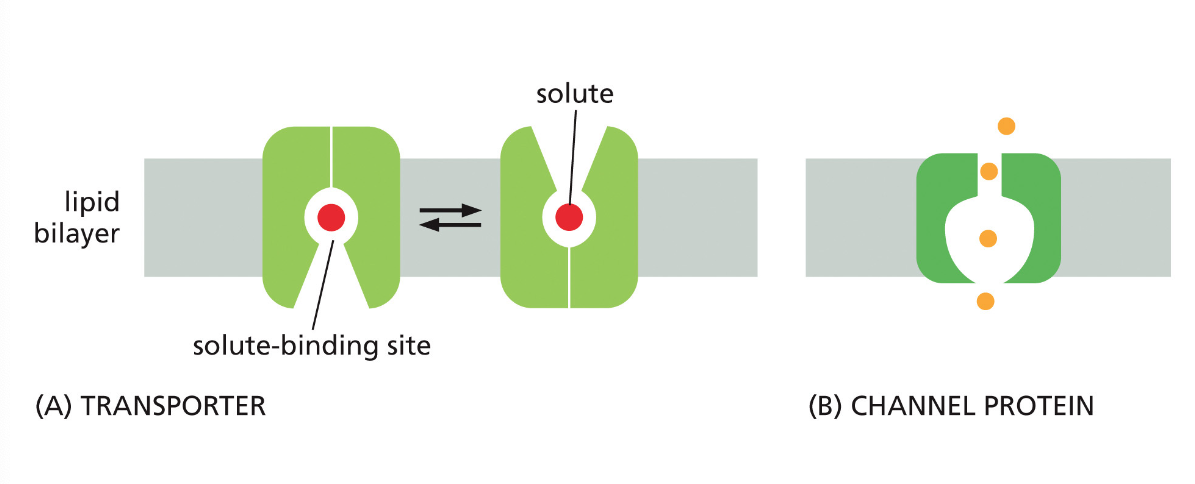
טרנספורטרים
טרנספורטר הוא חלבון עם אתר קישור (binding site) ספציפי לחומר שהוא מעביר (solute). כשהחומר נקשר לטרנספורטר, החלבון עובר שינוי קונפורמציה (שינוי מבני), ממצב שבו הוא פתוח לצד אחד של הממברנה, למצב שבו הוא פתוח לצד השני, וכך משחרר את החומר בצד השני.
טרנספורטרים דומים לאנזימים בכך שיש להם סובסטרט ספציפי שהם קושרים, אך בניגוד לאנזימים, הם לא משנים את החומר עצמו - הם רק מעבירים אותו מצד אחד של הממברנה לצד השני.
תהליך ההעברה נעשה בשלושה שלבים:
- קישור המולקולה לטרנספורטר
- שינוי קונפורמציה של הטרנספורטר (בשלב הזה המולקולה אינה חשופה לאף צד של הממברנה)
- שינוי קונפורמציה נוסף המשחרר את המולקולה בצד השני
תעלות
בניגוד לטרנספורטרים, תעלות (channel proteins) לא קושרות ישירות את החומר שהן מעבירות. הן פשוט נפתחות ונסגרות, ומאפשרות מעבר של חומרים ספציפיים דרכן. התעלות ספציפיות מאוד לסוג החומר שהן מעבירות.
בגלל שתעלות לא צריכות לקשור את החומר ולעבור שינויי קונפורמציה מורכבים, הן פועלות הרבה יותר מהר מטרנספורטרים.
העברה פסיבית לעומת העברה אקטיבית
יש מספר דרכים להעברת חומרים דרך הממברנה:
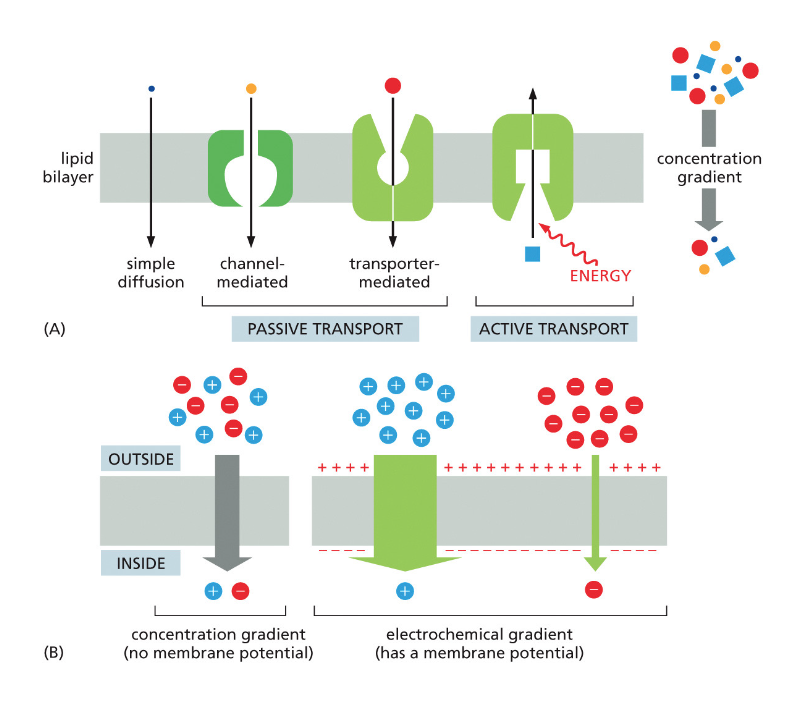
דיפוזיה פשוטה
החומרים היחידים שעוברים בדרך זו הם גזים כמו חמצן ו-$\ce{CO2}$.
העברה פסיבית דרך תעלה
חומר יעבור דרך תעלה רק אם הוא נע בכיוון מפל הריכוזים (מריכוז גבוה לריכוז נמוך). ברגע שהתעלה נפתחת, החומר יעבור באופן טבעי לצד השני.
העברה פסיבית דרך טרנספורטר
בדומה לתעלות, טרנספורטרים יכולים להעביר חומרים לפי מפל הריכוזים ללא השקעת אנרגיה.
העברה אקטיבית
כאשר יש צורך להעביר חומר נגד מפל הריכוזים (כלומר, מריכוז נמוך לריכוז גבוה), נדרשת השקעת אנרגיה. זו העברה אקטיבית.
הבדל חשוב:
- טרנספורטרים - יכולים לפעול הן בהעברה פסיבית והן בהעברה אקטיבית (עם השקעת אנרגיה).
- תעלות - פועלות רק בהעברה פסיבית, כלומר רק עם מפל הריכוזים.
קצב העברת חומרים
קיימים הבדלים משמעותיים בקצב העברת החומרים בין טרנספורטרים לתעלות:
-
טרנספורטרים: מגיעים בשלב מסוים לקצב מקסימלי שאינם יכולים לעבור. ההגבלה הזו נובעת מהזמן הדרוש לקישור המולקולה, שינוי הקונפורמציה ושחרור המולקולה.
-
תעלות: אינן מוגבלות באותו אופן. ככל שמפל הריכוזים גדול יותר, כך קצב מעבר החומר דרך התעלה יהיה מהיר יותר. אין להן “רוויה” כמו לטרנספורטרים.
הדבר בא לידי ביטוי במתמטיקה:
- בטרנספורטרים: $\text{Rate} = \frac{V_{\max} \cdot [\text{S}]}{K_m + [\text{S}]}$
- בתעלות: הקצב גדל באופן ליניארי עם מפל הריכוזים
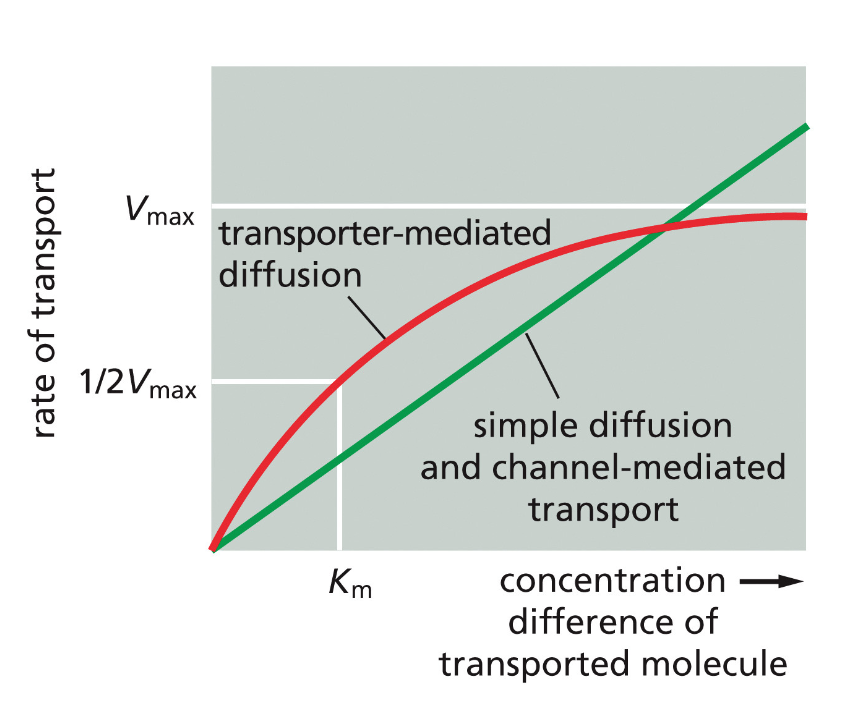
סוגי טרנספורטרים
מנגנוני העברה אקטיבית
כאשר יש צורך להעביר חומר נגד מפל הריכוזים, יש שלושה מקורות עיקריים לאנרגיה הדרושה:
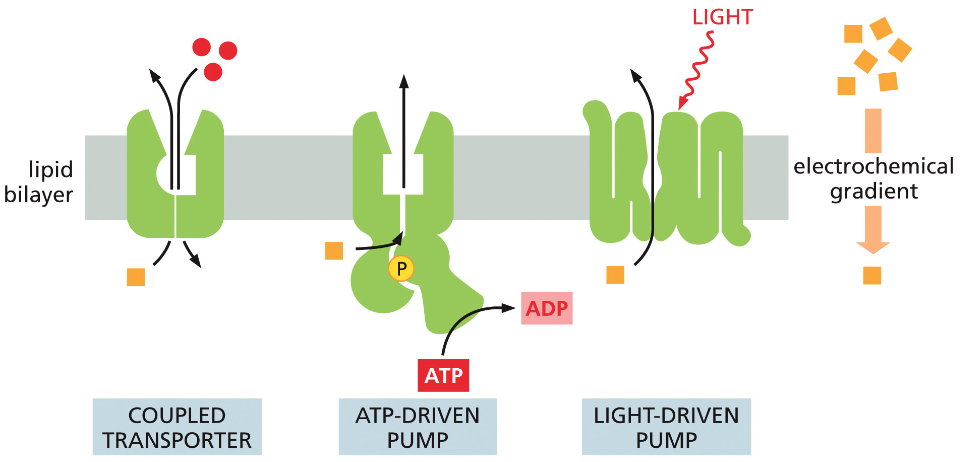
טרנספורטר מצומד (Coupled Transporter)
בשיטה זו, משתמשים במפל הריכוזים של חומר אחד כדי להעביר חומר אחר נגד מפל הריכוזים שלו. הטרנספורטר מכיל שני אתרי קישור - אחד לכל חומר. כאשר החומר הראשון נע לפי מפל הריכוזים שלו, האנרגיה המשתחררת מנוצלת להעברת החומר השני נגד מפל הריכוזים שלו.
שימוש ב-ATP
ATP משמש כספק אנרגיה לרוב הפעולות המכניות בתא. בטרנספורטרים תלויי-ATP, קשירת ATP לחלבון גורמת לשינוי קונפורמציה שמספק את האנרגיה הדרושה להעברת החומר נגד מפל הריכוזים.
שימוש באור
שימוש באור נפוץ ברצפטורים בעין ובצמחים. פוטון שפוגע בחלבון גורם לשינוי קונפורמציה ומספק אנרגיה.
סוגי טרנספורטרים לפי מספר החומרים המועברים
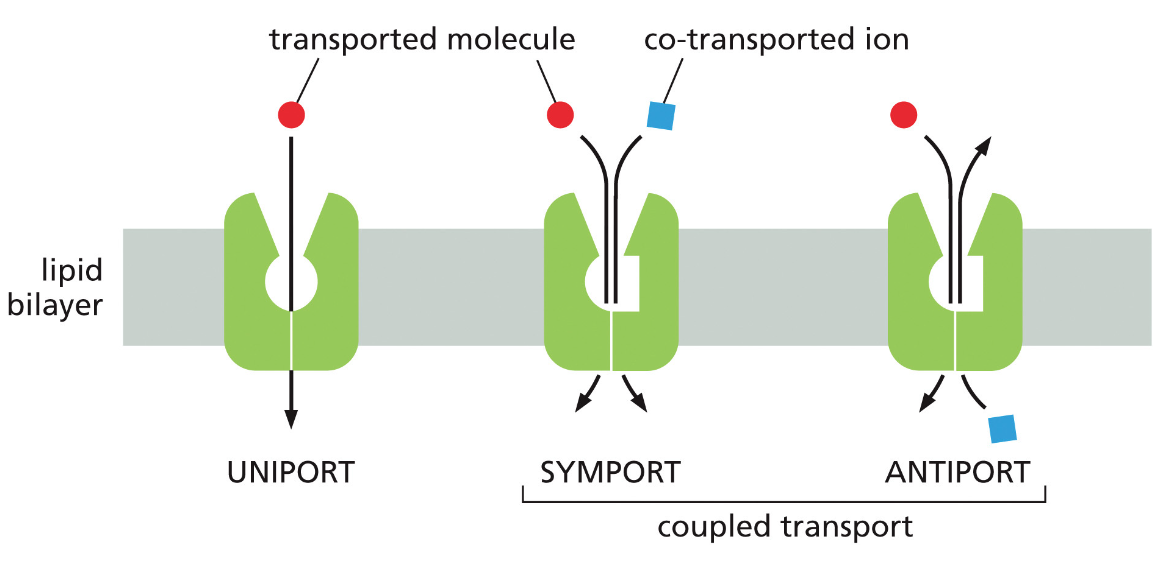
יוניפורט (Uniport)
טרנספורטר יוניפורט מעביר מולקולה אחת בלבד. זה יכול להיות בהעברה פסיבית (עם מפל הריכוזים) או בהעברה אקטיבית (נגד מפל הריכוזים, עם השקעת אנרגיה).
סימפורט (Symport)
טרנספורטר סימפורט מעביר שני חומרים שונים באותו כיוון. לדוגמה, אם מולקולה אחת (כחולה) רוצה להיכנס לתא בגלל מפל הריכוזים שלה, והמולקולה השנייה (אדומה) צריכה להיכנס נגד מפל הריכוזים שלה, הסימפורטר מנצל את האנרגיה ממפל הריכוזים של המולקולה הכחולה כדי להכניס גם את המולקולה האדומה.
אנטיפורט (Antiport)
טרנספורטר אנטיפורט מעביר שני חומרים בכיוונים מנוגדים. מפל הריכוזים של חומר אחד משמש להעברת החומר השני בכיוון ההפוך.
בניגוד לסימפורט, באנטיפורט אנחנו מעבירים מולקולות בכיוונים מנוגדים. המולקולה הכחולה מוצאת מהתא לסביבה החיצונית, והמולקולה האדומה נכנסת לתא. גם כאן מנצלים את מפל הריכוזים של אחת המולקולות (הכחולה) שרוצה לצאת מהתא (בגלל שהריכוז שלה נמוך יותר בחוץ) כדי לספק את האנרגיה להכנסת המולקולה השנייה (האדומה) שלא רוצה להיכנס (כי הריכוז שלה גבוה יותר בצד החיצוני).
שתי המולקולות נקשרות לטרנספורטר בצדדים מנוגדים, ובשינוי הקונפורמציה אחת יוצאת והשנייה נכנסת. יש גם מנגנונים בהם קודם נקשרת מולקולה אחת, ורק כאשר נקשרת המולקולה השנייה מתרחש שינוי הקונפורמציה.
נקודה חשובה: ההבדל בין סימפורט לאנטיפורט הוא שבסימפורט שתי המולקולות נכנסות מאותו צד של הממברנה, ובאנטיפורט המולקולות נכנסות מכיוונים מנוגדים.
דוגמה מרכזית: טרנספורטרים של גלוקוז בתאי אפיתל
בתאי אפיתל במעי יש הרבה טרנספורטרים שמבוססים על ניצול מפל הריכוזים של נתרן כדי להכניס גלוקוז לתוך התאים. הגוף עובד קשה כדי לשמור על ריכוז נתרן נמוך בתוך התאים (וגבוה מחוץ לתאים), כך שנתרן תמיד “רוצה” להיכנס לתא.
מאידך, ריכוז הגלוקוז גבוה יותר בתוך תאי האפיתל מאשר בחלל המעי (אלא אם כן אכלתם כמות גדולה של סוכרים). לכן, גלוקוז לא ייכנס באופן ספונטני לתאים - זה נגד מפל הריכוזים.
הפתרון: סימפורטר של נתרן-גלוקוז. טרנספורטר זה מנצל את הרצון של הנתרן להיכנס לתא כדי “לגרור” איתו גם את הגלוקוז פנימה. ברגע שנתרן נקשר לטרנספורטר וגלוקוז מצטרף אליו, הכוח שמניע את הנתרן פנימה פותח את הטרנספורטר ומאפשר לגלוקוז להיכנס לתא כנגד מפל הריכוזים שלו.
הערה חשובה: ברגע שהגלוקוז נכנס לתא, עלינו להבטיח שמפל הריכוזים של הנתרן יישמר. לכן, הנתרן שנכנס חייב להיות מוצא החוצה בשלב מסוים, דבר הדורש השקעת אנרגיה.
מנגנון מלא להעברת גלוקוז במעי
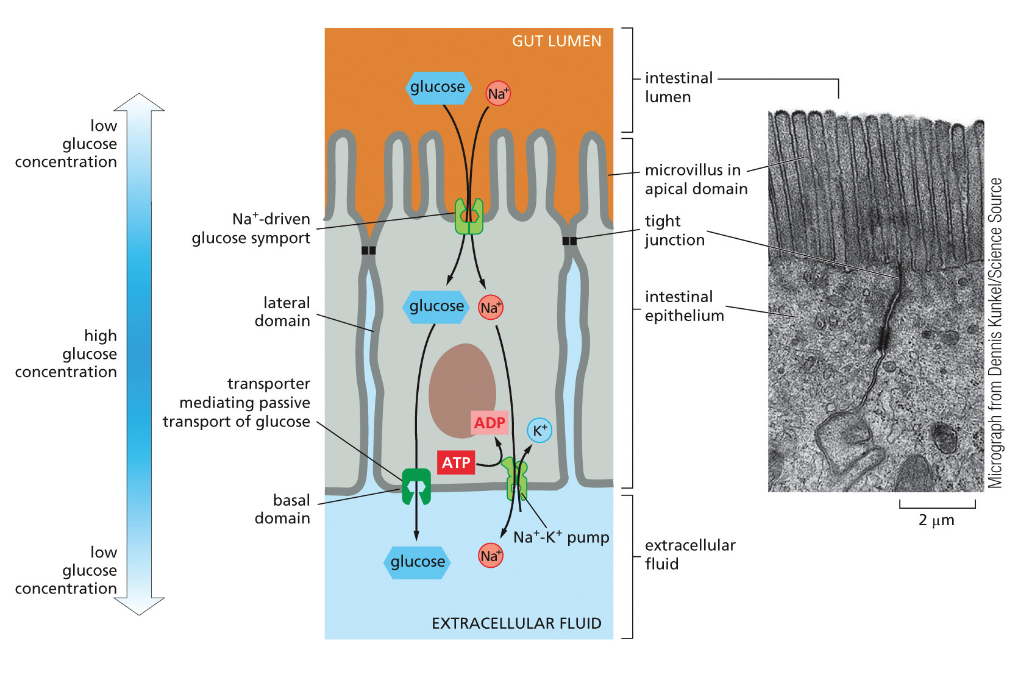
נסתכל על התמונה המלאה של העברת גלוקוז במעי:
- כניסת גלוקוז לתא האפיתל - הצד האפיקלי (הפונה לחלל המעי):
- בחלק העליון של התא (צד הלומן - חלל המעי) יש גלוקוז שאנחנו רוצים להכניס לתא.
- הגלוקוז נכנס דרך סימפורטר נתרן-גלוקוז, המנצל את מפל הריכוזים של הנתרן
(טרנספורטר סימפורטר - להבנתי (דור) SGLT1).
- יציאת גלוקוז לזרם הדם - הצד הבזאלי (הפונה לזרם הדם):
- בצד השני של התא (הצד הבזאלי הפונה לזרם הדם), ריכוז הגלוקוז בתא גבוה יותר מאשר בדם.
- הגלוקוז יוצא באופן פסיבי דרך יוניפורטר (טרנספורטר פשוט), ללא צורך בהשקעת אנרגיה.
- יוניפורט GLUT2
- שמירה על מפל הריכוזים של נתרן:
- כדי שהמערכת תמשיך לעבוד, יש צורך להוציא את הנתרן שנכנס לתא.
- זה נעשה על ידי משאבת נתרן-אשלגן (Na⁺/K⁺ ATPase), שמוציאה נתרן ומכניסה אשלגן תוך השקעת אנרגיה (ATP).
הערה על מיקום הטרנספורטרים: חשוב לציין שהטרנספורטרים ממוקמים בצורה מאורגנת בממברנת התא. הסימפורטר נמצא בצד האפיקלי (הפונה לחלל המעי), והיוניפורטר נמצא בצד הבזאלי (הפונה לזרם הדם).
מה שמונע מהטרנספורטרים לנוע מצד לצד הם חלבונים הנקראים “Tight Junctions”, היוצרים מחסום בין שני צדדי הממברנה ומחברים תאי אפיתל סמוכים.
tight junctions מונעים מעבר של חלבונים טרנס-ממבראנליים מהצד הבזאלי לצד האפיקלי באותו תא
טרנספורטרים תלויי ATP (העברה אקטיבית)
עד כה דיברנו בעיקר על טרנספורטרים הפועלים עם מפל הריכוזים או מנצלים מפל ריכוזים של חומר אחד להעברת חומר אחר. כעת נדון בטרנספורטרים שמשתמשים ישירות באנרגיה מ-ATP להעברת חומרים נגד מפל הריכוזים.
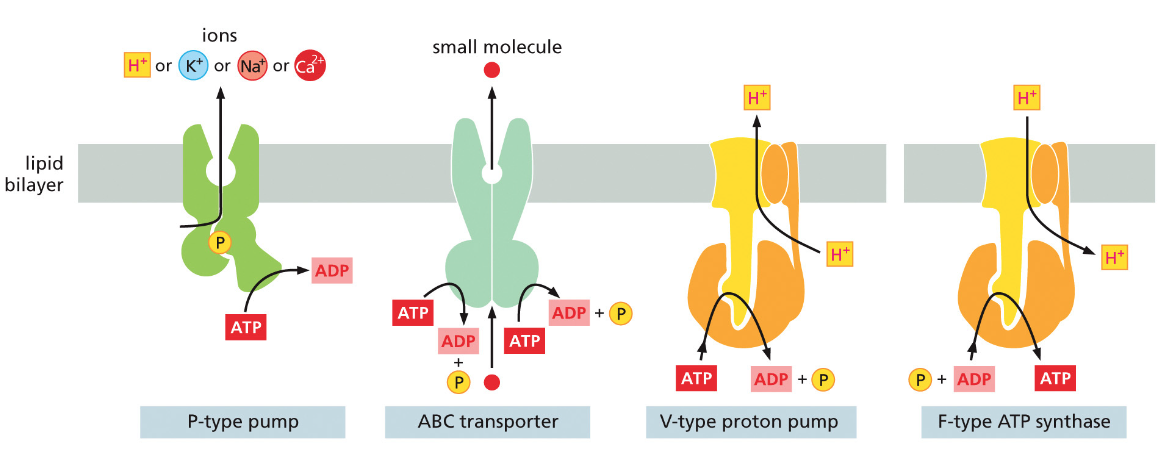
יש שלושה סוגים עיקריים של טרנספורטרים תלויי ATP:
משאבות מסוג P (P-type ATPases)
- תפקידן העיקרי הוא להעביר יונים.
- פועלות באופן פשוט יחסית:
- יון נקשר בצד אחד
- יש השקעה של ATP
- הטרנספורטר משנה קונפורמציה
- והיון משתחרר בצד השני
- דוגמה מרכזית: משאבת הנתרן-אשלגן (Na⁺/K⁺ ATPase) - להלן.
טרנספורטרים מסוג ABC (ATP Binding Cassette)
- ABC הם ראשי תיבות של ATP Binding Cassette.
- שונים מבחינה מבנית ממשאבות מסוג P.
- מעבירים בעיקר מולקולות קטנות כמו סוכרים או חלבונים קטנים, בניגוד למשאבות מסוג P שמעבירות בעיקר יונים.
- התגלו לראשונה בחיידקים והם בעלי חשיבות רבה בעמידות לאנטיביוטיקה, כיוון שהם יכולים להוציא אנטיביוטיקה מתוך החיידק החוצה, גם נגד מפל הריכוזים.
- חשוב לציין שטרנספורטרים מסוג ABC התפתחו הרבה לפני שבני אדם החלו להשתמש באנטיביוטיקה, כחלק מהמאבק האבולוציוני בין חיידקים לפטריות.
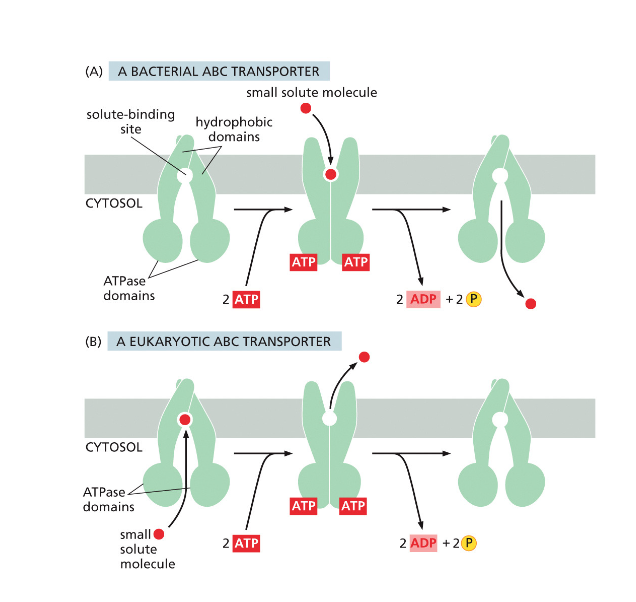
משאבות מסוג V ו-F (V-type and F-type ATPases)
- משאבות מסוג V (V-type): מוציאות פרוטונים (יוני מימן, $\ce{H^+}$) מהתא החוצה נגד מפל הריכוזים, תוך שימוש באנרגיה מ-ATP.
- משאבות מסוג F (F-type) או ATP סינתאז: פועלות בכיוון ההפוך - הן מנצלות את מפל הריכוזים של הפרוטונים (שרוצים להיכנס לתא) כדי לייצר ATP. זוהי למעשה טורבינה מולקולרית שמייצרת אנרגיה כאשר פרוטונים זורמים דרכה. זהו הבסיס לייצור אנרגיה בכל האורגניזמים החיים, במיוחד במיטוכונדריה ובכלורופלסטים.
הבהרה: משאבות V-type דורשות ATP כי הן פועלות נגד מפל הריכוזים, בעוד ש-F-type ATP סינתאז פועל עם מפל הריכוזים ולכן דווקא מייצר ATP.
משאבת הנתרן-אשלגן (Na⁺/K⁺ ATPase)
משאבת הנתרן-אשלגן היא אחד הטרנספורטרים החשובים ביותר בתאים. זוהי משאבה מסוג P שמשתמשת ב-ATP כדי להוציא נתרן ולהכניס אשלגן כנגד מפל הריכוזים של שניהם.
למרות שנתרן ואשלגן הם שניהם יונים חיוביים עם מטען זהה, המערכת הביולוגית מפרידה ביניהם. לכאורה מדובר בהשקעת אנרגיה מיותרת, אך כנראה שבפועל זה “פטנט” אבולוציוני מוצלח מאוד, שכן כל היצורים החיים משתמשים במנגנון משאבת הנתרן-אשלגן. כשליש מהאנרגיה המושקעת בתאים של בעלי חיים מוקדשת רק למשאבת נתרן-אשלגן.
המשאבה נחשבת יעילה משום שהיא משתמשת במולקולת ATP אחת בלבד כדי להוציא שלושה יוני נתרן מהתא ולהכניס שני יוני אשלגן פנימה.
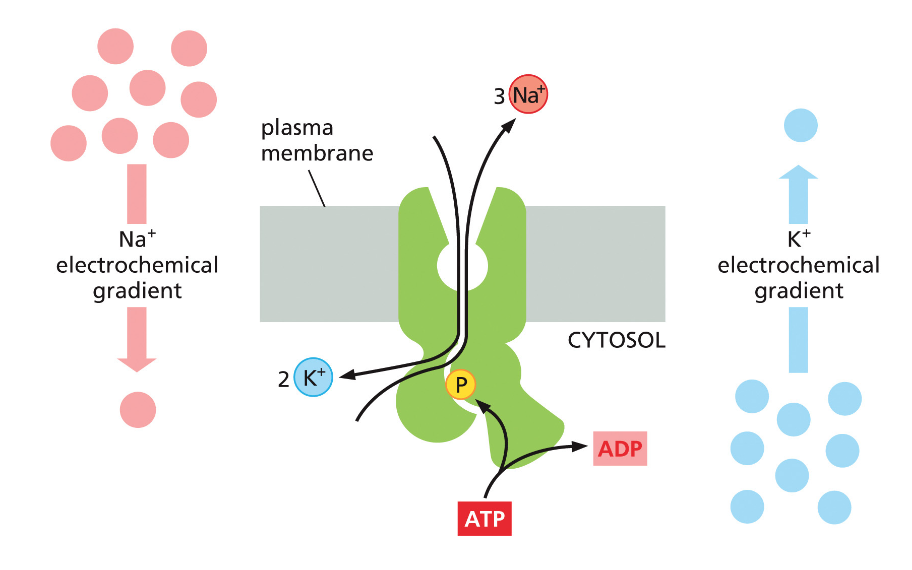
תעלות ממברנליות
בניגוד לטרנספורטרים, תעלות הן פשוט “חורים” בממברנה שיכולים להיפתח ולהיסגר. בדומה לכיור בבית, כשהפקק פתוח המים זורמים מלמעלה למטה בהתאם לכוח הכבידה. אין לכיור שליטה על כיוון הזרימה - זה נקבע על ידי כוחות חיצוניים.
באותו אופן, תעלות לא שולטות בכיוון מעבר החומרים דרכן - מפל הריכוזים הוא שקובע את כיוון המעבר. אולם, תעלות יכולות להיפתח ולהיסגר במהירות רבה מאוד, וזו תכונה חשובה במיוחד.
יתרונות התעלות
- מהירות: תעלות פועלות מהר הרבה יותר מטרנספורטרים, מה שהופך אותן למתאימות במיוחד להעברת אותות מהירים, כמו במערכת העצבים.
- יעילות בהעברת יונים: תעלות מאפשרות העברה מהירה של יונים, חיוניות במיוחד לתהליכים כמו העברת אותות עצביים ותגובות מהירות אחרות.
אולם, בניגוד לטרנספורטרים, תעלות יכולות לפעול רק עם מפל הריכוזים ולא נגדו, כיוון שהן אינן משתמשות באנרגיה.
תעלות יוניות וסלקטיביות מולקולרית: פלאי האבולוציה ברמה המולקולרית
בחלק זה של ההרצאה, נעמיק בנושא של תעלות ממברנליות, במיוחד בדגש על המנגנונים המופלאים שמאפשרים סלקטיביות מדויקת ברמה המולקולרית. כפי שנראה, האבולוציה פיתחה מבנים מורכבים אך מדויקים להפליא, שפועלים על בסיס הבדלים זעירים בין מולקולות ויונים.
תעלות לעומת טרנספורטרים: מהירות מול יכולת בקרה
יש הבדל דרמטי במהירות הפעולה בין שני סוגי חלבוני המעבר שלמדנו עליהם:
תעלות הן פי 10,000 מהירות יותר מטרנספורטרים. הבדל עצום זה מסביר מדוע תעלות הן החלבונים המועדפים בתהליכים הדורשים תגובה מהירה במיוחד, כמו העברת אותות עצביים.
אולם, למהירות זו יש מחיר: בניגוד לטרנספורטרים, לא ניתן לחבר תעלות למקור אנרגיה. כתוצאה מכך, הן אינן יכולות להעביר חומרים נגד מפל הריכוזים. האפשרות היחידה לבקרה היא קביעת הזמנים בהם התעלה נפתחת או נסגרת.
אקווה-פורינים: תעלות המים המופלאות
אחת הדוגמאות המרתקות ביותר לתעלות היא האקווה-פורין (מלשון “אקווה” - מים, “פור” - חור או מעבר). תעלות אלו נמצאות במקומות רבים בגוף שנדרשת בהם העברה מהירה של מים, כמו בתהליך הזעה.
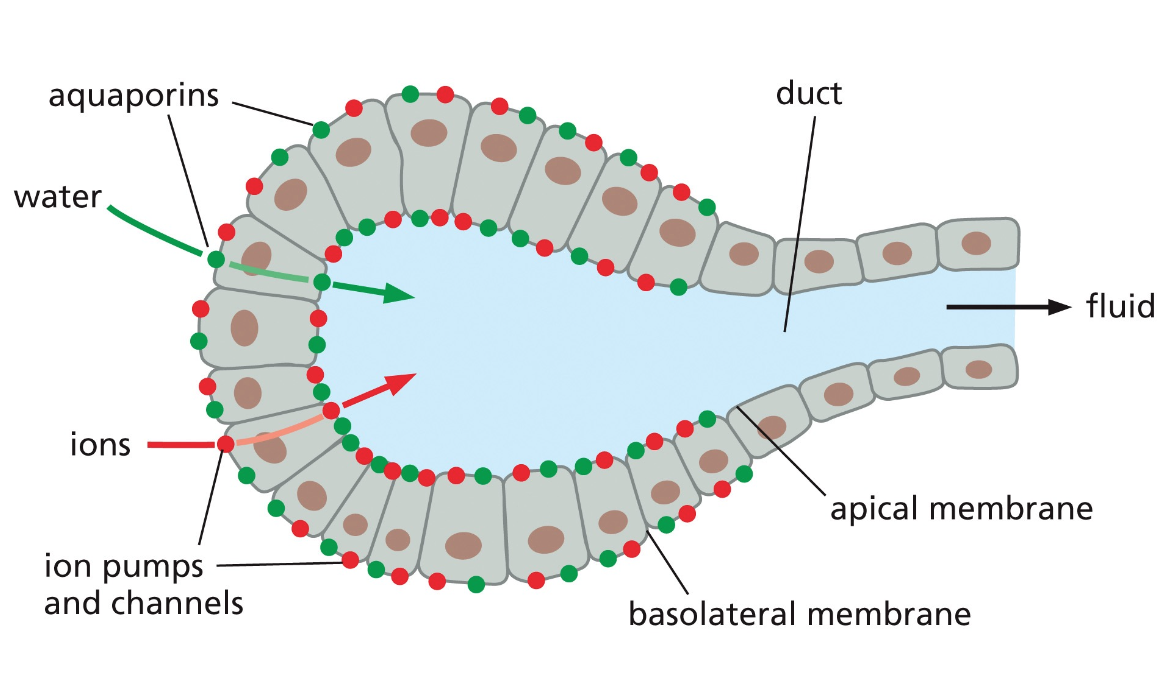
סלקטיביות מדהימה למולקולות מים בלבד
האקווה-פורינים מציגים רמת סלקטיביות מרשימה במיוחד - הם מעבירים מולקולות מים בלבד, למרות שנוזלי הגוף מכילים יונים רבים שבדרך כלל מוקפים במולקולות מים. כיצד הם מצליחים להפריד בין המים לבין היונים הקשורים אליהם?
המבנה המיוחד של האקווה-פורין כולל:
- מבנה סימטרי עם פתחים משני צדדיו
- קבוצות קרבוניל (C=O) בצדדי התעלה, היוצרות קשרים חולפים עם אטומי המימן של מולקולת המים
- חומצות אמינו מסוג אספרגין במרכז התעלה, עם קבוצות שיוצרות קשרים עם אטום החמצן של מולקולת המים
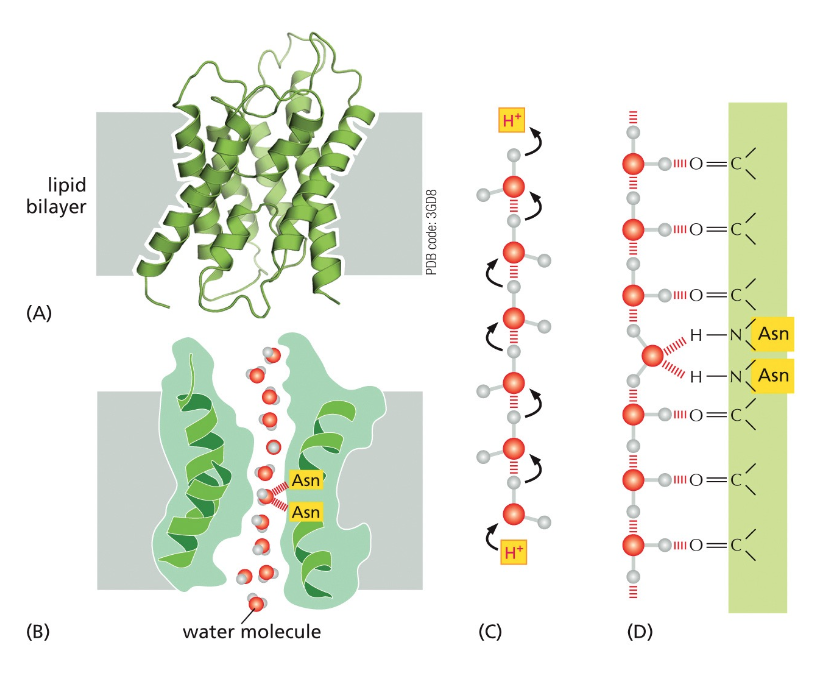
כאשר מולקולת מים עוברת דרך התעלה, מתרחש תהליך מדויק:
- תחילה, אטומי המימן של המים נקשרים לקבוצות הקרבוניל
- במרכז התעלה, אטום החמצן של המים נקשר לקבוצות האמינו של האספרגין
- בהמשך המסלול, נוצרים שוב קשרים עם המימן
רק מולקולת מים יכולה לבצע את השינויים האלה בקשרים - להיקשר פעם דרך המימן ופעם דרך החמצן. אף יון אחר אינו מסוגל לכך, ולכן אינו יכול לעבור דרך התעלה.
עקרונות בסיסיים של תעלות ממברנליות
כל תעלה ממברנלית בנויה משני מרכיבים עיקריים:
-
פילטר סלקטיבי (Selectivity Filter) - האזור הצר ביותר בתעלה הקובע אילו מולקולות או יונים יכולים לעבור דרכה
-
שער (Gate) - המנגנון המאפשר פתיחה וסגירה של התעלה, ובכך שליטה על מעבר החומרים
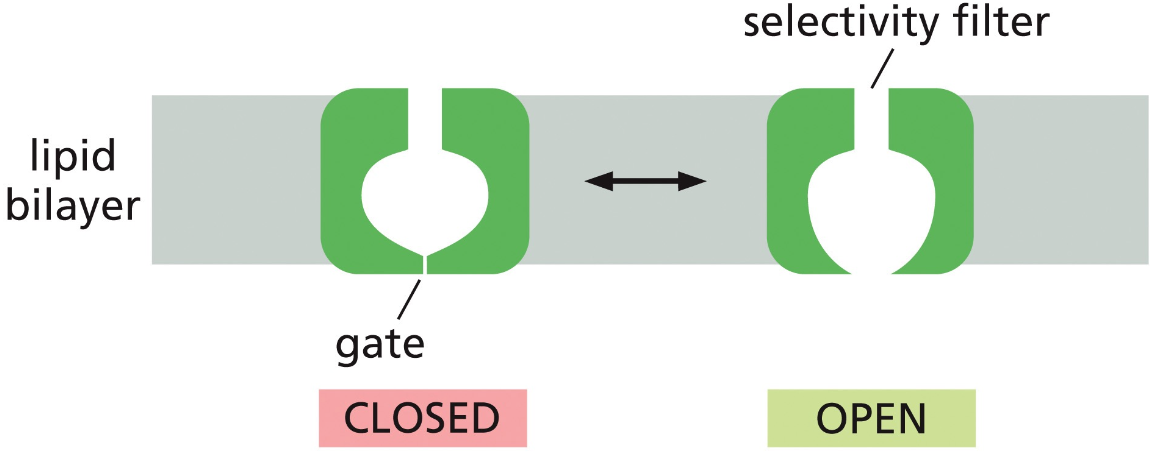
מכיוון שמפל הריכוזים הוא שקובע את כיוון המעבר, הדרך היחידה שבה התא יכול לשלוט בתהליך היא באמצעות פתיחה וסגירה של השער.
שלושה סוגים עיקריים של תעלות בעלות שער
התאים פיתחו מגוון מנגנונים לפתיחה וסגירה של תעלות:
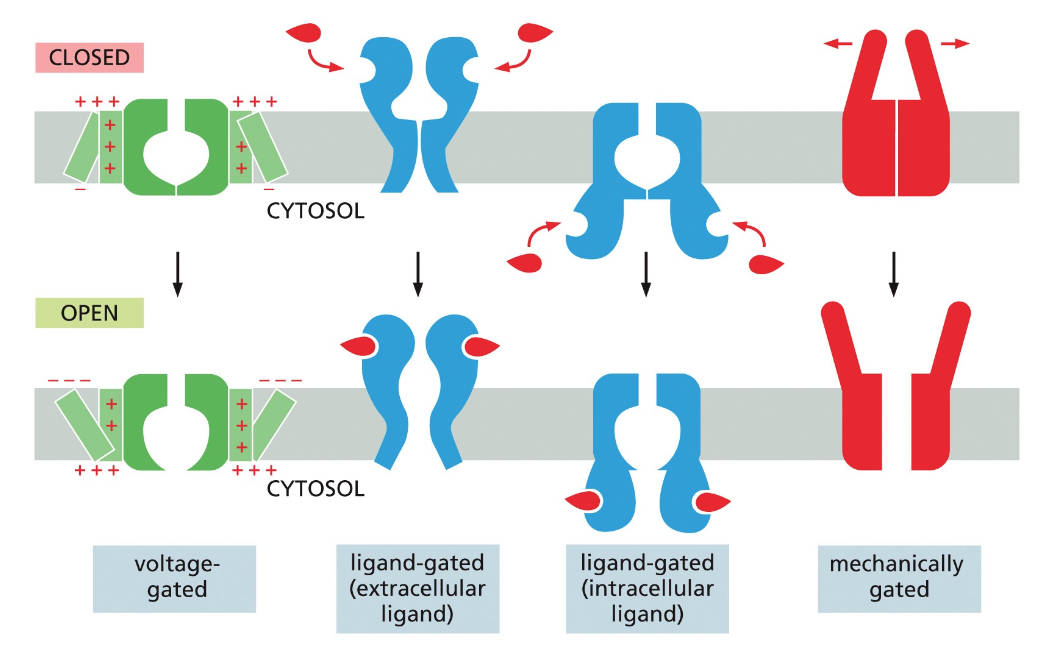
תעלות מבוקרות מתח (Voltage-Gated Channels)
תעלות מבוקרות מתח נפתחות ונסגרות בתגובה לשינויים במתח החשמלי על פני ממברנת התא. הן מהוות את הבסיס לפעילות החשמלית של נוירונים ותאי שריר.
תעלות מבוקרות ליגנד (Ligand-Gated Channels)
תעלות מבוקרות ליגנד נפתחות כאשר מולקולה ספציפית (ליגנד) נקשרת אליהן. במערכת העצבים, נוירוטרנסמיטורים כמו GABA, דופמין וסרוטונין משמשים כליגנדים כאלה.
תעלות מבוקרות ליגנד הן לרוב תעלות סידן, והסיבה לכך אינה מקרית - מפל הריכוזים של סידן הוא הגדול ביותר מבין כל היונים (פי 10,000!), מה שמבטיח תגובה מהירה במיוחד כשהתעלה נפתחת.
רוב הסמים המשפיעים על מערכת העצבים פועלים כליגנדים המתחרים בנוירוטרנסמיטורים הטבעיים על הקישור לתעלות אלו.
תעלות מבוקרות מכנית (Mechanically-Gated Channels)
תעלות מבוקרות מכנית מגיבות ללחץ פיזי על ממברנת התא. תעלות מסוג פיאזו (Piezo) הן דוגמה לכך, והן מאפשרות לנו לחוש מגע, לחץ וכאב.
תעלת האשלגן: פלא של דיוק מולקולרי
תעלת האשלגן מהווה אחת הדוגמאות המרשימות ביותר לדיוק המופלא בביולוגיה מולקולרית. היא מצליחה להבחין בין יוני אשלגן ($\ce{K^+}$) ליוני נתרן ($\ce{Na^+}$), למרות הדמיון הרב ביניהם:
- לשניהם מטען חיובי זהה (+1)
- ההבדל בגודל ביניהם הוא רק 40 פיקומטר (0.04 ננומטר)!
זהו הבדל זעיר להפליא, ובכל זאת התעלה מצליחה להבחין ביניהם בדייקנות מושלמת.
מנגנון הסלקטיביות המדויק
הפילטר הסלקטיבי של תעלת האשלגן כולל ארבע קבוצות קרבוניל המסודרות במעגל. כאשר יון מגיע לתעלה, עליו לוותר על מעטה המים שבדרך כלל מקיף אותו.
- יון האשלגן, בזכות גודלו המדויק, יכול ליצור ארבעה קשרים חולפים עם קבוצות הקרבוניל
- קשרים אלו מספקים לו יתרון אנרגטי מספיק כדי לשחרר את מולקולות המים ולעבור דרך התעלה
לעומת זאת:
- יון הנתרן, בהיותו קטן יותר, יכול ליצור רק שני קשרים עם קבוצות הקרבוניל
- שני קשרים אלו אינם מספיקים כדי להעניק לו יתרון אנרגטי על פני הקשרים שלו עם המים
- לכן, הנתרן “מעדיף” להישאר מוקף במים ואינו עובר דרך התעלה
המורכבות המופלאה של תהליכי החיים
הדוגמאות שראינו מבהירות את המורכבות המופלאה של תהליכי החיים ברמה המולקולרית. הבדל מזערי של 40 פיקומטר - מרחק שאיננו יכולים אפילו לדמיין - הוא ההבדל בין תפקוד תקין של הגוף לבין כשל מערכתי.
חשוב לציין שכל התעלות והטרנספורטרים שלמדנו עליהם הם חלבונים מסוג “מולטי-פאס” - כלומר, הם חוצים את ממברנת התא מספר פעמים. תכונה זו הכרחית ליצירת מבנים פונקציונליים שיכולים לשמש כתעלות או כטרנספורטרים.
האבולוציה, לאורך מיליארדי שנים, יצרה מערכות מדויקות להפליא שפועלות על בסיס הבדלים מולקולריים זעירים - דוגמה יפדה לדיוק ולמורכבות של עולם החי.
שיעור 10 - מבנה ותפקוד הגרעין
תאריך: 05/05/2025פתיחה: למה זה חשוב לרופאים?
הקורסים בשנים א׳ ו-ב׳ הם קורסי הליבה שקובעים את עתידכם כרופאים. הבנת התהליכים הבסיסיים של התא חיונית להבנת הפיזיולוגיה והפתופיזיולוגיה האנושית. במהלך השיעור נראה דוגמאות קליניות המדגימות כיצד הבנת תהליכים תאיים בסיסיים מאפשרת אבחון מדויק יותר, טיפולים טובים יותר, ואף מניעת מחלות.
הגוף האנושי במספרים: הפתעה ראשונה
כמה תאים יש בגופנו?
- גברים (70 ק”ג): 37 טריליון תאים
- נשים: 28 טריליון תאים
- ילדים: 14 טריליון תאים
אבל הנה ההפתעה: אנחנו לא לבד! בגופנו חיים גם כ-38 טריליון מיקרואורגניזמים, בעיקר חיידקים המרכיבים את המיקרוביום. חיידקים אלה עוזרים לנו לחיות ולהיות בריאים - מפרקים מזון, מייצרים ויטמינים, ומגנים מפני פתוגנים.
ההפתעה השנייה: 80% מהתאים שלנו חסרי גרעין
מתוך 37 טריליון תאים, כ-29 טריליון הם אריתרוציטים (כדוריות דם אדומות) ומבשריהם - תאים חסרי גרעין. נותרים “רק” 7 טריליון תאים עם גרעין המרכיבים את כל המערכות והרקמות.
מה מבדיל תאים אוקריוטיים מפרוקריוטיים?
התאים שלנו הם אוקריוטיים, בעוד החיידקים הם פרוקריוטיים. ההבדלים המרכזיים:
| מאפיין | תאים אוקריוטיים | תאים פרוקריוטיים |
|---|---|---|
| גרעין | קיים גרעין תחום בממברנה | אין גרעין תחום – ה-DNA חופשי בציטופלסמה |
| אברונים תחומי ממברנה | קיימים (מיטוכונדריה, ER, גולג׳י, פרוקסיזומים וכו’) | לא קיימים |
| מבנה ה-DNA | DNA ארוז עם חלבוני היסטונים | DNA מעגלי ולא ארוז, נמצא חופשי בציטופלסמה |
| מנגנוני בקרה תאית | מורכבים ומוסדרים | פשוטים יחסית |
הגרעין: האברון (אורגנלה) הגדול ביותר
הגרעין הוא מרכז הבקרה של התא - ה”דיסק הקשיח” שלו. קוטרו 20-5 מיקרומטר, והוא תופס חלק משמעותי מנפח התא. בגרעין שמור כל המידע הגנטי הדרוש לתא כדי:
- לגדול ולהתחלק
- להגיב לגירויים מהסביבה
- לבצע את תפקידיו הספציפיים
- לתקן נזקים
וריאציות במספר הגרעינים: התאמה לתפקוד
תאים ללא גרעין - אֵרִיתְרוֹצִיטים (Erythrocytes)
אֵרִיתְרוֹצִיטים הם תאי דם אדומים.
במהלך ההתמיינות מאריתרובלסט לאריתרוציט בוגר, מתרחש תהליך מרתק: הגרעין מפורק ומסולק באמצעות אוטופגיה. למה? כדי לפנות מקום מקסימלי למולקולות המוגלובין. זאת דוגמה יפה להתאמה אבולוציונית - ויתור על יכולת חלוקה וסינתזת חלבונים לטובת יעילות מקסימלית בנשיאת חמצן.
תאים רב-גרעיניים: כשצריך כוח ייצור
תאים טרופובלסטים (תאי שליה): בעלי 6-4 גרעינים או יותר. למה? התפתחות העובר דורשת אספקה מסיבית של חמצן, נוטריינטים וגורמי גדילה. ריבוי הגרעינים מאפשר סינתזת חלבונים בקצב גבוה במיוחד.
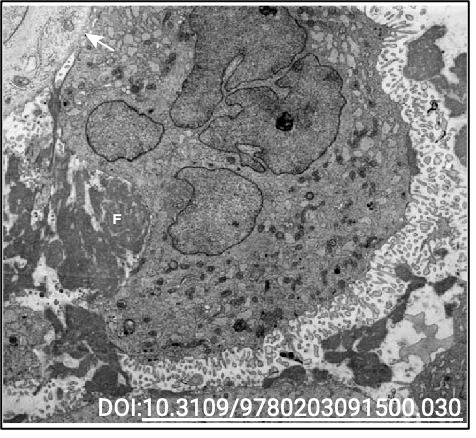
תאים אוסטאוקלסטים: תאים המפרקים עצם פגומה. כדי לבצע רזורבציה של עצם, הם צריכים לייצר כמויות עצומות של אנזימים. ריבוי הגרעינים (אנאפלואידיה) מגדיל את “כוח הייצור” של התא.
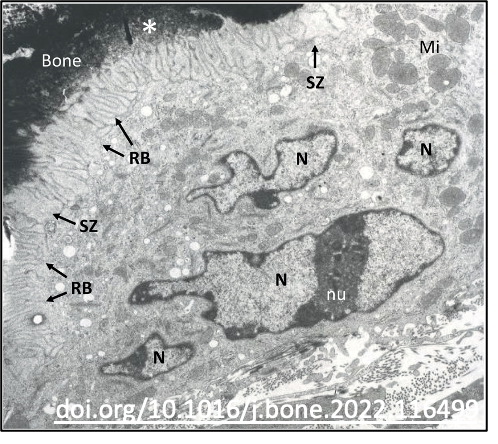
תאי שריר: עובדים תחת עומס מכני כבד ודורשים תחזוקה מתמדת של החלבונים המכווצים. ריבוי הגרעינים מאפשר לעמוד בדרישות אלה.
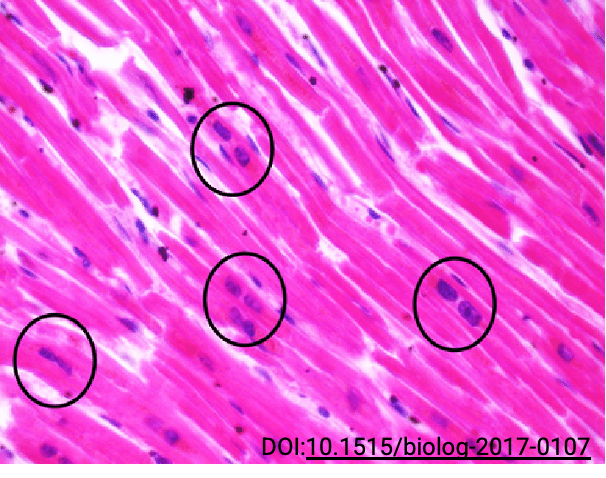
תאי קרדיומיוציטים: 2-1 גרעינים. תאים שעברו התמיינות סופית (terminally differentiated) אך עדיין צריכים יכולת סינתזה גבוהה.
תופעה מעניינת: ריבוי הגרעינים (אנאפלואידיה) מקטין את הסיכוי שהתא יהפוך לסרטני - כמות ה-DNA הגדולה מקשה על התא להפוך לאינווזיבי.
צורת הגרעין כסמן דיאגנוסטי
פתולוגים משתמשים בצורת הגרעין כאחד הסמנים הדיאגנוסטיים החשובים ביותר כבר למעלה ממאה שנה. גרעין עגול וסדיר מעיד על תא בריא, בעוד עיוותים בצורה (nuclear dysmorphism) מעידים על פתולוגיה.
מבנה הגרעין: ארכיטקטורה מורכבת
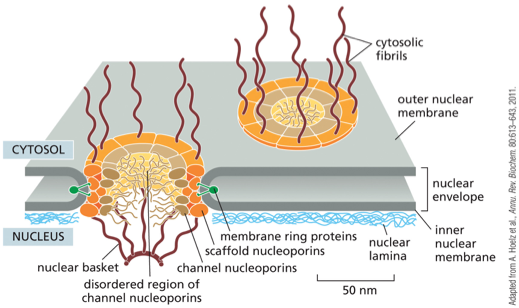
מעטפת הגרעין - לא סתם קליפה
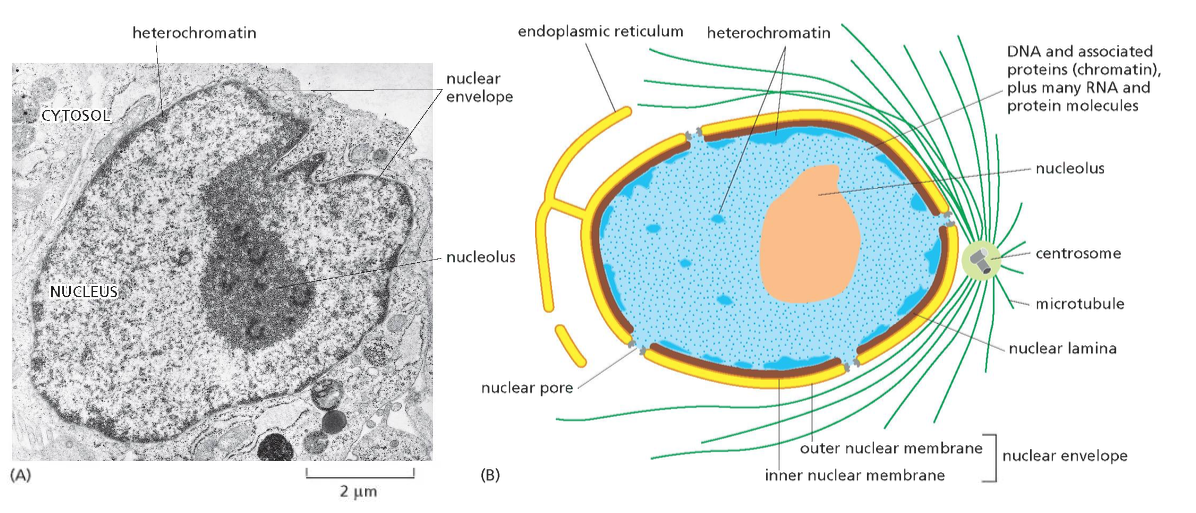
מעטפת הגרעין בנויה משתי ממברנות ליפידיות:
הממברנה החיצונית:
- רציפה עם ה-ER המחוספס
- מכוסה בריבוזומים
- מאפשרת מעבר ישיר של חלבונים מה-ER לגרעין
הממברנה הפנימית:
- מכילה חלבונים ייחודיים
- מעגנת את הלמינה הגרעינית
- קובעת את מיקום הכרומטין
המרווח הבין-ממברני:
- רוחב 50-30 ננומטר
- רציף עם חלל ה-ER
- מאפשר תנועת חלבונים
נקבוביות גרעיניות - שערי הגרעין
קומפלקסים ענקיים של 250-150 חלבונים (נוקלאופורינים) היוצרים תעלות סלקטיביות. כמו “שומר במועדון” - מכניסים רק את מי שצריך:
- יונים וחומרי תזונה - עוברים בדיפוזיה
- מקרומולקולות - רק עם “כרטיס כניסה” (סיגנל גרעיני)
הלמינה הגרעינית - השלד הפנימי
רשת חלבונים הצמודה לממברנה הפנימית, בעובי של כ-3.5 ננומטר בלבד אך חזקה להפליא. מורכבת משני סוגי למינים:
למין A/C:
- מקודד מגן יחיד (LMNA) על כרומוזום 1
- קושר ישירות לכרומטין ב-LADs
- מוטציות גורמות לפנוטיפים חמורים
למין B1/B2:
- מקודדים משני גנים על כרומוזומים שונים
- יוצרים את הרשת המבנית
- יתירות גנטית מספקת הגנה חלקית
תפקידי הלמינה:
- מבנית: קובעת צורת הגרעין ויציבותו המכנית
- ארגונית: מעגנת כרומטין במיקומים ספציפיים
- רגולטורית: משפיעה על ביטוי גנים
- תפקודית: חיונית לשכפול DNA ולתיקון נזקים
מערכת LINC - הגשר בין גרעין לציטופלסמה
קומפלקס LINC (Linker of Nucleoskeleton and Cytoskeleton) מחבר את הלמינה הגרעינית לשלד התא:
- חלבוני SUN: בממברנה הפנימית, קושרים למינים
- חלבוני נספרין: בממברנה החיצונית, קושרים מיקרוטובולים ואקטין
מערכת ה-LINC מאפשרת מכנוטרנסדוקציה - העברת כוחות מכניים מהסביבה לגרעין. לחיצה על הרקמה מועברת דרך שלד התא ללמינה, משנה את ארגון הכרומטין ומשפיעה על ביטוי של גנים (למשל, סינתזת מיוזין בתגובה לעומס מכני).
כשהגרעין כושל: למינופתיות
פרוגריה - טרגדיה של הזדקנות מואצת
מוטציה נקודתית בגן LMNA גורמת ל-Hutchinson-Gilford Progeria Syndrome. המוטציה יוצרת חלבון פגום (פרוגרין) שאינו יכול ליצור פולימריזציה תקינה. התוצאה:
ברמה התאית:
- עיוות דרמטי בצורת הגרעין (“ציפור” במקום כדור)
- פגיעה בארגון הכרומטין
- הפרעה בתיקון DNA
- פגיעה בחלוקת תאים
 |  |
|---|---|
| תא תקין | תא פרוגריה |
ברמה הקלינית:
- הזדקנות מואצת מגיל צעיר (השראה לסרט “בנג׳מין באטן”)
- מיופתיה - חולשת שרירי שלד
- ליפודיסטרופיה - אובדן רקמת שומן
- בעיות קרדיווסקולריות חמורות
- התקרחות ושינויי עור
- תוחלת חיים: 21-14 שנים
המחלה נדירה (1:1,000,000) אך תרמה רבות להבנת תהליכי הזדקנות נורמליים.
מוטציות בלמין B - ספקטרום שונה
בניגוד ללמין A, בלמין B קיימת יתירות גנטית (שני גנים). לכן הפנוטיפ פחות חמור אך מגוון:
- אפילפסיה ואטקסיה
- מיקרוצפליה
- נטייה לאלצהיימר
- ליפודיסטרופיה
- סרטן
ההבדל נובע מכך שלמין B אינו קושר ישירות כרומטין, והיתירות הגנטית מאפשרת פיצוי חלקי.
ארגון הכרומטין: לא סתם ספגטי
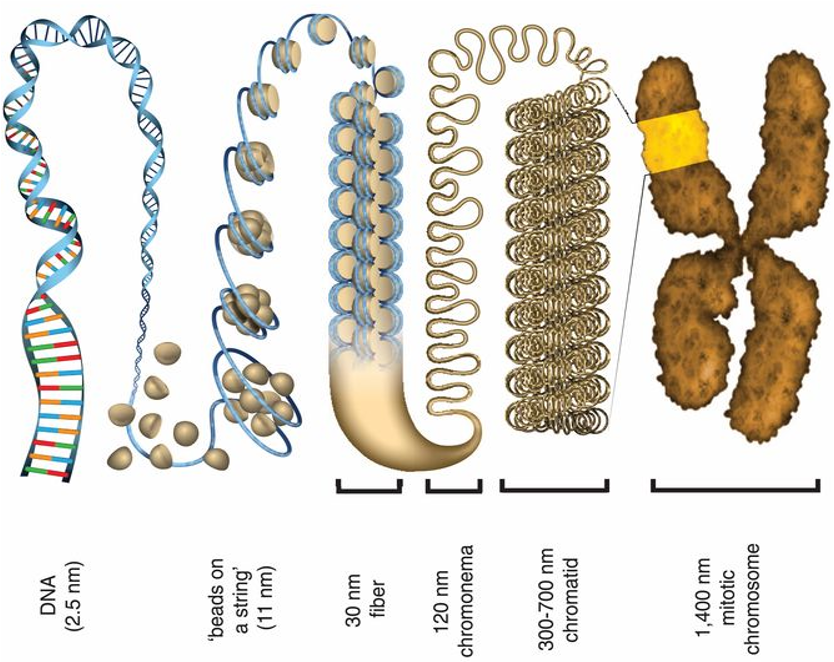
הגדרות בסיסיות שחשוב להבין
- DNA: המולקולה הדו-גדילית עצמה, רצף הנוקלאוטידים
- כרומטין: DNA + חלבונים (היסטונים ולא-היסטונים). זו צורת הארגון הפונקציונלית
- כרומוזום: יחידת כרומטין שלמה המכילה מולקולת DNA אחת ארוכה
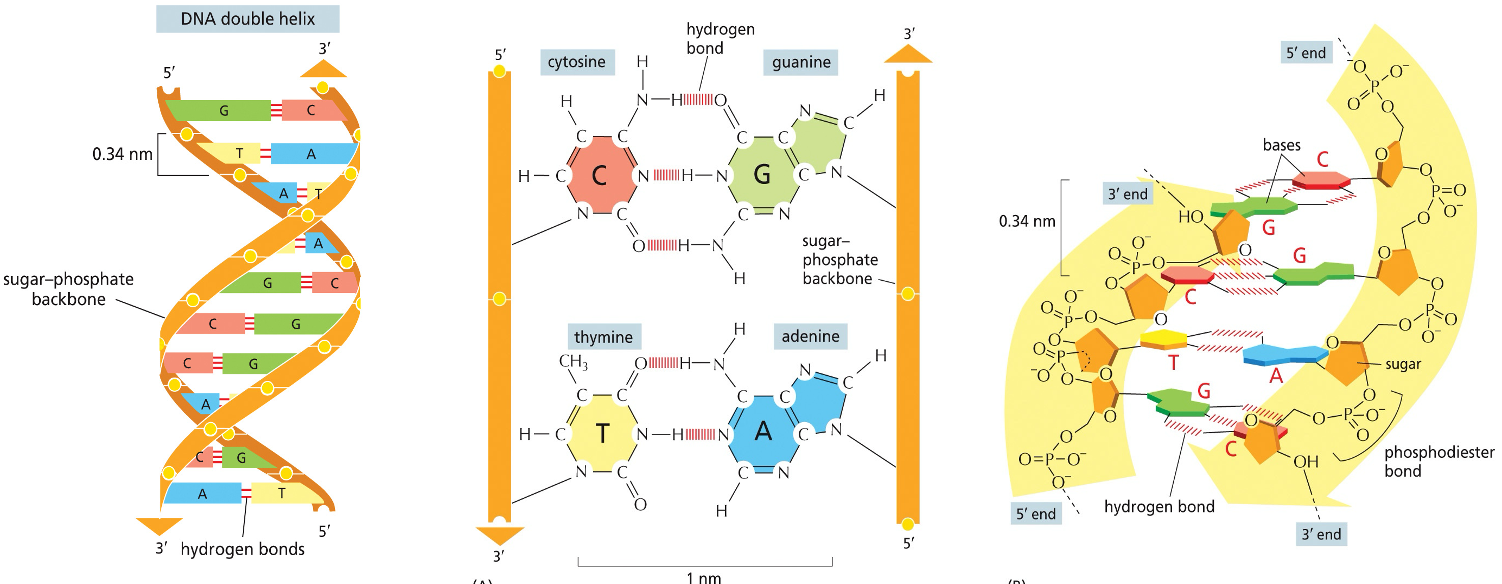
חשוב: DNA לעולם אינו “עירום” בתא - הוא תמיד קשור לחלבונים!
שני מצבי הכרומטין
יוכרומטין (Euchromatin)
- כרומטין פתוח, נגיש
- מכיל גנים פעילים (“housekeeping genes”)
- ממוקם במרכז הגרעין
- מאפשר שעתוק, שכפול ותיקון
הטרוכרומטין (Heterochromatin)
- כרומטין דחוס, לא נגיש
- מכיל גנים מושתקים
- ממוקם בפריפריה, צמוד ללמינה
- מוגן מפעילות לא רצויה
המיקום הפריפרי אינו מקרי - הקישור ללמין A מייצב את הדחיסות. שינוי במבנה הלמינה (כמו בפרוגריה) משבש ארגון זה.
טריטוריות כרומוזומליות - לא ספגטי
בניגוד למה שחשבו בעבר, הכרומוזומים אינם מפוזרים אקראית “כמו ספגטי במרק”. לכל כרומוזום יש טריטוריה מוגדרת בגרעין התלת-ממדי.
ארגון זה:
- ספציפי לסוג התא
- משתנה בהתאם למצב הפיזיולוגי
- חיוני לתפקוד תקין
- משובש במחלות
כשלמין A פגום, הכרומוזומים “לא במקום הנכון” - פוגע בשעתוק, שכפול ותיקון.
הגנום האנושי: עוד הפתעות
המספרים הבסיסיים
- תאים דיפלואידים: 46 כרומוזומים (22 זוגות אוטוזומים + זוג כרומוזומי מין)
- תאים הפלואידים (זרע וביצית): 23 כרומוזומים
- גודל הגנום: ~3 מיליארד זוגות בסיסים (הפלואידי), 6 מיליארד (דיפלואידי)
ההפתעה הגדולה של פרויקט הגנום האנושי (2003)
רק 2.5-1.5% מהגנום מקודד לחלבונים! כ-21,000 גנים בלבד - דומה למספר הגנים בתולעת C. elegans או בזבוב הפירות!
אז איך אנחנו כל כך מורכבים? התשובה טמונה ב:
- ויסות גנים מתוחכם
- שחבור אלטרנטיבי
- מודיפיקציות פוסט-תרגומיות
- אינטראקציות מורכבות בין חלבונים
הגן הגדול ביותר - דיסטרופין
2.5 מיליון זוגות בסיסים! ממוקם על כרומוזום X, מקודד לחלבון המחבר את שלד התא לממברנה בתאי שריר.
מוטציות גורמות ל:
- Duchenne Muscular Dystrophy: מחלה קשה, בעיקר בבנים
- Becker Muscular Dystrophy: צורה קלה יותר
למה בעיקר בבנים? כי יש להם רק עותק אחד של כרומוזום X. לבנות יש שניים - אם אחד פגום, השני מפצה.
DNA תחת מתקפה מתמדת
בכל 45 דקות של שיעור מתרחשים כ-2,500 אירועי נזק ל-DNA בכל תא! מכפילים ב-37 טריליון תאים - המספרים מדהימים.
מקורות הנזק:
- ROS ממטבוליזם רגיל (Reactive Oxygen Species)
- קרינה
- חומרים רעילים (פורמלדהיד, בנזופירן)
- טעויות בשכפול
למזלנו, במהלך האבולוציה פיתחנו מנגנוני תיקון יעילים. אבל - הם עובדים ביעילות מרבית רק כשהכרומטין מאורגן נכון! זאת סיבה נוספת להרסניות של מוטציות בלמינים.
DNA מיטוכונדריאלי - הגנום השני
בנוסף לגנום הגרעיני, יש לנו DNA גם במיטוכונדריה - Mitochondrial DNA (mtDNA):
- מעגלי (כמו בחיידקים - עדות למקור האנדוסימביוטי)
- ללא היסטונים
- מקודד לאנזימים של מחזור קרבס ושרשרת הנשימה
- עובר בירושה אימהית
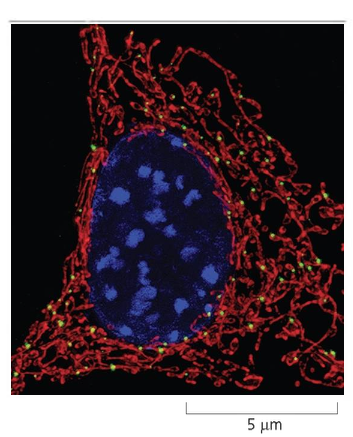
סיכום: הגרעין כאורגניזם חי
הגרעין אינו מחסן פסיבי של DNA. זהו אברון דינמי המשלב:
- הגנה: מעטפת כפולה, למינה חזקה, ארגון מרחבי מדויק
- תקשורת: נקבוביות סלקטיביות, מערכת LINC, מכנוטרנסדוקציה
- ויסות: ארגון כרומטין דינמי, טריטוריות כרומוזומליות, LADs
- תגובתיות: שינוי ארגון בתגובה לגירויים, ביטוי גנים ממוקד
- תחזוקה: תיקון מתמיד של נזקים, שמירה על יציבות גנטית
הבנת המבנה והתפקוד של הגרעין היא הבסיס להבנת מחלות רבות ולפיתוח טיפולים. מלמינופתיות נדירות ועד סרטן שכיח, מהזדקנות נורמלית ועד מחלות ניווניות - הכל מתחיל בגרעין.
זכרו: בביולוגיה ובמיוחד בביולוגיה של התא, יש הרבה מאוד “אבל”. זו המורכבות שהופכת את התחום למרתק, ואת הרפואה למקצוע מאתגר שדורש הבנה עמוקה של התהליכים הבסיסיים.
שיעור 11 - מבנה ותפקוד הגרעין (חלק 2)
תאריך: 07/05/2025פרק 4: ארכיטקטורה מולקולרית של הגרעין - מבנה הכרומטין ומנגנוני הוויסות האפיגנטי
הקדמה: הגרעין כמרכז בקרה מולקולרי
גרעין התא מייצג את המבנה המורכב ביותר בתא האוקריוטי, המשמש כמרכז הבקרה לכל התהליכים התאיים. מעטפת הגרעין הדו-שכבתית יוצרת תא נפרד המכיל את כל המידע הגנטי הנדרש לתפקוד התא, רבייתו והעברת המידע הגנטי לדורות הבאים. המבנה הייחודי של מעטפת הגרעין, הכוללת קשר רציף בין הממברנה החיצונית לרשת האנדופלזמטית הגסה (rER), מאפשר העברה יעילה של תוצרי שעתוק מהגרעין לאתרי סינתזת החלבונים.
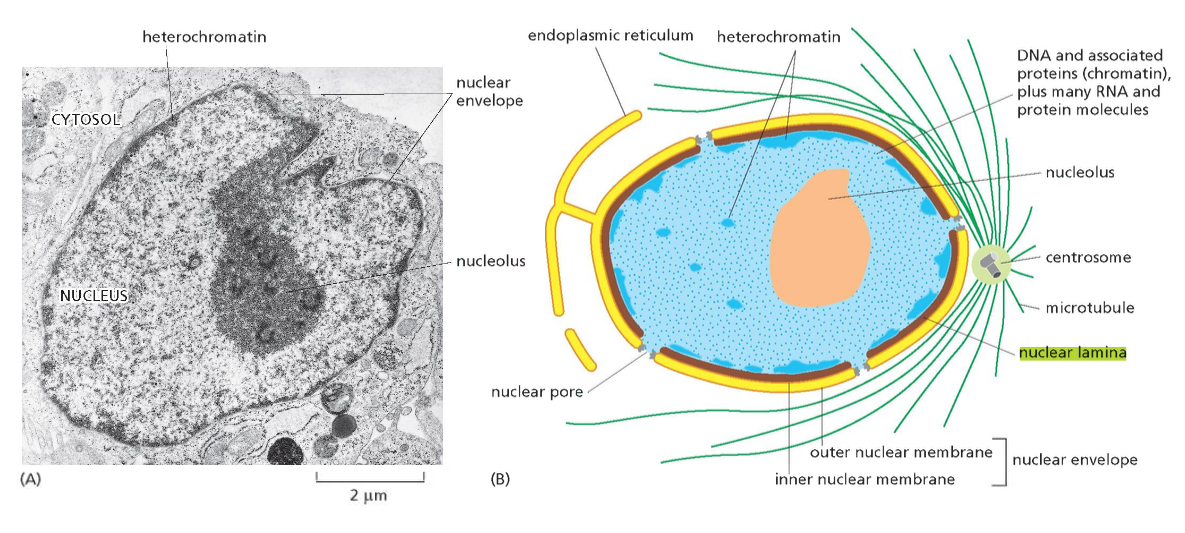
הלמינה הגרעינית: המסגרת המבנית של הגרעין
הממברנה הפנימית של המעטפת הגרעינית קשורה באופן הדוק לרשת חלבונים ייחודית הנקראת הלמינה הגרעינית (Nuclear Lamina). הלמינה הגרעינית מורכבת בעיקר משני חלבונים פיברילריים עיקריים: למין A ולמין B.
למין A ולמין B שייכים למשפחת חלבונים בשם פילמנט ביניים (Intermediate filaments - ״סיבי ביניים״ או ״קורי ביניים״) והם מבצעים מספר תפקידים קריטיים:
תפקידים מבניים:
- שמירה על צורת הגרעין ועל החוזק המכני שלו
- עיגון נקודות חיבור לכרומטין
- ארגון מרחבי של הכרומוזומים בתוך הגרעין
תפקידים רגולטוריים:
- השתתפות בארגון הטרוכרומטין באזור הפריפריה הגרעינית
- וויסות תהליכי חלוקת התא
- השפעה על ביטוי גנים דרך אינטראקציות עם חלבוני שעתוק
המשמעות הרפואית של חלבוני הלמינה
בולטת במספר מחלות קשות הנובעות ממוטציות בגנים המקודדים לחלבונים אלו:
- פרוגריה (תסמונת ההזדקנות המואצת) - מוטציות בגן LMNA גורמות להצטברות חלבון למין A פגום, המוביל לאי-יציבות גרעינית ולהזדקנות מואצת
- מחלות לב תורשתיות - חלק מהקרדיומיופתיות הדילטטיביות נגרמות על ידי מוטציות בלמין A/C
- מחלות נוירודגנרטיביות - קשר בין מוטציות בלמינים לבין צורות מסוימות של מחלת אלצהיימר
ארכיטקטורה של הגנום האנושי: מעבר לפרדיגמה המקודדת
התפלגות התוכן הגנומי
הגנום האנושי, המכיל כ-3.2 מיליארד זוגות נוקלאוטידים הפרוסים על פני 46 כרומוזומים, מציג תמונה מפתיעה של ארגון המידע הגנטי. ניתוח מפורט מגלה כי רק 2.5% מהגנום מקודד לחלבונים, בעוד ש-97.5% הנותרים מורכבים מרכיבים אחרים בעלי משמעות ביולוגית רבה.
החלוקה המפורטת של הגנום האנושי:
- רצפים מקודדים (2.5%)
- אקסונים המתורגמים לחלבונים
- כוללים כ-25,000-20,000 גנים
- אינטרונים (Intron) ואזורים רגולטוריים (47.5%)
- רצפי DNA הנמצאים בין אקסונים
- אלמנטים רגולטוריים (enhancers, silencers, promoters)
- רצפים המקודדים ל-microRNAs ו-long non-coding RNAs
- אלמנטים חוזרים (50%)
- הקטגוריה הגדולה ביותר בגנום
- מתחלקת למספר תת-קטגוריות משמעותיות
אלמנטים חוזרים: המרכיב הדומיננטי בגנום
״רצפים חוזרים (הידועים גם כאלמנטים חוזרים, יחידות חוזרות או חזרות) הם תבניות קצרות או ארוכות של חומצות גרעין (DNA או RNA) המופיעות במספר עותקים ברחבי הגנום. באורגניזמים רבים, חלק ניכר מה-DNA חוזר על עצמו, כאשר למעלה משני שלישים מהרצף מורכב מאלמנטים חוזרניים בבני אדם.[1] חלק מהרצפים החוזרים הללו נחוצים לשמירה על מבני גנום חשובים כגון טלומרים.
רצפים חוזרים מסווגים לסיווגים שונים לפי תכונות כגון מבנה, אורך, מיקום, מוצא ואופן ההכפלה.״ ויקיפדיה
האלמנטים החוזרים מהווים את הרכיב הגדול ביותר בגנום האנושי ומתחלקים לקטגוריות עיקריות:
אלמנטים חוזרים רטרו-ויראליים (Retroviral Elements)
אלמנטים רטרו-ויראליים נובעים מחדירה של ווירוסים רטרו-ויראליים לגנום האנושי במהלך האבולוציה. התהליך כולל:
- זיהום ראשוני - וירוס רטרו-ויראלי נכנס לתא
- טרנסקריפציה הפוכה - RNA ויראלי מומר ל-DNA באמצעות האנזים Reverse Transcriptase
- אינטגרציה - DNA ויראלי נכנס לגנום המארח
- קיבוע אבולוציוני - אם האינטגרציה מתרחשת בתאי הזרע, הרצף מועבר לצאצאים
התהליך ממשיך להתרחש גם בימינו כאשר אנו נדבקים בווירוסים רטרו-ויראליים:
- HIV/AIDS - משאיר “טביעת אצבע” בגנום התאים הנגועים
- HTLV (Human T-Lymphotropic Virus)
- וירוסי קורונה מסוימים - יכולים להשאיר חתימה גנומית
אלמנטים חוזרים מסוג LINE ו-SINE
LINE (Long Interspersed Nuclear Elements)
- מהווים כ-20% מהגנום
- אורכם נע בין מאות לאלפי נוקלאוטידים
- מקודדים לחלבונים הדרושים לשכפולם העצמי
- הפעילים ביותר הם מסדרת LINE-1 (L1)
SINE (Short Interspersed Nuclear Elements)
- מהווים כ-13% מהגנום
- קצרים יותר מ-LINE (בדרך כלל מתחת ל-500 נוקלאוטידים)
- הנפוצים ביותר הם אלמנטי Alu (כמיליון עותקים בגנום)
- תלויים ב-LINE עבור מנגון השכפול שלהם
Interspersed - “משובץ” או “מפוזר לסירוגין”. כלומר, SINE ו-LINE “משובצים” באקראי בין גנים אחרים או בתוך אזורים לא מקודדים.
הדינמיקה האבולוציונית של אלמנטים חוזרים
אלמנטים חוזרים יכולים לעבור “אבולוציה פנימית” בתוך הגנום באמצעות תהליך רב-שלבי:
- שעתוק - יצירת mRNA מהאלמנט החוזר
- טרנסקריפציה הפוכה - המרת mRNA בחזרה ל-DNA באמצעות Reverse Transcriptase
- אינטגרציה - הכנסת רצף ה-DNA החדש למיקום אחר בגנום
- הרחבת המשפחה - יצירת עותקים רבים של האלמנט
וויסות ביטוי אלמנטים חוזרים
בתאים בריאים, הביטוי של אלמנטים חוזרים נשמר ברמה נמוכה מאוד באמצעות מספר מנגנונים:
- ארגון בהטרוכרומטין - רוב האלמנטים החוזרים נמצאים באזורי כרומטין דחוסים
- מתילציה של DNA - מעכבת שעתוק של רצפים חוזרים
- מודיפיקציות מעכבות של היסטונים - יוצרות סביבה כרומטינית שלא מתאימה לשעתוק
השלכות פתולוגיות של אי-וויסות
כאשר מערכות הוויסות נכשלות, כמו במחלות הבאות, אלמנטים חוזרים עלולים להתבטא בצורה לא מבוקרת:
- סרטן - אי-יציבות גנומית גורמת לביטוי אלמנטים חוזרים
- פרוגריה - הזדקנות מואצת קשורה לשבירה של ארגון הכרומטין
- מחלות אוטואימוניות - ביטוי אלמנטים חוזרים עלול לעורר תגובה חיסונית
מבנה ודינמיקה של הכרומטין
האתגר הפיזיקלי של אריזת DNA
הגנום האנושי מכיל בכל תא סומטי (תא בגוף שאינו תא מין - כלומר לא תא זרע או ביצית), 46 כרומוזומים (23 זוגות), ואם נפרוש את כל מולקולות ה-DNA במשטח ליניארי, נקבל אורך כולל של כ-שני מטר. התא צריך לארוז כמות עצומה זו של מידע גנטי בתוך גרעין שקוטרו נע בין 20-5 מיקרומטר בלבד - יחס דחיסה של יותר ממיליון לאחד.
למה DNA לא יכול להתקיים לבד?
מולקולת DNA גולמית בתוך התא הייתה:
- נפגעת מיד על ידי מנגנוני ההגנה התאיים שמזהים DNA חופשי כאיום
- חשופה לנזק מרדיקלים חופשיים ומחמצנים סלולריים
- לא זמינה בצורה מבוקרת לתהליכי שעתוק ושכפול
- עלולה ליצור קשרים לא רצויים עם מולקולות אחרות
לכן, כל ה-DNA בתא האוקריוטי קיים בצורה של כרומטין - קומפלקס דינמי של DNA וחלבונים המספק הגנה, ארגון וויסות.
הנוקלאוזום: היחידה הבסיסית של הכרומטין
הרכב מולקולרי של הנוקלאוזום
הנוקלאוזום מהווה את אבן הבניין הבסיסית של הכרומטין.
הנוקלאוזום מורכב ממרכיבים מדויקים:
רכיב ה-DNA
- 147 זוגות נוקלאוטידים בדיוק
- DNA דו-גדילי נכרך סביב ליבת ההיסטון פעם אחת ושלושה רבעים
- כל “לפיפה” של ה-DNA סביב ההיסטון כוללת כ-10.4 זוגות נוקלאוטידים
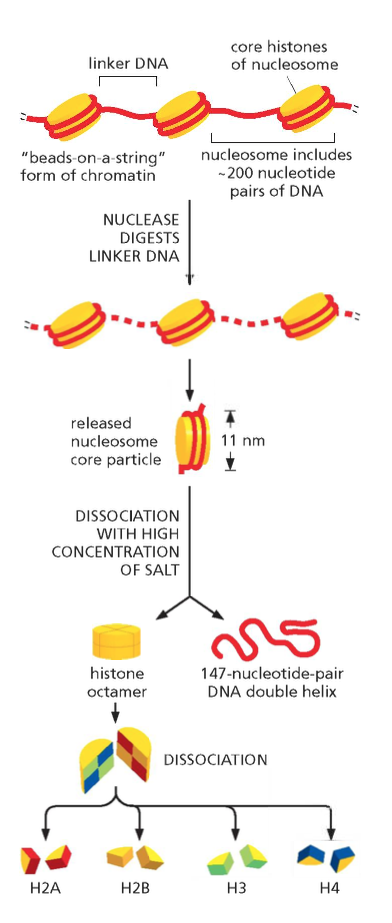
ליבת ההיסטון (Histone Octamer)
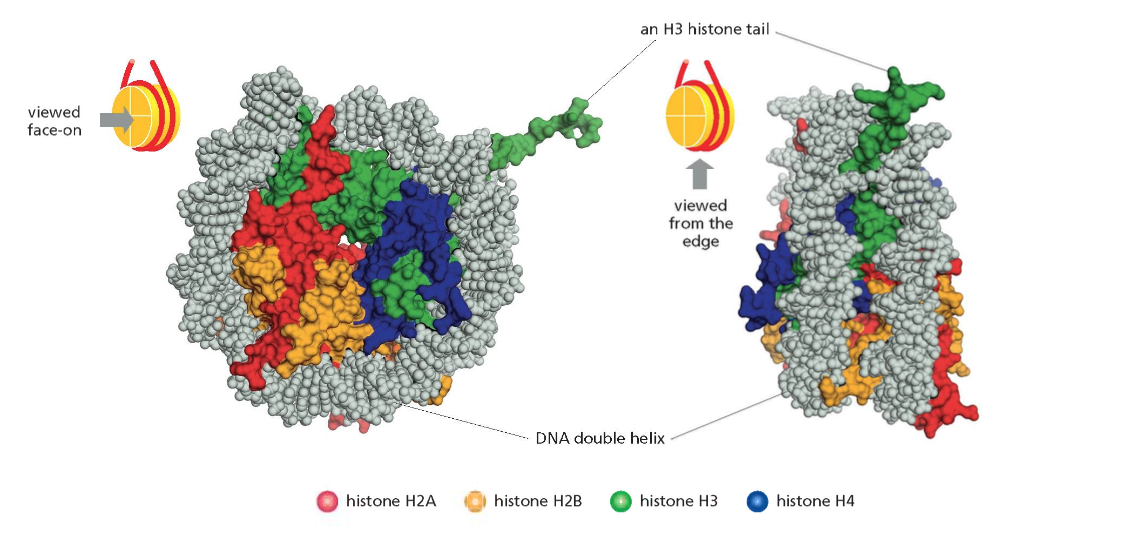
שמונה חלבוני היסטון המורכבים מארבעה זוגות:
- שני עותקים של H2A
- שני עותקים של H2B
- שני עותקים של H3
- שני עותקים של H4
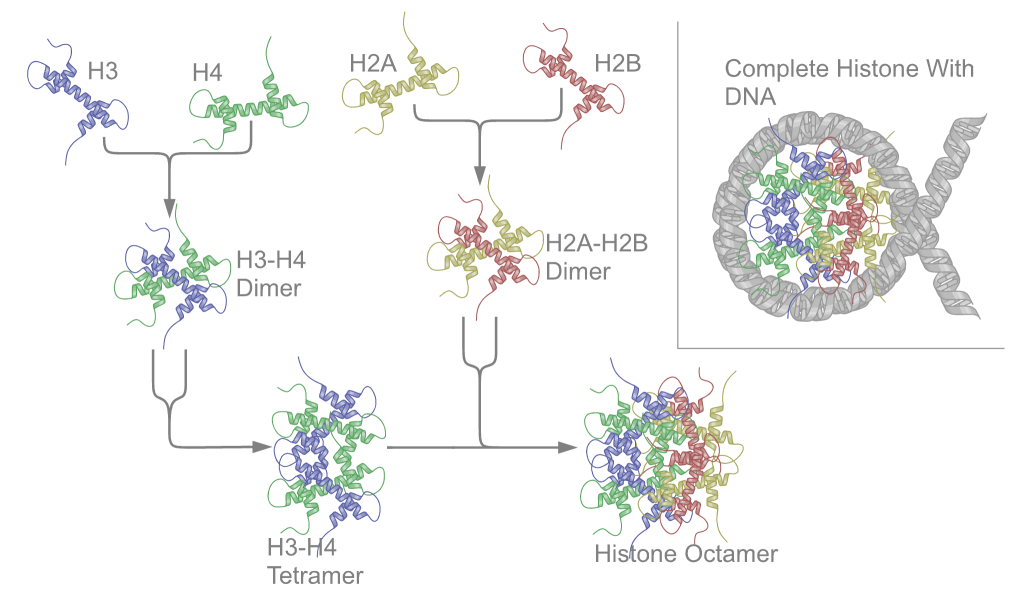
חלבונים אלו מאורגנים כדימרים יציבים:
- דימר H2A-H2B (מתקשר כיחידה)
- דימר H3-H4 (מתקשר כיחידה)
- שני דימרים H3-H4 יוצרים טטרמר מרכזי
- שני דימרי H2A-H2B נקשרים לטטרמר המרכזי
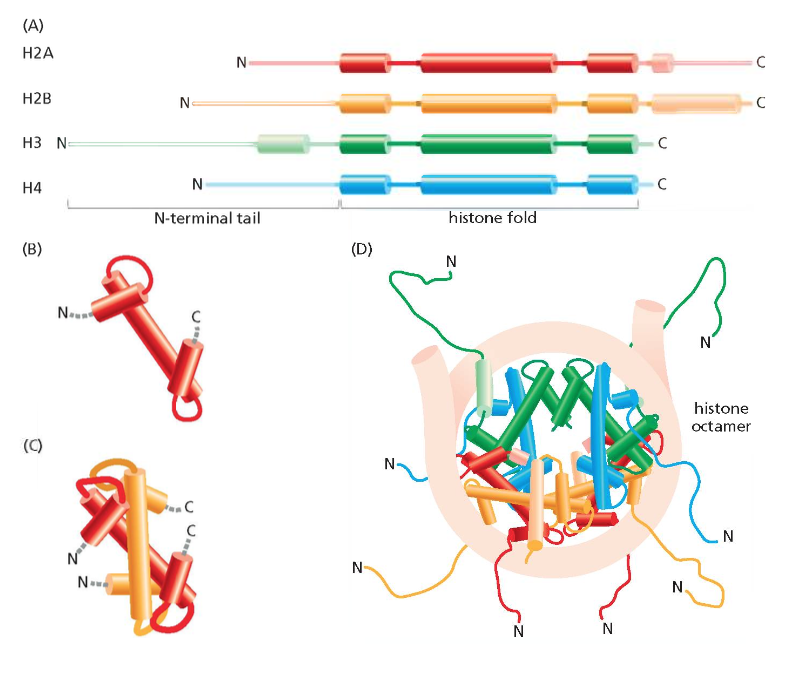
מאפיינים מולקולריים של אינטראקציות DNA-היסטון
טבע הקשרים
הקישור בין DNA לחלבוני ההיסטון הוא לא קוולנטי. הוא מבוסס על מספר סוגי אינטראקציות:
- קשרי מימן - בין זוגות הבסיסים לחומצות האמינו בחלבוני ההיסטון
- אינטראקציות אלקטרוסטטיות - בין הזרחתנים הטעונים שלילית ב-DNA לחומצות ליזין וארגינין הטעונות חיוביתיות בהיסטונים
- כוחות ואן דר ואלס - אינטראקציות חלשות המתרחשות במרחקים קצרים
מיקום הקישור - התעלה הקטנה
הקשר בין DNA לחלבוני ההיסטון מתרחש בעיקר דרך ה-Minor Groove (תעלה קטנה או אולי חריץ קטן) של מולקולת ה-DNA. באזור זה ניתן לגשת לזוגות הבסיסים מבלי לפתוח את הסליל הכפול, מה שמאפשר זיהוי ספציפי של רצפים.
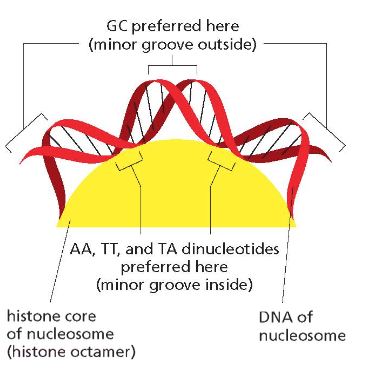
ספציפיות רצף
יש עדיפות ברורה לרצפי נוקלאוטידים מסוימים:
- AA (אדנין-אדנין)
- TT (תימין-תימין)
- TA (תימין-אדנין)
הרצפים האלו יוצרים בתעלה הקטנה מבנה תלת-ממדי שמתאים במיוחד לקישור חלבוני היסטון. זה מסביר מדוע:
- אלמנטים חוזרים, העשירים ברצפים אלו, נקשרים בחוזקה לנוקלאוזומים
- אזורים אלו נמצאים לרוב בהטרוכרומטין דחוס
- השחרור של אזורים אלו מנוקלאוזומים דורש השקעת אנרגיה רבה
רמות הארגון הכרומטיני
הכרומטין מאורגן בהיררכיה של רמות דחיסה, החל מהמבנה הבסיסי ועד לכרומוזום המיטוטי הדחוס לחלוטין.
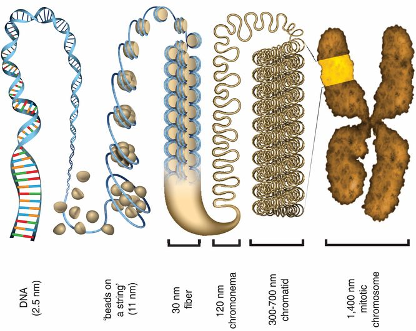
רמה ראשונה: “חרוזים על חוט” (11 ננומטר)

המבנה הבסיסי, הנקרא “Beads on a String”, מורכב מ:
- נוקלאוזומים (ה”חרוזים”) בקוטר של כ-11 ננומטר
- רצפי DNA מקשרים (Linker DNA) באורך של 80-20 נוקלאוטידים
- מבנה זה נראה במיקרוסקופ אלקטרונים כשרשרת חרוזים
רמה שנייה: סיבי 30 ננומטר
במצבים מסוימים, הנוקלאוזומים יכולים להידחס ליצירת מבנה עבה יותר:
- קוטר של כ-30 ננומטר
- דורש נוכחות יונים (במיוחד $\ce{Mg^{2+}}$) כדי לשמור על יציבות
- תלוי במודיפיקציות של זנבות ההיסטון
- מציג רמת דחיסה של כ-6 פעמים ביחס לרמה הבסיסית
רמה שלישית: כרומטין בינוני (300 ננומטר)
רמת דחיסה ביניים הכוללת:
- לולאות כרומטין המעוגנות לחלבוני scaffold
- דחיסה של כ-50-40 פעמים
- נמצאת באזורים מסוימים גם באינטרפאזה
רמה רביעית: הכרומוזום המיטוטי (1400 ננומטר)
הרמה הדחוסה ביותר, המתרחשת רק במיטוזה (חלוקת התא):
- קוטר של כ-1.4 מיקרומטר
- דחיסה של כ-10,000 פעמים ביחס ל-DNA גולמי
- מאפשרת ראייה במיקרוסקופ אור רגיל
- חיונית לחלוקה תקינה של הכרומוזומים
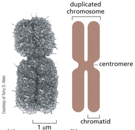
מנגנוני הוויסות הכרומטיני
הכרומטין (ה-DNA והחלבונים הקשורים אליו) הוא מבנה דינמי המשתנה כל הזמן בהתאם לצרכי התא. קיימים ארבעה מנגנונים עיקריים המאפשרים שליטה מדויקת במבנה הכרומטין:
מודיפיקציות של זנבות ההיסטון
מבנה זנבות ההיסטון
זנבות חלבוני ההיסטון הן הקצוות ה-N-טרמינליים הבולטים מחוץ לליבת הנוקלאוזום. זנבות אלו:
- עשירים בחומצות אמינו בסיסיות (ליזין וארגינין)
- גמישים ונגישים לאנזימי מודיפיקציה
- לא מובנים (unstructured) במצבם הטבעי
- מהווים פלטפורמה לקישור חלבונים רגולטוריים
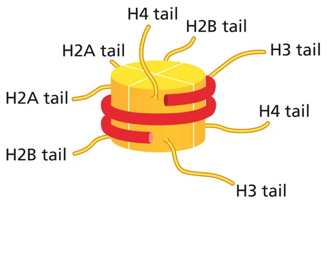
סוגי המודיפיקציות העיקריות
מתילציה (Methylation):
- מתרחשת בעיקר על ליזין וארגינין
- יכולה לכלול 1, 2 או 3 קבוצות מתיל (mono-, di-, tri-methylation)
- דוגמאות לסגירת כרומטין:
- H3K9me3 (tri-methylation של ליזין 9 בהיסטון H3)
- H3K27me3 (tri-methylation של ליזין 27 בהיסטון H3)
- דוגמאות לפתיחת כרומטין:
- H3K4me3 (tri-methylation של ליזין 4 בהיסטון H3)
- H3K36me3 (tri-methylation של ליזין 36 בהיסטון H3)
אצטילציה (Acetylation):
- מתרחשת כמעט תמיד על ליזין
- בדרך כלל מקושרת לפתיחת כרומטין ולביטוי גנים
- מנטרלת את המטען החיובי של הליזין, מחלישה את הקישור ל-DNA
- דוגמאות:
- H3K27ac (acetylation של ליזין 27 בהיסטון H3)
- H4K16ac (acetylation של ליזין 16 בהיסטון H4)
אוביקוויטינציה (Ubiquitination):
- הוספת חלבון אוביקוויטין קטן (76 חומצות אמינו)
- יכולה לסמן חלבונים לפירוק או לשינוי תפקוד
- H2AK119ub1 - סימון לחלבונים מדכאי שעתוק
פוספורילציה (Phosphorylation):
- מתרחשת בעיקר על סרין ותראונין
- חשובה במיוחד במהלך חלוקת התא
- H3S10ph - מסמן התחלת קונדנסציה כרומטינית במיטוזה
הקונטקסט קובע את המשמעות
עקרון מהותי בביולוגיה האפיגנטית הוא שמשמעות המודיפיקציה תלויה בהקשר:
- אותה מודיפיקציה יכולה לגרום לפתיחה או לסגירה בהתאם למיקום הגנומי
- שילוב מודיפיקציות יוצר “קוד היסטון” מורכב
- חלבונים “קוראים” מזהים מודיפיקציות ומפעילים תגובות תאיות
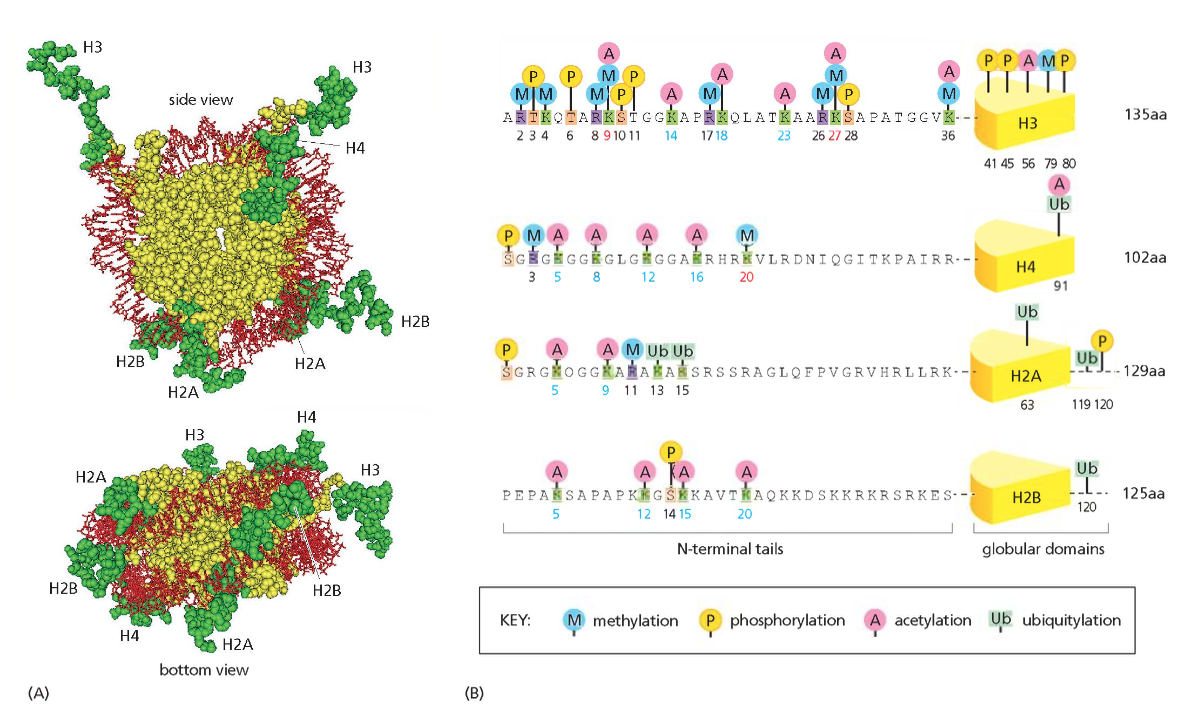
החלקת נוקלאוזומים (Nucleosome Remodeling)
משפחת חלבוני SWI/SNF
מחליקי הנוקלאוזומים הם קומפלקסים חלבוניים גדולים השייכים למשפחת SWI/SNF (Switch/Sucrose Non-Fermentable). משפחה זו כוללת מספר תת-משפחות:
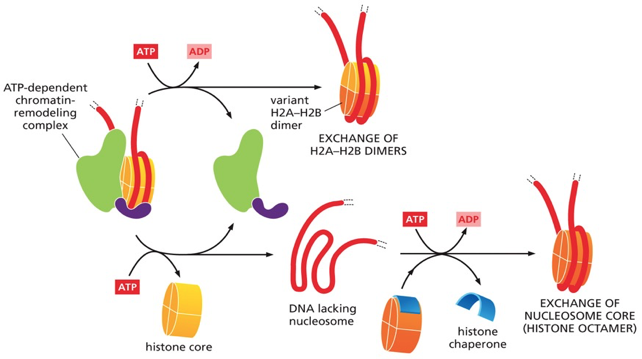
מנגנון הפעולה של SWI/SNF
- זיהוי המטרה - הקומפלקס נקשר לרצפי DNA ספציפיים או לכרומטין המכיל מודיפיקציות מסוימות
- הידרוליזת ATP - השימוש באנרגיה מ-ATP מאפשר שינוי קונפורמציה של הקומפלקס
- העברת כוח מכני - הקומפלקס “מסובב” את ה-DNA יחסית לליבת ההיסטון
- הזזה הדרגתית - כל מולקולת ATP מאפשרת החלקה של נוקלאוטיד אחד
צריכת האנרגיה:
- נוקלאוזום מלא מכיל 147 זוגות נוקלאוטידים
- שחרור מלא דורש 147 מולקולות ATP
- זהו תהליך יקר מאוד מבחינה אנרגטית, המתרחש רק כאשר יש צורך דחוף בנגישות ל-DNA
תת-משפחות עיקריות:
- SWI/SNF - מתמחה בפתיחת כרומטין לשעתוק
- ISWI - מתמחה בארגון מחדש של מבנה הכרומטין
- CHD - משתתף גם בפתיחה וגם בדחיסה של כרומטין
השמטה והחלפה של נוקלאוזומים
מנגנון השמטת נוקלאוזומים:
תהליך זה כולל הסרה זמנית או קבועה של חלבוני ההיסטון מה-DNA, ויכול להתרחש בשני מצבים:
השמטה חלקית - הסרת דימרים:
- הסרת דימר H2A/H2B תוך השארת הטטרמר H3/H4
- מאפשרת נגישות חלקית ל-DNA
- תהליך יחסית מהיר וקל להחזרה
השמטה מלאה - הסרת כל הליבה:
- הסרת כל שמונה חלבוני ההיסטון
- שחרור מלא של 147 זוגות הנוקלאוטידים
- נדרשת לתהליכים הדורשים נגישות מלאה כמו שכפול DNA
מנגנון החלפת וריאנטים:
במקום השמטה מלאה, לעיתים מתרחשת החלפה של חלבוני היסטון בוריאנטים בעלי תכונות שונות:
וריאנטים של H2A:
- H2A.Z - מקל על שעתוק ופתיחת כרומטין
- H2A.X - חיוני לתיקון נזקי DNA, במיוחד שברים כפולים
- macroH2A - מעורב בהשתקת כרומוזום X
וריאנטים של H3:
- H3.3 - מופק בכל שלבי מחזור התא, לא רק ב-S phase
- CENP-A - מחליף את H3 באזור הצנטרומר
מתי מתרחשת החלפה:
- במהלך שעתוק פעיל - החלפה ב-H2A.Z ו-H3.3
- לאחר נזק ל-DNA - החלפה ב-H2A.X
- במהלך התמיינות - החלפות ספציפיות לרקמה
חלבון הלינקר היסטון H1
מבנה ותפקוד של היסטון H1
היסטון H1 הוא חלבון נוסף שלא נמצא בליבת הנוקלאוזום אלא נקשר בין נוקלאוזומים. מאפייניו:
מיקום הקישור של H1
- נקשר ל-Linker DNA (ה-DNA המקשר בין נוקלאוזומים)
- יוצר אינטראקציות עם זנבות ההיסטון שעברו מודיפיקציות מתאימות
- “מהדק” את הנוקלאוזומים זה לזה
השפעת H1 על מבנה הכרומטין
- נוכחות H1 - יוצרת מבנה דחוס ויציב של הטרוכרומטין
- העדר H1 - מאפשרת מבנה פתוח יותר של אוכרומטין
- רמות משתנות - כמות H1 קובעת את רמת הדחיסה
וריאנטים של H1
קיימים מספר וריאנטים של H1 עם ביטוי ספציפי לרקמה ולשלב התפתחותי:
- H1.0 - נמצא ברוב הרקמות הבוגרות
- H1.1-H1.5 - ביטוי ספציפי לסוג תא
- H1t - ספציפי לתאי יצירת הזרע
- H1oo - ביצית וטמיחה ראשונית
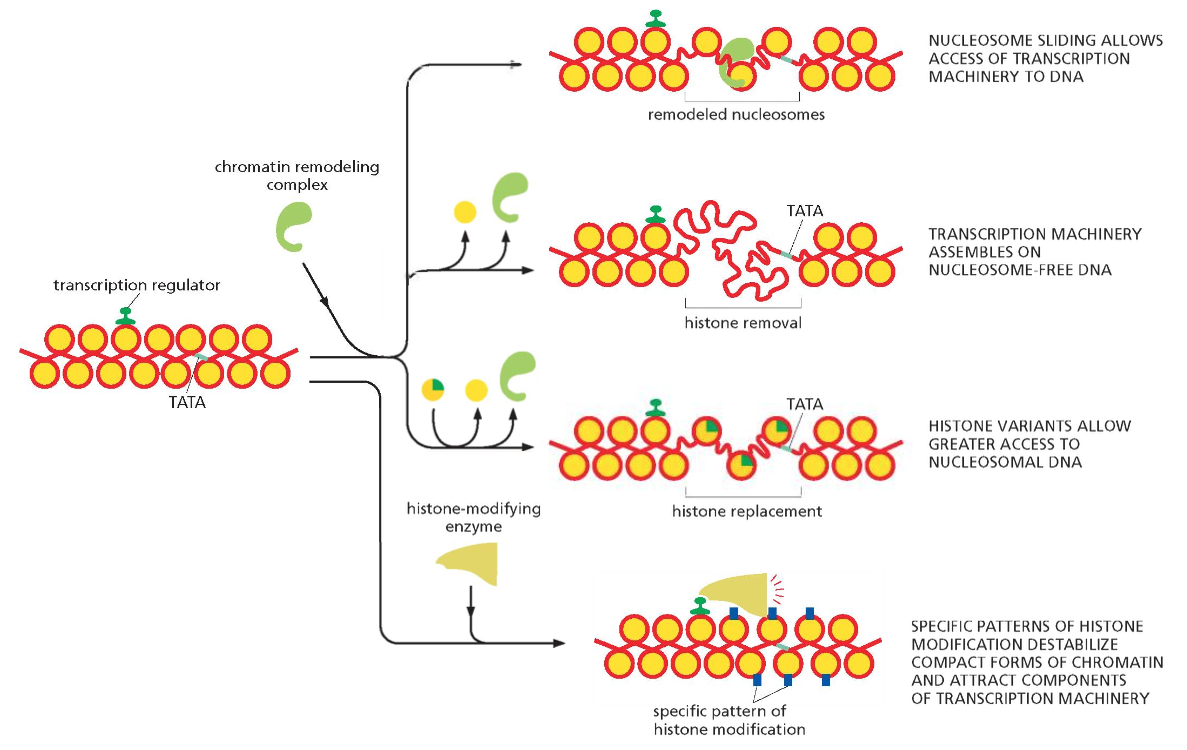
סיווג והתפלגות מצבי הכרומטין
אוכרומטין לעומת הטרוכרומטין
הכרומטין בגרעין התא מתחלק לשני מצבים עיקריים המבוססים על רמת הדחיסה והפעילות הטרנסקריפציונית:
אוכרומטין (Euchromatin) - כרומטין פעיל:
- מהווה כ-20% מכלל הכרומטין בתא ממוצע
- מאופיין במרחקים גדולים יחסית בין נוקלאוזומים
- נגיש לחלבוני שעתוק ורגולציה
- עשיר במודיפיקציות “פתוחות” כמו H3K4me3, H3K27ac
- נמצא בדרך כלל במרכז הגרעין
- מכיל גנים הנמצאים בביטוי פעיל או פוטנציאלי
הטרוכרומטין (Heterochromatin) - כרומטין דחוס:
- מהווה כ-80% מכלל הכרומטין
- מאופיין בנוקלאוזומים דחוסים עם מרחקים קטנים
- לא נגיש לחלבוני שעתוק ברוב המקרים
- עשיר במודיפיקציות “סוגרות” כמו H3K9me3, H3K27me3
- נמצא בעיקר בפריפריה הגרעינית, סמוך למעטפת הגרעין
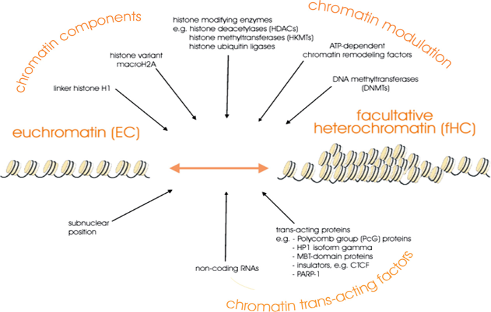
תת-סוגי הטרוכרומטין
ההטרוכרומטין מתחלק לשני תת-סוגים עיקריים על בסיס יכולת הפתיחה:
הטרוכרומטין פקולטטיבי (Facultative Heterochromatin):
- המונח “פקולטטיבי” נגזר מ”פקולטה” = הזדמנות/אפשרות
- כרומטין שסגור זמנית אך יכול להיפתח בתגובה לאותות תאיים
- מאופיין בקודים אפיגנטיים הפיכים
- אינו מכיל היסטון H1 ברמות גבוהות
- דוגמאות:
- גנים רגולטוריים התפתחותיים שפועלים בשלבים מסוימים
- אזורים הנפתחים בתגובה לגירויים סביבתיים
- חלק מכרומוזום X בנקבות (X-inactivation)
הטרוכרומטין קונסטיטוטיבי (Constitutive Heterochromatin):
- נשאר דחוס באופן קבוע ולא נפתח במצבים פיזיולוגיים רגילים
- מאופיין בנוכחות יציבה של היסטון H1
- עשיר במודיפיקציות יציבות כמו H3K9me3
- מיקומים עיקריים:
- צנטרומרים - אזורי הקישור של הכרומטידים
- טלומרים - קצוות הכרומוזומים
- אזורי רצפים חוזרים - LINE, SINE, ואלמנטים רטרו-ויראליים
חשיבות ביולוגית של הטרוכרומטין קונסטיטוטיבי
שמירה על המצב הסגור של אזורים אלו חיונית מכמה סיבות:
- מניעת אי-יציבות גנומית - אלמנטים חוזרים עלולים לגרום לרקומבינציה לא הומולוגית
- הגנה מפני מוטגנזה - אזורים אלו עלולים להזיק לגנים חיוניים
- שמירה על שלמות הכרומוזום - מניעת פיוז’ן של קצוות כרומוזומים
מנגנוני המעבר בין מצבי כרומטין
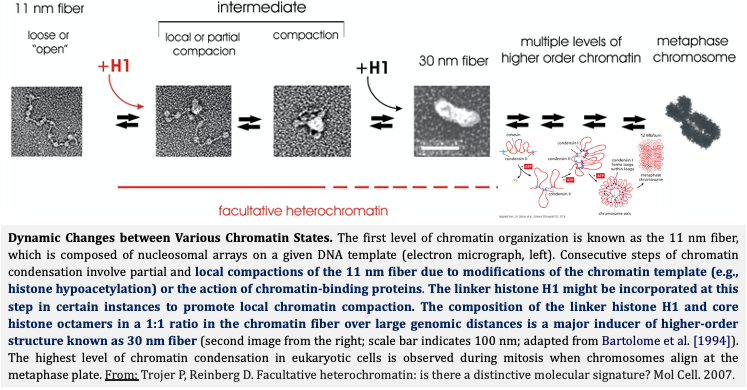
המעבר מהטרוכרומטין פקולטטיבי לאוכרומטין כולל מספר שלבים מתואמים:
-
שלב 1: איתות ראשוני
- קישור חלבוני שעתוק לאלמנטים רגולטוריים
- גיוס אנזימי מודיפיקציה (למשל demethylases)
-
שלב 2: שינוי קוד היסטון
- הסרת מודיפיקציות “סוגרות” (H3K9me3, H3K27me3)
- הוספת מודיפיקציות “פותחות” (H3K4me3, H3K27ac)
-
שלב 3: גיוס מחליקי כרומטין
- פעילות קומפלקסי SWI/SNF
- החלפת וריאנטי היסטון
-
שלב 4: ייצוב מצב פתוח
- גיוס מכונת השעתוק
- שמירה על מודיפיקציות פתוחות
מבנה הכרומוזום המיטוטי
הכרומוזום כמבנה ארעי
חשוב להדגיש שהכרומוזומים בצורתם המוכרת (צורת X) נראים רק במהלך המיטוזה, כאשר הכרומטין עובר דחיסה מקסימלית. במצב הרגיל של התא (אינטרפאזה), הכרומטין מפוזר בגרעין כאוכרומטין והטרוכרומטין.
מתי נראים כרומוזומים מובחנים:
- פרופאזה - התחלת הקונדנסציה
- מטאפאזה - דחיסה מקסימלית וסידור על הציר
- אנאפאזה - הפרדת כרומטידים אחות
- משך כולל: 3-2 שעות מתוך מחזור תא של 24-20 שעות
אנטומיה של הכרומוזום המיטוטי
הצנטרומר - מרכז הבקרה
הצנטרומר הוא האזור המחבר בין שני הכרומטידים האחות ומורכב מ:
- רצפי DNA חוזרים מיוחדים (alpha satellite DNA באדם)
- חלבונים ספציפיים לצנטרומר:
- CENP-A (מחליף את היסטון H3)
- CENP-B, CENP-C (חלבוני קישור)
- חלבוני הקינטוכור
- מבנה הקינטוכור - הממשק לקישור הציר המיטוטי
זרועות הכרומוזום
על בסיס מיקום הצנטרומר, הכרומוזום מתחלק לזרועות:
- זרוע P (p-arm):
- נגזרת מ-“petite” (קטן בצרפתית)
- הזרוע הקצרה יותר
- מכילה בדרך כלל פחות גנים
- זרוע Q (q-arm):
- האות הבאה באלפבית אחרי P
- הזרוע הארוכה יותר
- מכילה בדרך כלל יותר גנים
הטלומרים - מגני הקצוות
בקצוות הכרומוזום נמצאים הטלומרים, המורכבים מ:
- רצפי DNA חוזרים (TTAGGG באדם)
- חלבוני הגנה (שלטרין - shelterin complex)
- תפקיד הגנתי - מניעת היתוך כרומוזומים והכרה כ-DNA שבור
סיווג כרומוזומים לפי מיקום הצנטרומר

כרומוזומים מטאצנטריים
- הצנטרומר במרכז או קרוב למרכז
- יחס בין זרועות קרוב ל-1:1
- דוגמאות: כרומוזומים 1, 3, 16, 19, 20
כרומוזומים תת-מטאצנטריים
- הצנטרומר מוזז מהמרכז
- יחס בין זרועות בין 1:1.5 ל-1:3
- דוגמאות: כרומוזומים 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 17, 18, X
כרומוזומים אקרוצנטריים
- הצנטרומר כמעט בקצה
- זרוע P קטנה מאוד או כמעט לא נראית
- דוגמאות: כרומוזומים 13, 14, 15, 21, 22, Y
- מכילים גנים ריבוזומליים בזרוע P הקטנה
גופיפי הגרעין ואברוני הפונקציה
The Nuclear Interior: The Nuclear Bodies
Nuclear bodies (NBs) are non-membrane bound structures in the nucleoplasm that fulfill the following requirements:
- they are microscopically visible (at least during some periods of the cell cycle);
- they concentrate specific nuclear factors, i.e., proteins and RNAs;
- they constantly exchange their components with the surrounding nucleoplasm.
*The last condition discriminates NBs from protein aggregates that form in the nucleus during certain pathologies, e.g., amyloid plagues.
(from the professor’s slides)
קונדנסטים ביולוגיים - פרדיגמה חדשה
הגרעין מכיל מספר רב של מבנים הנקראים גופיפי גרעין (Nuclear Bodies), המייצגים צורה חדשה של ארגון תאי הנקראת קונדנסטים ביולוגיים. מבנים אלו מתאפיינים ב:
מאפיינים פיזיים:
- חסרי ממברנה - לא מוקפים בקרום ביולוגי
- צפופים מקומית - ריכוז גבוה של מולקולות ספציפיות
- כדוריים או אליפסואידיים בצורתם
- בגדלים משתנים - בין 5-0.1 מיקרומטר בקוטר
מאפיינים דינמיים:
- יצירה דינמית - יכולים להיווצר ולהתפרק בהתאם לצרכים
- נגישות גבוהה - מולקולות יכולות להיכנס ולצאת בחופשיות
- תלות בריכוז - נוצרים כאשר הריכוז של רכיבים חוצה סף מסוים
- תגובה לאותות - מגיבים לשינויים תאיים ופיזיולוגיים
הבדלה מאגרגטים פתולוגיים:
בניגוד לאגרגטים החלבוניים הפתולוגיים (כמו באלצהיימר או בפרקינסון):
- קונדנסטים ביולוגיים הפיכים ונגישים
- אגרגטים פתולוגיים בלתי הפיכים וצפופים
הנוקלאולוס - מרכז סינתזת הריבוזומים
הנוקלאולוס הוא הגוף הגרעיני הבולט והגדול ביותר, ומהווה דוגמה מושלמת לקונדנסט ביולוגי פונקציונלי.
מיקום ומבנה:
- נמצא בדרך כלל בקרבת מספר כרומוזומים (13, 14, 15, 21, 22)
- מורכב משלושה אזורים נפרדים:
- FC (Fibrillar Center) - מכיל גנים ריבוזומליים
- DFC (Dense Fibrillar Component) - עיבוד מוקדם של rRNA
- GC (Granular Component) - הרכבת תת-יחידות ריבוזומליות
תהליכי הביוגנזה הריבוזומלית
-
שלב 1: שעתוק rRNA
- שעתוק גנים ריבוזומליים על ידי RNA Polymerase I
- יצירת תרא-RNA 45S (pre-rRNA)
- מתרחש ב-FC ו-DFC
-
שלב 2: עיבוד rRNA
- חיתוך והסרת רצפים פנימיים (ITS - Internal Transcribed Spacers)
- מודיפיקציות כימיות (pseudouridylation, methylation)
- מתרחש בעיקר ב-DFC
-
שלב 3: הרכבת תת-יחידות
- צירוף חלבונים ריבוזומליים ל-rRNA מעובד
- יצירת תת-יחידות 40S ו-60S
- מתרחש ב-GC
-
שלב 4: ייצוא והשלמת ההרכבה
- ייצוא תת-יחידות דרך נקבוביות הגרעין
- מיקוד לרשת האנדופלזמטית הגסה
- הרכבה סופית לריבוזומים פעילים
וויסות פעילות הנוקלאולוס
גודל ופעילות הנוקלאולוס משקפים את הצורך התאי בריבוזומים:
- תאים מתחלקים במהירות - נוקלאולוס גדול ופעיל
- תאים בדיפרנציאציה - נוקלאולוס קטן יותר
- תאים במנוחה - נוקלאולוס מזערי
גופיפי גרעין נוספים
Cajal Bodies:
- מתמחים בעיבוד snRNAs ו-snoRNAs
- חשובים לתפקוד הספלייסאוזום
- קשורים לגנים המקודדים להיסטונים
Nuclear Speckles:
- מכילים חלבוני ספלייסינג
- אתרי אחסון ועיבוד של מכונת הספלייסינג
- דינמיים במיוחד במהלך השעתוק
PML Bodies:
- מעורבים בתגובת לחץ תאי
- קשורים לתיקון DNA ולאפופטוזיס
- מטרה של חלבונים ויראליים מדכאים
Histone Locus Bodies:
- מתמחים בעיבוד mRNAs של היסטונים
- פעילים במיוחד בשלב S של מחזור התא
- חשובים לסינכרון סינתזת ההיסטונים עם שכפול DNA
אינטגרציה: מבנה-תפקוד ברמת הגרעין
הארגון המרחבי של הגרעין
הגרעין אינו מרחב אחיד אלא בעל ארגון מרחבי מדויק:
פריפריה גרעינית:
- עשירה בהטרוכרומטין קונסטיטוטיבי
- אזור של השתקת גנים
- קשורה לחלבוני הלמינה
אזורים פנימיים:
- עשירים באוכרומטין ובגופיפי גרעין פעילים
- אזורי שעתוק אקטיביים
- ריכוז מכונת השעתוק והעיבוד
התארגנות כרומוזומלית:
כל כרומוזום תופס “טריטוריה” מוגדרת בגרעין:
- כרומוזומים שונים ממוקמים באזורים נפרדים
- אינטראקציות בין-כרומוזומליות מוגבלות יחסית
- ארגון זה חשוב למניעת טרנסלוקציות
דינמיקה תאית ושינויי מבנה
במהלך מחזור התא:
שלב G1:
- כרומטין במצב בינוני של דחיסה
- פעילות שעתוק גבוהה
- גופיפי גרעין פעילים
שלב S:
- פתיחה מקומית לשכפול DNA
- פעילות נוקלאולוס גבוהה (סינתזת היסטונים)
- דינמיקה גבוהה של מחליקי כרומטין
שלב G2:
- הכנה לקונדנסציה
- הפחתה בפעילות שעתוק
- התחלת הרכבת מכונת הקונדנסציה
מיטוזה:
- קונדנסציה מקסימלית
- פירוק גופיפי הגרעין
- פירוק המעטפת הגרעינית
תיקון נזקי DNA והכרומטין
הכרומטין משחק תפקיד מכריע בתיקון נזקי DNA:
זיהוי הנזק:
- חלבונים מזהי נזק צריכים נגישות ל-DNA
- מחליקי כרומטין נגוסים לאתר הנזק
- מודיפיקציות מיוחדות (H2A.X phosphorylation)
תהליך התיקון:
- פתיחה מקומית של הכרומטין
- גיוס חלבוני תיקון לאתר הנזק
- ביצוע התיקון המולקולרי
- סגירה מחדש של הכרומטין
חשיבות הארגון
התזמון של פתיחה וסגירה חיוני:
- פתיחה ממושכת עלולה לגרום לאי-יציבות
- סגירה מהירה מדי עלולה למנוע תיקון מלא
השלכות רפואיות ותרפויטיות
מחלות הקשורות לחלבוני כרומטין
מוטציות בחלבוני היסטון:
- סרטנים המאופיינים בפעילות-יתר של H3K4me3 demethylase
- מחלות נוירודגנרטיביות הקשורות לחלבוני תגובת סטרס
מוטציות במחליקי כרומטין:
- תסמונות התפתחותיות חמורות
- סרטנים מאופיינים בקומפלקסי SWI/SNF פגועים
- מחלות אוטואימוניות
טיפולים אפיגנטיים
מעכבי מתילטרנספרזות:
- 5-azacytidine ו-decitabine
- פותחים כרומטין דחוס
- מאושרים לטיפול בסרטנים מסוימים
מעכבי היסטון דיאצטילזות (HDACi):
- Vorinostat, Romidepsin
- מגבירים אצטילציה ופותחים כרומטין
- יעילים בלימפומות מסוימות
מעכבי מתילטרנספרזות היסטון:
- EPZ-6438 (מעכב EZH2)
- מטפלים בסרטנים עם מוטציות במטילטרנספרזות H3K27me3
אסטרטגיות טיפול עתידיות
עריכה אפיגנטית ממוקדת:
- שימוש בטכנולוגיית CRISPR/dCas9
- הכנסת מודיפיקציות ספציפיות למיקומים מדויקים
- פוטנציאל לטיפול במחלות מונוגניות
תרפיה משולבת:
- שילוב מעכבי אפיגנטיקה עם כימותרפיה
- טיפולים ממוקדי אימונותרפיה
- התאמה אישית על בסיס פרופיל אפיגנטי
סיכום והשלכות
מבנה הגרעין והכרומטין מייצג אחד המערכות הביולוגיות המורכבות והמתוחכמות ביותר בטבע. הארגון ההיררכי של המידע הגנטי, החל מנוקלאוזומים בודדים ועד לארגון הכרומטין בחלל התלת-ממדי של הגרעין, מאפשר שליטה מדויקת בביטוי גנים ובתפקוד התא.
ההבנה העמוקה של מערכות אלו פותחת פתחים חדשים ברפואה המודרנית, במיוחד בתחום הטיפולים האפיגנטיים שמתמקדים בשינוי מצב הכרומטין במקום בשינוי רצף ה-DNA עצמו. בעוד שאנו רק בתחילת הדרך להבנה מלאה של המורכבות הזו, ברור שעקרונות הארגון הכרומטיני יהיו בבסיס הבנתנו את התפתחות המחלות ופיתוח טיפולים חדשים בעשורים הקרובים.
העובדה שבכל רגע נתון מתרחשים מיליארדי תהליכים של פתיחה וסגירה של כרומטין ברחבי הגוף האנושי, כאשר כל תא מתמודד עם מאות נזקי DNA בכל שעה, מדגישה את הרמה הבלתי נתפסת של הסינכרון והבקרה הקיימת במערכות הביולוגיות. הבנת מערכות אלו היא לא רק הישג מדעי מרשים אלא גם המפתח לפיתוח הדור הבא של הטיפולים הרפואיים.
שיעור 12 - הציטוסקלטון
תאריך: 12/05/2025מוכנים למבחן?
נסו 10 שאלות על הציטוסקלטון, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
הקדמה: הציטוסקלטון כמערכת תמיכה דינמית
הציטוסקלטון מהווה את ״שלד״ התא האוקריוטי, אך בניגוד לשלד הפיזיולוגי הקבוע, הציטוסקלטון הוא מערכת דינמית ומשתנה המאפשרת לתא לבצע מגוון רחב של פעילויות. מערכת זו כוללת רשת מורכבת של סיבי חלבון הפרוסים בכל חלקי התא ומקנים לו צורה, יכולת תנועה, ואפשרות להעביר חומרים בתוכו ממקום למקום.
ההבנה של חשיבות הציטוסקלטון עולה בבירור כאשר אנו בוחנים דוגמאות קיצוניות מהטבע. דג המתגורר בעומקי האוקיינוס, במקום שבו הלחץ עשוי להרוס צוללות, מצליח לשמור על מבנה תאיו הודות לציטוסקלטון מותאם. כאשר מעלים דג כזה לפני הים, הירידה הדרמטית בלחץ גורמת לקריסת הציטוסקלטון ולהרס מבנה התא, מה שמסביר את השינוי הדרמטי בצורתו.

התפקידים המרכזיים של הציטוסקלטון
הציטוסקלטון מבצע מספר תפקידים קריטיים:
- תמיכה מבנית - מקנה לתא צורה מוגדרת ויציבות מכנית
- תנועת תאים - מאפשר תנועה פעילה של התא כולו
- תנועה פנים-תאית - מעביר אברונים וחלבונים בתוך התא
- חלוקת תאים - משתתף בתהליך המיטוזה והציטוקינזיס
- קביעת פולריות תאית - מארגן את התא למחוזות פונקציונליים שונים
המרכיבים העיקריים של הציטוסקלטון
הציטוסקלטון מורכב משלושה סוגי סיבים עיקריים, כל אחד בעל מאפיינים ייחודיים ותפקידים ספציפיים:
סיבי אקטין (Actin Filaments)

מבנה בסיסי:
סיבי האקטין הם הדקים ביותר מבין רכיבי הציטוסקלטון, בקוטר של כ-7 ננומטר. הם בנויים מחזרות של חלבון האקטין במבנה דמוי צמה כפולה.
פולימריזציה דינמית:
האקטין קיים בשני מצבים עיקריים:
- G-actin (Globular actin) - מונומרים בודדים של אקטין הקשורים למולקולת ATP
- F-actin (Filamentous actin) - פילמנטים של אקטין שבהם ה-ATP עבר הידרוליזה ל-ADP
פילמנט (מאנגלית: Filament; ובעברית קוּר) הוא שרשרת ארוכה עשויה חלבונים, למשל בשיער, בשרירים או בשוטון. לעיתים מתחברים קורים יחד ליצירת מבנה חזק וקשיח. קורים לדוגמה בתאים הם מיקרוטובולים, קוּרֵי אקטין וסיבי ביניים. (ויקיפדיה)
מנגנון הפולימריזציה:
- נוקליאציה - יצירת גרעיני התחלה של הפילמנט
- אלונגציה - הוספת מונומרי G-actin עם ATP לקצה החיובי (Plus end)
- מצב יציב - קצב הוספה שווה לקצב הפירוק
המנגנון הדינמי מאפשר לתא לשנות במהירות את מבנה הציטוסקלטון בהתאם לצרכיו. הקצה החיובי של הפילמנט גדל במהירות כאשר ישנה זמינות של G-actin עם ATP, בעוד הקצה השלילי (Minus end) נוטה להתפרק.
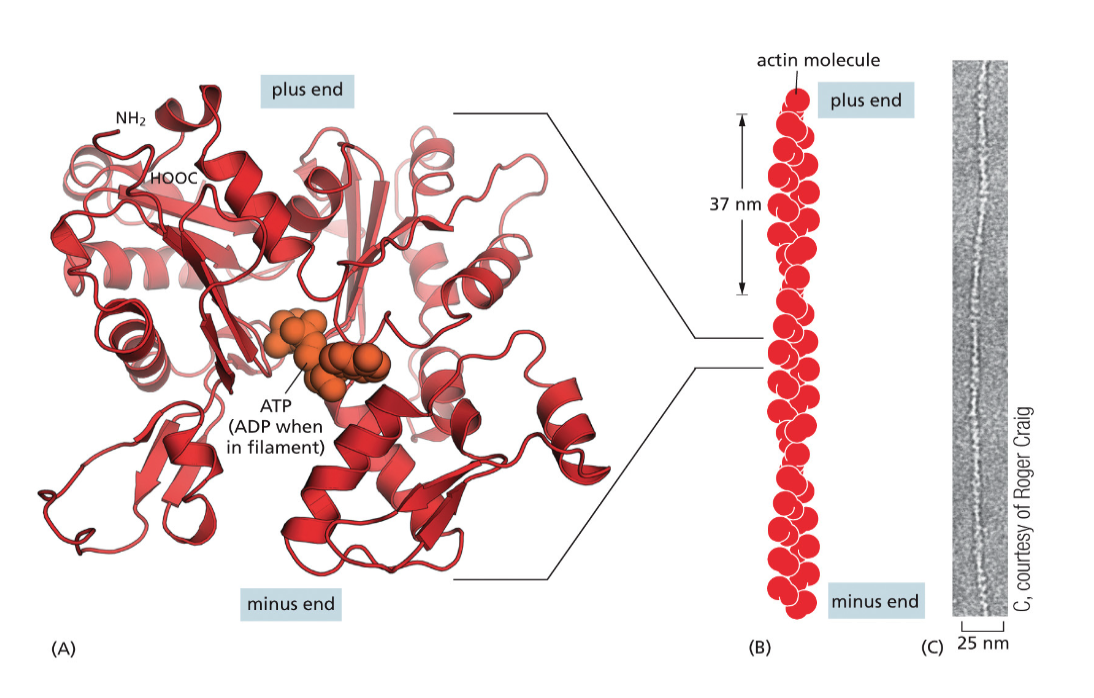
מיקרוטובולים (Microtubules)
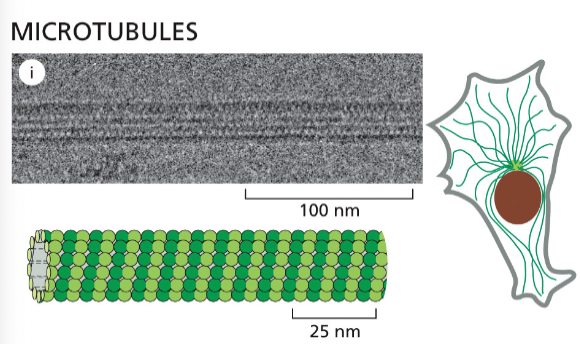
מבנה צינורי:
המיקרוטובולים הם הגדולים ביותר מרכיבי הציטוסקלטון, בקוטר של כ-25 ננומטר. הם בנויים כצינורות חלולים המורכבים מ-13 פרוטופילמנטים (Protopfilaments) המסודרים במעגל.
יחידות הבנייה:
כל פילמנט בנוי מדימרים של:
- α-טובולין (הירוק הבהיר בתמונות מיקרוסקופיה)
- β-טובולין (הירוק הכהה)
פולימריזציה עם GTP:
בניגוד לאקטין המשתמש ב-ATP, המיקרוטובולים משתמשים ב-GTP כמקור אנרגיה לפולימריזציה (Guanosine Triphosphate).
התהליך דומה לאקטין - GTP-טובולין נוסף לקצה החיובי, ולאחר ההוספה עובר הידרוליזה ל-GDP-טובולין.
יתרונות המבנה הצינורי:
- חוזק מבני - צורת הצינור מקנה קשיחות גבוהה
- יעילות פולימריזציה - ניתן להוסיף יחידות רק בהיקף, לא בכל הנפח
- מסלולי תנועה - המיקרוטובולים משמשים כ״כבישים״ לתנועת אברונים
פילמנטים ביניים (Intermediate Filaments - קוּרֵי ביניים)
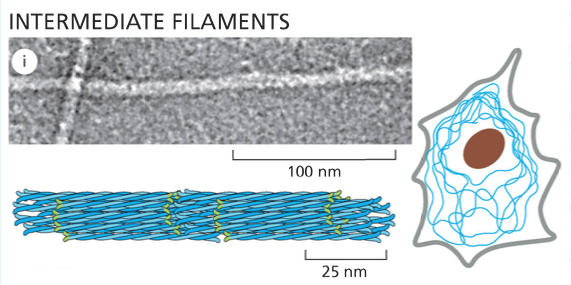
גיוון חלבוני:
בניגוד לאקטין והמיקרוטובולים הבנויים מחלבון אחד, פילמנטים ביניים בנויים ממגוון חלבונים, בהתאם לסוג התא:
- קרטין - בתאי אפיתל, שיער וציפורניים
- למין - במעטפת הגרעין
- נוירופילמנטים - באקסונים של נוירונים
- ויממטין - בתאי חיבור ופיברובלסטים
תפקיד מבני:
פילמנטי ביניים מספקים בעיקר תמיכה מכנית ויציבות, והם פחות דינמיים מהסיבים האחרים. הם אחראים על החוזק המכני של רקמות כמו עור (קרטין) ועל יציבות הגרעין (למין).
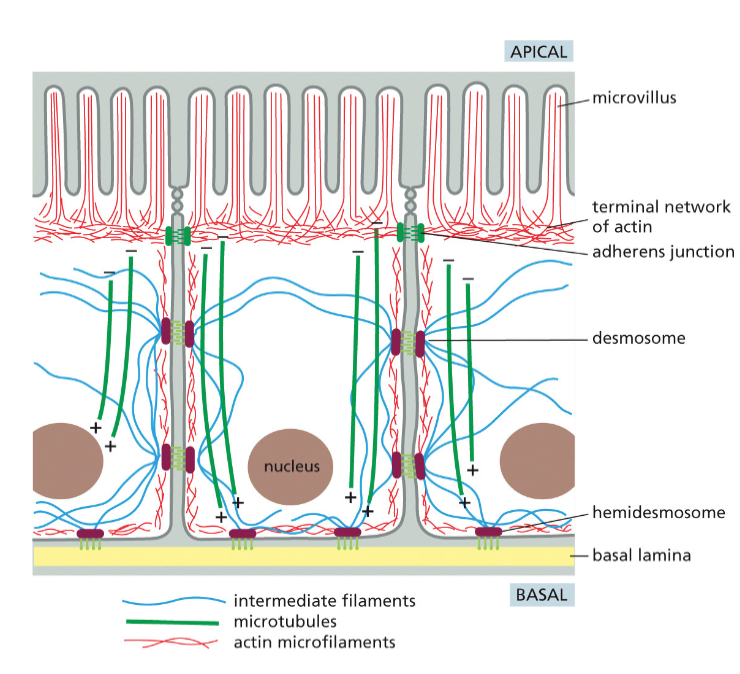
מבני ציטוסקלטון מיוחדים ותפקידיהם
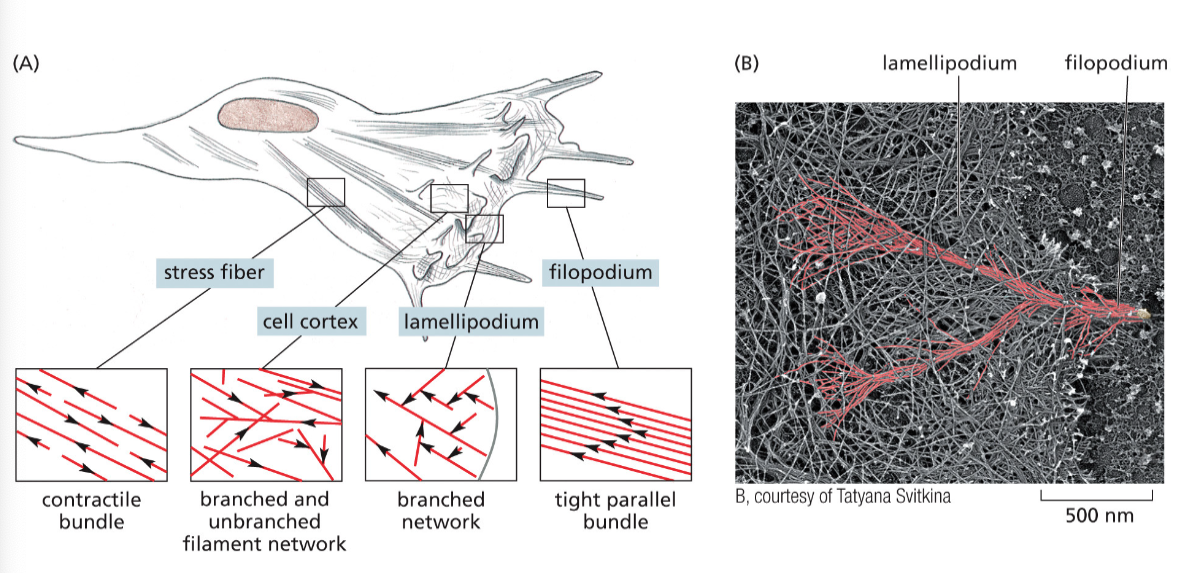
פילופודיה - ״אצבעות״ התא
מבנה:
פילופודיה הן בליטות דקות דמויות אצבעות הבולטות מקצה התא. הן מכילות צרורות של סיבי אקטין מקבילים שמכוונים באותו כיוון (מהקצה השלילי אל החיובי).
תפקידים:
- חישה סביבתית - זיהוי גירויים כימיים ופיזיים
- יוזמת תנועה - מנחות את כיוון תנועת התא
- יצירת קשרים - התחברות לתאים אחרים או למטריקס החוץ-תאי
חלבונים מעורבים:
- קרוס-לינקרים - חלבונים המחברים בין סיבי האקטין המקבילים
- חלבוני קיצור - מונעים מהפילמנט לגדול מעבר לאורך הרצוי
למלופודיה - ״הכנף המנחה״
מבנה:
למלופודיה היא רשת מסועפת של סיבי אקטין היוצרת מבנה דמוי כנף בחלק הקדמי של התא הנע.
מנגנון ההסתעפות:
החלבון Arp2/3 יוצר נקודות הסתעפות בסיבי האקטין הקיימים, מה שמאפשר יצירת רשת צפופה ומסועפת של פילמנטים.
Arp2/3 - (Actin-Related Protein)
תפקיד בתנועת תאים:
הלמלופודיה מהווה את ה״מנוע״ העיקרי לתנועת התא. הפולימריזציה המהירה של האקטין דוחפת את הממברנה קדימה, בעוד התכווצות בחלק האחורי של התא מושכת את גוף התא אחרי הקצה המנחה.
מנגנוני תנועת תאים
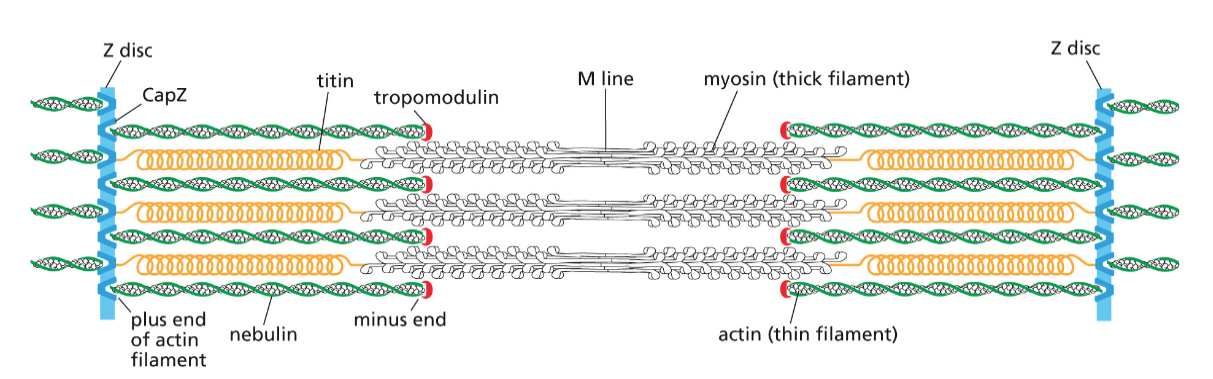
החלבונים המניעים - מיוזין
מבנה מיוזין
המיוזין הוא חלבון מנוע המורכב מ:
- ראש גלובולרי - מכיל אתר קישור לאקטין ואתר הידרוליזת ATP
- צוואר גמיש - מאפשר תנועת הראש
- זנב סליליני - מתארגן עם מיוזינים אחרים למבנים גדולים יותר
מנגנון הפעולה:
- קישור - ראש המיוזין נקשר לסיב האקטין
- שחזרור כוח - הידרוליזת ATP גורמת לשינוי קונפורמציה וליצירת כוח
- שחרור - קישור ATP חדש גורם לשחרור המיוזין מהאקטין
- איפוס - המיוזין חוזר למצב ההתחלתי
מנגנון ה״רצ’ט״: התנועה הכיוונית של המיוזין על האקטין דומה למנגנון רצ’ט - המיוזין יכול לנוע רק בכיוון אחד (לכיוון הקצה החיובי) ולא יכול לחזור אחורה ללא השקעת אנרגיה.
תנועת תאים באמצעות אדהזינים
המנגנון המשולב:
תנועת תאים מצריכה תיאום מדויק בין מספר תהליכים:
- יצירת פילופודיה/למלופודיה - הפילמנטים הגדלים דוחפים את הממברנה קדימה
- יצירת אדהזיות - האדהזינים נקשרים למטריקס החוץ-תאי
- התכווצות - חלבוני מיוזין יוצרים התכווצות שמושכת את גוף התא
- שחרור אדהזיות אחוריות - מאפשר לחלק האחורי של התא להתקדם
סידור אנטי-מקביל:
בנקודות ההתקשרות בין התא למטריקס, סיבי האקטין מסודרים בצורה אנטי-מקבילית - חלק מכוונים מהמינוס לפלוס בכיוון אחד, וחלק בכיוון ההפוך. סידור זה מאפשר למיוזין ליצור התכווצות יעילה על ידי משיכה בשני הכיוונים בו-זמנית.
ניצול הציטוסקלטון על ידי פתוגנים
אסטרטגיות חיידקיות
חיידקים פתוגניים פיתחו אמצעים מתוחכמים לניצול הציטוסקלטון של התא המארח לטובתם:
-
סלמונלה (Salmonella): מפרישה חלבונים בשם ״אפקטורים״ שמתערבים בפעילות חלבוני Arp2/3 של התא המארח. התוצאה היא יצירת בליטות ממברנליות שמקיפות את הסלמונלה ומושכות אותה פנימה לתא.
התהליך הזה נקרא ״בליעה מחוללת״ כיוון שהתא למעשה ״בולע״ את החיידק בעל כורחו.
-
ליסטריה (Listeria): מגייסת את חלבוני האקטין לאחר שחודרת לתא, ויוצרת בעזרתם ״זנב״ של פילמנטים שדוחף אותה קדימה בתוך התא ומאפשר לה להתפשט לתאים שכנים.
השלכות רפואיות
הבנת מנגנוני הניצול הללו פותחה דרכים חדשות במחקר הרפואי:
- פיתוח תרופות - חסימת החלבונים שהחיידקים משתמשים בהם
- חיסונים - יצירת התגובה חיסונית נגד האפקטורים החיידקיים
- דיאגנוסטיקה - זיהוי זיהומים על בסיס שינויים בציטוסקלטון
אתגרי הטיפול בסלמונלה:
הטיפול בזיהומי סלמונלה מורכב מכמה סיבות:
- עמידות לאנטיביוטיקות - סלמונלה עמידה לרוב האנטיביוטיקות הנפוצות
- תחרות מיקרוביומית - האנטיביוטיקות הורגות תחילה את החיידקים המועילים שמונעים מהסלמונלה להתפשט
- הסתרה תוך-תאית - החיידק מסתתר בתוך התאים במקום נגיש פחות לאנטיביוטיקות
לכן, הטיפול העיקרי הוא תומך ומסתמך על מערכת החיסון הטבעית.
הציטוסקלטון ברקמת השריר
ארגון מיוחד בתאי השריר
בתאי השריר, הציטוסקלטון מאורגן בצורה מאוד מסודרת ומתמחה:
הסרקומר - היחידה הפונקציונלית
הסרקומר הוא המבנה החוזר הבסיסי בסיב השריר, המורכב מ:
- סיבי אקטין דקים - מעוגנים ל-Z-disk
- סיבי מיוזין עבים - ממוקמים במרכז הסרקומר
- חלבונים רגולטוריים - כמו טרופומיוזין הנקשר לאקטין
המנגנון המולקולרי של התכווצות:
- מצב מנוחה - הטרופומיוזין חוסם את אתרי הקישור של המיוזין על האקטין
- עירור - אצטילכולין משתחרר מהנוירון המוטורי
- שחרור סידן - ה-ER (רשת אנדופלזמטית) משחרר יוני סידן
- קישור סידן - הסידן נקשר לטרופונין ומזיז את הטרופומיוזין
- התכווצות - המיוזין יכול כעת להיקשר לאקטין וליצור כוח
- הרפיה - הסידן נשאב חזרה ל-ER והשריר נרפה
ארגון כיווני של סיבי השריר
הסידור האנטי-מקביל:
בסרקומר, סיבי האקטין מסודרים כך שהקצוות החיוביים שלהם פונים לכיוון המרכז מכיוונים הפוכים. הסידור הזה מאפשר לסיבי המיוזין, הנעים תמיד לכיוון הקצה החיובי, למשוך את שני קצוות הסרקומר זה לכיוון זה ולגרום להתכווצות.
חשיבות הטרופומיוזין:
הטרופומיוזין אינו רק חלבון רגולטורי אלא גם מייצב את אורך סיבי האקטין ומונע מהם להמשיך ולגדול באופן בלתי מבוקר, דבר שייפגע ביכולת ההתכווצות של השריר.
מיקרוטובולים - כבישי התא
המבנה והארגון
המרכז המארגן של המיקרוטובולים (MTOC)
המיקרוטובולים צומחים מנקודות מיוחדות בתא הנקראות מרכזי ארגון של מיקרוטובולים.
במרכזי ארגון של מיקרוטובולים נמצאים:
- צנטריולים - מבנים צילינדריים המורכבים מ-9 טריפלטים של מיקרוטובולים
- חומר פרי-צנטריולי - רשת חלבונים המכילה אתרי נוקליאציה למיקרוטובולים
הארגון הרדיאלי: ברוב התאים, המיקרוטובולים מאורגנים ברדיוס מהמרכז לכיוון פריפריית התא, כאשר הקצוות השליליים קרובים למרכז והחיוביים בפריפריה.
תפקידי המיקרוטובולים
תנועת אברונים:
המיקרוטובולים משמשים כמסלולי תנועה לאברונים שונים בתא:
חלבוני המנוע:
- דיניין - נע לכיוון הקצה השלילי (לכיוון המרכז)
- קינזין - נע לכיוון הקצה החיובי (לכיוון הפריפריה)
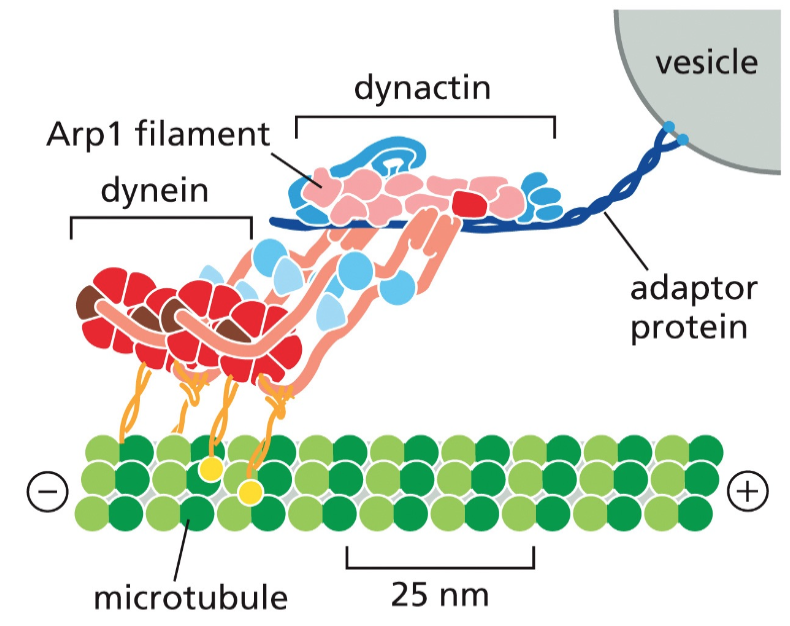
מנגנון התנועה:
חלבוני המנוע קושרים מצד אחד למיקרוטובול ומצד שני ל״מטען״ (וזיקולה, אברון או חלבון). הם משתמשים באנרגיית ATP כדי לנוע על גבי המיקרוטובול בצעדים מדודים של כ-8 ננומטר לכל מולקולת ATP.
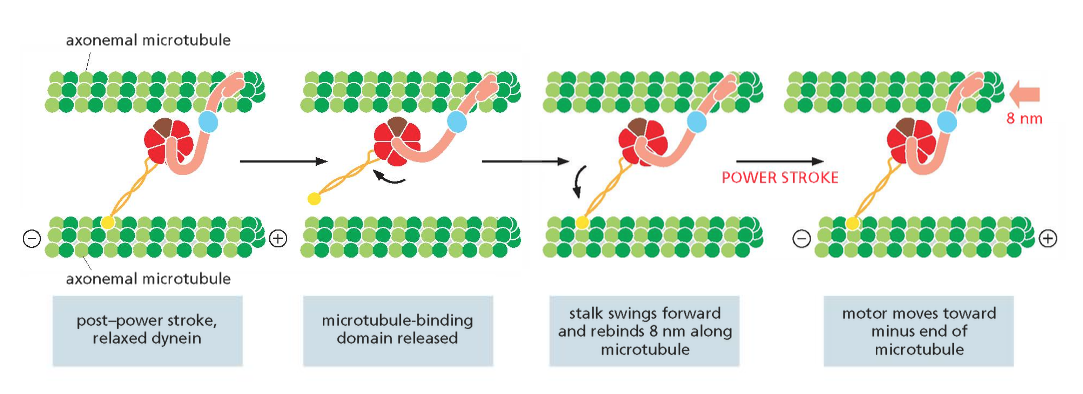
תפקידים נוספים:
- חלוקת תאים - המיקרוטובולים יוצרים את הציר המיטוטי המפריד את הכרומוזומים
- שמירה על מיקום אברונים - מקבעים את מיקומם של גרעין התא, ER והאברונים האחרים
- יצירת סיליה ופלג׳לה - מבנים תנועתיים בולטים מהתא
סיליה ופלג׳לה
המבנה הבסיסי (אקסונמה)
סיליה ופלג׳לה בנויים על בסיס של מבנה הנקרא אקסונמה, המורכב מ:
- 9 זוגות מיקרוטובולים חיצוניים - מסודרים במעגל
- 2 מיקרוטובולים מרכזיים - במרכז המבנה
- זרועות דיניין - יוצרות תנועה על ידי החלקה בין המיקרוטובולים
תפקידים:
- בדרכי הנשימה - סיליה מניעות ליחה וזיהומים כלפי מעלה
- בתאי זרע - הפלג׳לום מאפשר תנועה
- בכיוון הזרימה - סיליה בכליות ובמוח מכוונות זרימת נוזלים
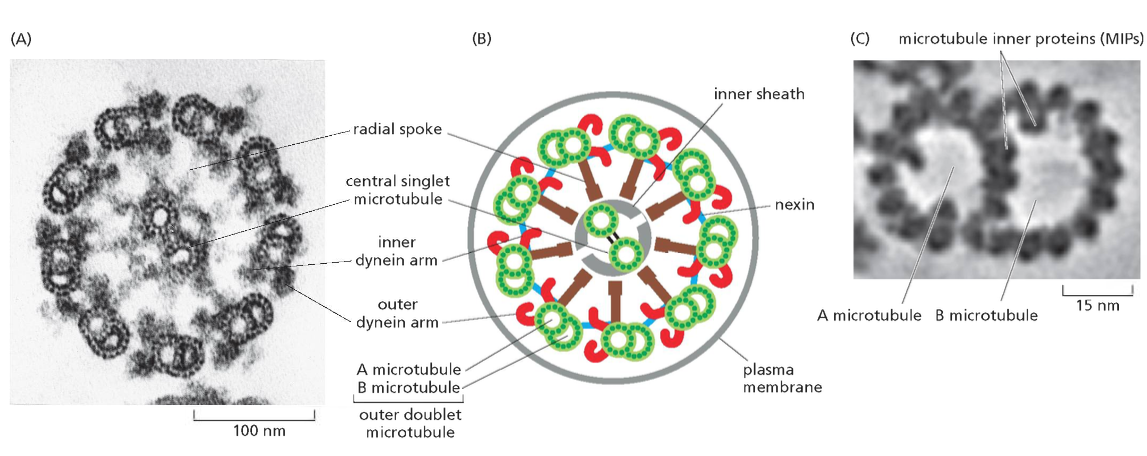
הציטוסקלטון כמטרה תרפויטית
תרופות המשפיעות על המיקרוטובולים
טקסול (פקליטקסל)
טקסול הוא תרופה כימותרפית הפועלת על ידי התערבות בדינמיקה של המיקרוטובולים:
מנגנון הפעולה:
- ייצוב המיקרוטובולים - טקסול נקשר למיקרוטובולים ומונע מהם להתפרק
- הפרעה לחלוקת תאים - ללא יכולת פירוק וארגון מחדש של המיקרוטובולים, התא לא יכול לעבור מיטוזה תקינה
- אפופטוזיס - תאים שלא יכולים להתחלק נכנסים למוות תאי מתוכנת
סלקטיביות יחסית:
למרות שטקסול פוגע בכל התאים, הוא פוגע יותר בתאי סרטן כיוון שהם מתחלקים במהירות רבה יותר מתאים רגילים.
תופעות לוואי:
התאים הבריאים הנפגעים ביותר הם אלו המתחלקים במהירות:
- תאי מערכת החיסון - גורם לדיכוי חיסוני
- תאי שיער - גורם לנשירת שיער
- תאי מעי - גורם לשלשולים ובחילות
רעלנים טבעיים
במהלך מיליארדי שנות אבולוציה, אורגניזמים שונים פיתחו רעלנים המתערבים בציטוסקלטון כנשק ביולוגי:
רעלני אקטין:
- פאלואידין - מייצב את סיבי האקטין ומונע פירוק
- לטרונקולין - מפרק את סיבי האקטין
- ציטוכלזין - חוסם את הפולימריזציה של אקטין
רעלני מיקרוטובולים:
- קולכיצין - מפרק מיקרוטובולים
- ווינבלסטין וווינקריסטין - מונעים פולימריזציה של טובולין
חלק מהרעלנים הללו נמצאים בשימוש כתרופות בריכוזים מבוקרים.
וויסות הציטוסקלטון והתאמה לתפקוד
גמישות מול יציבות
הציטוסקלטון חייב לאזן בין שני דרישות נראות סותרות:
- יציבות מבנית - מתן תמיכה מכנית לתא
- דינמיות תפקודית - התאמה מהירה לשינויים בצרכי התא
מנגנוני הוויסות:
- קשרים לא קוולנטיים - מאפשרים הרכבה ופירוק מהירים
- חלבונים מווסתים - שולטים על קצב הפולימריזציה והפירוק
- מודיפיקציות פוסט-טרנסלציוניות - משנות את תכונות החלבונים
- אורגניזציה מרחבית - ארגון שונה בחלקים שונים של התא
התאמה לסוג התא
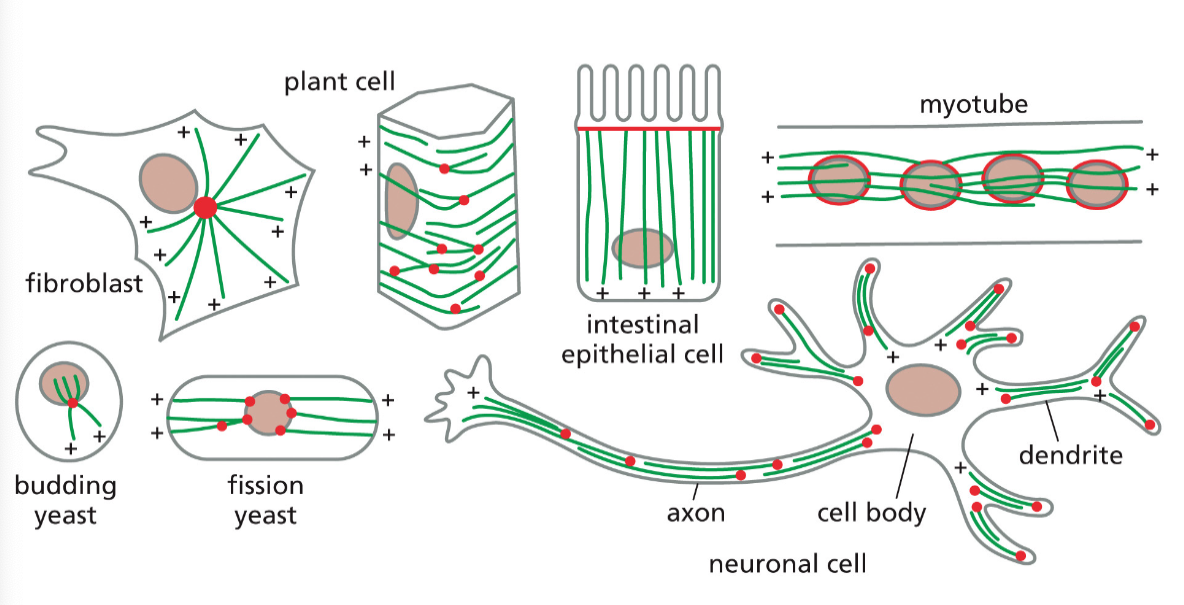
סוגי תאים שונים מציגים ארגון שונה של הציטוסקלטון:
תאי אפיתל:
- מיקרוטובולים מאורגנים אנכית לקביעת פולריות
- אקטין מרוכז בחלק העליון ליצירת מיקרווילי
- פילמנטים ביניים (קרטין) מספקים עמידות מכנית
פיברובלסטים:
- מיקרוטובולים מאורגנים רדיאלית לתנועה
- רשת אקטין נרחבת ליצירת כוח ותנועה
- סיבי עמיד מקבילים לכיוון התנועה
נוירונים:
- מיקרוטובולים מאורגנים במקביל לאורך האקסון
- אקטין מרוכז בקונוס הגדילה
- נוירופילמנטים מייצבים את צורת האקסון
השלכות רפואיות ומחלות
מחלות גנטיות של הציטוסקלטון
מוטציות בלמין:
- פרוגריה - הזדקנות מואצת עקב למין פגום
- מיופתיות - חולשת שרירים עקב בעיות במעטפת הגרעין
- ליפודיסטרופיה - הפרעות בחלוקת שומן
מוטציות בקרטין:
- אפידרמוליזיס בולוזה - שבירות עור קיצונית
- ללת הציפורניים וחמק - מומים בקרטין של ציפורניים ושיער
מוטציות בחלבוני הציליה:
- תסמונת קרטגנר - ליקוי בתפקוד הציליה גורם לדלקות ריאות חוזרות
- מחלות כליה פוליציסטיות - ליקוי בחישה של ציליה הכליה
סרטן והציטוסקלטון
תפקיד הציטוסקלטון בסרטן:
- פלישה וגרורות - תאי סרטן משתמשים בציטוסקלטון לתנועה ופלישה
- עמידות לתרופות - שינויים בציטוסקלטון יכולים להקנות עמידות לכימותרפיה
- חלוקה בלתי מבוקרת - ליקויים בוויסות הציטוסקלטון תורמים לחלוקה סרטנית
אסטרטגיות טיפול:
- תרופות ממוקדות ציטוסקלטון - כמו טקסול וווינקה אלקלואידים
- חסימת תנועת תאים - מניעת היווצרות גרורות
- שילוב תרופות - התקפה על מספר מטרות בציטוסקלטון
סיכום והשלכות
הציטוסקלטון מייצג אחת המערכות המתוחכמות ביותר בתא האוקריוטי. המבנה הדינמי שלו מאפשר לתא לבצע מגוון רחב של תפקודים - מתמיכה מכנית בסיסית ועד תנועה מתוחכמת ותגובה לגירויים סביבתיים. ההבנה המעמיקה של מערכת זו חיונית לא רק להבנת ביולוגיה בסיסית אלא גם לפיתוח טיפולים רפואיים חדשים.
הדינמיות הגבוהה של הציטוסקלטון, המושגת באמצעות קשרים לא קוולנטיים ושימוש באנרגיית ATP/GTP, מאפשרת לתאים להגיב במהירות לשינויים סביבתיים ולבצע תפקודים מורכבים כמו תנועה מכוונת, חלוקה מדויקת ותחבורה פנים-תאית יעילה.
הניצול של הציטוסקלטון על ידי פתוגנים מדגיש את המרכזיות של מערכת זו בתפקוד התא, ופותח אפיקים חדשים למחקר ולפיתוח תרופות. הבנת המנגנונים הללו עשויה להוביל לפיתוח תרופות חדשות נגד זיהומים חיידקיים ופטרייתיים.
בתחום הרפואה, הציטוסקלטון מהווה מטרה חשובה לטיפול בסרטן, והבנתו מעמיקה עשויה להוביל לפיתוח תרופות סלקטיביות יותר עם פחות תופעות לוואי. כמו כן, הבנת מחלות גנטיות הקשורות לציטוסקלטון פותחת אפשרויות לטיפולי גנים ותרפיות חדשניות.
העתיד של חקר הציטוסקלטון צפוי להתמקד בהבנה מתקדמת יותר של הוויסות הדינמי של המערכת, פיתוח שיטות הדמייה חדשות לחקירת התהליכים בזמן אמת, ויצירת טיפולים מותאמים אישית המבוססים על הפרופיל הייחודי של הציטוסקלטון בתאי המטופל.
שיעור 13 - הבשלה והכוונה של חלבונים
תאריך: 14/05/2025עיבוד והכוונה של חלבונים בתאים אוקריוטיים: מהסינתזה ליעד
פתיחה: האתגר הביולוגי של הארגון התאי
התא האוקריוטי מציב בפנינו אחד האתגרים המרתקים ביותר בביולוגיה: כיצד מערכת כה מורכבת, הכוללת עשרות אלפי חלבונים שונים, מצליחה לתפקד בצורה מסודרת ויעילה? התשובה טמונה בעיקרון המנחה של הקומפרטמנטליזציה (compartmentalization) - החלוקה של התא למדורים מתמחים, שבהם מתבצעים תהליכים ביוכימיים ספציפיים בסביבה מווסתת ומבוקרת.
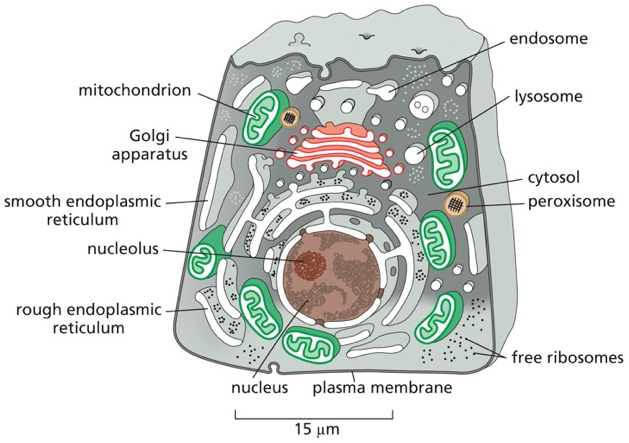
אולם החלוקה למדורים יוצרת בעיה לוגיסטית עצומה: כמעט כל החלבונים בתא מסונתזים במקום אחד - על גבי ריבוזומים בציטוסול, אך הם נדרשים לתפקד במדורים שונים ומרוחקים. כיצד חלבון “יודע” שהוא צריך להגיע לגרעין ולא למיטוכונדריה? איך חלבון המיועד להפרשה מוצא את דרכו דרך המבוך המורכב של הרשת האנדופלזמית והגולג׳י? ומה מונע מחלבונים להגיע למקומות הלא נכונים?
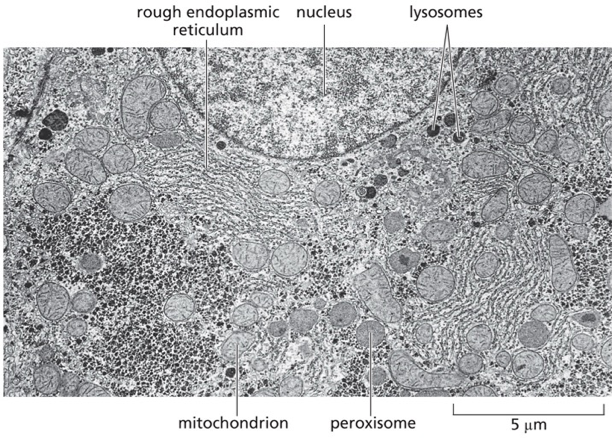
התשובה המרתקת היא שכל חלבון נושא עמו, מרגע היווצרותו, “כתובת מדויקת” המקודדת ברצף חומצות האמינו שלו. זהו רעיון מהפכני שפותח בשנות השבעים של המאה הקודמת, והוא עומד בבסיס הבנתנו המודרנית של ביולוגיה תאית.
פרק ראשון: תגליות פורצות דרך - מפלאדה לבלובל
המהפכה הטכנולוגית: מיקרוסקופיה אלקטרונית וטכניקות מעקב
ההתפתחות בהבנת מורכבותו של התא האוקריוטי החלה באמצע המאה העשרים, עם פיתוח שתי טכנולוגיות מהפכניות: המיקרוסקופיה האלקטרונית, שחשפה לראשונה את המבנה הפנימי המורכב של התא, והטכניקות הרדיואקטיביות שאפשרו מעקב אחר מולקולות בודדות בתא החי.
ג׳ורג׳ פלאדה, רופא רומני שהקדיש את חייו למחקר, היה הראשון להבין שהתמונות הסטטיות של המיקרוסקופ האלקטרוני מסתירות מציאות דינמית מורכבת. הוא פיתח את הגישה המהפכנית של שחזור תהליכים תאיים במבחנה, ובכך הניח את הבסיס לביולוגיה ניסויית מודרנית.

ניסוי הפולס-צ’ייס: חלון לעולם הדינמי של התא
הניסוי החשוב ביותר של פלאדה, הפולס-צ’ייס (pulse-chase), מהווה דוגמה קלאסית לאלגנטיות המחקר הביולוגי. העיקרון פשוט אך גאוני: תאים נחשפים לזמן קצר (פולס) לחומצות אמינו מסומנות רדיואקטיבית, כך שכל החלבונים שמסונתזים באותו פרק זמן מקבלים “תווית” רדיואקטיבית. לאחר מכן, חומצות האמינו הרדיואקטיביות מוחלפות בכמות עודפת של חומצות אמינו לא מסומנות (צ’ייס), כך שחלבונים חדשים שיסונתזו לא יהיו מסומנים.
הגאונות של השיטה טמונה ביכולת לעקוב אחרי המסלול של אותו חלבון בזמנים שונים. בתחילת הפולס, כל הסימון הרדיואקטיבי נמצא ברשת האנדופלזמית הגסה - שם מסונתזים חלבוני ההפרשה. עם הזמן, הסימון עובר למתקן הגולג׳י, משם לשלפוחיות עיכוי (condensing vesicles), ולבסוף לזימוגן גרנולס - השלפוחיות שמכילות את האנזימים הלא פעילים המיועדים להפרשה.
התגלית החשובה הייתה שזהו מסלול כיווני וסדור: חלבונים לא נודדים באקראי בתא, אלא עוקבים אחר מסלול קבוע ומוגדר מראש. יתרה מכך, החלבונים נשמרים בצורה לא פעילה (כזימוגנים) לאורך כל המסלול, ומופעלים רק כשמגיעים ליעדם הסופי - עיקרון שחוזר על עצמו פעמים רבות בביולוגיה.
היפותזת הסיגנל של בלובל: מהיפותזה למהפכה
גינטר בלובל, רופא גרמני שהפך לחוקר ביולוגיה, לקח את התגליות של פלאדה צעד נוסף קדימה. בשנת 1971, הוא הציע היפותזה נועזת שהייתה אמורה לשנות לחלוטין את הבנתנו של עולם החלבונים: “היפותזת הסיגנל”. לפי היפותזת הסיגנל, חלבונים לא מגיעים ליעדים הרצויים במקרה, אלא נושאים עמם רצפי הכוונה מובנים.

העיקרון המהפכני שבלובל הציע היה שהמידע הדרוש להכוונת חלבון ליעדו מקודד בתוך רצף חומצות האמינו של החלבון עצמו. בפשטות מדהימה: החלבון נושא עמו את כתובתו.
המודל של בלובל תיאר תהליך דינמי: כאשר חלבון המיועד להפרשה מתחיל להיווצר על ריבוזום חופשי בציטוסול, רצף הסיגנל שלו - הנמצא ב-N-terminus - מזוהה על ידי “גורם קישור” עוד כשהחלבון נמצא בתהליך סינתזה. זיהוי זה גורם לצימוד הריבוזום לממברנה של הרשת האנדופלזמית, והחלבון הגדל נדחף דרך הממברנה אל תוך הלומן.
התובנה החדה של בלובל הייתה שרצף הסיגנל נחתך במהלך התהליך. חיתוך זה קריטי לשני מטרות: ראשית, הוא מעניק כיווניות לתהליך - ברגע שנחתך הסיגנל, החלבון לא יכול לחזור לציטוסול. שנית, הסרת הסיגנל מאפשרת לחלבון להשיג את הצורה הפעילה שלו.
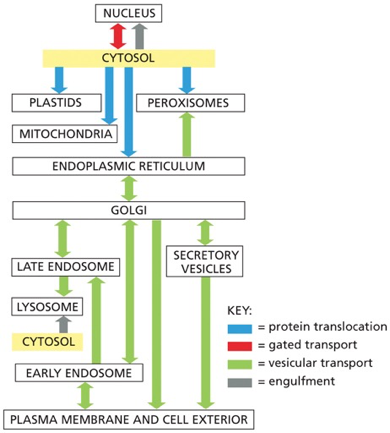
פרק שני: האינסולין כדוגמה קלאסית
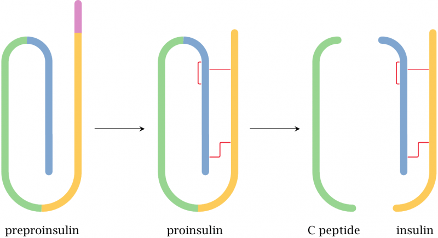
מסע האינסולין: מגן להורמון פעיל
האינסולין מהווה דוגמה מושלמת למורכבות תהליכי העיבוד והכוונה של חלבונים. ההורמון הפעיל הוא מולקולה קטנה יחסית, המורכבת משתי שרשראות פוליפפטידיות קצרות (A ו-B) המחוברות בגשרים דיסולפידיים. אולם המסע שלו מהגן להורמון הפעיל הוא מורכב ורב שלבי.
תהליך הסינתזה מתחיל בתאי בטא של האיים בלבלב, שם מסונתז תחילה פרפרו-אינסולין - מולקולה ארוכה יותר המכילה שלושה מקטעים עיקריים:
- רצף הסיגנל (Signal peptide) - ב-N-terminus, המכוון את החלבון לרשת האנדופלזמית
- שרשרת B - שתהפוך לאחד משני החלקים של האינסולין הבשל
- C-peptide - מקטע מקשר
- שרשרת A - החלק השני של האינסולין הבשל
כאשר תהליך התרגום מתחיל, רצף הסיגנל מופיע ראשון מהריבוזום ומזוהה מיד על ידי מערכת הזיהוי. הריבוזום מוצמד לרשת האנדופלזמית, והחלבון הגדל נדחף פנימה ללומן. שם, בסביבה החומצית של הרשת האנדופלזמית, נוצרים הגשרים הדיסולפידיים הקריטיים לפעילות הביולוגית.
הסביבה החומצית של לומן הרשת האנדופלזמית קריטית ליצירת הגשרים הדיסולפידיים. בציטוסול, הסביבה חזקה ומונעת יצירת גשרים כאלה, אך בתוך הרשת האנדופלזמית הסביבה מאפשרת ואף מעודדת תהליך זה. זאת דוגמה יפה לחשיבות הקומפרטמנטליזציה - אותו תהליך שיכול להזיק בסביבה אחת, חיוני בסביבה אחרת.
עיבוד רב שלבי: מהכוונה להפעלה
לאחר יצירת הגשרים הדיסולפידיים, הפרפרו-אינסולין עובר עיבוד נוסף. רצף הסיגנל נחתך על ידי אנזים ייעודי (signal peptidase), והמולקולה הופכת לפרו-אינסולין. המולקולה ממשיכה במסלול ההפרשה - עוברת למתקן הגולג׳י, משם לשלפוחיות הפרשה. רק בשלב המאוחר, בתוך שלפוחיות ההפרשה, נחתך גם C-peptide, והאינסולין הופך לפעיל.
התזמון של החיתוכים אינו מקרי. האינסולין הפעיל הוא הורמון עוצמתי, שיכול לגרום לנזק רב אם ישוחרר בזמן הלא נכון או במקום הלא נכון. על ידי שמירה על המולקולה בצורה לא פעילה עד הרגע האחרון, התא מבטיח ששיחרור ההורמון יהיה מבוקר ומדויק.
פרק שלישי: המערכת הממברנלית כרשת תחבורה
הרשת האנדופלזמית: מפעל הייצור התאי
הרשת האנדופלזמית (Endoplasmic reticulum - ER) מהווה את המדור הגדול ביותר במערכת הממברנות הפנימיות של התא, ותפקידה הולך הרבה מעבר לסינתזת חלבונים. היא משמשת כמפעל ייצור מורכב שמייצר ומעבד מגוון עצום של מוצרים ביולוגיים: חלבונים, ליפידים, פוספוליפידים, סטרואידים ועוד.
אנדו-פלזמית = בתוך הפלזמה
הרשת האנדופלזמית מחולקת לשני אזורים עיקריים בעלי מאפיינים ותפקידים שונים:
- הרשת האנדופלזמית הגסה (Rough ER - rER): מאופיינת בריבוזומים הצמודים לצד הציטופלזמי של הממברנה. כאן מסונתזים חלבונים המיועדים להפרשה, לממברנות, או למדורים אורגנליים ספציפיים. הריבוזומים אינם צמודים באופן קבוע - הם נצמדים בתחילת סינתזת חלבון עם רצף סיגנל ומשתחררים בסיום התהליך.
- הרשת האנדופלזמית החלקה (Smooth ER - sER): נטולת ריבוזומים ומתמחה בסינתזה של ליפידים, פוספוליפידים וסטרואידים. באיברים מסוימים, כמו הכבד, היא מתמחה גם בניקוי רעלים וחילוף חומרים של תרופות.
הדינמיות המורכבת של המערכת
בניגוד לתמונה הסטטית הנוצרת מתצלומי מיקרוסקופ, הרשת האנדופלזמית היא מערכת דינמית ביותר. היא נמצאת במצב מתמיד של שינוי צורה, הארכה, התכווצות וחלוקה. תנועות אלו מתואמות על ידי חלבוני מנוע הפועלים על גבי מערכת הציטוסקלטון, בעיקר מיקרוטובולים.
הדינמיות הזאת לא אקראית, אלא מווסתת בקפידה על ידי הצרכים המשתנים של התא. כאשר התא זקוק לייצור מוגבר של חלבוני הפרשה - למשל, כתגובה לסיגנל הורמונלי - נפח הרשת האנדופלזמית הגסה יכול לגדול במהירות. לעומת זאת, כאשר נדרשת סינתזה מוגברת של ממברנות או ליפידים - למשל, לקראת חלוקת תא - הרשת האנדופלזמית החלקה מתרחבת.
מנגנון הזיהוי והצימוד
המנגנון שבאמצעותו ריבוזומים מזהים שהם צריכים להיצמד לרשת האנדופלזמית מורכב ומפותח. התהליך מתחיל כאשר רצף הסיגנל של החלבון הגדל מתחיל להופיע מהריבוזום. רצף הסיגנל מזוהה מיד על ידי חלקיק זיהוי הסיגנל (Signal Recognition Particle - SRP), קומפלקס המורכב מ-RNA ומחלבונים.
ה-SRP קושר את רצף הסיגנל ועוצר זמנית את תהליך התרגום. זהו מנגנון הגנה חשוב - הוא מונע מהחלבון להמשיך להיווצר בציטוסול ולהתקפל שם בצורה שעלולה להיות שגויה. במקום זאת, כל הקומפלקס (ריבוזום + mRNA + SRP + החלבון הגדל) נע אל הרשת האנדופלזמית.
ברשת האנדופלזמית ממתין רצפטור SRP (SRP receptor), חלבון אינטגרלי הממברנה שמזהה את ה-SRP ומאפשר לריבוזום להצמד לממברנה. במקביל, נפתחת תעלה מיוחדת בממברנה (Translocon) שמאפשרת לחלבון הגדל לעבור דרכה אל תוך לומן הרשת האנדופלזמית.
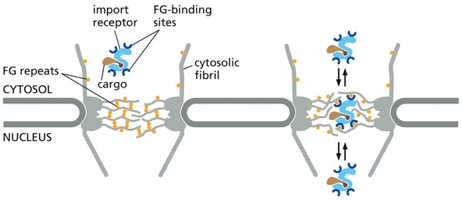
פרק רביעי: עיבוד ובקרת איכות ברשת האנדופלזמית
הסביבה הייחודית של הלומן
לומן הרשת האנדופלזמית מהווה סביבה ייחודית המותאמת במיוחד לעיבוד חלבונים. בניגוד לציטוסול, שבו שורר מצב מחזר, הלומן מתאפיין בסביבה חומצית. סביבה חומצית קריטית ליצירת גשרים דיסולפידיים - קשרים קוולנטיים בין קבוצות סולפיד של חומצות אמינו מסוג ציסטין.
הגשרים הדיסולפידיים ממלאים תפקיד מכריע ביציבות ובפונקציה של חלבונים רבים. הם מייצבים את המבנה התלת-ממדי של החלבון ומונעים ממנו להתפרק או לאבד את פעילותו. תהליך יצירתם צריך להיות מבוקר ומדויק - גשרים שנוצרים בין הציסטינים הלא נכונים יכולים לגרום לחלבון להתקפל באופן שגוי ולאבד את פעילותו.
מערכת השאפרונים והאנזימים המתקנים
בתוך לומן הרשת האנדופלזמית פועלת מערכת מתוחכמת של חלבוני עזר, הידועים בשם שאפרונים (Chaperones).
שאפרונים מסייעים לחלבונים חדשים להתקפל למבנה המרחבי התקין, מונעים הצטברות של קיפולים שגויים, ומזהים חלבונים שלא התקפלו כראוי.
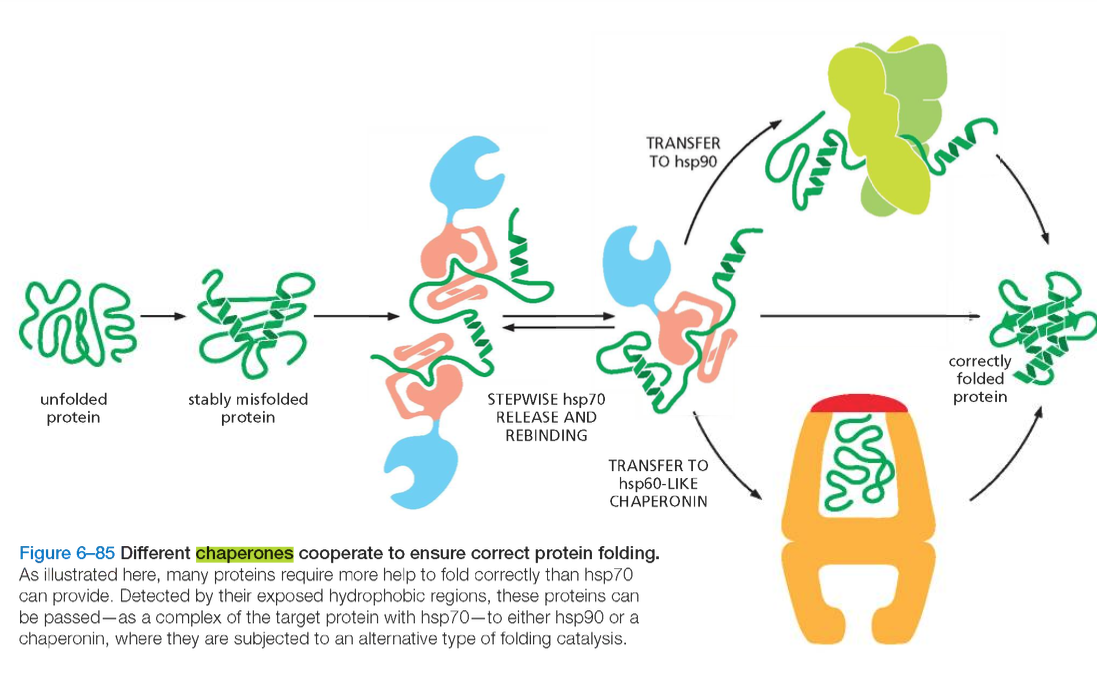
השאפרון המרכזי ברשת האנדופלזמית הוא BiP (Binding Immunoglobulin Protein), המשתייך למשפחת חלבוני ה-Hsp70.
BiP נקשר לחלבונים שלא התקפלו כראוי, ומסייע להם להגיע למבנה הפעיל התקין. כאשר חלבון ממשיך להיכשל בתהליך הקיפול, BiP שומר על הקשר אליו ומונע את מעברו לשלב הבא במסלול ההפרשה.
בנוסף לשאפרונים, פועלים בלומן גם אנזימים המתמחים בבקרת איכות ועיבוד מבני של חלבונים:
-
Protein Disulfide Isomerase (PDI) – אנזים המזרז את יצירת הגשרים הדיסולפידיים (S–S) בין שיירי ציסטאין, ומוודא שהם נוצרים בין זוגות תקינים. במקרים של קיפול שגוי, הוא מסוגל גם לשבור גשרים לא תקניים ולאפשר יצירתם מחדש.
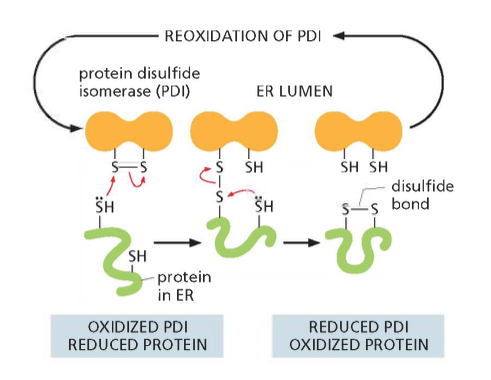
-
Peptidyl-prolyl Isomerase – אנזים שמזרז איזומריזציה בין קונפורמציות cis/trans של קשרי פפטיד סביב שיירי פרולין, תהליך קריטי לקיפול חלבונים מסוימים שבהם פרולין יוצר עיכוב מבני.
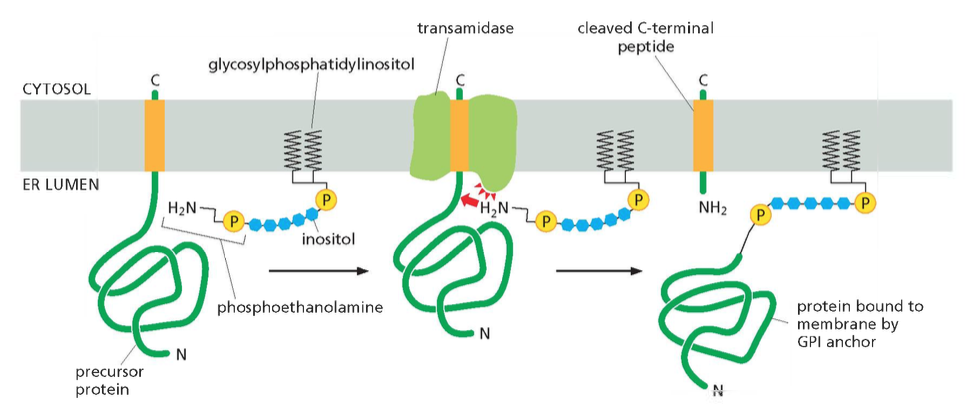
תגובה לחלבונים לא מקופלים (Unfolded Protein Response)
כאשר כמות החלבונים הלא מקופלים ברשת האנדופלזמית עולה מעל רמה מסוימת - למשל, בתנאי לחץ או מחלה - התא מפעיל מנגנון הגנה מתוחכם הנקרא תגובת הלחץ הלא מקופל (UPR).
מנגנון UPR כולל שלושה מסלולי סיגנל עיקריים שמטרתם להתמודד עם העומס:
- הפחתת סינתזת חלבונים חדשים - כדי להפחית את העומס על המערכת
- הגברת ייצור שאפרונים ואנזימי עיבוד - כדי לשפר את יכולת העיבוד
- הפעלת מסלולי הרס חלבונים פגומים - כדי לפנות חלבונים שלא ניתן לתקן
אם המנגנונים הללו אינם מצליחים להתמודד עם הבעיה, התא עלול להיכנס לתוכנית מוות מתוכנת (אפופטוזיס) כדי למנוע נזק לרקמה שלמה.
פרק חמישי: מסלול ההפרשה - מהרשת האנדופלזמית לעולם החיצון
המעבר למתקן הגולג׳י
חלבונים שהושלם עיבודם בהצלחה ברשת האנדופלזמית אינם נשארים שם. הם נארזים בשלפוחיות הובלה מיוחדות ונשלחים ליעד הבא במסלול - מתקן הגולג׳י. תהליך זה מדויק ביותר ומבוסס על מיון וברירה קפדניים.
המנגנון פועל באמצעות זיהוי של “תוויות יצוא” על החלבונים. חלבונים שעברו קיפול נכון וכל התהליכים הנדרשים מקבלים תווית שמסמנת אותם כמוכנים ליצוא. התווית הזו מזוהה על ידי חלבונים מיוחדים שמארזים את החלבונים בשלפוחיות הובלה.
שלפוחיות ההובלה אינן סתם “מכולות” להעברת חומרים. הן מערכות הובלה מתוחכמות הכוללות:
- מנגנוני כיוון: חלבונים על פני השלפוחית שמזהים את היעד הנכון
- מנגנוני איחוי: מערכות שמבטיחות ששלפוחית תתמזג רק עם המדור הנכון
- מנגנוני בקרה: מערכות שמונעות איחוי שגוי או מוקדם מדי
מתקן הגולג׳י: עיבוד מתקדם ומיון סופי
מתקן הגולג׳י מהווה “תחנת העיבוד המתקדם” במסלול ההפרשה. בניגוד לרשת האנדופלזמית, שעוסקת בעיקר בקיפול בסיסי ויצירת גשרים דיסולפידיים, הגולג׳י מתמחה בעיבודים כימיים מורכבים יותר.
המתקן מורכב ממספר תתי-מדורים הארגונים בסדר מדויק:
- ה-Cis Golgi: הצד המקבל, הקרוב לרשת האנדופלזמית
- ה-Medial Golgi: האזור האמצעי
- ה-Trans Golgi: הצד המשחרר, שממנו יוצאים החלבונים המעובדים
כל אזור מתמחה בסוגי עיבוד שונים:
גליקוזילציה: הוספת קבוצות סוכר לחלבונים. תהליך זה קריטי לפונקציה של חלבונים רבים ומשפיע על יציבותם, כיוונם ופעילותם הביולוגית.
פוספורילציה: הוספת קבוצות פוספט שיכולות לשנות את פעילות החלבון או לשמש כסיגנל להכוונה נוספת.
פרוטיאוליזה מוגבלת: חיתוך מדויק של חלבונים להפעלתם או לשינוי פונקציה.
הקבלה הסופית: מיון ליעדים שונים
אחד התפקידים החשובים ביותר של הגולג׳י הוא המיון הסופי של חלבונים ליעדיהם השונים. מה-Trans Golgi יוצאים חלבונים לכמה יעדים אפשריים:
- הפרשה קונסטיטוטיבית: חלבונים שמופרשים באופן רציף ללא צורך בסיגנל חיצוני
- הפרשה מווסתת: חלבונים שנשמרים בשלפוחיות מיוחדות ומופרשים רק בתגובה לסיגנל ספציפי
- ליזוזומים: אנזימים פרוטאוליטיים המיועדים לפירוק חומרים
- ממברנת התא: חלבונים שיתמזגו עם הממברנה ויפעלו שם
תהליך המיון מבוסס על זיהוי מדויק של רצפי הכוונה ספציפיים לכל יעד. טעויות במיון יכולות להוביל למחלות חמורות, כפי שרואים במחלות ליזוזומליות, שבהן אנזימים נשלחים למקום הלא נכון.
פרק שישי: המערכת הגרעינית - שער המידע התאי
מבנה מעטפת הגרעין: מעבר בין עולמות
הגרעין מהווה את “מרכז הפיקוד” של התא האוקריוטי, המכיל את כל המידע הגנטי ומרבית המנגנונים להעתקתו ועיבודו. הפרדת הגרעין מהציטופלזמה מאפשרת שליטה דקיקה על תהליכי התעתקה, עיבוד RNA, וויסות ביטוי גנים. אולם הפרדה זו יוצרת אתגר לוגיסטי עצום: כיצד מולקולות נדרשות חודרות פנימה, וכיצד תוצרים מוכנים יוצאים החוצה?
מעטפת הגרעין שונה מיסודה ממדורים אורגנליים אחרים. היא מורכבת משתי ממברנות נפרדות:
- הממברנה החיצונית: המשך ישיר של הרשת האנדופלזמית, נושאת ריבוזומים ומחוברת ללומן הרשת האנדופלזמית
- הממברנה הפנימית: ממברנה ייחודית הצמודה לכרומטין ומעוגנת על ידי חלבוני למין
בין שתי הממברנות קיים לומן (perinuclear space) המהווה המשך של לומן הרשת האנדופלזמית. מבנה זה מאפשר תקשורת ישירה בין הגרעין למערכת הממברנות הפנימיות, אך שומר על הפרדה מוחלטת בין התוכן הגרעיני לציטופלזמה.
נקבוביות הגרעין: שערים מולקולריים מורכבים (Nuclear Pore Complexes - NPCs)
המעבר בין הגרעין לציטופלזמה מתבצע באמצעות מבנים מורכבים ומפותחים שנקראים נקבוביות גרעין (Nuclear Pore Complexes - NPCs). כל נקבובית היא מבנה ענק מבחינה מולקולרית, המורכב מכ-800-700 שרשראות פוליפפטידיות שונות, שמאורגנות בסימטריה של שמונה סביב תעלה מרכזית.
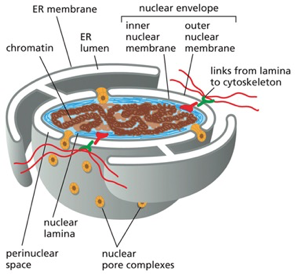
נקבוביות הגרעין כוללות מספר רכיבים מרכזיים:
- הגוף המרכזי: הממוקם בתוך הממברנות ויוצר את התעלה הבסיסית
- הסל הגרעיני (Nuclear Basket): מבנה דמוי סל הבולט אל תוך הגרעין
- הסיבים הציטופלזמיים: זרועות ארוכות הבולטות אל הציטופלזמה
למרות הרושם שהתעלה פתוחה, קיים בה מחסום בררני (permeability barrier) שמונע מעבר חופשי של מאקרומולקולות. מחסום זה מורכב מחלבונים המכילים רצפים חוזרים עשירים בפנילאלנין וגליצין (FG repeats), היוצרים מעין “רשת מולקולרית” שמאפשרת מעבר בררני.
מנגנוני הטרנספורט הגרעיני
הטרנספורט דרך נקבוביות הגרעין הוא תהליך פעיל הדורש אנרגיה וחלבוני עזר מיוחדים. המערכת מבוססת על עיקרון של רצפטורי הובלה מחזוריים (shuttling transport receptors), הידועים כאימפורטינים (לכניסה) ואקספורטינים (ליציאה).
רצפטורי ההובלה המרכזיים שונים בתכלית מרצפטורי ממברנה רגילים - הם לא עוגנים למקום אחד, אלא נעים הלוך ושוב בין הגרעין לציטופלזמה. המחזור הבסיסי כולל מספר שלבים:
- זיהוי המטען: הרצפטור מזהה ונקשר למטען שלו (קארגו) בציטופלזמה
- מעבר דרך הנקבובית: הקומפלקס עובר דרך המחסום הבררני
- שחרור בגרעין: המטען משתחרר בתוך הגרעין
- חזרה לציטופלזמה: הרצפטור חוזר לציטופלזמה למחזור חדש
הרצף NLS הקלאסי ומנגנון פעולתו
הכוונת חלבונים לגרעין מבוססת על זיהוי רצפי הכוונה גרעיניים (Nuclear Localization Signals - NLS). הרצף הקלאסי, שהתגלה לראשונה בחלבון הויראלי Large T Antigen של וירוס SV40, מהווה דוגמה מושלמת לעוצמה של רצפי הכוונה.
הרצף: ליזין-ליזין-ליזין-ארגינין-ליזין, המורכב מחמש חומצות אמינו בעלות מטען חיובי, מספיק להכוונת כל חלבון לגרעין. המחקר שהוביל לגילוי זה השתמש בהנדסה גנטית לשינוי חומצה אמינית אחת - החלפת ליזין אחד בתריאונין - מספיק כדי לבטל לחלוטין את יכולת ההכוונה לגרעין.
המנגנון פועל באמצעות אימפורטין-α ואימפורטין-β:
- אימפורטין-α: מזהה ונקשר ישירות לרצף ה-NLS על החלבון המיועד
- אימפורטין-β: נקשר לאימפורטין-α ומתווך את המעבר הפיזי דרך נקבובית הגרעין
לאחר הכניסה לגרעין, החלבון Ran-GTP גורם לפירוק הקומפלקס ולשחרור המטען, ואימפורטין-β חוזר לציטופלזמה.
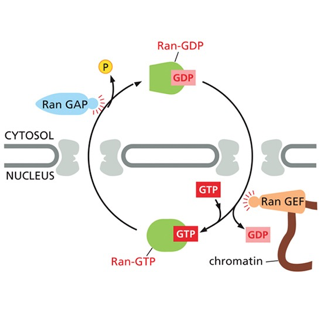
Ran = Ras-related nuclear protein
מורכבות המערכת: מסלולים מרובים ווויסות דק
המערכת האמיתית הרבה יותר מורכבת מהתיאור הבסיסי. קיימים עשרות מסלולי כניסה ויציאה שונים, כל אחד מותאם לסוג מטען ספציפי:
- מסלולי כניסה שונים: לחלבונים שונים יש רצפי NLS שונים, המזוהים על ידי אימפורטינים ספציפיים
- מסלולי יציאה: חלבונים עם רצפי יצוא גרעיניים (Nuclear Export Signals - NES) מועברים החוצה בתיווך אקספורטינים
- מטענים מורכבים: תת-יחידות ריבוזום, קומפלקסי RNA-חלבון, ואף וירוסים שלמים עוברים במסלולים מיוחדים
המורכבות הזו מאפשרת לתא שליטה עדינה בהרכב הגרעיני. חלבונים עם גם רצף כניסה וגם רצף יציאה יכולים להיות מווסתים באמצעות הסתרה או חשיפה של אחד הרצפים, מה שמאפשר תגובה מהירה לשינויים בתנאי התא.
דוגמה קלאסית היא ויסות גורמי תעתוק בתגובה לסיגנלים הורמונליים. כאשר מגיע אינסולין לתא, הוא מפעיל רצף אירועים שמוביל לכניסה של גורמי תעתוק מסוימים לגרעין, שם הם מפעילים ביטוי של גנים מסוימים. כאשר הסיגנל נעלם, אותם גורמי תעתוק עלולים להיות מועברים חזרה לציטופלזמה או אף לעבור פירוק.
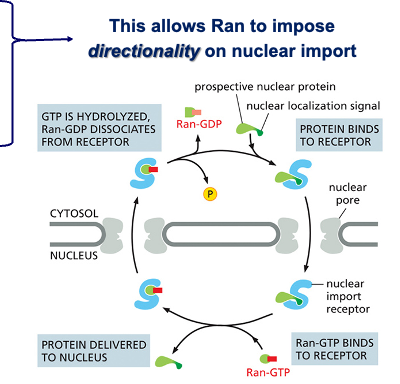
פרק שביעי: ויסות, בקרת איכות והשלכות פתולוגיות
מערכות בקרת איכות רב שלביות
המערכת המורכבת של הכוונת חלבונים חייבת לכלול מנגנוני בקרת איכות מתוחכמים. שגיאות בהכוונה יכולות להיות קטלניות - אנזים פרוטאוליטי שמגיע לגרעין במקום לליזוזום יכול להרוס את ה-DNA, וחלבון ממברנה שמגיע לציטוסול עלול ליצור צבירים רעילים.
בכל שלב במסלול קיימים מנגנוני בקרה:
- ברמת הסינתזה: מערכת SRP מוודאת שחלבונים עם רצף סיגנל יגיעו לרשת האנדופלזמית ולא יישארו בציטוסול
- ברמת הקיפול: שאפרונים ומערכת UPR מוודאים שרק חלבונים מקופלים נכון ימשיכו במסלול
- ברמת ההכוונה: רצפטורי הובלה בררניים מוודאים שחלבונים יגיעו רק ליעדים הנכונים
- ברמת היעד: מערכות זיהוי ביעד מוודאות שרק חלבונים מתאימים יישארו במדור
כאשר מנגנוני הבקרה מזהים שגיאה, נכנסות פעולה מערכות “חירום”:
- מערכת האוביקוויטין-פרוטאזום: מסמנת חלבונים פגומים להרס
- אוטופגיה: מפרקת מדורים שלמים שנפגעו
- אפופטוזיס: במקרים קיצוניים, התא נכנס למוות מתוכנת כדי להגן על הרקמה
השלכות רפואיות של הפרעות בהכוונה
הפרעות במערכת הכוונת החלבונים עומדות בבסיס מחלות רבות ומגוונות. כמה דוגמאות בולטות:
מוקופוליסכרידוזיס: מחלות הנגרמות מהפרעה בהכוונת אנזימים לליזוזומים. האנזימים נשלחים בטעות החוצה מהתא במקום לליזוזומים, מה שגורם להצטברות של חומרי פסולת ברקמות.
מחלות פרובות (Protein folding diseases): כמו אלצהיימר, פרקינסון והנטינגטון, הקשורות להפרעות בקיפול ובהכוונה של חלבונים במערכת העצבים.
מחלות כבד: חלק ממחלות הכבד קשורות להפרעות בסינתזה ובהפרשה של חלבוני פלזמה.
סוכרת: חלק מצורות הסוכרת נגרמות מהפרעות בעיבוד או בהפרשה של אינסולין.
הבנה מולקולרית לטיפולים חדשים
ההבנה המעמיקה של מנגנוני הכוונת החלבונים פותחת דרכים חדשות לטיפול:
- טיפולי החלפה אנזימטית: הזרקה של אנזימים מעובדים שיכולים להגיע ליעדים הנכונים בתאים חולים
- תרופות שאפרון: מולקולות קטנות שמסייעות לחלבונים מוטנטים להתקפל נכון
- טיפול גני: הכנסה של גנים תקינים שיפצו על הפרעות גנטיות במערכת ההכוונה
פרק שמיני: היבטים אבולוציוניים ואנרגטיים
המחיר האנרגטי של הקומפרטמנטליזציה
המערכת המורכבת של הכוונת חלבונים דורשת השקעה אנרגטית עצומה. השאלה הטבעית היא: מדוע התפתחה מערכת כה יקרה אנרגטית, כאשר תאים פרוקריוטיים מתפקדים ללא הפרדה מדורית מורכבת?
ההשקעה האנרגטית כוללת:
- סינתזה של חלבוני עזר: אלפי מולקולות שונות המשרתות את מערכת ההכוונה
- תחזוקת גרדיאנטים: שמירה על הבדלי הרכב בין מדורים
- תהליכי הובלה פעילים: מעבר של מולקולות נגד גרדיאנטי ריכוז
- מנגנוני בקרת איכות: מערכות מורכבות לזיהוי ותיקון שגיאות
היתרונות האבולוציוניים
למרות המחיר הגבוה, הקומפרטמנטליזציה מעניקה יתרונות אבולוציוניים משמעותיים:
- התמחות תפקודית: כל מדור יכול להתפתח להתמחות בתהליכים ספציפיים
- יעילות מטבולית: ריכוז אנזימים במקום הנכון מגביר יעילות
- גמישות ווויסות: אפשרות לווסת תהליכים בצורה עדינה ומורכבת
- הפרדת תהליכים מתנגדים: תהליכים שיכולים להפריע זה לזה מופרדים מרחבית
היתרונות הללו הכרחיים לפיתוח של יצורים רב-תאיים מורכבים, עם רקמות מתמחות ומערכות איברים מתוחכמות.
השוואה עם מערכות פרוקריוטיות
תאים פרוקריוטיים אמנם נטולי קומפרטמנטליזציה מורכבת, אך הם מכילים את האבני הבניין הבסיסיות של מערכת ההכוונה. רצפי סיגנל קיימים גם בחיידקים, בעיקר להכוונת חלבונים לממברנה או להפרשה החוצה. האבולוציה של מערכת מורכבת יותר איפשרה את הקפיצה לרמת מורכבות של תאים אוקריוטיים.
מסקנות: מערכת מורכבת עם עקרונות פשוטים
המערכת של עיבוד והכוונת חלבונים, למרות מורכבותה הרבה, מבוססת על עקרונות פשוטים ואלגנטיים:
- מידע מקודד ברצף: כל חלבון נושא את המידע הדרוש להכוונתו ברצף חומצות האמינו שלו
- זיהוי ספציפי: מערכות זיהוי מולקולריות מבטיחות שכל חלבון יגיע ליעדו הנכון
- עיבוד הדרגתי: תהליכים מורכבים מתרחשים בשלבים, המאפשרים בקרה ותיקון
- בקרת איכות רב שלבית: כל שלב כולל מנגנוני בקרה למניעת שגיאות
- גמישות ווויסות: המערכת מאפשרת התאמה לשינויים בתנאי התא
ההבנה הזו חיונית לא רק להכרת הביולוגיה הבסיסית, אלא גם לפיתוח טיפולים רפואיים, כלי הנדסה גנטית, ויישומים ביוטכנולוגיים. המורכבות הזו מייצגת את היופי של המערכות הביולוגיות - פתרונות אלגנטיים לבעיות הנדסיות מורכבות, שמאפשרים חיים מורכבים ומגוונים על פני כדור הארץ.
בסופו של דבר, מערכת הכוונת החלבונים מדגימה כיצד מידע גנטי פשוט מתורגם לארגון מרחבי וזמני מורכב, המאפשר לתא לתפקד כיחידה מתוחכמת וחכמה. זהו אחד מביטויי הגאונות של האבולוציה הביולוגיה - יצירת מורכבות עצומה מרכיבים פשוטים, באמצעות עקרונות ברורים ומובנים.
שיעור 14 - מעבר מגרעין ל-ER
תאריך: 19/05/2025חזקים בהובלות?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
הרצאה 11: טרנספורט לגרעין (המשך)
מבוא והכוונה כללית
הדיון חוזר לנושאים שנדונו בסוף ההרצאה הקודמת, לשם הבהרה וחזרה. לאחר המעבר מכימיה אורגנית לביולוגיה של התא, הנושא הנוכחי הוא כניסה לגרעין.
רקע כללי - הכוונת חלבונים במדורים
חלק זה מסכם את הרצאה 11 ועובר להרצאה 12.
באופן כללי, הנושא המרכזי הוא הכוונה של חלבונים למדורים השונים בתא האוקריוטי. סדרת ההרצאות נועדה לספק תמונה כללית של האופן שבו תאים אוקריוטיים מבצעים את עיקרון “הפרד ומשול” — הכוונת חלבונים למדורים השונים וגם אל מחוץ לתא.
במקרה זה, הדיון מתמקד בכניסה לגרעין.
נקבוביות הגרעין (Nuclear Pore Complexes)
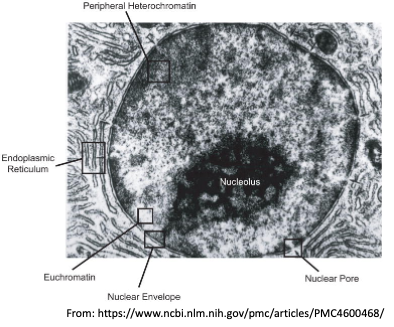
העקרונות המרכזיים, שכבר הוצגו, כוללים את הנוקלאר פור קומפלקסים (NPC), שהם שערים ענקיים במעטפת הממברנה הכפולה של הגרעין.
מאפיינים של השערים הגרעיניים
- לא מדובר בתעלות יונים, שהן קטנות משמעותית ביחס לשערים הענקיים האלה.
- אף על פי שתמונות ממיקרוסקופ אלקטרונים עשויות להראות תעלה פתוחה, היא אינה פתוחה.
- ההצגה הסכמטית מראה מחסום בררני תלת-ממדי.
המחסום הבררני המולקולרי
בעשורים האחרונים, פוענח במידה רבה מנגנון הפעולה של מבנה זה. מבלי להיכנס לפרטים ביוכימיים מתקדמים, המנגנון מבוסס על חזרות של שתי חומצות אמינו:
- פנילאלנין: חומצת אמינו עם שרשרת צדדית הידרופובית וטבעת ארומטית.
- אלפי עותקים של חומצות אמינו אלה, שהטבעות הארומטיות שלהן יוצרות את המחסום התלת-ממדי הסלקטיבי של הכניסה והיציאה מהגרעין.
מסלולי כניסה לגרעין - קטגוריות שונות
רצפטורים מסיסים ושאטלים מולקולריים
אלפי מולקולות שונות, המכונות “קארגו”, צריכות להיכנס לגרעין ולצאת ממנו, וחלקן אף נעות בשני הכיוונים. נדרש גורם שיתווך את המעבר הסלקטיבי.
מדובר באימפורט רצפטורים, שהם חלק ממשפחה כללית של רצפטורים מסיסים. בניגוד לרצפטורים ממברנליים, import receptors אינם מעוגנים לממברנה ונכנסים ויוצאים בין שני המדורים — הציטופלזמה והגרעין.
קטגוריות של אותות הכוונה לגרעין
הסכמה בתמונה 12.58 בספר מראה כי קיימות קטגוריות שונות של אותות הכוונה לגרעין, ולא רק רצף אחד.
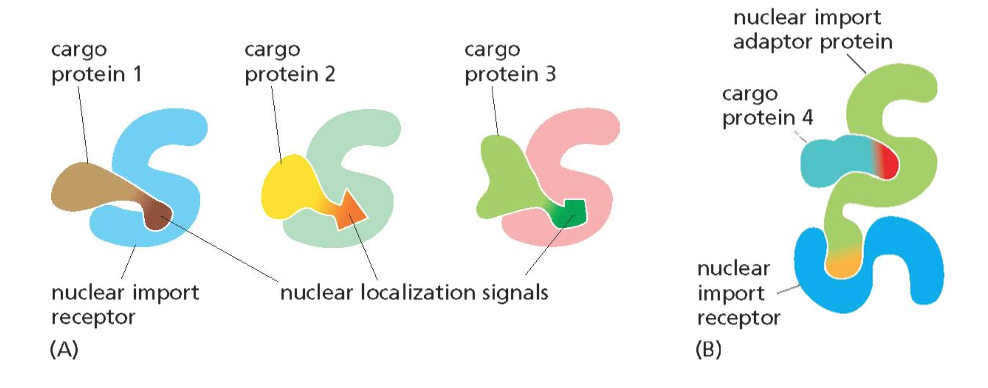
הדוגמה הקלאסית היא NLS (Nuclear Localization Signal):
- רצף של חמש חומצות אמינו טעונות חיובית.
- זהו רק סוג אחד של NLS.
- מאות חלבונים שונים נושאים את רצף ה-NLS לצורך הכוונה לגרעין.
לדוגמה, חלבון הנושא NLS מזוהה על ידי רצפטור מסיס. עם זאת, זוהי רק דוגמה אחת מני רבות. קיימות תת-קטגוריות שונות ומסלולים שונים של כניסה לגרעין, כאשר כל מסלול מתווך על ידי רצפטורים ייחודיים (אימפורטין מסוים).
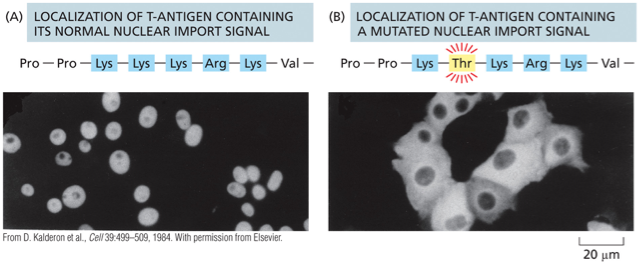
ה-NLS הוא פנימי, בתוך החלבון (ואינו נחתך)
מורכבות המערכת - רספטורים ואדפטורים
המערכת מורכבת אף יותר. הרצפטורים נכנסים ויוצאים, ומכניסים את מטעניהם — במקרה זה, חלבונים שצריכים להיכנס לגרעין.
כל סיגנל מזוהה על ידי רצפטור ייחודי, אך קיימות וריאציות. לעיתים, הרצפטור אינו מזהה ישירות את החלבון, אלא נעזר במתווך (אדפטור). קיימים מסלולים ותת-מסלולים רבים.
דוגמה מפורסמת: אימפורטין α ו-β
הדוגמה המוכרת ביותר (אין צורך לזכור את שמות החלבונים):
- הרצפטור המפורסם ביותר הוא אימפורטין β.
- האדפטור שלו, המתווך, נקרא אימפורטין α.
- בגנום האנושי קיימים שבעה סוגים שונים של אימפורטין α.
כאן נראה שוב עיקרון שכבר הוזכר — חלוקה למסלולים ולתתי-מסלולים.
Importins & exportints - Shuttling transport receptors

היתרונות של חלוקה למסלולים
מה היתרון בחלוקה זו?
החלוקה מאפשרת בקרה. חלוקה למסלולים, תתי-מסלולים וקומבינציות שונות של אימפורט רצפטורים ואדפטורים מאפשרת בקרה דיפרנציאלית על אלפי החלבונים שנכנסים לגרעין. בתאים שונים ותחת מצבים שונים (כגון סטרס, רעב או זמינות מזון), קיימות קבוצות חלבונים שכל אחת מהן מתווכת על ידי רצפטור שייחודי לה.
עקרונות כלליים של התנועה הגרעינית
אותו עיקרון פועל גם ביציאה מהגרעין: יש רצפטורים שמתמחים בהכנסת קארגו (מטענים מולקולריים) לגרעין, ורצפטורים שמתמחים בבהוצאה.
כפי שכבר הוזכר:
- mRNA עטוף בחלבונים צריך לצאת מהגרעין.
- תת-יחידות של הריבוזום צריכות לצאת.
הקארגו אינו בהכרח חלבון בודד, אלא יכול להיות:
- קומפלקס של חלבונים.
- קומפלקס של RNA וחלבון.
נפח התנועה
כל התנועה הזאת מתבצעת בו-זמנית — כניסה ויציאה דרך אותם שערים, אותם נוקלאר פורים.
יתרה מכך, כיום ידוע כי בתא פעיל, בנוקלאר פור אחד יכולים להתרחש מאה אירועים של כניסה ויציאה בו-זמנית.
זהו נפח תנועה עצום, אך כל התנועה הזאת היא תנועה מבוקרת — אין כניסה אקראית לגרעין.
התחלנו מכך שחלבונים צריכים להציג תו כניסה, אישור כניסה — NLS — כדי להיכנס לגרעין.
הבקרה הכללית - חלבון Ran
מבט כללי על המערכת
האם קיימת בקרה כללית על נפח התנועה העצום הזה?
תאים אוקריוטיים לא יכולים לשרוד ללא כניסה ויציאה מבוקרת מהגרעין.
התשובה היא כן, והמנגנון מזכיר נושא שכבר נדון.
מדובר בחלבון Ran, “בן-דוד” של Ras. הוא נחשב “מגניב יותר” כי:
- א) הוא קשור לגרעין.
- ב) הוא לא קשור לסרטן.
משפחת חלבוני GTPase הקטנים
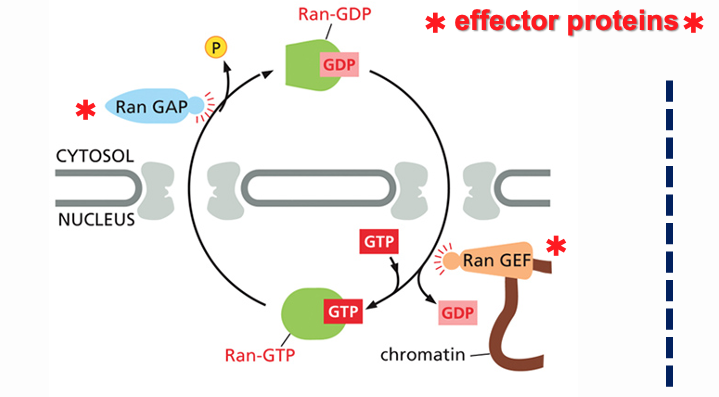
חלבוני GTPase קטנים שייכים למשפחה שלמה שמבקרת תהליכים ביולוגיים רבים. אחד מהם, Ran - הוא חלבון קטן שמבקר את כל מסלולי התנועה הגרעינית.
Ran = Ras-related nuclear protein
עקרון הפעולה של Ran
חלבונים Ran הם מתגים מולקולריים בעלי שני מצבים: ON ו-OFF.
- מצב ON: כאשר Ran קשור ל-GTP (גואנוזין טריפוספט).
- מצב OFF: כאשר Ran קשור ל-GDP (גואנוזין דיפוספט).
כאשר בתוך כיס הנוקלאוטידים קשור GTP — זהו מצב ON. במצב ON חלבון Ran יכול ליצור אינטראקציה עם חלבונים אחרים ולהשפיע על תפקודם.
במצב של GDP הוא ב-OFF.
כמו כל מתג, הוא עובר בין ON ל-OFF.
ההפרדה הייחודית במרחב
במנגנון זה קיימת וריאציה על הנושא: הצורות של GTP ו-GDP מופרדות במרחב התא.
הסכמה מראה:
- בתוך הגרעין, כמעט כל חלבוני Ran נמצאים במצב ON, טעונים ב-GTP. ההבדל הוא של חמישה סדרי גודל — הסיכוי לפגוש מולקולת Ran הקשורה ל-GDP בתוך הגרעין הוא קטן מאוד.
- בציטופלזמה — הפוך - שם כמעט כל מולקולות Ran יהיו במצב GDP (לאחר שאיבדו פוספט אחד).
המנגנון שיוצר את ההפרדה
השאלה נטועה מראש. ל-Ran, כמו לשאר בני משפחתו (כמו Ras), יש חלבוני אפקטור.
מולקולות ה-GTPase הן אנזימים חלשים מאוד. במבחנה, קצב ההידרוליזה של GTP על ידי Ras או Ran הוא איטי ביותר.
חלבוני אפקטור מעלים את קצב ההידרוליזה בכמה סדרי גודל. חלבוני אפקטור אלה ממוקמים:
- מחוץ לנוקלאר פור.
- או בתוך הגרעין.
מיקום זה הוא שיוצר את ההפרדה המרחבית.
שני סוגי האפקטורים
אין צורך לזכור את השמות, אך ראשי התיבות הם:
בצד החיצוני:
- GAP (GTPase Activating Proteins) — חלבונים אלה “דוחפים” את Ran לבצע הידרוליזה ולשחרר פוספט.
בתוך הגרעין:
- חלבון זה (GEF) מוציא את ה-GDP מכיס הקישור ומכניס במקומו GTP.
כלומר, מושקעת אנרגיה במחזור של Ran כדי ליצור הפרדה מרחבית. הפרדה זו מאפשרת להקנות כיווניות לכל מסלולי הטרנספורט שהוזכרו.
מתג זה הוא מעין “מתג-על” המשפיע על עשרות מסלולים של אימפורט ואקספורט (אימפורטינים ואקספורטינים), אם כי לא על כולם.
ההפרדה המרחבית בין שתי הצורות היא המאפשרת לשלוט בכיווניות.
דוגמה קונקרטית - מחזור האימפורט
נבחן דוגמה של אימפורט כדי להבין איך המנגנון פועל. לא נתעמק באקספורט, שפועל בעיקרון דומה.
השקף מראה כיצד הרצפטורים שראינו קודם פועלים ביחס ל-Ran.
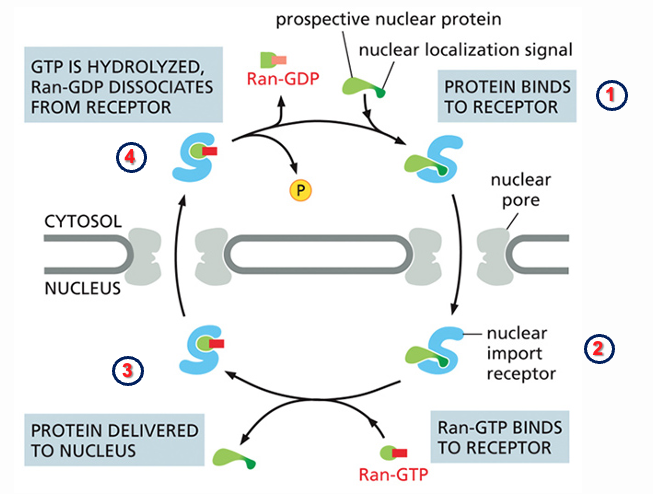
שלבי המחזור
ההסבר מופיע בספר, הוספו מספרים כדי להקל על המעקב.
$\textcolor{green}{Cargo}$ = single protein / protein complex / protein-RNA complex
-
שלב 1: חיבור בציטופלזמה
- החלבון הירוק (קארגו) נושא סיגנל הכוונה לגרעין ונקשר על ידי האימפורט רצפטור (צורת בצבע כחול “S”).
- Ran לא מעורב בשלב זה, מכיוון שבציטופלזמה הוא במצב OFF.
תחילת המסלול מתרחשת ללא מעורבות של Ran.
-
שלב 2: מעבר דרך הנוקלאר פור
- הרצפטור מתווך את המעבר דרך המחסום הסלקטיבי.
- השאטל (הרצפטור - הכחול) נכנס יחד עם המטען שלו.
-
שלב 3: שחרור הקארגו בגרעין (בעקבות קישור הרצפטור ל-Ran)
- בצד הפנימי של הגרעין, הסיכוי לפגוש את Ran במצב ON עולה משמעותית.
- Ran טעון ב-GTP (שלושה פוספטים).
- לרצפטור יש אתר קישור אחד לקארגו ואזור אחר לבקרה אלוסטרית.
- Ran נקשר לאתר השני ברצפטור, גורם לשינוי קונפורמציה ברצפטור ולשחרור הקארגו בגרעין
לכאורה, ניתן היה לעצור כאן, לאחר שהמטרה הושגה.
השלמת המחזור - שלבים 5-4
מדוע נדרשת השלמת המחזור?
הקארגו הובא למדור המטרה, המחסום הסלקטיבי נחצה, והקארגו שוחרר. המטרה הושגה, אך רק פעם אחת.
כדי לצבור חלבון בניגוד למפל הריכוזים במדור היעד (בתוך הגרעין), יש צורך במחזורים רבים. לכן, שלבים 4 ו-5 הם הכרחיים.
-
שלב 4: יציאת הקומפלקס
- כעת, כש-Ran קשור לאימפורט רצפטור, הקומפלקס יוצא החוצה דרך ה-NPC.
- ביציאה מהנוקלאר פור, הוא פוגש את חלבון ה-GAP, הממוקם על הסיבים בצד החיצוני של ה-NPC.
-
שלב 5: הידרוליזה וסיום המחזור
- בשלב זה מתרחשת הידרוליזה של ה-GTP.
- כאשר ה-GTP בכיס של Ran עובר הידרוליזה, פוספט משתחרר, ו-Ran מתנתק.
- האימפורט רצפטור (החלבון הכחול) פנוי כעת להובלה נוספת.
כלומר, השקעת האנרגיה אינה במעבר עצמו, אלא במחזוריות המאפשרת הובלות חוזרות ונשנות.
עקרונות כלליים של המערכת
השקעת האנרגיה
זה עיקרון שחוזר הרבה בביולוגיה. כמו שכבר ראינו:
- חלבוני Ran הם מתגים מולקולריים.
- יש להם שני מצבים: ON (קשור ל-GTP) ו-OFF (קשור ל-GDP).
- השם Ras-related nuclear protein (Ran) מרמז על הקשר למשפחת חלבוני Ras.
במצב ON, Ran יוצר אינטראקציה עם חלבונים אחרים ומשפיע על תפקודם. במצב OFF, הוא אינו פעיל. הצורות השונות (GTP ו-GDP) מופרדות במרחב התא.
תפקיד Ran במערכת - מתג ביולוגי
Ran אינו גורם לתהליך לקרות או לא לקרות, אלא מקנה לו כיווניות.
הקישור הראשוני של הקארגו לרצפטור מתרחש ללא Ran. הרצפטור מזהה אתרי קישור בתוך ה-NPC ומפלס את דרכו פנימה.
התהליך עצמו אינו כיווני במהותו. מטענים בודדים יכולים לנוע פנימה והחוצה. מה שמקנה כיווניות הוא העובדה שבתוך הגרעין, יש סיכוי גבוה שהרצפטור יפגוש מולקולת Ran-GTP, מה שגורם לשחרור הקארגו.
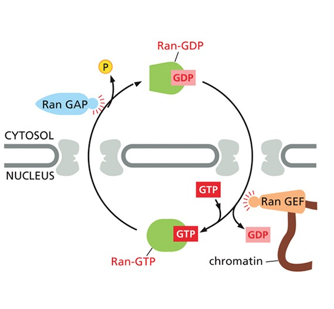
המחזור הנדרש - הידרוליזה של GTP ושחרור Ran
שחרור הקארגו אינו מספיק. כדי שהאימפורט רצפטור יהיה פנוי להובלה נוספת, נדרשת הידרוליזה של GTP ושחרור של Ran.
זהו אחד מהמנגנונים המורכבים שדורשים עיון מעמיק. חשוב להכיר מסלול מורכב כזה כדוגמה ראשונה.
הערות על המורכבות
קיימים מסלולי כניסה ויציאה רבים מהגרעין. חלק גדול מהם נשלט על ידי המתג הביולוגי Ran, הפועל בשני מצבים המופרדים מרחבית.
ההידרוליזה, המקום בו מושקעת אנרגיה, משמשת למחזור הרצפטור. זה מחזיר אותנו להגדרתם כשאטל אימפורט רצפטורים — הם נעים כל הזמן פנימה והחוצה. כאשר המערכת מכוונת כך שהקארגו יועמס במדור אחד וישוחרר במדור אחר, התוצאה נטו היא אימפורט כיווני והיכולת לצבור חלבונים בניגוד למפל הריכוזים במדור היעד.
המורכבות גדלה כאשר חלק מהחלבונים צריכים גם לצאת מהגרעין בשלב מאוחר יותר.
הרצאה 12: מעבר ל-ER - הכוונה לרשתית האנדופלזמטית
מבוא - חזרה למפה הכללית
הדיון התעכב לא מעט על נושא זה. בבחינה, לא יידרשו פרטים קטנים, והנתונים הדרושים יינתנו בשאלה.
כעת, המעבר הוא למצגת 12 — חזרה לרשתית האנדופלזמטית (ER).
המפה הכללית, שהופיעה גם בתחילת המצגת הקודמת, מסמנת את המסלולים השונים בתא אוקריוטי מורכב. נחזור אליה שוב ושוב.
איפה אנחנו בתמונה הכללית?
המטרה היא להבין כיצד תאים אוקריוטיים מכוונים חלבונים לאחר התרגום למדורים שונים ובכך משיגים מידור של פעילויותיהם.
מידור הוא מילת מפתח בתאים אוקריוטיים.
הדיון מתמקד כעת בחץ הכחול, מהציטוזול. מדובר בחלבונים שמתורגמים על ריבוזומים חופשיים בציטוזול, המכוונים אל הרשתית האנדופלזמטית (ER). זה כולל מגוון חלבונים:
- חלבונים כמו אינסולין, המופרש החוצה
- חלבונים שיישארו ב-ER
- חלבונים שימשיכו לגולג׳י
כפי שניתן לראות במפה, קיימים יעדים שונים. אנו בדרך לקבל תמונה כללית של תהליכים אלה.
השוואה בין תאים שונים
השקף מציג שתי דוגמאות: תא אנימלי ותא צמחי.
צביעה ומיקרוסקופיה - הבנת המבנה התאי
בשתי הדוגמאות יש צביעה של ה-ER. כיצד היא נעשתה ומדוע היא ירוקה?
מיקרוסקופיה מסורתית מתבססת על קיבוע (פיקסציה) של דוגמאות חיות. בתהליך כימי זה, המערכת מקובעת במקומה, מה שמאפשר צפייה בתמונות מיקרוסקופ אלקטרונים או אור, ובמקרה זה, מיקרוסקופ פלואורסנטי.
מהפכת ה-GFP - מיקרוסקופיה חיה
אחד החידושים הגדולים של סוף המאה ה-20 (שזכה בפרס נובל) הוא האפשרות למיקרוסקופיה חיה (live imaging). דוגמה מרכזית לכך היא השימוש ב-GFP (Green Fluorescent Protein).
חלבון זה, שבמקור בודד ממדוזה, זוהר באור פלואורסנטי ירוק כאשר מקרינים עליו אור באורך גל מסוים. קיימות וריאציות נוספות, כמו חלבונים הזוהרים באדום.
טכנולוגיה זו מאפשרת להסתכל במיקרוסקופ מותאם ולראות רק את מיקום המולקולה. יתרה מכך, היא מאפשרת מיקרוסקופיה חיה — צפייה בתהליכים דינמיים בזמן אמת. השימוש ב-GFP כסמן מאפשר מעקב בתאים חיים (live tracking) וחושף את הדינמיות של המערכות התאיות.
שוני במבנה ER בין סוגי תאים
התמונות המוצגות הן תמונות רגע (snapshot). ניתן לראות כמה המבנה שונה בין התאים:
- בתא אחד: צינורות ארוכים עם צורת חיבורים משולשת אופיינית.
- בתא השני: מבנים צינוריים, אך גם משטחים רבים יותר.
הבדל זה קשור לשאלה שהועלתה בעבר: מבנה המשטחים מאפשר שטח פנים גדול יותר של ה-ER במקומות שבהם הוא נדרש. הצורות השונות מרמזות על תפקידים שונים.
עיקרון המבנה-תפקיד בתאים אוקריוטיים
זה מחזיר אותנו לעיקרון חשוב שיחזור בקורסים רבים:
תאים אוקריוטיים משתמשים באותו סט בסיסי של:
- אברונים תוך-תאיים.
- ציטוסקלטון.
- מנועים מולקולריים.
- GTPase קטנים.
אותו סט כלים משמש למטרות שונות.
על ידי וריאציות בשטח הפנים ובשימוש בכלים השונים, ניתן לקבל תאים בעלי פונקציות שונות. העיקרון של מבנה-תפקיד הוא עיקרון יסוד.
שני סוגי ER ותפקידיהם
התמונה מהספר מראה את שני סוגי ה-ER, המוכרים עוד מלימודי התיכון.

ER גס (Rough ER)
ה-ER הגס (מחוספס, מגורגר) מכוסה בהמון ריבוזומים. הדוגמה היא מתא אקסוקריני בלבלב, המפריש אנזימים בכמות אדירה. לכן, רוב שטח הציטופלזמה שלו נתפס על ידי ER גס.
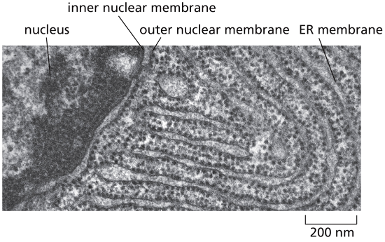
ER חלק (Smooth ER)
לעומת זאת, ה-ER החלק נטול ריבוזומים. הדוגמה היא מתא באשכים, העוסק באינטנסיביות בסינתזה של ההורמון הסטרואידי טסטוסטרון.
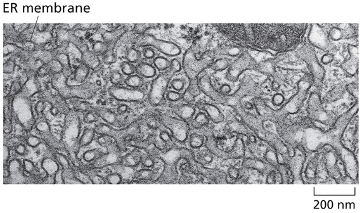
הסינתזה של כל ההורמונים הסטרואידיים מתחילה מכולסטרול. המשטחים החלקים של ה-ER מסמנים סינתזה חזקה של ליפידים:
- כלל סינתזת הליפידים.
- פוספוליפידים.
- כולסטרול.
- הורמונים סטרואידיים.
כל אלה מרוכזים ב-ER החלק.
חלוקת המרחב בתא הכבד
מימין נראה שחזור תלת-ממדי של החלוקה בין ER חלק למחוספס בתא כבד. הדבר מציין שתא הכבד עוסק בשני התפקידים וזקוק לשני הסוגים. התמונה מראה כיצד הם מחולקים במרחב.
ניתן לראות את גבול הגרעין ואת הממברנה החיצונית שלו, שגם עליה יש ריבוזומים. כל המבנה הזה מציין את חלוקת העבודה בין המדורים.
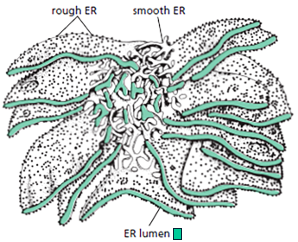
הניסויים של בלובל - הבסיס להיפותזת הסיגנל
כעת, נבחן את הניסויים שהובילו לתגליות הגדולות. חוקרים לא עבדו בוואקום; תיאוריות השתנו בעקבות ניסויים, והמסקנות לא הושגו במהירות. הספר מנסה לתת תמונה סכמטית של התהליך.
הפולס-צ’ייס אקספרימנט
בשיעור הקודם דובר על ניסוי הפולס-צ’ייס (Pulse-Chase Experiment). הסרטון שהוצג מסביר היטב את הניסוי, אך אין צורך לשנן אותו לבחינה.
הומוגניזציה ופרקציונציה
מה מראה התמונה? התמונה מהספר מראה ציטופלזמה של תא עם תערובת של ER חלק ומחוספס.
הניסוי של גינתר בלובל (שזכה בפרס נובל על עבודתו) הוביל להיפותזת הסיגנל, הגורסת שחלבונים נושאים רצפים קצרים של חומצות אמינו (סיגנלים) המכוונים אותם ליעדיהם.
תהליך ההומוגניזציה (Homogenization)
כיצד עוברים מהתא השלם לתערובת? באמצעות “הומוגניזציה”. בדומה לשימוש בבלנדר במטבח, במעבדה משתמשים בהומוגנייזר.
מכשיר זה, הדומה לכלי מהמאה ה-17, קורע את התאים ויוצר תערובת הומוגנית. התהליך גורם לממברנות להיסגר על עצמן וליצור וסיקולות, הנקראות מיקרוזומים.
פרקציונציה וצנטריפוגציה
העיקרון השני הוא פרקציונציה — הפרדת מרכיבי התערובת. המטרה היא להפריד בין המיקרוזומים החלקים לאלה המעוטרים בריבוזומים.
ההפרדה מתבצעת באמצעות צנטריפוגציה. כאשר מריצים את התערובת בצנטריפוגה, למשל על גרדיאנט של סוכרוז (תמיסה צפופה יותר בתחתית ומהולה יותר למעלה), הוסיקולות הצפופות יותר (אלה עם הריבוזומים) שוקעות למטה.
זוהי דוגמה לאופן שבו, באמצעות ניסוי וטעייה, הגיעו להפרדה של מרכיבים תאיים לפרקציות שונות.
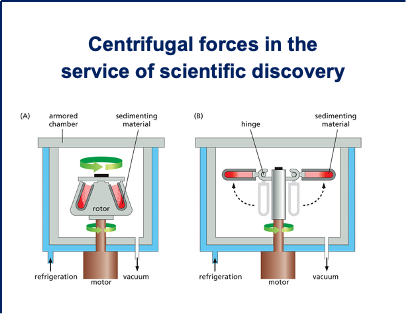
הניסוי המכונן של בלובל
מה עושים עם הפרקציות המופרדות? בתמונה מהרצאת הנובל של גינתר בלובל, נראית תוצאה ממיקרוסקופ אלקטרוני הדומה לתמונה מהספר. הניסויים בוצעו, ככל הנראה, על לבלב של כלב.

העיקרון המהפכני
הגדולה של בלובל ואנשיו הייתה הניסיון הראשון לשחזר במבחנה (in vitro) תהליכים המתרחשים בתא. הגישה הייתה דומה לפירוק שעון לחלקיו והרכבתו מחדש: לקחת רכיבים שונים, לערבב אותם ולראות מה קורה.
תיאור הניסוי הספציפי
התמונה בספר, המתארת את “הבסיס הניסויי להיפותזת הסיגנל”, מציגה ניסוי אחד מתוך סדרה.
ישנם שני מצבים:
- למעלה: ביקורת.
- למטה: ניסוי.
ההבדל הוא שבניסוי הוסיפו מיקרוזומים של ER.
בביקורת יש רק ציטוזול, המכיל ריבוזומים חופשיים. בשני המקרים, הוסיפו mRNA המקודד לחלבון מופרש, שסונתז במבחנה.
תוצאות הניסוי ומסקנותיו
המפתח להבנת הניסוי והיפותזת הסיגנל הוא הרצף הראשוני של החלבון (“התולעת”) המציץ מהריבוזום בתחילת התרגום.

- בתחילת התרגום, הרצף הראשוני (N-טרמינוס) של החלבון מבצבץ מהריבוזום.
- בשלב זה, קורה משהו שמוביל לתוצאה שונה בין הביקורת לניסוי.
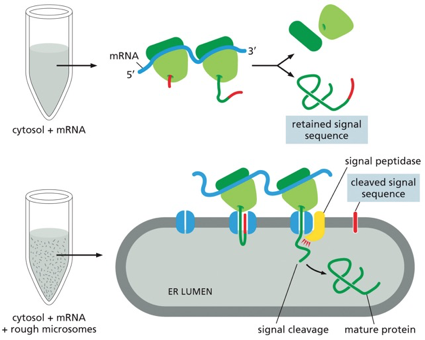
הסיגנל הזה הוא הרצף שבלובל הסיק שנחתך.
- בניסוי (עם מיקרוזומים): החלבון השלם נכנס לתוך הלומן של המיקרוזומים, והסיגנל נחתך ממנו. החלבון אינו נמצא בציטוזול.
- בביקורת (ללא מיקרוזומים): החלבון המלא, כולל הסיגנל, משוחרר לציטוזול.
ההבדל נגרם מצירוף של גורם בציטוזול וגורם על ממברנת המיקרוזום.
החלבון הבשל (לאחר החיתוך) נמצא בתוך המיקרוזום. רוב מוחלט של החלבון נכנס פנימה, והסיגנל שלו נחתך.
המסקנות מהניסוי
ההיפותזה של בלובל מ-1975 התבררה כנכונה. הוא ראה שהחלבון שנוצר בניסוי קצר יותר, והסיק שקיים מנגנון חיתוך.

המסקנה היא שגורם כלשהו מכוון את הריבוזומים. בשתי המבחנות יש ריבוזומים, אך רק בנוכחות מיקרוזומים, הריבוזומים מכוונים לממברנה, והחלבון המסונתז נדחף פנימה.
זה היה קונספט פורץ דרך. הניסוי מדגים כיצד הגיעו להיפותזת הסיגנל.
SRP - Signal Recognition Particle
המכונה הביולוגית שמכוונת ריבוזומים
מי מכוון את הריבוזום בתחילת התרגום? גורם כלשהו צריך לזהות ש”כאן מסונתז חלבון שאמור לצאת מהתא” ולכוון אותו ללומן של ה-ER. הניסוי הצליח לשחזר זאת במבחנה.
המכונה הביולוגית שעושה זאת נקראת SRP - Signal Recognition Particle.
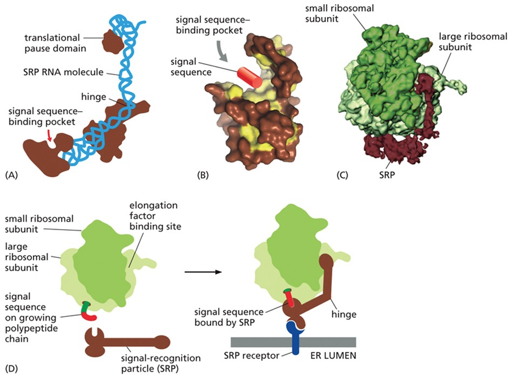
מבנה ה-SRP
מכונה ביולוגית זו, בדומה לדוגמאות אחרות, מורכבת מ-RNA ומחלבון:
- ה-RNA (בכחול) מתקפל על עצמו ויוצר מבנה דמוי מנוף או מלקחיים.
- מבנה זה מחבק את הריבוזום ומוביל אותו ליעדו.
מנגנון הזיהוי הראשוני
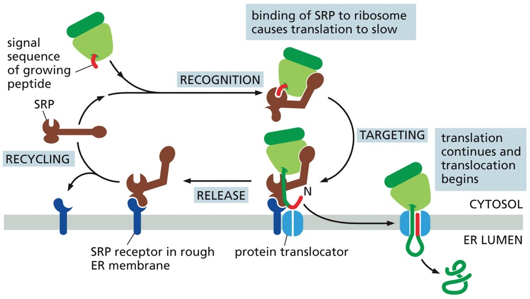
הכל מתחיל בכיס קישור באחת מהיחידות החלבוניות של ה-SRP (החלבונים בחום).
תת-יחידה חלבונית זו מכילה כיס קישור המזהה את רצף הסיגנל (signal sequence).
כפי שנראה, רצף הסיגנל (באדום) מופיע בתחילת הסינתזה של החלבון. זהו רצף של חומצות אמינו הידרופוביות, המזוהה על ידי כיס קישור תלת-ממדי ב-SRP.
ברגע שמתרחש זיהוי זה, מתחילה שרשרת פעולות.
מדובר במכונה ביולוגית המורכבת מחלבון ו-RNA, שתפקידה לזהות חלבונים חדשים בתחילת הסינתזה שלהם.
המשך עיבוד חלבונים ב-ER
עיבוד נוסף של חלבונים - דוגמת האינסולין
לאחר חיתוך פפטיד הסיגנל, מתרחשים אירועי עיבוד נוספים, כפי שראינו בדוגמת האינסולין (יצירת קשרי דיסולפיד ושני חיתוכים נוספים) עד לקבלת אינסולין פעיל ובשל (mature).

קיימת מערכת שלמה, הפועלת כמעין “סרט נע”, הדואגת לביצוע מודיפיקציות על החלבון עוד בזמן שהסינתזה שלו נמשכת. תהליכים אלה מתרחשים במהירות.
היגיון הפרדת המדורים
העובדה שמאות ואלפי חלבונים מכוונים לתוך החלל הפנימי של ה-ER יוצרת סביבה מוגנת ומופרדת משאר התא, שבה ריאקציות אנזימטיות יכולות להתרחש בסדר מסוים.
ההיגיון מאחורי המורכבות של התא האוקריוטי הוא “הפרד ומשול”. החלבונים המיועדים לשלבים הבאים עוברים שלבי מודיפיקציות עוד תוך כדי המעבר ל-ER.
יצירת גשרים דיסולפידיים - דוגמה קונקרטית
דוגמה אחת היא יצירת גשרים דיסולפידיים. החלבון האחראי לכך הוא PDI (Protein Disulfide Isomerase).
מה זה אומר?
זהו אנזים היוצר קשרי S-S בחלבונים אחרים. גם הוא עצמו זקוק למחזור פעילות.
- הוא מתחיל במצב מחומצן, כשאצלו יש גשר דיסולפידי.
- הוא פועל על חלבון המטרה תוך כדי כניסתו ללומן.
תהליך יצירת הגשר
התהליך כולל מצב ביניים של קשר קובלנטי בין האנזים לחלבון המטרה. בסופו של דבר, חלבון המטרה מקבל את הגשר הדיסולפידי (למשל, שלושה גשרים באינסולין).
האנזים עצמו עובר למצב מחוזר וזקוק לחלבוני עזר בלומן של ה-ER כדי לחזור למצבו הפעיל ולהתחיל סיבוב נוסף.
זהו רצף שלם של מודיפיקציות החל על שני הסוגים הכלליים של חלבונים:
שני סוגי החלבונים הנפוצים
1. חלבונים מסיסים:
- חלבונים המשוחררים לחלל המימי (לומן) של ה-ER.
- אינסולין הוא דוגמה טובה.
- אנזימים פרוטאוליטיים המופרשים למערכת העיכול הם דוגמה נוספת.
2. חלבונים ממברנליים:
- נשארים משולבים בממברנה.
- החלקים הבולטים ללומן יעברו מודיפיקציות, כמו גליקוזילציות.
שיווי משקל אנרגטי
מדובר בשיווי משקל חמצון-חיזור שהוא ייחודי לסביבת ה-ER. באופן כללי, תהליכים אלה דורשים אנרגיה.
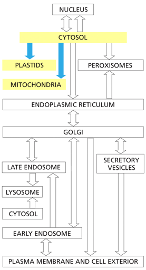
גליקוזילציה - הוספת קבוצות סוכר
ה”קקטוסים” בתמונה מייצגים שרשראות סוכריות — מודיפיקציות סוכריות. סוכרים וליפידים מוספים לחלבונים, לעיתים קרובות לאלה המיועדים למשלוח הלאה. השלב הראשון מתרחש ב-ER, והשלבים הבאים בתחנות אחרות.

הגליקוזילציה הנפוצה ביותר
המודיפיקציה הנפוצה ביותר מתרחשת על כשני שלישים מהחלבונים (מסיסים או ממברנליים) המכוונים ל-ER.
כל השרשרת הסוכרית המסועפת (ה”קקטוס”) מועברת כיחידה אחת. היא כוללת סוכרים כמו גלוקוז, מנוז ו-N-אצטילגלוקוזאמין. זוהי הגליקוזילציה הנפוצה ביותר, המתרחשת על חומצת האמינו אספרגין.
המנגנון הביוכימי
השרשרת הצדדית של חומצת האמינו אספרגין (המכילה קבוצת $NH_2$) היא אתר הקישור. אנזים ספציפי מחבר את כל השרשרת הסוכרית המסועפת לחלבון תוך כדי כניסתו ללומן.
האנזים האחראי הוא Oligosaccharyl transferase.
תהליך מדורג ומורכב
זהו רק השלב הראשון. התהליך מתרחש בזמן שהריבוזום עדיין מסנתז את החלבון. חלבון יכול להיות באורך מאות חומצות אמינו:
- היה לו פפטיד סיגנל.
- הוא כוון לממברנה.
- הוא עבר דרך הטרנסלוקון (למשל, Sec61).
- הוא מתחיל להיכנס ללומן.
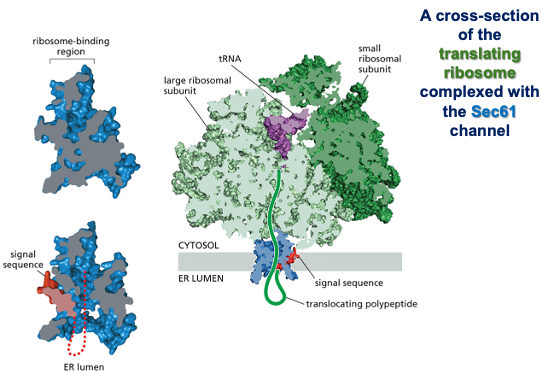
אנזים היושב בממברנה ופונה ללומן מזהה רצפי אספרגין מסוימים (לפי קוד ספציפי).
חומר המוצא
חומר המוצא מצומד לממברנה. זהו סוכר המחובר דרך שני פוספטים לשרשרת ליפידית.
מדוע? חומר המוצא מחובר לממברנה וממתין בסביבת האנזים. כך, לאנזים יש את כל מה שהוא צריך: הפרקורסור (חומר המוצא) צמוד לתעלה. ברגע שמגיע הרצף המתאים, האנזים חותך את השרשרת הסוכרית מהליפיד ומעביר אותה לחלבון. גם כאן, אקטיבציה באמצעות פוספט היא עיקרון חוזר.
שלבים נוספים - גיזום ועיבוד
זהו רק השלב הראשון. לאחר הוספת השרשרת הסוכרית, היא עוברת “גיזום” (trimming).
כמחצית מהחלבונים העוברים דרך התעלה עוברים עיבוד זה. זוהי הצורה הנפוצה של גליקוזילציה, הנקראת N-linked glycosylation.
השפעה על פעילות החלבונים
למודיפיקציות סוכריות יש השפעה גדולה מאוד על פעילותם של חלבונים ממברנליים, במיוחד אלה הפונים אל מחוץ לתא.
יצירת מגוון ביולוגי
האם המודיפיקציה זהה בכל החלבונים? לא. ניתן לקבל מגוון ביולוגי על ידי סוגים שונים של מודיפיקציות נוספות על הסוכר הראשוני.
לדוגמה:
- נוגדנים
- רצפטורים
- חלבונים רבים הפועלים מחוץ לסביבה התאית.
חלק גדול מפעילותם מוכתב על ידי האתרים הסוכריים. זהו פתח למגוון ביולוגי עצום, שכולו מתחיל מהכוונה ל-ER.
למה תהליך כל כך מורכב?
מדוע התהליך כה רב-שלבי ודורש אנרגיה כה רבה? זוהי שאלת “ביצה ותרנגולת”.
יצירת תהליך רב-שלבי העובר בין תחנות בתא האוקריוטי מאפשרת:
- שלבי בקרה.
- מערכת בקרת איכות.
כפי שנשאל בעבר, מה קורה כשהתהליך משתבש? קיימת מערכת בקרת איכות הבודקת שהשלבים הקודמים בוצעו כראוי. אם חלבון אינו מקופל נכון או לא קיבל את המודיפיקציות הנדרשות, הוא לא ימשיך הלאה. בתאים אוקריוטיים קיימות רמות רבות של בקרה.
טרנספורט למיטוכונדריה
הדיון בטרנספורט למיטוכונדריה נועד בעיקר לציין את קיומו, ולא להעמיק בפרטים.
מבנה המיטוכונדריה
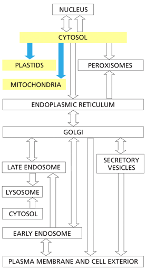
במפה הכללית, יש חץ המוביל למיטוכונדריה. המבנה המורכב של המיטוכונדריה כבר נדון:
- ממברנה חיצונית.
- ממברנה פנימית עם קיפולים (cristae).
תהליכים ביוכימיים רבים מתרחשים במיטוכונדריה, והיא חיונית לא רק לייצור אנרגיה.
חלוקה למדורים
שחזור תלת-ממדי מראה את הקיפולים הרבים של הממברנה הפנימית, היוצרים שטח פנים גדול. מבנה זה יוצר מדורים שונים:
- ממברנה חיצונית.
- ממברנה פנימית.
- חלל בין-ממברנלי (intermembrane space).
- מטריקס (החלל הפנימי ביותר).
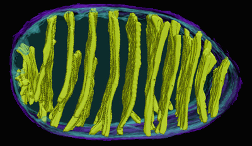
במטריקס הפנימי מתרחשים תהליכים כמו מעגל קרבס. לכן, יש צורך לכוון חלבונים למדורים השונים בתוך המיטוכונדריה.
מורכבות ההכוונה למיטוכונדריה
בדומה לבובות בבושקה, זהו מדור בתוך מדור. חלבון חדש צריך לדעת לא רק שהוא מיועד למיטוכונדריה, אלא לאיזה תת-מדור בדיוק:
- בין הממברנות.
- בתוך אחת הממברנות.
- אל תוך המטריקס.
נדרש מידע הכוונה רב המפוענח על ידי מערכת ייעודית.

דוגמה קונקרטית למנגנון
השמות אינם חשובים, אך הם הגיוניים:
- TOM: Translocon of the Outer Membrane.
- TIM: Translocon of the Inner Membrane.
הדוגמה מראה חלבון המגיע מבחוץ:
- הוא קודד בגרעין ותורגם על ריבוזומים חופשיים בציטופלזמה.
- החלבון המלא מגיע למיטוכונדריה.
- שפרונים פורסים אותו (לא נראה בתמונה).
- במקרה הספציפי הזה, הוא עובר דרך טרנסלוקון בממברנה החיצונית (TOM), חוצה את החלל הבין-ממברנלי, עובר דרך טרנסלוקון נוסף בממברנה הפנימית (TIM), ובעזרת שפרון נוסף (HSP70), משוחרר למטריקס.
זוהי רק דוגמה אחת.
הגנום המיטוכונדריאלי
כפי שדובר, המיטוכונדריה התפתחה מחיידק אירובי ששולב בתא.
למיטוכונדריה יש גנום עצמאי, הדומה לגנום פרוקריוטי:
- הוא קטן ועצמאי.
- הוא עובר בתורשה אימהית (מטרנית).
- הוא מכיל מספר קטן של גנים.
הרוב המכריע של החלבונים שהמיטוכונדריה צריכה מקודד בגרעין ומגיע מבחוץ.
אך בפנים, בתוך המטריקס, יש גם:
- גנום.
- ריבוזומים בעלי אופי פרוקריוטי.
- אלה מתרגמים את מעט החלבונים המקודדים מקומית, בעיקר חלבונים מורכבים הפועלים במיטוכונדריה.
המורכבות המלאה של המערכת
לסיום, וכדי לתת טעימה מהמורכבות, התמונה 12.48 מהספר מראה כמה תהליכים שונים מתרחשים.
חלבון המקודד בגרעין ומגיע מבחוץ יכול:
- להיכנס לממברנה החיצונית.
- לעבור לחלל הבין-ממברנלי.
- להשתלב בממברנה הפנימית (למשל, ATP סינתאז).
- לעבור פנימה למטריקס.
בנוסף, ישנו המיעוט הקטן של חלבונים המקודדים בגנום המיטוכונדריאלי, המסונתזים בפנים ואינם צריכים לעבור במערכת זו.
התמונה מראה קשרים אפשריים בין הטרנסלוקונים בממברנות השונות.
המיטוכונדריה אינה פשוטה כלל, והמנגנונים מכוונים חלבונים לתת-מדורים שונים.
הגדרת טרנסלוקונים
טרנסלוקונים הם מערכות של תעלות מתוחכמות היושבות בממברנה. בדרך כלל, לטרנסלוקון נלווים חלבוני עזר, כמו רצפטורים.
הדוגמה נועדה להמחיש את מורכבות המערכת.
סיכום והמשך
כמעט בכל תא בגופנו יש מיטוכונדריה, והיא מעורבת בתהליכים ביולוגיים רבים.
רוב החלבונים שלה מקודדים בגרעין:
- סינתזה על ריבוזום בציטוזול.
- שחרור והובלה למיטוכונדריה.
- שפרונים מסייעים בתהליך.
התמונה הכללית מראה עד כמה האבולוציה התקדמה, וקשה לדמיין כיצד מערכת זו התפתחה בשלבים. היא החלה כנראה מאקטו-סימביונט שהפך לאנדו-סימביונט — יצור החי בתוך יצור אחר, כאשר שני הצדדים מרוויחים.
סיום וכיווני המשך
עם זה נסיים. המשך הדרך, בהרצאות הבאות, יעסוק במסלול מ-ER לגולג׳י וליעדים נוספים, כפי שנראה במפה.
שיעור 15 - מסלול ההפרשה והובלת וזיקולות בתאים
תאריך: 21/05/2025מבוא למסלול ההפרשה (The Secretion Pathway)
ברוכים הבאים לסדרת שלושה שיעורים על הובלת וזיקולות בתוך התאים. הנושא נקרא The Secretion Pathway, או בעברית “מסלול ההפרשה” - למרות שכפי שציין המרצה, התרגום לעברית לא מעורר קונוטציות טובות ואולי צריך מיתוג מחדש.
חשוב להבין ש”מסלול ההפרשה” לא עוסק רק בהפרשה (secretion), אלא גם בהכנסת חומרים מבחוץ באמצעות אנדוציטוזה. זהו תהליך דו-כיווני החיוני לתפקוד התא.
מנגנון כללי של הובלת וזיקולות
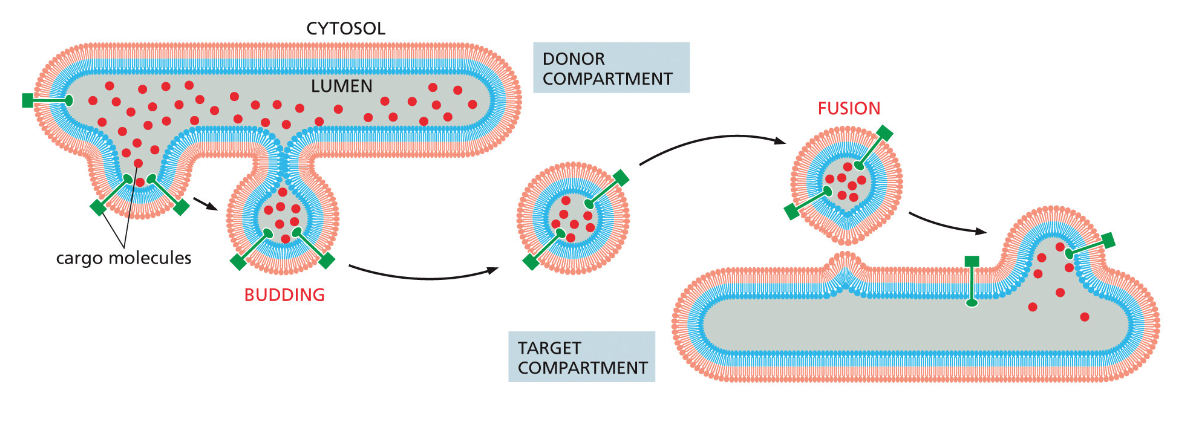
התהליך הבסיסי של הובלת וזיקולות בתא מתחלק לארבעה שלבים עיקריים:
- Budding (הנצה) - יצירת הוזיקולה מממברנה קיימת
- Tethering (קישור) - זיהוי ראשוני של המטרה
- Docking (עגינה) - התקרבות וחיבור מדויק
- Fusion (איחוי) - התמזגות הממברנות
בשלב ההנצה (Budding) נוצרת הוזיקולה מממברנה קיימת, ובמהלך התהליך הזה הוזיקולות מכוסות בחלבוני מעטפת המספקים מבנה מכני ומאפשרים זיהוי ראשוני של סוג הוזיקולה.
עם זאת, חלבוני המעטפת לבדם אינם מספיקים. המרצה הדגיש שאנחנו צריכים סימונים יותר מדויקים כדי שכל וזיקולה תגיע בדיוק לאן שהיא צריכה להגיע.
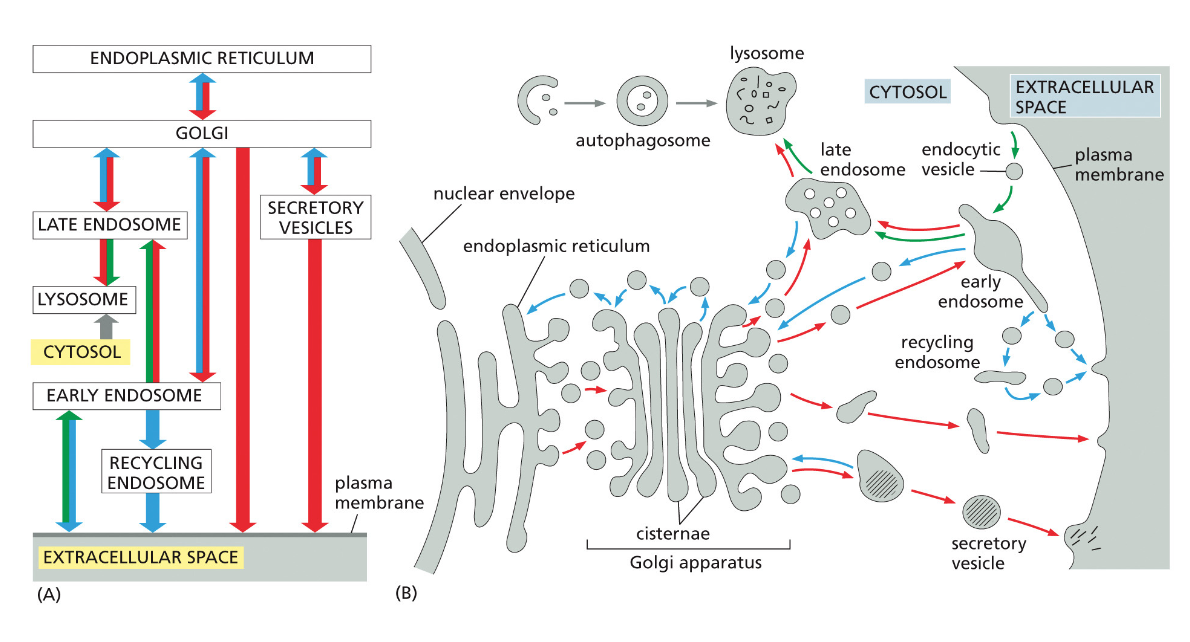
חלבוני Rab - מערכת הכתובות התאית
מי שמאפשר את הסימון המדויק של יעדי הוזיקולות הם משפחה של חלבונים שנקראים חלבוני Rab. יש Rab מ-1 עד 9 וגם 11 שמשתמשים בהם, וכנראה יש עוד חלבוני Rab שעדיין לא זיהינו.
כל חלבון Rab מסמן וזיקולה לכיוון מסוים - למשל, Rab1 יסמן וזיקולות השולחות מה-ER לגולג׳י, Rab2 יסמן וזיקולות שנמצאות באזור הציס-גולג׳י, ו-Rab3 יסמן וזיקולות בסינפסות שמשחררות נוירוטרנסמיטורים.
המנגנון עובד כך: חלבוני Rab יודעים לזהות חלבוני קישור (Rab effectors) שייחודיים עבורם. אם מדובר בחלבון Rab2 שנמצא בציס-גולג׳י, החלבון שאמור לקשור אותו נמצא רק בציס-גולג׳י. כך אנחנו מבטיחים שהוזיקולה תגיע רק למקום אחד שהיא צריכה להגיע.
כשסטודנט שאל למה זה לא מספיק, המרצה הסביר שיש בעיה נוספת: ממברנות קרובות זו לזו אף פעם לא יעברו איחוי ספונטני בגלל שיש ביניהן מולקולות מים. צריך כוח מכני מספיק חזק בשביל לגרום לממברנות להתאחות.
| חלבון Rab | תפקיד |
|---|---|
| Rab1 | וזיקולות מ-ER לגולג׳י |
| Rab2 | וזיקולות באזור ציס-גולג׳י |
| Rab3 | וזיקולות בסינפסות (שחרור נוירוטרנסמיטורים) |
חלבוני SNARE - המנוע המכני
כאן נכנסים לתמונה חלבוני SNARE. יש לנו V-SNARE (Vesicle SNARE - על הוזיקולה) ו-T-SNARE (Target SNARE - על אברון המטרה). ברגע שחלבוני Rab מקרבים את הוזיקולה למטרה ויש את הקישור (Tethering), חלבוני SNARE נכנסים לפעולה בשלב ה-דוקינג.
התהליך יפה: חלבוני SNARE מתחברים זה לזה ועוברים תהליך כמו של שזירה - כמו כשלוקחים הרבה סיבים ומפתלים אותם יחד, האורך שלהם מתקצר. הכוח המכני הזה מקרב את הממברנות זו לזו, דוחק החוצה את מולקולות המים, עד שיש את השלב האחרון - Fusion, האיחוי. אחרי האיחוי, באמצעות ATP, החלבונים משתחררים ומוכנים למחזור הבא.
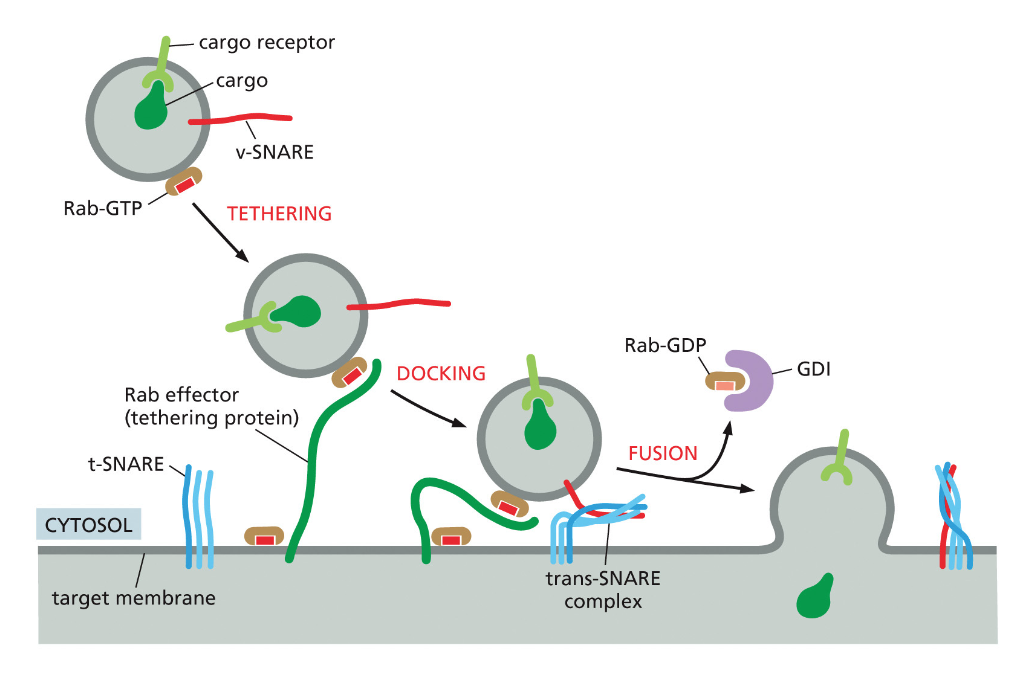
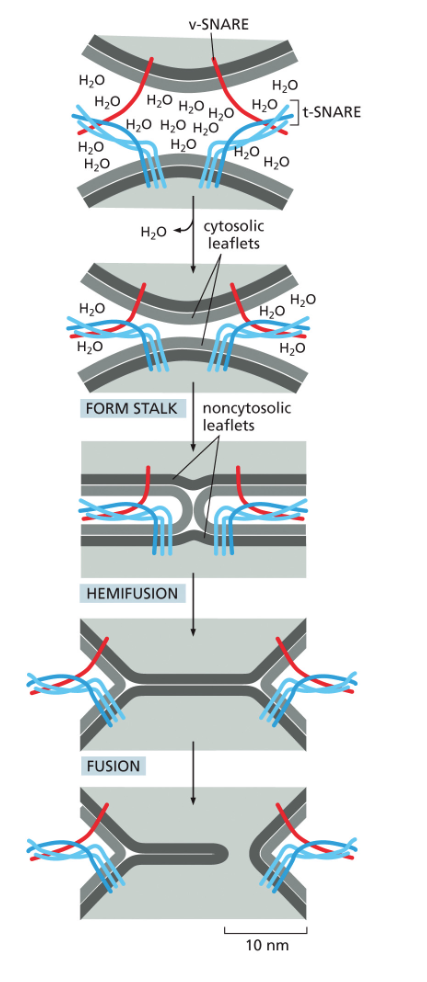
כשסטודנט שאל מה ההבדל המהותי בין SNARE ל-Rab, המרצה הסביר: חלבוני Rab הם ספציפיים לכל וזיקולה ואברון מטרה אבל לא יכולים להפעיל כוח מכני. חלבוני SNARE הם כלליים (אותם SNARE על כל הוזיקולות) אבל יכולים להפעיל כוח מכני. צריך את שניהם - Rab לספציפיות, SNARE לביצוע.
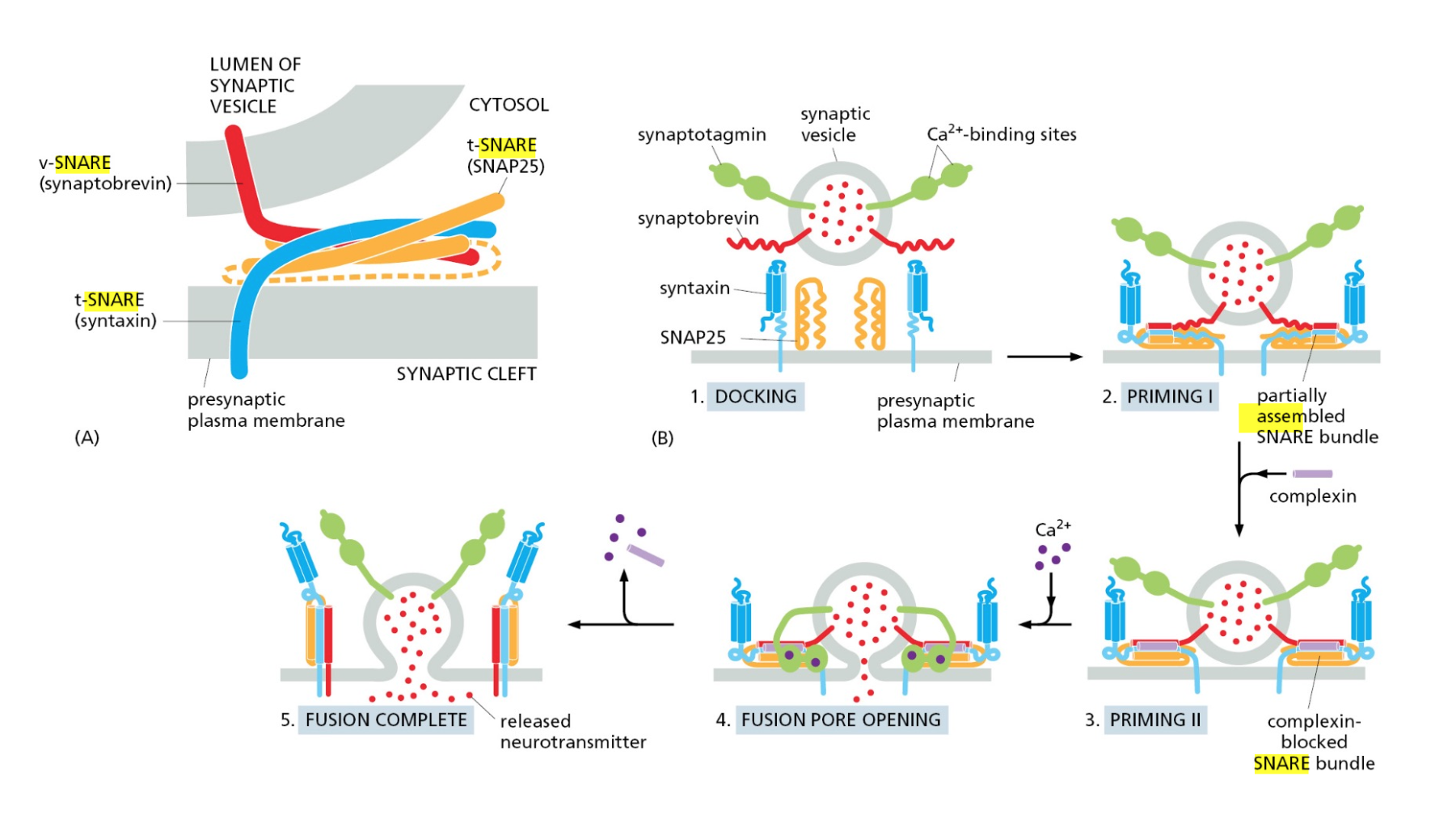
הבדלים תפקודיים: Rab מול SNARE
| היבט | חלבוני Rab | חלבוני SNARE |
|---|---|---|
| ספציפיות | ספציפיים לכל וזיקולה ויעד | כלליים לכל הוזיקולות |
| כוח מכני | אינם יכולים להפעיל | מפעילים כוח מכני |
| תפקיד | זיהוי ובחירת יעד | ביצוע האיחוי |
המסלול מה-ER לגולג׳י
עכשיו נתחיל לדבר בצורה יותר ספציפית על המסלול מה-ER לגולג׳י. התהליך מתחיל באזורים ב-ER שנקראים Exit Sites (אתרי יציאה). למרות השם ביחיד, יש הרבה כאלה ב-ER והם נוצרים באופן רנדומלי.
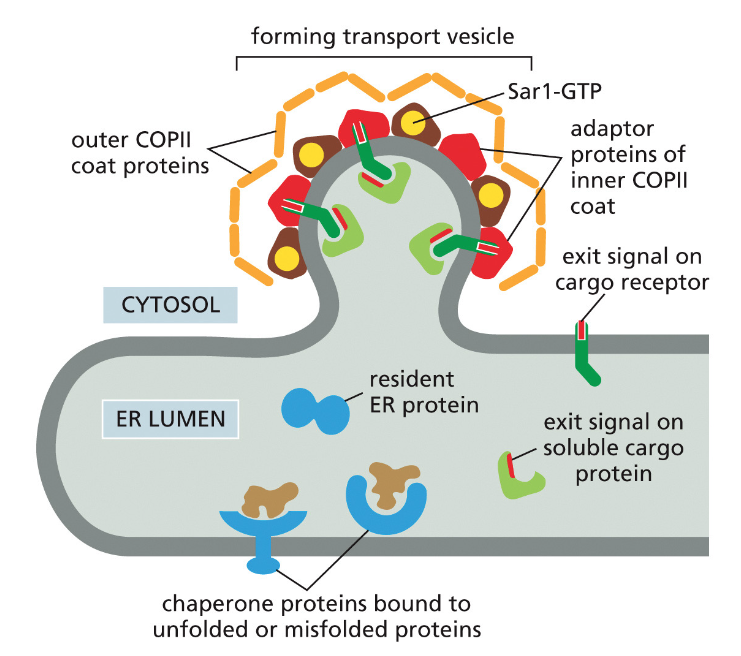
ברגע שחלבונים טרנס-ממברנליים מסונתזים, הם מיד “נתקעים” בממברנה. הם לא יכולים להסתובב חופשי בציטוזול או בלומן של ה-ER כי יש להם אזורים הידרופוביים שיגרמו להם להתקפל על עצמם. לחלבונים האלה יש סיגנל שנקרא Exit Signal - רצף ספציפי של חומצות אמינו שמזוהה על ידי חלבוני COPII.
מה קורה עם חלבונים שהם לא ממברנליים אבל צריכים להיכנס למסלול ההפרשה? הם “תופסים טרמפ” עם החלבונים הממברנליים. גם להם יש Exit Signal משלהם, והם נקשרים לחלבונים הטרנס-ממברנליים שנקשרים ל-COPII.
בקרת איכות - תפקיד השפרונים
המסלול הזה לא מושלם, ולפעמים נדחפים לתוך הוזיקולה גם חלבונים שצריכים להישאר ב-ER. אבל יותר חשוב - מאוד חשוב שלא יגיעו חלבונים שלא יוכלו לבצע את תפקידם כמו שצריך - וזה קורה כשחלבונים לא מתקפלים כראוי.
שפרונים הם חלבונים שעוזרים לחלבונים להתקפל כראוי. כשחלבון לא מתקפל כמו שצריך, השפרונים נקשרים אליו ומונעים ממנו להיכנס לוזיקולות.
הדוגמה של CFTR וציסטיק פיברוזיס
המרצה הביא דוגמה קלאסית - חלבון CFTR שמוטציה בו גורמת לציסטיק פיברוזיס. זוהי תעלת יוני כלוריד שצריכה להעביר יונים כדי למשוך מים אל מחוץ לתאים. אם היא לא עובדת, מים לא יוצאים מהתאים והריר בריאות נהיה מאוד צמיגי.
מה שמעניין ופרדוקסלי: המוטציה לא מונעת מהחלבון לעבוד! אם ניקח את חלבון ה-CFTR ונצליח להביא אותו לממברנה, הוא יתפקד כתעלת כלוריד. אבל בגלל שהכיפול לא תקין, השפרונים לא משחררים אותו מה-ER. כפי שאמר המרצה: “הגוף מכשיל את עצמו”. אפילו אם החלבון יתפקד רק ב-30%, זה עדיף מאשר שלא יהיה בכלל.
תהליך ההובלה וההתקדמות
לאחר שהוזיקולות עוברות הנצה, חלבוני מנוע רצים על גבי המיקרוטובולים ולוקחים את הוזיקולות לכיוון חוץ התא. בשלב הזה הוזיקולות מורידות את חלבוני COPII, והן הופכות למה שנקרא VTC - Vesicular Tubular Clusters. השם מתאר את המראה שלהן במיקרוסקופ - הן נראות כמו צינורות (Tubular) שמורכבים מוזיקולות (Vesicular) שהתחברו יחד לצבר (Clusters).
המרצה ניגן סרטון פלואורסנטי שרואים בו את התהליך - איך החלבונים הממברנליים מתרכזים באתרי היציאה, איך הם נעים על המיקרוטובולים “כמו על כבישים”, ואיך ברגע שהוזיקולה מתאחה עם הממברנה, החלבונים מתפזרים בה.
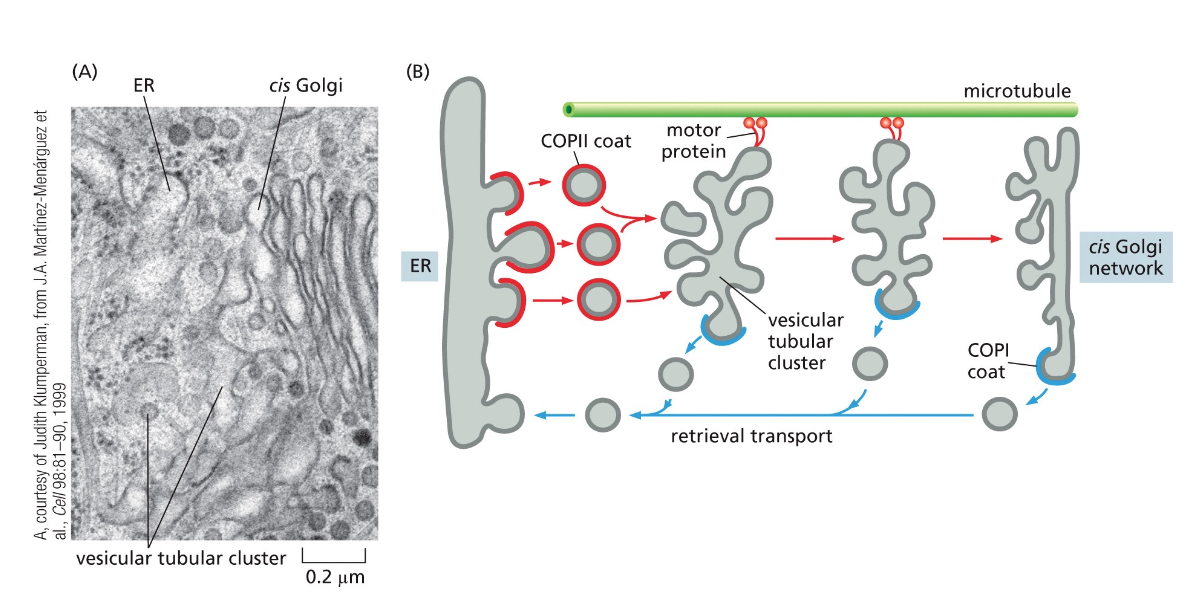
מסלול החזרה - מערכת KDEL
לאורך כל התהליך הזה יש מסלול של החזרה, שמסומן על ידי חלבוני COPI (לא COPII!). במסלול החזרה אנחנו מחזירים את הרצפטורים שתפסו את המטען, מחזירים ממברנות (אחרת ה-ER יתכווץ), ומחזירים חלבונים שבטעות יצאו מה-ER.
החוכמה של המערכת נמצאת ברצף KDEL - ארבע חומצות אמינו (K-D-E-L) שמסמנות חלבונים השייכים ל-ER. רצף KDEL נקשר לרצפטור ספציפי, והרצפטור נקשר ל-COPI.
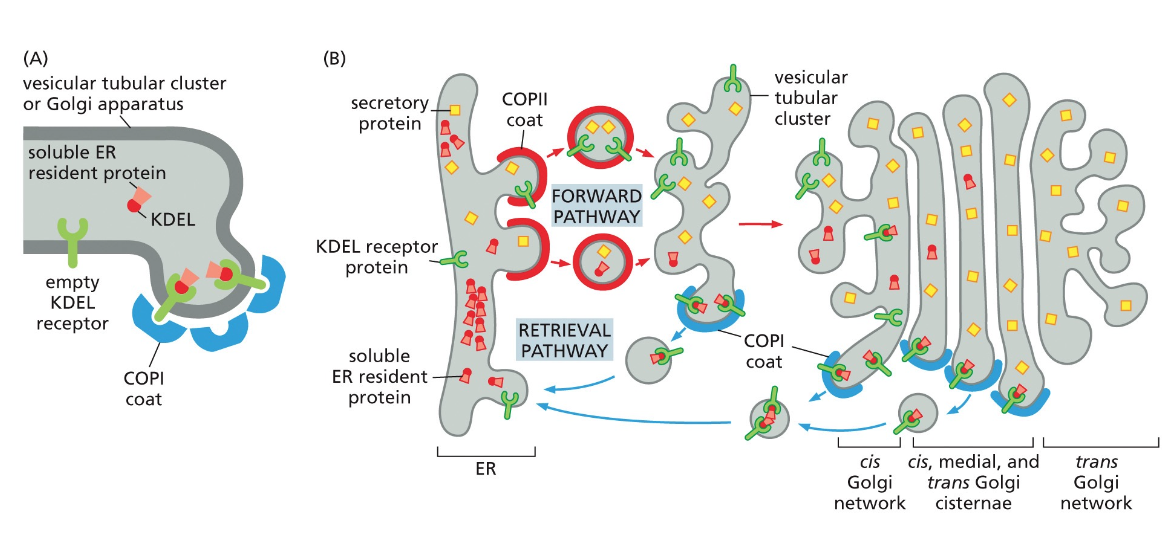
המנגנון החכם של pH
כשסטודנט שאל למה הקישור נעשה בגולג׳י ולא ב-ER, המרצה הסביר: ה-pH ב-ER הוא קרוב ל-7 (ניטרלי), אבל ככל שמתקדמים בגולג׳י לכיוון וזיקולות שיוצאות מהתא, ה-pH יורד (נהיה חומצי). ב-pH חומצי, רצף KDEL נקשר לרצפטור. ב-pH ניטרלי, החלבון משוחרר.
זה תהליך מתמשך של “ניקוי” - כל פעם מושכים אחורה חלבונים שבטעות ברחו, עד שמגיעים לטרנס-גולג׳י שם אמור להיות מצב נקי. המרצה ציין שאם עושים מוטציה ב-KDEL, החלבון יצא מהתא במקום להישאר ב-ER - כך הוכיחו את החשיבות של הרצף.
מבנה הגולג׳י - מגדל הפיטות
הגולג׳י נראה כמו מגדל של פיטות - אם ניקח וזיקולה גדולה מאוד בצורת כדור ונלחץ אותה, נקבל משהו כמו פיטה עם חלל פנימי וממברנה מסביב. כשמערימים הרבה כאלה זו על זו, מקבלים את המבנה האופייני של הגולג׳י. המבנים האלה נקראים ציסטרנות.
המיקרוטובולים מחזיקים את הציסטרנות במקום, כדי שכל ה”פיטות” האלה לא יתפזרו בחלל התא. יש לנו ציס-גולג׳י (הצד הפנימי הקרוב ל-ER) וטרנס-גולג׳י (הצד החיצוני הפונה לממברנת התא).
התעלומה: איך עוברים בין ציסטרנות?
המרצה הודה: “אולי זה יפתיע אתכם? אין לנו מושג”. יש שתי תיאוריות מתחרות:
תיאוריה ראשונה: בין ציסטרנה לציסטרנה יוצאות וזיקולות ומתחברות לציסטרנה הבאה.
תיאוריה שנייה: כל VTC שמגיע מה-ER הופך להיות הציס-גולג׳י החדש (כמו כשבאים לרופא ושואלים “מי האחרון?” ואומרים לך “אתה”). מי שהיה ציס מתחיל לנוע, וככל שמתחברות עוד וזיקולות, הציסטרנות מתקדמות. הציסטרנה נשארת אותו דבר, החלבונים לא עוזבים אותה - היא עצמה מתקדמת עד שהופכת לטרנס-גולג׳י ומתפרקת.
גליקוזילציה - אחד התפקידים המרכזיים של הגולג׳י
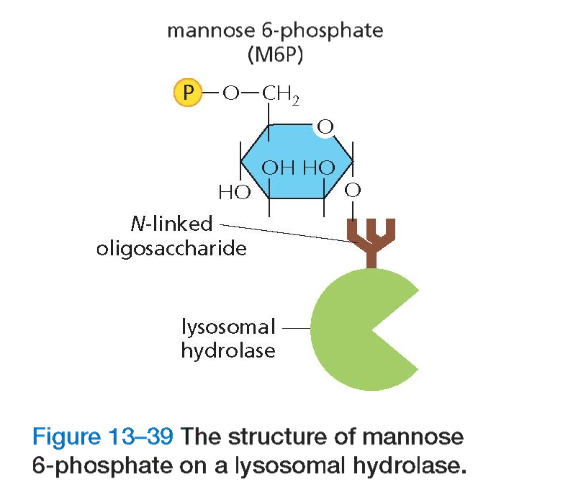
בגולג׳י מתרחש תהליך מאוד חשוב של גליקוזילציה - הוספה או הסרה של סוכרים מחלבונים. מה שמעניין הוא שבכל אזור בגולג׳י יש תהליך אחר של גליקוזילציה, וזה סופר חשוב כי יש המון סוגים שונים של סוכרים שצריכים להיבנות בסדר מסוים.
כפי שהמרצה הסביר: “תחשבו על אותיות ומילים. אנחנו לא יכולים סתם לזרוק אותיות בסדר רנדומלי, אנחנו צריכים לשים אותן בסדר מסוים כדי שייצרו מילים שאנחנו יכולים להבין. הסוכרים זה בדיוק אותו דבר”.
סוגי גליקוזילציה
יש שני סוגים עיקריים:
- N-linked glycosylation: קישור דרך אטום חנקן
- O-linked glycosylation: קישור דרך אטום חמצן
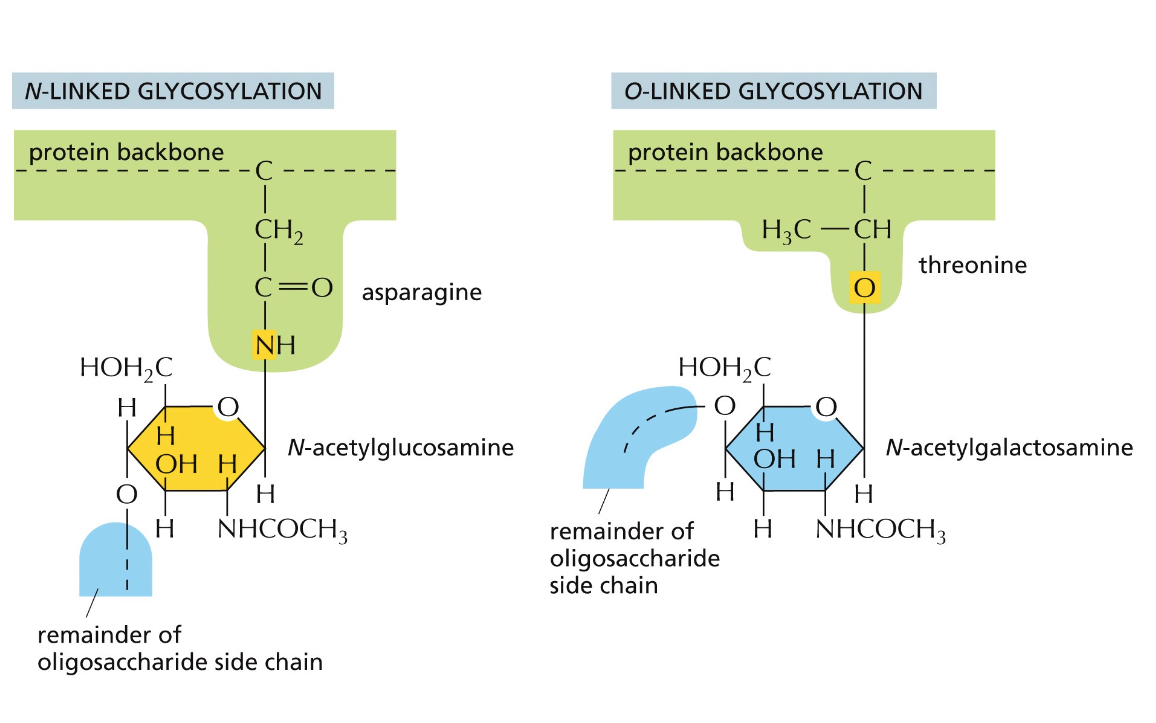
כשסטודנט שאל איך קוראים לתהליך של עשרת סוכרים, המרצה ענה בכנות: “שאלה טובה, אני לא בטוח בטרמינולוגיה”.
תפקידי הסוכרים - דוגמת קבוצות הדם
הדוגמה הקלאסית היא קבוצות דם A, B ו-O. מה שאנחנו קוראים A ו-B זה פשוט עצי סוכרים ספציפיים על חלבונים ממברנליים. הגוף מזהה את הסוכרים האלה ויודע אם התא “שייך לי” או “הגיע מבחוץ ואני צריך להרוג אותו”. O הוא החוסר של A ו-B, לכן הוא תורם אוניברסלי - אין לו סוכרים שיגרמו לתגובה חיסונית. מצד שני, הוא לא יכול לקבל מאף אחד כי אם הגוף מזהה A או B, הוא תוקף.
תפקידים נוספים של הסוכרים: הם שומרים על החלבון מפני פרוטאזות (חלבונים שמפרקים חלבונים), משפיעים על המטען החשמלי, משפיעים על המבנה התלת-ממדי, ומגדילים משמעותית את נפח החלבון. המרצה ציין שנדיר מאוד למצוא חלבון במסלול ההפרשה שלא עובר גליקוזילציה.
ריר - דוגמה מרתקת לחשיבות הגליקוזילציה
המרצה שיתף: “אם עניין אתכם, ואני בטוח שלא, מה הדבר הספציפי שאני חוקר במעי - זה ריר. אני יודע שזה נשמע דוחה, אבל ריר זה דבר מדהים!”
הוא הסביר את ההבדל בין עור למעי: העור שלנו “חסר תועלת” מבחינה פונקציונלית - לא נושמים או סופגים נוטריאנטים דרכו. השכבה החיצונית מורכבת מתאים מתים, מה שמספק הגנה. במעי זה לא אפשרי - התאים חייבים להיות חיים כדי לספוג מזון, מים וחמצן.
אז מה מונע מחיידקים להיכנס לתאים? מה מונע מהתאים להתייבש? התשובה היא ריר. “איך אנחנו יודעים שריר זה פטנט מוצלח? כי כל אורגניזם בטבע שיש לו תאים חיים שפוגשים את העולם החיצוני מכוסה בריר - מקרפדות דרך אלמוגים ועד אלינו”.
המרצה הראה תמונות מהמעבדה שלו - הריר יוצר הפרדה בין תאי האפיתל לחיידקים. המנגנון פשוט: החלבון עצמו כמעט חסר משמעות, הוא רק מאפשר לסוכרים להיבנות עליו. כשהחלבון מופרש מהתא, המים נספגים לסוכרים ונוצרת שכבת ג׳ל - “כמו ג׳לו או פודינג”.
הקשר למיקרוביום ומחלות
המרצה הסביר שהגוף יכול לבחור את המיקרוביום שלו על ידי שינוי הסוכרים על הריר. חיידקים פתוגנים כמו סלמונלה, ליסטריה ושיגלה לא יודעים לאכול את הסוכרים שלנו, ולכן הם מתקשים להתחרות עם המיקרוביום הטבעי. קלוסטרידיום דיפיצילה, שגורם לזיהומים אגרסיביים בבתי חולים, גם לא יודע לאכול ריר - הטיפול היחיד שעובד נגדו הוא השתלת צואה.
כשסטודנטים שאלו על כיבים ומחלות מעי דלקתיות, המרצה הסביר על הליקובקטר פילורי (וסיפר על החוקר ששתה את החיידק וקיבל פרס נובל), ועל הקשר החזק בין סטרס למחלות כמו קוליטיס כיבית. הוא ציין שהמערכת העצבית הגדולה ביותר מחוץ למוח נמצאת במעי, והיא אוטונומית - יכולה לתפקד גם ללא חיבור למוח.
המרצה הזכיר את המחקר המרשים של אסיה רולס מהטכניון, שהראתה שאפשר לגרום לדלקת במעי על ידי גירוי אזור במוח. כששאלו על עמרי קורן, הוא ציין שקורן חוקר מיקרוביום בהקשר של היריון ובריאות האישה, וגילה שהמיקרוביום משתנה במהלך הטרימסטרים כדי להכין את האם ללידה.
סיכום
מסלול ההפרשה מהווה מערכת מורכבת ומתוחכמת המשלבת זיהוי ספציפי (חלבוני Rab), כוח מכני (חלבוני SNARE), בקרת איכות (שפרונים) ומערכת החזרה (KDEL). הגולג׳י ממלא תפקיד מרכזי כתחנת מיון וכמקום שבו מתרחשת גליקוזילציה - תהליך קריטי המשפיע על כל היבט בתפקוד החלבונים, מזיהוי עצמי/זר ועד יצירת ריר המגן עלינו.
כפי שסיים המרצה: “יום שני זה יום ירושלים, וכידוע צפת מוקפת חומה, אז אין שיעור. נתראה ביום רביעי!”
שיעור 16 - אקסוציטוזה ומסלולי הפרשה תאיים
תאריך: 28/05/2025חזקים בהפרשות?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא: מהרשת האנדופלסמטית אל פני התא
אקסוציטוזה מייצגת את התהליך המשלים לאנדוציטוזה - הוצאת חומרים מהתא אל הסביבה החיצונית. תהליך זה חיוני להפרשת הורמונים, נוירוטרנסמיטרים, אנזימים עיכול, וחלבונים רבים אחרים. המסלול המלא, מהרשת האנדופלסמטית (ER) דרך מערכת הגולג׳י ועד להפרשה, מכונה המסלול הסקרטורי (secretory pathway).
בפרק זה נתמקד באירועים המתרחשים ברשת הטרנס-גולג׳י (Trans-Golgi Network - TGN), האזור הדיסטלי של מערכת הגולג׳י הפונה אל הממברנה הפלסמטית. ה-TGN משמש כתחנת מיון מרכזית, שבה מתקבלות החלטות קריטיות לגבי היעד הסופי של כל חלבון.
שלושת המסלולים מהטרנס-גולג׳י
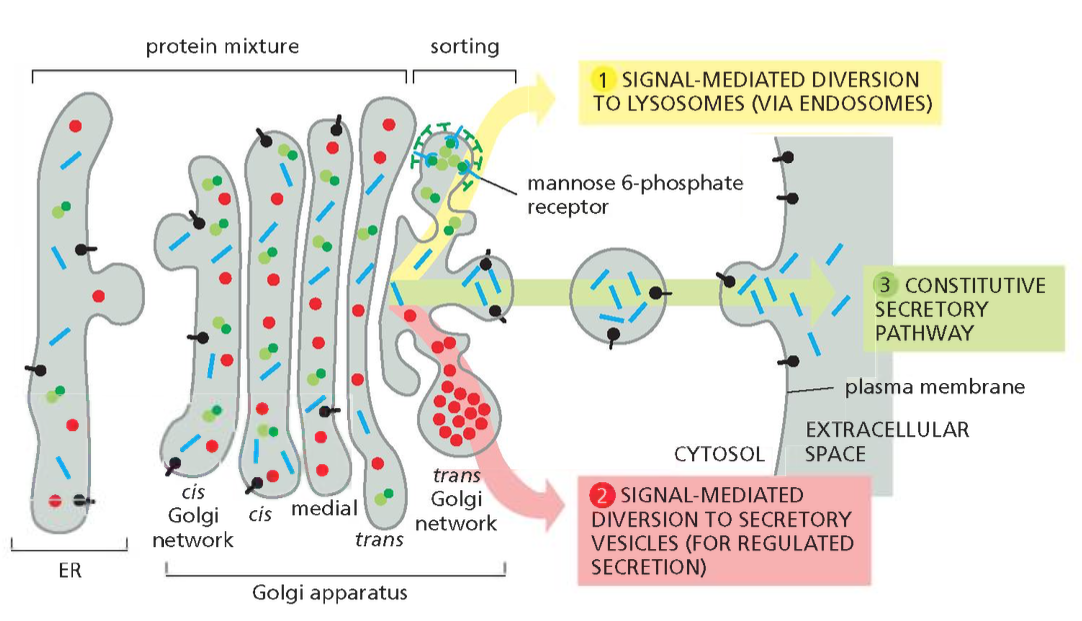
1. המסלול הליזוזומלי
הליזוזום הוא אברון מיוחד המתמחה בפירוק מקרומולקולות. הסביבה החומצית הקיצונית שלו (pH 5-4.5) וריכוז האנזימים ההידרוליטיים הגבוה הופכים אותו ל”מרכז המיחזור” של התא. חלבונים שמיועדים לליזוזום חייבים להיות מסומנים בצורה ספציפית כדי למנוע הפרשה שלהם מהתא או הגעה שלהם ליעדים שגויים.
2. הפרשה מבוקרת (Regulated Secretion)
מסלול ההפרשה המבוקרת מאפשר לתאים לשלוט על העיתוי המדויק של ההפרשה. החומרים נאגרים בגרנולות הפרשה בוגרות הממתינות לאות ספציפי - בדרך כלל עלייה בריכוז הסידן התוך-תאי. דוגמאות קלאסיות להפרשה מבוקרת כוללות:
- הפרשת אינסולין מתאי בטא בלבלב בתגובה לעליית גלוקוז בדם
- שחרור נוירוטרנסמיטרים בסינפסות עצביות
- הפרשת אנזימי עיכול מתאי אצינר בלבלב
3. הפרשה קונסטיטוטיבית (Constitutive Secretion)
זהו מסלול ה”ברירת מחדל” - חלבונים שאינם נושאים סימני מיון ספציפיים מופרשים באופן רציף מהתא. מסלול זה חיוני לחידוש מתמיד של הממברנה הפלסמטית ולהפרשת חלבוני מטריקס חוץ-תאי.
סימון חלבונים ליזוזומליים: מנגנון המנוז-6-פוספט (M6P)

העיקרון הביוכימי
חלבונים המיועדים לליזוזום מסומנים באמצעות קבוצת מנוז-6-פוספט (M6P). תהליך הסימון מורכב ומתרחש בשלבים:
- שלב 1 - זיהוי ראשוני: אנזימים ליזוזומליים מכילים רצף אות מיוחד שנקרא “signal patch” - מבנה תלת-ממדי שמורכב מחומצות אמינו שאינן בהכרח סמוכות ברצף הראשוני.
- שלב 2 - הוספת הסימון: בציסטרנות הגולג׳י, האנזים $\text{GlcNAc-phosphotransferase}$ מזהה את ה-signal patch ומוסיף $\text{N-acetylglucosamine-phosphate}$ לשיירי מנוז על גליקופרוטאינים.
- שלב 3 - חשיפת האות: אנזים נוסף מסיר את ה-N-acetylglucosamine וחושף את קבוצת הפוספט על המנוז.
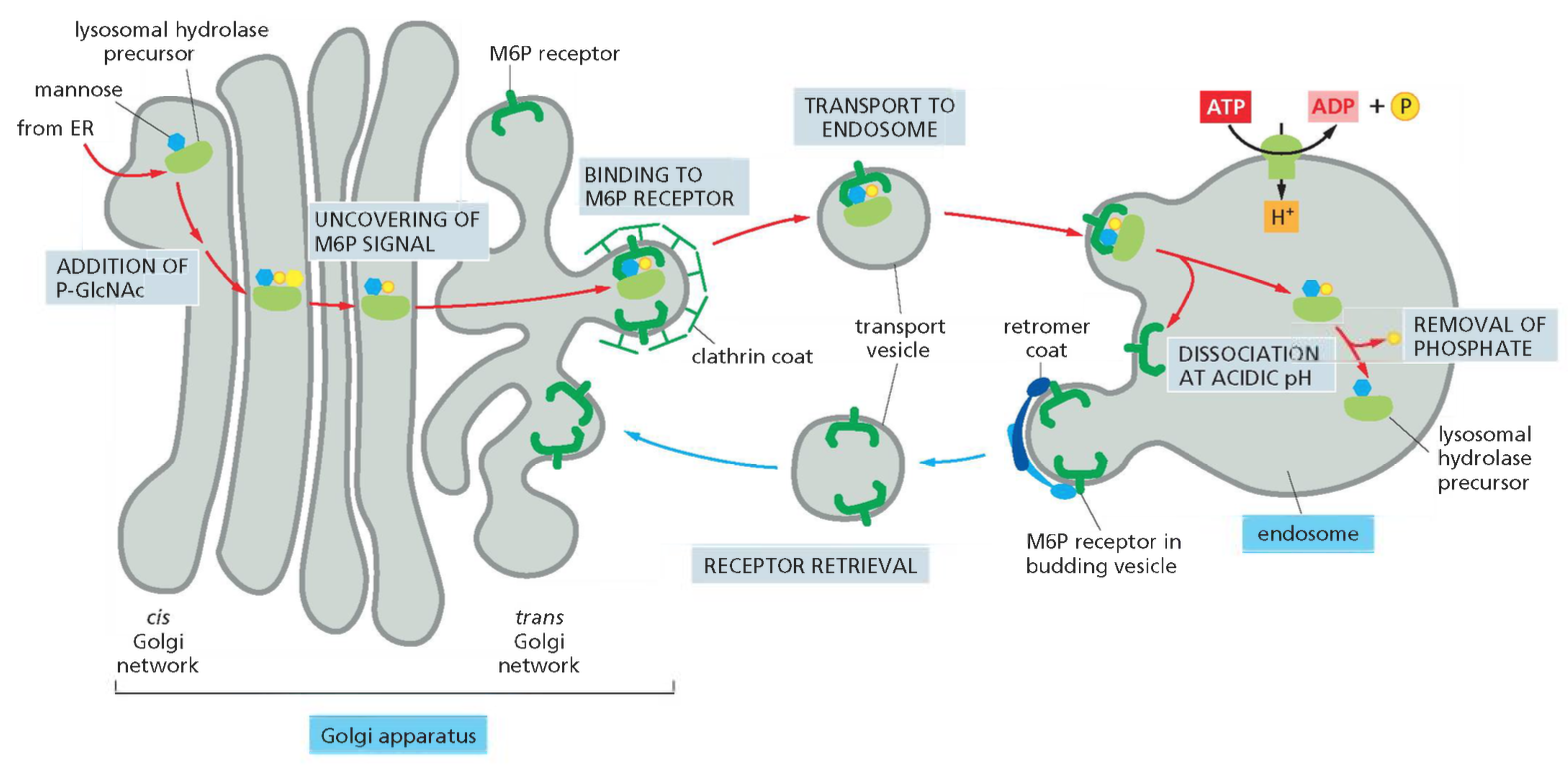
מנגנון הקישור והשחרור תלוי pH
רצפטורי M6P בטרנס-גולג׳י קושרים את החלבונים המסומנים ב-pH ניטרלי (6.5-7.0). השלפוחיות העטופות קלתרין המכילות את קומפלקס הרצפטור-ליגנד נעות לעבר האנדוזומים המאוחרים והליזוזומים. ירידת ה-pH (ל-5.5-5.0) גורמת לדיסוציאציה של הקומפלקס: החלבון הליזוזומלי משתחרר לחלל הליזוזום, בעוד הרצפטור ממוחזר חזרה לגולג׳י באמצעות שלפוחיות עטופות רטרומר.
כמנגנון הגנה נוסף, פוספטאזות ליזוזומליות מסירות את קבוצת הפוספט מה-M6P, מונעות קישור חוזר לרצפטור וחזרה לא רצויה לגולג׳י.
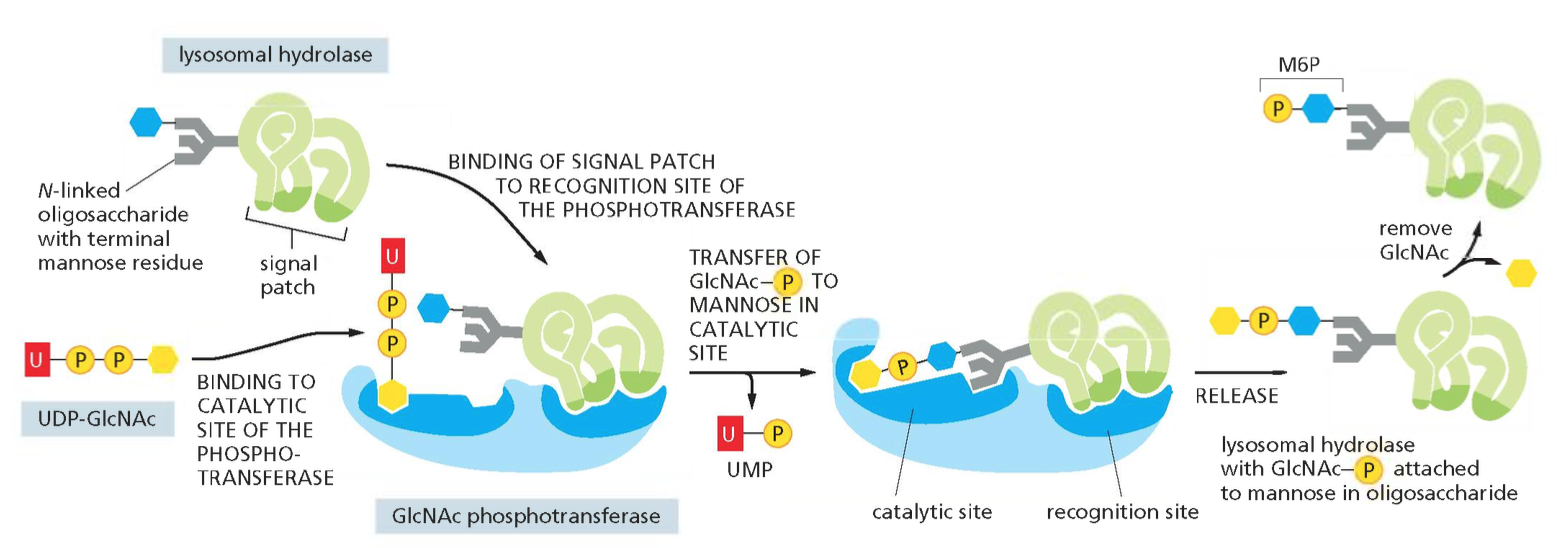
מחלות אגירה ליזוזומליות: כשהמערכת כושלת
פגמים במנגנון ה-M6P או באנזימים ליזוזומליים גורמים למחלות אגירה ליזוזומליות. מחלות אלה מאופיינות בהצטברות חומרים שאינם מפורקים בתאים, במיוחד בנוירונים. הביטוי הקליני הראשוני הוא לרוב נוירולוגי - עיכוב התפתחותי חמור, ניוון נוירונים, ומוות מוקדם.
הרגישות המיוחדת של נוירונים נובעת מאופיים הפוסט-מיטוטי - הם אינם מתחלקים ולכן אינם יכולים “לדלל” את החומרים המצטברים באמצעות חלוקת תא. דוגמאות למחלות כוללות:
- מחלת טיי-זקס (Tay-Sachs) - חסר ב-hexosaminidase A
- מחלת גושה (Gaucher) - חסר ב-glucocerebrosidase
- מחלת פומפה (Pompe) - חסר ב-acid α-glucosidase
השכיחות הגבוהה של מחלות אלה באוכלוסיות מבודדות גנטית (כמו יהודים אשכנזים) נובעת מאפקט המייסד ונישואי קרובים היסטוריים.
תאים מפרישים מתמחים: ארגון מרחבי של ההפרשה
תאי גובלט ותאי פאנת
תאים אפיתליאליים מפרישים במעי מדגימים התמחות קיצונית להפרשה. תאי גובלט (Goblet cells) מפרישים ריר להגנה על האפיתל, בעוד תאי פאנת (Paneth cells) מפרישים פפטידים אנטי-מיקרוביאליים. בתאים אלה:
- גרנולות ההפרשה תופסות את מרבית נפח התא
- האברונים האחרים (גרעין, ER, גולג׳י) דחוסים לאזור בזאלי צר
- קיימת פולריות ברורה - הפרשה מתרחשת אך ורק מהצד האפיקלי
יצירת גרנולות הפרשה בוגרות
התהליך כולל מספר שלבי ריכוז והבשלה:
שלב הגרנולות הלא-בוגרות: שלפוחיות עטופות קלתרין יוצאות מה-TGN ומתמזגות ליצירת גרנולות ראשוניות. בשלב זה הגרנולות מכילות גם את החלבונים המיועדים להפרשה וגם חלבונים וליפידים עודפים.
תהליך ההבשלה והעיבוי: במהלך ההבשלה מתרחש תהליך של “עיבוי סלקטיבי”:
- חלבונים המיועדים להפרשה מתרכזים במרכז הגרנולה
- חומרים עודפים ממוחזרים חזרה לגולג׳י בשלפוחיות עטופות קלתרין
- התהליך חוזר על עצמו, מגדיל בהדרגה את ריכוז המטען
בסוף התהליך, גרנולות בוגרות מכילות ריכוז גבוה פי 300-200 של חלבונים להפרשה בהשוואה לריכוזם ב-ER.
מנגנון ההפרשה המבוקרת: תפקיד הסידן
חלבוני SNARE ותהליך ה-Priming
גרנולות הפרשה בוגרות נעות לאזור ההפרשה (למשל, הממברנה האפיקלית או האזור הפרה-סינפטי) שם הן עוברות:
- Docking: חלבוני v-SNAREs על הגרנולה (וזיקולה) מזהים t-SNAREs על הממברנה המטרה
- Priming: יצירת קומפלקס SNARE יציב המקרב את הממברנות עד למרחק של 2-1 ננומטר, אך עדיין מונע היתוך ספונטני
- היתוך תלוי-סידן: עלייה מקומית בריכוז הסידן (מ-100 ננומולר ל-100-10 מיקרומולר) גורמת לשינוי קונפורמציוני בחלבוני SNARE, המוביל להיתוך הממברנות ושחרור המטען.
חשיבות המנגנון בנוירונים
בסינפסות עצביות, המנגנון מאפשר תגובה תוך מילישניות לפוטנציאל פעולה:
- שלפוחיות סינפטיות ממתינות ב”מצב מוכן” (primed state)
- פתיחת תעלות סידן תלויות-מתח גורמת לזרימת סידן מקומית
- היתוך מסונכרן של מספר שלפוחיות משחרר נוירוטרנסמיטרים לסינפסה
מיחזור שלפוחיות סינפטיות: יעילות מקסימלית
המנגנון המולקולרי
נוירונים פיתחו מנגנון מיחזור מהיר לשלפוחיות סינפטיות, המאפשר תפקוד רציף ללא תלות מוחלטת בסינתזה חדשה:
Kiss-and-Run: בחלק מהמקרים, השלפוחית לא מתמזגת לחלוטין אלא יוצרת נקבובית זמנית, משחררת את תוכנה ומתנתקת
מיחזור מלא: לאחר היתוך מלא, חלבוני השלפוחית (כולל טרנספורטרים לנוירוטרנסמיטרים) נשארים בממברנה. אנדוציטוזה מקומית יוצרת שלפוחיות חדשות המכילות את החלבונים הדרושים.
מנגנון הטעינה מחדש
השלפוחיות הממוחזרות נטענות מחדש בנוירוטרנסמיטרים באמצעות:
V-ATPase: משאבת פרוטונים היוצרת גרדיאנט pH (pH 5.5 בשלפוחית לעומת 7.2 בציטופלסמה)
אנטיפורטרים ספציפיים: מנצלים את גרדיאנט הפרוטונים להכנסת נוירוטרנסמיטרים כנגד מפל הריכוזים שלהם. לדוגמה, VGLUT (vesicular glutamate transporter) מחליף פרוטון יוצא בגלוטמט נכנס.
מנגנון זה מסביר את פעולתם של תרופות נוגדות דיכאון מסוג SSRI - הן חוסמות את הטרנספורטרים המחזירים סרוטונין מהסינפסה לתא הפרה-סינפטי, מגדילות את זמן השהייה של הנוירוטרנסמיטר בסינפסה.
פולריות תאית ומיון חלבונים
מיון ישיר (Direct Sorting)
בתאים פולריים (כגון תאי אפיתל), חלבונים מסוימים חייבים להגיע לדומיין ממברנלי ספציפי. במיון ישיר:
- חלבונים נושאים סיגנלי מיון המכוונים אותם לדומיין האפיקלי או הבזולטרלי
- SNAREs ספציפיים מבטיחים היתוך רק עם הממברנה המתאימה
טרנסציטוזה
במנגנון חלופי זה:
- חלבונים מופרשים תחילה לדומיין ממברנלי אחד (לרוב הבזולטרלי)
- אנדוציטוזה סלקטיבית קולטת חלבונים ספציפיים
- השלפוחיות האנדוציטיות חוצות את התא ומתמזגות עם הדומיין הנגדי
טרנסציטוזה חשובה במיוחד להעברת נוגדנים מהאם לעובר או לתינוק היונק, כפי שראינו בפרק הקודם.
סיכום: רשת משולבת של מסלולי הובלה
מערכת האקסוציטוזה מדגימה את המורכבות והדיוק של התהליכים התאיים. שלושת המסלולים מה-TGN - ליזוזומלי, הפרשה מבוקרת, והפרשה קונסטיטוטיבית - מאפשרים לתא להתאים את תפקודו לצרכים משתנים. המנגנונים המולקולריים, מסימון M6P ועד לוויסות על ידי סידן, מבטיחים דיוק במיון ובהפרשה. הבנת מנגנונים אלה חיונית להבנת פתולוגיות רבות ולפיתוח טיפולים חדשניים.
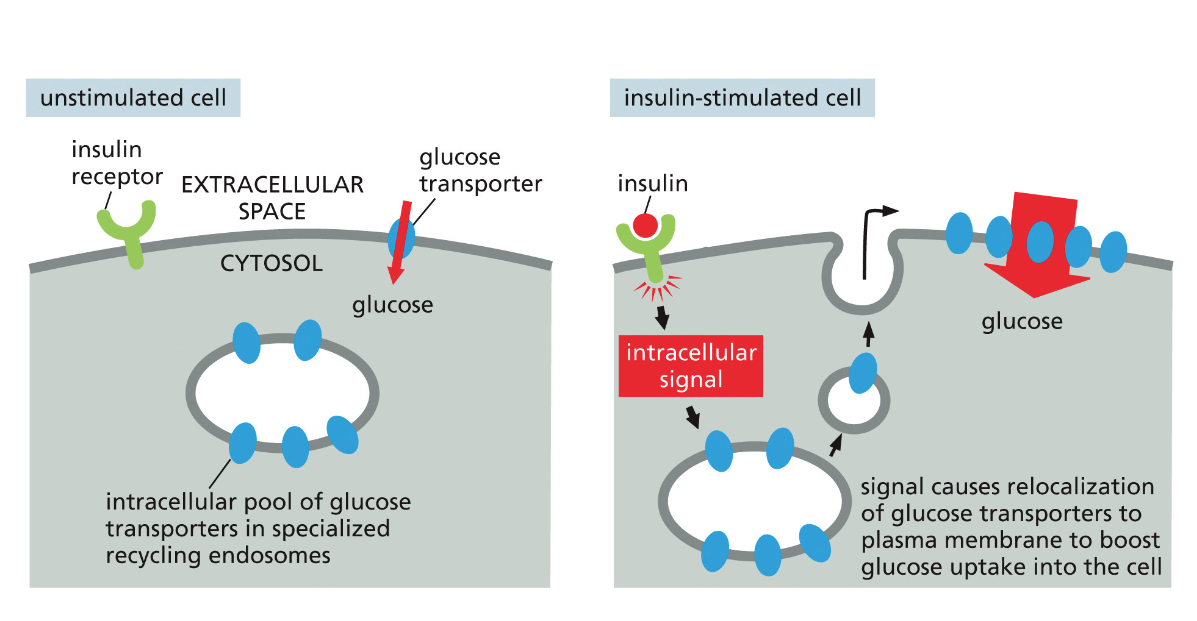
שיעור 17 - אנדוציטוזה - מנגנונים תאיים להכנסת חומרים
תאריך: 04/06/2025מבוא: התהליך ההפוך לאקסוציטוזה
אנדוציטוזה מהווה תהליך תאי יסודי המאפשר הכנסת חומרים מהסביבה החיצונית אל תוך התא. בניגוד לאקסוציטוזה, שבה חומרים מופרשים מהתא החוצה, אנדוציטוזה מאפשרת לתאים לקלוט מולקולות גדולות שאינן יכולות לחצות את הממברנה באמצעות טרנספורטרים או תעלות יוניות. כל תא פעיל מבצע אנדוציטוזה באופן מתמיד, כאשר התהליך חיוני לקליטת חלבונים, ליפידים, וחומרים מורכבים אחרים.
התהליך כרוך ביצירת שלפוחיות (וזיקולות) מהממברנה הפלסמטית, כאשר חלק מהממברנה מתקפל פנימה ונסגר ליצירת שלפוחית המכילה חומרים מהסביבה החיצונית. חשוב להבין כי תהליך זה גורע משטח הממברנה, ולכן מתקיים באופן מתמיד איזון עדין עם תהליכי אקסוציטוזה להחזרת ממברנה לפני השטח של התא.
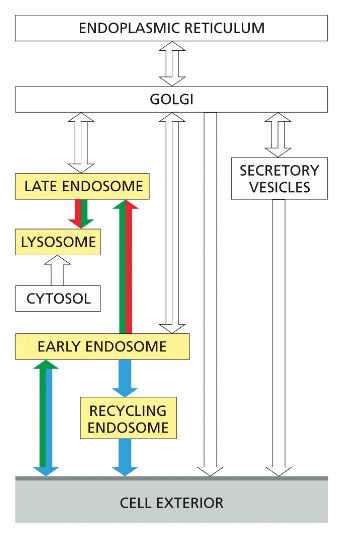
סוגי אנדוציטוזה: פינוציטוזה ופגוציטוזה
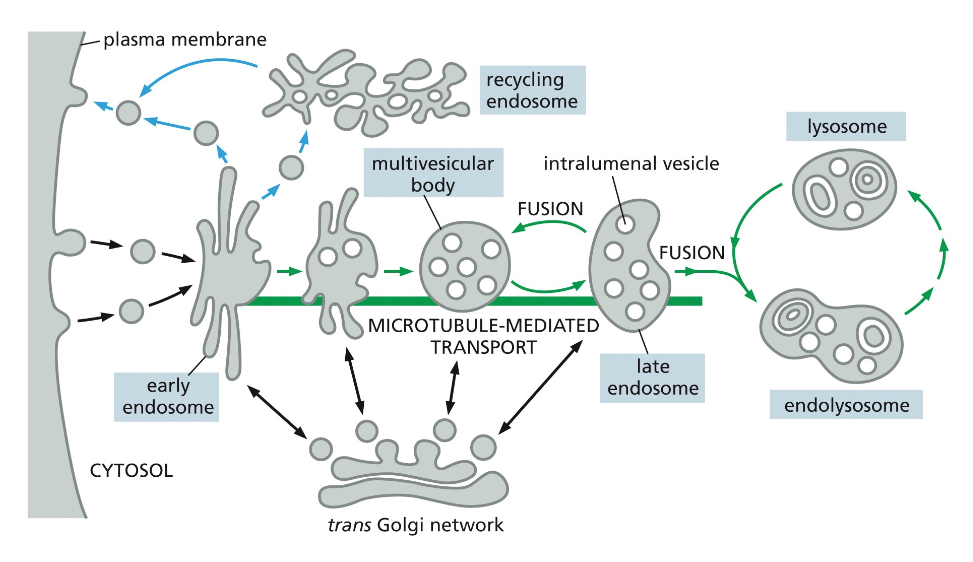
שימו לב: בדרך כלל היה בצד שמאל את ה-ER או הגרעין בצד שמאל ואת הממברנה של התא בצד ימין. כאן הופכים את הכיוון - הפעם הממברנה בצד שמאל ושאר האברונים בצד ימין.
פינוציטוזה - “שתייה תאית”
פינוציטוזה (מהמילה הלטינית “pino” - לשתות) מייצגת את התהליך הנפוץ ביותר של אנדוציטוזה. בתהליך זה נוצרות שלפוחיות (בועיות) קטנות יחסית, בקוטר של כ-150-100 ננומטר, העטופות בחלבון קלתרין (clathrin).
התהליך מתרחש באופן קונסטיטוטיבי בכל התאים, כאשר קצב הפינוציטוזה משתנה בהתאם לסוג התא ולתפקידו הפיזיולוגי.
מאפיינים מרכזיים של פינוציטוזה:
- יצירת שלפוחיות קטנות עטופות קלתרין
- תהליך מתמשך וקבוע
- קליטת נוזלים וחומרים מומסים
- מנגנון סלקטיבי באמצעות רצפטורים
פגוציטוזה - “אכילה תאית”
פגוציטוזה (מהמילה הלטינית “phago” - לאכול) מאופיינת בקליטת חלקיקים גדולים במיוחד, כגון חיידקים, תאים מתים, או שברי תאים. בניגוד לפינוציטוזה, השלפוחיות הנוצרות בפגוציטוזה גדולות משמעותית (מעל מיקרומטר בקוטר) ואינן עטופות בקלתרין. תהליך זה מתרחש בעיקר בתאים פגוציטיים מקצועיים כגון מקרופאגים ונויטרופילים.
המנגנון המולקולרי של פינוציטוזה
תפקיד הקלתרין ביצירת שלפוחיות
קלתרין מהווה חלבון מפתח בתהליך יצירת השלפוחיות. מולקולות הקלתרין מתארגנות ליצירת מבנה כלוב תלת-ממדי סביב הממברנה המתקפלת, תוך סיוע בעיקול הממברנה וביצירת צורת הכדור של השלפוחית. לאחר היווצרות השלפוחית והיפרדותה מהממברנה, מעטפת הקלתרין מתפרקת במהירות, מה שמאפשר לשלפוחית להתמזג עם אברונים תוך-תאיים.
דינמיקה של ממברנות במקרופאגים
מקרופאגים מדגימים את העוצמה של תהליכי האנדוציטוזה: תאים אלה ממחזרים כ-25% משטח הממברנה שלהם מדי חצי שעה. משמעות הדבר היא שתוך מספר שעות, כל שטח הממברנה של המקרופאג עובר מחזור מלא של אנדוציטוזה ואקסוציטוזה. יכולת זו חיונית לתפקודם כתאים פגוציטיים המסלקים פתוגנים ופסולת תאית.
אנדוציטוזה מתווכת-רצפטור
עקרון הסלקטיביות
תאים אינם קולטים חומרים באופן אקראי מהסביבה. במקום זאת, קיים מנגנון מתוחכם של זיהוי וקליטה סלקטיבית באמצעות רצפטורים ספציפיים. רצפטורים אלה הם חלבונים טרנסממברנליים המסוגלים לזהות ולקשור ליגנדים ספציפיים בדיוק רב. כאשר רצפטור קושר את הליגנד שלו, נוצר אות להתחלת תהליך האנדוציטוזה באזור זה של הממברנה.
דוגמה קלאסית: קליטת LDL
מנגנון קליטת הליפופרוטאין בצפיפות נמוכה (LDL - Low Density Lipoprotein) מהווה דוגמה מצוינת לאנדוציטוזה מתווכת-רצפטור. LDL משמש כנשא עיקרי של כולסטרול בזרם הדם, כאשר הכולסטרול ארוז בתוך מיצלה חד-שכבתית ומוקף בחלבון ApoB (Apolipoprotein B).
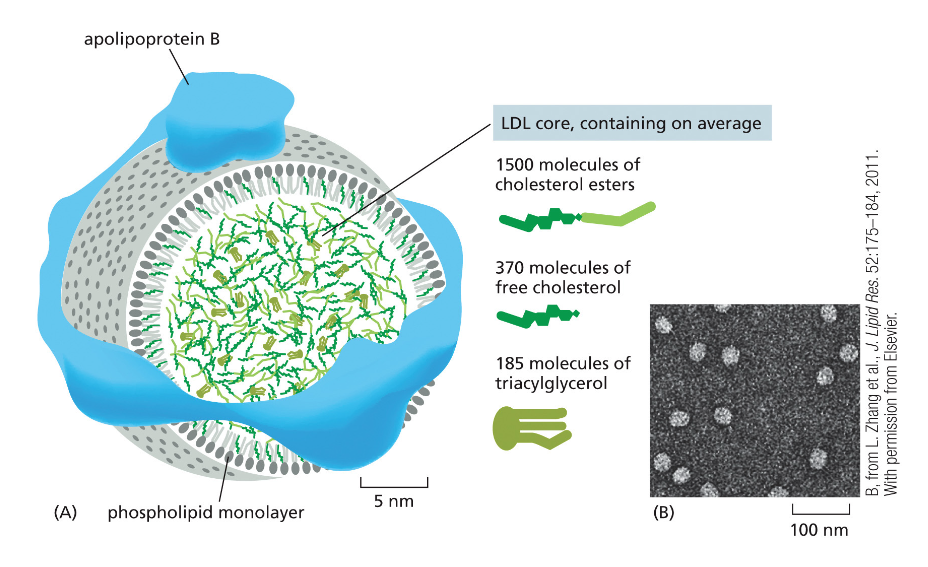
התהליך מתרחש בשלבים הבאים (ראינו סרטון):
-
קישור הרצפטור: רצפטורי LDL על פני התא מזהים וקושרים את חלקיקי ה-LDL באמצעות אינטראקציה ספציפית עם החלבון ApoB.
-
יצירת שלפוחית עטופת קלתרין: לאחר הקישור, האזור הממברנלי המכיל את קומפלקס הרצפטור-LDL מתחיל להתקפל פנימה, תוך יצירת שלפוחית עטופת קלתרין.
-
היפרדות מהממברנה: השלפוחית נסגרת ומשתחררת לציטופלסמה, כאשר ה-LDL נמצא כעת בתוך התא.

מסלול האנדוזומים והחשיבות של pH
האנדוזום המוקדם ותהליך ההבשלה
האנדוזום זה גופיף ביניים שעוזר לנו לעשות סדר: להחזיר חומרים שצריכים לחזור לגולג׳י, להחזיר רצפטורים לממברנה, ולשלוח חומרים לליזוזום לפירוק.
לאחר היווצרות השלפוחית האנדוציטית והסרת מעטפת הקלתרין, השלפוחית מתמזגת עם האנדוזום המוקדם (early endosome). אברון זה משמש כתחנת מיון מרכזית, שבה מתקבלות החלטות לגבי גורל החומרים השונים שהוכנסו לתא.
האנדוזום המוקדם עובר תהליך הבשלה (maturation) הדרגתי, במהלכו הוא הופך לאנדוזום מאוחר (late endosome). תהליך זה כולל:
- ירידה הדרגתית ב-pH מ-6.5 ל-5.5
- החלפת חלבונים ממברנליים אופייניים
- שינויים במורפולוגיה הפנימית
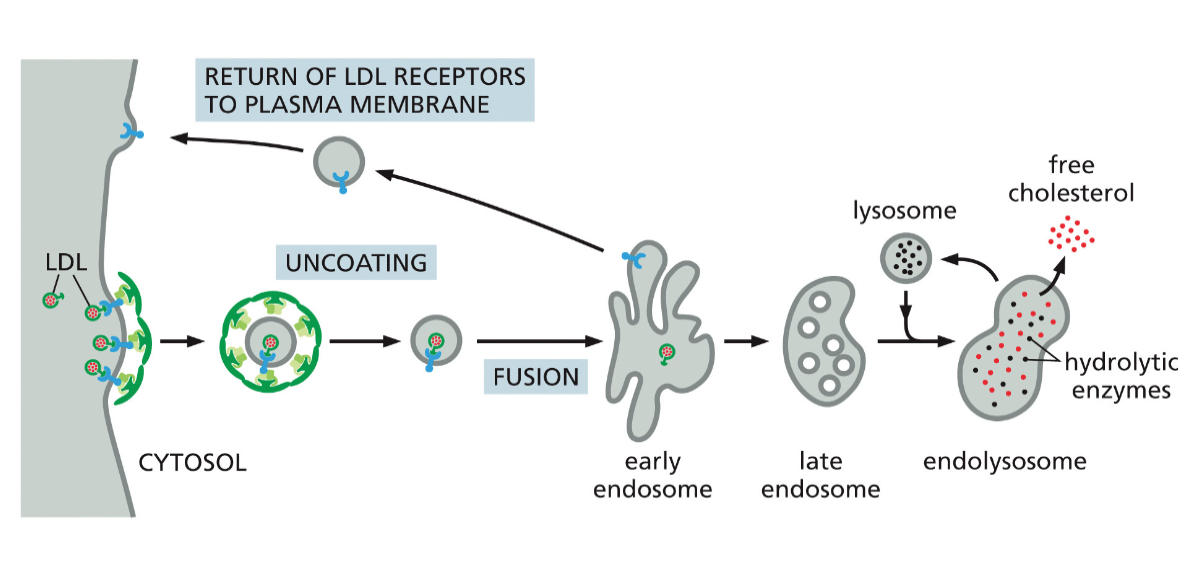
מנגנון ה-pH וההיפרדות רצפטור-ליגנד
אחד המנגנונים החשובים ביותר במערכת האנדוזומלית הוא השימוש בשינויי pH להפרדת רצפטורים מהליגנדים שלהם. ירידת ה-pH באנדוזום גורמת לשינויים קונפורמציוניים ברצפטורים רבים, מה שמוביל לירידה בזיקה לליגנד ולשחרורו.
בדוגמת ה-LDL:
- ב-pH ניטרלי (7.4) - הרצפטור קושר LDL בחוזקה
- ב-pH חומצי (5.5-6.0) - הרצפטור משחרר את ה-LDL
- ה-LDL החופשי ממשיך לליזוזום לפירוק
- הרצפטור ממוחזר חזרה לממברנה דרך האנדוזום הממחזר
מחזור רצפטורים ויעילות תאית
מחזור הרצפטורים מהווה מנגנון חיוני לשמירה על יעילות התא. במקום לייצר רצפטורים חדשים לאחר כל מחזור אנדוציטוזה, התא ממחזר את הרצפטורים הקיימים. רצפטור LDL בודד יכול לבצע מאות מחזורי קליטה במהלך חייו, מה שמדגיש את היעילות של המערכת.
האנדוזום הממחזר (recycling endosome) משחק תפקיד מרכזי בתהליך זה, כאשר הוא מפריד בין חומרים המיועדים לפירוק בליזוזום לבין רצפטורים וחלבונים אחרים שצריכים לחזור לממברנה.
טרנסציטוזה: מעבר חומרים דרך התא
מנגנון ייחודי להעברת נוגדנים
טרנסציטוזה מייצגת תהליך ייחודי שבו חומרים נקלטים בצד אחד של התא ומופרשים בצד הנגדי, ללא פירוק בליזוזום. דוגמה קלאסית לתהליך זה היא העברת נוגדנים מחלב האם לתינוק דרך תאי האפיתל במעיים.
בתינוקות יונקים, המערכת החיסונית האדפטיבית טרם התפתחה במלואה. כפיצוי, נוגדנים מסוג IgG מועברים מהאם לתינוק דרך חלב האם. תהליך זה מתאפשר הודות לרצפטורים ספציפיים על תאי האפיתל במעי התינוק.
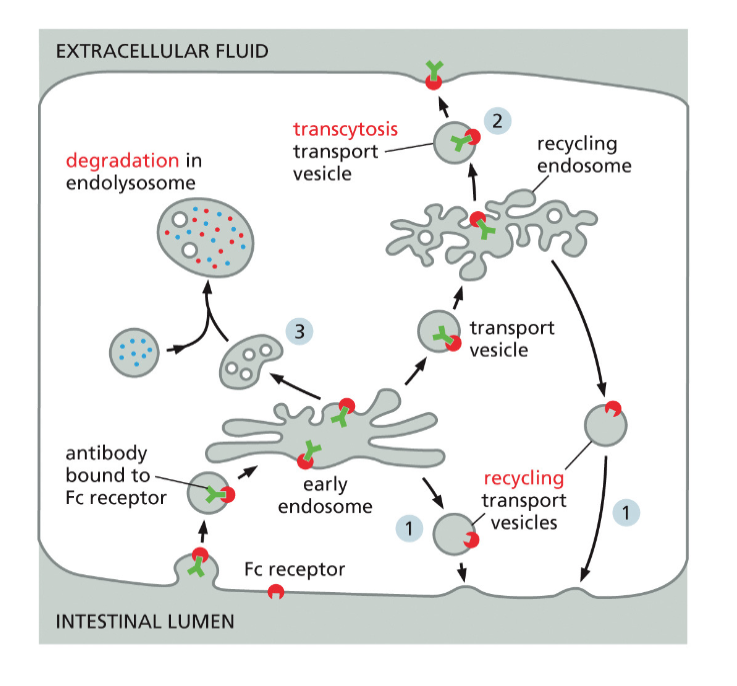
תפקיד ה-pH בטרנסציטוזה
המנגנון המולקולרי של טרנסציטוזה מדגים שימוש מתוחכם בשינויי pH:
בחלל המעי (צד אפיקלי): ה-pH חומצי (כ-6.0) בשל הפרשת חומצת הקיבה. בתנאים אלה, הנוגדנים נקשרים בחוזקה לרצפטורים שלהם. הקישור החזק בתנאי pH חומצי מנוגד למה שראינו במקרה של LDL, ומדגיש את המגוון של מנגנוני הרגולציה התאית.
במהלך הטרנספורט התוך-תאי: השלפוחית האנדוציטית שומרת על ה-pH החומצי לאורך כל מסלולה דרך התא. זה קריטי למניעת שחרור מוקדם של הנוגדנים.
בצד הבזולטרלי: כאשר השלפוחית מתמזגת עם הממברנה הבזולטרלית (הפונה לזרם הדם), היא נחשפת ל-pH הניטרלי של הנוזל הבין-תאי (pH 7.4). השינוי ב-pH גורם לשחרור הנוגדנים מהרצפטור, והם משתחררים לזרם הדם של התינוק.
מחזור הרצפטור: לאחר שחרור הנוגדן, הרצפטור חייב לחזור לצד האפיקלי להמשך תפקודו. תהליך זה מדגים את הקוטביות התפקודית של תאי אפיתל ואת החשיבות של מיון חלבונים לממברנות שונות.
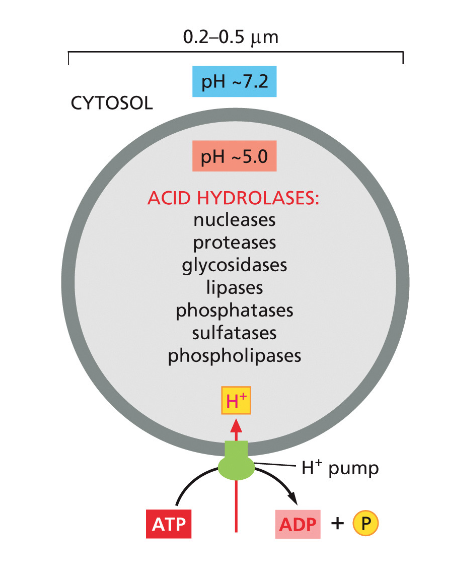
ויסות דינמי של רצפטורים ממברנליים
עקרון הדסנסיטיזציה
תאים משתמשים באנדוציטוזה ככלי לוויסות רגישותם לגירויים חיצוניים. על ידי הכנסת רצפטורים מהממברנה לאנדוזומים, התא יכול להפחית את תגובתו לליגנד מסוים. תהליך זה, המכונה דסנסיטיזציה, חיוני למניעת גירוי-יתר של התא.
דוגמה: ויסות טרנספורטרים לגלוקוז
אחת הדוגמאות המרשימות ביותר לוויסות דינמי של רצפטורים היא השליטה על קליטת גלוקוז בתאי שריר ורקמת שומן:
במצב צום: רוב הטרנספורטרים לגלוקוז (GLUT4) מאוחסנים בשלפוחיות אנדוזומליות בתוך התא. רמת הגלוקוז בדם נשמרת על ידי הכבד, ותאי השריר והשומן קולטים מינימום גלוקוז.
לאחר ארוחה: עליית רמת הגלוקוז בדם גורמת להפרשת אינסולין מתאי בטא בלבלב. האינסולין נקשר לרצפטורים שלו על תאי המטרה ומפעיל מסלול איתות תוך-תאי.
תגובת התא: מסלול האיתות גורם לשלפוחיות המכילות GLUT4 לנוע לממברנה ולהתמזג איתה. תוך דקות, מספר הטרנספורטרים לגלוקוז על פני התא עולה פי 20-10, מה שמאפשר קליטה מהירה של גלוקוז מהדם.
חזרה למצב בסיסי: כאשר רמות האינסולין יורדות, הטרנספורטרים עוברים אנדוציטוזה חזרה לתוך התא, ומאוחסנים עד לארוחה הבאה.
מנגנון זה חיוני לשמירה על הומאוסטזיס של גלוקוז. פגיעה בו (כמו בסוכרת סוג 2) גורמת להיפרגליקמיה ולסיבוכים מטבוליים חמורים.
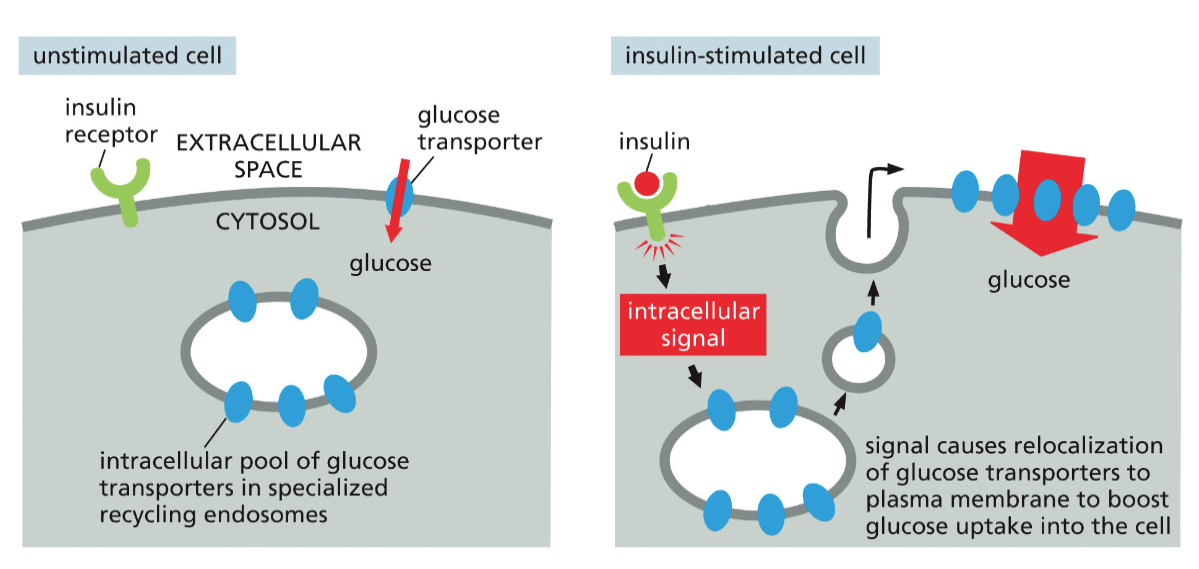
הליזוזום: מרכז הפירוק התאי
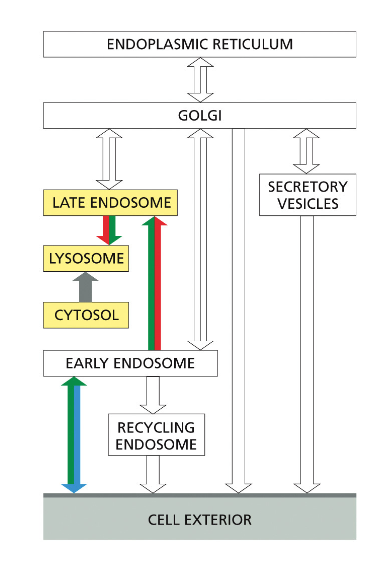
מאפיינים ביוכימיים
הליזוזום מכיל מעל 50 אנזימי הידרוליזה שונים, המסוגלים לפרק כמעט כל מקרומולקולה ביולוגית:
- נוקלאזות: מפרקות DNA ו-RNA
- פרוטאזות: מפרקות חלבונים לחומצות אמינו
- ליפאזות: מפרקות ליפידים
- גליקוזידאזות: מפרקות פחמימות
כל האנזימים הליזוזומליים פועלים באופן אופטימלי ב-pH חומצי (5.0-4.5). תכונה זו משמשת כמנגנון בטיחות - אם הליזוזום נפרץ והאנזימים משתחררים לציטופלסמה (pH 7.2), פעילותם מופחתת משמעותית.
מנגנון שמירת ה-pH החומצי
משאבת ה-ATPase V-type (משאבות פרוטונים ($\ce{H^+}$)) אחראית לשאיבת פרוטונים לתוך הליזוזום תוך ניצול אנרגיה מ-ATP. המשאבה יוצרת ריכוז פרוטונים גבוה פי 1000-100 מהציטופלסמה.
הגנה על האנזימים הליזוזומליים
אנזימי הליזוזום עצמם מוגנים מפירוק על ידי גליקוזילציה נרחבת. שרשראות הסוכר הארוכות יוצרות מעטפת מגן סביב האנזימים, המונעת מפרוטאזות אחרות לגשת לאתרי החיתוך. זהו פתרון אלגנטי לבעיה של “מי מפרק את המפרקים”.
אוטופגיה: מיחזור תוך-תאי
מנגנון האוטופגיה
אוטופגיה (מיוונית: “אכילה עצמית”) היא תהליך שבו התא מפרק ומחזר את מרכיביו הפנימיים. בניגוד לאנדוציטוזה, הקולטת חומרים חיצוניים, אוטופגיה מטפלת באברונים פגומים, צברי חלבונים, ומרכיבים תוך-תאיים אחרים.
יצירת האוטופגוזום
התהליך מתחיל ביצירת ממברנה כפולה ייחודית (double membrane) המקיפה את החומר המיועד לפירוק. מבנה זה, הנקרא אוטופגוזום, מכיל שתי ממברנות ביליפיד - סך הכל ארבע שכבות ליפידיות. המורפולוגיה הייחודית נובעת מתהליך היווצרות מיוחד שבו ממברנה שטוחה מתעקלת ונסגרת על עצמה.
חשיבות פיזיולוגית של אוטופגיה
אוטופגיה חיונית לתפקוד תקין של התא:
-
מיחזור אברונים: מיטוכונדריה פגומות, פרוקסיזומים ישנים, וחלקי רשת אנדופלסמית יכולים להיות מפורקים ומרכיביהם ממוחזרים.
-
סילוק צברי חלבונים: חלבונים שלא התקפלו כראוי או צברים גדולים של חלבונים אינם יכולים להיות מפורקים בפרוטאזום. אוטופגיה היא הדרך היחידה לסלק אותם.
-
הישרדות בתנאי רעב: בהיעדר חומרי מזון, התא יכול לפרק חלבונים ואברונים לא חיוניים כדי לספק אבני בניין לסינתזה של חלבונים חיוניים.
אוטופגיה ומחלות נוירודגנרטיביות
הקשר בין פגמים באוטופגיה למחלות נוירודגנרטיביות נובע ממספר גורמים:
-
נוירונים הם תאים פוסט-מיטוטיים: בניגוד לרוב תאי הגוף, נוירונים בוגרים אינם מתחלקים. הם חייבים לתפקד לאורך כל חיי האורגניזם ולכן תלויים במיוחד במנגנוני ניקוי יעילים.
-
הצטברות צברי חלבונים: במחלות כמו אלצהיימר ופרקינסון, נוצרים צברי חלבונים (פלאקים של בטא-עמילואיד, גופיפי לואי) שרק אוטופגיה יכולה לסלק.
-
נזק מצטבר: פגיעה חלקית באוטופגיה גורמת להצטברות איטית של נזקים. התסמינים הקליניים מופיעים רק לאחר שכ-50% מהנוירונים באזור מסוים מתו - עדות לכושר הפיצוי המרשים של המוח.
מחלות אוטופגיה ומעי
מחקרים עדכניים מצביעים על קשר בין פגמים באוטופגיה למחלות מעי דלקתיות. תאי פאנת (Paneth cells) במעי, האחראים להפרשת פפטידים אנטי-מיקרוביאליים, משתמשים באוטופגיה גם כמנגנון הפרשה חלופי כאשר מסלול הגולג׳י נפגע על ידי פתוגנים. פגיעה ביכולת זו עלולה לתרום להתפתחות מחלות כמו קרוהן.
סיכום: רשת משולבת של מסלולי הובלה
מערכת האנדוציטוזה, הליזוזומים והאוטופגיה יוצרות רשת משולבת המאפשרת לתא לקלוט חומרים מהסביבה, למחזר מרכיבים פנימיים, ולשמור על הומאוסטזיס. ההבנה המעמיקה של מנגנונים אלה חיונית להבנת פתולוגיות רבות ולפיתוח טיפולים חדשניים למחלות ניווניות, מטבוליות ודלקתיות.
שיעור 18 - שעתוק ועיבוד RNA - מהגנום לחלבון
תאריך: 09/06/2025חזקים בשעתוק?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא: הקשר בין מבנה לתפקוד
אנחנו ממשיכים להסתכל על התפקוד של התא דרך הבנה של המבנה. מבנה קובע תפקוד, ותפקוד יכול להשפיע על מבנה - זהו עיקרון מרכזי בביולוגיה של התא.
בשיעורים הקודמים התמקדנו בגרעין - אחד האברונים הגדולים והבולטים ביותר בתא. הגרעין הוא ה”בית” של הגנום, והתפקיד הראשוני והחשוב ביותר של מעטפת הגרעין וכל הקומפוננטים שבתוכו הוא לשמור על הגנום שלנו. שינויים בגנום יכולים לגרום למחלות, ולכן ההגנה עליו קריטית.
ארגון הגרעין והכרומטין
בגרעין באינטרפייז (מצב של אי-חלוקה) ניתן להבדיל מספר מרכיבים חשובים:
מעטפת הגרעין משמשת כ”כיפת ברזל” או “כיפת דוד” - שכבת הגנה נוספת מפני נזקים כמו ROS (Reactive Oxygen Species) שיכולים להיווצר במיטוכונדריה ולפגוע בגנום. אך למעטפת יש תפקיד נוסף: היא קובעת את המיקום של ההטרוכרומטין (כרומטין דחוס) וכך משפיעה על הנגישות לגנום. המיקום והפטרן של ההטרוכרומטין שונים בין תאים שונים, מה שקובע אילו גנים יהיו נגישים לביטוי.
הבחנה בין מצבי התא: באינטרפייז הכרומטין מפוזר, אך בחלוקה הכרומוזומים דחוסים מאוד ונקראים כרומטידים. במצב דחוס זה אפשר לראותם במיקרוסקופ ואפילו למיין אותם לפי צורתם. בשיטות ציטוגנטיות מתקדמות, כל כרומוזום נצבע בצבע ייחודי, מה שמאפשר לזהות טרנסלוקציות ושבירות כרומוזומליות.
הגנום האנושי: מספרים ופרדוקסים
הגנום האנושי מכיל כ-6 מיליארד זוגות בסיסים (בתא דיפלואידי), אך רק כ-1.5% מהגנום מקודד לחלבונים - כ-21,000 גנים בלבד. זהו פרדוקס מרתק: איך אנחנו מסתדרים עם מספר גנים הדומה לזה של תולעים קטנות או זבובי דרוזופילה? התשובה טמונה במנגנונים מתוחכמים של ויסות ועיבוד שנלמד עליהם.
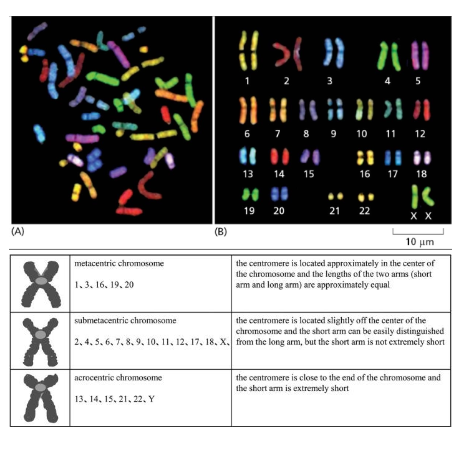
כרומוזומי המין והמחלות הקשורות
מתוך 46 הכרומוזומים האנושיים, 44 הם אוטוזומים (כרומוזומים רגילים) ו-2 הם כרומוזומי מין:
- בנות: XX
- בנים: XY
הגן SRY (Sex-determining Region Y) בכרומוזום Y קובע התפתחות של שכים במקום שחלות, ובכך קובע את מין העובר.
ההבדל במספר הגנים:
- כרומוזום X: כמעט 900 גנים מקודדי חלבון
- כרומוזום Y: רק 64 גנים
הגן דיסטרופין - חשיבות קלינית
דיסטרופין הוא אחד הגנים הגדולים ביותר בגנום האנושי, ממוקם על כרומוזום X. “תזכרו את הגן הזה, נחזור אליו בהמשך.” הגן מקודד לחלבון הנקשר לציטוסקלטון של תאי השריר ומגן עליהם מפני נזקי ROS שנוצרים במהלך פעילות גופנית אינטנסיבית.
מוטציות בגן גורמות למחלות קשות (מסומנים בתמונה באדום):
- Duchenne Muscular Dystrophy
- Becker Muscular Dystrophy
בהיעדר החלבון התקין, סיבי השריר מתפרקים, והחולים סובלים מחולשת שרירים פרוגרסיבית - “לא יכולים לנשום, לא יכולים להתפתח”. המחלות שכיחות יותר בבנים מכיוון שיש להם עותק יחיד של כרומוזום X, בעוד שלבנות יש שני עותקים והסיכוי למוטציה בשני האללים קטן מאוד.
Dystrophin:
- around 3000 kB DNA
- 79 exons (0.6% DNA sequence)
- 14 kB mRNA
- 427 kDa protein
- Protects muscle fibers from breaking down when exposed to stress/enzymes.
- Localizes in skeletal muscle to the cytoplasmic surface of the sarcolemma (muscle fiber membrane) to provide a link between cytoskeletal actin and extracellular matrix.
- Mutations lead in boys to X-linked recessive (congenital) muscular dystrophy (e.g. Duchene muscular dystrophy or Becker muscular dystrophy).
נושא השיעור - יצירת חלבונים
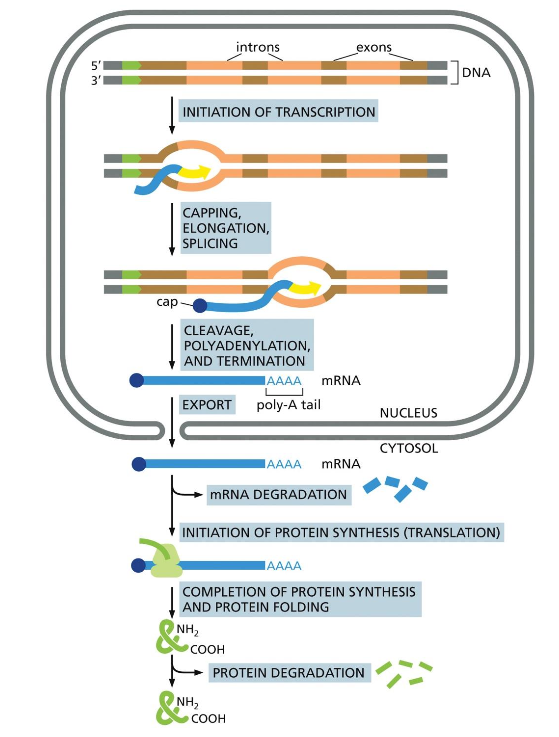
המולקולות הבסיסיות: DNA ו-RNA
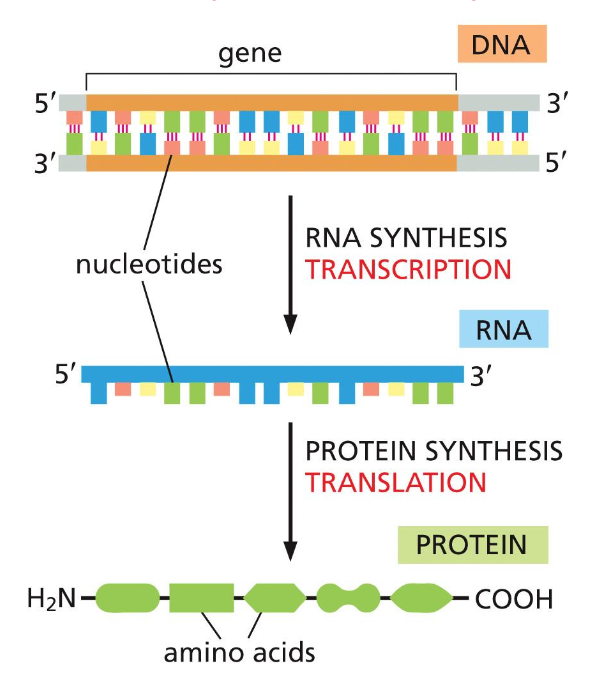
מבנה ה-DNA
DNA הוא פולימר של נוקלאוטידים. כל נוקלאוטיד בנוי מ:
- בסיס חנקני: אדנין (A), גואנין (G), תימין (T), ציטוזין (C)
- סוכר: דאוקסיריבוז
- קבוצת פוספט
הבחנה חשובה במינוח:
- בסיס בלבד: אדנין, גואנין, תימין, ציטוזין
- נוקלאוזיד (בסיס + סוכר): אדנוזין, גואנוזין, תימידין, ציטידין
- נוקלאוטיד (בסיס + סוכר + פוספט): היחידה המלאה
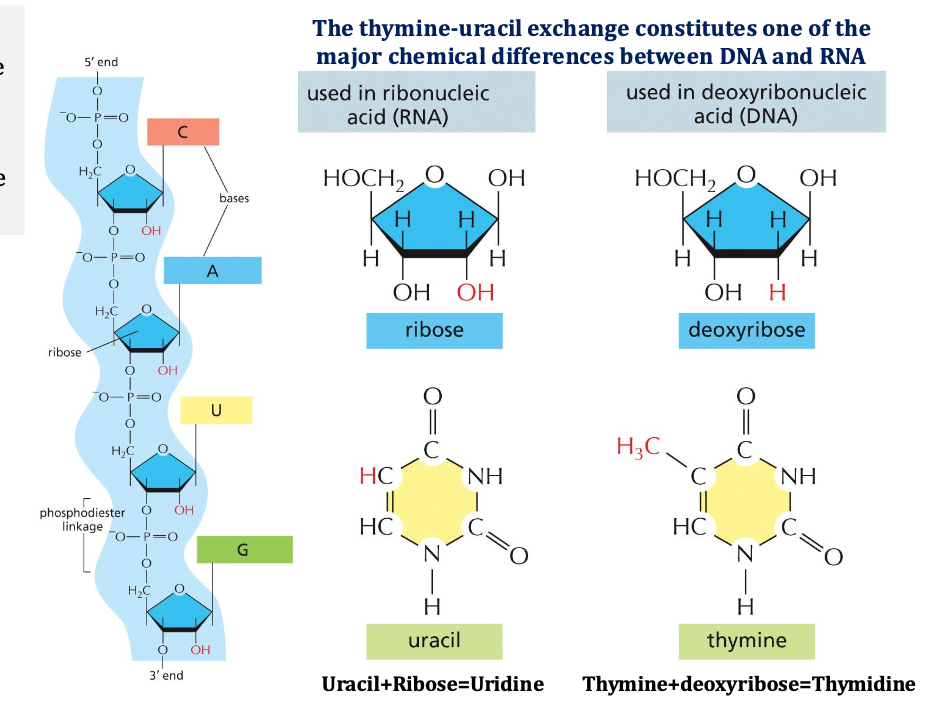
ביטוי של גנים
ההבדלים בין DNA ל-RNA
- מבנה: DNA דו-גדילי, RNA חד-גדילי (עם חריגים חשובים!)
- הבסיסים: במקום תימין ב-DNA, יש אורציל (U) ב-RNA
- הסוכר: ריבוז ב-RNA במקום דאוקסיריבוז ב-DNA - “יש כאן הידרוקסיל אחד נוסף”
ההבדלים הללו מאפשרים מגוון גנומי במהלך האבולוציה, אך גם יוצרים סכנות פוטנציאליות.
Uracil can also be found in DNA (!!)
- spontaneous (hydrolytic) deamination of cytosine; It is estimated that between 100 and 500 uracil residues per day, per cell, may be introduced into DNA as a result of this process.
- AID (activation-induced cytosine deaminase)- mediated DNA mutations.
- Uracil in DNA is also produced by the incorporation of dUMP during DNA replication.
נזקים ל-DNA - מוטציות
דאמינציה - המקור העיקרי למוטציות
דאמינציה היא איבוד קבוצת אמין מהבסיסים החנקניים. התהליך יכול להתרחש:
- ספונטנית - קורה באופן טבעי
- מוגברת על ידי חומרים טוקסיים - פורמלדהיד, בנזופירן, זיהום סביבתי
הסוגים העיקריים:
-
ציטוזין ← אורציל: השינוי הנפוץ ביותר. אורציל מזדווג עם אדנין במקום גואנין, וכך נוצרת מוטציה C:G ← T:A
דה-אמינציה של ציטוזין בתא מובילה להיווצרות אורציל, שהוא בסיס דומה מאוד לטימין, אך מופיע ברנ”א ולא בדנ”א. אם שינוי זה לא מתוקן, בעת השכפול הבא האנזימים מתייחסים לאורציל כאל טימין, והוא מזדווג עם אדנין במקום גואנין. לכן, במקום זוג בסיסים תקין C:G, מתקבל זוג מוטנטי U:A, שמתורגם בסופו של דבר לזוג T:A — כלומר מוטציית החלפת בסיס מסוג טרנזישן (transition).
- אדנין ← היפוקסנטין: היפוקסנטין מזדווג עם ציטוזין, יוצר מוטציה A:T ← G:C
- גואנין ← קסנטין: משנה את דפוס הזיווג
- 5-מתילציטוזין ← תימין: מוטציה בעייתית במיוחד
התדירות מדהימה: בכל אחד מ-37 טריליון התאים בגופנו מתרחשים 500-100 אירועי דאמינציה מדי יום!
מנגנוני ההגנה - “איך אנחנו לא מוטנטים שנראים כמו איירון מן?”
התא מצויד במערכת תיקון מתוחכמת:
DNA גליקוזילאזות - אנזימים המזהים בסיסים פגומים ומחליפים אותם. “זה כמו החלפת חלקי חילוף במכונית… הוא מחליף לך את החלק החשוב מאוד.”
המנגנון העיקרי נקרא BER (Base Excision Repair) - חיתוך הבסיס הפגום והחלפתו בבסיס תקין.
DNA glycosylases play a key role in the elimination of such DNA lesions (BER): they recognize and excise damaged bases, thereby initiating a repair process that restores the regular DNA structure with high accuracy (e.g., uracil-DNA glycosylase). If not -> C:G in parental DNA can be changed into a T:A pair in the daughter DNA molecule.
Nonsense-mediated decay - מנגנון נוסף המזהה mRNA עם קודוני עצירה מוקדמים ומפרק אותם.
חשיפה לזיהום סביבתי מגבירה את קצב המוטציות, וזו הסיבה לקשר בין זיהום לסרטן - “מחלה שקשורה להצטברות מוטציות.”
“בביולוגיה הרבה מאוד BUT”
למרות ש-RNA מוגדר כחד-גדילי, במציאות נמצאות מולקולות RNA כפולות-גדיל במצבים רבים:
- זיהום ויראלי
- ביטוי של רטרו-אלמנטים (טרנספוזונים)
- שחרור DNA מיטוכונדריאלי לציטופלזמה בעקבות נזק
- מבנים משניים של RNA עצמו דרך זיווג תוך-מולקולרי
מולקולות אלה חשובות לזיהוי על ידי מערכת החיסון.
בסיסים לא קונבנציונליים
משפחת מולקולות ה-RNA
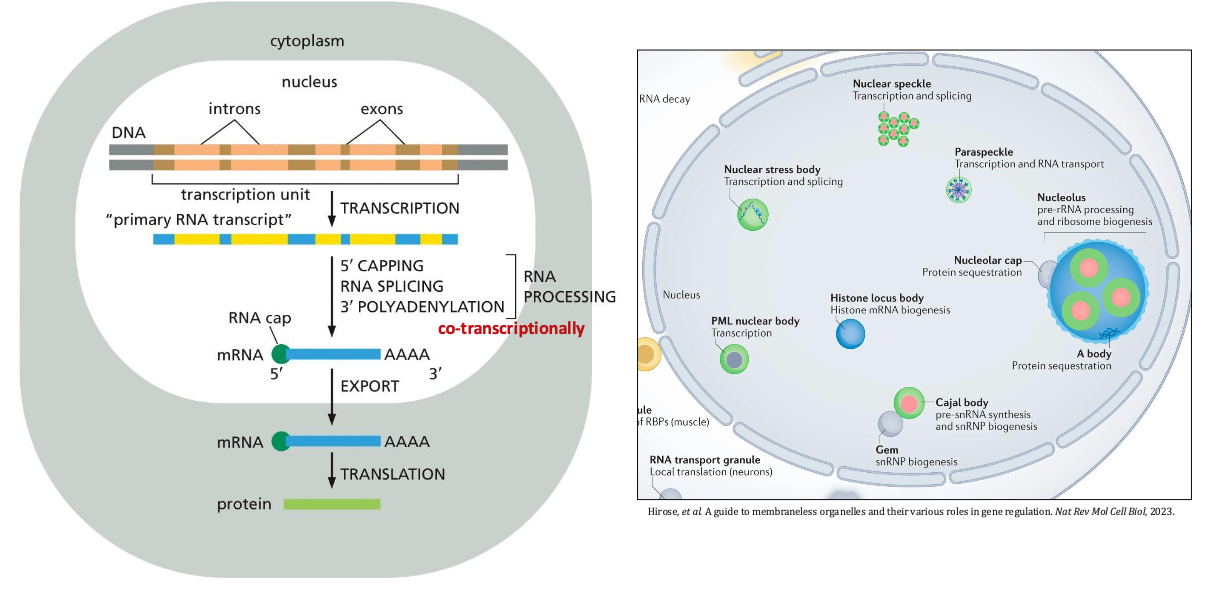
RNA מקודד לחלבון
mRNA (messenger RNA) - מהווה רק 1.5% מכלל ה-RNA המשועתק, אך חיוני לתרגום חלבונים.
RNA לא-מקודד (80% מה-RNA)
- rRNA (ribosomal RNA) - “בונים את התת-יחידות של ריבוזום… לא עוברים תרגום אבל משתתפים בתרגום”
- tRNA (transfer RNA) - “מביאים חומצות אמינו” - מולקולות קטנות הנושאות חומצות אמינו לריבוזום
- snRNA (small nuclear RNA) - עוזרים בשעתוק ועריכה של mRNA
- snoRNA (small nucleolar RNA) - מעורבים בעיבוד rRNA
- lncRNA (long non-coding RNA) - כולל כאלה המשועתקים מטרנספוזונים
- miRNA ו-siRNA - יכולים לגרום לחיתוך ודגרדציה של mRNA, משתתפים בוויסות ביטוי גנים
הנקודה החשובה: “רוב ה-RNAs לא עוברים תרגום, לא מקודדים לחלבון, אבל יש להם תפקיד חשוב!”
מנגנון השעתוק
RNA פולימראז - המכונה המולקולרית
RNA פולימראז הוא “קומפלקס מאוד גדול של לפחות 10 חלבונים ביחד”, לא אנזים בודד.
שלושה סוגים באוקריוטים:
- RNA Pol I - משעתק גנים של rRNA (למעט 5S rRNA)
- RNA Pol II - משעתק את כל הגנים של מסוג mRNA, רוב ה-snRNA, miRNA ו-lncRNA
- RNA Pol III - משעתק גנים של tRNA ו-5S rRNA
| סוג ה-RNA | תפקיד |
|---|---|
| mRNA | מעביר מידע גנטי מה-DNA לריבוזום |
| rRNA | מרכיב את הריבוזום |
| tRNA | מביא חומצות אמינו לריבוזום |
| snRNA | משתתף בשעתוק ועריכה של mRNA |
| snoRNA | מעורב בעיבוד rRNA |
| lncRNA | כולל RNA ארוך שאינו מקודד, מעורב בוויסות גנים |
| RNA Pol I | RNA Pol II | RNA Pol III |
|---|---|---|
| משעתק rRNA (למעט 5S) | משעתק mRNA, snRNA, miRNA, lncRNA | משעתק tRNA, 5S rRNA |
כיצד מתבצע השעתוק?
שאלת מפתח: “מאיזה צד בדיוק מגיעה הסינתזה?” התשובה: “אתה לא יכול לגשת לנוקלאוטידים מבחוץ, יש שם סוכר… כדי ש-RNA יסונתז, ה-DNA צריך להיפתח.”
שלבי השעתוק - מ-DNA ל-RNA
- אנזים הליקאז פותח את סליל הדנ”א הדו-גדילי באזור הפרומוטור (לא תמיד, לעיתים RNA פולימראז עושה זאת בעצמו בפרוקריוטים).
- RNA פולימראז נקשר לפרומוטור (באמצעות פקטורי תעתוק באאוקריוטים), ופותח את הסליל במידה הדרושה.
- הוא מתחיל את סינתזת ה־RNA על־פי תבנית הדנ”א (הגדיל הלא-מקודד).
- קצב הסינתזה: כ-10–30 נוקלאוטידים בשנייה באאוקריוטים, מהיר יותר בפרוקריוטים.
- כיוון הסינתזה: תמיד 5’ ל-3’, כי נוקלאוטידים חדשים מתחברים לקצה ה־3’ של השרשרת המתארכת. (הכיוון של השעתוק ביחס לגן משתנה, אך כיוון הסינתזה תמיד זהה).
- “RNA תמיד גדל מהקצה 5’ לקצה 3’“
- “תמיד יש אנטי-פרלליות בין התבנית לגדיל החדש”
לגן של 1000 נוקלאוטידים יידרשו כ-4-3 דקות לשעתוק מלא.
בקרת השעתוק - מערכת מורכבת
RNA פולימראז זקוק לTranscription Factors שמביאים אותו למקום הנכון ובזמן הנכון.
המערכת כוללת:
- Enhancers - אלמנטים רגולטוריים המגייסים mediators
- Mediators - מתווכים בין enhancers ל-RNA פולימראז
- Chromatin remodeling complexes - מסירים או מזיזים נוקלאוזומים כדי לחשוף את ה-DNA
- Promoter - “ממש בתחילת הגן, לפני הסטארט קודון של השעתוק” - המקום שבו RNA פולימראז מתיישב
הארגון התלת-ממדי של הכרומטין מאפשר לאנהנסרים רחוקים להשפיע על גנים דרך יצירת לולאות DNA.
עיבוד RNA - תהליכים מקבילים לשעתוק
בתאים אוקריוטיים, כל mRNA חייב לעבור שלושה תהליכי עיבוד עיקריים. תהליכים אלה מתרחשים “co-transcriptionally” - במקביל לשעתוק.
מבנה הגן האוקריוטי
גנים אוקריוטיים מורכבים מ:
- אקזונים - אזורים המקודדים לחלבון
- אינטרונים - אזורים מפרידים שאינם מקודדים (Introns)
כל ה-DNA משועתק, כולל האינטרונים, אך רק האקזונים יופיעו ב-mRNA הבוגר.
Capping - הוספת “כובע” מגן
“קייפינג זה תהליך של הצמדה לנוקלאוטיד הראשון… מתיל גואנזין.”
מה כולל התהליך:
- הוספת 7-methylguanosine דרך קשר טריפוספטי ייחודי (5’-5’)
- מתילציה של הסוכר בנוקלאוטיד הראשון (ולעתים השני)
תפקידי ה-Cap:
- מאפשר לריבוזום לזהות את ה-mRNA
- הגנה מפני פירוק אנזימטי
- סימון למערכת החיסון - “self vs non-self”
- ייצוב המבנה התלת-ממדי
- חיוני ליצוא מהגרעין לציטופלזמה
- מאפשר לחלבונים לזהות “הנה mRNA שאני צריך לקחת החוצה”
Splicing - חיבור האקזונים
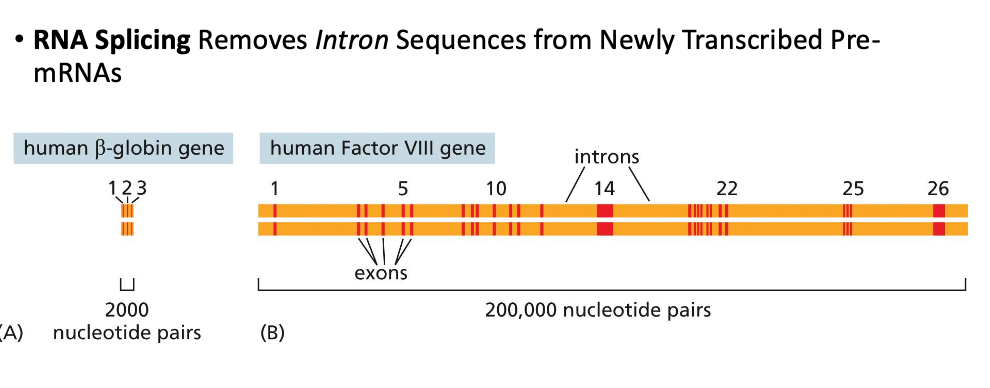
התהליך: “להוציא אינטרונים ולחבר בין אקזונים.”
דוגמאות למורכבות:
- גן β-globin: 3 אקזונים בלבד
- גן Factor VIII: 26 אקזונים
מה קורה לאינטרונים? “הם מפורקים לנוקלאוטידים… חוזרים למאגר.” זה חשוב כי לתהליכי שעתוק, תיקון ושכפול נדרש מאגר זמין של נוקלאוטידים.
טעויות בשחבור גורמות למחלות רבות, במיוחד נוירודגנרטיביות, כאשר אינטרונים נשארים בטעות או אקזונים מדולגים, ונוצר “חלבון מוטנטי”.
![מאת Courtesy: National Human Genome Research Institute - [1] (file), נחלת הכלל, https://commons.wikimedia.org/w/index.php?curid=212144](/biology/image-230.png)
Polyadenylation - הוספת “זנב” מגן
הוספת כ-250-200 אדנינים בקצה 3’ של ה-mRNA.
תפקידים:
- הגנה מפני פירוק מהקצה
- סיגנל חיוני לאקספורט מהגרעין
- השפעה על יציבות ה-mRNA
- מאפשר תרגום יעיל
אזורי UTR
ב-mRNA הבוגר יש אזורים שאינם מתורגמים:
- 5’ UTR - האזור שלפני קודון ההתחלה (AUG)
- 3’ UTR - האזור שאחרי קודון העצירה
- רצף קוזאק - רצף מיוחד המסמן לריבוזום איפה להתחיל תרגום
הריבוזום מתרגם רק את האזור בין קודון ההתחלה לקודון העצירה, אך אזורי ה-UTR חיוניים לוויסות ויציבות.
הבדלים אבולוציוניים
פרוקריוטים (חיידקים)
- ללא capping
- ללא splicing (הגנים רציפים)
- ללא polyadenylation
- שעתוק ותרגום מתרחשים בו-זמנית
מיטוכונדריה
“כמעט אין שם capping, אין splicing, אבל יש polyadenylation.”
הדמיון לפרוקריוטים תומך בתיאוריה האנדוסימביוטית למקור המיטוכונדריה.
אברונים גרעיניים ותפקידם
Nuclear bodies הם “condensates של מולקולות שיכולות לזוז ממקום למקום, להתחבר או לעשות dissociation.” הם מכילים ריכוזים גבוהים של חלבונים ו-RNA המעורבים בתהליכי העיבוד, במיוחד small nuclear RNA שעוזרים בשחבור ועיבוד.
חשיבות קריטית של התהליכים
“זה הבסיס. אם תפספסו את זה, יהיה לכם נורא נורא קשה.”
כל mRNA שנוצר בתאים אוקריוטיים חייב לעבור RNA processing מלא. בלי התהליכים האלה - capping, splicing ו-polyadenylation - ה”mRNA ייצא פגום, mRNA פגום לא יתורגם לחלבון, בדרך כלל הוא עובר decay או פירוק.”
המורכבות של מערכת השעתוק והעיבוד היא שמאפשרת לגנום האנושי הקטן יחסית (21,000 גנים) ליצור את המגוון העצום של חלבונים ותפקודים הנדרשים לחיים מורכבים.
שיעור 19 - עיבוד RNA ותרגום חלבונים
תאריך: 11/06/2025חזקים ב-RNA וחלבונים?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
הבהרה מבואית: כיוון סינתזת חומצות הגרעין
לפני התעמקות בתהליכי עיבוד ה-RNA, הכרחי להבהיר עיקרון יסודי בביולוגיה מולקולרית. כל הפולימרזים המעורבים בסינתזת חומצות גרעין - RNA פולימרז I, II ו-III, וכן DNA פולימרז - מסנתזים תמיד בכיוון מ-5’ ל-3’. הסיבה לכך נעוצה במנגנון הפעולה של הפולימרזים: הם יכולים להוסיף נוקלאוטידים חדשים אך ורק לקצה 3’-OH של הנוקלאוטיד הקודם.
בהקשר זה, שני הגדילים של ה-DNA מקבלים שמות שמבוססים על הכיוון שלהם יחסית לכיוון השעתוק:
- גדיל Sense: גדיל ה-DNA המכוון מ-5’ ל-3’
- גדיל Antisense: הגדיל המשלים (קומפלמנטרי), המכוון מ-3’ ל-5’
מאחר שה-RNA פולימרז יכול לסנתז רק בכיוון 5’ ל-3’, השעתוק מתחיל תמיד מהגדיל Antisense, המשמש כתבנית (template) לסינתזת ה-RNA.
עיבוד mRNA: שלושה תהליכים מרכזיים
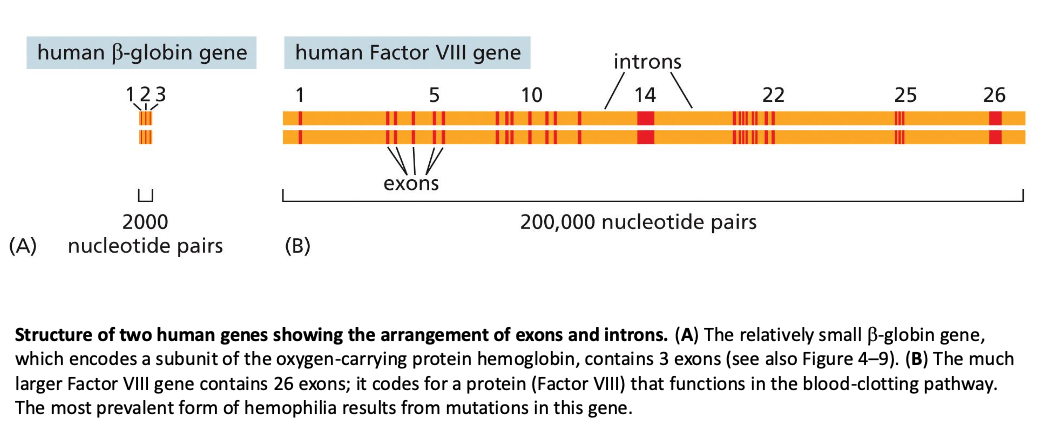
רקע כללי על עיבוד RNA
במהלך השעתוק בתאים איקריוטיים, ה-RNA החדש שנוצר אינו מוכן מיד לתרגום. התוצר
הראשוני, הנקרא pre-mRNA או precursor mRNA, שיוצא על האנטיסנס גדיל ה-DNA,
חייב לעבור שלושה תהליכי עיבוד (processing) מרכזיים המתרחשים כבר במהלך השעתוק עצמו, ולא רק לאחריו. תהליכים אלו הכרחיים להפיכת ה-pre-mRNA ל-mRNA בוגר (mature mRNA) ותפקודי.
התהליך הראשון: Capping - הוספת הכובע
התהליך הראשון הוא הוספת 7-methylguanosine cap לקצה 5’ של ה-RNA הנוצר. מודיפיקציה זו כוללת הוספת גואנין במהופך (במבנה 5’-5’ במקום 5’-3’ הרגיל) עם קבוצת מתיל על הנוקלאוטיד השני.
$\text{m}^7\text{G}$ -
7-methylguanosine cap
תפקידי ה-Capping:
- הגנה מפני פירוק: הכובע מגן על ה-mRNA מפני אקסונוקלאזות 5’ שמפרקות RNA לא מוגן
- זיהוי על ידי הריבוזום: הכובע משמש אתר זיהוי ספציפי לתת-היחידה הקטנה (40S) של הריבוזום
- הובלה מהגרעין: הכובע נדרש לטרנספורט יעיל דרך הנקבוביות הגרעיניות (nuclear pores)
- התחלת תרגום: הכובע מסמן את נקודת ההתחלה לסריקת הריבוזום
הכובע מתחיל להיווצר כאשר ה-RNA שנוצר עדיין קצר יחסית, מיד עם יציאתו מה-RNA פולימרז.
התהליך השני: Alternative Splicing - הסרת אינטרונים מה-mRNA
לתשומת ליבכם: החלק הבא כולל לא מעט חזרות מיותרות.
השלב השני כולל הסרת רצפים לא מקודדים (אינטרונים) וחיבור הרצפים המקודדים (אקסונים). התהליך מתבצע על ידי מכונת ה-spliceosome - קומפלקס ריבונוקלאופרוטאין מורכב המורכב מ-small nuclear RNAs (snRNAs) וחלבונים נלווים.
החלק המקודד נקרא אקסון (exon), והחלק הלא מקודד נקרא אינטרון (intron).
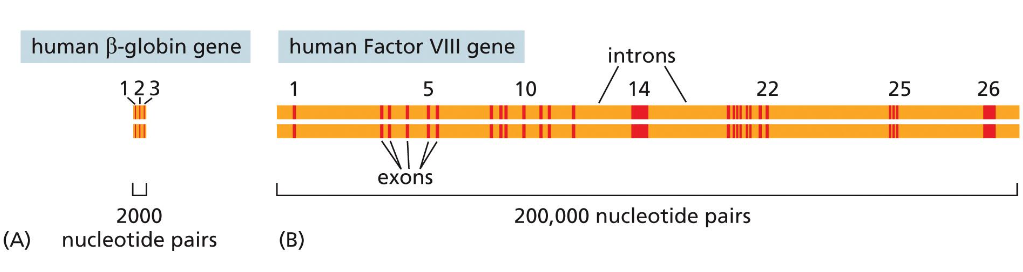
בתמונה, הקווים האדומים הם האקסונים. החיבור שלהם נדרש ליצירת RNA בשל.
זיהוי גבולות אקסון-אינטרון
השאלה שעולה היא איך מזהים איפה אקסון ואיפה אינטרון.
המידע שנדרש לכך מקודד בתוך ה-DNA - הזיהוי מתבצע על בסיס רצפים קונסרבטיביים (שמורים אבולוציונית):
- כל אקסון מסתיים ברצף A-G
- כל אינטרון מתחיל ברצף G-U ומסתיים ב-A-G
- קיימים רצפים נוספים בתוך האינטרון (כמו branch point sequence) המסמנים למכונת הספלייסינג את נקודות החיתוך המדויקות
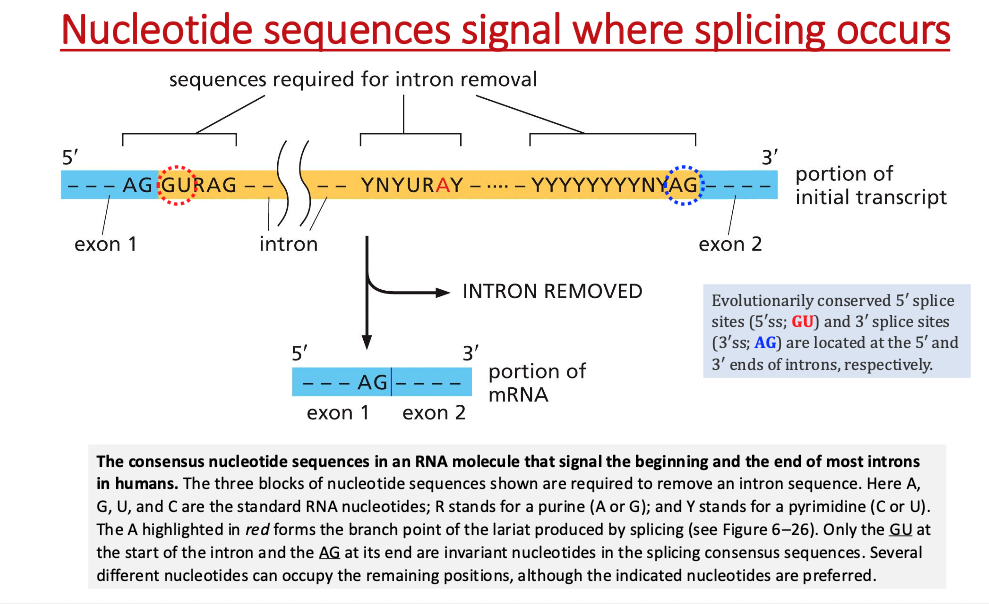
ראינו בשלב הזה סרטון שתיאר את פעולת ה-spliceosome ואת תהליך ה-splicing עצמו.
לא קריטי בשלב הזה לזכור את שמות החלבונים המרכיבים את ה-spliceosome, אלא להבין את העיקרון הכללי.
פגיעה בהוצאת האינטרונים משאירה חלבון מוטנטי שיכול לפגוע בתאים. __ סרטן.
השימור האבולוציונית הגבוהה של רצפי האינטרונים מעידה על חשיבותם הקריטית לתפקוד תקין של התא ולהישרדות האורגניזם. מתברר שבתוך האינטרונים יש רצפים שעוברים שיעתוק ויש להם חשיבות רגולטורית, כמו micro RNAs (miRNAs) (ראו בהמשך).
micro RNAs יודעים לזהות mRNAs פגומים, לקשור אותם ולמנוע מהם להתפרק. הם גם יכולים להכווין את ה-mRNA לפירוק על ידי אקסונוקלאזות. או לעצור תרגום.
בנוסף, הם מגוונים את הגנום האנושי ומאפשרים יצירת חלבונים שונים מאותו גן. כלומר חלבונים שונים עם רצפים דומים - איזופורם (isoform).
סוגי Splicing:
- Constitutive splicing: הסרה סטנדרטית של כל האינטרונים בצורה קבועה
- Alternative splicing: חיבורים חלופיים בין אקסונים שונים, מה שמאפשר יצירת תוצרים שונים מאותו גן
Alternative Splicing - מנגנון הגיוון החלבוני
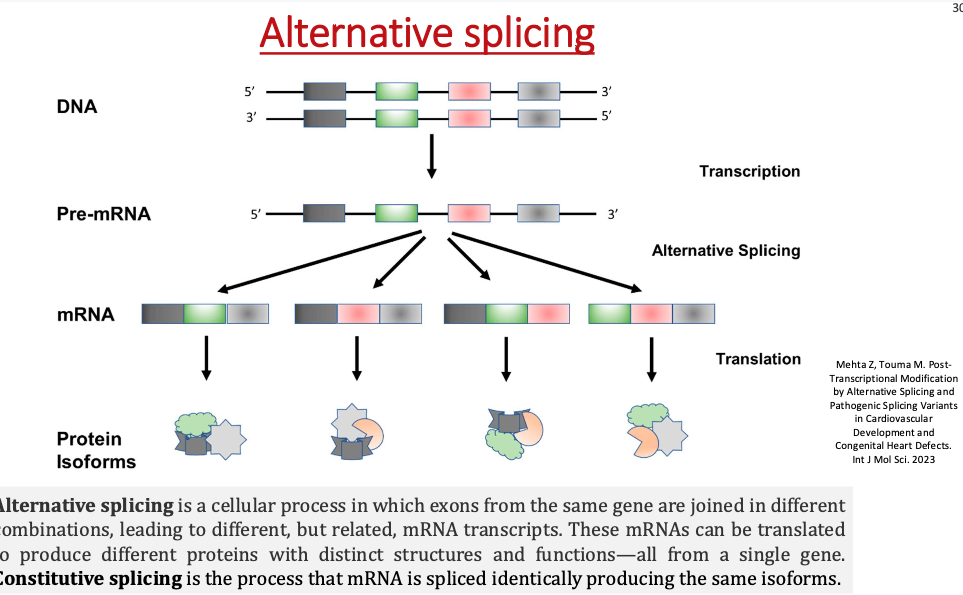
המשמעות הביולוגית והאבולוציונית
Alternative splicing מהווה מנגנון מרכזי להסבר הפרדוקס הגנומי: כיצד האדם, עם כ-21,000 גנים מקודדי חלבון בלבד - מספר דומה לזה של זבוב הפירות Drosophila melanogaster או התולעת Caenorhabditis elegans - מצליח לייצר פרוטיאום מורכב הרבה יותר של כ-300,000 חלבונים שונים או יותר.
נתונים כמותיים:
- כ-65% מהגנים האנושיים מכילים אקסונים מרובים ועוברים splicing
- מכ-21,000 גנים העוברים alternative splicing נוצרים כ-300,000 חלבונים שונים
- היחס אינו 1:1 (DNA→RNA→חלבון) אלא 1:רבים (DNA→RNAs מרובים→חלבונים מרובים)
הבסיס המנגנוני
בעוד constitutive splicing מסיר את כל האינטרונים ומחבר את כל האקסונים ברצף (1-2-3-4-5…), alternative splicing מאפשר:
- דילוג על אקסונים (exon skipping): חיבור אקסון 1 ישירות לאקסון 4, תוך דילוג על אקסונים 2-3
- שימוש באתרי splicing חלופיים: שימוש בנקודות חיתוך שונות באותו אקסון
- שמירת אינטרונים: במקרים מסוימים, אינטרון נשמר כחלק מה-mRNA הבוגר
- מודיפיקציות ב-UTRs: שינויים ב-5’ או 3’ UTR המשפיעים על זיהוי וויסות
איזופורמים וספציפיות רקמתית
הגדרת איזופורמים
איזופורמים הם חלבונים הנוצרים מאותו גן אך עם רצפים מעט שונים עקב alternative splicing. החלבונים הללו יכולים לשמר תפקודים בסיסיים משותפים אך לקבל תכונות ייחודיות לרקמה או לתא ספציפיים.
דוגמה: טרופומיוזין (tropomyosin)
טרופומיוזין הוא חלבון המייצב את סיבי האקטין ומבצע alternative splicing ספציפי לרקמה:
- בשריר מפוספף (שלד): איזופורם המתאים לתנועה מהירה ולכיווץ רצוני
- בשריר חלק: איזופורם המותאם לכיווץ איטי ומתמשך
- בפיברובלסטים: איזופורם המיועד לתחזוקת מבנה התא
- במוח ובנוירונים: איזופורם המסייע לארגון הציטוסקלטון בדנדריטים ואקסונים, חיוני לתפקוד הסינפסות
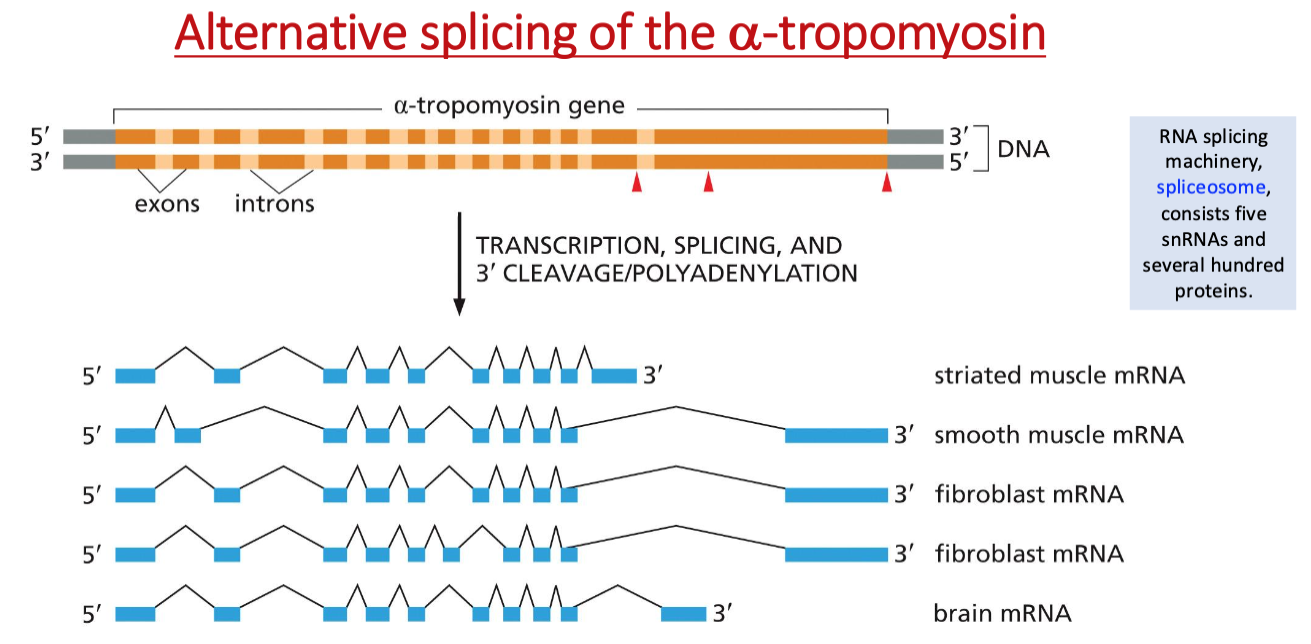
דוגמאות קליניות מרכזיות
פרוגריה (Hutchinson-Gilford Progeria Syndrome)
פרוגריה היא מחלה נדירה שנגרמת על ידי מוטציה דה-נובו (חדשה, לא מתורשת) המשפיעה על הספלייסינג של הגן LMNA. הגן מקודד לחלבונים המארגנים את מעטפת הגרעין ואת מבנה הכרומטין. המוטציה גורמת לספלייסינג לא תקין:
- במקום חיבור תקין של אקסונים 1-2-3-4-5, נוצר חיבור חריג כמו 1-3-5-11
- התוצר הוא חלבון פגום המשבש את מבנה הגרעין
- התוצאה: זדקנות מוקדמת דרמטית - ילדים בני 10-9 נראים כבני 80
דיסטרופין - הגן הגדול ביותר
הגן הגדול ביותר בגנום האנושי עובר alternative splicing נרחב:
- ברקמת השריר בלבד: 12 איזופורמים שונים
- כל איזופורם בעל תפקוד מעט שונה מהאחר
- מוטציות גורמות למחלות שריר קשות כמו Duchenne (דושן) ו-Becker muscular dystrophy
- המחלות פוגעות בעיקר בבנים (הגן נמצא על כרומוזום X)
הוויסות של Alternative Splicing
גורמים שמשפיעים על הספלייסינג:
- מבנה הכרומטין: ארגון שונה של הכרומטין ברקמות שונות משפיע על נגישות למכונת הספלייסינג
- רמות ביטוי של splicing factors: רקמות שונות מבטאות רמות שונות של חלבונים המכווינים את הספלייסינג
- מודיפיקציות אפיגנטיות: מתילציות ואצטילציות המשפיעות על הביטוי והספלייסינג
התהליך עדיין נחקר אך ברור שמדובר בשילוב של גורמים גנטיים, אפיגנטיים וסביבתיים הפועלים יחד.
מיקרו-RNAs וויסות גנים פוסט-טרנסקריפציוני
תפקיד האינטרונים החבוי
אחד הגילויים המרכזיים בעשורים האחרונים היה שאינטרונים אינם “זבל גנטי” כפי שנחשבו בעבר. במקום זאת, הם מכילים רצפים קודדים חשובים למיקרו-RNAs (miRNAs) ו-small nuclear RNAs (snRNAs).
תהליך יצירת miRNAs
- שעתוק: האינטרונים עוברים שעתוק יחד עם שאר הגן
- עיבוד: לאחר הספלייסינג, רצפים ספציפיים באינטרון מעובדים ל-miRNAs
- פירוק חלקי: בעוד רוב האינטרון מתפרק, חלקים ספציפיים נשמרים כmiRNAs פעילים
תפקידי miRNAs
- זיהוי mRNAs פגומים: קישור לרצפים משלימים ב-mRNAs שעברו נזק או שגיאות
- עיכוב תרגום: מניעת גישת הריבוזום ל-mRNA פגום
- הפניה לפירוק: הכוונת mRNAs לא תקינים למנגנוני הפירוק התאיים (degradation)
מנגנון זה מהווה רובד בטיחות חשוב המונע ייצור חלבונים פגומים שעלולים לפגוע בתא או אפילו להוביל למותו.
המשמעות האבולוציונית
השימור האבולוציוני של מערכת ה-miRNAs מעיד על חשיבותה. מערכת זו מאפשרת:
- בקרת איכות: ווידוא שרק mRNAs תקינים מתורגמים
- ויסות דינמי: התאמת רמות החלבונים לצרכי התא
- תגובה למתח: זיהוי מהיר של mRNAs שניזוקו במצבי לחץ
התהליך השלישי: Polyadenylation - הוספת זנב הפולי-A
השלב השלישי כולל הוספת רצף של כ-250 נוקלאוטידי אדנין (פוליאדינין) לקצה 3’ של ה-mRNA. תהליך זה נקרא polyadenylation ומתבצע על ידי אנזימי polyadenylation ספציפיים.
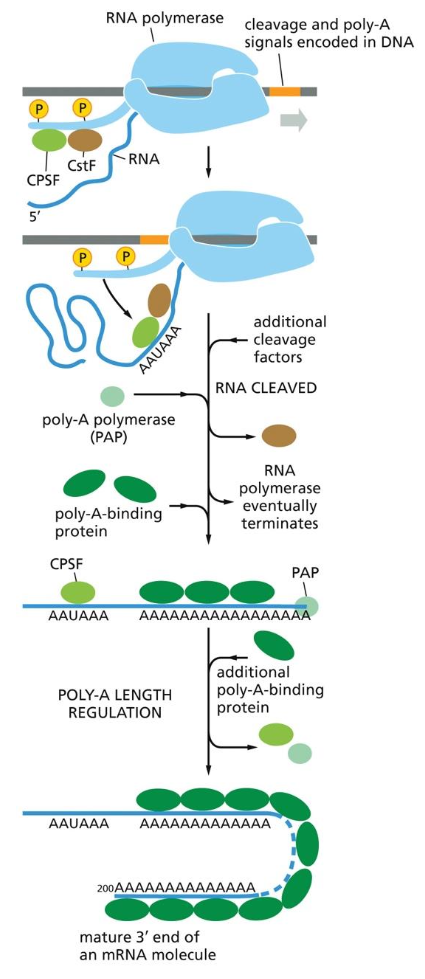
תפקידי ה-Polyadenylation:
- סימן לסיום השעתוק: מסמן ל-RNA פולימרז להשתחרר מה-DNA ולסיים את השעתוק
- יציבות ה-mRNA: הזנב מגן מפני פירוק על ידי 3’ אקסונוקלאזות
- קבלת מבנה תלת-ממדי: מאפשר יצירת מבנה מקופל יציב המסייע לטרנספורט יעיל
- זיהוי על ידי הריבוזום: הזנב נדרש לזיהוי יעיל על ידי חלבוני עזר וליצירת קומפלקס התרגום
- ווסות זמן חיים: אורך הזנב משפיע על יציבות ה-mRNA וזמן החיים שלו
ציור מסכם של שלבי העיבוד ה-mRNA:
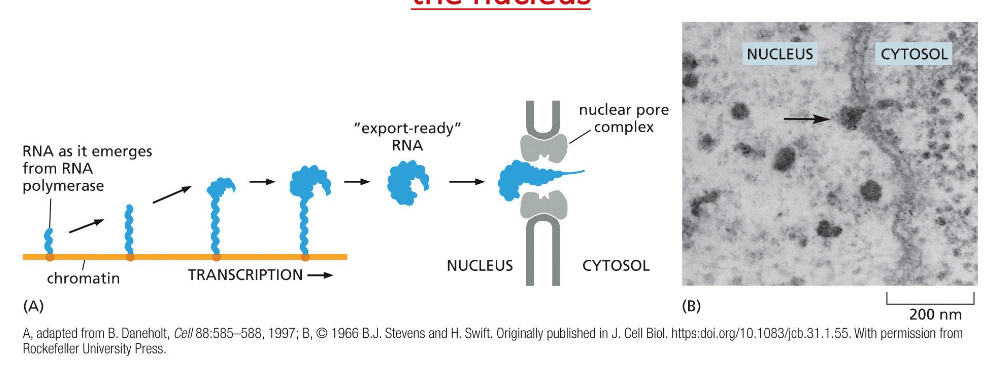
ריבוזומל RNA וביוגנזת הריבוזום (rRNAs)
ארגון הגנים והגרעינון
גנים המקודדים ל-rRNA מפוזרים בחמישה כרומוזומים שונים (13, 14, 15, 21, ו-22) אך מתארגנים יחד פיזית בתוך הגרעינון (nucleolus). ארגון מרחבי זה אינו מקרי - הוא מאפשר ייצור יעיל ומהיר של רכיבי הריבוזום על ידי ריכוז כל המשאבים הנדרשים במקום אחד.
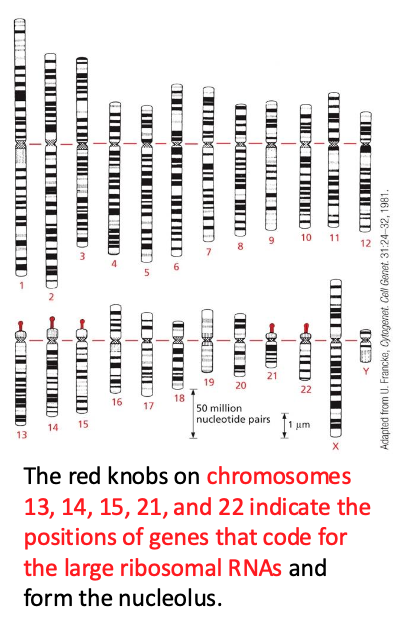
מבנה הגרעינון (nucleolus) - בית חרושת לריבוזומים
הגרעינון מורכב משלושה תת-מבנים מרכזיים:
- Fibrillar Center: אתר השעתוק הפעיל של גנים שמקודדים ל-rRNA
- Dense Fibrillar Component: אזור העיבוד והמודיפיקציות של ה-rRNA
- Granular Component: אתר ההרכבה הראשונית של תת-יחידות הריבוזום
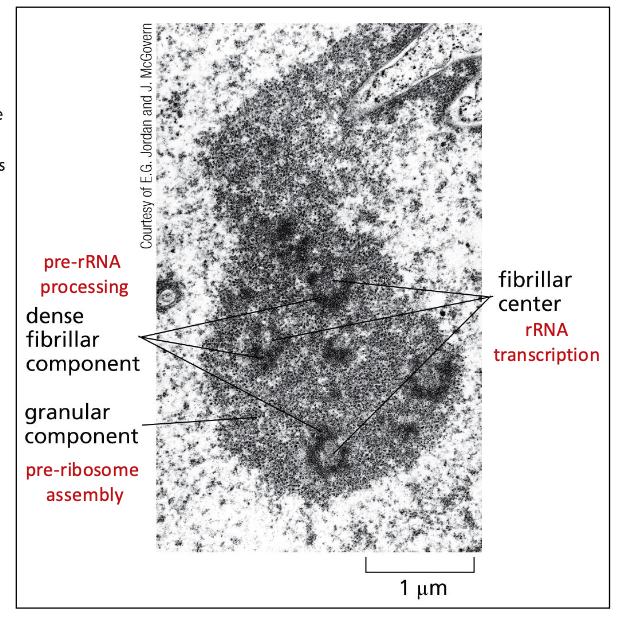
תהליך הביוגנזה המפורט
שעתוק ראשוני
שלושה מארבעת סוגי ה-rRNA (18S, 5.8S, 28S) מסונתזים כמולקולת precursor אחת גדולה (45S pre-rRNA, כ-13,000 נוקלאוטידים) על ידי RNA פולימרז I. ה-rRNA הרביעי (5S) מסונתז בנפרד על ידי RNA פולימרז III.
עיבוד ומודיפיקציות
התהליך כולל מודיפיקציות כימיות מורכבות:
- מתילציות: הוספת קבוצות מתיל לנוקלאוטידים ספציפיים (בעיקר על הריבוז)
- איזומריזציות: המרת אורידין לפסאודואורידין במיקומים מדויקים
- חיתוך מדויק: הפרדה לתת-יחידות בגדלים שונים על ידי אנדונוקלאזות ספציפיות
תפקיד ה-snoRNAs
small nucleolar RNAs מכווינים את תהליכי העיבוד:
- זיהוי אתרים: קישור לרצפים משלימים ב-pre-rRNA
- גיוס אנזימים: הבאת האנזימים המתאימים למיקום המדויק
- הבטחת דייקנות: ווידוא שהמודיפיקציות מתרחשות במיקומים הנכונים בלבד
הרכבת הריבוזום
התהליך מתרחש בשלבים מדורגים:
- עיבוד בגרעינון: מודיפיקציות וחיתוך ראשוני ב-fibrillar ו-dense fibrillar components
- הרכבה חלקית: חיבור עם חלבונים ריבוזומליים יבואים מהציטופלזמה
- יצירת “90S particle”: קומפלקס ביניים גדול הכולל את כל הרכיבים
- large subunit (60S) ו-small subunit (40S) עדיין לא מופרדים
- פיצול לתת-יחידות: חלוקה לתת-יחידה גדולה (~66S) וקטנה (~45S)
- small subunit (40S) מורכבת מ-18S rRNA ו-30 חלבונים
- יצוא לציטופלזמה: מעבר נפרד דרך הנקבוביות הגרעיניות (הגודל הגדול מונע יצוא יחד)
- הרכבה סופית: השלמת המבנה התלת-ממדי והבשלה לתת-יחידות 60S ו-40S
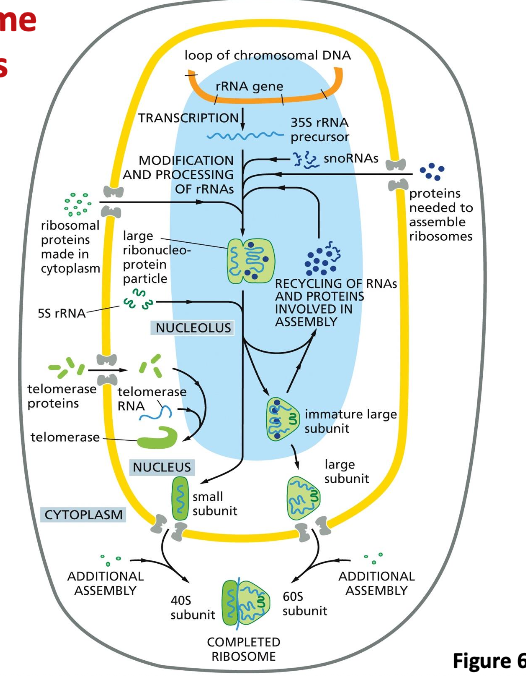
למה תת-יחידות נפרדות?
הנקבוביות הגרעיניות (תעלות ה- nuclear pore) קטנות מדי לאפשר מעבר של ריבוזום שלם. לכן התא פיתח מנגנון של פירוק והרכבה מחדש.
מבנה הריבוזום הבוגר (השלם) ופרס נובל
הריבוזום האיקריוטי השלם (Mammalian Ribosome) (80S) מורכב מ:
- תת-יחידה גדולה (60S): 28S, 5.8S, ו-5S rRNA עם כ-50 חלבונים
- תת-יחידה קטנה (40S): 18S rRNA עם כ-30 חלבונים
הריבוזום הוא שילוב (קומפלקס) של חלבונים ו-rRNA
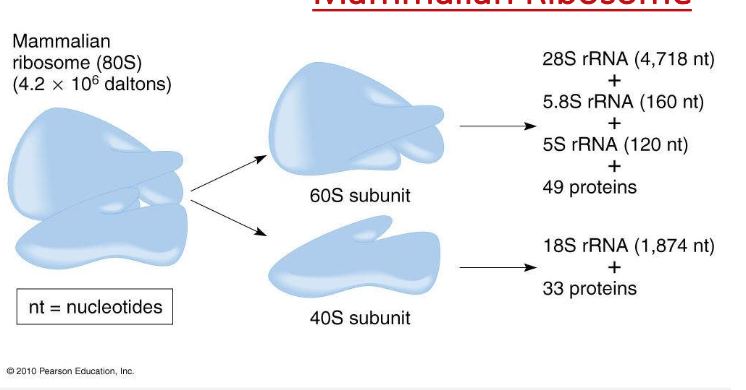
בשנת 2009, אדה יונת ממכון ויצמן זכתה פרס נובל בכימיה (יחד עם תומאס שטייץ ורמאקרישנן ונקטרמן) על פענוח המבנה התלת-ממדי של הריבוזום וחשיפת מנגנון פעולתו. מחקרם היה פריצת דרך בהבנת אחד המנגנונים המורכבים ביותר בתא.
טרנספר RNA ומנגנון התרגום
מבנה ה-tRNA והתקפלות
מולקולות ה-tRNA (כ-80 נוקלאוטידים) עוברות תהליך התקפלות מורכב ליצירת מבנה תלת-ממדי ייחודי:
מבנה דו-ממדי (דמוי תלתן)
- קצה 3’ עם רצף CCA שמור: אתר חיבור חומצת האמינו (קונסרבטיבי בכל ה-tRNAs)
- לולאת האנטי-קודון: שלושה נוקלאוטידים המזהים את הקודון ב-mRNA
- לולאות נוספות: D loop, TψC loop המייצבות את המבנה
מבנה תלת-ממדי (דמוי L)
המבנה התלת-ממדי האמיתי דמוי האות L, כאשר:
- חומצת האמינו נמצאת בקצה של זרוע אחת
- האנטי-קודון נמצא בקצה של הזרוע השנייה
- המבנה מייצב על ידי קשרי מימן בין-מולקולריים
מודיפיקציות כימיות
ה-tRNA עובר מודיפיקציות כימיות נרחבות לאחר השעתוק:
- מתילציות: הוספת קבוצות מתיל לבסיסים ולריבוז
- איזומריזציות: המרת אורידין לפסאודואורידין
- מודיפיקציות נוספות: יצירת בסיסים נדירים כמו inosine
מודיפיקציות אלו חיוניות ליציבות המבנה ולתפקוד הנכון.
אין כל כך Caping ו-Polyadenylation ב-tRNA, אלא רק ב-mRNA.
טעינת ה-tRNA על ידי Aminoacyl-tRNA Synthetases
תהליך הטעינה מבוצע על ידי משפחת אנזימים ייחודית (אמינואצילים-tRNA סינתטאזות) שמבצעת זיהוי כפול מדויק:
שלב הזיהוי הראשון - חומצת האמינו
כל aminoacyl-tRNA synthetase מזהה חומצת אמינו ספציפית אחת בלבד על בסיס:
- גודל ומבנה השרשרת הצדדית
- מטען חשמלי
- יכולת יצירת קשרי מימן
שלב הזיהוי השני - tRNA
זיהוי ה-tRNA המתאים מבוסס על:
- רצף האנטי-קודון הספציפי
- מבנה תלת-ממדי ייחודי
- רצפים נוספים ב-tRNA המכונים “identity elements”
בתמונה האנזים הכתום מצמיד ל-tRNA את חומצת האמינו המתאימה.
מזהה גם את האנטי קודון וגם את קצה 3’ של ה-tRNA.
מצמידה רק לאחר זיהוי קומפלמנטרי נכון.
מחבר את החומצה אמינית ל-tRNA באמצעות קשר אסטרי.
יצירת הקישור
האנזים מקשר כימית בין חומצת האמינו ל-tRNA תוך שימוש ב-ATP, ויוצר קשר אסטרי יציב אך עדין.
איכות הזיהוי ומנגנוני בקרה
דיוק הזיהוי הכפול מבטיח נאמנות תרגום גבוהה (שגיאה של פחות מ-1 ל-10,000). חלק מהאנזימים כוללים גם אתר “editing” המסוגל לתקן שגיאות ולהסיר חומצות אמינו שגויות.
Wobble Base Pairing והקוד הגנטי - זיווג רופף
מנגנון המאפשר גמישות בקוד הגנטי תוך שמירה על דייקנות:
חוקי ה-Wobble
- עמדות 1 ו-2: חייב להיות זיווג מושלם 100%
- עמדה 3: מותר זיווג “רופף” לפי כללים ספציפיים:
- A יכול להתזווג רק עם U
- U יכול להתזווג עם A, G, או I (inosine)
- G יכול להתזווג עם C או U
- C יכול להתזווג רק עם G
אין כאן T - RNA של tRNA, אלא רק של mRNA.
משמעויות הביולוגיות:
- הסבר לכך שמספר קודונים מקודד לחומצת אמינו אחת
- קיומם של פחות מ-61 tRNAs שונים (למרות 61 קודונים מקודדי חלבון)
- גמישות אבולוציונית בקוד הגנטי
- הקטנת ההשפעה של מוטציות “שקטות”
תהליך התרגום המפורט
התחלת התרגום ותפקיד גורמי העזר
זיהוי ה-mRNA ותפקיד ה-Cap
כזכור, רק ב-mRNA יש Caping ו-Zn tail.
- תת-היחידה הקטנה (40S) מזהה את ה-7-methylguanosine cap (m^7G) בקצה 5’ של ה-mRNA
- גיוס translation initiation factors רבים (eIF1, eIF1A, eIF4F complex ועוד)
- יצירת קומפלקס סריקה הכולל 40S + eIFs + Met-tRNA
- סריקה לאורך ה-5’ UTR במהירות של כ-4 נוקלאוטידים/שנייה
היחידה ממשיכה עד שהיא מוצאת את ה-start codon (AUG) הראשון.
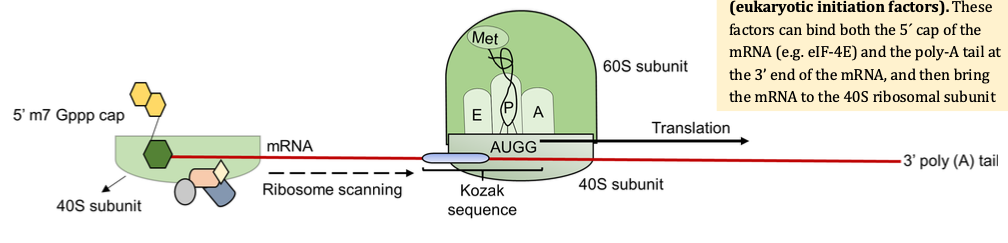
Kozak Sequence וזיהוי Start Codon
רצף הקונסנסוס: 5’-GCCRCCAUGG-3’ (כאשר R = פורין)
- המוטיב שמור אבולוציונית ונקרא על שם מרלין קוזק שגילתה אותו
- מבטיח התחלת תרגום במקום הנכון ומונע “התחלות כוזבות”
- באיקריוטים: Kozak sequence
- בפרוקריוטים: Shine-Dalgarno sequence (רצף שונה לחלוטין)
גיוס תת-היחידה הגדולה
לאחר זיהוי האתר הנכון:
- גיוס תת-היחידה הגדולה (60S)
- שחרור גורמי ההתחלה
- יצירת ריבוזום פעיל (80S) מוכן לתרגום
מחזור התרגום והאתרים הפעילים
הריבוזום מכיל שלושה אתרים מרכזיים המתפקדים בצורה מתואמת:
- A site (aminoacyl site): כניסת tRNAs טעונים חדשים
- P site (peptidyl site): מיקום ה-tRNA הנושא את השרשרת הגדלה
- E site (exit site): יציאת tRNAs ריקים
שלבי המחזור המפורטים
- Binding ובדיקה:
- tRNA טעון מגיע עם elongation factor Tu (eEF1A)
- בדיקת התאמה קודון-אנטי-קודון
- אם התאמה נכונה: קישור יציב; אם לא: דחייה מהירה
- Translocation:
- peptidyl transferase (פעילות קטליטית של ה-rRNA, לא חלבון!) יוצרת קשר פפטידי
- elongation factor G (eEF2) גורם להזזת הריבוזום 3 נוקלאוטידים
- tRNA עובר מ-A ל-P, מ-P ל-E
- שחרור: tRNA ריק יוצא דרך E site
מהירות התהליך:
- איקריוטים: 3-5 חומצות אמינו/שנייה
- פרוקריוטים: 20-15 חומצות אמינו/שנייה (מהיר יותר בגלל פשטות מערכתם)
פוליריבוזומים ויעילות התרגום
מנגנון המאפשר תרגום יעיל של mRNA אחד על ידי מספר ריבוזומים במקביל:
התהליך:
- ריבוזומים מתחילים תרגום בזמנים מדורגים
- mRNA ארוך יכול לשאת 20-10 ריבוזומים או יותר
- כל ריבוזום מייצר עותק שלם של החלבון
- הריבוזום הראשון שהתחיל כמעט סיים, האחרון רק מתחיל
יתרונות:
- ייצור מקבילי של עותקים רבים
- ניצול מיטבי של ה-mRNA
- תגובה מהירה לצרכי התא
פוליריבוזומים קשורי-ER
ריבוזומים חופשיים מול קשורים
- ריבוזומים חופשיים: מייצרים חלבונים לציטופלזמה
- ריבוזומים קשורי-ER: מייצרים חלבונים להפרשה או לממברנות
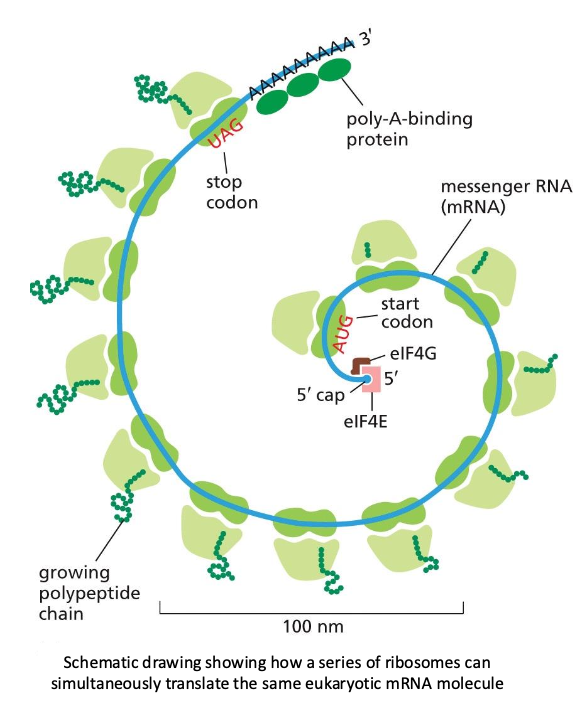
מנגנון הקישור:
רצף אות (signal sequence) בתחילת החלבון הנוצר מזוהה על ידי signal recognition particle (SRP), המכוון את הריבוזום ל-ER.
סיום התרגום
התרגום מסתיים כאשר הריבוזום פוגש אחד משלושת stop codons:
- UAG (amber)
- UAA (ochre)
- UGA (opal)
במקום tRNA, מגיעים release factors (eRF1 ו-eRF3) המובילים לשחרור החלבון ופירוק קומפלקס התרגום.
השוואה בין פרוקריוטים לאיקריוטים
הבדלים מבניים ותפקודיים
מהירות תהליכים
| תהליך | איקריוטים (יצורים בעלי גרעין) | פרוקריוטים (בעיקר חיידקים) |
|---|---|---|
| שעתוק | 30-10 נוקלאוטידים לשנייה | מהיר יותר |
| תרגום | 5-3 חומצות אמינו לשנייה | 20-15 לשנייה |
הפרדה מרחבית
באיקריוטים קיימת הפרדה גרעין-ציטופלזמה המאפשרת:
- עיבוד מורכב של ה-RNA לפני התרגום
- ויסות נוסף ברמת הטרנספורט
- מניעת תרגום של mRNAs לא בשלים
- שליטה עדינה יותר על הביטוי הגנטי
מורכבות המנגנונים:
איקריוטים מפתחים מנגנונים מורכבים יותר (alternative splicing, מודיפיקציות רבות) שמאפשרים גיוון גדול יותר למרות מספר גנים דומה.
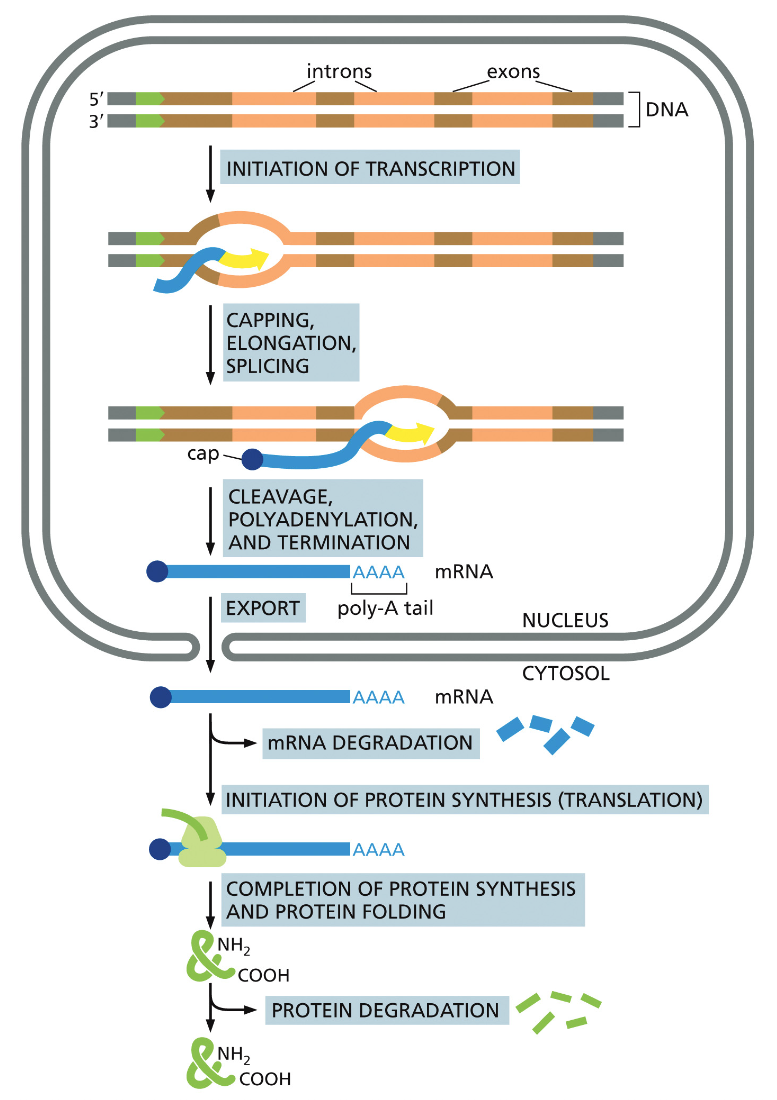
מודיפיקציות פוסט-טרנסלציוניות - מבוא
לאחר שהחלבון משוחרר מהריבוזום, הוא אינו מוכן עדיין לתפקוד. החלבון חייב לעבור מודיפיקציות נוספות הכרחיות לתפקודו התקין, המכונות מודיפיקציות פוסט-טרנסלציוניות (co-translational ו-post-translational modifications).
סוגי המודיפיקציות העיקריים
- גליקוזילציה: הוספת קבוצות סוכר ב-ER ובגולגי
- פוספורילציה: הוספת קבוצות פוספט לויסות פעילות
- אצטילציה: מודיפיקציה המשפיעת על פעילות ויציבות
- יוביקוויטינציה: סימון לפירוק חלבונים
- חיתוך: הסרת רצפי אות או אזורים לא נחוצים
מודיפיקציות אלו מתרחשות בעיקר ב-endoplasmic reticulum, במערכת הגולגי ובאברונים ספציפיים אחרים. נושא זה יכוסה בפירוט רב בשיעורים העוקבים.
סיכום וחשיבות הנושא
תהליכי עיבוד ה-RNA ותרגום החלבונים מהווים את הבסיס לכל התפקודים התאיים. הבנת מנגנונים אלו חיונית להבנת:
- מחלות גנטיות רבות
- פיתוח תרופות
- הנדסה גנטית
- מחקר בסיסי בביולוגיה תאית
המורכבות העצומה של מנגנונים אלו מעידה על ההתפתחות האבולוציונית הארוכה והעדינה שהביאה ליצירת מכונות מולקולריות מדויקות ויעילות המאפשרות את החיים כפי שאנחנו מכירים אותם.
שיעור 20 - חלבונים לאחר תרגום
תאריך: 16/06/2025חזקים ב-PTMs?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא: מהגנום לפרוטאום הפונקציונלי
המסע מהמידע הגנטי המקודד ב-DNA ועד לחלבון פעיל הוא מסע ארוך ומורכב. בפרקים הקודמים למדנו על ארגון הכרומטין, שעתוק גנים, עיבוד RNA, ותרגום חלבונים. אולם סינתזת החלבון היא רק תחילת הדרך - כדי שחלבון יוכל למלא את תפקידו הביולוגי, עליו לעבור סדרה של שינויים מבניים וכימיים המכונים “שינויים לאחר תרגום” (Post-Translational Modifications - PTMs).
הגנום האנושי מכיל כ-21,000 גנים, מספר דומה למספר הגנים בזבוב הפירות או בתולעת C. elegans. כיצד אם כן מתאפשרת המורכבות העצומה של האורגניזם האנושי? חלק מהתשובה טמון בשינויים לאחר תרגום. בעוד ששחבור אלטרנטיבי מגדיל את מגוון התעתיקים מ-21,000 ל-200,000, שינויים לאחר תרגום מרחיבים את המגוון הפונקציונלי עד לכמיליון חלבונים שונים בתפקודם.
יצירת החלבון הפונקציונלי: השלבים הראשונים
הסרת מתיונין ואצטילציה של הקצה האמיני

כל חלבון מתחיל את מסעו עם חומצת האמינו מתיונין, המקודדת על ידי קודון ההתחלה AUG. אולם בכ-70% מהחלבונים האוקריוטיים, המתיונין הראשון נחתך על ידי אנזימים ספציפיים בשם מתיונין אמינופפטידאזות (Methionine aminopeptidases). תהליך זה מתרחש בזמן התרגום עצמו (co-translationally).
לאחר הסרת המתיונין, חומצת האמינו השנייה בשרשרת עוברת לעתים קרובות אצטילציה - הוספת קבוצת אצטיל ($\ce{CH3CO-}$) לקבוצת האמינו החופשית. אנזימים מסוג N-acetyltransferases מבצעים את האצטילציה, אשר משפיעה על:
- יציבות החלבון: האצטילציה מגינה על החלבון מפני פירוק
- מטען החשמלי: שינוי המטען בקצה האמיני משפיע על אינטראקציות אלקטרוסטטיות
- הידרופוביות: הוספת הקבוצה האצטילית מגבירה את האופי ההידרופובי
- קיפול החלבון: השינוי במטען ובהידרופוביות משפיע על אופן קיפול החלבון
חשוב להבין שתהליכים אלה אינם אקראיים - הם מווסתים בקפידה ומשפיעים על גורל החלבון. פגיעה במנגנונים אלה קשורה למחלות התפתחותיות, מחלות ניווניות וסרטן.
חלבוני שפרון - שומרי הקיפול הנכון
Chaperones - ״חלבון סוכך״
קיפול החלבון למבנה התלת-ממדי הנכון הוא תהליך קריטי. חלבונים המכונים “שפרונים מולקולריים” (Molecular Chaperones) מסייעים בתהליך הקיפול. כאשר חלבון אינו מצליח להתקפל כראוי למרות עזרת השפרונים, הוא מסומן לפירוק על ידי מערכת האוביקוויטין-פרוטאזום (Proteasome), נושא שנרחיב עליו בהמשך.
השפרונים פועלים על פי מספר עקרונות:
משפחת hsp70 (Heat Shock Protein 70)
חלבוני משפחת ה-hsp70 נקשרים לאזורים הידרופוביים בחלבון המתקפל, מונעים אגרגציה ומאפשרים קיפול הדרגתי. המנגנון כולל:
- זיהוי רצפים הידרופוביים חשופים
- קשירה תלוית ATP
- שחרור מבוקר המאפשר ניסיונות קיפול חוזרים
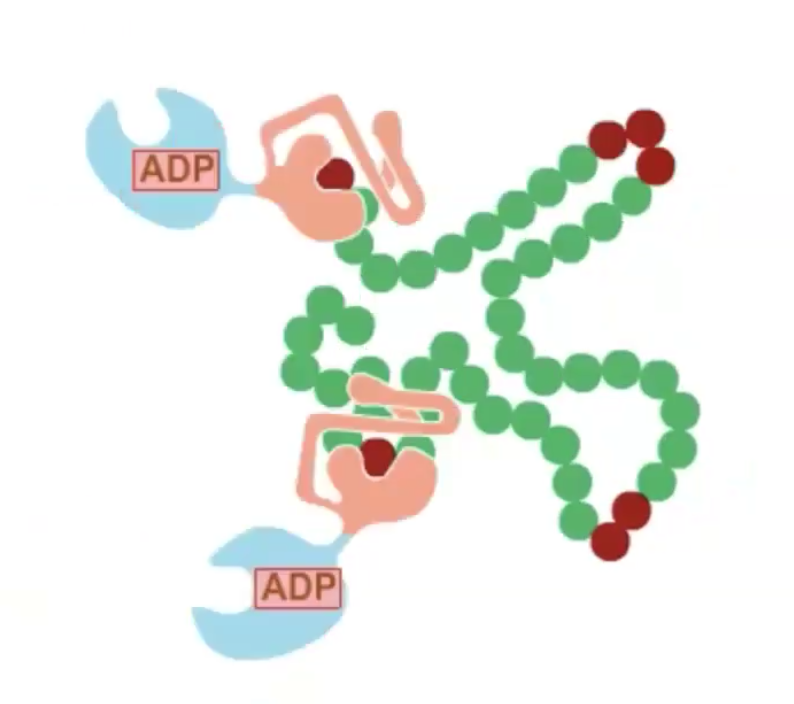
משפחת hsp60 (Heat Shock Protein 60)
משפחת hsp60 יוצרת מבנה דמוי חבית המספק סביבה מבודדת לקיפול (isolation chamber). החלבון נכנס לחלל הפנימי, שם הוא מוגן מאינטראקציות לא רצויות ויכול להתקפל בתנאים אופטימליים.
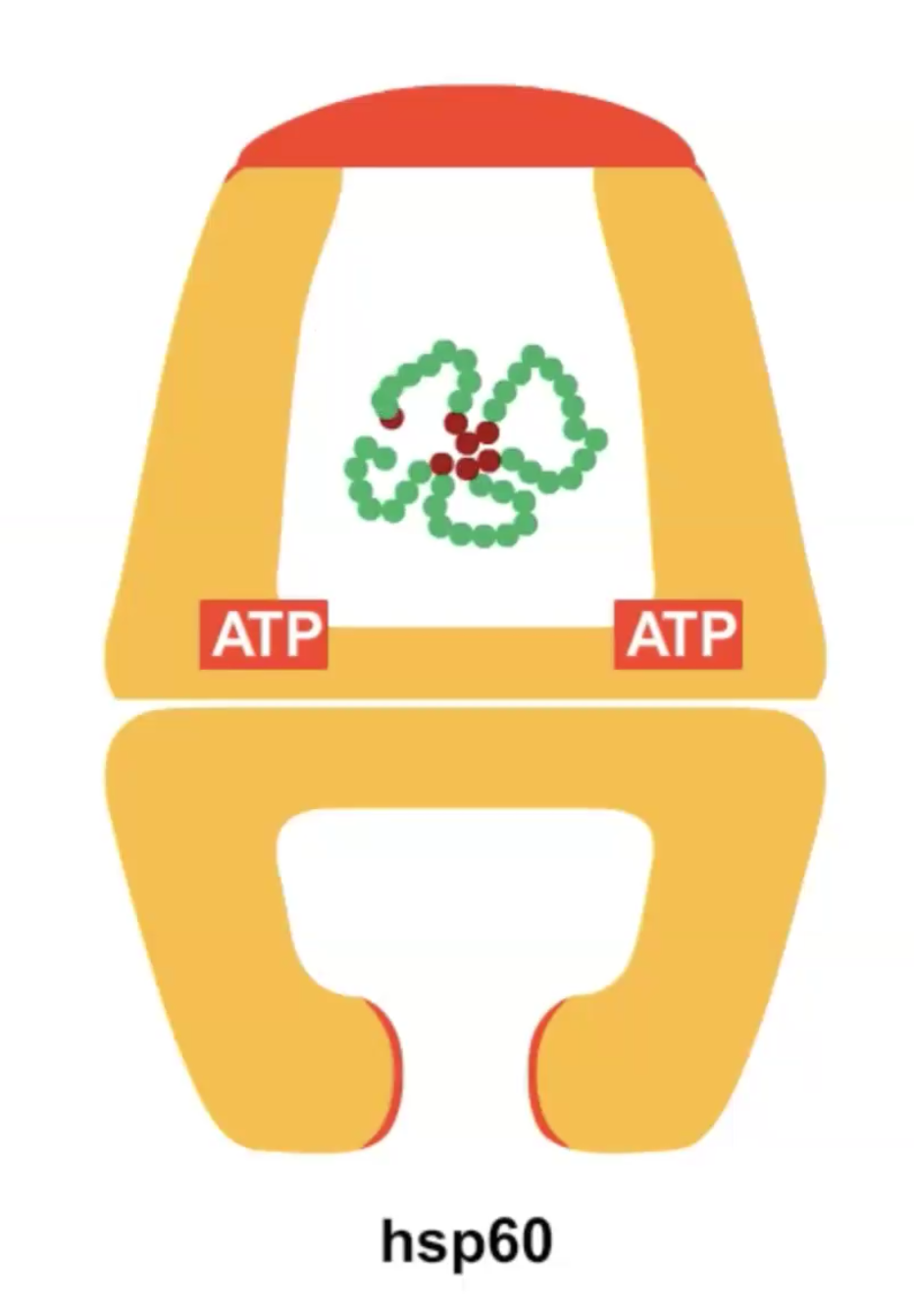
הקבוצות העיקריות של שינויים לאחר תרגום (PTMs)
המדע מכיר כיום בכ-200 סוגים שונים של שינויים לאחר תרגום. לצורך הבנה שיטתית, נהוג לחלק שינויים לאחר תרגום לארבע קבוצות עיקריות:
הוספת קבוצות פונקציונליות קטנות (e.g. methylation; Hydroxylation)
קבוצה זו כוללת את השינויים הנפוצים ביותר, בהם מתווספות קבוצות כימיות קטנות לחומצות אמינו ספציפיות.
זרחון (Phosphorylation)
זרחון הוא השינוי השכיח ביותר בפרוטאום (Proteome - סך החלבונים המתבטאים בתא). בתהליך זה, קבוצת פוספט ($\ce{PO4^3-}$) מתווספת בעיקר לחומצות האמינו סרין, תראונין וטירוזין. הזרחון משמש כ”מתג מולקולרי”:
- מפעיל או מדכא פעילות אנזימטית
- משנה את מיקום התוך-תאי של החלבון
- יוצר אתרי קישור לחלבונים אחרים
- מווסת אינטראקציות חלבון-חלבון
המנגנון כולל העברת קבוצת פוספט מ-ATP על ידי אנזימים הנקראים קינאזות, כאשר פוספטאזות מבצעות את התגובה ההפוכה.
הידרוקסילציה (Hydroxylation)
הוספת קבוצת הידרוקסיל (-OH) היא קריטית במיוחד לקולגן - החלבון הנפוץ ביותר בגוף האדם (25-35% מכלל החלבונים). פרולין הידרוקסילאז מזרז את התגובה:
פרולין + α-קטוגלוטרט + O₂ → הידרוקסיפרולין + סוקצינט + CO₂
ההידרוקסילציה של פרולין וליזין בקולגן חיונית ליציבותו. מחסור בוויטמין C, קו-פקטור חיוני לתגובה, גורם לצפדינה - מחלה בה הקולגן אינו יציב.
חשיבות נוספת של הידרוקסילציה התגלתה במחקר שזכה בפרס נובל לרפואה ב-2019. החוקרים וויליאם קיילין, פיטר רטקליף וגרג סמנזה גילו כיצד תאים חשים ברמות חמצן. בתנאי חמצן תקינים, פרולין הידרוקסילאז מבצע הידרוקסילציה של HIF (Hypoxia Inducible Factor), מה שמוביל לפירוקו. בתנאי היפוקסיה, ההידרוקסילציה נפגעת, HIF מתייצב ומפעיל גנים להתמודדות עם מחסור בחמצן.
הוספת חלבונים או פפטידים (e.g. Glycosylation; Ubiquitination)
גליקוזילציה - הוספת סוכרים
גליקוזילציה היא אחד השינויים המורכבים והחשובים ביותר. קיימים שני סוגים עיקריים:
N-גליקוזילציה: הוספת סוכרים לחנקן של אספרגין. מתרחשת ברשת האנדופלסמית (ER) בזמן התרגום ומאפיינת את רוב הרצפטורים על פני התא. התהליך כולל:
- זיהוי רצף הקונצנזוס Asn-X-Ser/Thr
- העברת אוליגוסכריד מורכב מ-dolichol
- עיבוד נוסף בגולג׳י
O-גליקוזילציה: הוספת סוכרים לחמצן של סרין או תראונין. מתרחשת בגולג׳י ומאפיינת במיוחד מוצינים - גליקופרוטאינים המרכיבים את הריר המגן על אפיתל.
הגליקוזילציה משפיעה על:
- מסיסות החלבון במים
- יציבות ואורך חיי החלבון
- זיהוי תאי ואינטראקציות
- קיפול נכון של החלבון
אוביקוויטינציה - סימון לגורלות שונים
למשל כשחלבון נפגע על ידי ROS
אוביקוויטין הוא חלבון קטן (76 חומצות אמינו) המתווסף לליזין בחלבוני מטרה. התהליך מערב שלושה סוגי אנזימים:
- E1: אנזים מפעיל
- E2: אנזים מצמיד
- E3: ליגאזה המקנה ספציפיות
סוג האוביקוויטינציה קובע את גורל החלבון:
- מונו-אוביקוויטינציה: משנה פעילות או מיקום
- פולי-אוביקוויטינציה דרך K48: סימון לפירוק בפרוטאזום
- פולי-אוביקוויטינציה דרך K63: תפקידים בתיקון DNA, אנדוציטוזה ועוד
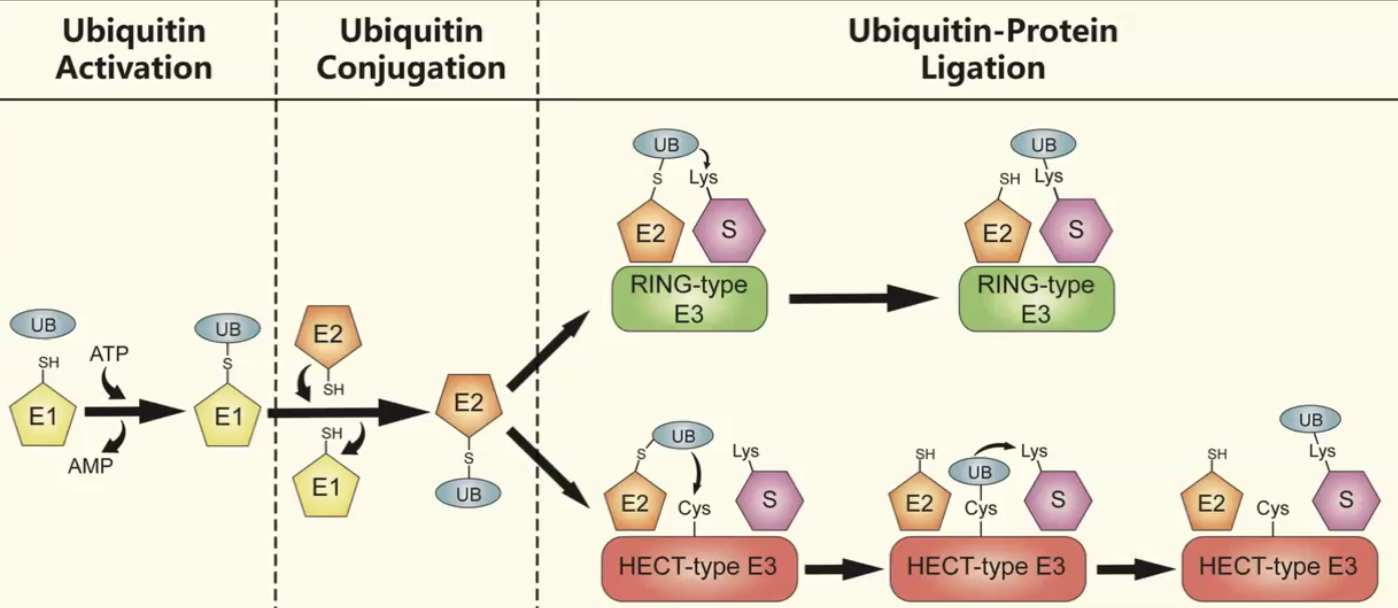
Endocytosis - תהליך בו התא סופג חומרים מהסביבה על ידי יצירת שלפוחיות מהקרום התאי.
Biodistribution - התפשטות והפצה של חומרים בגוף, כמו חלבונים או תרופות, לאחר כניסתם לתוך התא או האורגניזם.
Enzymatic activity - פעילות אנזימטית, כלומר היכולת של אנזים לזרז תגובות כימיות ספציפיות.
Gene expression - ביטוי גנים, כלומר התהליך שבו מידע גנטי מתורגם לחלבון או RNA פעיל.
DNA repair - תיקון DNA, תהליכים המתקנים נזקים ב-DNA כדי לשמור על יציבות הגנום.
Autophagy - תהליך בו התא מפרק רכיבים לא נחוצים או פגומים כדי למחזר חומרים ולשמור על הומיאוסטזיס.
Proteasomal degradation - פירוק חלבונים על ידי הפרוטאזום, מערכת תאית המפרקת חלבונים לא נחוצים או פגומים.
שינוי הצורה הכימית של חומצת אמינו (citrullination)
ציטרולינציה - המרת ארגינין לציטרולין
בתהליך זה, אנזימים מסוג PAD (Peptidyl Arginine Deiminase) ממירים ארגינין לציטרולין:
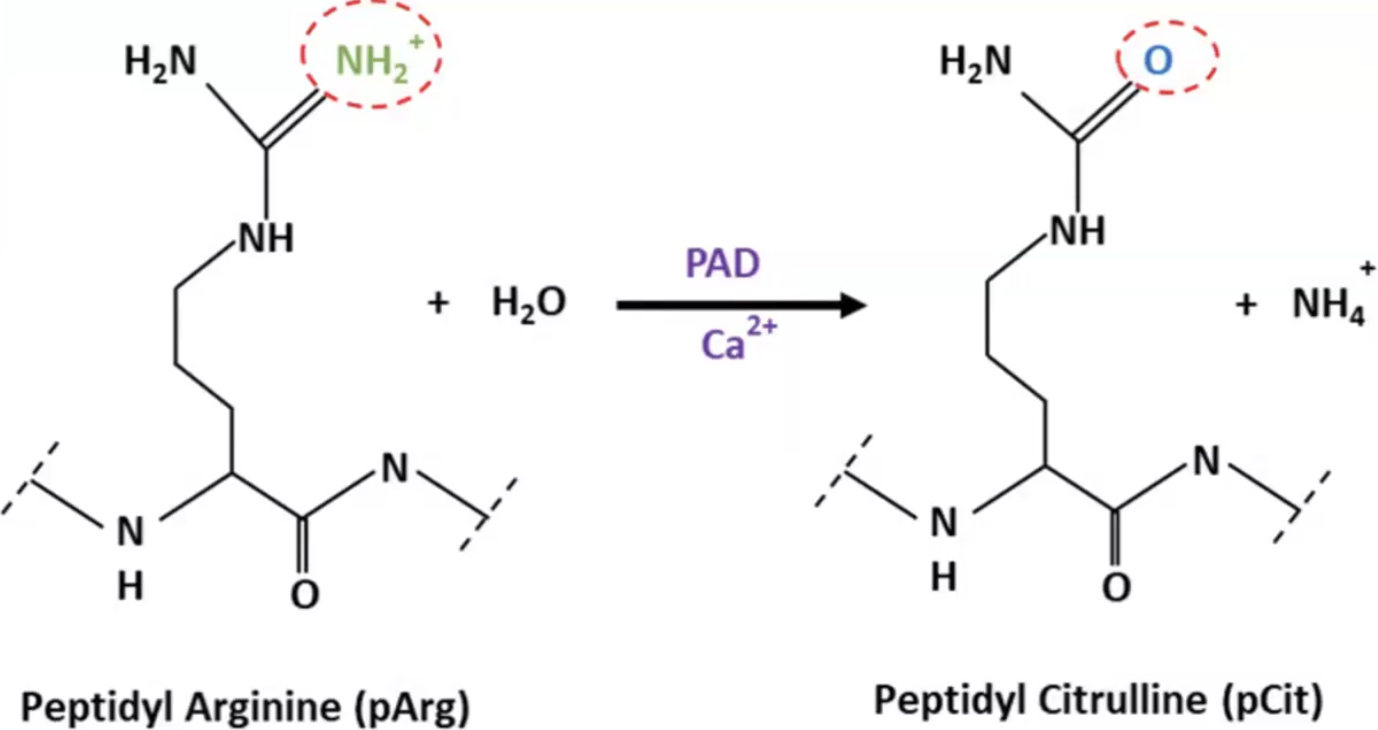
השינוי מקטין את המטען החיובי ומגביר הידרופוביות. בתנאים פיזיולוגיים, ציטרולינציה מתרחשת ב:
- היסטונים - משפיעה על מבנה הכרומטין
- פילגרין - חשוב להתמיינות תאי עור
- חלבוני מיאלין - בתאי עצב
ציטרולינציה חריגה קשורה למחלות אוטואימוניות כמו דלקת מפרקים שגרונית (Rheumatoid Arthritis), בה נוצרים נוגדנים נגד חלבונים מציטרולינים.
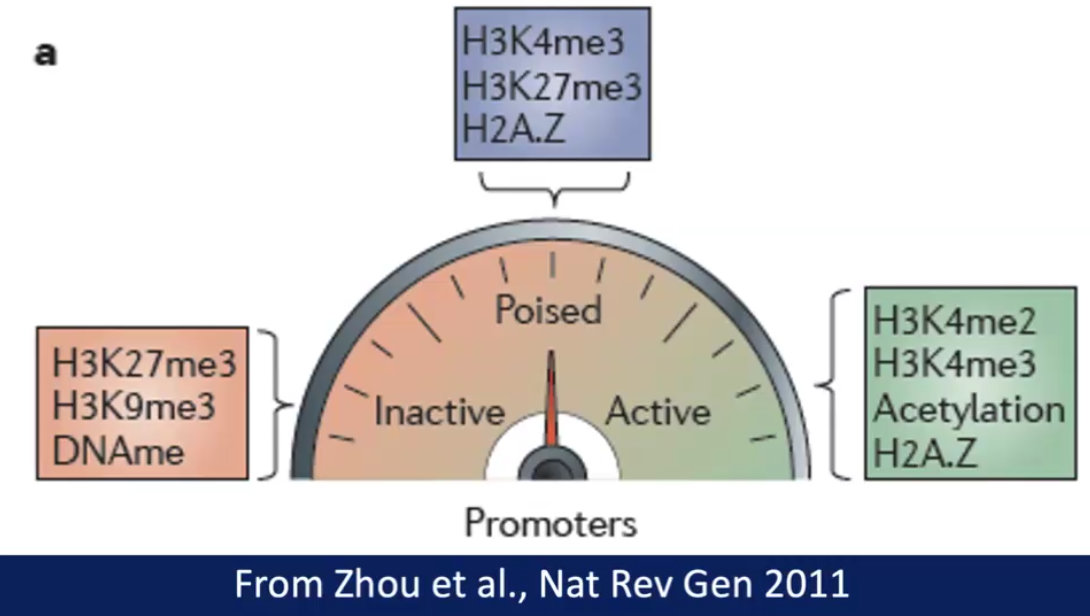
שינויים מבניים (disulfide bridges; proteolytic cleavage)
גשרים דיסולפידיים
קשרי S-S בין שני ציסטאינים חשובים ליציבות מבנית. בתנאים תקינים בציטופלזמה, הסביבה המחזרת מונעת יצירת גשרים אלה. אולם:
- בחלל הרשת האנדופלסמית הסביבה מחמצנת ומאפשרת יצירתם
- בתנאי עקה חמצונית נוצרים גשרים גם בציטופלזמה
- אנזימים כמו גלוטתיון פרוקסידאז ותיורדוקסין מווסתים את התהליך
חיתוך פרוטאוליטי
חיתוך מבוקר של חלבונים חיוני להפעלת חלבונים רבים. דוגמה קלאסית היא אינסולין:
- פרה-פרואינסולין (110 חומצות אמינו) מסונתז בריבוזומים
- חיתוך פפטיד האות ברשת האנדופלסמית יוצר פרואינסולין
- יצירת גשרים דיסולפידיים בין שרשראות A ו-B
- חיתוך שרשרת C בגרנולות ההפרשה יוצר אינסולין בוגר (51 חומצות אמינו)
חיתוך לקוי גורם לצורות מסוימות של סוכרת.
ויסות משך חיי החלבון
שינויים לאחר תרגום משפיעים דרמטית על משך חיי החלבון. מחצית החיים משתנה מדקות ועד עשרות שנים:
- קולגן: 20~ שנה
- קריסטלינים בעדשת העין: >70 שנה
- היסטונים: 6~ חודשים
- גורמי שעתוק רבים: דקות עד שעות
היציבות נקבעת על ידי:
- מידת הגליקוזילציה וההידרוקסילציה
- נוכחות סימוני אוביקוויטין
- שינויים הגורמים לחשיפת אזורים הידרופוביים
קרבמילציה - גשר בין סביבה לפתולוגיה
קרבמילציה היא הוספת קבוצת קרבמיל (NH₂CO-) לליזין או לקצה האמיני של חלבונים. בניגוד לשינויים רבים אחרים, זהו תהליך בלתי הפיך המתרחש:
- באופן ספונטני בנוכחות ציאנט או אוראה
- מוגבר בעישון ובחשיפה לזיהום אוויר
- מואץ באורח חיים בישיבה (sedentary lifestyle)

קרבמילציה של חלבונים כמו המוגלובין ואלבומין פוגעת בתפקודם ונחשבת לאחד המנגנונים המרכזיים בהזדקנות. רמות קרבמילציה גבוהות נמצאו במחלות ניווניות כמו אלצהיימר ופרקינסון.
אינטגרציה וחשיבות קלינית
הבנת השינויים לאחר תרגום חיונית להבנת:
- מסלולי העברת אותות: זרחון ושינויים אחרים מווסתים מסלולים כמו MAPK ו-PI3K
- בקרת מחזור התא: זרחון של חלבונים כמו p53 ו-Rb קריטי לבקרת חלוקה
- תגובות חיסוניות: גליקוזילציה של נוגדנים וציטרולינציה של אוטואנטיגנים
- מחלות: שינויים חריגים קשורים לסרטן, מחלות ניווניות ואוטואימוניות
המחקר בתחום מוביל לפיתוח תרופות חדשות:
- מעכבי קינאזות בטיפול בסרטן
- מעכבי PAD למחלות אוטואימוניות
- מווסתי אוביקוויטינציה למחלות ניווניות
סיכום
שינויים לאחר תרגום הם מפתח להבנת המורכבות הביולוגית. הם מגשרים בין המידע הגנטי הסטטי לבין הדינמיקה של החיים, מאפשרים לתא להגיב לשינויים סביבתיים ומווסתים כל היבט של פעילות החלבון. ללא הבנת התהליכים האלה, לא ניתן להבין לעומק את הביולוגיה של התא, העברת אותות, חלוקת תאים ופתולוגיה של מחלות.
בפרק הבא נלמד כיצד שינויים אלה משתלבים במסלולי העברת אותות, המאפשרים לתא לקלוט מידע מהסביבה ולהגיב בהתאם - תהליך המהווה בסיס לכל תגובה ביולוגית מורכבת.
שיעור 21 - ויסות מולקולרי וחלוקת תאים
תאריך: 23/06/2025חזקים במחזור התא?
נסו 10 שאלות, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? חפשו בחנים נוספים בדפים אחרים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא: הקשר בין העברת אותות לחלוקת תאים
מחזור התא מהווה נושא מרכזי בביולוגיה של התא, עשיר במושגים ומולקולות הנבנים בשכבות זו על גבי זו. בהרצאה הקודמת דנו בנושא העברת האותות (signal transduction) וחשפנו עולם שלם של מולקולות ומסלולים מרכזיים, כגון מסלול הרצפטור טירוזין קינאז. כעת נבחן כיצד מסלולים אלה מופעלים, מה קורה במורד הזרם (downstream) לאחר ההפעלה, וכיצד הם מבקרים את מחזור התא.
הקשר בין מה שהתאים “מרגישים” מהסביבה לבין היכולת שלהם להתחלק הדוק במיוחד. לתאים יש רצפטורים המסוגלים לזהות סיגנלים - בין אם מדובר ברצפטורים תוך-תאיים עבור הורמונים סטרואידיים, או רצפטורים על פני קרום התא עבור ליגנדים שונים כמו רצפטורי טירוזין קינאז. רצפטורים אלה מזהים מגוון גורמי גדילה:
- EGF (Epidermal Growth Factor) - גורם גדילה אפידרמלי
- NGF (Nerve Growth Factor) - גורם גדילה עצבי
- PDGF (Platelet-Derived Growth Factor) - גורם גדילה המופרש מטסיות דם
גורמי גדילה אלה, יחד עם סיגנלים נוספים, חיוניים להבטחת אספקה נאותה של מזון ונוטריינטים מחוץ לתא. זאת כדי להכין ולמלא את המאגרים הדרושים לשלבים הבאים בחלוקת התא.
היחס בין גדילה לחלוקה
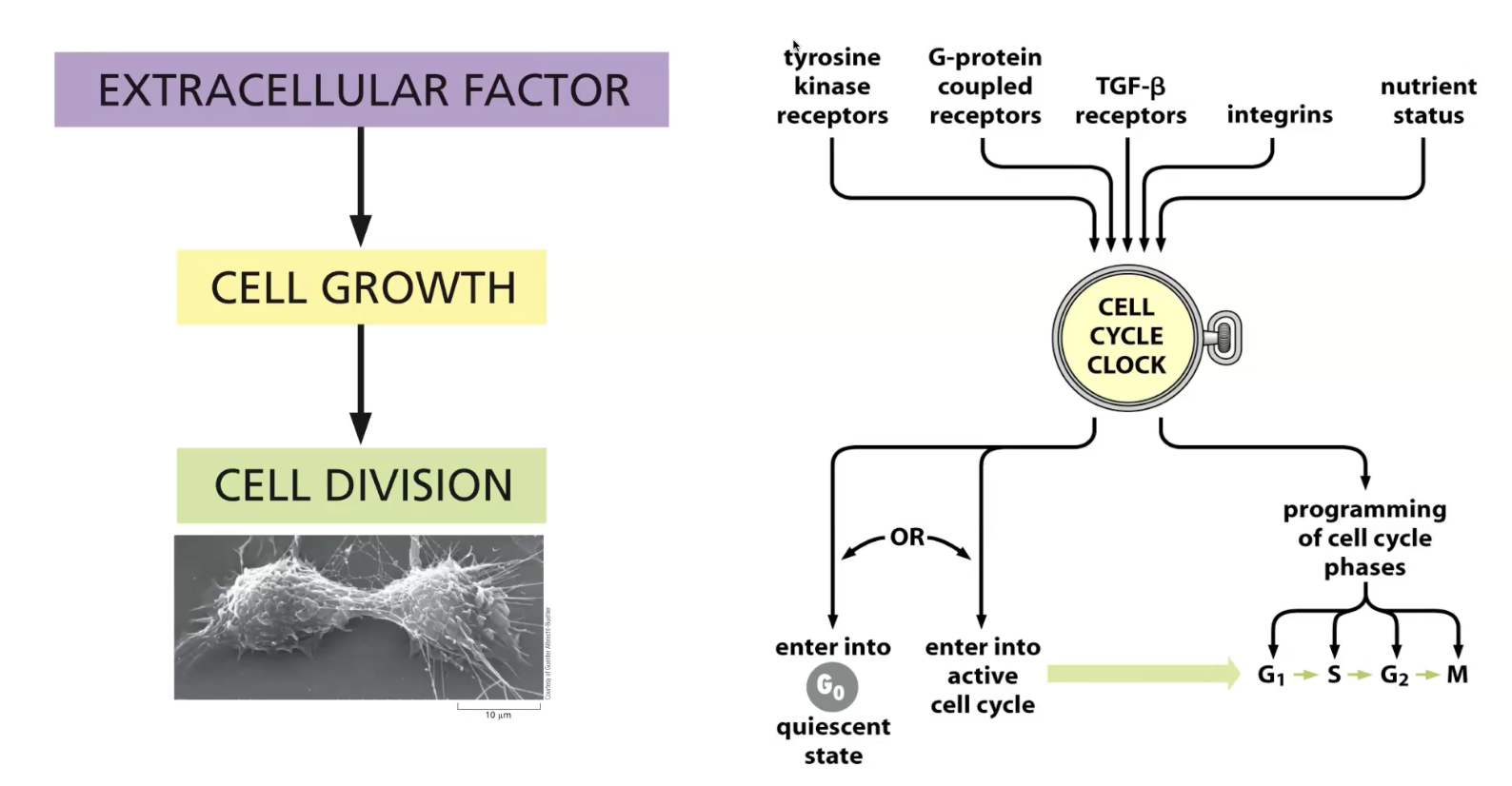
נקודה קריטית להבנה: בהרבה מאוד תאים, קצב החלוקה תלוי בקצב היכולת של התאים לגדול. גדילה משמעותה היכולת לייצר ולאגור מקרומולקולות - חלבונים, ליפידים, חומצות גרעין ופחמימות.
כפי שלמדנו, הסיגנלים שהתא מקבל מהסביבה מגיעים בארבע דרכים עיקריות:
- תלוי-מגע (Contact-dependent) - מגע פיזי ישיר בין תאים
- אנדוקריני - הורמונים שמופרשים למחזור הדם
- פאראקריני - גורמים שמופרשים לסביבה הקרובה
- אוטוקריני - גורמים שהתא מפריש ושפועלים עליו עצמו
רוב מולקולות העברת האותות, ובמיוחד מסלול PI3-kinase/AKT שדנו בו, מבקרים סינתזה ואגירה של מקרומולקולות. זהו תפקידם המרכזי בתהליכים אנאבוליים.
מהו מחזור התא?
מחזור התא הוא רצף אירועים מולקולריים וביוכימיים שבסופו של דבר מתא אחד נוצרים שני תאים. התהליך דורש:
- אגירת מקרומולקולות ואנרגיה - במיוחד מולקולות ATP
- שכפול הגנום - כל 46 הכרומוזומים (23 זוגות הומולוגיים) חייבים לעבור שכפול
- שכפול אברונים - בעיקר מיטוכונדריה וצנטרוזומים
במהלך פאזת S (סינתזה), ה-DNA עובר שכפול כך שתאים דיפלואידיים (2n) הופכים לטטרפלואידים (4n). בחלוקה, כל תא בת מקבל בחזרה את הכמות הדיפלואידית.
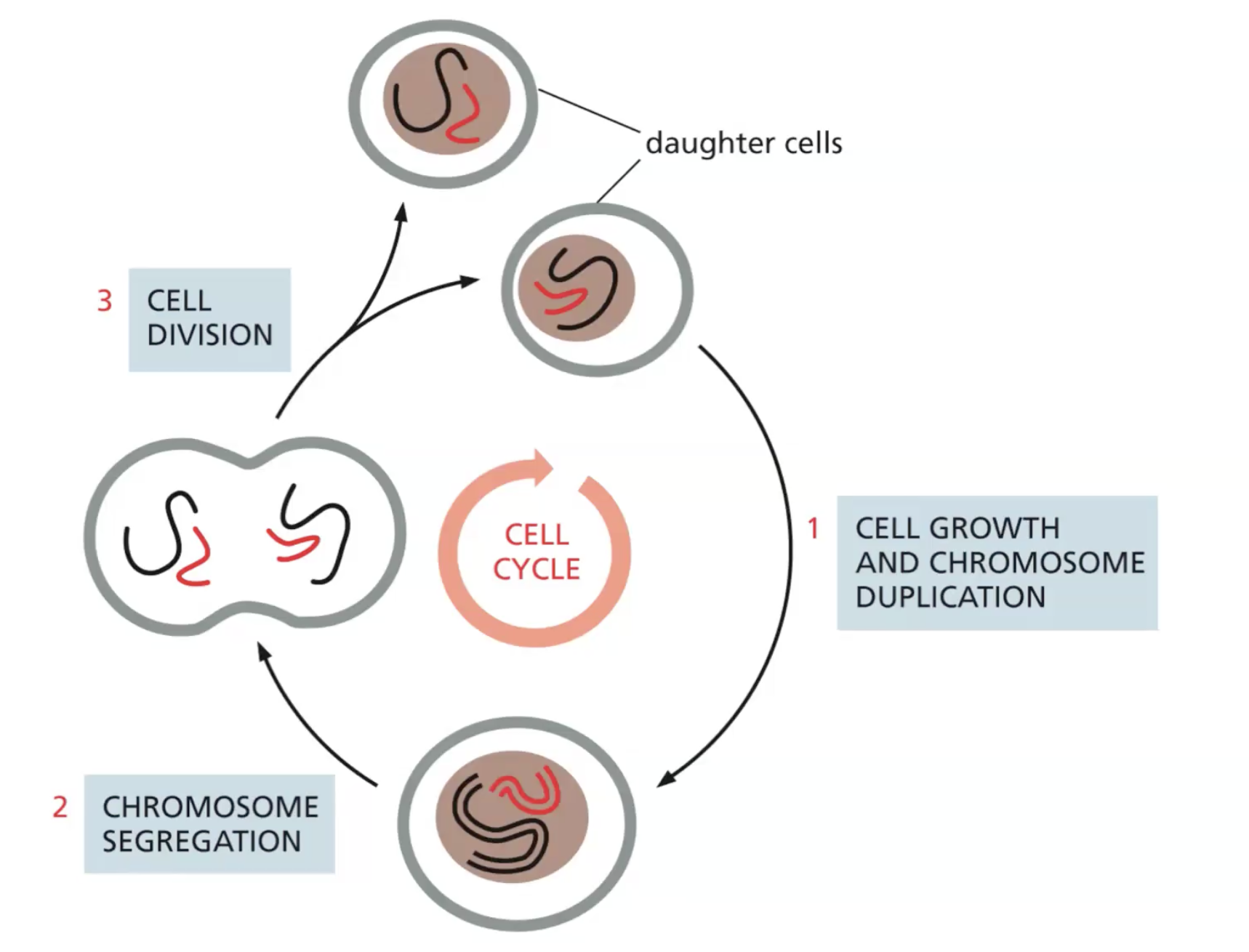
פאזות מחזור התא
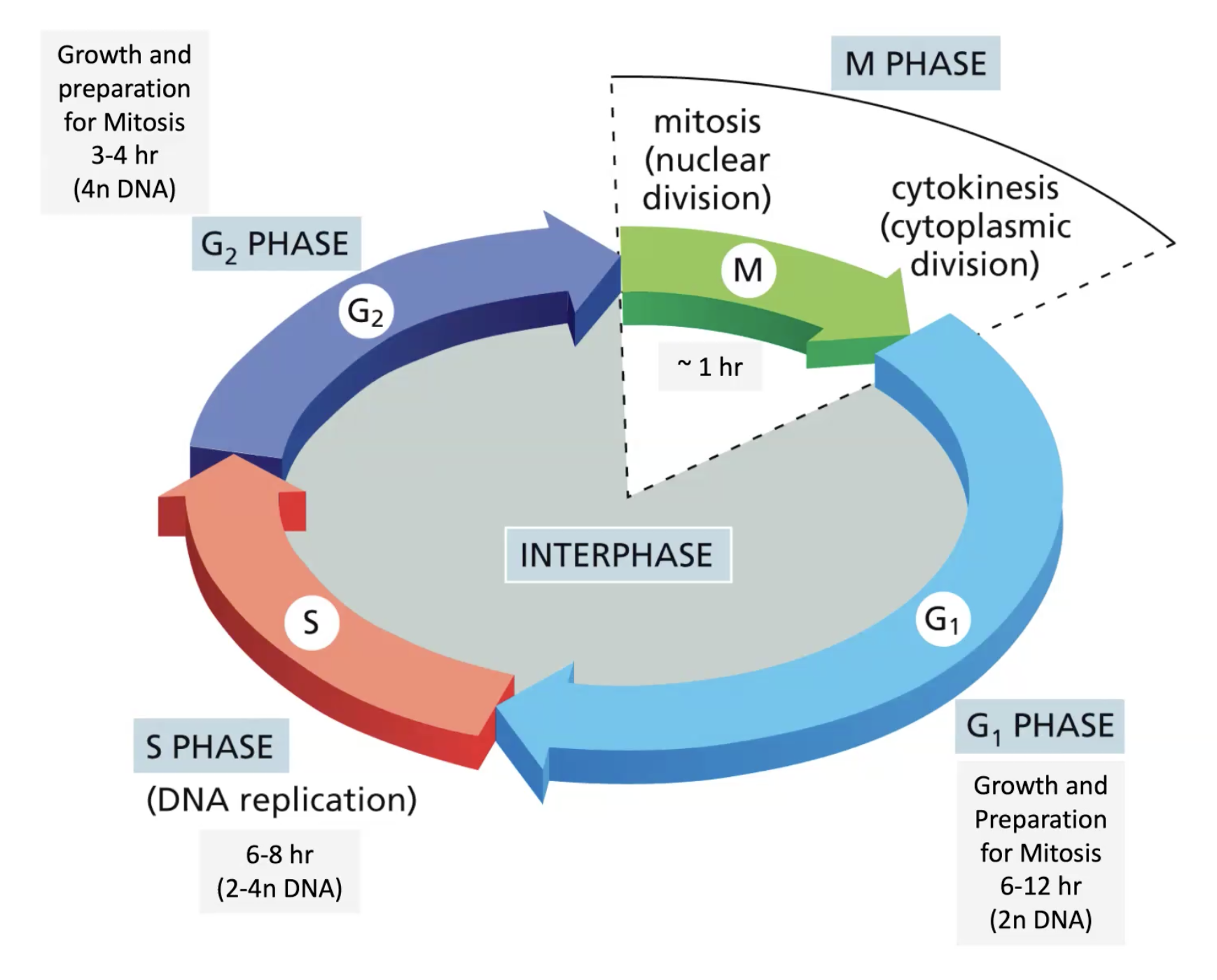
מחזור התא מוצג כמעגל מכיוון שתאים בעלי יכולת התרבות יכולים לעבור אותו שוב ושוב. המחזור מחולק לארבע פאזות עיקריות:
פאזת $\text{G}_1$ (Gap 1)
- משך: 12-6 שעות בתאים מתרבים
- מאפיינים:
- גדילת התא ואגירת מקרומולקולות
- התאים נשארים דיפלואידיים (2n)
- קבלת סיגנלים מהסביבה והפעלת מסלולי PI3K/AKT
“במחזור התא, $\text{G}_1$ מאפשר לתא זמן לבדוק אם תנאי הסביבה מתאימים להיכנס לשלב S”
רוב התאים נמצאים בפאזת $\text{G}_1$.
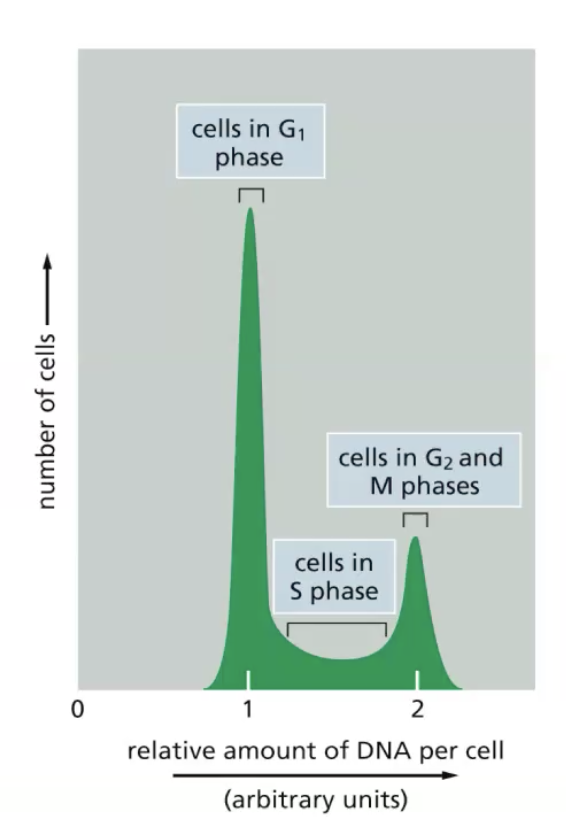
פאזת S (Synthesis)
- משך: 8-6 שעות
- תהליכים עיקריים:
- רפליקציה של DNA
- דופליקציה של צנטרוזומים
- בסיומה התאים הם טטרפלואידים (4n)
פאזת $\text{G}_2$ (Gap 2)
- משך: 4-3 שעות
- תפקיד: בדיקה ש-DNA עבר שכפול תקין והכנה למיטוזה
פאזת M (Mitosis)
- משך: 40 דקות עד שעה וחצי
- מחולקת לחמישה שלבים
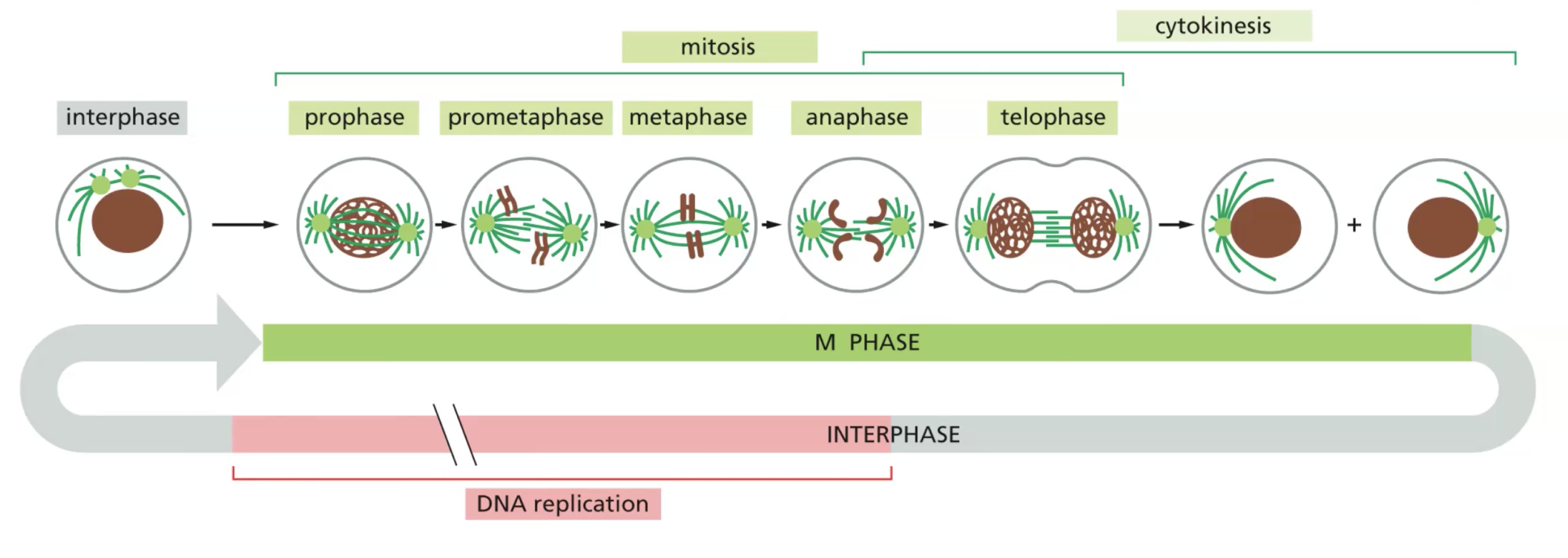
פאזת $\text{G}_0$ - מצב מנוחה
תאים יכולים לצאת ממחזור התא ולהיכנס למצב $\text{G}_0$ כאשר:
- אין מספיק גורמי גדילה
- הסביבה אינה תומכת (environment unfavorable)
- התא במצב עקה
תאים יכולים להישאר ב-$\text{G}_0$ זמן רב מאוד, עד שיקבלו את הסיגנלים המתאימים.
| מצב | תיאור | זמן ממוצע | |
|---|---|---|---|
| $\text{G}_1$ | פעיל | התא מוכן להתחלק, אך עדיין לא התחיל בשכפול DNA | 12-6 שעות |
| S | פעיל | התא עובר שכפול DNA | 8-6 שעות |
| $\text{G}_2$ | פעיל | התא מוכן למיטוזה, אך עדיין לא התחיל בה | 4-3 שעות |
| M | פעיל | התא עובר מיטוזה וחלוקה | 40 דקות עד שעה וחצי |
| $\text{G}_0$ | מנוחה | התא לא מתכוון להתחלק כרגע, אך יכול לחזור למחזור | זמן לא מוגדר |
מערכת הבקרה של מחזור התא
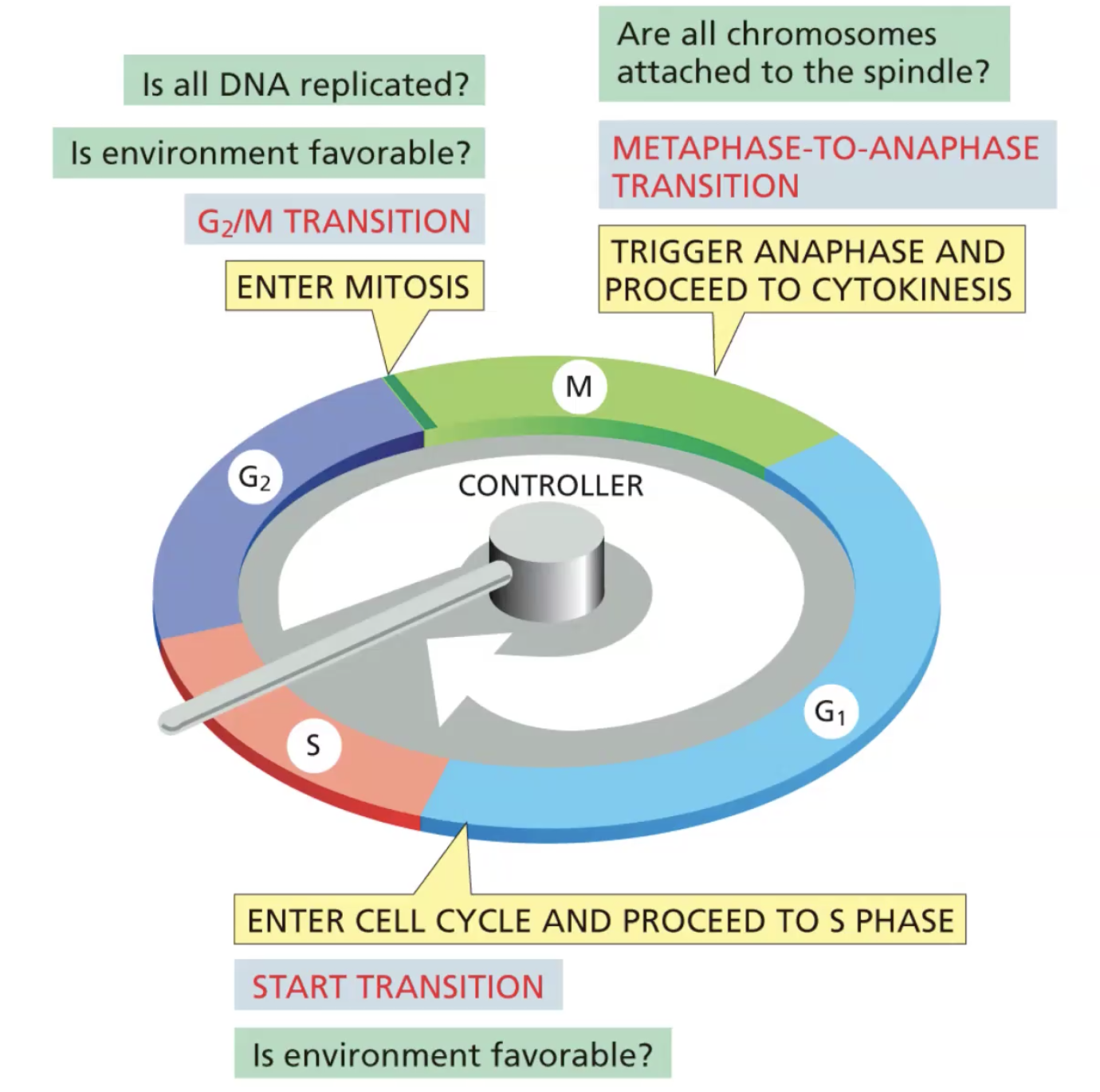
מערכת הבקרה (Cell Cycle Control System) כוללת תהליכים ביוכימיים שדוחפים את התא להתקדם במחזור. המערכת מבוססת על איזון בין:
רגולטורים חיוביים - “דוחפים קדימה”
קומפלקסי Cyclin-Cdk (Cyclin-Dependent Kinases)
Cyclin-Cdk הם אנזימי קינאז התלויים בציקלינים להפעלתם. המנגנון:
- ציקלין נקשר ל-Cdk
- הקומפלקס עובר אקטיבציה
- Cdk מזרחן סובסטרטים ספציפיים
הקומפלקסים העיקריים:
- Cdk4/6-Cyclin D: מניע התקדמות ב-$\text{G}_1$
- Cdk2-Cyclin E: כניסה מ-$\text{G}_1$ ל-S
- Cdk2-Cyclin A: התקדמות ב-S ו-$\text{G}_2$
- Cdk1-Cyclin B: כניסה למיטוזה (נקרא גם Mitotic Cdk)
| Cyclin-Cdk complex | Cyclin | Cdk partner |
|---|---|---|
| G1-Cdk | Cyclin D* | Cdk4, Cdk6 |
| G1/S-Cdk | Cyclin E | Cdk2 |
| S-Cdk | Cyclin A | Cdk2, Cdk1** |
| M-Cdk | Cyclin B | Cdk1 |
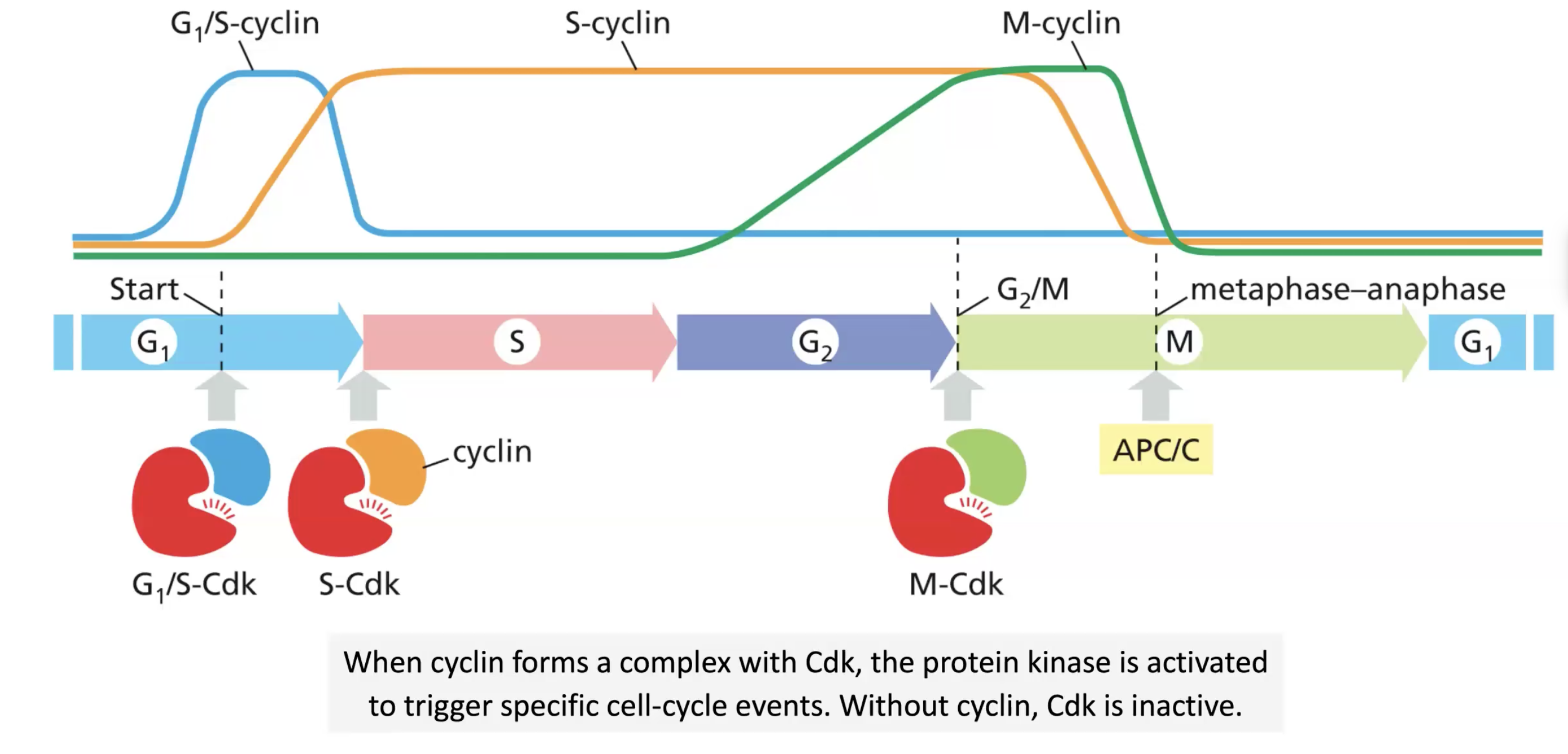
מזרחנים אחרים.
כדי שיוכלו לעבוד הם צריכים להיות מאוקטבים. מה שמאקטב אותם הם ציקלינים.
לכל פאזה יש ציקלין ספציפי שנקשר ומווסת.
רגולטורים שליליים - “הבלמים”
נקודות ביקורת (Cell Cycle Checkpoints)
- בודקות שכל שלב הושלם בהצלחה
- מונעות התקדמות אם יש בעיות
מעכבי Cdk (Cdk Inhibitors)
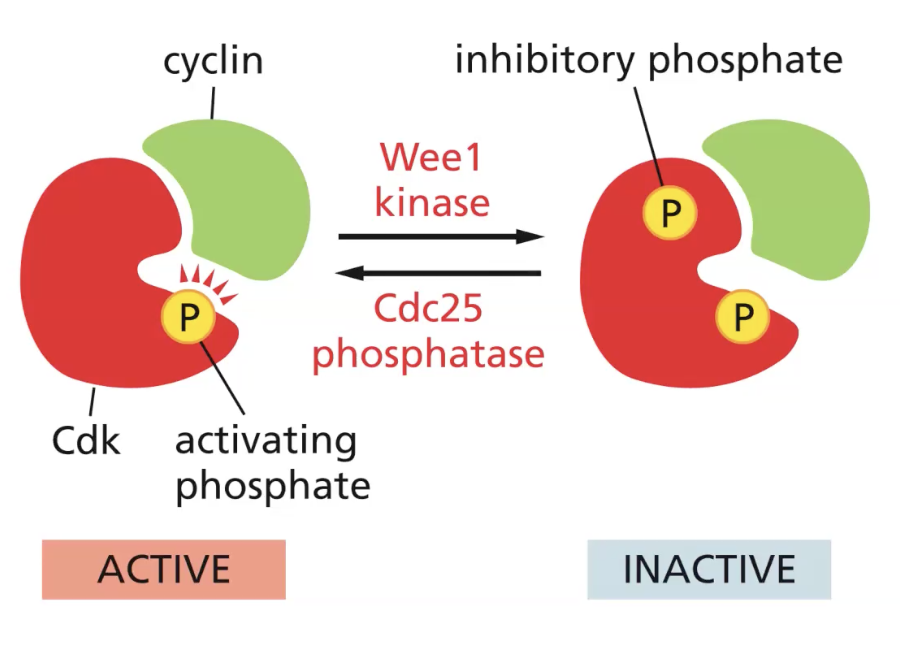
- p27: מעכב בעיקר Cdk2-Cyclin E, מבוקר על ידי AKT
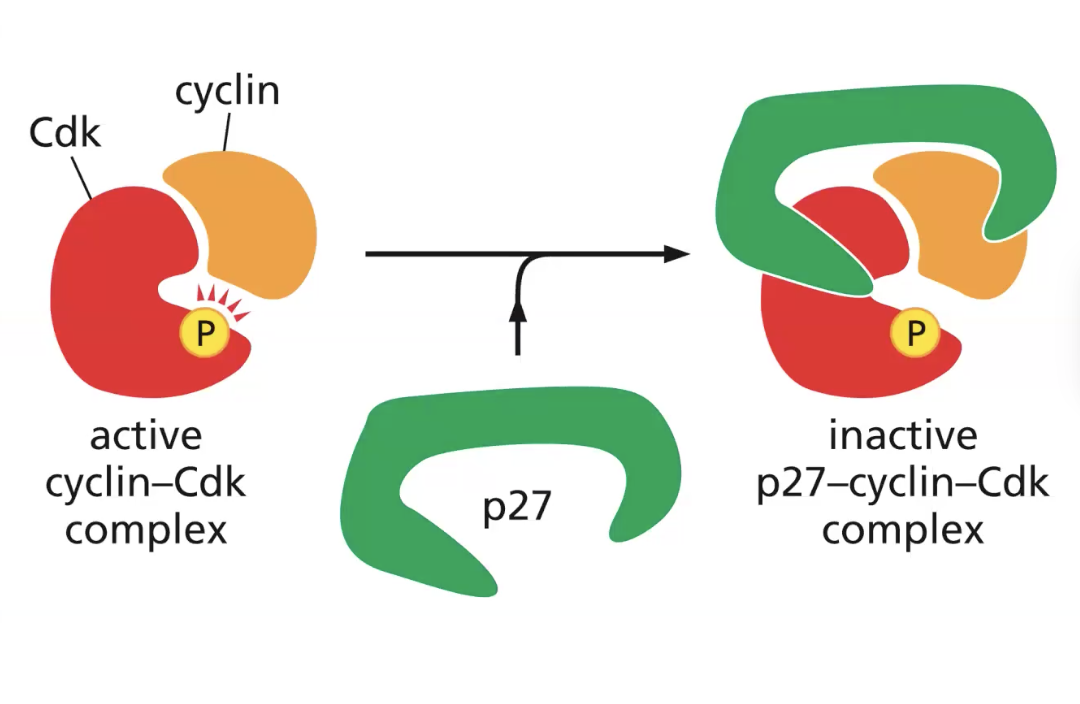
- p21: מעכב רחב טווח, מטרה של p53
- p16, p15, p18: מעכבים של Cdk4/6
בקרה רב-שכבתית של Cdk
הפעלת Cdk דורשת שלושה תנאים:
- קישור ציקלין מתאים
- דפוספורילציה מפעילה - הסרת זרחנים מעכבים על ידי פוספטאזות CDC25
- העדר מעכבים - הרחקת חלבוני CKI
דוגמה לוויסות: כאשר AKT מופעל על ידי מסלול PI3K, הוא מזרחן את p27. זרחון זה גורם ל-p27 להישאר בציטופלזמה ולא להגיע לגרעין, ובכך מאפשר ל-Cdk2-Cyclin E להיות פעיל לחלוטין.
נקודת ההגבלה (Restriction Point או R-Point)
R-point: restriction point
זוהי הנקודה הקריטית ביותר במעבר מ-$\text{G}_1$ ל-S - “נקודת אל-חזור”. נקודת המעבר מ-$\text{G}_1$ ל-S מבוקרת על ידי Cdk2 Cyclin E (בסוף פאזת S מבקר את התהליך גם Cdk1 עם Cyclin A).
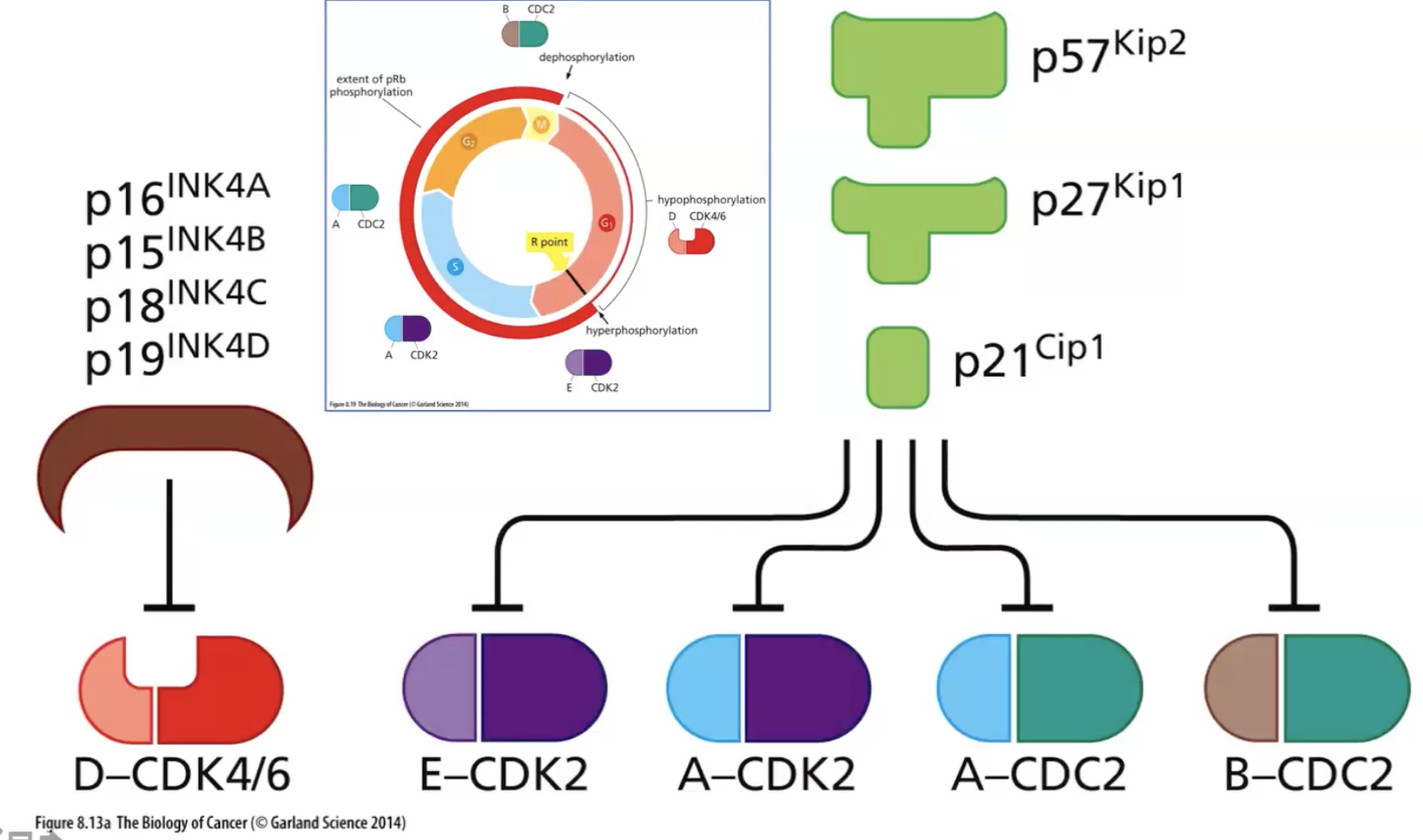
כאן התא בודק:
- האם הסביבה תומכת?
- האם יש מספיק גורמי גדילה?
- האם יש מספיק נוטריינטים?
מה קורה עם שאר הסיקלנים - D או E כשהתאים הגיעו למידל - $\text{G}_1$ וכו?
הם מתפרקים.
הערה כללית - דוגמה לתשובה, מי אחראי על X?
זה סייקלין D, בקומפלקס עם Cdk4/6 וכן הלאה.
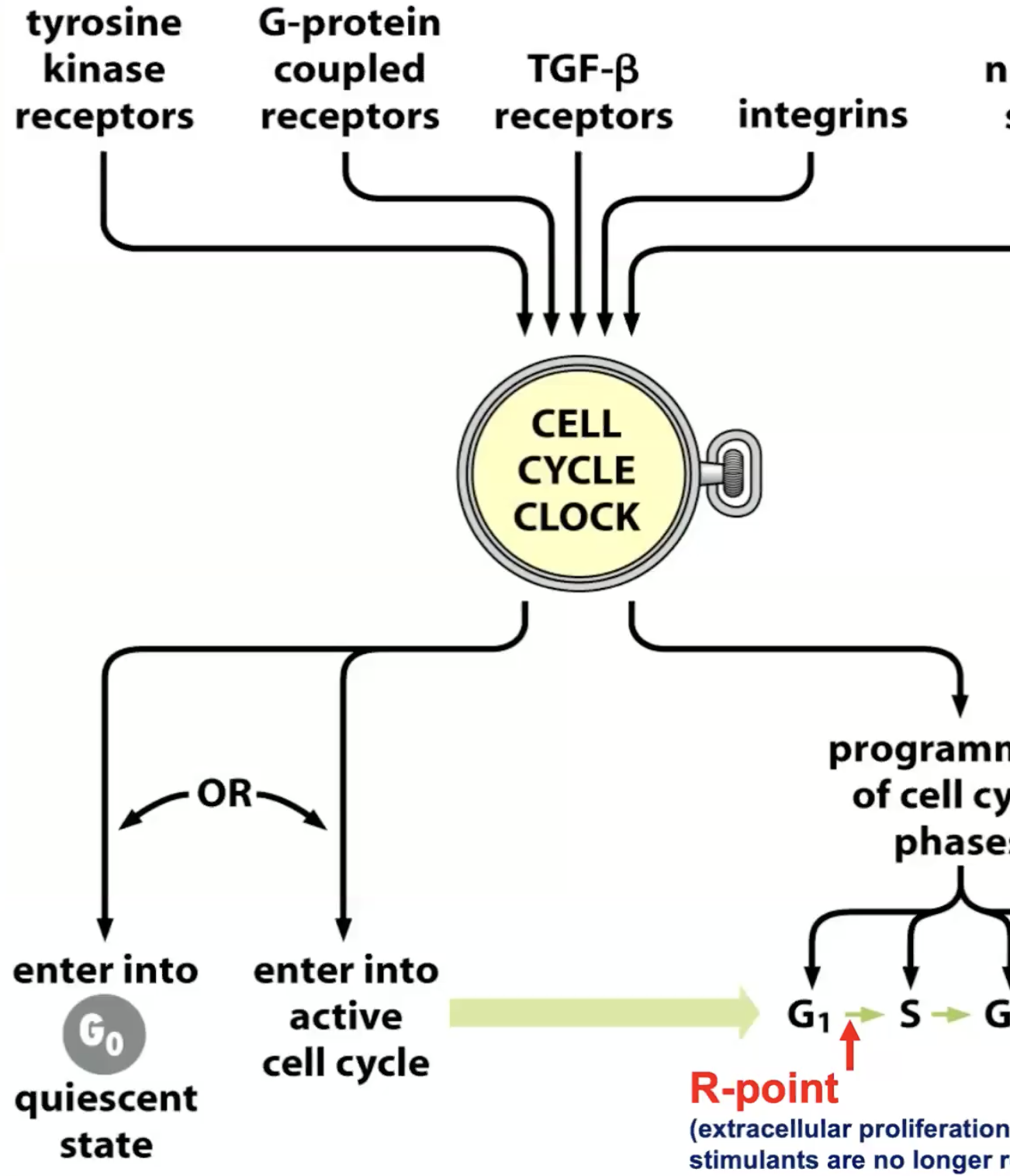
מנגנון E2F-Rb
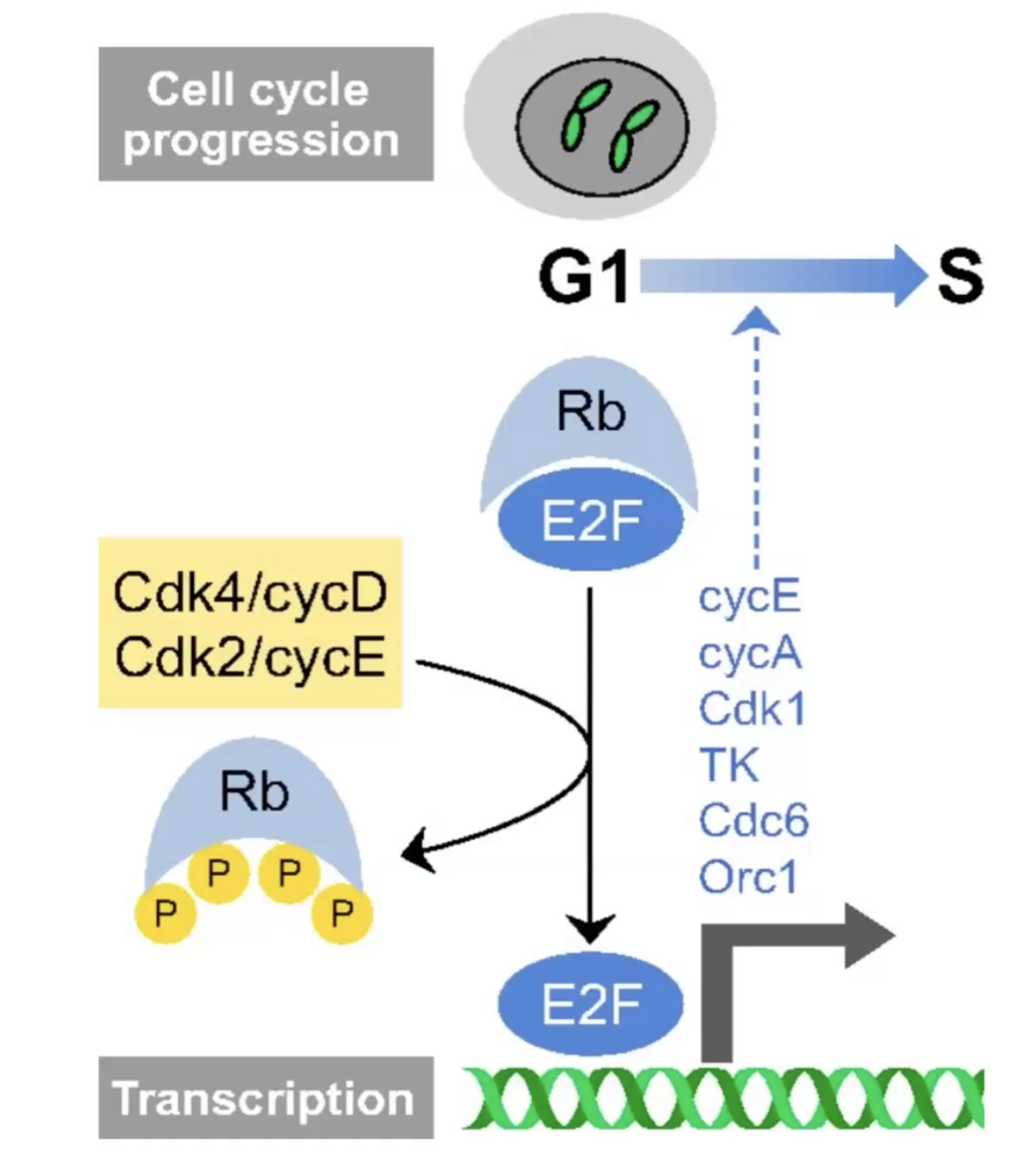
The R-point (E2F-Rb axis)
Retinoblastoma (Rb) - חלבון מדכא גידולים שהתגלה לראשונה בסרטן עין (רטינובלסטומה).
המנגנון:
- במצב לא מזורחן, Rb קושר ומעכב את פקטור השעתוק E2F
- Cdk4/6-Cyclin D מזרחן את Rb
- Rb המזורחן משחרר את E2F
- E2F מפעיל שעתוק של גנים הכרחיים ל:
- סינתזת DNA
- ייצור ציקלינים נוספים (כמו Cyclin E)
- חלבונים לשכפול DNA
E2F - פאקטור שעתוק חיוני לשכפול DNA, במיוחד בשלב S.
פאקטור שעתוק - חלבון שמקשר ל-DNA ומפעיל שעתוק של גנים ספציפיים.
פאזת S - סינתזה ושכפול
שני תהליכים מרכזיים מתרחשים ב-S:
1. רפליקציית DNA
- שכפול מלא של הגנום
- מבוקר על ידי Cdk2-Cyclin E (כניסה) ו-Cdk2-Cyclin A (התקדמות)
2. דופליקציה של צנטרוזומים
- הצנטרוזום בתא אינטרפאזי מורכב משני צנטריולים
- ב-S נוצרים עוד שני צנטריולים
- הצנטרוזומים משמשים כמרכזי ארגון מיקרוטובולים (MTOC)
- חיוניים ליצירת ציר החלוקה במיטוזה
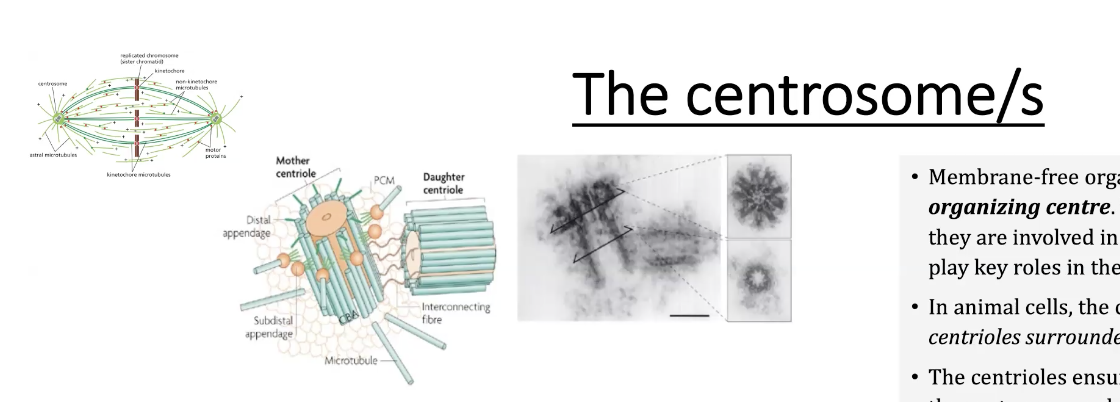
שלבי המיטוזה
1. פרופאזה (Prophase)
- עיבוי כרומטין - היווצרות כרומוזומים נראים
- חלבוני קונדנסין וקוהזין מסייעים בתהליך
- מודיפיקציות של היסטונים תורמות לעיבוי
2. פרומטאפאזה (Prometaphase)
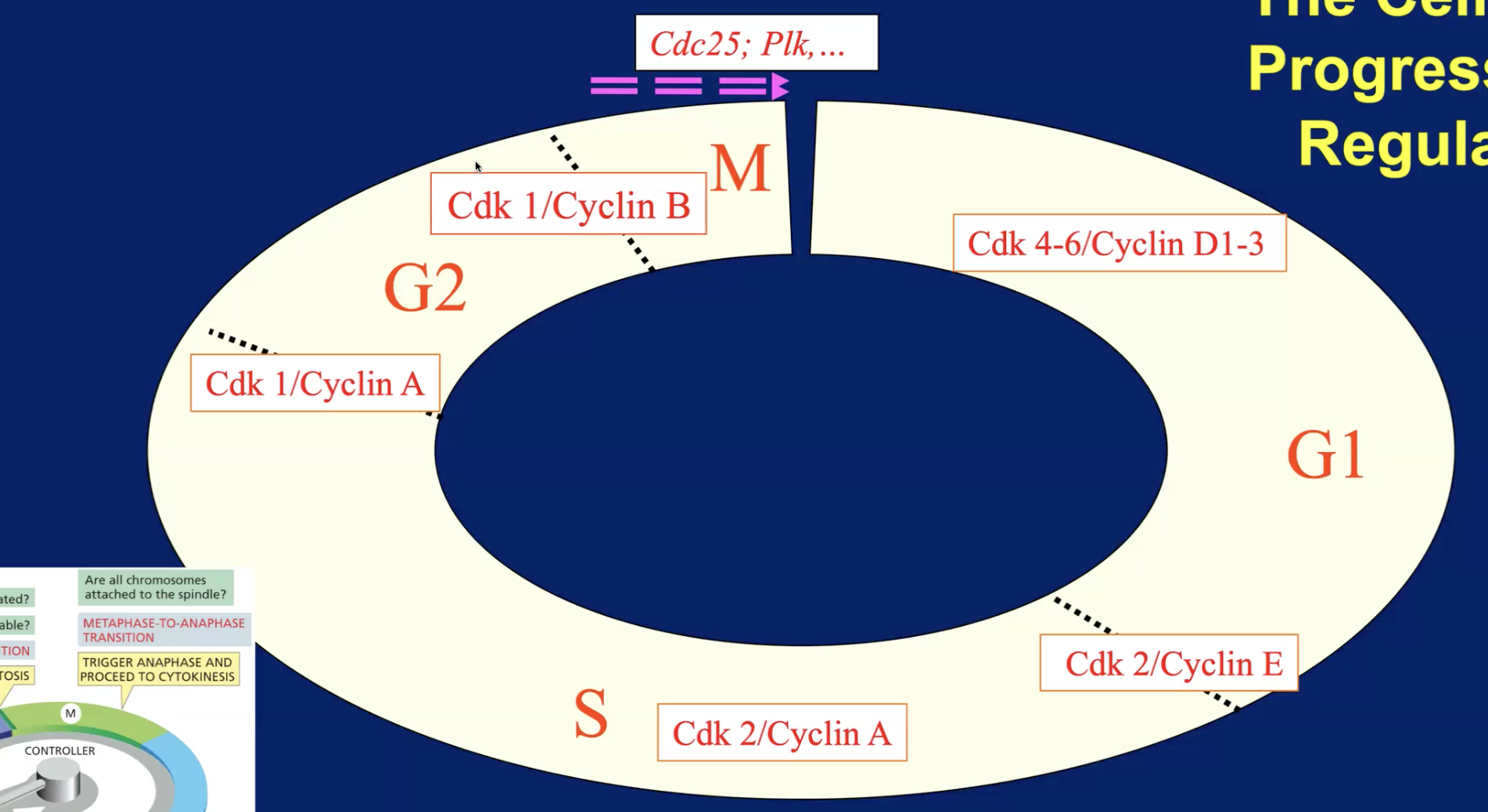
- פירוק מעטפת הגרעין (Nuclear Envelope Breakdown - NEBD)
- Cdk1-Cyclin B מזרחן למינים וחלבונים נוספים
- גורם לדיסאינטגרציה של הממברנה
- התחברות מיקרוטובולים לקינטוכורים
- קינטוכורים - אזורים בכרומוזום עשירים בחלבונים
- מכילים וריאנט של היסטון H3 בשם CENP-A
- משמשים כנקודות עגינה למיקרוטובולים
3. מטאפאזה (Metaphase)
- היערכות כרומוזומים במישור המשווני (Metaphase Plate)
- כל הקינטוכורים חייבים להיות מחוברים למיקרוטובולים
- Spindle Assembly Checkpoint - מוודא שכל החיבורים תקינים
4. אנאפאזה (Anaphase)
מתחלקת לשני תהליכים:
- Anaphase A: התכווצות מיקרוטובולים קינטוכוריים - מושכת כרומטידות לקטבים
- Anaphase B: התארכות מיקרוטובולים המחברים צנטרוזומים לממברנת התא
5. טלופאזה וציטוקינזיס (Telophase & Cytokinesis)
- הרכבה מחדש של מעטפות גרעיניות סביב הכרומוזומים
- דה-קונדנסציה של הכרומטין
- יצירת טבעת התכווצות מאקטין ומיוזין
- חלבון ספסטין חותך את הגשר הציטופלזמי האחרון
זמנים ואבחון
- משך מיטוזה: 30 דקות עד שעה וחצי
- סה”כ מחזור תא בתרבית: כ-24 שעות
- ברקמות חיות: יכול להימשך ימים עד שבועות
ניתן לזהות תאים בשלבי המחזור השונים על ידי:
- כמות DNA - מבדילה בין $\text{G}_1$ (2n), S (2n-4n) ו-$\text{G}_2$/M (4n)
- מורפולוגיה - במיוחד בשלבי המיטוזה השונים
- סמנים מולקולריים - ביטוי ציקלינים ספציפיים
השלכות קליניות
הבנת מחזור התא קריטית למחקר ולטיפול בסרטן. תרופות רבות פועלות על:
- עיכוב Cdks ספציפיים
- הפרעה לנקודות ביקורת
- פגיעה בציר החלוקה
מוטציות בגנים כמו Rb, p53, p16 או ציקלינים שונים נמצאות בבסיס גידולים סרטניים רבים.
הבדל בין תאים סומטיים לתאי רבייה
בעוד שתאים סומטיים עוברים מיטוזה ויוצרים שני תאי בת זהים גנטית, תאי המין עוברים מיוזה - תהליך שונה הכולל:
- יצירת כיאזמות (chiasma) - נקודות מגע בין כרומוזומים הומולוגיים
- החלפת חומר גנטי (רקומבינציה)
- יצירת גמטות הפלואידיות
סיכום
מחזור התא הוא תהליך מורכב ומבוקר בקפידה, המבטיח העברה מדויקת של המידע הגנטי לדורות הבאים של תאים. השילוב בין גורמים מקדמים (Cdk-Cyclin) ומעכבים (CKIs ונקודות ביקורת), יחד עם התיאום ההדוק עם מסלולי העברת אותות, מבטיח שחלוקת התא תתרחש רק בתנאים המתאימים. הבנה מעמיקה של התהליכים האלה חיונית להבנת התפתחות נורמלית, רגנרציה של רקמות, וכן לפיתוח טיפולים למחלות הקשורות בחלוקת תאים בלתי מבוקרת.
שיעור 22 - מוות תאי מבוקר
תאריך: 30/06/2025חזקים במוות תאי?
נסו 10 שאלות, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? חפשו בחנים נוספים בדפים אחרים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
פתיחה: החשיבות הקריטית של מוות תאי
מוות תאי מהווה אחד המנגנונים החשובים ביותר בביולוגיה של התא - לא פחות חשוב מחלוקת תאים. כפי שהודגש בהרצאה, כולנו, התאים שלנו והרקמות שלנו הם תמותיים (mortal), אך המוות התאי אינו רק סוף הסיפור. זהו תהליך מבוקר ומתוזמן בקפידה שמתרחש לאורך כל החיים ומאפשר את קיומנו התקין.
נקודה קריטית להבנה: מוות תאי מבוקר הכרחי לחיים! ללא היכולת לסלק תאים פגומים, שחוקים או מיותרים, לא נוכל להתקיים. התהליך פעיל במהלך ההתפתחות העוברית, בגדילה, ולאורך כל חיינו הבוגרים.
דוגמאות קלאסיות לחשיבות התהליך
דוגמאות מרכזיות שהוזכרו בהרצאה:
במחלות ניווניות: במחלת אלצהיימר, הצטברות חלבונים שלא עברו קיפול נכון (protein aggregates) יוצרת אגרגטים רעילים. תאים אלו חייבים להיות מסולקים במהירות כדי לאפשר לתאים סמוכים להתחלק ולתפוס את מקומם - תהליך שנקרא tissue replacement.
בחיי היומיום: אנחנו חיים בסביבה עוינת וצוברים נזקים לאורך החיים. ללא מנגנוני מוות תאי יעילים, נזקים אלו היו מצטברים ופוגעים בתפקוד.
הטקסונומיה המקיפה של מוות תאי

אנלוגיה מעניינת מהשיעור: המוות כשחקנית סנוקר, כאשר בהתאם לכדור שבו היא פוגעת, כך ייקבע סוג המוות התאי. יש לפחות עשרה סוגים שונים של מוות תאי מבוקר!
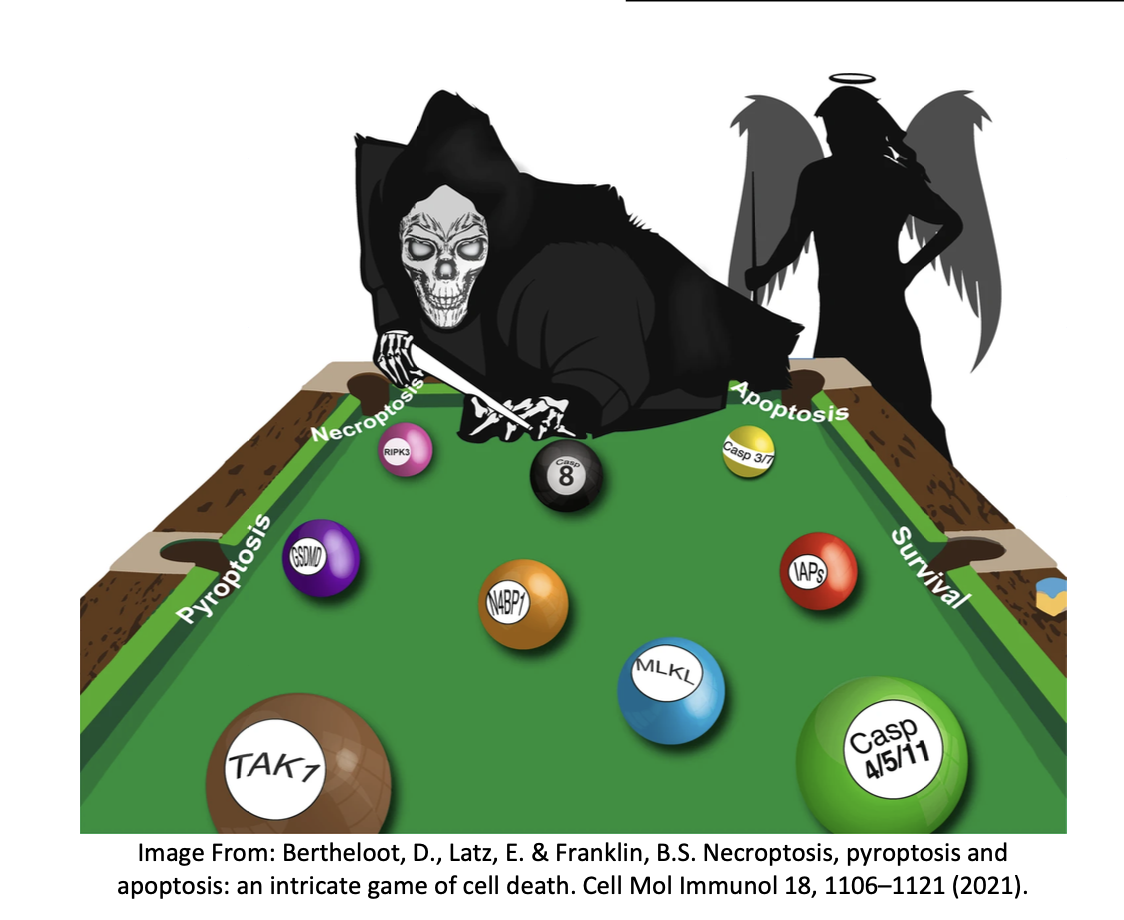
החלוקה הבסיסית
מוות מבוקר (Programmed Cell Death - PCD)
זהו מוות תאי המתרחש דרך מסלולי סיגנלינג מוגדרים, עם שרשרת אירועים ביוכימיים ברורה. הדגש החשוב: גם כאשר יש נזק חמור, התא עדיין מפעיל תוכנית מסודרת של מוות.
סוגי מוות מבוקר - סקירה מפורטת
מספר סוגים חשובים:
אפופטוזיס - הכוכב המרכזי
השם מיוונית: “נשירה” - כמו עלים שנושרים מהעץ. אפופטוזיס הוא המנגנון השמור ביותר אבולוציונית והמאופיין ביותר בספרות.
סימן ההיכר המולקולרי: הפעלת קספאזות (Caspases) - ציסטאין פרוטאזות החותכות אחרי אספרטט.
אוטופגיה
“התא אוכל את עצמו” - מתרחש בחוסר מזון. אם נמשך זמן רב מדי, מוביל למוות.
פירופטוזיס
מוות דלקתי המופעל כאשר פתוגנים (כמו סלמונלה או Mycobacterium tuberculosis) חודרים לתא. שונה לחלוטין מאוטופגיה במולקולות המעורבות ובסיגנלים. גורם גם לאיבוד שלמות ממברנת התא (כך התאים הנגועים מסולקים).
פרופטוזיס (Ferroptosis)
גילוי חדש מלפני כ-15-10 שנה: מוות הנגרם מפרוקסידציה של ליפידים עקב הצטברות יוני ברזל.
קופרופטוזיס (Cuproptosis)
מוות מהצטברות יוני נחושת. הקשר הקליני החשוב: מחלת וילסון - הצטברות נחושת בנוירונים ובתאי כבד.
המנגנון המפורט: נחושת נקשרת לחלבונים lipoylated המשתתפים במעגל קרבס, גורמת לאגרגציה שלהם ולעקה פרוטאוטוקסית. התא מאבד את ההומאוסטזיס ומת.
אלקללוזיס (Alkaliptosis)
מוות הנגרם מעלייה ברמות ה-pH בתא, בעיקר עקב חוסר אשלגן. הקשר הקליני: תסמונת Bartter - חוסר אשלגן מולד.
פרטנטוס (Parthanatos)
טאנאטוס הוא אל מוות ביוונית, ופרתנוס הוא “דרך”. מוות הנגרם מהפעלת PARP (Poly ADP-ribose polymerase) - אנזים המתקן נזקי DNA. כאשר יש נזק חמור מדי, PARP מפעיל את מסלול המוות.
מוות לא מבוקר - נקרוזה (Necrosis)
מוות פתאומי ומיידי ללא הפעלת מסלולים ביוכימיים. הדוגמה הקלאסית מההרצאה: “תשימו אקונומיקה על התא - הוא ימות מיד”. מאופיין בדזאינטגרציה של ממברנות ושפיכת תוכן התא החוצה.
ההבדל הקריטי: נקרוזה תמיד גורמת לדלקת חריפה בסביבה, בעוד שמוות מבוקר (כמו אפופטוזיס) מתרחש ללא דלקת.
אפופטוזיס - ניתוח מעמיק של המנגנון המרכזי
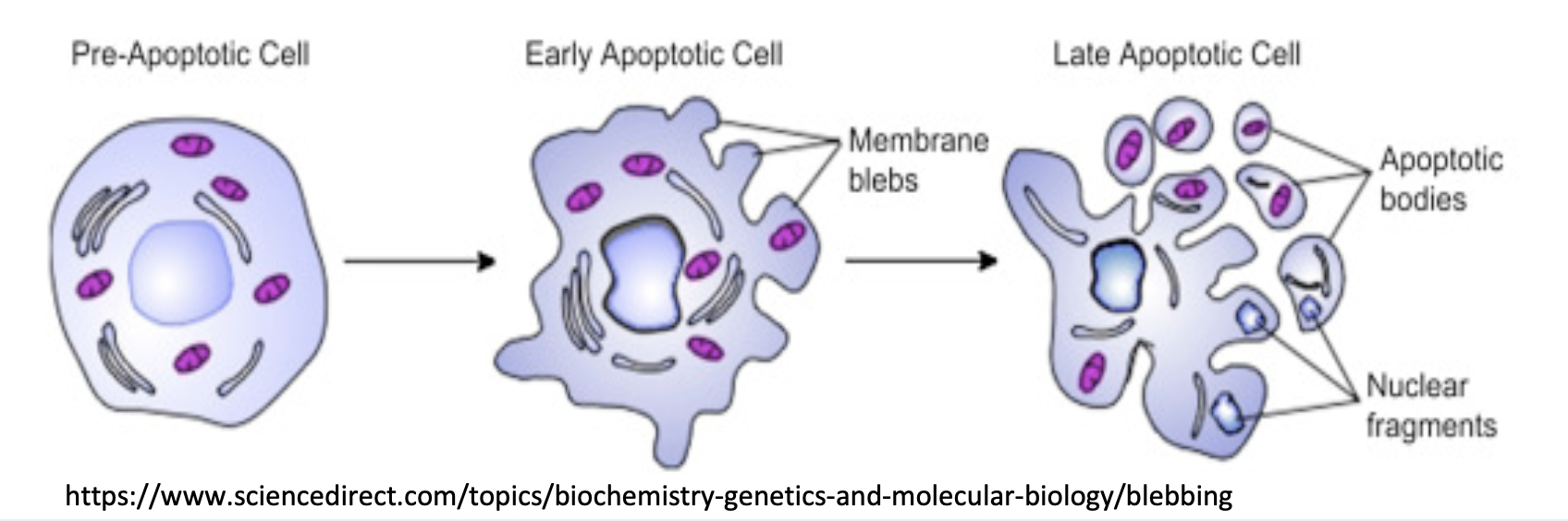
המאפיינים המורפולוגיים
הפרופסור הדגיש את היכולת לזהות תאים אפופטוטיים במיקרוסקופ:
תא בריא:
- ממברנת תא שלמה
- מעטפת גרעין תקינה
- כרומטין מפוזר עם ריכוזים ליד מעטפת הגרעין
- אברונים תקינים
תא אפופטוטי מוקדם:
- Cell blebbing - בליטות בממברנה עקב חיתוך חלבוני השלד (אקטין)

- עיבוי כרומטין
- התא עדיין שומר על שלמות יחסית
תא אפופטוטי מאוחר (Late apoptotic cell):
- Apoptotic bodies - גושי כרומטין מעובה
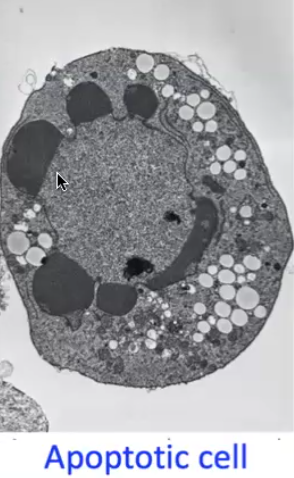
- פירוק מעטפת הגרעין
- פרגמנטציה מוחלטת (של הכרומטין והאברונים), על ידי הפעלה של קספאזות
החתיכות נבלעות על ידי תאים פאגוציטיים (כמו מקרופאגים) - כך נמנעת דלקת.
המסלול החיצוני (Extrinsic Pathway) - פירוט מלא
הפרופסור הדגיש שני מנגנונים עיקריים:
מסלול TNF-α
המקור: תאי מערכת החיסון - T cells, מקרופאגים, נויטרופילים, NK cells
המנגנון המפורט:
- TNF-α נקשר לקולטן (רצפטור) TNFR
- לא כמו ב-RTK רגיל! - אין זרחון צולב, אלא שינוי קונפורמציוני
- גיוס קומפלקס DISC (Death Inducing Signaling Complex)
- הנקודה הקריטית: Caspase-8 מצטרף לקומפלקס (Cas-8)
- דימריזציה של Cas-8 - יחידה אחת חותכת את השנייה
- הפיכה מזימוגן (פרו-אנזים) לאנזים פעיל
הדגש: גיוס קאספאזות.
הבדלה בין Intrinsic ל-Extrinsic Pathway היא קריטית להבנת המנגנון:
- Extrinsic: מתחיל מחוץ לתא, דורש סיגנל חיצוני (כמו TNF-α)
- Intrinsic: מתחיל בתוך התא, בעיקר מהמיטוכונדריה
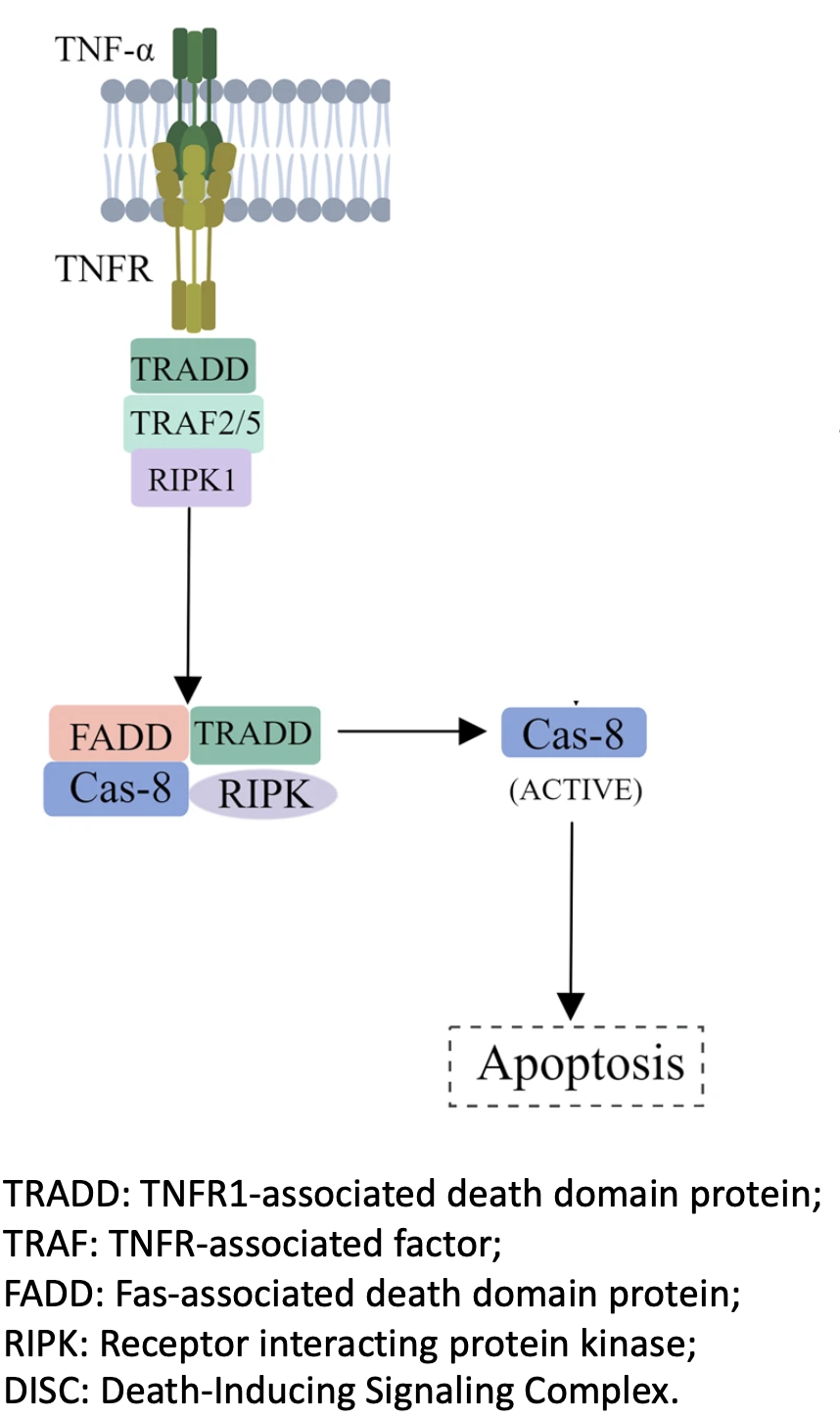
מסלול Fas (FasL)
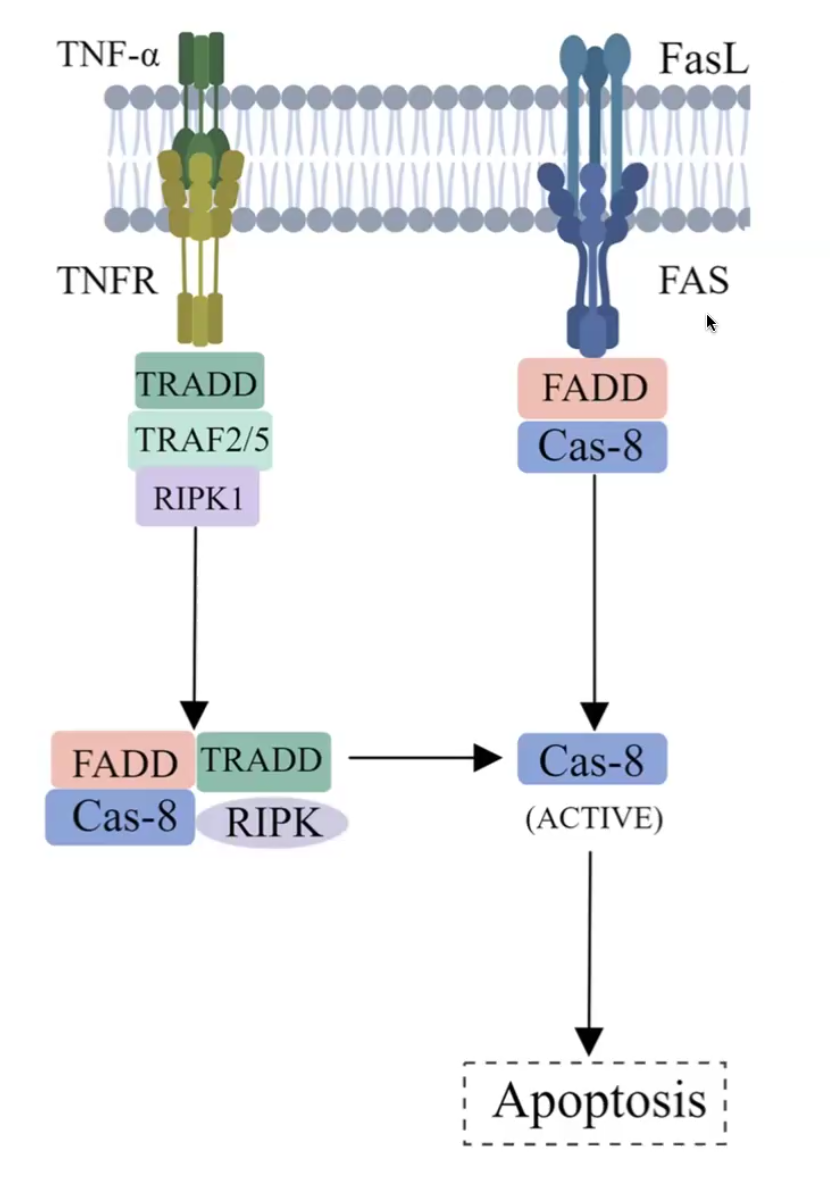
ההבדל המהותי: דורש מגע פיזי (אינטרקציה) בין תאים!
הדוגמה החשובה: תא T killer המזהה תא פגום חייב “להתיישב” עליו פיזית. זה מבטיח ספציפיות גבוהה - לא כמו TNF-α שיכול להגיע מרחוק.
המנגנון זהה: Fas ligand על תא החיסון נקשר ל-Fas receptor, יוצר DISC, מפעיל Cas-8.
Cas-8 הופך ממצב של זימוגן לאנזים פעיל.
המסלול הפנימי (Intrinsic Pathway) - הפירוט החיוני
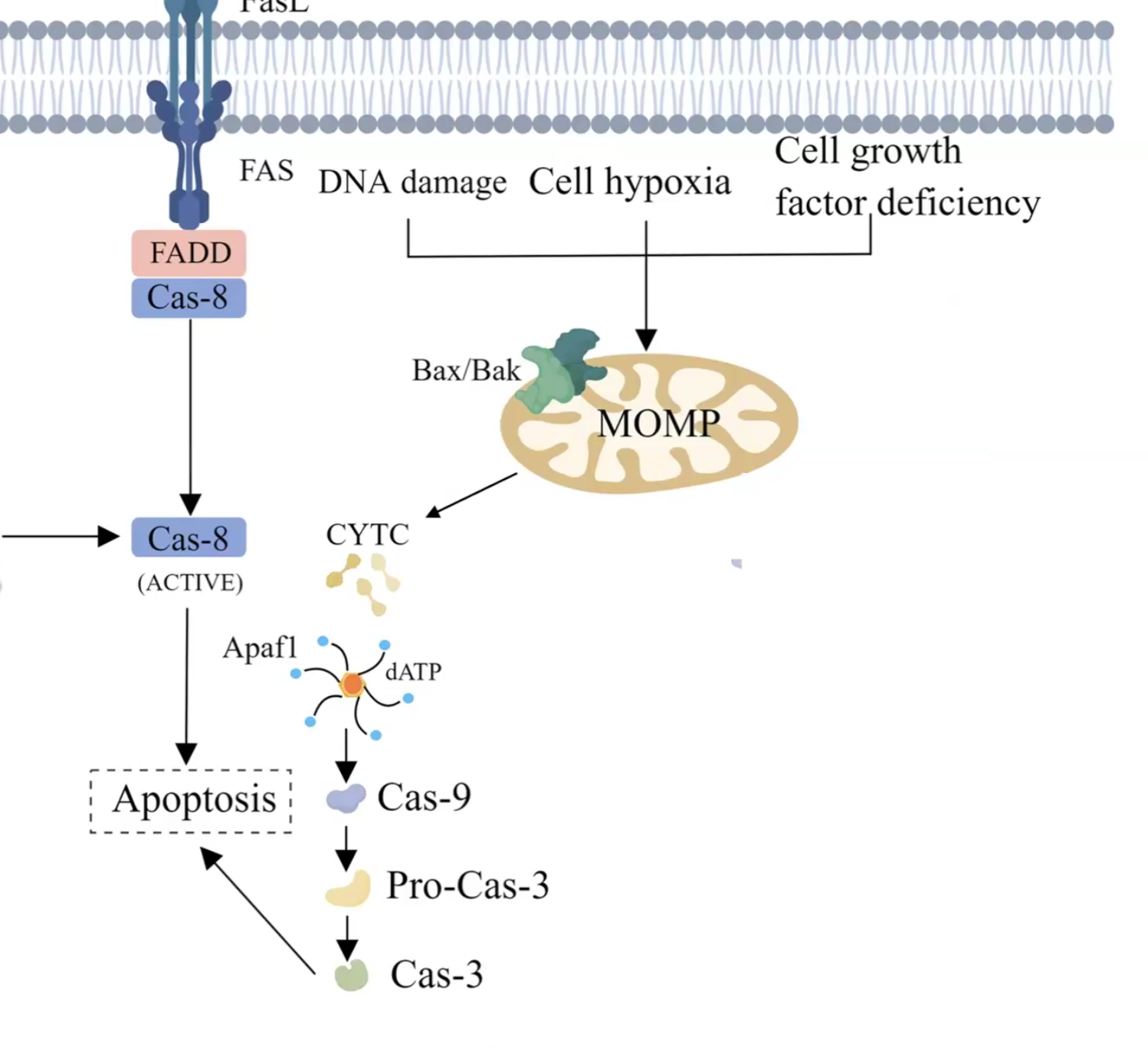
המקור תמיד מהמיטוכונדריה! - זו נקודת מפתח שהפרופסור חזר עליה. (- חדירת חלבונים מהמיטוכונדריה לציטופלזמה.)
MOMP: mitochondrial outer membrane permeabilization
הטריגרים למסלול
- היפוקסיה
- נזקי DNA
- חוסר בגורמי גדילה (כמו חוסר גלוקוז)
- הצטברות ROS (Reactive Oxygen Species)
- פגיעה במעגל קרבס
המנגנון המולקולרי המלא
השלב הקריטי: שחרור ציטוכרום c מהמיטוכונדריה (Cytc).
החידוש החשוב: הממברנה המיטוכונדריאלית יכולה להישאר שלמה! מספיק שינוי בתעלות.
השרשרת המלאה:
- Cytc יוצא לציטופלזמה
- נקשר ל-Apaf-1 (Apoptotic Protease Activating Factor)
- מאקטבים את Caspase-9
- יוצרים יחד עם Caspase-9 את האפופטוזום (Cas-9 + Apaf-1)
- Cas-9 מופעל
- חותך את Caspases 3, 6, 7
Cytc נקשר ל Apaf-1
מוות תאי לא-אפופטוטי ממיטוכונדריה
נקודה קריטית שהפרופסור הדגיש: מהמיטוכונדריה יכולים לצאת גם:
- AIF (Apoptosis Inducing Factor)
- Endonuclease G (EndoG)
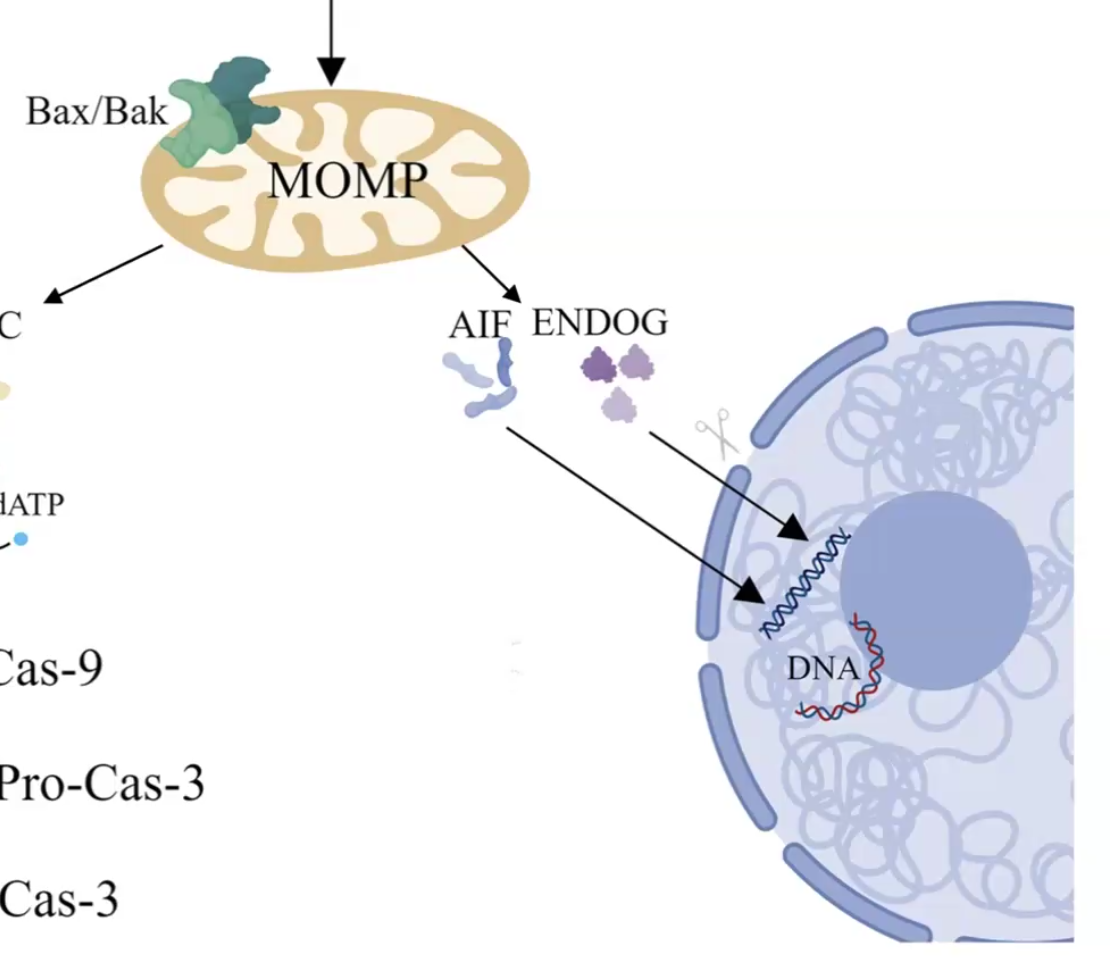
אלו אינם חלק מאפופטוזיס! הם גורמים ל-“Caspase-independent cell death”.
הגדרנו מוות אפפטודי כמוות שמבוסס על קאספאזות.
Caspase-independent cell death - לא מוות אפופטוטי!
ההבדל המעשי: תהליך מהיר יותר, עשוי לגרום לדלקת (בניגוד לאפופטוזיס).
משפחת Bcl-2 - מערכת הבקרה המרכזית
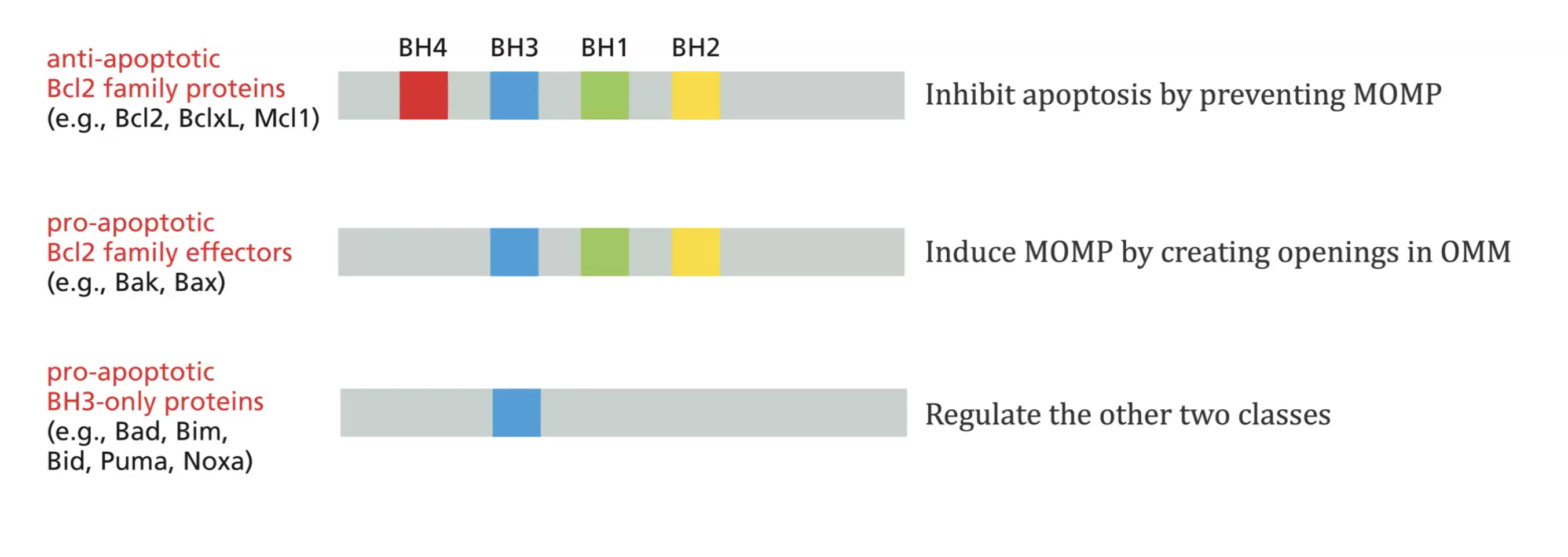
הרקע ההיסטורי
Bcl-2 התגלה ב-B-cell lymphoma - תאי סרטן שלא מתים בגלל ביטוי יתר של חלבון זה.
שלוש הקבוצות והדומיינים שלהן
אנטי-אפופטוטיים
- חלבונים: Bcl-2, Bcl-XL
- דומיינים: BH1, BH2, BH3, BH4 (כל הארבעה!)
- תפקיד: מונעים יציאת ציטוכרום c
פרו-אפופטוטיים
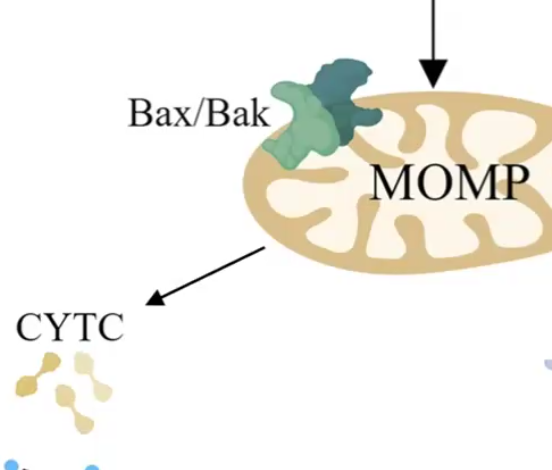
- חלבונים: Bax, Bak
- דומיינים: BH1, BH2, BH3 (אין BH4!)
- תפקיד: יוצרים את התעלה בממברנה שמאפשרת יציאת ציטוכרום c
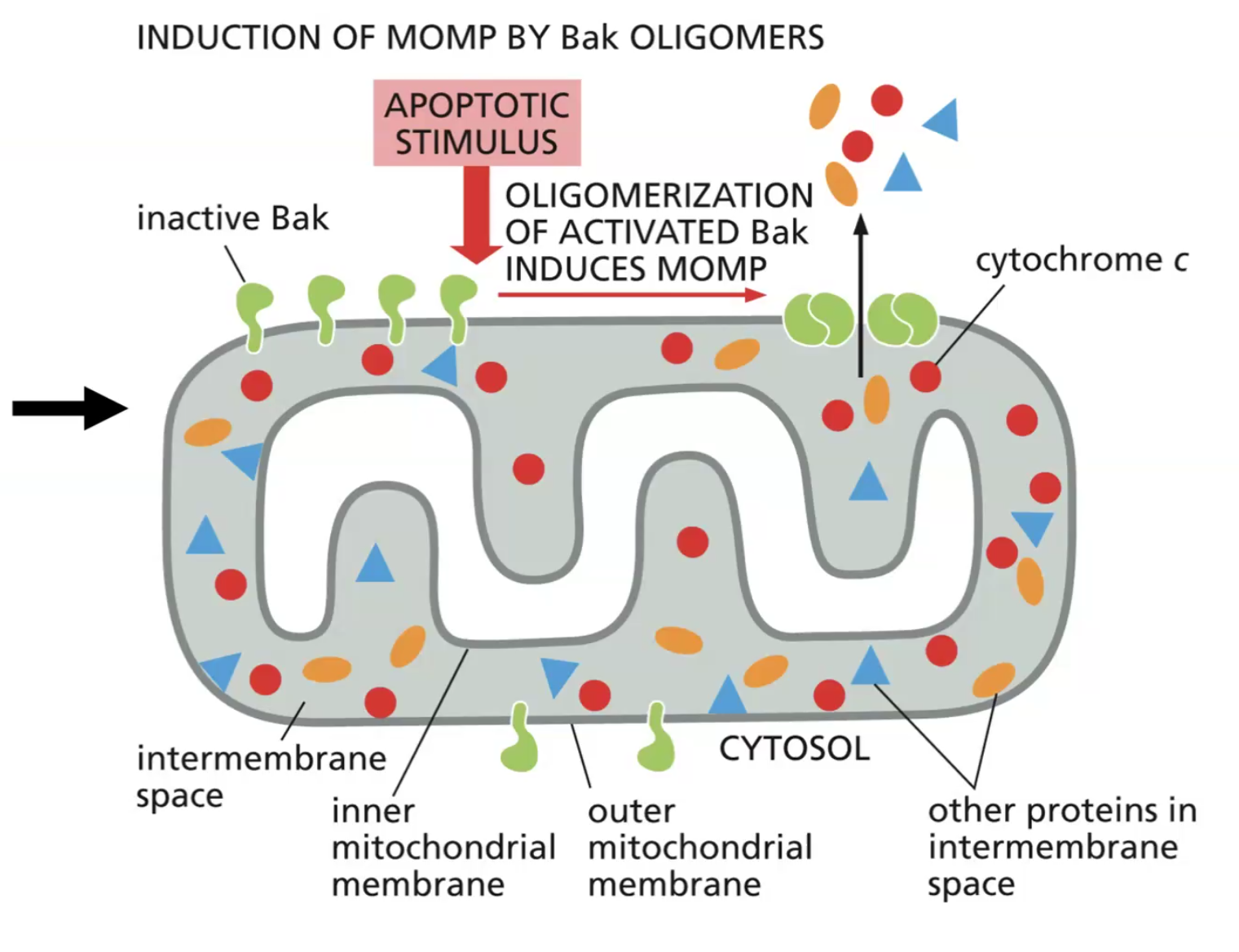
המנגנון המפורט:
- בתנאי מנוחה - Bax ו-Bak מפוזרים בנפרד
- בתגובה לעקה (כמו ROS) - עוברים אוליגומריזציה
- יוצרים תעלה פיזית בממברנה
- ציטוכרום c יוצא
רגולטורים (BH3-only)
- חלבונים: BID, Bad
- דומיינים: רק BH3!
- תפקיד: מבקרים את הבקרים
שלוש רמות הבקרה - המורכבות המלאה
“תמיד יש בקרה על בקרה על בקרה”
- רמה 1: Bax/Bak יוצרים תעלות
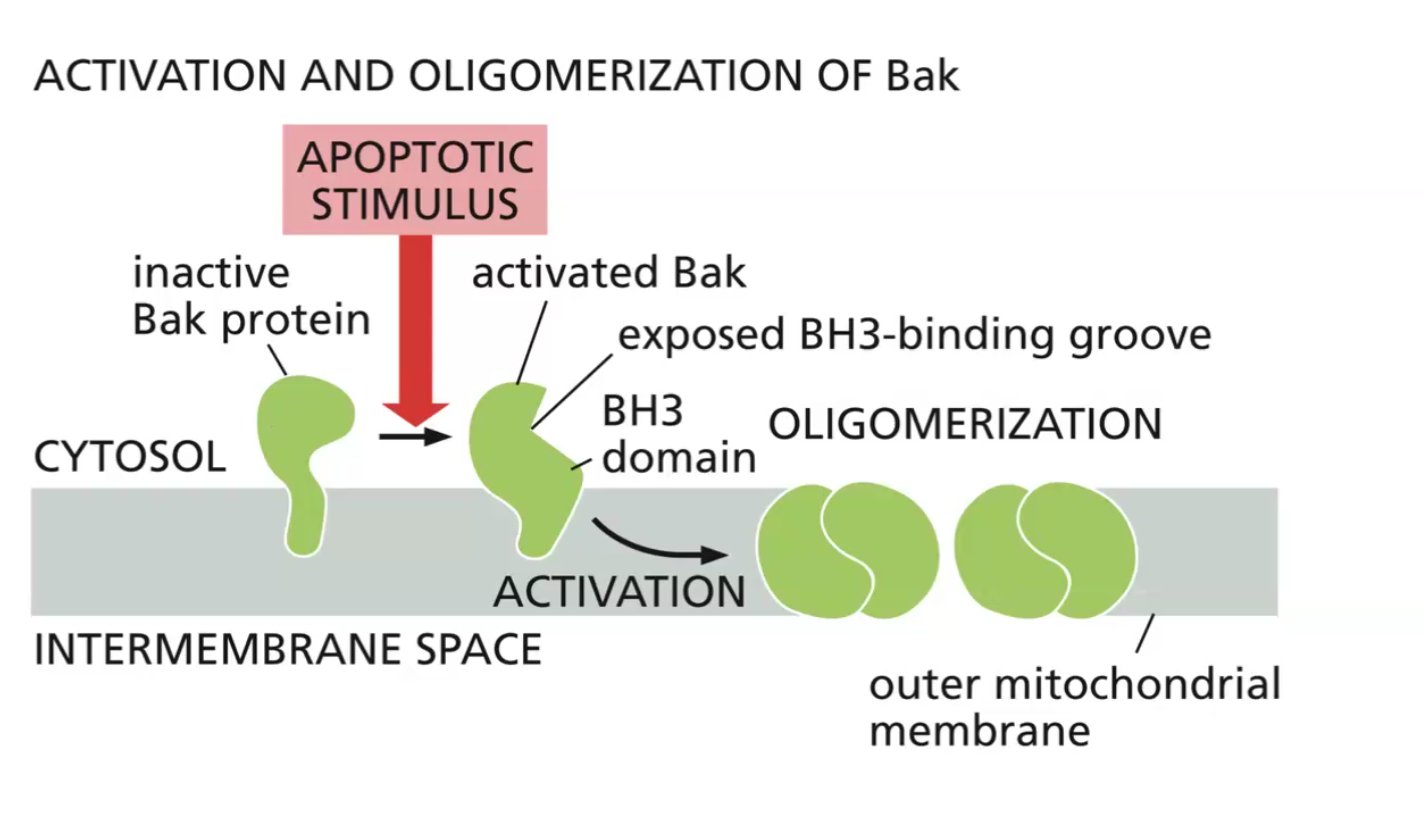
-
רמה 2: Bcl-2/Bcl-XL קושרים את Bax/Bak ומונעים יצירת תעלות
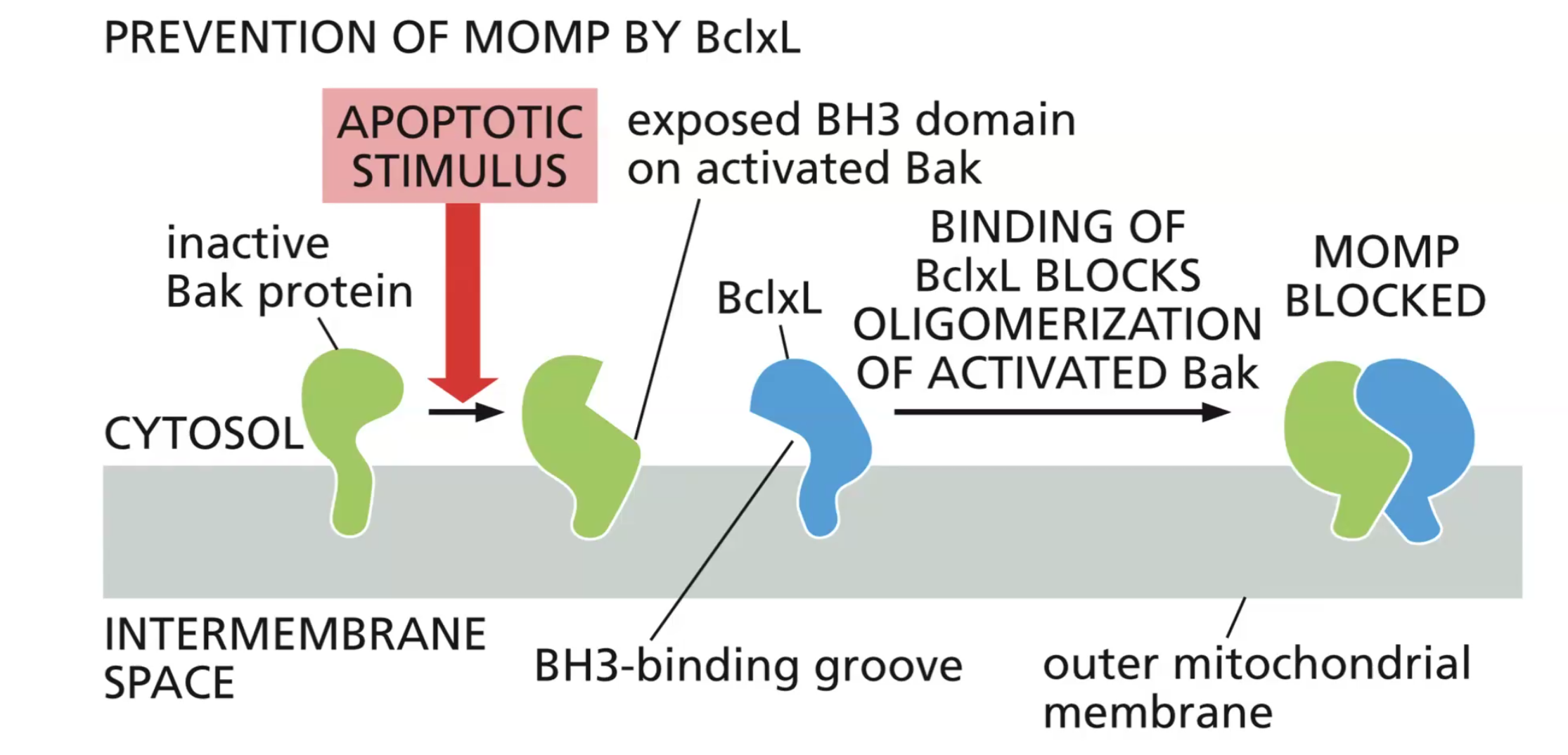
ביטול ביטוי שלהם בלימופמה - סרטן הדם
- רמה 3: BID/Bad קושרים את Bcl-2/Bcl-XL ומשחררים את Bax/Bak
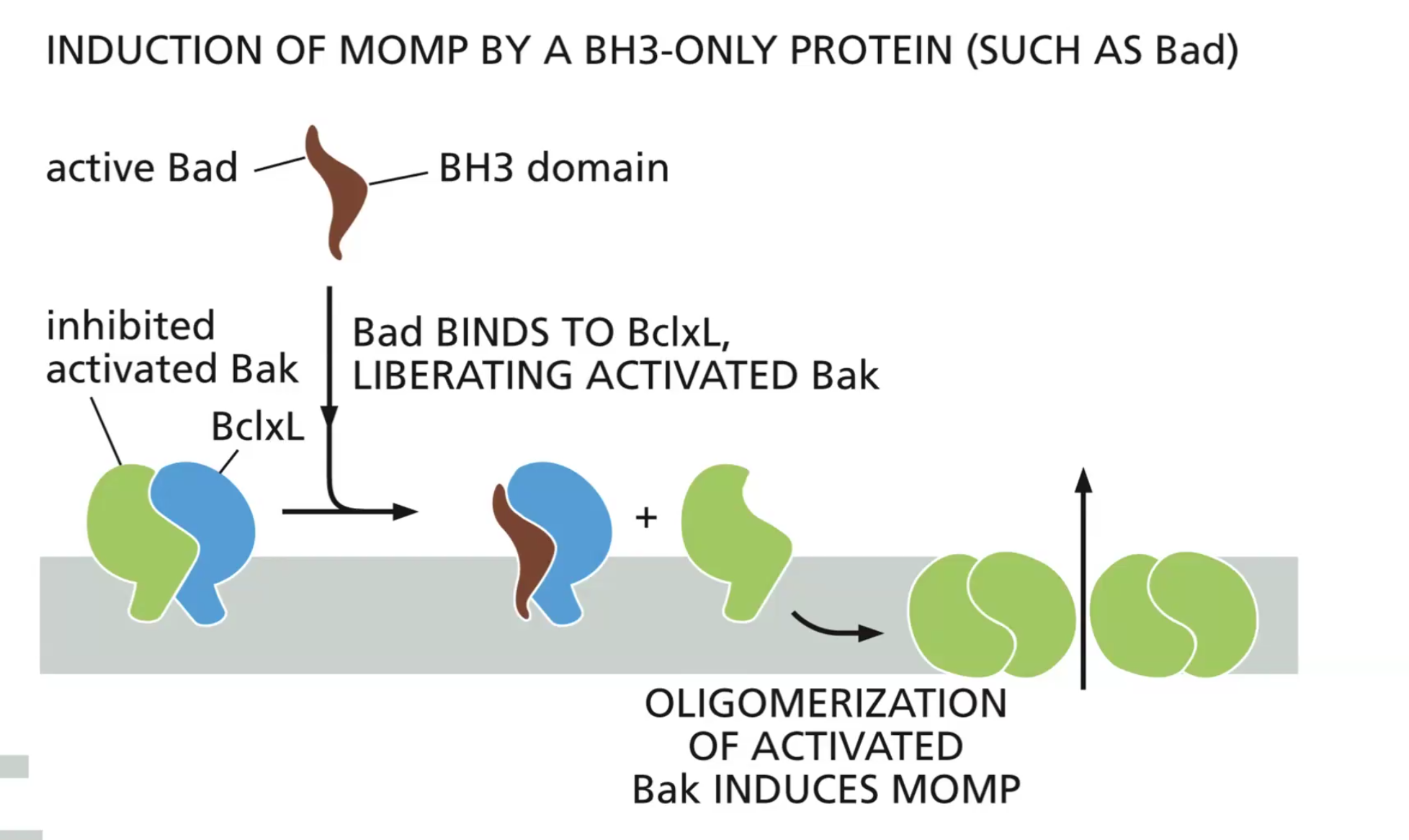
האיזון הקריטי: היחס בין כמויות החלבונים קובע אם התא ימות או ישרוד.
האינטגרציה עם מסלולי הישרדות - החיבור הקריטי
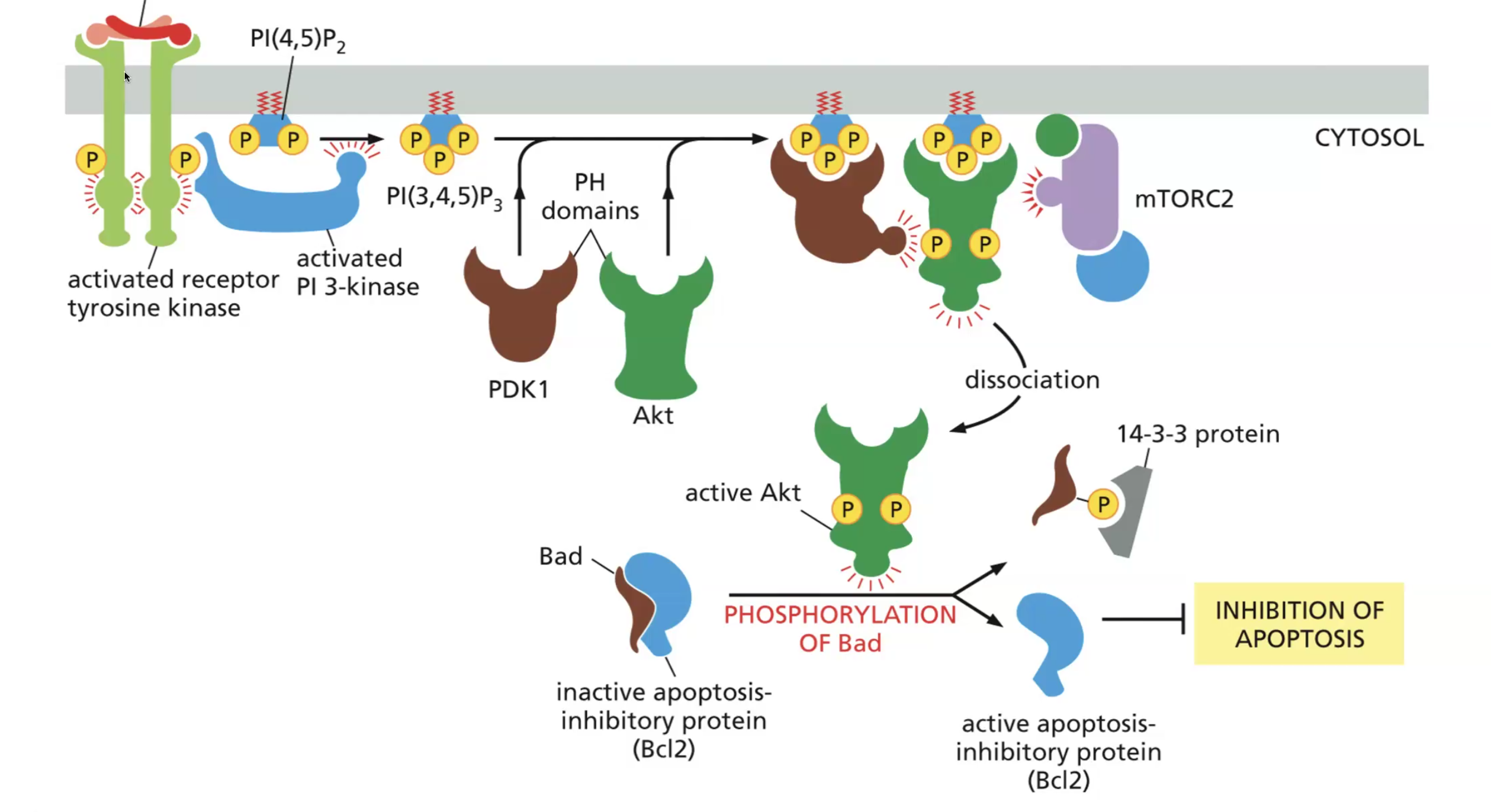
מסלול PI3K/Akt - הקשר לאפופטוזיס
כיצד מסלולי גדילה מונעים מוות:
השרשרת המלאה:
- גורם גדילה (EGF/PDGF) ← RTK
- PI3K ← PIP3
- PDK1 ← Akt activation
הפעולות האנטי-אפופטוטיות של Akt:
- זרחון Bad:
- Akt מזרחן את Bad
- Bad המזורחן יוצא מהמיטוכונדריה
- Bcl-2 נשאר פעיל ומונע אפופטוזיס
-
עיכוב p27/p21: מאפשר התקדמות במחזור התא
תזכורת:
- p27/p21 הם מעכבי ציקלינים
- Akt מזרחן אותם, מפעיל את ציקלין D1, ומאפשר מעבר מ-G1 ל-S
- קידום סינתזה: ליפידים, חלבונים, גלוקוז - תומך בחיי התא
הנקודה הקלינית: זו הסיבה שמסלול PI3K/Akt הוא “major drug target” בסרטן!
חלבוני cIAP - קו ההגנה האחרון
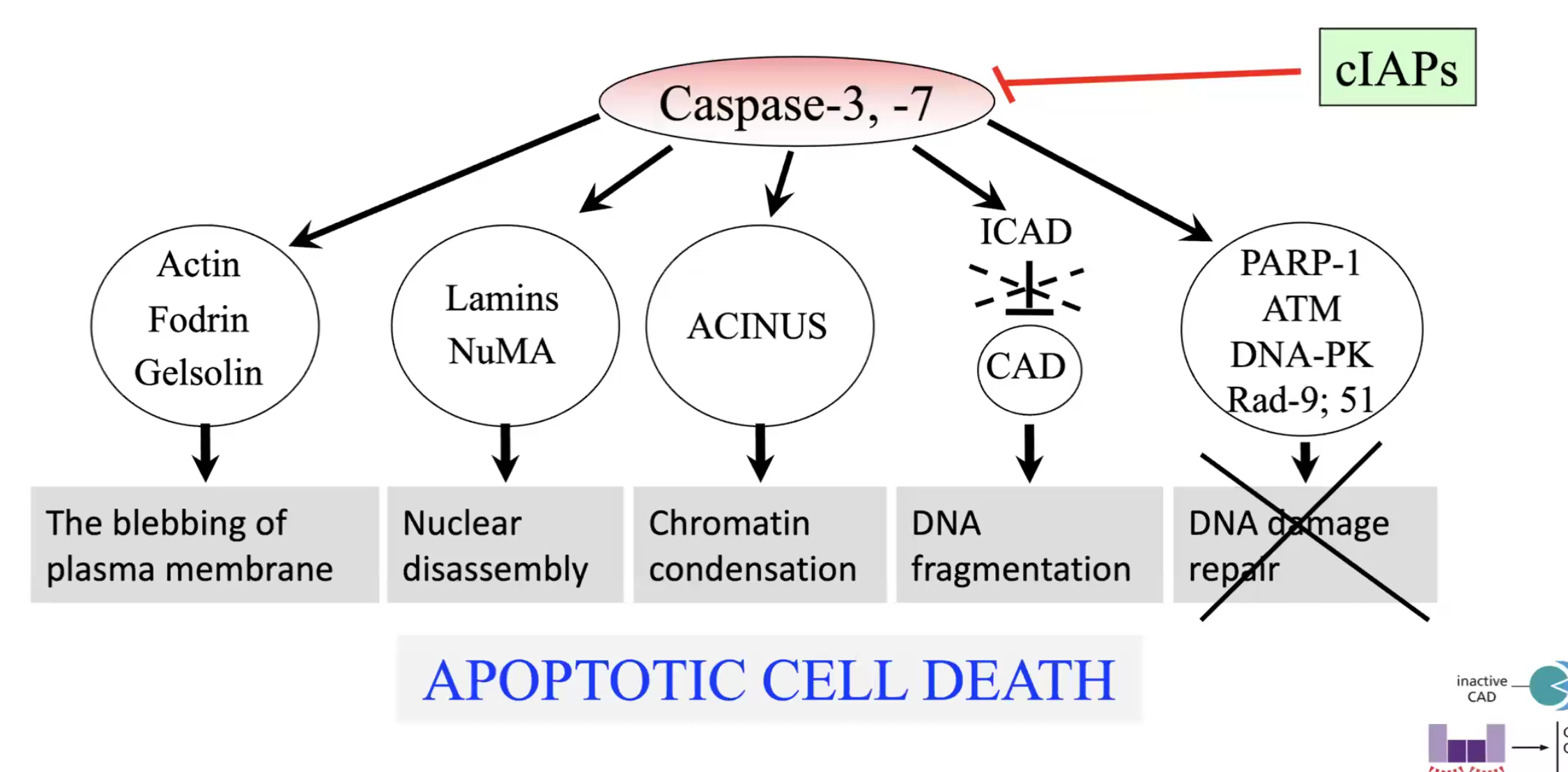
משפחת מעכבי האפופטוזיס (Cellular Inhibitor of Apoptosis Proteins):
- cIAPs
- XIAP (X-linked IAP)
התפקיד: קושרים ומנטרלים קספאזות מופעלות
הנקודה החשובה: “מי שמהיר יותר מנצח!” - אם הקספאזות כבר התחילו לחתוך, שום דבר לא יעזור.
SMAC/DIABLO - המאזן הנגדי
חלבונים אנטי-אפופטוטיים (anti-IAPs) שמופרשים מהמיטוכונדריה:
- SMAC/Diablo (Second Mitochondria-derived Activator of Caspases)
- Omi - הופיע במצגת אבל לא הוזכר בהרחבה, למיטב הבנתי.
יוצאים מהמיטוכונדריה יחד עם ציטוכרום c וקושרים את ה-IAPs, משחררים את הקספאזות מעיכוב.
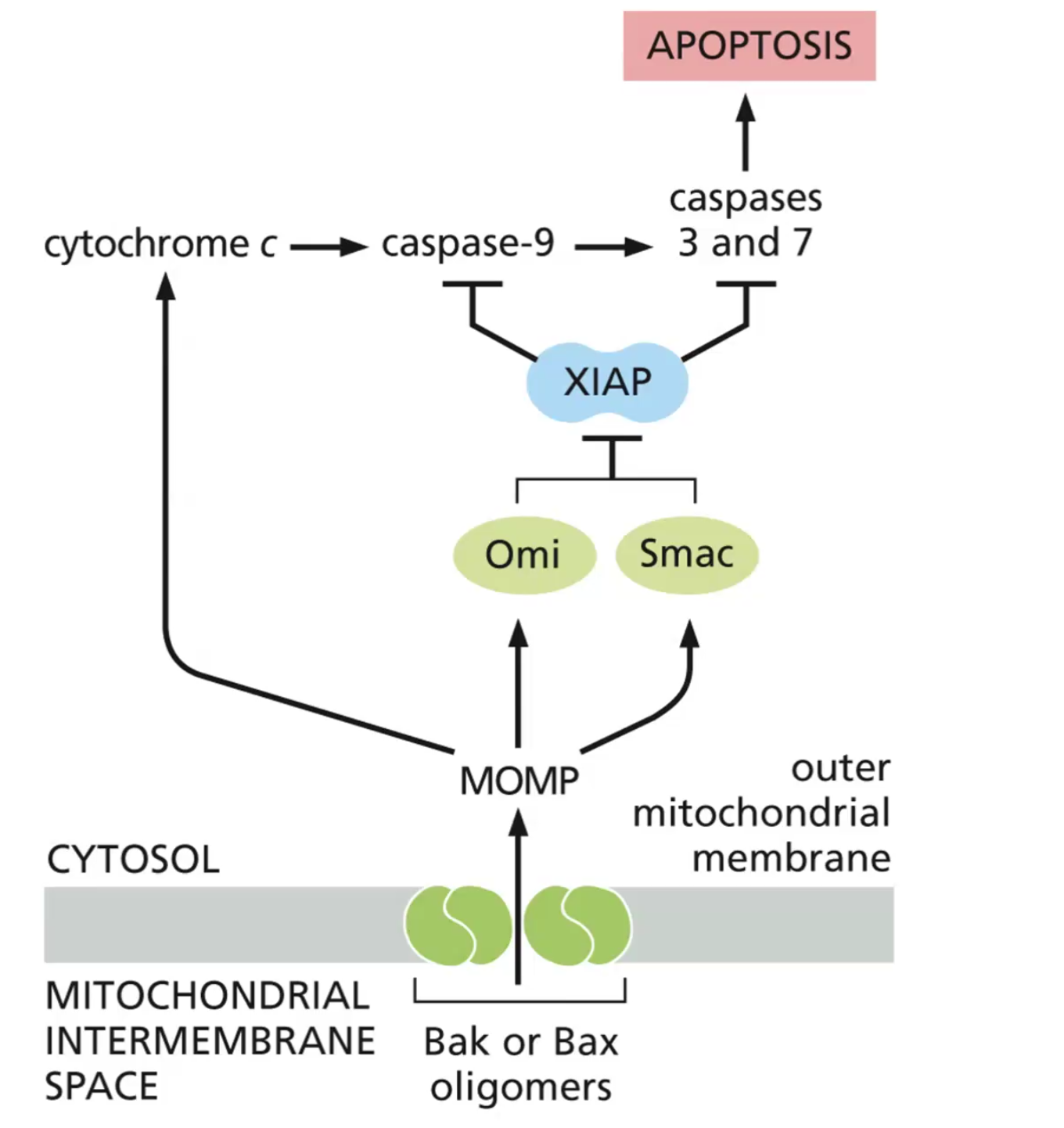
השלכות קליניות
בסרטן - מנגנוני הבריחה מאפופטוזיס
הבעיה המרכזית: תאים סרטניים מפתחים עמידות!
המנגנונים:
- ביטוי יתר של Bcl-2/Bcl-XL
- הפעלת יתר של PI3K/Akt
- ביטוי גבוה של IAPs
הגישה הטיפולית: “גם וגם” - תקיפה במספר מסלולים במקביל
במחלות ניווניות - יותר מדי מוות
דוגמה מההרצאה: באלצהיימר ופרקינסון, הצטברות אגרגטים (β-amyloid, α-synuclein, tau) מפעילה אפופטוזיס.
האסטרטגיה:
- עיכוב זמני של מוות תאי
- טיפול בגורם - פירוק האגרגטים
- “לתת לנוירון לחשוב פעמיים” - כי נוירונים לא מתחלקים!
הסטטיסטיקה המעודדת
המרצה הדגיש שסרטן היא מחלה נדירה יחסית!
- 77% מהגידולים מופיעים בגיל 55+
- המערכת שלנו עובדת מצוין רוב הזמן
- הבעיה: התאים הבודדים שבורחים מנצלים את המערכת לרעה
סיכום
-
מוות תאי הוא תהליך חיוני לחיים - לא פחות חשוב מחלוקת תאים
-
אפופטוזיס = הפעלת קספאזות - זו ההגדרה המולקולרית
- שני מסלולים עיקריים לאפופטוזיס:
- התחלה חיצונית לתא:
\[\begin{aligned} &\textbf{Extrinsic Pathway:} \\ &\text{TNF-α or FasL} \\ &\downarrow \\ &\text{DISC (Death-Inducing Signaling Complex)} \\ &\downarrow \\ &\text{Caspase-8} \\ &\downarrow \\ &\begin{cases} \text{Caspase-3, Caspase-6, Caspase-7} \rightarrow \text{Apoptosis} \\ \text{Bid} \rightarrow \text{tBid} \rightarrow \text{MOMP} \rightarrow \text{Intrinsic Pathway} \end{cases} \\ &\text{↓ Inhibition:} \\ &\text{cIAP, XIAP} \rightarrow \cancel{\text{Caspase-8, -3, -7}} \\ &\text{↓ Counteracting IAPs:} \\ &\text{SMAC/DIABLO, Omi} \rightarrow \text{Neutralize IAPs} \end{aligned}\]
- התחלה פנימית - מהמיטוכונדריה:
\[\begin{aligned} &\textbf{Intrinsic Pathway:} \\ &\text{Cellular Stress (DNA damage, ROS, Hypoxia)} \\ &\downarrow \\ &\text{Activation of Bax/Bak} \\ &\downarrow \\ &\text{MOMP (Mitochondrial Outer Membrane Permeabilization)} \\ &\downarrow \\ &\text{Cytochrome c + SMAC/DIABLO} \\ &\downarrow \\ &\text{Apaf-1 + Cyt c} \\ &\downarrow \\ &\text{Apoptosome Formation} \\ &\downarrow \\ &\text{Caspase-9} \\ &\downarrow \\ &\text{Caspase-3, Caspase-6, Caspase-7} \\ &\downarrow \\ &\text{Apoptosis} \\ &\text{↓ Positive Regulation:} \\ &\text{Bid, Bad (BH3-only)} \rightarrow \text{Inhibit Bcl-2/Bcl-XL} \\ &\text{↓ Negative Regulation:} \\ &\text{Bcl-2, Bcl-XL} \rightarrow \cancel{\text{Bax/Bak activation}} \\ &\text{↓ Survival Pathway:} \\ &\text{PI3K → Akt → Bad phosphorylation → Inhibits apoptosis} \end{aligned}\]
-
תמיד יש ריבוי רמות בקרה - המערכת מוודאת שההחלטה נכונה
-
האיזון קובע: בין פרו- לאנטי-אפופטוטיים, בין קספאזות ל-IAPs
- ההבנה המולקולרית מאפשרת טיפול - כל חלבון הוא מטרה פוטנציאלית
כפי שהוזכר בהרצאה: הכרת המנגנונים האלה חיונית להבנת מחלות ולפיתוח תרופות. המורכבות של המערכת מבטיחה שתאים ימותו רק כשצריך, וישרדו כשצריך - וזו הסיבה שאנחנו חיים טוב (בלי עין הרע).
| path | Initiator Caspase | Executioner Caspases |
|---|---|---|
| Extrinsic | Caspase-8 | Caspase-3, 6, 7 |
| Intrinsic | Caspase-9 | Caspase-3, 6, 7 |
| blocked by IAPs | Caspase-3, 7, 9 | – |