מבוא: אנזימים כקטליזטורים ביולוגיים
הגדרות ומושגי יסוד
- אנזים (Enzyme): חלבון עם פעילות קטליטית. ככלל, אנזימים הם חלבונים, אבל יש גם חריגים כמו RNA קטליטיים בשם ריבוזימים (Ribozymes)
- אתר פעיל (Active Site): חלל תלת-ממדי בחלבון שבו מתרחשת הקטליזה
- סובסטרט (Substrate, S): המגיב בריאקציה האנזימטית
- תוצר (Product, P): התוצר של הריאקציה האנזימטית
עקרון הפעולה של אנזימים
אנזימים לא קובעים אם ריאקציה תתרחש או לא - הם רק מזרזים ריאקציות שהן תרמודינמית אפשריות ($\Delta G < 0$).
דוגמה: המרת פירובט לאצטיל-CoA על ידי פירובט דהידרוגנאז:
- ללא האנזים - הריאקציה כל כך איטית שלא היינו יכולים לקיים את מעגל קרבס
- עם האנזים - הריאקציה מתרחשת במהירות המאפשרת חיים
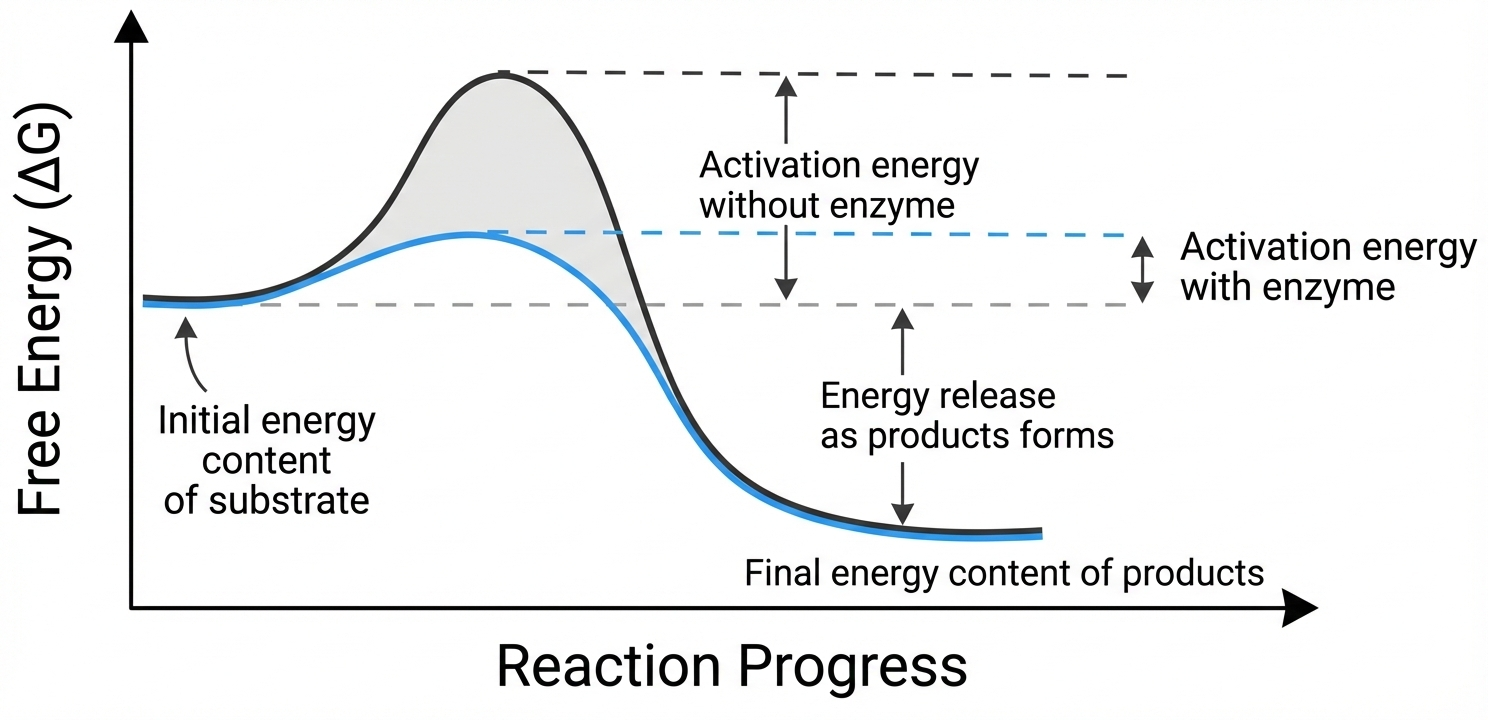
אנרגיית אקטיבציה והורדתה
- אנרגיית אקטיבציה: ההפרש באנרגיה החופשית בין המגיבים לפיק המחסום האנרגטי
- אנזימים מורידים את אנרגיית האקטיבציה אך לא משנים את ה-$\Delta G$ של הריאקציה
- ההאצה יכולה להגיע לפי 10,000,000-10,000
מאפייני האתר הפעיל
תכונות מבניות
- חלק קטן מהחלבון - רוב מסת החלבון משמשת לייצוב ומיקום מדויק של האתר הפעיל
- התכנסות שיירים רחוקים - שיירי צד רחוקים ברצף מתקרבים במרחב התלת-ממדי
- ספציפיות גבוהה - התאמה מדויקת לסובסטרט
דוגמה: פרוטאז NS2B-NS3 של נגיף דנגי
הטריאדה הקטליטית:
- $\ce{Ser 135}$ - השייר הקטליטי העיקרי (נוקלאופיל)
- $\ce{His 51}$ - בסיס כללי
- $\ce{Glu 75}$ - מייצב את ההיסטידין
הפרוטאז מזהה רצף ספציפי: $\ce{E-N-L-Y-F-Q\downarrow G}$ (חיתוך בין $\ce{Q}$ ל-$\ce{G}$)
סוגי התאמה לסובסטרט
- התאמה גיאומטרית - הכיס באנזים מתאים לצורת הסובסטרט
- התאמה אלקטרוסטטית - משיכה בין מטענים מנוגדים (למשל $\ce{Arg+}$ ל-$\ce{Glu-}$)
- התאמה הידרופובית - אזורים הידרופוביים בסובסטרט נכנסים לכיסים הידרופוביים
Induced Fit - התאמה מושרית
מנגנון שהדגים הקסוקינאז:
- $\ce{glucose}$ נקשר לאתר הפעיל
- האנזים משנה קונפורמציה
- השינוי מקרב את ה-$\ce{ATP}$ ל-$\ce{glucose}$
- מתאפשרת העברת פוספט מ-$\ce{ATP}$ לפחמן 6 של ה-$\ce{glucose}$
חשוב: האתר הפעיל לא מתאים 100% לסובסטרט - אחרת האנזים היה “תקוע” עם הסובסטרט
קו-פקטורים וקו-אנזימים
קו-פקטורים (Cofactors)
מולקולות קטנות או יונים הנדרשים לפעילות:
- $\ce{Mg^2+}$ - נדרש לקישור $\ce{ATP}$ (הקסוקינאז, קרבוניק אנהידראז)
- $\ce{Zn^2+}$ - קרבוקסיפפטידאז, קרבוניק אנהידראז
- $\ce{Fe^2+/Fe^3+}$ - ציטוכרומים, פרוקסידאזות
מונחים:
- אפו-אנזים (Apoenzyme) - האנזים ללא הקו-פקטור
- הולו-אנזים (Holoenzyme) - האנזים + קו-פקטור (הצורה הפעילה)
קו-אנזימים (Coenzymes)
נגזרות של ויטמינים:
- $\ce{NAD+/NADH}$ - נגזרת של ניאצין (B3), נשא אלקטרונים
- $\ce{FAD/FADH2}$ - נגזרת של ריבופלאבין (B2)
- תיאמין פירופוספט ($\ce{TPP}$) - נגזרת של תיאמין (B1), חיונית לפירובט דהידרוגנאז
- קו-אנזים A - נגזרת של חומצה פנטותנית
דוגמה קלינית: צפדינה (Scurvy) - מחסור בויטמין C גורם לפגיעה בסינתזה של קולגן
שישה סוגי אנזימים (לפי EC Classification)
1. אוקסידורדוקטאזות (EC 1)
ריאקציות חמצון-חיזור:
\[\ce{ethanol + NAD+ ->[alcohol dehydrogenase] acetaldehyde + NADH + H+}\]זיהוי: שם האנזים מכיל “דהידרוגנאז”
2. טרנספראזות (EC 2)
העברת קבוצות פונקציונליות:
\[\ce{glucose + ATP ->[hexokinase] glucose-6-phosphate + ADP}\]העברת פוספט γ מ-$\ce{ATP}$ לפחמן 6
3. הידרולאזות (EC 3)
שבירת קשרים בעזרת מים:
- פרוטאזות - הידרוליזה של קשרים פפטידיים
- ליפאזות - הידרוליזה של אסטרים
- גליקוזידאזות - הידרוליזה של קשרים גליקוזידיים
דוגמה: TEV פרוטאז (ציסטאין פרוטאז)
4. ליאזות (EC 4)
יצירת קשרים כפולים על ידי הוצאת קבוצות:
\[\ce{2-phosphoglycerate ->[enolase] phosphoenolpyruvate + H2O}\]5. איזומראזות (EC 5)
שינוי מבני בתוך המולקולה:
\[\ce{glucose-6-phosphate <=>[phosphohexose isomerase] fructose-6-phosphate}\]המרה מטבעת 6 איברים לטבעת 5 איברים (דורש $\ce{Mg^2+}$)
6. ליגאזות (EC 6)
חיבור שתי מולקולות תוך צריכת $\ce{ATP}$:
- DNA ליגאז - מחבר מקטעי אוקזקי בשכפול DNA
- חיבור קשר פוספודיאסטר בין 3’-OH ל-5’-פוספט
מצב המעבר (Transition State)
המושג והחשיבות
מצב המעבר ($\ce{S^‡}$) הוא הקונפורמציה בעלת האנרגיה הגבוהה ביותר במסלול הריאקציה.
אנלוגיית מקל המתכת (Figure 6-5 בספר הלימוד):
- מקל ישר = סובסטרט
- מקל מכופף = מצב מעבר
- שני חצאים = תוצרים
- ככל שהמקל נשאר יותר זמן מכופף, הסיכוי לשבירה גדל
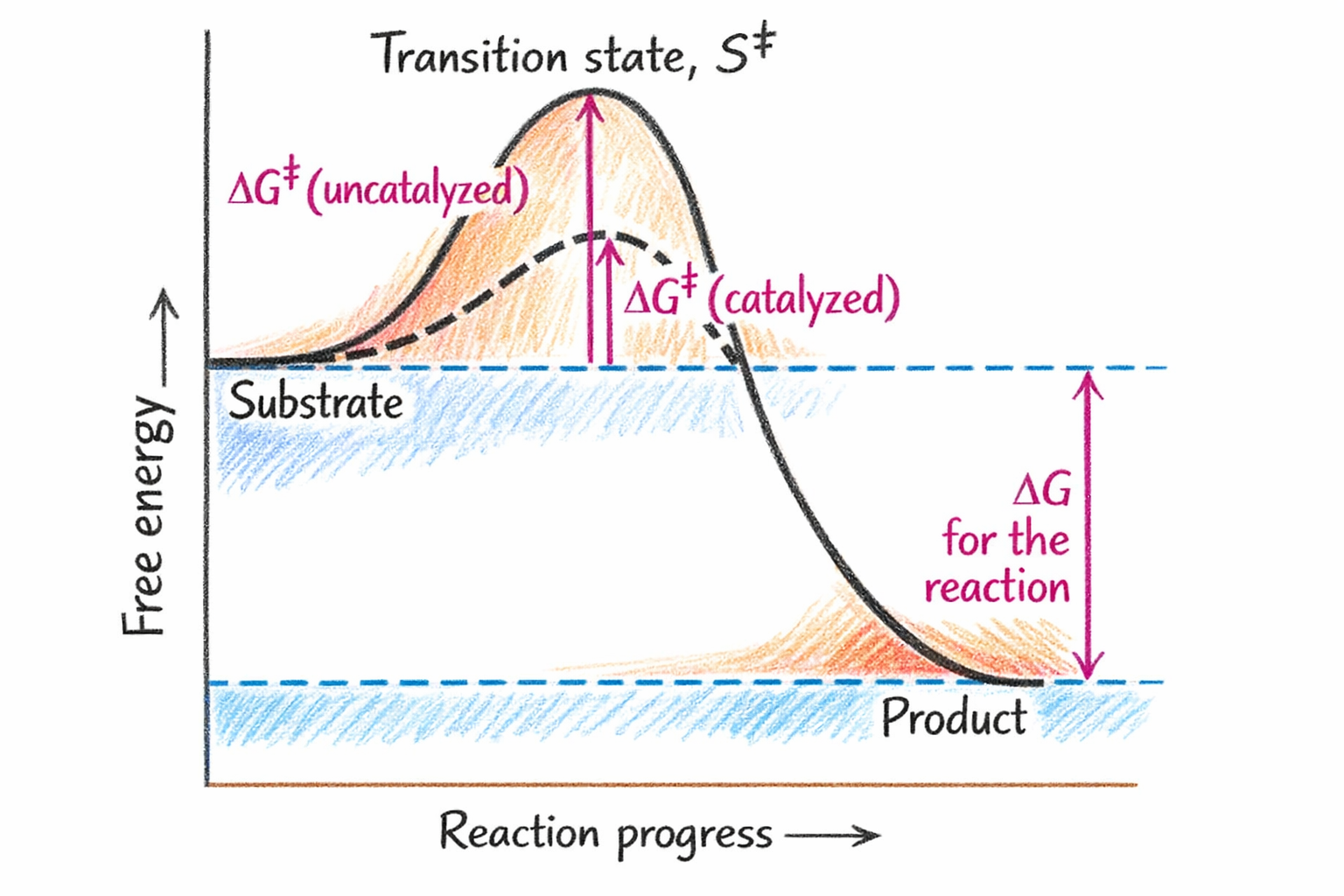
מנגנון ייצוב מצב המעבר
- האתר הפעיל לא מתאים בדיוק לסובסטרט
- האתר הפעיל מתאים יותר למצב המעבר
- הייצוב מוריד את אנרגיית האקטיבציה
- מאפשר התקדמות לתוצרים
נקודה חשובה: אם האנזים היה מתאים בדיוק לסובסטרט, הוא היה יוצר מינימום אנרגטי עמוק והריאקציה לא הייתה מתקדמת!
שלבי הריאקציה האנזימטית
\[\ce{E + S <=>[k_1][k_{-1}] ES ->[k_2] EP ->[k_3] E + P}\]קבועי המהירות:
- $k_1$ = קבוע קישור סובסטרט
- $k_{-1}$ = קבוע דיסוציאציה של $\ce{ES}$
- $k_2$ = קבוע קטליזה ($k_\text{cat}$)
- $k_{-2} \approx 0$ (מזניחים בדרך כלל)
קינטיקה אנזימטית - תיאורית מיכאליס-מנטן
הנחות היסוד (מ-1913)
- מצב עמיד (Steady State):
- $[\ce{ES}]$ קבוע לאורך המדידה. כלומר, ריכוז הקומפלקס $\ce{ES}$ לא משתנה עם הזמן:
- $d[\ce{ES}]/dt = 0$
- מזניחים ריאקציה הפוכה: $k_{-2} \approx 0$
- מדידה בתחילת הריאקציה: $[\ce{P}] \approx 0$
פיתוח המשוואה
הגדרות:
- \[\left[\ce{E}\right]_{\text{total}} = \left[\ce{E}\right]_{\text{free}} + \left[ \ce{ES} \right]\]
- במצב עמיד: קצב יצירת $\ce{ES}$ = קצב פירוק $\ce{ES}$
קבוע מיכאליס ($K_{\text{m}}$):
\[\boxed{K_{\text{m}} = \frac{k_{-1} + k_2}{k_1}}\]משמעות $K_{\text{m}}$:
- ריכוז הסובסטרט כאשר $V = V_\max/2$
- יחידות: מולר (M)
- מדד לאפיניות ($K_{\text{m}}$ נמוך = אפיניות גבוהה) - בתנאים בהם $k_{-1} \gg k_2$
משוואת מיכאליס-מנטן
\[\boxed{V_0 = \frac{V_\max \times [\ce{S}]}{K_{\text{m}} + [\ce{S}]}}\]כאשר:
- $V_0$ = מהירות התחלתית
- $V_\max = k_2 \times [\ce{E}]_\text{total}$
- $[\ce{S}]$ = ריכוז סובסטרט
גרף מיכאליס-מנטן
- עקומה היפרבולית (רוויה)
- ב-$[\ce{S}] \ll K_{\text{m}}$: התנהגות ליניארית (מסדר ראשון)
- ב-$[\ce{S}] \gg K_{\text{m}}$: התנהגות של רוויה (מסדר אפס)
- ב-$[\ce{S}] = K_{\text{m}}$: $V = V_\max/2$
מדידות מעשיות
מהירות התחלתית ($V_0$)
למה מודדים רק בהתחלה?
- בריאקציות הפיכות, הצטברות תוצר גורמת לריאקציה הפוכה
- מדידה בשניות/מילישניות הראשונות
- האזור הליניארי של הגרף
ניסוי טיפוסי
- סדרת מבחנות עם ריכוזי סובסטרט עולים
- כמות אנזים זהה בכל מבחנה
- מדידת $V_0$ בכל מבחנה
- בניית גרף $V_0$ מול $[\ce{S}]$
שיטות מעקב
- ספקטרופוטומטריה - שינוי בבליעה ($\ce{NADH}$ בולע ב-340nm)
- פלואורסנציה - תוצר פלואורסנטי
- pH - שחרור/צריכת פרוטונים
- טמפרטורה - ריאקציות אקסותרמיות
דוגמאות ספציפיות מההרצאה
הקסוקינאז
- אנזים ראשון בגליקוליזה
- ריאקציה בלתי הפיכה (שלב קובע מהירות)
- מונע יציאת $\ce{glucose}$ מהתא (לאחר זירחון)
- 4 איזוזימים בגוף האדם
משל פועל פס הייצור
להמחשת $V_\max$:
- 3 קופסאות ליום - קל מאוד
- 100 קופסאות ליום - עדיין אפשרי
- 2000 קופסאות ליום - רק 1500 (המקסימום)
- 3000 קופסאות ליום - עדיין רק 1500
בתנאים של רוויה, הוספת סובסטרט לא מעלה את המהירות. כמו כן, אם נתון שריאקציה מתקיימת בתנאים של $V_{\max}$, נוכל להסיק שהאנזים רווי בסובסטרט. כלומר, $\left[\ce{ES}\right]$ נמצא בערך הגבוה ביותר שלו, וריכוז $\left[\ce{S}\right]$ יחסית גבוה.
נקודות קריטיות להבנה
- תרמודינמיקה מול קינטיקה: אנזים משפיע על מהירות, לא על כיוון
- $\Delta G$ חייב להיות שלילי: אנזים לא הופך ריאקציה לא ספונטנית לספונטנית
- קשרים לא קובלנטיים: מלבד תוצרי ביניים קובלנטיים רגעיים (כמו בסרין פרוטאזות)
- יעילות מוגבלת בדיפוזיה: המהירות המקסימלית מוגבלת במהירות המפגש בין אנזים לסובסטרט ($\sim 10^8 - 10^9 \, M^{-1} s^{-1}$)