תוכן עניינים:
- מבוא: מהתפיסה האסוציאלית לסוציו-מיקרוביולוגיה
- Quorum Sensing: העיקרון הבסיסי
- הגילוי הראשון: Vibrio fischeri
- שלוש שפות תקשורת
- המנגנון המולקולרי:
Iו-R - Pseudomonas aeruginosa: שתי מערכות בהיררכיה
- Staphylococcus aureus: מערכת AGR
- בקרה על Quorum Sensing
- יישומים טיפוליים: Anti-Virulence Therapy
- סיכום
מבוא: מהתפיסה האסוציאלית לסוציו-מיקרוביולוגיה
במשך עשרות שנים, החל מתקופת רוברט קוך ופסטר, התייחסו לחיידקים כיצורים אסוציאליים. פרנסואה ז’קוב (François Jacob), ביוכימאי חתן פרס נובל, כתב:
“What, then, could be the aim of the bacterium?
What does it want to produce that justifies its existence, determines its organization, and underlies its work?
There is apparently only one answer to this question.
A bacterium continuously strives to produce TWO BACTERIA.”
התפיסה הייתה שכל חיידק חי את חייו לבדו, ומתעניין אך ורק בהשגת מזון ובהתחלקות. a
אולם כבר בתחילת המאה ה-20 הופיעו תצפיות שערערו על כך. פיטופתולוג שעבד על פתוגנים של צמחים שם לב שכמות קטנה של חיידקים לא הצליחה לגדול במצע עני, אבל כמות גדולה כן הצליחה. הוא כתב על “union” - התארגנות של חיידקים לעבודה משותפת.
בשנות ה-70 של המאה ה-20 התגלה שלחיידקים יש יכולת לתקשר. בתחילת שנות ה-2000 הוגדר תחום חדש: Sociomicrobiology - הכולל את יכולת התקשורת (Quorum Sensing) ואת היכולת לייצר מבנים משותפים (Biofilm).
Quorum Sensing: העיקרון הבסיסי
Quorum Sensing (בעברית: “חישת מניין”) הוא היכולת של חיידקים לדעת בכל רגע מה ריכוז החיידקים מסביבם - בראש ובראשונה, מה הסוג שלהם.
המנגנון הכללי
חיידקים מפרישים מולקולות סיגנל לסביבה. כשיש מעט חיידקים - יש מעט סיגנל. ככל שהאוכלוסייה גדלה, כל חיידק תורם את הסיגנל שלו וכמות הסיגנל בסביבה עולה.
כשהסיגנל מגיע ל-Threshold (סף, או “מניין”), החיידקים מבינים שיש מספיק ״חברים״ בסביבה ומפעילים תהליכים ש״כדאי להם״ לעשות אותם רק ביחד.
הגילוי הראשון: Vibrio fischeri
המערכת התגלתה לראשונה בחיידק Vibrio fischeri - סימביונט של דיונונים ודגים שמייצר אור (Bioluminescence).
למה דווקא הוא? כי קל לראות אם החיידקים מאירים או לא - לא היה צורך בטכנולוגיות מתקדמות (עוד לא היה PCR או Sequencing בשנות ה-70).
ההיגיון הביולוגי
ייצור אור הוא תהליך בזבזני מבחינה אנרגטית. חיידק בודד (בגודל מיקרון) שמאיר - לא נראה לאף אחד. לכן, יש היגיון שהחיידקים יפעילו את המנגנון רק כשהם רבים וביחד.
ניסוי המצע המשומש (Conditioned Medium)
הקבוצה של Hastings (1970) עקבה אחרי גידול וייצור אור. הם ראו שבהתחלה אין אור, ואז בצפיפות מסוימת - האור “פורץ” בבת אחת. פנוטיפ כזה (שקט ואז פריצה) הוא קלאסי ל-Quorum Sensing.
כדי להוכיח שמדובר בסיגנל כימי, הם עשו ניסוי פשוט:
- גידלו חיידקים לריכוז גבוה
- סיננו את החיידקים והשאירו רק את הנוזל (המצע המשומש)
- הוסיפו לנוזל מעט מזון וחיידקים חדשים בריכוז נמוך
התוצאה: החיידקים החדשים התחילו להאיר מיד! הם “הוטעו” כי הנוזל כבר הכיל את הסיגנל מהחיידקים הקודמים.
שלוש שפות תקשורת
1. Homoserine Lactones (HSL) - חיידקים גראם-שליליים
מולקולות עם טבעת לקטונית וזנב שומני. כל מין מייצר מולקולה ספציפית - זו שפה מוצפנת. למשל, P. aeruginosa משתמש ב-C4-HSL, ו-Vibrio harveyi משתמש במולקולה דומה אך עם קבוצת OH. למרות הדמיון, הם לא מגיבים לסיגנל אחד של השני.
2. Peptides - חיידקים גראם-חיוביים
פפטידים קצרים. גם כאן - שפה מוצפנת לכל מין. ב-Staphylococcus aureus הפפטיד נקרא AIP (Auto-Inducing Peptide).
3. AI-2 - השפה האוניברסלית
מולקולה שמאפשרת Interspecies Communication - תקשורת בין מינים שונים.
הערה מעניינת: AI-2 היא למעשה תוצר פסולת מטבולית. זה עורר ויכוח גדול בתחום - קשה היה לקבל שמולקולת פסולת יכולה לשמש כסיגנל. אבל ההיגיון ברור: ככל שיש יותר חיידקים, יש יותר פסולת, וחיידקים למדו לנצל את זה.
המנגנון המולקולרי: I ו-R
בליבת המערכת יש שני חלבונים:
-
I Gene(למשל LuxI): אנזים שמסנתז את מולקולת הסיגנל מאבות מזון (פחמן, חנקן, חמצן). -
R Gene(למשל LuxR): רגולטור שקושר את הסיגנל. כשהוא קושר מספיק סיגנל, הוא הופך ל-Transcription Factorפעיל ומפעיל גנים.
מניעת Auto-Activation
בעיה: אם החיידק מייצר בתוכו סיגנל, למה R לא נקשר אליו מיד? שלושה פתרונות:
-
שאיבה אקטיבית: הסיגנל נדחף החוצה במהירות. רק כשיש מספיק סיגנל בחוץ (הרבה חיידקים), הדיפוזיה פנימה מתגברת על השאיבה החוצה.
-
Rלא יציב: בהיעדר סיגנל, חלבוןRמתפרק במהירות. -
מדידה חיצונית: בחלק מהמערכות (בעיקר בגראם-חיוביים), הרצפטור יושב בממברנה ומודד את הסיגנל בחוץ.
Pseudomonas aeruginosa: שתי מערכות בהיררכיה
P. aeruginosa הוא פתוגן ורסטילי - גורם לזיהומים אקוטיים (Bacteremia, Keratitis) וגם לזיהומים כרוניים (בחולי Cystic Fibrosis שם הוא גדל ב-Biofilm).
שתי המערכות
-
מערכת
Las:LasI(מסנתז3-oxo-C12-HSL) ו-LasR(הרגולטור) -
מערכת
Rhl:RhlI(מסנתז C4-HSL) ו-RhlR(הרגולטור)
המערכות מבקרות מאות גנים - בעיקר פקטורי וירולנטיות (טוקסינים, אנזימים מופרשים).
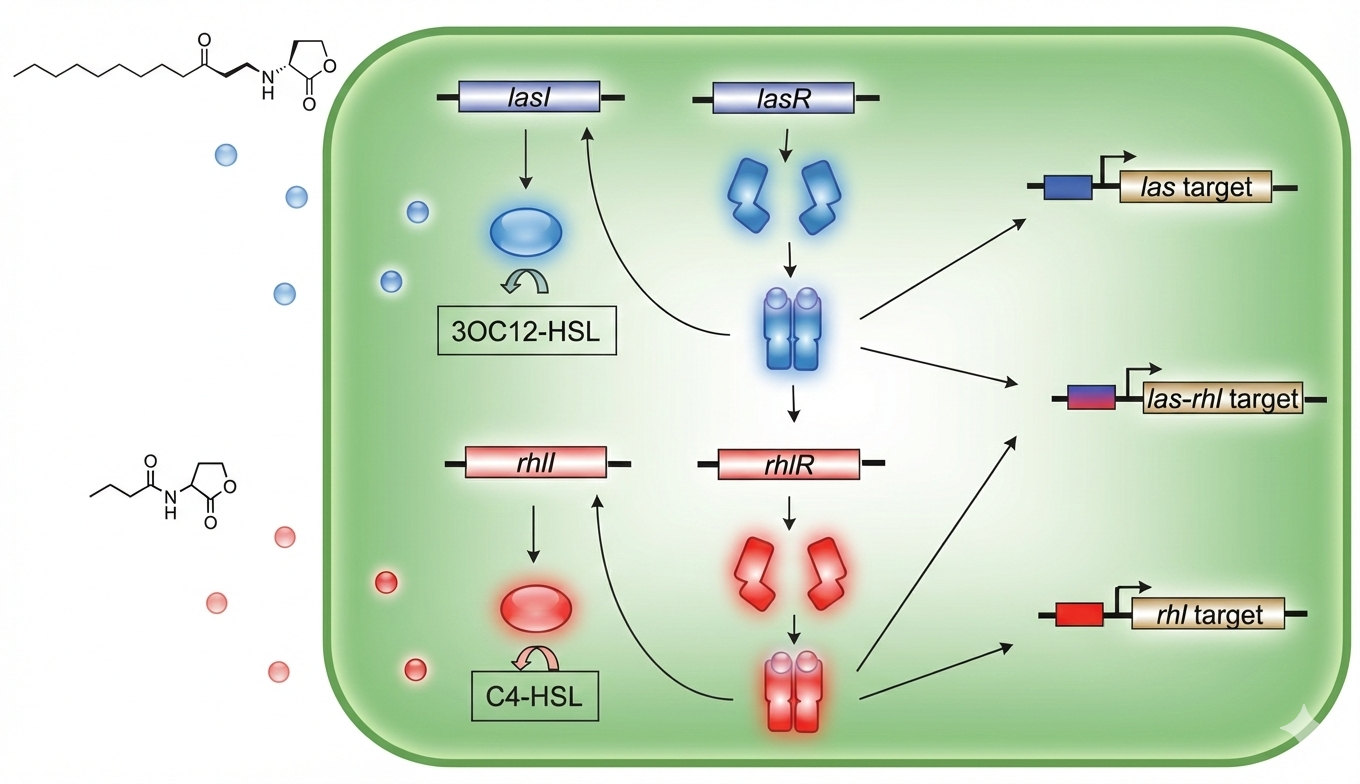
ההיררכיה
מערכת Las שולטת על מערכת Rhl:
- בריכוז נמוך: שתי המערכות כבויות
- כשמגיעים ל-
Quorum: מופעל קודםLasR- מפעיל את הביטוי שלLasIו-LasRLasRעושה Auto-activation (מפעיל את הפרומוטור של עצמו ושל LasI) - כדי לסנכרן את התרביתLasRגם נותן Jump Start למערכתRhl- מפעיל את הביטוי שלRhlIו-RhlR
- רק אז מערכת
Rhlיכולה לפעול
נקודה קריטית: אם פוגעים ב-LasR, גם הוספת סיגנל אדום (C4-HSL) מבחוץ לא תעזור! צריך את LasR כדי להפעיל את הביטוי של RhlI ו-RhlR.
רגולציה דואלית
יש גנים שמבוקרים רק על ידי Las, יש שמבוקרים רק על ידי Rhl, ויש שדורשים את שניהם - זה מאפשר רגולציה עדינה יותר.
Staphylococcus aureus: מערכת AGR
S. aureus הוא פתוגן גראם-חיובי שגורם למגוון מחלות - מפצעים פשוטים ועד לזיהומים מסכני חיים. הגרסה MRSA (Methicillin-Resistant) היא בעיה קלינית קשה.
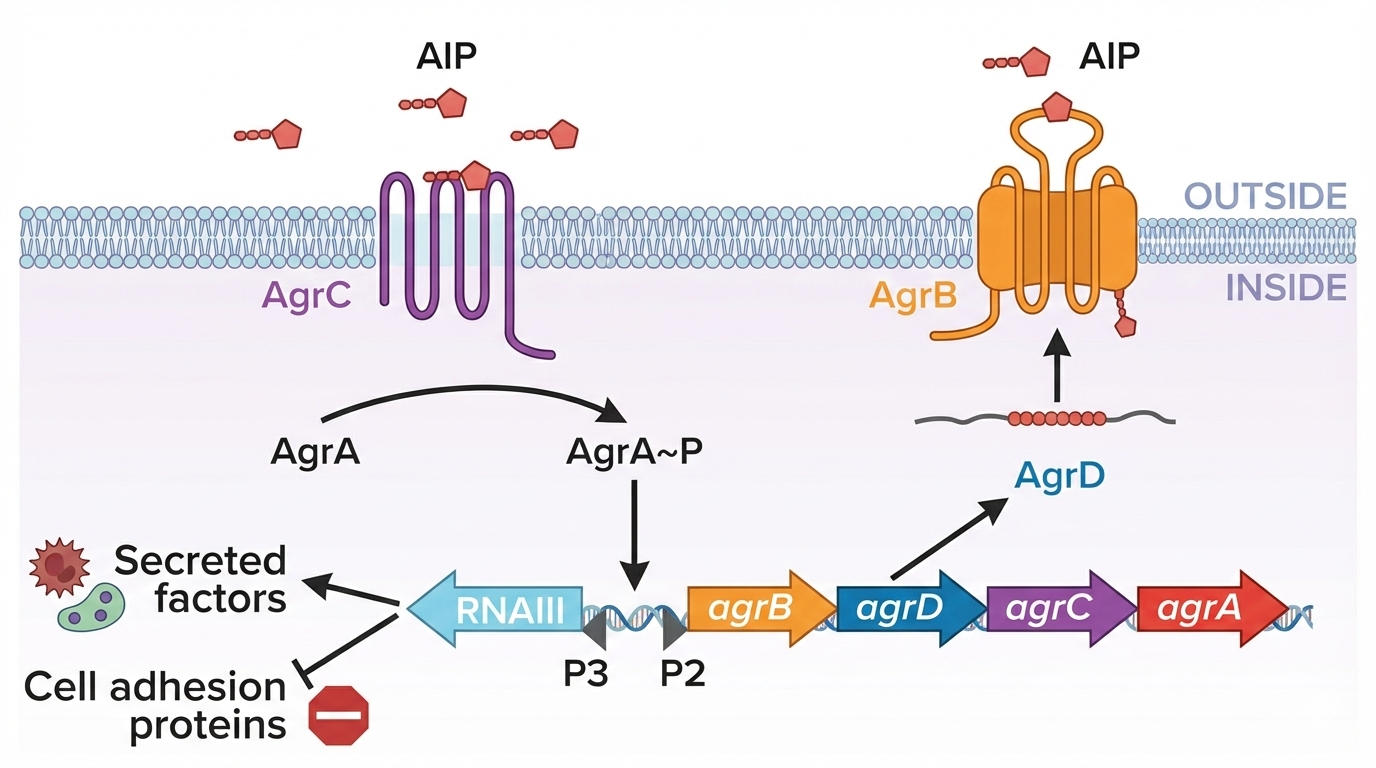
המעבר מקולוניזציה לאלימות
| ריכוז נמוך של AIP | ריכוז גבוה |
|---|---|
| Adhesion, Colonization | Toxins, Enzymes |
| התמקדות בהידבקות ובהתבססות | הפרשת פקטורי וירולנטיות |
מבנה מערכת AGR
אופרון של ארבעה גנים (A, B, C, D) ו-RNA רגולטורי:
-
AgrD: חלבון גדול שמכיל בתוכו את הפפטיד AIP -
AgrB: חותך את AIP מתוך AgrD ומפריש אותו החוצה -
AgrC: רצפטור ממברנלי. בהיעדר AIP - פועל כ-Phosphatase (מוריד פוספט מ-AgrA). בנוכחות AIP - הופך ל-Kinase (מוסיף פוספט ל-AgrA) -
AgrA: Transcription Factor. פעיל רק כשהוא מזורחן (Phosphorylated) -
RNAIII: RNA רגולטורי שמופעל על ידי AgrA. מעכב גנים של Adhesion ומפעיל גנים של וירולנטיות
ארבעה סרוטיפים
ב-S. aureus יש ארבע קבוצות שמייצרות AIP שונים. כל קבוצה מגיבה רק לסיגנל שלה, והסיגנלים האחרים דווקא מעכבים אותה. אם שני סרוטיפים מתחרים - מי שמגיע ל-Quorum ראשון משתלט.
בקרה על Quorum Sensing
המערכות מבקרות Group Behaviors - דברים שכדאי לעשות ביחד:
-
וירולנטיות: טוקסינים, אנזימים - כדאי להפריש רק כשהקבוצה גדולה מספיק בשביל להתמודד עם מערכת החיסון
-
Public Goods: כל מה שמופרש החוצה הופך לנחלת הכלל. המערכת מבטיחה שכל החיידקים יתרמו ולא רק חלק מהם
חשוב: המערכות מבקרות גם מה קורה בריכוז נמוך! אם יש Repressor שמופעל בריכוז גבוה, הוא מעכב גנים - וגנים אלה פעילים דווקא בריכוז נמוך
יישומים טיפוליים: Anti-Virulence Therapy
הרעיון
במקום להרוג חיידקים (אנטיביוטיקה), לעכב את יכולת התקשורת שלהם. החיידקים יהיו רבים אבל “יחשבו” שהם מעטים - לא יפעילו וירולנטיות ומערכת החיסון תתמודד.
יתרון: לחץ סלקטיבי נמוך
אנטיביוטיקה יוצרת לחץ חזק - מי שלא עמיד מת. Anti-Quorum Sensing לא הורג, רק מונע תקשורת. הלחץ לפתח עמידות נמוך יותר.
הגוף כבר עושה את זה
בסרום שלנו יש אנזים שמפרק את הסיגנל 3-oxo-C12 של P. aeruginosa.
דוגמאות בפיתוח
-
Small Molecules: חומרים שמעכבים Quorum Sensing ב-P. aeruginosa - בניסויים קליניים
-
נוגדנים נגד AIP: פותחו נוגדנים נגד AIP של S. aureus. בניסויים בבעלי חיים, טיפול בנוגדנים ריפא זיהומי עור ללא אנטיביוטיקה
סיכום
Quorum Sensing היא מערכת תקשורת מתוחכמת שמאפשרת לחיידקים לתאם פעילויות קבוצתיות. המערכות שולטות על מאות גנים, בעיקר הקשורים לוירולנטיות, ומהוות מטרה לפיתוח טיפולים חדשים.
דור פסקללהעמקה: הרצאת TED של Bonnie Bassler (מגלת מערכת AI-2) על Quorum Sensing - קישור להרצאה