מוכנים למבחן?
נסו 10 שאלות על מבנה ותפקוד של חלבונים, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
10 / 1
00:00
תוצאות המבחן
0
ענית נכון על 0 מתוך 10 שאלות
היסטוריית מבחנים
100
75
50
25
0
טוען את השאלות...
אנא המתן...
מבוא לחלבונים
- הנושאים מופיעים בפרק 3 בספר (אך בקורס נלמד רק חלק מהפרק)
- הקורס חופף חלקית עם ביוכימיה
- המבנה של חלבון נקבע על ידי רצף חומצות האמינו
- המידע על רצף חומצות האמינו מגיע מהגנים
- רוב הגנים קובעים רצף של חלבונים
- המידע עובר דרך מתווך - ה-mRNA
- ה-mRNA מגיע לריבוזום (מכונת התרגום) שמייצרת חלבונים
- סוד הקיום של היצורים החיים מתמקד בחלבונים ובפונקציות שלהם
חומצות אמינו
מבנה בסיסי של חומצת אמינו
- בספר בפרק 3 יש פאנל 3.1 בעמוד 118 המפרט את כל 20 חומצות האמינו השכיחות בחלבונים
- חפשו תמיד את פחמן אלפא (α-carbon) - הוא הפחמן שבאמצע
- מבנה בסיסי:
- פחמן אלפא במרכז
- בצד אחד יש קבוצה אמינית (+NH₃)
- בצד שני יש קבוצה קרבוקסילית (COO⁻)
- צד שלישי - מימן בודד (H)
- צד רביעי - שרשרת צדדית (R) ייחודית לכל חומצת אמינו
- בpH פיזיולוגי (בין 6-8, בד”כ סביב 7):
- הקבוצה האמינית טעונה חיובית
- הקבוצה הקרבוקסילית טעונה שלילית
- ישנה דינמיות בטעינה (המטענים הם on/off)
קבוצות של חומצות אמינו
חומצות האמינו מחולקות לקבוצות על פי תכונות השרשרת הצדדית (R):
- חומצות אמינו עם שרשרת צדדית טעונה חיובית (בסיסית):
- ליזין (Lys)
- ארגינין (Arg)
- היסטידין (His) - בpH נטרלי רק כ-40-50% מהמולקולות טעונות
- חומצות אמינו עם שרשרת צדדית טעונה שלילית (חומצית):
- חומצה אספרטית (Asp)
- חומצה גלוטמית (Glu)
- חומצות אמינו עם שרשרת צדדית פולארית (לא טעונה):
- טירוזין (Tyr) - בעלת טבעת ארומטית וקבוצה הידרוקסילית
- חומצות אמינו נוספות בקבוצה זו
- חומצות אמינו עם שרשרת צדדית לא פולארית (הידרופוביות):
- גליצין (Gly) - השרשרת הצדדית היא רק מימן נוסף
- אלנין (Ala) - השרשרת הצדדית היא CH₃
- חומצות אמינו נוספות בקבוצה זו
- נוטות לשבת יחד ולהימנע ממגע עם מים
דוגמה לפפטיד
- פפטיד של ארבע חומצות אמינו (מסומנות בצבעים שונים)
- קוראים פפטידים מהקצה האמיני לקצה הקרבוקסילי (N→C)
- הקשר בין חומצות האמינו נקרא “קשר פפטידי”
- יצירת קשר פפטידי היא ריאקציית דחיסה (קונדנסציה) עם שחרור מולקולת מים
- ריאקציה זו דורשת אנרגיה ומתרחשת על הריבוזום בעת תרגום החלבון
מבנה החלבון
ישנן ארבע רמות של ארגון בחלבונים:
מבנה ראשוני (Primary Structure)
- הרצף הלינארי של חומצות האמינו בשרשרת הפוליפפטידית
- קובע את כל המידע הדרוש ליצירת המבנה המרחבי של החלבון
- לדוגמה: פוליפפטיד כשרשרת פשוטה של חומצות אמינו המחוברות בקשרים פפטידיים
מבנה שניוני (Secondary Structure)
- מבנים מקומיים בחלבון הנוצרים עקב אינטראקציות בין חומצות אמינו קרובות
- דוגמה נפוצה: אלפא הליקס (α-helix) - סליל
- דוגמאות נוספות יפורטו בהמשך ההרצאה
- האזורים האלה הם מבנים מקומיים בתוך החלבון השלם
מבנה שלישוני (Tertiary Structure)
- המבנה המרחבי המלא של שרשרת פוליפפטידית שלמה
- נוצר כתוצאה מקיפול שרשרת החלבון במרחב
- דוגמה: אזור (“דומיין”) של ארבעה אלפא הליקסים המחוברים יחד
- דוגמה נוספת: המוגלובין (בחלק החלבוני שלו)
מבנה רביעוני (Quaternary Structure)
- קומפלקס של כמה תת-יחידות חלבוניות הפועלות יחד
- דוגמה: המוגלובין מורכב משתי שרשראות אלפא-גלובין ושתי שרשראות בטא-גלובין
- כולל גם חלקים לא-חלבוניים (כמו הם - טבעת סוכרית עם יון ברזל)
- רק המבנה הרביעוני המלא מאפשר פעילות מלאה של החלבון
אינטראקציות בין חומצות אמינו בחלבון
- קשרים לא קוולנטיים (חלשים) שיחד מייצבים את מבנה החלבון:
- קשרים אלקטרוסטטיים (בין מטענים חיוביים ושליליים)
- קשרי מימן
- אינטראקציות הידרופוביות
- ככל שיש יותר קשרים כאלה, המבנה יציב יותר
דוגמה: המוגלובין
- חלבון מוכר המצוי בכדוריות דם אדומות
- תפקידו: הובלת חמצן מהריאות לרקמות
- מורכב מחלק חלבוני וחלק לא חלבוני (הם - טבעת סוכרית המחזיקה יון ברזל)
- המבנה הרביעוני מורכב מארבע תת-יחידות
- המוגלובין מסוכר (בהקשר של סוכרת) - קשור לרמת הגלוקוז בדם
- המוגלובין מסוכר פחות יעיל בקליטת חמצן והובלתו
הערות נוספות
- החלבונים הם מקרומולקולות חיוניות לקיום החיים
- המבנה של חלבון קובע את תפקודו
- החלבון הגדול ביותר בתאי אדם נקרא טייטין (Titin) ומכיל כ-27,000 חומצות אמינו
- חלבונים מתפקדים רק במבנה המרחבי התקין שלהם
- דנטורציה של חלבון גורמת לאובדן פעילותו
אינטראקציות לא קוולנטיות בחלבונים
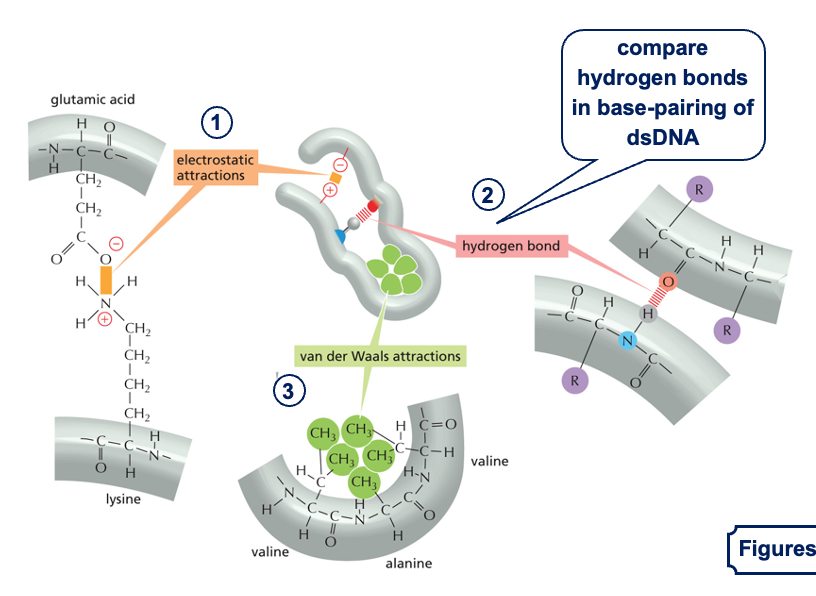
לאחר יצירת השרשרת הפפטידית עם קשרים קוולנטיים חזקים (הקשרים הפפטידיים), החלבון מתקפל למבנה התלת-מימדי שלו בעזרת אינטראקציות לא קוולנטיות:
סוגי קשרים לא קוולנטיים
- קשרים אלקטרוסטטיים:
- משיכה בין שיירים בעלי מטענים מנוגדים
- לדוגמה: ליזין (טעון חיובית) נמשך לחומצה גלוטמית (טעונה שלילית)
- מחזיקים חלקים שונים של החלבון קרובים זה לזה
- קשרי מימן:
- דומים לקשרי המימן שראינו ב-DNA וב-RNA
- בין קבוצות C=O ו-N-H בקשרים פפטידיים
- מייצבים את המבנה התלת-מימדי של החלבון
- קשרי ון דר ואלס:
- בין שיירים צדדיים לא פולריים
- לדוגמה: בין אלנין (CH₃) לולין (שיירים גדולים יותר)
- חלשים יחסית אך כוחם בכמות
- אינטראקציות הידרופוביות:
- שיירים הידרופוביים (כמו טריפטופן, פנילאלנין) נוטים להתקבץ יחד
- נטייה להימנע ממגע עם מולקולות מים
- בחלבונים גלובולריים: השיירים ההידרופוביים נוטים להתקבץ בליבת החלבון
- יתרון אנרגטי - מערכת יציבה יותר כשהחלקים ההידרופוביים מוסתרים מהמים
מאפייני הקשרים הלא קוולנטיים
- כל קשר בודד חלש הרבה יותר מקשר קוולנטי
- כוחם של קשרים אלה הוא במספרם הרב
- החלבון מתקפל לצורה המועדפת מבחינה אנרגטית
- המבנה אינו נוקשה לחלוטין אלא יש בו מידה מסוימת של גמישות (“נשימה” של המבנה)
מבנים שניוניים נפוצים
אלפא הליקס (α-helix)
- מבנה סלילי שנוצר בזכות קשרי מימן חוזרים בעמדות קבועות
- הקשרים הם בין קבוצות NH ו-CO של קשרים פפטידיים
- השיירים הצדדיים פונים החוצה מהסליל
- במבט מלמעלה נראה כמו סליל עם חלל באמצע
- מופיע ברוב החלבונים באזורים שונים
- הממדים שלו קבועים יחסית
ביטא שיט (β-sheet)
- מתואר לרוב כ”סרטים” הנמתחים במקביל
- יוצר מבנה דמוי משטח (לא שטוח לגמרי)
- יכול להיות מקבילי (parallel) או אנטי-מקבילי (anti-parallel)
- קשרי מימן בין קבוצות NH ו-CO של שתי שרשראות פפטידיות שונות
- מספר רצועות ה-β-sheet יכול להשתנות
הצגת מבנה חלבונים
ישנן מספר דרכים להציג את מבנה החלבון בתצוגות מחשב או בספרים:
- שלד פפטידי בלבד - מציג רק את החיבורים בין חומצות האמינו ללא שיירים צדדיים
- לעתים עם קוד צבעים מאדום לכחול
- מבנים שניוניים - מציג אלפא הליקס כגלילים וביטא שיט כחצים
- דרך נוחה לראות את הארגון הכללי של החלבון
- תצוגת מקלות (wireframe) - כולל שיירים צדדיים כמבנה של מקלות
- מאפשר לראות חומצות אמינו ספציפיות (כמו טירוזין, ליזין, ארגינין)
- מודל space-filling - מציג כל אטום בגודלו היחסי האמיתי
- נותן תחושה של הטופוגרפיה והמשטחים של החלבון
מבנים מורכבים
Coiled-coil (סליל מסולסל)
- מבנה מורכב יותר המבוסס על אלפא הליקס
- שני סלילי אלפא הליקס המתלפפים זה סביב זה
- מאופיין ברצף חוזר של 7 חומצות אמינו (a, b, c, d, e, f, g)
- בעמדות a ו-d נמצאות חומצות אמינו הידרופוביות
- השיירים ההידרופוביים יוצרים “פס” לאורך האלפא הליקס
- שני הסלילים נסגרים יחד כך שהאזורים ההידרופוביים מסתתרים מהמים
- רוב השיירים ההידרופוביים הם ולין, לאוצין ואיזולאוצין
לאוצין זיפר (Leucine zipper)
- סוג ספציפי של מבנה coiled-coil
- בעמדות a ו-d יש ריכוז גבוה של לאוצין
- מאפשר לשתי תת-יחידות זהות של חלבון להיצמד זו לזו
- נפוץ בחלבונים שנקשרים ל-DNA כדי להפעיל גנים
- הצמדת שתי תת-היחידות הכרחית לתפקוד החלבון
דומיינים בחלבונים
- דומיין (Domain) - אזור בחלבון בעל מבנה ותפקוד עצמאיים יחסית
- בדרך כלל בין 350-40 חומצות אמינו
- פועלים כמו “קוביות לגו” מודולריות בבניית חלבונים מורכבים
- ניתן למצוא אותם דומיינים בחלבונים שונים
דומיינים ואבולוציה
- באבולוציה התרחש “ערבוב” של דומיינים ליצירת חלבונים חדשים
- חלבונים שונים יכולים לכלול אותם דומיינים בסידורים שונים
- יש משפחות של חלבונים המבוססות על דומיינים משותפים
דוגמאות לדומיינים בחלבונים
- חלבונים פשוטים:
- EGF (Epidermal Growth Factor) - פקטור גדילה המשפיע על התחלקות תאים
- טריפסין (Trypsin) - אנזים עיכול המפרק חלבונים במעי
- חלבונים מורכבים:
- פקטורי קרישת דם (פקטור 8, 9, 10) - משלבים דומיינים מחלבונים שונים
- פרוטאזות - אנזימים המפרקים חלבונים אחרים
- חלבוני מטריקס חוץ-תאי:
- מכילים מספר עותקים חוזרים של אותו דומיין (inline repeats)
- דוגמה: פיברונקטין טיפוס III - סדרה של דומיינים מסוג β-sheet
סיכום ביניים
- רצף חומצות האמינו (מבנה ראשוני) קובע את הקונפורמציה המרחבית של החלבון
- אינטראקציות לא קוולנטיות רבות מתאגדות יחד ליצירת מבנה יציב
- המבנים השניוניים (אלפא הליקס וביטא שיט) הם אבני הבניין הבסיסיות
- דומיינים פועלים כיחידות מודולריות בבניית חלבונים מורכבים
- המבנה המרחבי של החלבון קובע את תפקודו
דינמיות וקונפורמציה של חלבונים
- מבנה החלבון אינו קבוע ונוקשה כמו קיר
- חלבונים יכולים להיות דינמיים ולעבור בין קונפורמציות שונות
- אזורים שונים של השרשרת יכולים להתקרב זה לזה במרחב
- קצה אמיני וקצה קרבוקסילי יכולים להיות קרובים במרחב לאחר קיפול החלבון
- המבנה התלת-מימדי של חלבון קובע את הפעילות שלו
מבנה ותפקוד של חלבונים
- חלבונים מתורגמים על הריבוזום ומוצאים את מבנם התלת-מימדי
- לעיתים עוברים מודיפיקציות לאחר התרגום (post-translational modifications)
- חלבונים מכוונים למדורים שונים בתא
- בתאים איקריוטיים, הפעילות ממודרת ומחולקת בין מדורים שונים
קומפלקסים חלבוניים
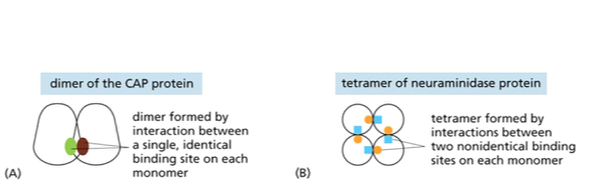
הומו-דימר (Homo-dimer)
- מורכב משתי תת-יחידות זהות של אותו חלבון
- אתר קישור זהה בכל תת-יחידה מאפשר להן להיצמד זו לזו
- יוצר משטח מגע באזור הקישור
- פעמים רבות החלבון פעיל רק כדימר ולא כמונומר
הומו-טטרמר (Homo-tetramer)
- מורכב מארבע תת-יחידות זהות של אותו חלבון
- כל תת-יחידה מכילה שני אתרי קישור שונים
- דוגמה: נוירו-אמינידאז - אנזים שפעיל רק במבנה הטטרמרי
חלבונים פולימריים
שלוש צורות ארגון בסיסיות של תת-יחידות חלבוניות זהות:
- דימר - שתי תת-יחידות בלבד
- הליקס - תת-יחידות רבות המסודרות במבנה סלילי ארוך
- טבעת - תת-יחידות היוצרות מבנה סגור (למשל, שמונה תת-יחידות בטבעת)
חלבונים סיביים
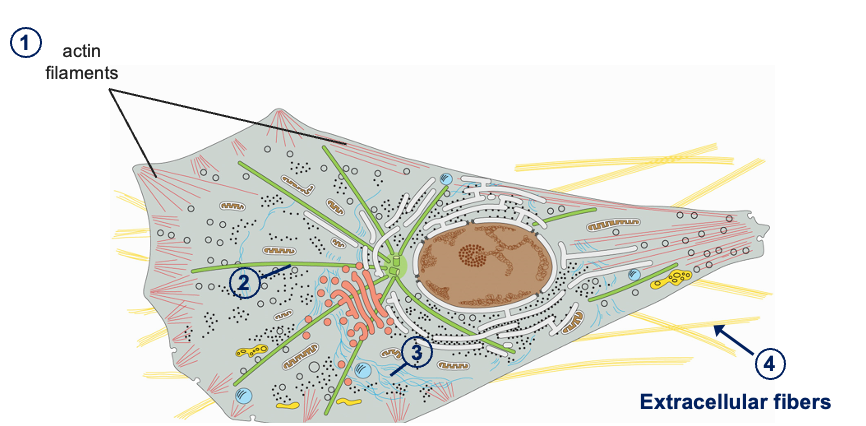
אקטין (Actin)
- כל מולקולה (מונומר) היא שרשרת פוליפפטידית אחת
- המונומרים מתפלמרים ליצירת סיבים ארוכים (אקטין פילמנטים)
- סיבי האקטין הם חלק מהשלד התוך-תאי (ציטוסקלטון)
- מבין שלושת סוגי השלד התוך-תאי, אקטין יוצר את הסיבים הדקים ביותר
סוגי שלד תוך-תאי נוספים
- מיקרוטובולים (Microtubules) - עבים יותר מאקטין, חלולים
- פילמנטים ביניים (Intermediate filaments) - בגודל ביניים בין אקטין למיקרוטובולים
מטריקס חוץ-תאי (Extracellular Matrix)
- תאים רבים מפרישים חלבונים אל מחוץ לממברנת התא
- החלבונים האלה מתפלמרים ויוצרים מבנים חזקים
- משמשים כ”דבק” המחזיק רקמות יחד
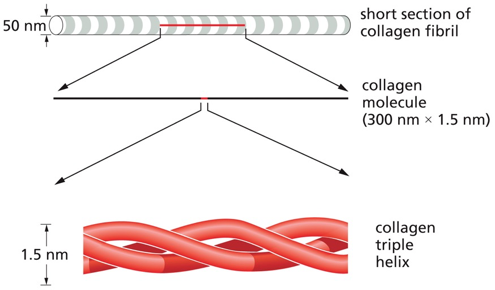
קולגן (Collagen)
- החלבון הנפוץ ביותר במטריקס החוץ-תאי
- מבחינת משקל, אחד החלבונים הנפוצים ביותר ביונקים
- יוצר סיבים בעלי חוזק מתיחה גבוה (“חוזק של פלדה”)
- מבנה מיוחד:
- סיבים באורך של עד 50 נאנומטר
- כל “מוט” באורך 300 נאנומטר, קוטרו פי 1/200 מאורכו
- מורכב משלוש שרשראות ארוכות של חלבון שמלופפות זו סביב זו (coiled-coil)
- השרשראות הן בעיקר אלפא-הליקסים
- בנוסף לקשרים לא קוולנטיים, יש מודיפיקציות ייחודיות היוצרות קשרים קוולנטיים בין השרשראות
- ניתן לראות “פספוס” אופייני במיקרוסקופ אלקטרונים
- נמצא בסחוס, גידים, עצמות ורקמות נוספות
הקולגן מורכב מ־שלוש שרשראות אלפא (α chains) המלופפות זו סביב זו במבנה שנקרא triple helix – זהו המבנה הקלאסי של קולגן מסוג I.
מבנים ביולוגיים מורכבים
חלבונים כאבני בניין
- חלבונים יכולים לשמש כאבני בניין בסיסיות למבנים גדולים מאוד
- לדוגמה: מבנה הקסגונלי - מרכז עם שישה “עלי כותרת” סביבו
- היתרון: שימוש באתרי קישור חוזרים מאפשר בנייה של מבנים מורכבים
- ניתן ליצור משטחים, גלילים חלולים ומבנים תלת-מימדיים מורכבים
- יתרון אבולוציוני: מעט מידע גנטי יכול לקודד למבנים מורכבים
וירוסים והרכבה עצמית
- וירוסים הם דוגמה בולטת למבנים מורכבים המורכבים מתת-יחידות חוזרות
- לדוגמה: אדנווירוס - אחראי לחלק גדול ממחלות החורף
- הקפסיד (מעטפת החלבון) מגן על הגנום הווירלי
- מעט מאוד מידע גנטי מקודד למבנה מורכב ומאורגן
- מנגנוני בקרת איכות מסלקים תת-יחידות פגומות
וירוס מוזאיקת הטבק (Tobacco Mosaic Virus)
- הווירוס הראשון שבודד (סוף המאה ה-19)
- תוקף צמחים רבים (לא רק טבק) וגורם לדפוס “מוזאיקה” אופייני בעלים
- מבנה פשוט יחסית: חלבון ו-RNA
- ניתן להרכיב וירוסים פעילים ממרכיבים מבודדים במבחנה
הרכבה עצמית והרכבה מתווכת
הרכבה עצמית (Self-assembly)
- מבנים ביולוגיים רבים מסוגלים להרכיב את עצמם
- כל המידע הדרוש להרכבה מקודד בחלבונים עצמם
- דוגמה: וירוס מוזאיקת הטבק - הרכבה מסודרת של חלבון ו-RNA
גורמי הרכבה (Assembly factors)
- במקרים רבים, נדרשים גורמים חיצוניים לסיוע בהרכבה
- גורמים אלה חיוניים לבנייה אך אינם חלק מהמבנה הסופי
- דומה לאנזים שנכנס ויוצא מהריאקציה באותו מצב
אינסולין - דוגמה להרכבה מתווכת
- האינסולין מורכב משתי שרשראות פוליפפטידיות (חרדל וירוק בתרשים)
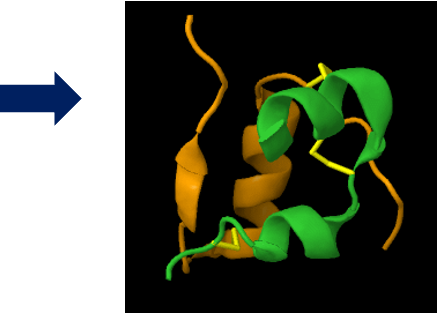
- בתחילה מיוצר כשרשרת אחת ארוכה
- פרוטאזות (אנזימים) חותכות את השרשרת ומסלקות חלק ממנה
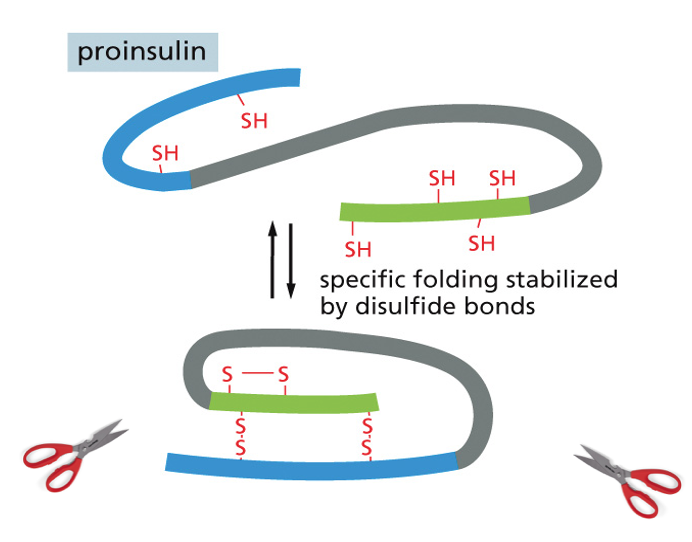
- התוצאה היא אינסולין פעיל
קשרים ייחודיים בחלבונים
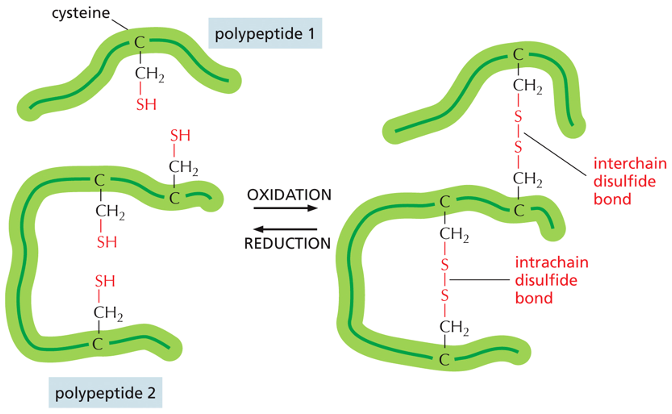
גשרים דיסולפידיים
- קשרים קוולנטיים בין שני אטומי גופרית
- נוצרים בין שיירי ציסטאין (חומצה אמינית עם קבוצת SH)
- יכולים לחבר אזורים שונים בתוך אותה שרשרת או בין שרשראות שונות
- מופיעים בחלבונים רבים, במיוחד אלה המופרשים מחוץ לתא (כמו נוגדנים)
- באינסולין, גשרים דיסולפידיים (מסומנים בצהוב בתרשים) מחברים את שתי השרשראות