המנגנון של תגובת $\mathrm{S_N2}$ ואת התנאים הדרושים לה, כולל חשיבות הנוקלאופיל החזק והממס האפרוטי.
מבנה השיעור
השיעור שלנו הולך להתחלק לשלושה חלקים:
- השלמה קטנה לסטריאוכימיה
- השלמה קטנה לקבוצות פונקציונליות
- תגובות התמרה
חומרי עזר שהועלו למודל:
- סיכומים של ציקלוהקסאן
- סיכומים של קבוצות פונקציונליות
- בקרוב: סיכום של כיראליות וסטריאוכימיה
תזכורת: שעת קבלה היום מ-16:00 עד 18:00 בזום, פרטים במודל.
קבוצות פונקציונליות
קבוצות פונקציונליות הן מבנים כימיים חשובים בכימיה אורגנית שעליכם לשנן בשלב זה. חלק מהקבוצות כבר פגשנו בעבר:
- אלקאן ($\ce{C-C}$)
- אלקן ($\ce{C=C}$)
- אלקין ($\ce{C≡C}$)
- טבעת ארומטית (בנזן)
- קטלים ואתרים
מבנה חשוב שחוזר על עצמו הרבה הוא הקרבוניל - קשר כפול בין פחמן לחמצן:
\[\ce{R-C=O}\]סוג הקרבוניל נקבע לפי מה שיושב בצד השני של הקרבוניל:
- אם זה מימן: אלדהיד $\ce{R-CHO}$
- אם זה עוד פחמן: קטון $\ce{R-CO-R’}$
- אם זה $\ce{O-R}$: אסטר $\ce{R-COOR’}$
- אם זה $\ce{OH}$: חומצה קרבוקסילית $\ce{R-COOH}$
- אם זה כלור: אציל כלוריד $\ce{R-COCl}$
חשוב לשיעור היום: אלקילהלידים (או אלו-אלקאן, כאשר אלו = הלוגן, אלקאן = שרשרת פחמנית). כל פחמן שיושב עליו הלוגן נקרא אלקילהליד.
סטריאוכימיה
אננטיומרים ודיאסטריאומרים
- אננטיומרים הם מולקולות זהות בהרכבן הכימי אך שונות בסידור המרחבי, כאשר אחת היא תמונת ראי של השנייה
- אננטיומרים מכילים מרכז/ים כיראלי/ים בקונפיגורציות הפוכות (R ו-S)
- כל פחמן כיראלי יכול להסתדר בשתי קונפיגורציות שונות

מספר האיזומרים האפשריים לפי מספר המרכזים הכיראליים הוא $2^n$ כאשר $n$ הוא מספר המרכזים הכיראליים:
- מרכז כיראלי אחד: 2 איזומרים
- שני מרכזים כיראליים: 4 איזומרים
כאשר יש שני מרכזים כיראליים, לא כולם אננטיומרים אחד של השני - יש גם דיאסטריאומרים.
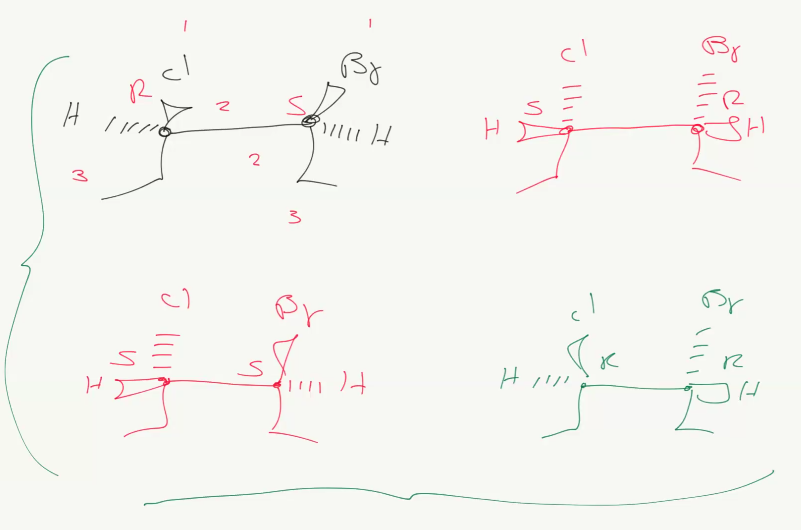
למשל בתמונה למעלה, שתי המולקולות האחרונות הן איזומרים מברחביים של העליונות, אבל לא אננטיומרים (הסידור הוא SS , RR ולא היפוך של RS שהוא SR). עם זאת, הם כן אננטיומריות אחת לשנייה.
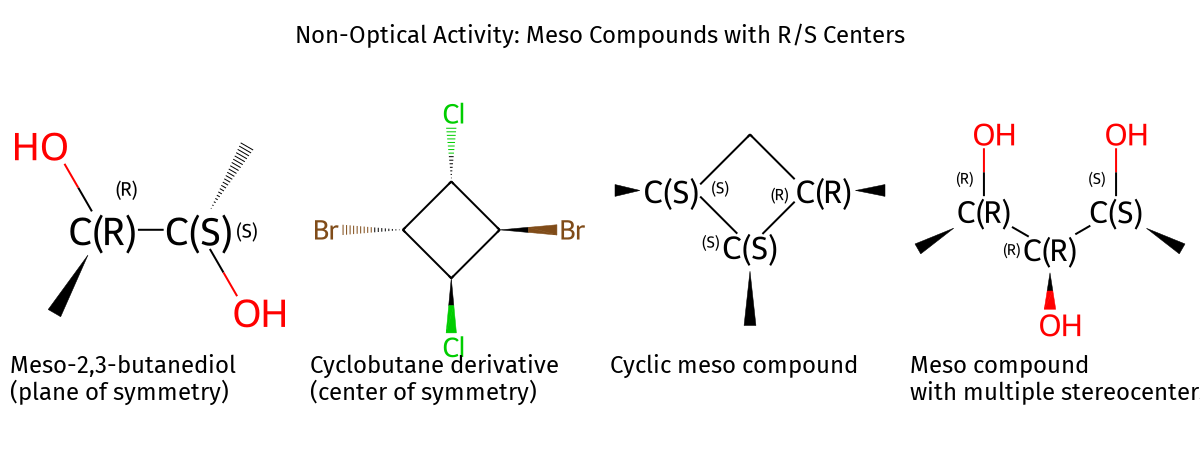
תרכובות מזו
תרכובת מזו היא מולקולה עם שני מרכזים כיראליים שיש לה מישור סימטריה, ולכן היא אינה פעילה אופטית. במולקולה מזו המרכזים הכיראליים מבטלים זה את זה.

דוגמה למולקולה מזו:
- שני מרכזים כיראליים: אחד בקונפיגורציה R והשני בקונפיגורציה S
- אותם מתמירים על שני המרכזים הכיראליים
- הקונפיגורציות ההפוכות גורמות לביטול הפעילות האופטית
למולקולות מזו:
- אין אננטיומר (הן זהות לתמונת הראי שלהן)
- יש דיאסטריאומרים (לדוגמה, אם שני המרכזים הכיראליים הם RR או SS)
תרגול בנושא סטריאוכימיה
שאלה: איזה מבין החומרים הבאים הם אננטיומרים?
הדרך לפתרון:
- בדקו האם מדובר באיזומרים מרחביים (אותו מבנה כימי)
- בדקו אם יש להם אותם מתמירים בכל מרכז כיראלי
- בדקו אם כל המרכזים הכיראליים הפכו את הקונפיגורציה שלהם (R ל-S ולהיפך)
אם יש שני מרכזים כיראליים:
- אם אחד R ואחד S (באותן עמדות) - זו תרכובת מזו ואינה פעילה אופטית
- אם שניהם R או שניהם S - זהו דיאסטריאומר של תרכובת המזו וכן פעיל אופטית
בתערובת של שני חומרים ביחס 1:1:
- תערובת אננטיומרים: לא פעילה אופטית
- תערובת דיאסטריאומרים: כן פעילה אופטית
- תערובת של מזו ודיאסטריאומר שלה: כן פעילה אופטית (כי הדיאסטריאומר פעיל אופטית)
תגובות התמרה
מושגי יסוד
מושגים חשובים לכל תגובה בכימיה אורגנית:
נוקלאופיל - חומר עם עודף אלקטרונים (או זוג אלקטרונים לא קושר) שיכול לתקוף.
- נוקלאופיל חזק: טעון במטען שלילי (לא יציב עליו)
- נוקלאופיל חלש: בדרך כלל ניטרלי (עם זוג אלקטרונים לא קושר)
אלקטרופיל - חומר שחסר לו אלקטרונים והוא יכול להיתקף.
- בכימיה אורגנית האלקטרופיל בדרך כלל הוא פחמן
- יכול להיות בעל מטען חיובי או $\delta^+$ (דלתא פלוס)
קבוצה עוזבת טובה - קבוצה שיכולה לעזוב את המולקולה יחד עם זוג האלקטרונים הקושר.
- קבוצה עוזבת טובה חייבת להיות מסוגלת לשאת מטען שלילי
- אטומים גדולים (כמו יוד, ברום) הם קבוצות עוזבות טובות
- אטומים קטנים (כמו פלואור, מימן) אינם קבוצות עוזבות טובות
- קבוצות עם רזוננס טוב גם הן קבוצות עוזבות טובות
ממס פרוטי - ממס שיש לו קשרי מימן (בין מימן לחמצן, חנקן או פלואור).
ממס אפרוטי - ממס שאין לו קשרי מימן.
קרבוקטיון - פחמן טעון במטען חיובי. ככל שהוא יותר מותמר הוא יותר יציב.
אלקילהלידים - מולקולות שבהן הלוגן מחובר לפחמן. הם יכולים להיות:
- אלקילהליד ראשוני: הפחמן שעליו יושב ההלוגן מחובר לפחמן אחד נוסף
- אלקילהליד שניוני: הפחמן שעליו יושב ההלוגן מחובר לשני פחמנים נוספים
- אלקילהליד שלישוני: הפחמן שעליו יושב ההלוגן מחובר לשלושה פחמנים נוספים
תגובות $\mathrm{S_N2}$
תגובת $\mathrm{S_N2}$ (Substitution Nucleophilic 2nd order) מתרחשת בשלב אחד. היא תגובה מסדר שני כיוון שהיא תלויה גם בריכוז הסובסטרט (האלקטרופיל) וגם בריכוז הנוקלאופיל.
מנגנון התגובה:
- הנוקלאופיל תוקף את הפחמן האלקטרופילי
- בו-זמנית משתחררת הקבוצה העוזבת
- מתקבל מצב מעבר עם פחמן שמרחבית נמצא במבנה של פירמידה משולשת מעוותת
- התוצר הסופי מתקבל לאחר יצירת הקשר החדש
התגובה מלווה בהיפוך קונפיגורציה (אם זהו פחמן כיראלי), מה שנקרא גם “היפוך מטריה”.
תנאים הכרחיים לתגובת $\mathrm{S_N2}$:
- הנוקלאופיל חייב להיות חזק (כדי שיוכל לדחוף החוצה את הקבוצה העוזבת)
- הפחמן האלקטרופילי חייב להיות כמה שפחות מותמר (כדי שהנוקלאופיל יוכל לגשת אליו)
- עובד מצוין על אלקילהליד ראשוני
- עובד טוב על אלקילהליד שניוני
- לא עובד על אלקילהליד שלישוני (בגלל הפרעה סטרית)
- הנוקלאופיל חייב לתקוף 180° מעלות לקבוצה העוזבת (כדי למנוע דחייה אלקטרוסטטית)
פרופיל אנרגיה:
- תגובה בשלב אחד עם אנרגיית אקטיבציה אחת
- מצב מעבר אחד שלא ניתן לבודד
ממסים בתגובות התמרה
בתגובת $\mathrm{S_N2}$ חשוב להשתמש בממס פולרי אפרוטי (ללא קשרי מימן). הסיבות לכך:
- ממס פרוטי מייצב מטענים שליליים (על ידי קשרי מימן)
- אם הנוקלאופיל (שהוא בד”כ שלילי) מיוצב מדי, הוא לא יהיה חזק מספיק להתקפה
- נוקלאופילים חזקים הם גם בסיסים חזקים, ובממס פרוטי הם יכולים להיקשר לפרוטונים במקום לתקוף את האלקטרופיל
דוגמאות לממסים פולריים אפרוטיים:
- DMSO (דימתיל סולפוקסיד)
- DMF (דימתילפורמאמיד)
- אצטון
- אתר
דוגמה לממס לא פולרי אפרוטי:
- הקסאן
שיקולים בבחירת מסלול תגובה
בשאלות של תגובות התמרה, ניתן לשאול באותה שאלה במגוון וריאציות - על פי סוג האלקילהליד, על פי הקבוצה העוזבת וכדומה. למשל, אפשר לקחת אותו חומר בדיוק, רק עם ברום, כלור ויוד, ולשאול מי יגיב הכי מהר.
בתגובות $\mathrm{S_N2}$, המהירות מושפעת מסוג הקבוצה העוזבת (ככל שהאלוגן גדול יותר, הוא קבוצה עוזבת טובה יותר) וממידת ההפרעה המרחבית סביב הפחמן האלקטרופילי.
דוגמה: דירוג מהירות תגובה ב-$\mathrm{S_N2}$
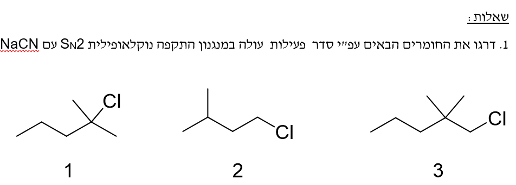
אם נסתכל על שלושה אלקילהלידים:
- אלקילהליד שלישוני
- אלקילהליד ראשוני במולקולה פשוטה
- אלקילהליד ראשוני עם קבוצות מתיל בקרבת מקום
הסדר מהמהיר ביותר לאיטי ביותר:
- חומר 2 (מהיר ביותר) - אלקילהליד ראשוני ללא הפרעה מרחבית
- חומר 3 - אלקילהליד ראשוני עם הפרעה מרחבית קלה מקבוצות המתיל
- חומר 1 (לא יגיב) - אלקילהליד שלישוני לא יכול לעבור תגובת $\mathrm{S_N2}$
דוגגמה - אלקילהליד שניוני עם $\ce{NaN3}$ (אזיד)
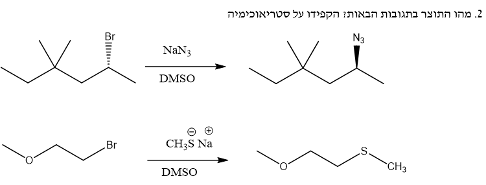
- נוקלאופיל חזק (אניון $\ce{N3-}$)
- אלקילהליד שניוני עם קבוצה עוזבת טובה (ברום)
- מנגנון $\mathrm{S_N2}$: הנוקלאופיל תוקף מהכיוון ההפוך לקבוצה העוזבת
- תוצר: אזיד עם היפוך קונפיגורציה (אם הפחמן כיראלי)
הנטריום ($\ce{Na+}$) והברום ($\ce{Br-}$) יוצרים מלח ($\ce{NaBr}$) שאינו משתתף בתגובה העיקרית. הקשר ביניהם הוא קשר יוני חלש, המתפרק בקלות בממס פולרי אפרוטי.
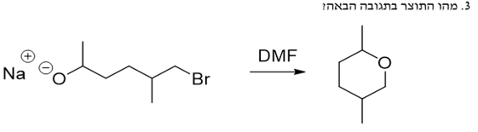
תגובה תוך-מולקולרית
כאשר הנוקלאופיל והאלקטרופיל נמצאים באותה מולקולה, יכולה להתרחש תגובת התמרה תוך-מולקולרית:
- במקרה של פחמן עם קבוצה עוזבת (כמו ברום) וחמצן טעון שלילית באותה מולקולה
- הנוקלאופיל (חמצן) תוקף את האלקטרופיל (פחמן עם הברום)
- התוצאה: יצירת טבעת והוצאת הברום כקבוצה עוזבת
חשוב לציין שתגובות תוך-מולקולריות מועדפות כאשר נוצרות טבעות יציבות (בעיקר טבעות בנות 6-5 איברים).
תגובות $\mathrm{S_N1}$
בניגוד לתגובות $\mathrm{S_N2}$, תגובות $\mathrm{S_N1}$ מתרחשות בשני שלבים:
- שלב ראשון (קובע מהירות): הקבוצה העוזבת מתנתקת עם זוג האלקטרונים ונוצר קרבוקטיון (פחמן עם מטען חיובי)
- שלב שני (מהיר): הנוקלאופיל תוקף את הקרבוקטיון
מאפיינים של תגובות $\mathrm{S_N1}$
- קרבוקטיון: ככל שהוא יותר מותמר, הוא יותר יציב
- אלקילהליד שלישוני: מעולה לתגובת $\mathrm{S_N1}$
- אלקילהליד שניוני: בסדר לתגובת $\mathrm{S_N1}$
- אלקילהליד ראשוני: לא יעבור תגובת $\mathrm{S_N1}$ (קרבוקטיון ראשוני לא יציב)
-
נוקלאופיל: חלש (לרוב הממס עצמו, כמו מים או אלכוהול)
-
ממס: פולרי פרוטי (עוזר למשוך את הקבוצה העוזבת ולייצב את הקרבוקטיון)
- שטח אנרגיה: שני מצבי מעבר עם קרבוקטיון כחומר ביניים (שאפשר לבודד)
תהליך תגובת $\mathrm{S_N1}$ עם מים או אלכוהול
כאשר מים או אלכוהול תוקפים:
- החמצן תוקף עם זוג אלקטרונים לא קושר ונוצר חמצן עם מטען חיובי
- מולקולת מים אחרת קוטפת פרוטון (דה-פרוטונציה)
- התוצר הסופי: קבוצת OH (מים) או OR (אלכוהול)
שחלוף קרבוקטיונים
חשוב מאוד: אם הקרבוקטיון אינו הכי יציב שיכול להיווצר, יכול להתרחש שחלוף:
- מימן (עם זוג אלקטרונים) או מתיל יכולים לעבור מפחמן שכן
- התוצאה: יצירת קרבוקטיון יציב יותר (למשל, שלישוני במקום שניוני)
- השחלוף קורה מהר יותר מהתקפת הנוקלאופיל
- הנוקלאופיל יתקוף את הקרבוקטיון אחרי השחלוף
הבדל מהותי: בתגובת $\mathrm{S_N2}$, הנוקלאופיל תמיד מחליף את הקבוצה העוזבת באותו פחמן. בתגובת $\mathrm{S_N1}$ עם שחלוף, הנוקלאופיל יכול להתחבר בפחמן אחר מזה שעליו ישבה הקבוצה העוזבת.
דוגמאות לתרגול
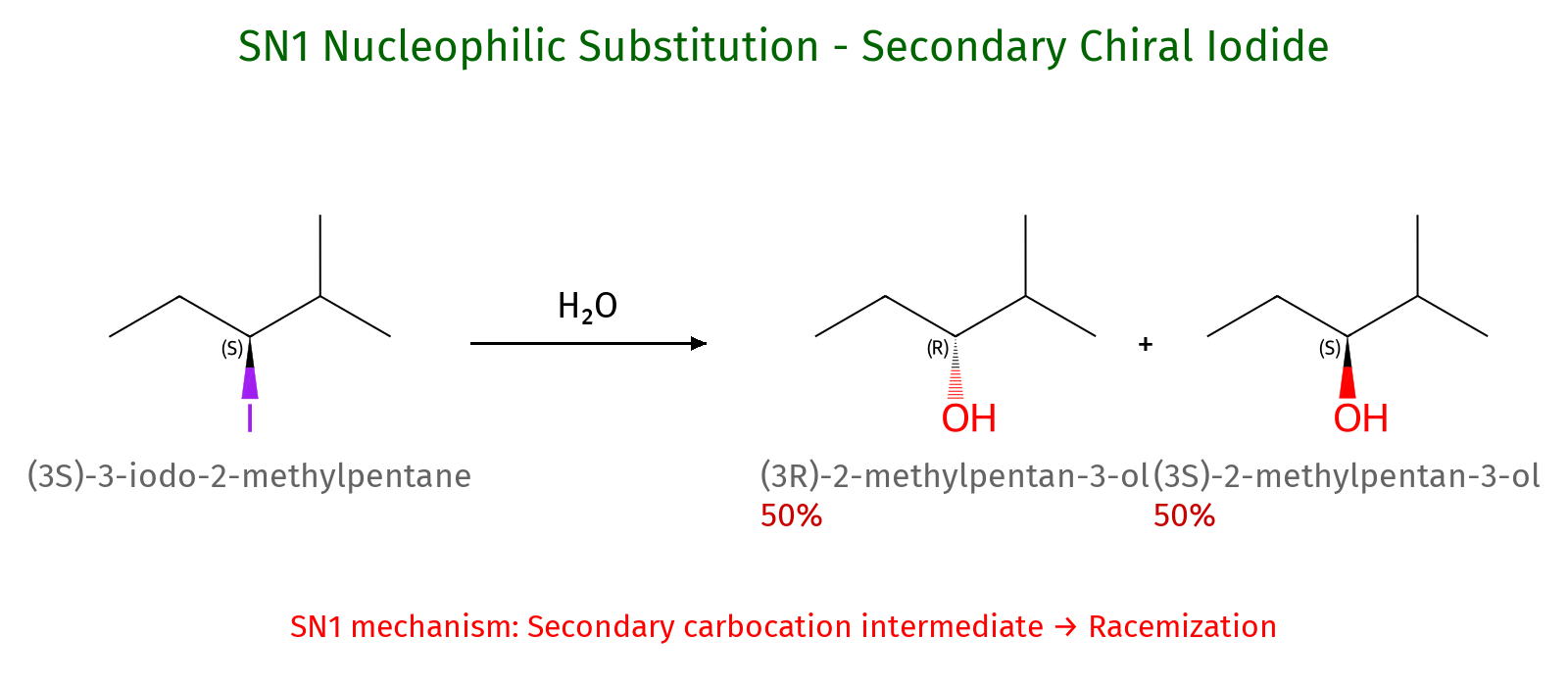
דוגמה 1: תגובת $\mathrm{S_N1}$ ללא שחלוף
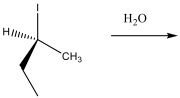
- אלקילהליד שניוני + מים (נוקלאופיל חלש) ← תגובת $\mathrm{S_N1}$
- מנגנון: הקבוצה העוזבת עוזבת ← נוצר קרבוקטיון ← מים תוקפים מכל כיוון ← דה-פרוטונציה
- תוצר: תערובת רצמית (50:50) של שני איזומרים (במקרה של פחמן כיראלי)
דוגמה 2: תגובת $\mathrm{S_N1}$ עם שחלוף
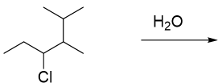
- אלקילהליד שניוני + מים, כאשר יש אפשרות לשחלוף (עמדה שלישונית שכנה)
- מנגנון: הקבוצה העוזבת עוזבת ← נוצר קרבוקטיון ← שחלוף (מימן עובר לפחמן עם הקרבוקטיון) ← נוצר קרבוקטיון שלישוני יציב יותר ← מים תוקפים
- תוצר: אלכוהול שונה מזה שהיה מתקבל ללא שחלוף
נקודות שחשוב לזכור
- בבחינת תגובה, תמיד בדקו:
- סוג האלקילהליד (ראשוני, שניוני, שלישוני)
- סוג הנוקלאופיל (חזק, חלש)
- סוג הממס (פולרי פרוטי, פולרי אפרוטי)
-
במקרה של נוקלאופיל חלש (מים) ופחמן ראשוני, ייתכן שלא תתרחש תגובה כלל
- חשוב לעבור דרך המנגנון כדי לא לפספס אפשרות של שחלוף בתגובות $\mathrm{S_N1}$
שחלופי קרבוקטיונים נוספים בתגובות $\mathrm{S_N1}$
שחלופי קבוצות מתיל
בנוסף לשחלוף מימן (הידריד) שראינו קודם, יכול להתרחש גם שחלוף של קבוצת מתיל:
- אם יש לי קרבוקטיון ליד עמדה שלישונית, יכול להתרחש שחלוף של קבוצת מתיל
- העברת קבוצת מתיל תיצור קרבוקטיון שלישוני אחר (עדיין יציב)
- שחלוף יתרחש רק אם התוצר יהיה קרבוקטיון יציב יותר
- אם העברת קבוצת מתיל תיצור קרבוקטיון שניוני (פחות יציב), השחלוף לא יתרחש
כללי מפתח לשחלופים
- שחלוף יתרחש רק מעמדה סמוכה (עמדה ליד הקרבוקטיון)
- גם אם יש עמדה שלישונית במקום אחר במולקולה, לא יהיה שחלוף אם היא לא סמוכה
- קרבוקטיון אליל (קרבוקטיון ליד קשר כפול) הוא מקרה מיוחד שיציב יחסית ויכול לעבור תגובת $\mathrm{S_N1}$
מבט מקדים על תגובות אלימינציה (E1 ו-E2)
בשיעור הבא נלמד על תגובות אלימינציה, שבהן במקום להחליף קבוצה (תגובת התמרה) אנחנו יוצרים קשר כפול:
- העקרונות דומים מאוד ל-$\mathrm{S_N1}$ ו-$\mathrm{S_N2}$
- E2 מתחרה עם $\mathrm{S_N2}$ (תנאים דומים)
- E1 מתחרה עם $\mathrm{S_N1}$ (תנאים דומים)
מי שהבין היטב את תגובות ההתמרה ($\mathrm{S_N1}$ ו-$\mathrm{S_N2}$) יוכל להבין בקלות את תגובות האלימינציה.
סיכום כללי לתגובות התמרה
| תגובות $\mathrm{S_N1}$ | תגובות $\mathrm{S_N2}$ |
|---|---|
| נוקלאופיל חלש (לרוב הממס עצמו) | נוקלאופיל חזק |
| אלקילהליד שניוני או שלישוני (לא ראשוני) | אלקילהליד ראשוני או שניוני (לא שלישוני) |
| ממס פולרי פרוטי | ממס פולרי אפרוטי |
| מנגנון בשני שלבים (דרך קרבוקטיון) | מנגנון בשלב אחד |
| אובדן הסטריאוכימיה המקורית | היפוך קונפיגורציה (מרחבית) |
| תוצר רצמי (תערובת 1:1) | תוצר אחד (סטריאוכימיה מוגדרת) |
| אפשרות לשחלוף | אין שחלוף |
חשוב לזכור:
- בתגובת $\mathrm{S_N2}$ הנוקלאופיל תמיד מחליף את הקבוצה העוזבת באותו פחמן
- בתגובת $\mathrm{S_N1}$ עם שחלוף, הנוקלאופיל יכול להתחבר בפחמן אחר מזה שעליו ישבה הקבוצה העוזבת
- בעת פתרון שאלה יש לזהות תחילה איזה מנגנון מתרחש ($\mathrm{S_N1}$ או $\mathrm{S_N2}$), ואז לעבור דרך מנגנון מלא כדי לזהות את התוצר הנכון