חזרה
- בשיעור הקודם למדנו תגובות התמרה $\mathrm{S_N1}$ ו-$\mathrm{S_N2}$
- תגובות אלימינציה מתחרות בתגובות התמרה:
- במקום נוקלאופיל - יש בסיס
- E2 מתחרה ב-$\mathrm{S_N2}$
- E1 מתחרה ב-$\mathrm{S_N1}$
תגובת אלימינציה E2
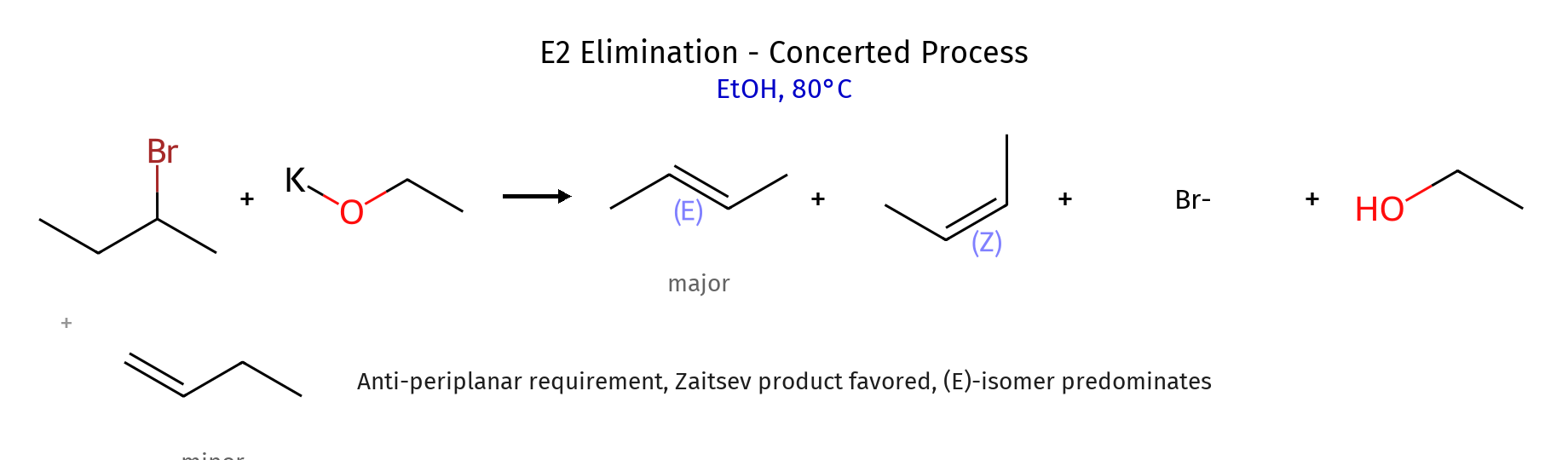
מאפיינים עיקריים
- מנגנון: תגובה חד-שלבית (בו-זמנית)
- הבסיס: קוטף פרוטון מעמדה β
- התוצר: יצירת קשר כפול בין עמדה α לעמדה β
- קצב התגובה: תלוי בסובסטרט ובבסיס
העדפת הקשר הכפול
- כלל זייצב (Zaitsev): הקשר הכפול המועדף הוא היותר מותמר (יציב יותר)
- כלל הופמן (Hofmann): כאשר הבסיס גדול ונפחי - מועדף הקשר הכפול הפחות מותמר
- בסיס גדול ונפחי: כאשר החמצן קשור לפחמן שלישוני
דרישות גיאומטריות - אנטי-פריפלנרי
- המימן הנקטף והקבוצה העוזבת חייבים להיות במצב אנטי-סטגר (anti-staggered)
- בטבעות ציקלוהקסן: שניהם חייבים להיות די-אקסיאליים
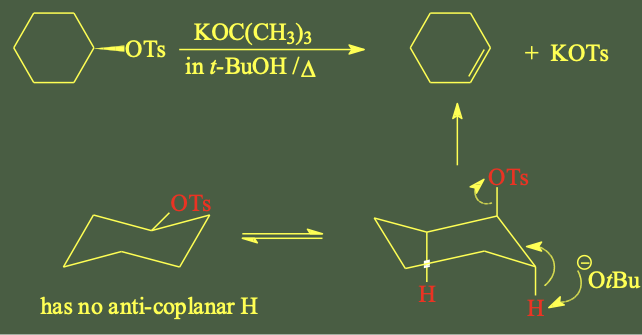
דוגמה לדרישה הגיאומטרית
כאשר יש קבוצה עוזבת (Cl) בטבעת ציקלוהקסן:
- אם הכלור אקסיאלי - המימן הנקטף חייב להיות אקסיאלי גם כן
- אם הכלור אקווטוריאלי - לא ניתן לבצע E2 (גם אחרי היפוך כיסא)
- לכן התוצר שמתקבל תלוי בגיאומטריה, לא בהכרח ביציבות
תנאי חובה ל-E2
- בסיס חזק
- מצב אנטי-סטגר בין H ו-X (הקבוצה העוזבת)
סיכום התגובות - טבלת החלטה
קטגוריות של נוקלאופילים/בסיסים
- בסיס חזק, נוקלאופיל חזק
- בסיס חזק, נוקלאופיל חזק, גדול ונפחי
- בסיס חלש, נוקלאופיל חזק (דוגמאות: $\ce{I-}$, $\ce{Br-}$, $\ce{Cl-}$)
בפחמן ראשוני ושניוני יגיבו ב-$\mathrm{S_N2}$
CN-, Br-, I-, SH-, SR-, N3-, CH3COO-, SH2, RSH, NRH2
- בסיס חלש, נוקלאופיל חלש (דוגמאות: $\ce{H2O}$, $\ce{CH3OH}$, $\ce{CH3CH2OH}$)
התנהגות לפי סוג הפחמן
פחמן מתילי ($\ce{CH3-X}$)
- תגובה יחידה אפשרית: $\mathrm{S_N2}$
- אין אפשרות ל-$\mathrm{S_N1}$ (פחמן ראשוני)
- אין אפשרות לאלימינציה (אין מימני β)
פחמן ראשוני
- $\mathrm{S_N1}$: לא אפשרי
- E2: לא אפשרי (בדרך כלל)
- תחרות בין $\mathrm{S_N2}$ ו-E2:
- בסיס חזק, נוקלאופיל חזק ← $\mathrm{S_N2}$ (מהיר יותר)
- בסיס חזק, נוקלאופיל חזק, גדול ונפחי ← E2
- בסיס חלש, נוקלאופיל חזק ← $\mathrm{S_N2}$
- בסיס חלש, נוקלאופיל חלש ← $\mathrm{S_N2}$ איטי
פחמן שניוני
- תחרות בין כל ארבע התגובות:
- בסיס חזק, נוקלאופיל חזק ← E2 (מותמר יותר)
- בסיס חזק, נוקלאופיל חזק, גדול ונפחי ← E2
- בסיס חלש, נוקלאופיל חזק ← $\mathrm{S_N2}$
- בסיס חלש, נוקלאופיל חלש ← $\mathrm{S_N1}$/E1
פחמן שלישוני
- $\mathrm{S_N2}$: לא אפשרי (הפרעה סטרית)
- תחרות בין E2, $\mathrm{S_N1}$, ו-E1:
- בסיס חזק, נוקלאופיל חזק ← E2
- בסיס חזק, נוקלאופיל חזק, גדול ונפחי ← E2
- בסיס חלש, נוקלאופיל חזק ← $\mathrm{S_N1}$
- בסיס חלש, נוקלאופיל חלש ← $\mathrm{S_N1}$/E1
סיכום תחרות בין התגובות
| סוג הפחמן | בסיס חזק, נוקלאופיל חזק | בסיס חזק, נוקלאופיל חזק, גדול ונפחי | בסיס חלש, נוקלאופיל חזק | בסיס חלש, נוקלאופיל חלש |
|---|---|---|---|---|
| מתילי ($\ce{CH3-X}$) | $\mathrm{S_N2}$ | $\mathrm{S_N2}$ | $\mathrm{S_N2}$ | $\mathrm{S_N2}$ (איטי) |
| ראשוני | $\mathrm{S_N2}$ (עיקרי) | E2 (עיקרי) | $\mathrm{S_N2}$ | $\mathrm{S_N2}$ (איטי מאוד) |
| שניוני | E2 (עיקרי) | E2 (עיקרי) | $\mathrm{S_N2}$ | $\mathrm{S_N1}$/E1 |
| שלישוני | E2 | E2 | $\mathrm{S_N1}$ | $\mathrm{S_N1}$/E1 |
הערות לטבלה:
- חימום ($\Delta$): תמיד מעודד תגובות אלימינציה (E1/E2) על פני התמרה ($\mathrm{S_N1}$/$\mathrm{S_N2}$).
- E2: התוצר העיקרי הוא לפי כלל זייצב (הקשר הכפול המותמר יותר), אלא אם הבסיס גדול ונפחי, ואז התוצר הוא לפי כלל הופמן (הקשר הכפול הפחות מותמר).
- $\mathrm{S_N1}$/E1: כאשר שני המנגנונים אפשריים, $\mathrm{S_N1}$ הוא בדרך כלל התוצר העיקרי, אלא אם יש חימום, המעדיף E1.
תגובת אלימינציה E1

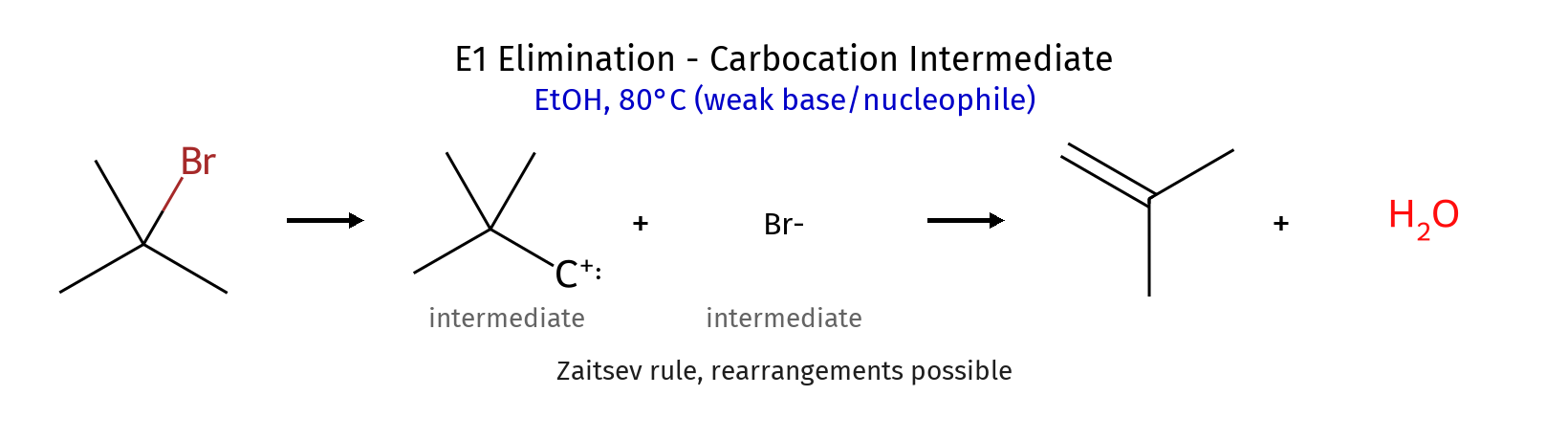
מאפיינים עיקריים של E1
- מנגנון: תגובה דו-שלבית
- שלב 1 (איטי): פירוק ליונים - יציאת הקבוצה העוזבת ויצירת קרבוקטיון
- שלב 2 (מהיר): בסיס קוטף פרוטון מעמדה β ונסגר קשר כפול
- קצב התגובה: תלוי רק בסובסטרט
השוואה ל-E2
- אין דרישה גיאומטרית של אנטי-סטגר
- הקרבוקטיון מישורי - כל מימן β יכול להיקטף
- מתקבלת תערובת של איזומרים גיאומטריים (cis/trans, E/Z)
- בדרך כלל מתקבל האיזומר היציב יותר (trans/E)
תנאים לתגובת E1
- פחמן אלקטרופילי: כמה שיותר מותמר (כמו ב-$\mathrm{S_N1}$)
- קבוצה עוזבת: טובה (יציבה עם מטען שלילי)
- בסיס: גם בסיסים חלשים מתאימים
- אפשרות לשחלופים (כמו ב-$\mathrm{S_N1}$)
הבחנה בין $\mathrm{S_N1}$ ל-E1
כאשר יש אפשרות לשתי התגובות:
- עם חימום ($\Delta$ או “heat”): E1 מועדף
- ללא חימום: $\mathrm{S_N1}$ מועדף
הסבר תרמודינמי:
- נוסחת גיבס: $\Delta G = \Delta H - T\Delta S$
- בתגובת E1 נוצרים יותר תוצרים (אנטרופיה גבוהה יותר):
- קבוצה עוזבת + אלקן + בסיס פרוטונטי
- חימום מגדיל את החשיבות של האנטרופיה בנוסחה
השפעת נוקלאופילים על בחירת התגובה
כאשר יש פחמן שלישוני עם נוקלאופיל חזק ובסיס חלש (כמו $\ce{Br-}$):
- $\mathrm{S_N1}$ מועדף על פני E1
- נוקלאופיל חזק מעדיף לתקוף ולהתחבר (התמרה) על פני קטיפת פרוטון (אלימינציה)
- למרות ששניהם חלשים כבסיסים, יש נוקלאופילים שמעדיפים התמרה
השפעת חימום על תחרות
כלל חשוב: חימום מעודד תגובת E1
- עם חימום: E1 יהיה התוצר העיקרי
- ללא חימום: $\mathrm{S_N1}$ יהיה התוצר העיקרי
הסבר תרמודינמי:
- נוסחת גיבס: $\Delta G = \Delta H - T\Delta S$
- בתגובת E1 נוצרים יותר תוצרים (אנטרופיה גבוהה יותר):
- קבוצה עוזבת + אלקן + בסיס פרוטונטי
- בתגובת $\mathrm{S_N1}$ נוצרים פחות תוצרים:
- קבוצה עוזבת + תוצר ההתמרה
- חימום מגדיל את החשיבות של האנטרופיה ($T\Delta S$)
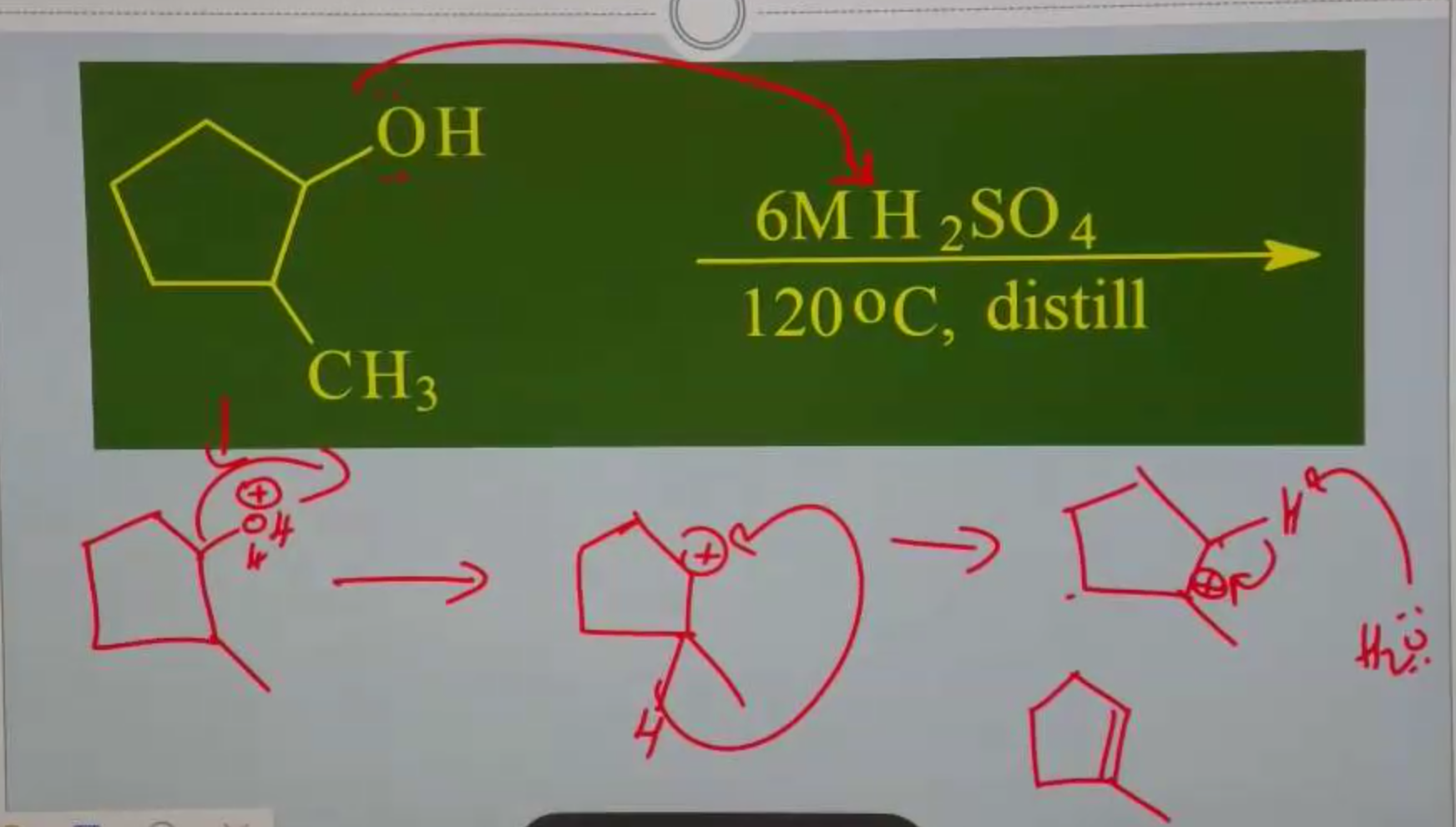
תגובת דהידרציה (Dehydration)
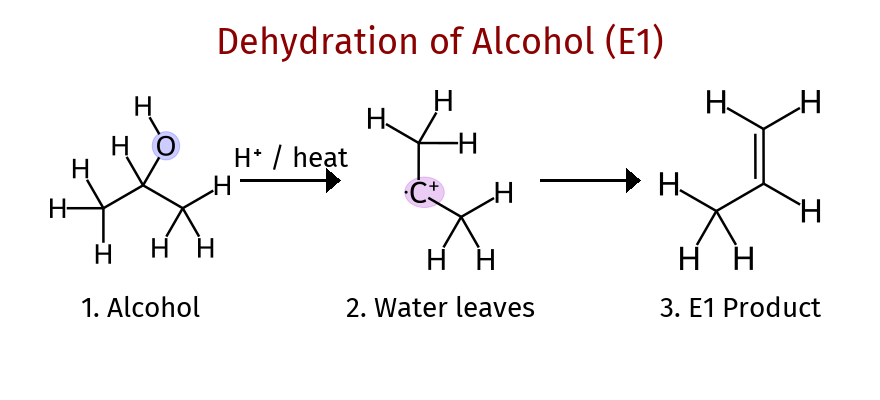
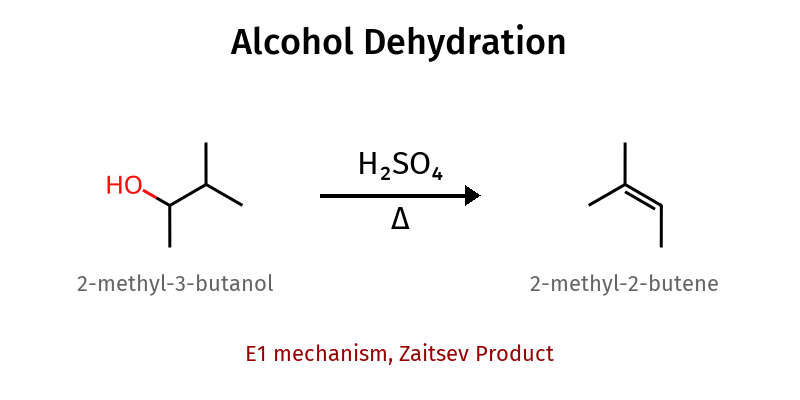
הבעיה עם OH כקבוצה עוזבת
$\ce{OH-}$ הוא בסיס מעולה ונוקלאופיל מעולה, אבל קבוצה עוזבת גרועה. הסיבה לכך היא ש-$\ce{OH-}$ לא מספיק יציב עם מטען שלילי
הפתרון להפיכת $\ce{OH}$ לקבוצה עוזבת טובה הוא להשתמש בחומצה חזקה (כמו $\ce{H2SO4}$):
- פרוטונציה: החמצן של הכוהל קוטף פרוטון מהחומצה
- $\ce{R-OH + H+ -> R-OH2+}$
- יציאת מים: $\ce{H2O}$ עוזבים (קבוצה עוזבת מצוינת)
- נוצר קרבוקטיון
- המשך התגובה: E1 או $\mathrm{S_N1}$
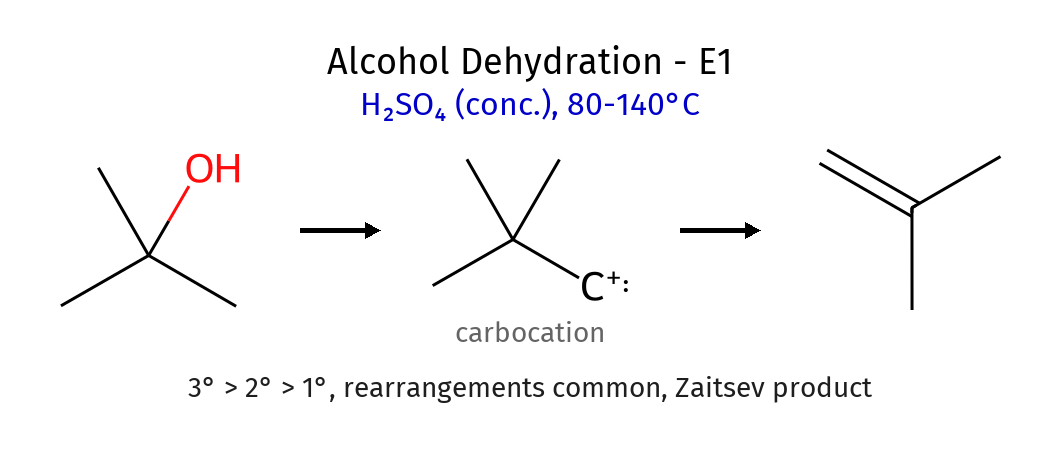
דוגמה מפורטת - מנגנון דהידרציה
כאשר יש כוהל שניוני עם $\ce{H2SO4}$:
- שלב ראשון: פרוטונציה של הכוהל
- שלב שני: יציאת $\ce{H2O}$ ויצירת קרבוקטיון
- אפשרות לשחלוף: אם אפשרי, קרבוקטיון משתכלל ליציב יותר
- שלב אחרון:
- תוצר משני: קטיפת פרוטון ישירות (ללא שחלוף)
- תוצר עיקרי: אחרי שחלוף, קטיפת פרוטון לקבלת האלקן היציב ביותר
הערה חשובה: בנוכחות חומצה בדרך כלל מקבלים תגובת אלימינציה (E1) ולא התמרה ($\mathrm{S_N1}$), כי המים שנוצרים משמשים כבסיס לקטיפת הפרוטון.
סיכום E1 לעומת E2
השוואה מקיפה
| תכונה | E1 | E2 |
|---|---|---|
| העדפת פחמן | שלישוני | שלישוני (אבל גם שניוני אפשרי) |
| בסיס | חלש | חזק |
| קצב התגובה | תלוי רק בסובסטרט | תלוי בסובסטרט ובבסיס |
| דרישה גיאומטרית | אין | אנטי-פריפלנרי (די-אקסיאלי בטבעות) |
| מנגנון | דו-שלבי | חד-שלבי |
| תוצרים | תערובת איזומרים גיאומטריים | איזומר אחד ספציפי |
תרגול - פתרון שאלות מבחן
זיהוי תגובה ותוצר
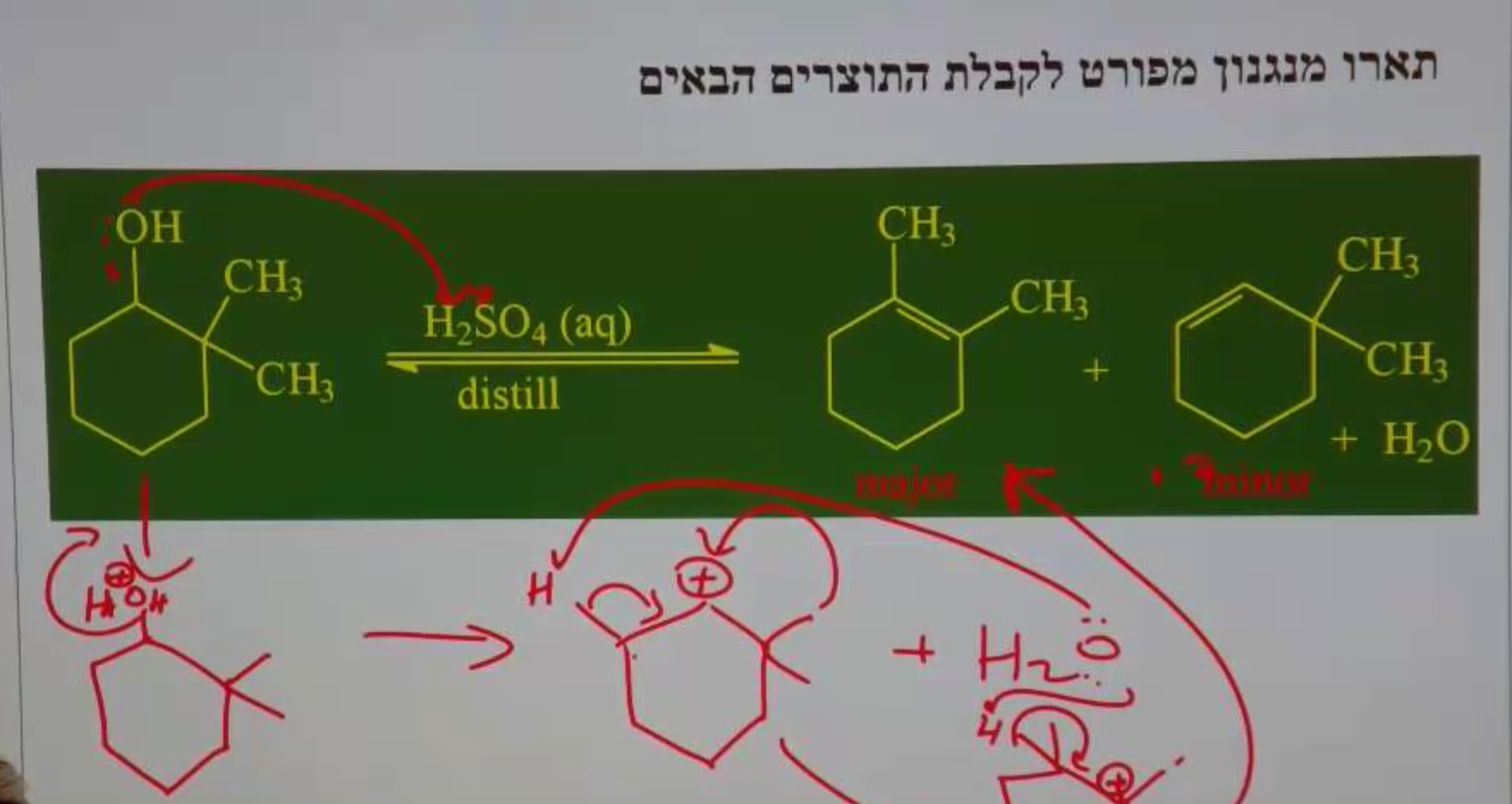
זיהוי תגובה ותוצר
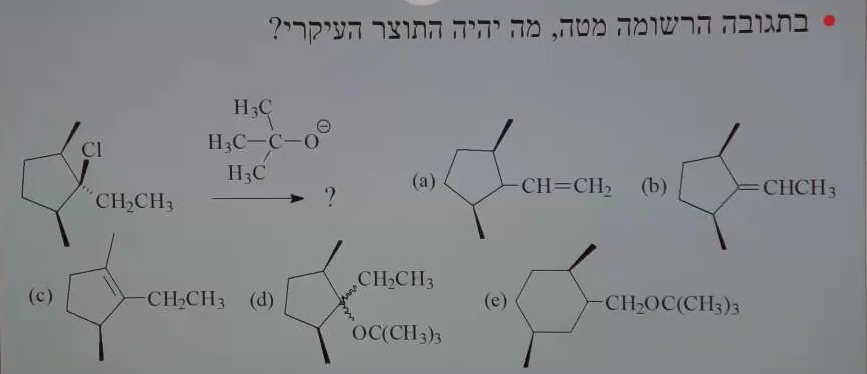
נתון: פחמן שלישוני + בסיס חזק גדול ונפחי
פתרון:
- פחמן שלישוני ← $\mathrm{S_N2}$ לא אפשרי
- בסיס חזק גדול ונפחי ← E2 עם כלל הופמן
- התוצר: הקשר הכפול הפחות מותמר
B התשובה הנכונה.
משוואת קצב
לאיזה סוג תגובה שייכת משוואת הקצב הבאה:
\[\text{Rate = k[RX][Nu:]}\]
- SN1
- SN2
- E1
- E2
- SN1 and E1
- SN2 and E2
זיהוי מנגנון
שלישוני

פחמן שלישוני עם בסיס חזק ($\ce{NH2-}$) - תגובת E2.

פחמן שניוי עם $\ce{Br-}$
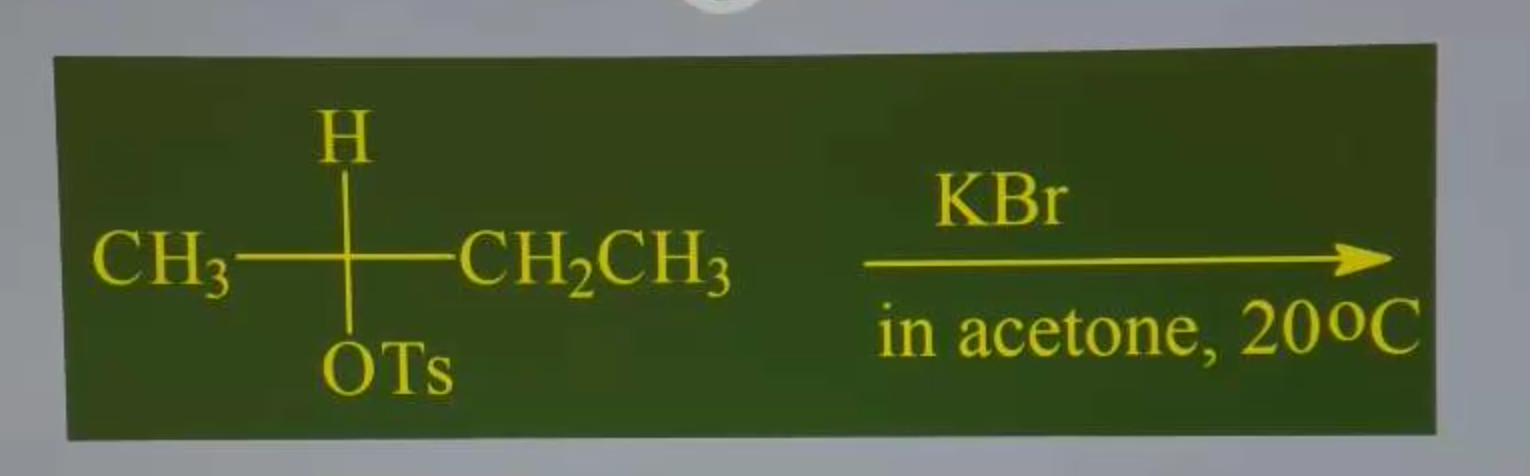
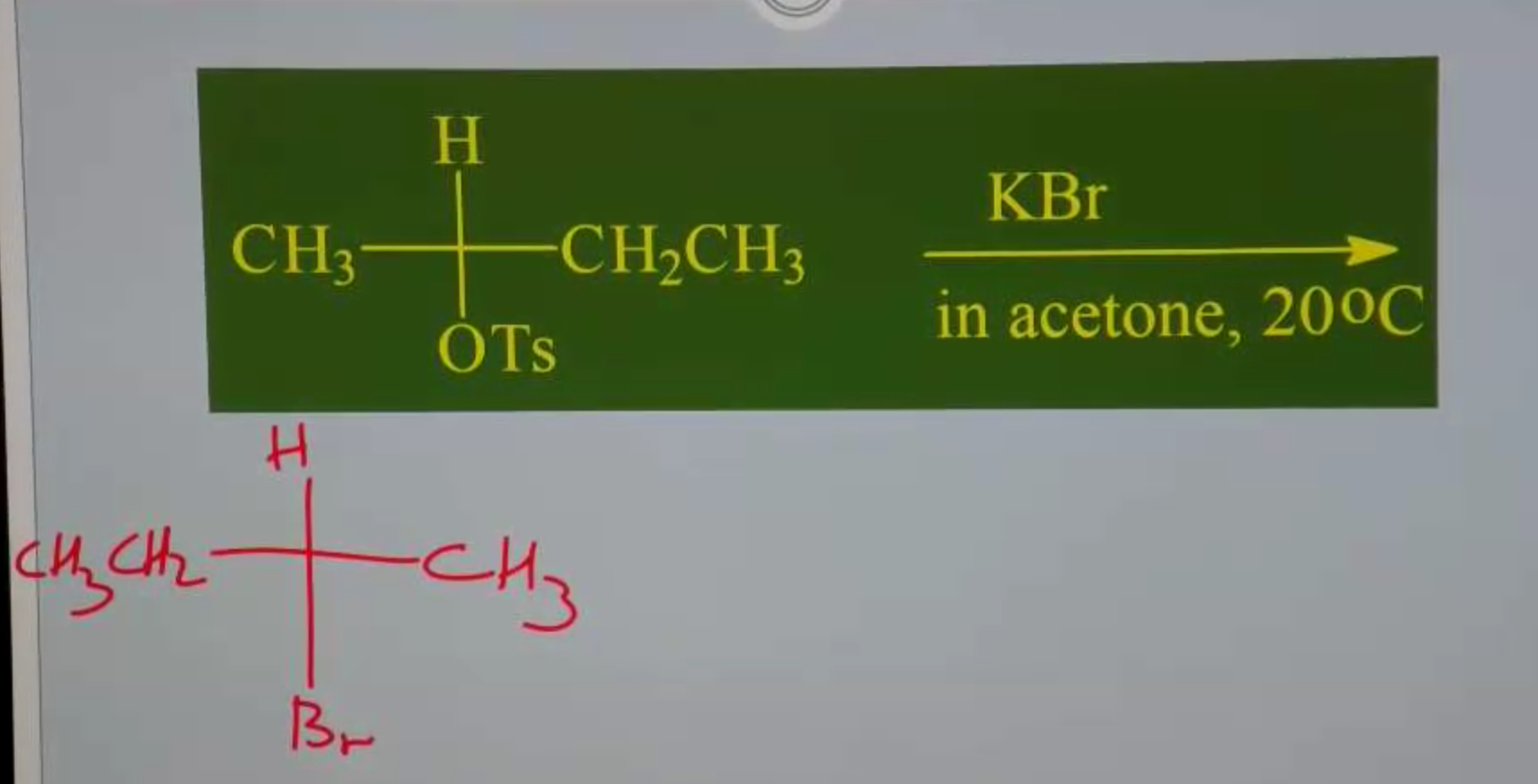
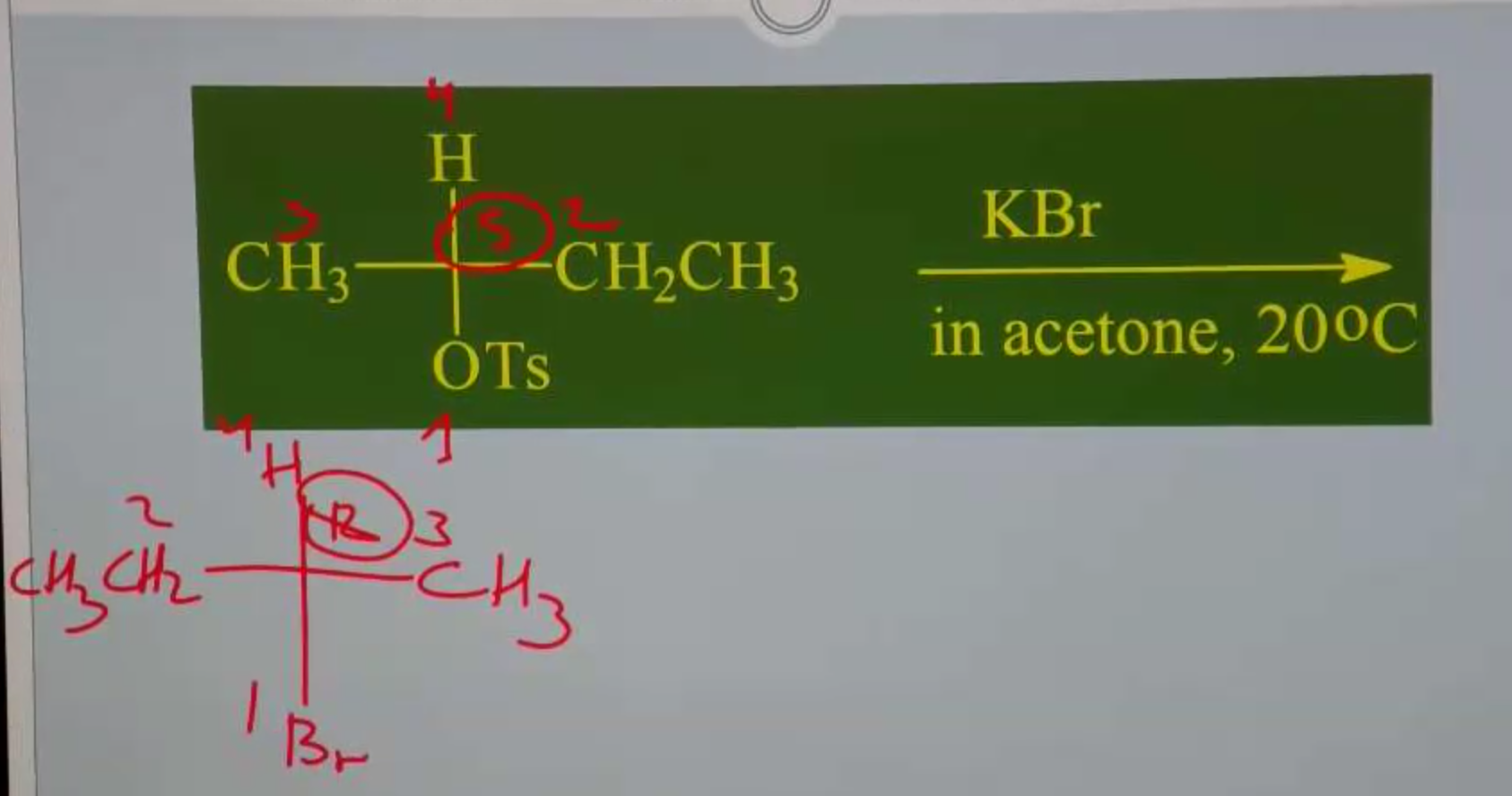
$\ce{Br-}$ הוא נוקלאופיל חזק, אבל לא בסיס חזק. לכן התגובה היא $\mathrm{S_N2}$.
- $\ce{Br-}$ נוקלאופיל חזק כי הוא יון גדול
בנוסף, התגובה מתרחשב עם ממס של אצטון (פולרי אפרוטי), שמעדיף נוקלאופילים חזקים.
הקבוצה העוזבת כאן היא $\ce{OTs}$ (טוסילט), שהיא קבוצה עוזבת טובה.
הפחמן כיראלי ולכן יהיה היפוך קונפיגורציה (inversion of configuration): אם התחלנו אם $\ce{S}$, התוצר יהיה $\ce{R}$ ולהפך.
פחמן שניוני + בסיס חזק
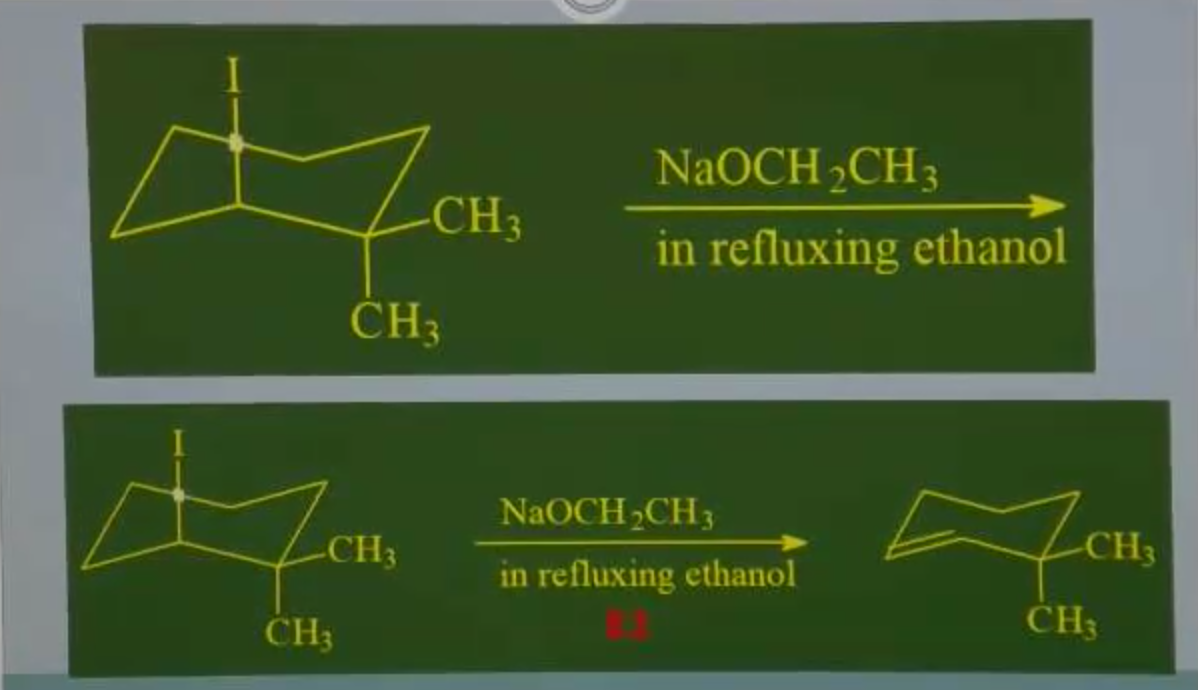
התגובה מתרחשב עם $\ce{NaOCH2CH3}$, שהוא בסיס חזק (אלקוקסיד) -> E2.
מצד ימין אין פחמן שיכול להיקטף, ולכן ייקטף דווקא הפחמן הפחות מועדוף (הפחות מותמר).
ראשוני עם $\ce{NaOCH3}$
\[\ce{CH3CH2CH2CH2CH2Cl ->[NaOCH3][in methanol, room temp] ?}\]
התגובה מתרחשת עם $\ce{NaOCH3}$, שהוא בסיס חזק. מכיוון שהפחמן הוא ראשוני, התגובה תהיה $\mathrm{S_N2}$.
הפחמן לא כיראלי ולכן אין להיפוך משמעות.

אנטי-פריפלנרי בטבעות ציקלוהקסן
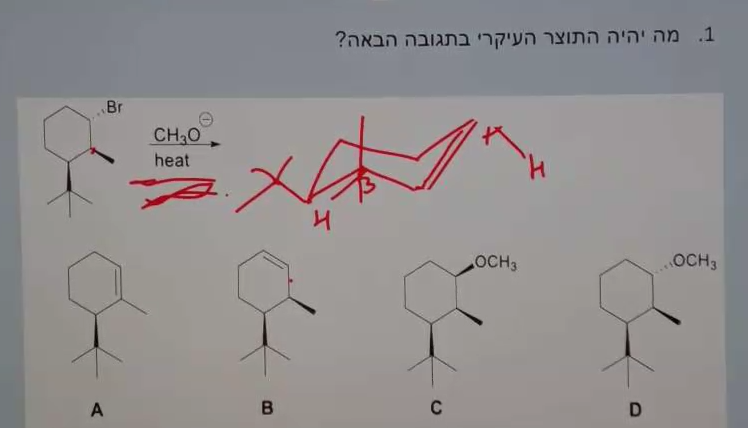
עיקרון חשוב: בטבעת ציקלוהקסן, E2 דורש שהמימן והקבוצה העוזבת יהיו די-אקסיאליים
דוגמה:
- אם $\ce{Br}$ אקסיאלי למטה
- המימן שיקטף חייב להיות אקסיאלי למעלה (בפחמן β)
- אם אין מימן כזה באותו צד - יקטף מימן מצד אחר
התשובה היא B.
בחירת בסיס מתאים ל-E2
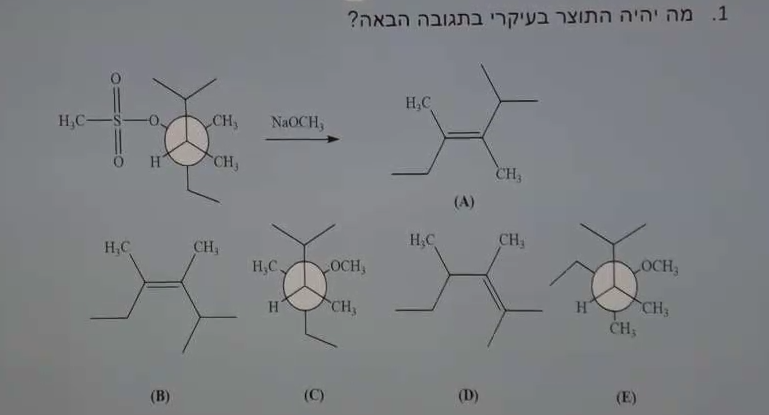
מהו הריאגנט שמתאים לתגובה הבאה?
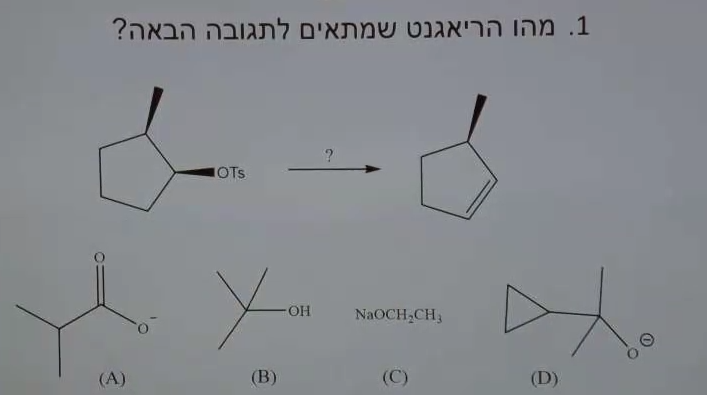
כדי לקבל את הקשר הכפול הפחות מותמר, צריך:
- לזהות שזו תגובת E2 (מהתוצר)
- לבחור בסיס חזק גדול ונפחי
- לדוגמה: $\ce{(CH3)3CO-}$ (tert-butoxide)
התשובה הנכונה היא D.
השוואת חוזק בסיסים
מהחומרים הבאים, מיהו הבסיס החלש ביותר?

סדר חוזק בסיסים (מהחלש לחזק):
- הכי חלש: $\ce{S-}$ (יציב עם מטען שלילי - יון גדול)
- $\ce{O-}$ (יותר אלקטרושלילי מ-N אבל פחות מ-S)
- $\ce{N-}$
- הכי חזק: $\ce{C-}$ sp³ (הכי פחות יציב עם מטען שלילי)
כללים:
- לאורך שורה: אלקטרושליליות קובעת (O > N > C)
- לאורך טור: גודל היון קובע (S > O)
השפעת הממס על $\mathrm{S_N2}$
התגובה הרשומה מטה תהיה הכי מהירה כאשר הנוקלואיפיל, Nu יהיה…
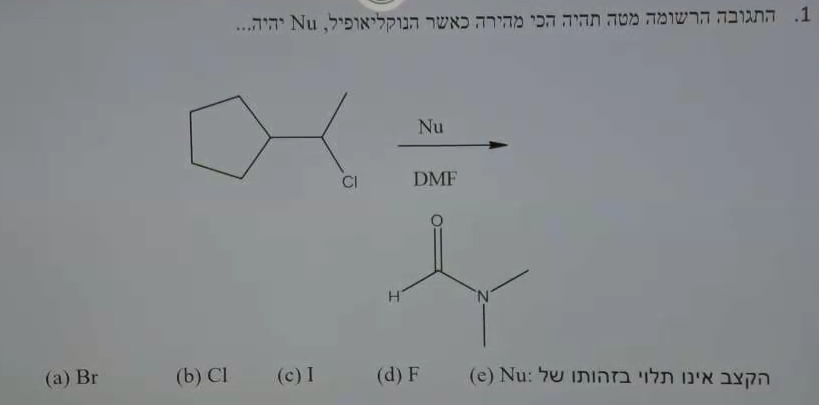
ממס DMF (דימתילפורמאמיד):
- כתוב ״נוקלאופיל״ אז אפשר לזהות שמדובר ב$\mathrm{S_N1}$ או $\mathrm{S_N2}$
- הפחמן שניוני - יכול גם $\mathrm{S_N2}$ וגם $\mathrm{S_N1}$
- ממס פולרי אפרוטי (DMF) - אין קשרים בין מימן לבין N או F
- בתגובת $\mathrm{S_N2}$ נוקלאופיל חזק מתחל לשני חלקים:
- בסיס חזק מנצח - כאשר הממס הוא פולרי אפרוטי
- יון גדול מנצח - כאשר הממס הוא פולרי פרוטי
- מעודד תגובות $\mathrm{S_N2}$
- הנוקלאופיל הטוב ביותר בממס אפרוטי: היון הבסיסי יותר. פלואור הוא הבסיס החזק ביותר מבין האפשרויות, ככל שיורדים בטור, חוזק הבסיס יורד.
התשובה: $\ce{F-}$ (הכי ריאקטיבי בממס אפרוטי)
השפעת הממס על תגובות $\mathrm{S_N2}$
ממס DMF (דימתילפורמאמיד)
שאלה: מהו הנוקלאופיל הטוב ביותר לתגובת $\mathrm{S_N2}$ בממס DMF?
זיהוי סוג הממס
- בחינת המבנה של DMF:
- יש לבדוק האם קיים קשר קוולנטי בין N או F למימן
- ב-DMF אין קשר כזה
- מסקנה: DMF הוא ממס פולרי אפרוטי
- הבנת קשרי מימן:
- קשר מימן נוצר בין מולקולות כאשר:
- במולקולה אחת: H קשור קוולנטית ל-N, O, או F
- במולקולה שנייה: N, O, או F עם זוג אלקטרונים חופשי
- DMF לא יכול ליצור קשרי מימן בין מולקולותיו
- קשר מימן נוצר בין מולקולות כאשר:
בחירת הנוקלאופיל
בממס פולרי אפרוטי:
- בסיס חזק מנצח על פני יון גדול
- סדר החוזק הבסיסי: $\ce{F- > Cl- > Br- > I-}$
- תשובה: $\ce{F-}$ הוא הנוקלאופיל הטוב ביותר
הסבר: בממס אפרוטי, היונים הקטנים (בסיסים חזקים) לא מסולבטים היטב ולכן ריאקטיביים יותר.
הערות חשובות לפתרון שאלות
- תמיד לזהות קודם את סוג התגובה לפני בחירת תשובה
- לבדוק את כל התנאים:
- סוג הפחמן (ראשוני/שניוני/שלישוני)
- חוזק הבסיס/נוקלאופיל
- גודל ונפחיות
- דרישות גיאומטריות
- בתגובות E2 בטבעות: תמיד לבדוק אנטי-פריפלנרי
- זכרו: E1 תמיד נותן את הקשר הכפול היותר מותמר
- חימום: מעודד אלימינציה על פני התמרה
תרגול מתקדם - שאלות מבחן
תגובת E2 עם דרישה גיאומטרית
נתון: פחמן שלישוני עם בסיס חזק
זיהוי התגובה:
- פחמן שלישוני + בסיס חזק ← E2
הקבוצה העוזבת היא הטוזילט (TsO), שהיא קבוצה עוזבת טובה. מסתכלים על הפחמן שמחובר אליה - הוא שלישוני, ולכן התגובה היא E2.
הפחמן הרלוונטי הוא זה שמאוחרה בהיטל ניומן.
הדרישות ל-E2:
- בסיס חזק ✓
- המימן שנקטף והקבוצה העוזבת צריכים להיות במצב אנטי-סטאגארד (anti-staggered)
בציקלוהקסאן (טבעת) המימן שנקטף והקבוצה העוזבת צריכים להיות אקסיאלים (⇅)
המצב הנתון בשאלה:
TsO CH3
\ /
◯ <— back c
/ |
isopropyl / Ethyl
| /
● <— FRONT C
/ \
H CH3
זה לא אנטי-סטגרד, כי ה-H וה-TsO לא נמצאים במצב אנטי-פריפלנרי. צריך לסובב את הפחמן הקדמי כך שה-H יהיה אנטי לקבוצה העוזבת:
TsO CH3
\ /
◯ <— back c
/ |
CH3 / Ethyl
| /
● <— FRONT C
/ \
isopropyl H
בשלב הבא המימנים והקבוצה העוזבת נעלמים:
CH3
/
◯
/ |
CH3 / Ethyl
| /
●
/
isopropyl
Front:
/
=C
\ _
|
נוצר קשר כפול בין הפחמן האחורי לפחמן הקדמי. צריך לזהות מי אנטי לאיזופרופיל כעת - זה המתיל ($\ce{CH3}$) שנמצא בצד השני של הקשר הכפול (בפחמן האחורי). באופן דומה, מי שאנטי למתיל הקדמי (שלמעלה) הוא האתיל מאחורה.
\ /
c==C
_/ \ _
|
התשובה הסופית היא B.
פתרון באמצעות הטלת ניומן:
- ציור הטלת ניומן עם הקבוצה העוזבת
- סיבוב הפחמן הקדמי כך שה-H יהיה אנטי לקבוצה העוזבת
- ביצוע האלימינציה
- ציור התוצר הסופי
טיפ: קל יותר לסובב בהטלת ניומן מאשר לסובב בייצוג תלת-ממדי
השוואת ריאקטיביות ב-$\mathrm{S_N1}$
מי מבין הסוּבְּסְטְרָטים הבאים יגיב הכי מהר בתגובה $\mathrm{S_N1}$?
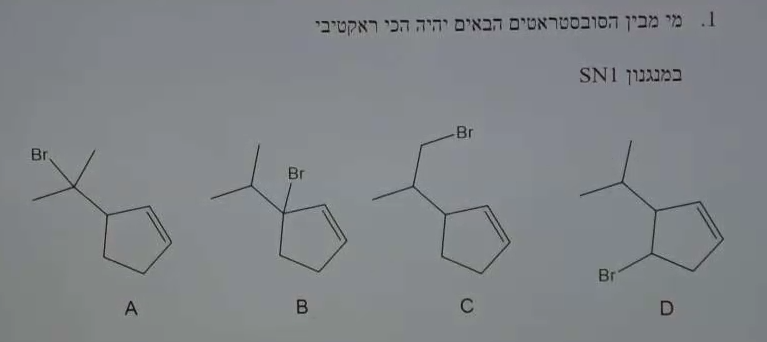
עיקרון: בתגובת $\mathrm{S_N1}$, מהירות התגובה תלויה ביציבות הקרבוקטיון
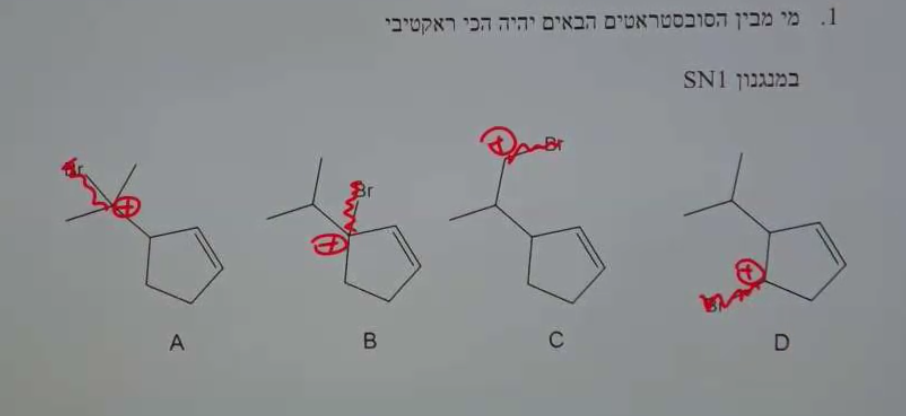
סדר הריאקטיביות:
- הכי ריאקטיבי: קרבוקטיון שלישוני עם רזוננס
- קרבוקטיון שלישוני רגיל
- קרבוקטיון שניוני עם רזוננס
- קרבוקטיון שניוני רגיל
- הכי פחות ריאקטיבי: קרבוקטיון ראשוני (לא קיים במציאות)
חשוב: רזוננס אפשרי רק כאשר יש פחמן $sp^2$ צמוד לקרבוקטיון
התשובה היא B - קרבוקטיון שלישוני עם רזוננס.
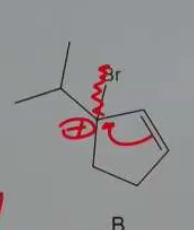
תגובת דהידרציה עם חומצה זרחתית
מי יהיה התוצר העיקרי בתגובה הבאה?
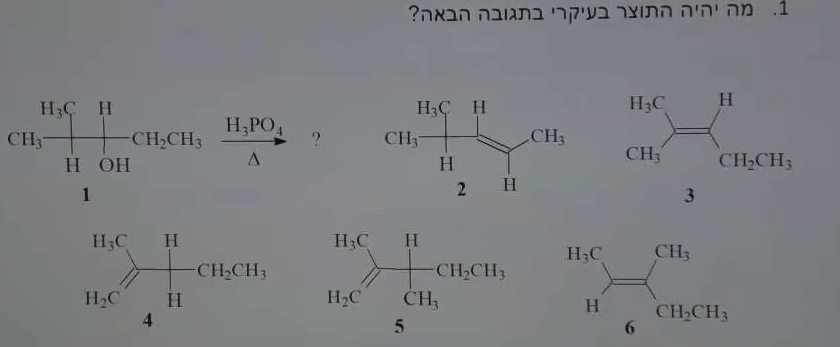
מנגנון (עם $\ce{H3PO4}$):
-
פרוטונציה:
\[\ce{R-OH + H+ -> R-OH2+}\] -
יציאת מים ויצירת קרבוקטיון:
\[\ce{R-OH2+ -> R+ + H2O}\] - שחלוף (אם אפשרי):
- העברת H או מתיל לקבלת קרבוקטיון יציב יותר
- אלימינציה:
- קטיפת פרוטון β על ידי המים
- יצירת הקשר הכפול היציב ביותר (כלל זייצב)
התשובה היא 3.
כללים חשובים לפתרון שאלות
סדר העבודה המומלץ
- זיהוי התגובה:
- התמרה או אלימינציה?
- אם התמרה: $\mathrm{S_N1}$ או $\mathrm{S_N2}$?
- אם אלימינציה: E1 או E2?
- בדיקת התנאים:
- סוג הפחמן
- חוזק הבסיס/נוקלאופיל
- דרישות גיאומטריות
- ציור התוצר:
- לעבוד בצד ורק אז להשוות לתשובות
- להיזהר מתשובות מבלבלות
טיפים חשובים
- אל תסתכלו על התשובות לפני שפתרתם
- בתגובות E2: תמיד בדקו אנטי-פריפלנרי
- בקרבוקטיונים: תמיד בדקו אפשרות שחלוף
- בטבעות: ציירו בקונפורמציית כיסא או השתמשו בהטלת ניומן
הבחנה בין סוגי ממסים
ממס פרוטי
- הגדרה: יכול ליצור קשרי מימן
- דוגמאות: מים, מתנול, אתנול
- השפעה: מייצב אניונים קטנים ← נוקלאופילים גדולים טובים יותר
ממס אפרוטי פולרי
- הגדרה: פולרי אך לא יכול ליצור קשרי מימן
- דוגמאות: DMF, DMSO, אצטון
- השפעה: לא מייצב אניונים ← נוקלאופילים קטנים (בסיסים חזקים) טובים יותר
סיכום התגובות - זיהוי מהיר
| סימן מזהה | סוג התגובה |
|---|---|
| קשר כפול בתוצר | אלימינציה (E1/E2) |
| החלפת קבוצה | התמרה ($\mathrm{S_N1}$/$\mathrm{S_N2}$) |
| פחמן שלישוני | $\mathrm{S_N1}$ או E2 (לא $\mathrm{S_N2}$!) |
| בסיס חזק | E2 או $\mathrm{S_N2}$ |
| בסיס חלש | E1 או $\mathrm{S_N1}$ |
| חימום | מעדיף אלימינציה |