מים ושיווי משקל
שיווי המשקל של מים הוא בסביבות $7 \, \text{pH}$ - מה שאנחנו קוראים לו “$\text{pH}$ טבעי”. ברוב האורגניזמים החיים, פעילות מולקולרית מתרחשת באזור ה-$\text{pH}$ הטבעי. אנזימים שמזרזים תהליכים ביוכימיים בגוף פועלים בצורה אופטימלית בסביבת ה-$\text{pH}$ הטבעי.
מבנה מולקולת המים
מולקולת מים בנויה משני אטומי מימן ואטום חמצן אחד ($\ce{H2O}$). לחמצן יש שני זוגות אלקטרונים לא קושרים, והוא מושך אליו את האלקטרונים של המימן. מבחינה הסתברותית, האלקטרונים של המימן נמצאים קרוב יותר לחמצן, ולכן:
- החמצן נושא מטען חלקי שלילי ($\delta^-$)
- המימנים נושאים מטען חלקי חיובי ($\delta^+$)
קשרי מימן
קשרי מימן נוצרים בין יסודות כמו חנקן ($\ce{N}$), חמצן ($\ce{O}$) ופלואור ($\ce{F}$) לבין מימן (נו״ף). אורך קשר מימן הוא בממוצע $\langle d_{\text{H-bond}} \rangle = 1.7,\text{Å}$, אך הוא יכול לנוע בטווח של $1.8,\text{Å} \leq d_{\text{H-bond}} \leq 3.4,\text{Å}$.
ככל שהמרחק בין שני המשתתפים בקשר ארוך יותר, כך הקשר חלש יותר.
מאפייני קשרי מימן
- קשרים חלשים יחסית (כ-23 קילו-ג’אול למול)
- קשרים אלקטרוסטטיים בעלי אוריינטציה מרחבית
- קשרים טרנזיינטיים (נשברים ונוצרים מחדש בהתמדה)
- זמן מחצית החיים של קשר מימן הוא בין 1 ל-20 פיקו-שניות ($10^{-12}$ שניות)
במולקולות מים בנוזל, כל מולקולה יוצרת בממוצע 3.4 קשרי מימן עם מולקולות מים שכנות. בקרח, בגלל הטמפרטורה הנמוכה, יש יותר קשרי מימן כי פחות קשרים נשברים.
תפקיד קשרי מימן בביולוגיה
- האינטראקציות בין חלבונים לליגנדים שלהם
- האינטראקציות בין חלבון לחלבון
- קישור בסיסים חנקניים ב-DNA (בין A ל-T שני קשרים, ובין C ל-G שלושה קשרים)
- אינטראקציות בין מולקולות מים לחלבונים
גיאומטריה של קשרי מימן
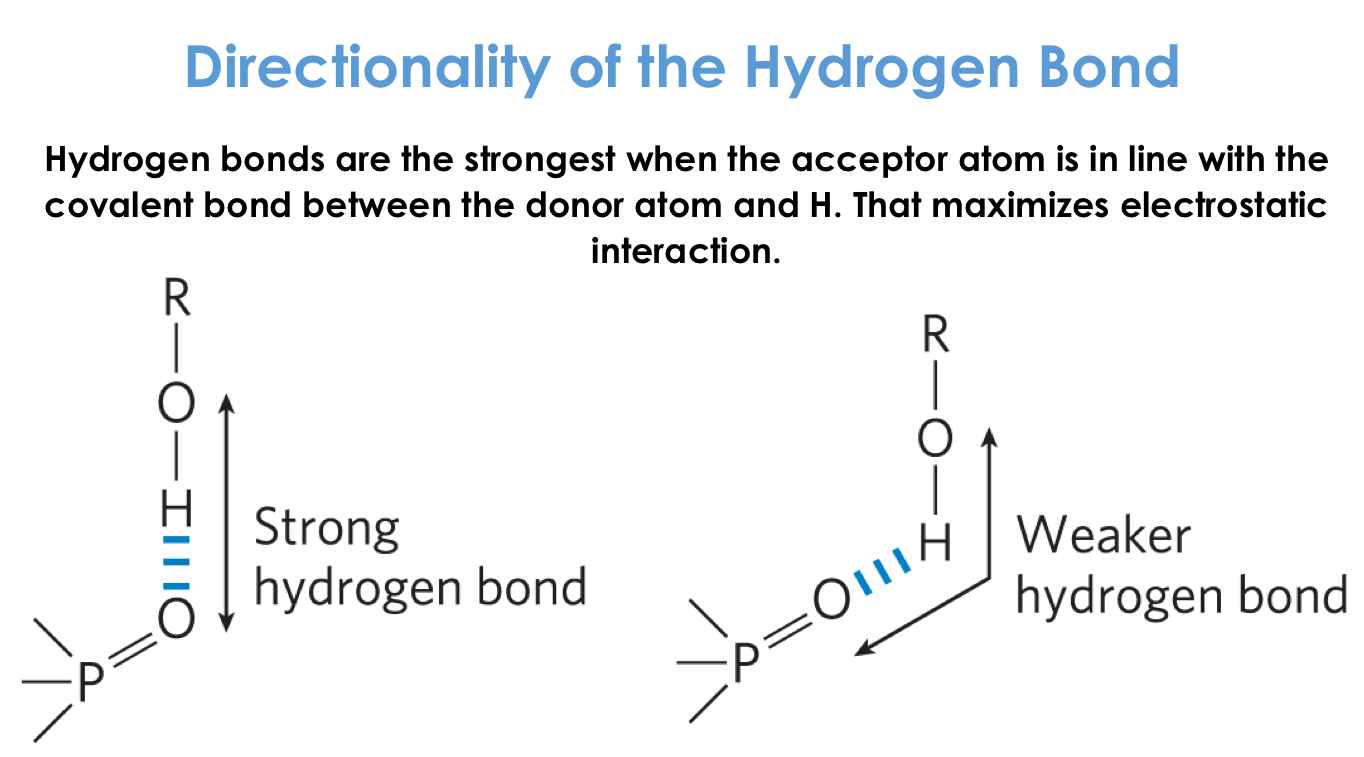
- כאשר כל המשתתפים בקשר מיושרים על אותו קו, הקשר חזק יותר
- כאשר הקשר נוצר בזווית (לא בקו ישר), הקשר חלש יותר
לגיאומטריה של קשרי מימן יש משמעות לגבי:
- יציבות חלבונים
- קישור ליגנדים
- פיתוח תרופות - איך יושבות הקבוצות הפונקציונליות של התרופה באתר הקישור
טרמינולוגיה של אינטראקציות מולקולריות
הידרופילי
- חומר שאוהב מים או מרגיש נוח במים
- בד”כ בעל קבוצות פולאריות או טעונות
הידרופובי
- חומר שלא אוהב מים
- בד”כ לא פולארי
אמפיפטי
- מולקולה בעלת חלק הידרופילי וחלק הידרופובי
- דוגמאות: סבון, דטרגנטים, פוספוליפידים
דוגמאות למולקולות שונות
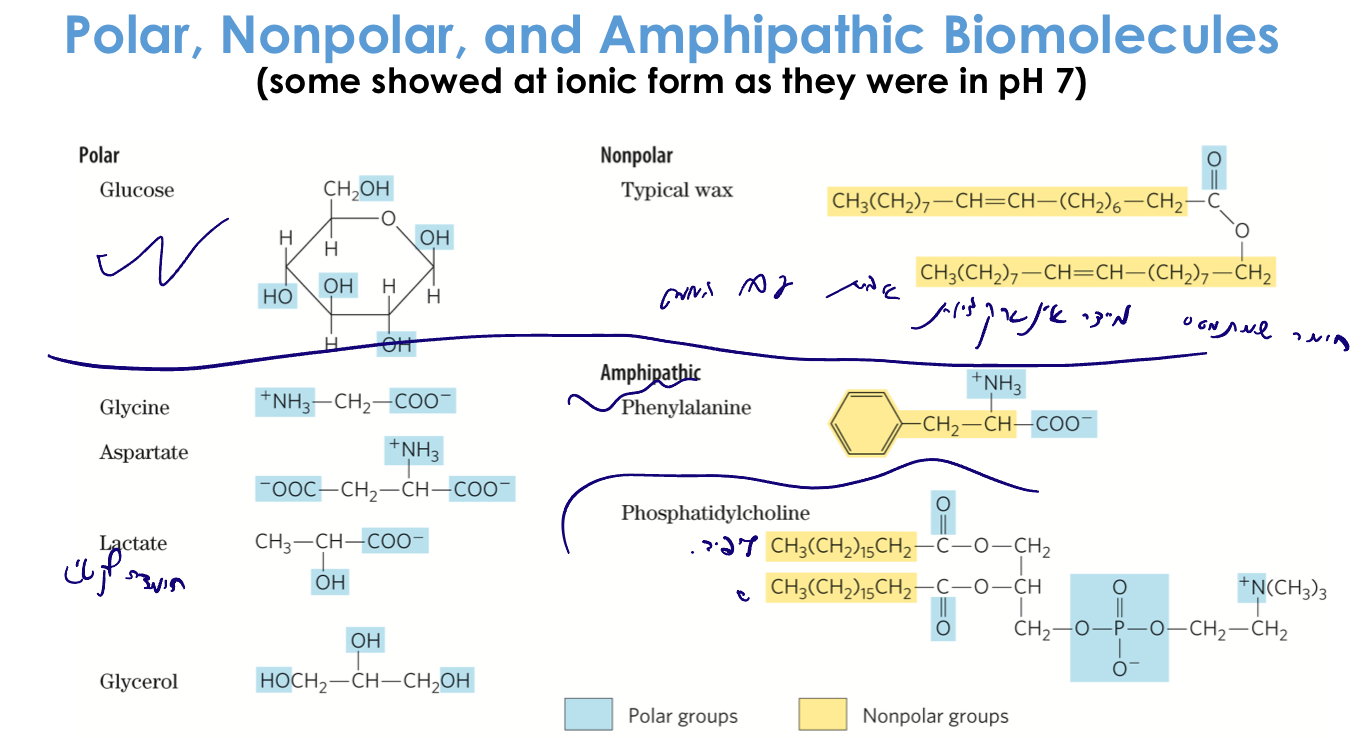
מולקולות פולאריות/טעונות (הידרופיליות)
- גלוקוז: סוכר עם הרבה קבוצות $\ce{OH}$ היוצרות קשרי מימן עם מים
- גליצין: חומצה אמינית עם קצה קרבוקסילי וקצה אמיני טעונים
- אספרטאט: חומצה אמינית עם קבוצה קרבוקסילית נוספת בשייר הצד
- לקטט: תוצר של נשימה אנאירובית בשרירים, עם קבוצת $\ce{OH}$ וקבוצה קרבוקסילית
מולקולות הידרופוביות (לא פולאריות)
- שעווה: שרשראות פחמימניות ארוכות ללא קבוצות פולאריות
- חומרים אליפטיים
- פנילאלנין: חומצה אמינית עם טבעת ארומטית הידרופובית בשייר הצד
המסת חומרים במים
כאשר מלח ($\ce{NaCl}$) מתמוסס במים, קשרי המימן של המים מחליפים את הקשרים היוניים בגביש המלח. זה מתרחש כי מספר מולקולות המים גדול בהרבה ממספר היונים בגביש המלח, ולכן ה”מאבק” בין הקשרים מוכרע לטובת קשרי המימן.
חומצות שומן, מולקולות אמפיפטיות ואינטראקציות הידרופוביות
מבנה ותכונות של חומצות שומן
חומצות שומן מכילות קבוצה קרבוקסילית פולארית ($\ce{COOH}$) וחלק הידרופובי - שרשרת אליפטית. המונחים “הידרופובי” ו”אליפטי” משמשים לעתים לתיאור אותה תכונה. השרשראות האליפטיות מורכבות מקבוצות $\ce{CH3}$, $\ce{CH2}$, $\ce{CH2}$, $\ce{CH2}$ וכו’, שהן הידרופוביות מטבען.
מסיסות מולקולות הידרופוביות במים
מנגנון המסה בריכוז נמוך
כאשר יש ריכוז נמוך של קבוצות הידרופוביות בממס מימי, המולקולות עדיין מסיסות כי:
- מולקולות המים מספיקות בכמותן ליצור מעטפת הידרציה סביב הקבוצות ההידרופוביות
- נוצרת מעטפת (הידרציה) של מולקולות מים מסביב למולקולה ההידרופובית
- כל מולקולה הידרופובית מתנהגת באופן עצמאי ומוקפת במעטפת ההידרציה שלה
האפקט ההידרופובי וייצור מיצלות
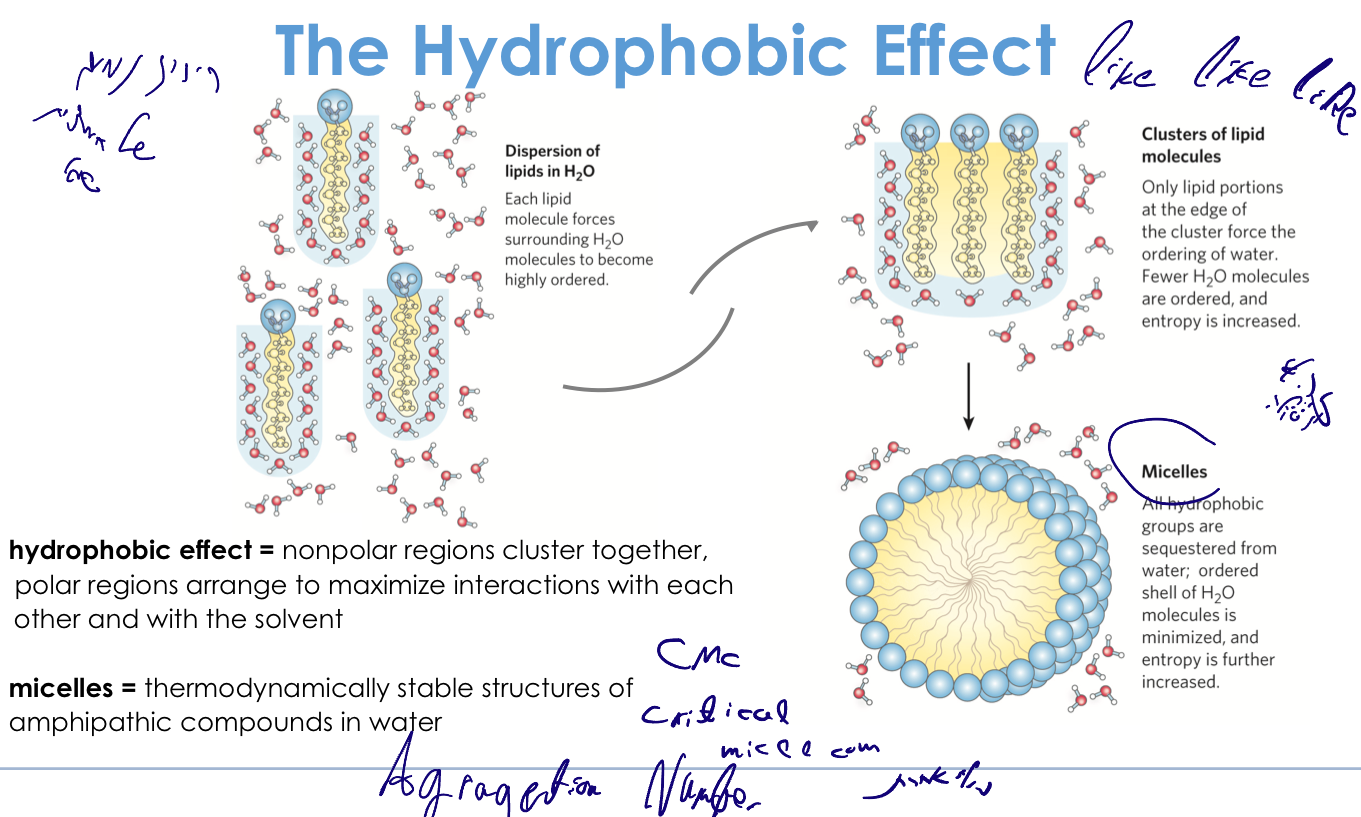
כאשר עולה ריכוז המולקולות ההידרופוביות במים:
- נוצרים אזורים הידרופוביים שמעדיפים להתקבץ יחדיו (“דומה אוהב דומה”)
- מולקולות הידרופוביות מעדיפות להיות בסביבה הידרופובית
- מולקולות הידרופיליות מעדיפות להיות בסביבה מימית
- מבחינה אנרגטית, המולקולות מעדיפות להתארגן כך שהשיירים ההידרופוביים פונים פנימה והקבוצות הפולאריות (כמו קבוצות קרבוקסיליות) פונות כלפי חוץ
מיצלות (Micelles)
- מיצלה מורכבת ממולקולות אמפיפטיות (בעלות חלק הידרופובי וחלק הידרופילי)
- הליבה של המיצלה היא הידרופובית - שרשראות השומן פונות פנימה
- בהיקף המיצלה נמצאים הראשים הפולאריים (לדוגמה, קבוצות קרבוקסיליות)
- זו מבנה כדורי שמאורגן כך: בפנים הידרופובי, בחוץ הידרופילי
ריכוז מיצלרי קריטי (CMC)
\[\textbf{CMC} = \text{Critical Micelle Concentration}\]- זהו הריכוז שבו מתחילות להיווצר מיצלות
- לכל דטרגנט או מולקולה אמפיפטית יש CMC ייחודי
- חלק מהדטרגנטים דורשים ריכוז גבוה מאוד להיווצרות מיצלות, ואחרים בעלי CMC נמוך יותר
מספר התאגדות (Aggregation Number)
- מגדיר את מספר המולקולות בתוך מיצלה בודדת
- משפיע על גודל המיצלה - מיצלה המורכבת מ-200 מולקולות תהיה קטנה יותר ממיצלה המורכבת מ-5000 מולקולות
- לכל סוג של חומצת שומן או פוספוליפיד יש מספר התאגדות אופייני
- משמעותי למעבר בין ממברנות או קרומים תאיים
הבדל בין מיצלות לווסיקולות
מיצלות הן מבנים מלאים (ללא חלל פנימי), בעוד שווסיקולות:
- מוקפות בממברנה דו-שכבתית (ליפיד ביילר)
- מכילות חלל פנימי
- משמשות בתא להובלת תוכן ממקום למקום
- כוללות לוזוזומים, אנדוזומים וגופיפים תוך-תאיים אחרים
יחידות מידה מולקולריות
דלתון (Dalton)
- 1 דלתון = $\frac{1}{12}$ ממסת אטום פחמן-12
- המסה המולקולרית של מימן היא בקירוב 1 דלתון
- קילו-דלתון = 1000 דלתון
- חלבונים נמדדים לרוב בקילו-דלתונים בשל גודלם
מסות מולקולריות של חלבונים
- חלבונים שונים בעלי מסות שונות: 13,000 דלתון, 13,700 דלתון וכו’
- בממוצע, חומצה אמינית שוקלת כ-110 דלתון
- ניתן להעריך את משקל החלבון על ידי הכפלת מספר חומצות האמינו ב-110
- לדוגמה: חלבון בעל 200 חומצות אמיניות ישקול בקירוב 22,000 דלתון
חומצות אמיניות
מבנה ותכונות
- חלבונים הם שרשרת לינארית של חומצות אמיניות המחוברות בקשר פפטידי
- תכונות חומצות אמיניות מאפשרות להן להיות “הרשות המבצעת” בתא:
- יכולת לעבור פולימריזציה ליצירת מקרומולקולות
- יכולת לקבל מבנים שונים המאפשרים מגוון פעילויות
- תכונות חומצה-בסיס ייחודיות (חומצות חלשות)
- יכולת להגיב ל-pH מקומי ולתנאי הסביבה
מספר חומצות אמיניות
- 20 חומצות אמיניות סטנדרטיות בונות חלבונים
- בנוסף ישנה חומצה אמינית מיוחדת (סלנוציסטאין) שמקודדת על ידי מבנה שניוני של ה-mRNA
- מאות חומצות אמיניות אחרות קיימות בטבע אך לא משתתפות בבניית חלבונים
- דוגמה: גלוטתיון - פפטיד קצר המורכב משלוש חומצות אמיניות, משמש לשמירה על פוטנציאל חיזור-חמצון של $\ce{NADPH}$ ו-$\ce{NADP}$
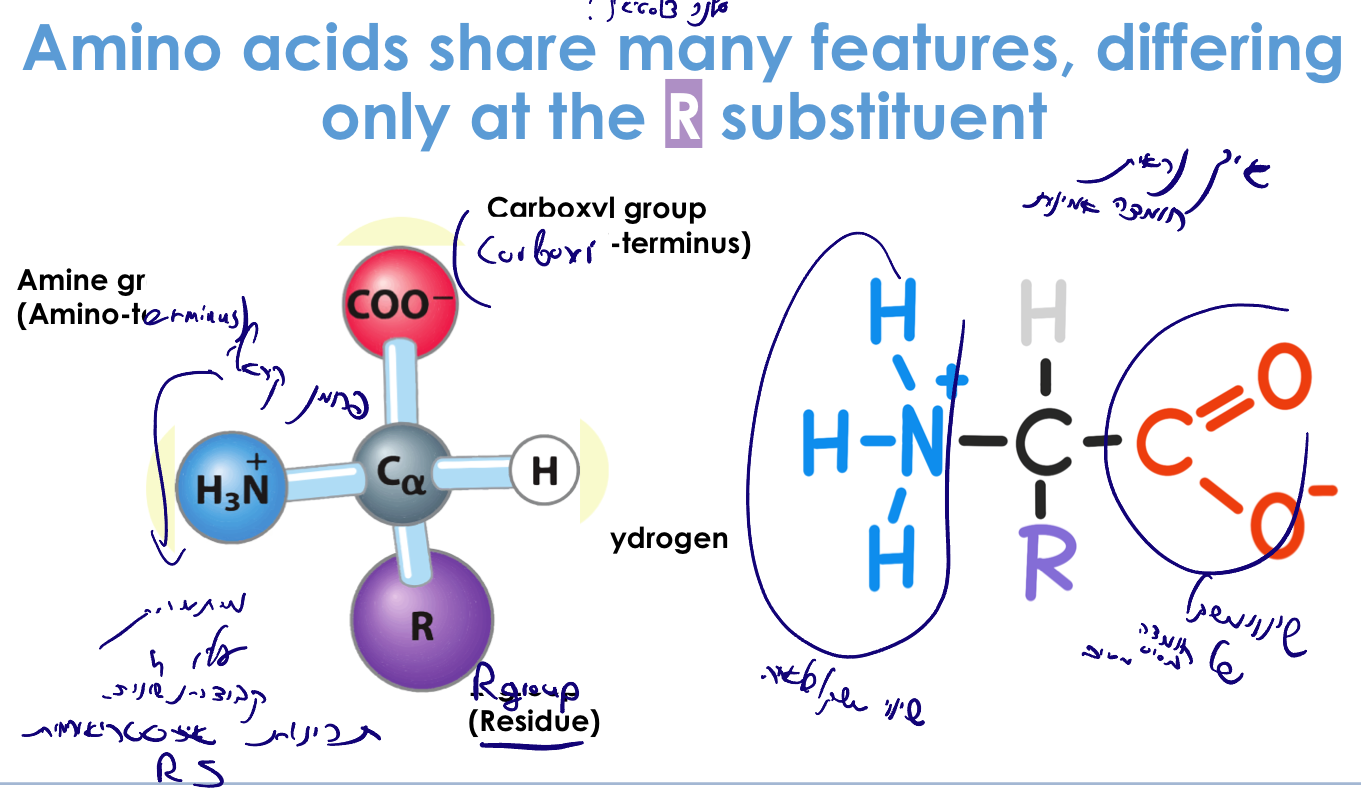
מבנה בסיסי של חומצה אמינית
- פחמן מרכזי (פחמן אלפא)
- פחמן קירלי (מחובר לארבע קבוצות שונות)
- בעל תכונות סטריאו-כימיות
- יוצר איזומרים אננטיומריים (D ו-L)
 דור פסקל
דור פסקל