קביעת הרכב ורצף חומצות אמינו בחלבון
1. קביעת הרכב חומצות אמינו
כדי לקבוע את הרכב חומצות האמינו בחלבון, מבצעים הידרוליזה מלאה של הקשרים הפפטידיים. התהליך כולל:
- חימום דגימת החלבון בתמיסת חומצה חזקה (למשל, 6M $\ce{HCl}$) למשך כ-24 שעות.
- התהליך מפרק את החלבון לחומצות האמינו המרכיבות אותו.
- את תערובת חומצות האמינו מפרידים באמצעות שיטות כרומטוגרפיות.
- מדידת הכמות של כל חומצה אמינית מאפשרת לקבוע את היחסים המולריים ביניהן בחלבון.
שלב זה מספק מידע על הרכב החלבון, אך לא על סדר (רצף) חומצות האמינו.
2. זיהוי חומצת האמינו בקצה האמיני (N-terminus)
תגובת סנגר (Sanger’s Reaction)
שיטה זו משתמשת בריאגנט סנגר (DNFB - 1-fluoro-2,4-dinitrobenzene) כדי לזהות את חומצת האמינו הראשונה בשרשרת.
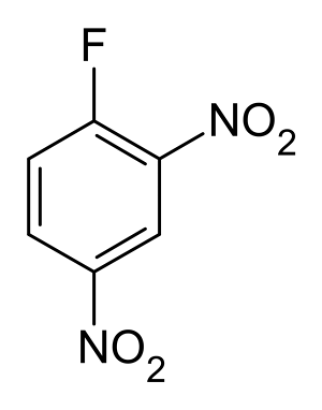
- הריאגנט מגיב עם קבוצת האמין הראשונית החופשית בקצה ה-$\ce{N}$ של הפפטיד.
- לאחר התגובה, מבצעים הידרוליזה מלאה של החלבון.
- חומצת האמינו שהייתה בקצה ה-$\ce{N}$ נשארת קשורה לריאגנט הצהוב, וניתן לזהותה בנפרד משאר חומצות האמינו.
- הערה: גם קבוצת האמין שבשייר של ליזין (
Lysine) יכולה להגיב עם הריאגנט, מה שעלול ליצור תוצאתfalse positive.
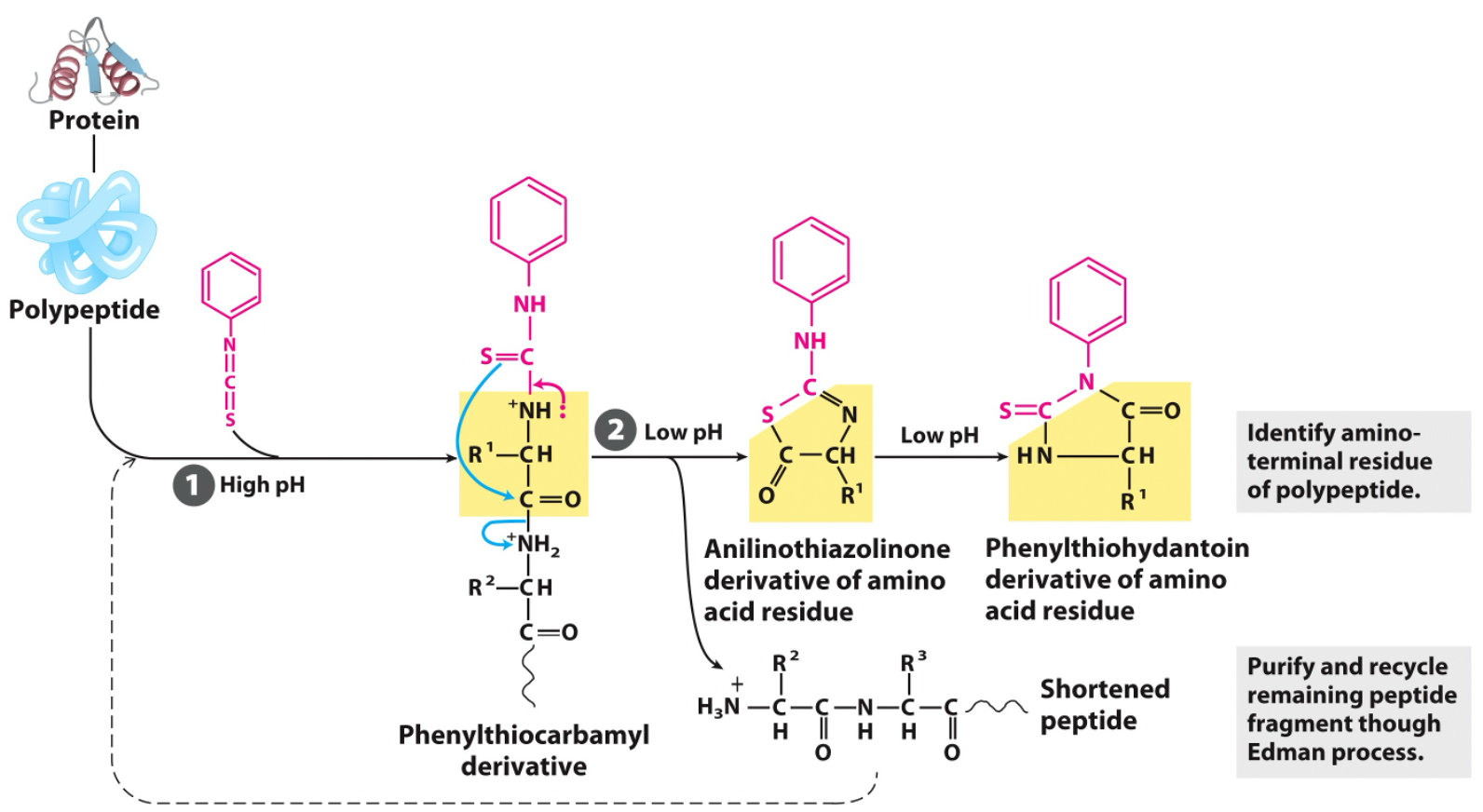
3. ריצוף חלבונים – דגרדציית אדמן (Edman Degradation)
דגרדציית אדמן מאפשרת קביעה סדרתית של רצף חומצות האמינו מהקצה ה-$\ce{N}$ של הפפטיד.
- התהליך הוא מחזורי: בכל מחזור, ריאגנט אדמן ($\text{phenylisothiocyanate}$) נקשר לחומצת האמינו בקצה ה-$\ce{N}$.
- לאחר מכן, בתנאי חומציות מבוקרים, חומצת האמינו המסומנת ניתקת מהשרשרת הפפטידית מבלי לפרק את שאר הקשרים.
- ניתן לזהות את חומצת האמינו ששוחררה.
- את הפפטיד המקוצר (בחומצה אמינית אחת) ניתן להכניס למחזור נוסף של התגובה.
- מגבלה: יעילות השיטה יורדת עם כל מחזור. בדרך כלל, ניתן לרצף באופן אמין כ-50-20 חומצות אמינו.
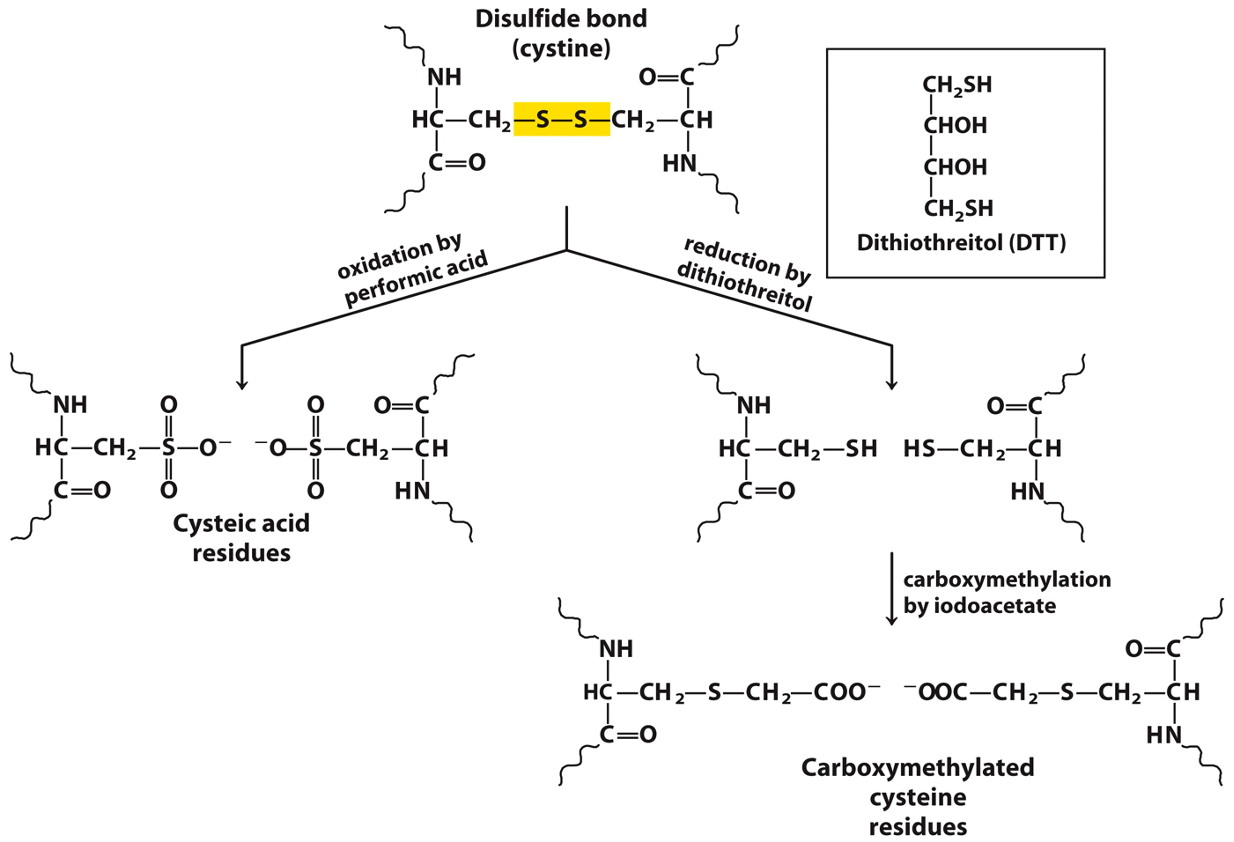
4. טיפול בקשרי דיסולפיד ($\ce{S-S}$)
קשרי דיסולפיד הם קשרים קוולנטיים בין שיירי ציסטאין ($\ce{Cys}$) המייצבים את המבנה השלישוני. כדי לרצף חלבון המכיל קשרים אלו, יש לפרק אותם תחילה.
- חיזור (Reduction): שימוש בחומרים מחזרים כמו $\beta\text{-mercaptoethanol}$ או DTT מפרק את קשר ה-$\ce{S-S}$ לשתי קבוצות תיול ($\ce{SH}$). כדי למנוע יצירה מחדש של הקשר, מבצעים חסימה (Alkylation) באמצעות ריאגנט כמו יודואצטט (iodoacetate), שנקשר קוולנטית לקבוצת ה-$\ce{SH}$.
- חמצון (Oxidation): שימוש בחומצה פרפורמית (Performic acid) מחמצן באופן בלתי הפיך את קשר ה-$\ce{S-S}$ לחומצה ציסטאית ($\ce{-SO3H}$), ובכך מונע את יצירתו מחדש.
סביבה תוך-תאית וחוץ-תאית
- סביבה תוך-תאית (ציטוזול): היא סביבה מחזרת. לכן, חלבונים ציטוזוליים מכילים בדרך כלל קבוצות $\ce{SH}$ חופשיות.
- סביבה חוץ-תאית: היא סביבה מחמצנת. לכן, חלבונים מופרשים (כמו נוגדנים) או חלבונים ממברנליים מכילים לרוב קשרי $\ce{S-S}$ המייצבים את מבנם.
5. פירוק אנזימטי באמצעות פרוטאזות
פרוטאזות הן אנזימים המפרקים קשרים פפטידיים בספציפיות גבוהה. שימוש בפרוטאזות שונות מאפשר לחתוך חלבון גדול למקטעים קטנים יותר, אותם ניתן לרצף בנפרד.
| אנזים/ריאגנט | אתר החיתוך (חומצות אמינו) | נקודת החיתוך |
|---|---|---|
| טריפסין (Trypsin) | ליזין (Lys), ארגינין (Arg) | אחרי השייר (Downstream) |
| כימוטריפסין (Chymotrypsin) | פנילאלנין (Phe), טירוזין (Tyr), טריפטופן (Trp) | אחרי השייר (Downstream) |
| פפסין (Pepsin) | פנילאלנין (Phe), טירוזין (Tyr), טריפטופן (Trp) | לפני השייר (Upstream) |
| V8 Protease | חומצה אספרטית (Asp), חומצה גלוטמית (Glu) | אחרי השייר (Downstream) |
| ציאנוגן ברומיד ($\ce{CNBr}$) | מתיונין (Met) | אחרי השייר (Downstream) |
- אמינופפטידאז (Aminopeptidase): מפרק חומצות אמינו בזו אחר זו מהקצה ה-$\ce{N}$.
- קרבוקסיפפטידאז (Carboxypeptidase): מפרק חומצות אמינו בזו אחר זו מהקצה ה-$\ce{C}$.
מבנים שניוניים (Secondary Structures)
מבנים שניוניים הם סידורים מרחביים מקומיים של השרשרת הפוליפפטידית, המיוצבים בעיקר על ידי קשרי מימן בין קבוצות הקרבוניל ($\ce{C=O}$) והאמיד ($\ce{N-H}$) של שלד החלבון.
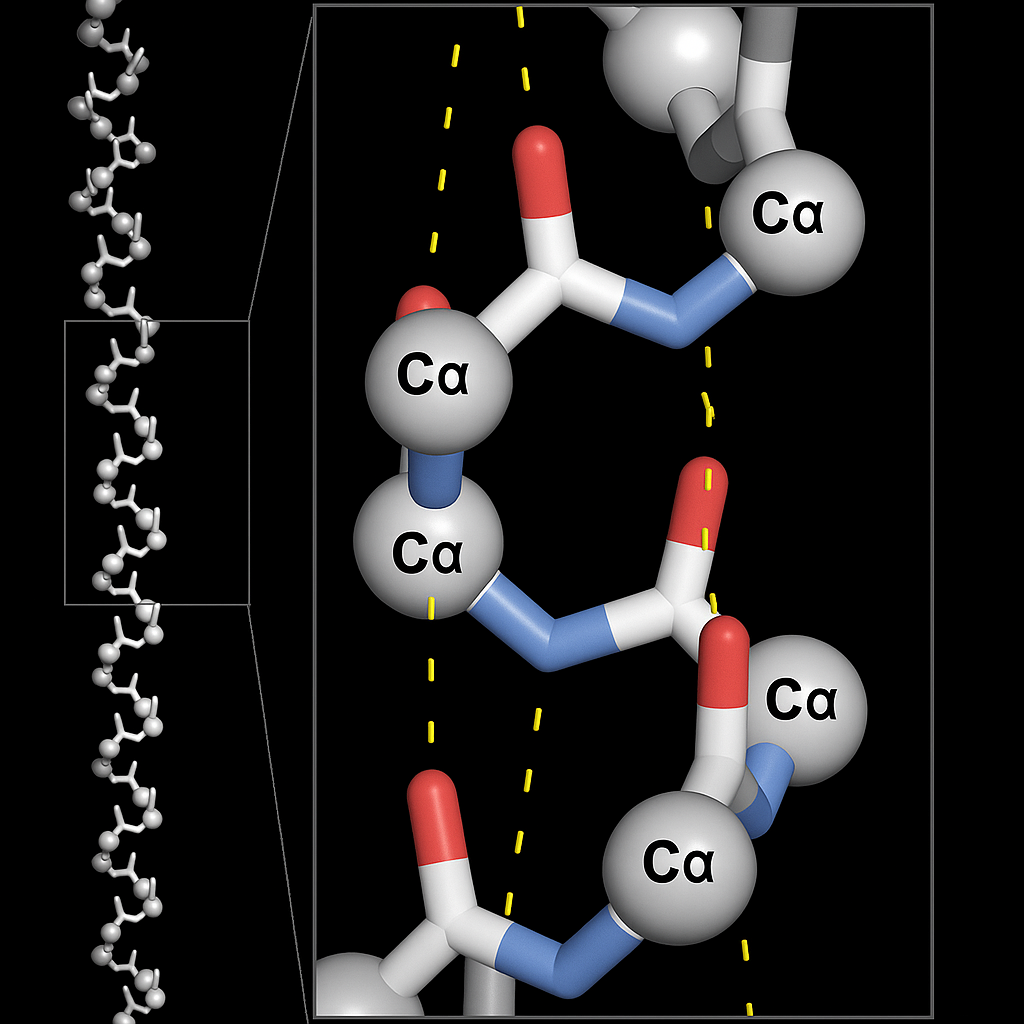
1. סליל אלפא (Alpha-Helix)
סליל אלפא הוא מבנה גלילי קשיח הנוצר כאשר שלד החלבון מסתלסל סביב ציר מרכזי.
- ייצוב: המבנה מיוצב על ידי קשרי מימן תוך-שרשרתיים. קבוצת הקרבוניל ($\ce{C=O}$) של חומצה אמינית
nיוצרת קשר מימן עם קבוצת האמיד ($\ce{N-H}$) של חומצה אמיניתn+4. - מבנה:
- בכל סיבוב מלא של הסליל יש כ-3.6 חומצות אמינו.
- שיירי הצד (R groups) פונים כלפי חוץ והרחק מציר הסליל, כדי למנוע הפרעה סטרית.
- זוויות ה-Phi ($\phi$) וה-Psi ($\psi$) של כל חומצות האמינו בסליל דומות (כ-
57°- ו-47°- בהתאמה).
- Helical Wheel Projection: הצגה דו-ממדית של הסליל במבט על. היא מאפשרת לראות את פיזור השיירים סביב הסליל. סלילים רבים הם אמפיפטיים: צד אחד שלהם הידרופובי (פונה לליבת החלבון) והצד השני הידרופילי (פונה לסביבה המימית).
- אפקט הדיפול (Dipole Effect): כל קשרי המימן בסליל מכוונים לאותו כיוון, מה שיוצר דיפול חשמלי לאורך הסליל. הקצה ה-$\ce{N}$ טעון חיובית חלקית ($\delta^+$) והקצה ה-$\ce{C}$ טעון שלילית חלקית ($\delta^-$). לעיתים קרובות, חומצות אמינו בעלות מטען הפוך יימצאו בקצוות הסליל כדי לנטרל את הדיפול ולייצב את המבנה.
- גורמים המערערים את יציבות הסליל:
- פרולין (Proline): המבנה הטבעתי הקשיח שלו אינו מאפשר את הזוויות הנדרשות ושובר את רציפות הסליל.
- גליצין (Glycine): גמישותו הרבה (שייר קטן) מאפשרת קונפורמציות רבות ומערערת את המבנה המסודר.
- דחייה אלקטרוסטטית: רצף של חומצות אמינו בעלות מטען זהה.
- הפרעה סטרית: רצף של חומצות אמינו עם שיירים גדולים ונפחיים.
2. משטח בטא (Beta-Sheet)
משטח בטא מורכב ממספר מקטעים של השרשרת הפוליפפטידית, הנקראים גדילי בטא (beta strands), המסודרים זה לצד זה.
- ייצוב: המבנה מיוצב על ידי קשרי מימן בין-גדיליים, בין קבוצות הקרבוניל והאמיד של גדילים סמוכים.
- מבנה:
- השרשרת הפוליפפטידית בגדיל בטא כמעט מתוחה לחלוטין.
- שיירי הצד (R groups) פונים באופן מתחלף מעל ומתחת למישור המשטח.
- סוגי משטחי בטא:
-
אנטי-מקבילי (Anti-parallel): הגדילים הסמוכים נעים בכיוונים מנוגדים (N→C מול C→N). קשרי המימן ישרים וקצרים, מה שהופך מבנה זה ליציב יותר.
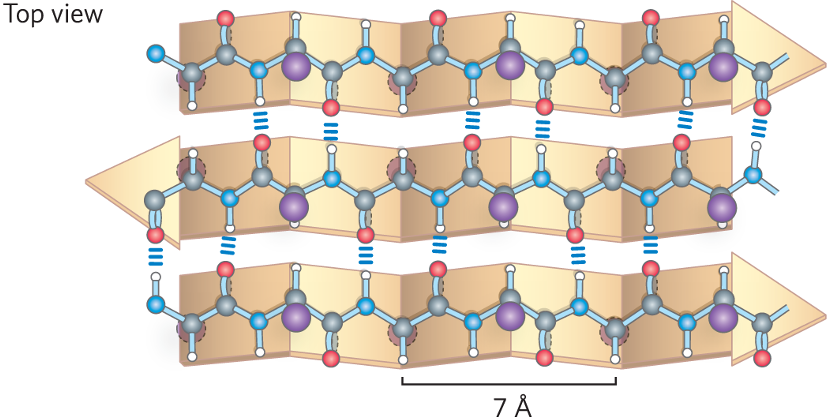
-
מקבילי (Parallel): הגדילים הסמוכים נעים באותו כיוון (N→C מול N→C). קשרי המימן אלכסוניים וארוכים יותר, ולכן מבנה זה מעט פחות יציב.
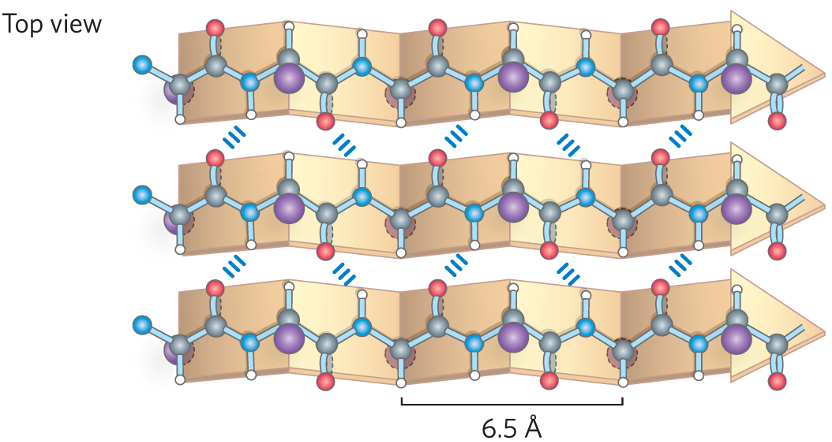
-