הגדרה
תהליך קביעה כמותית של חומר אחד על ידי הוספת חומר אחר בעל ריכוז ידוע בצורה מבוקרת והדרגתית ומעקב אחר התהליך הכימי שביניהם עד להשלמתו.
מרכיבי הניסוי
- נפח ידוע של תמיסת נעלם (אנליט)
- תמיסה בעלת ריכוז ידוע (מטטר)
- מוסיפים כמויות קטנות ומדודות של מטטר
- כל עוד יש מהנעלם - תתרחש תגובה
- סמן (אינדיקטור) מסמל את תום התגובה
- בעזרת נפח המטטר הדרוש מחשבים את ריכוז הנעלם המקורי
הגדרות נוספות
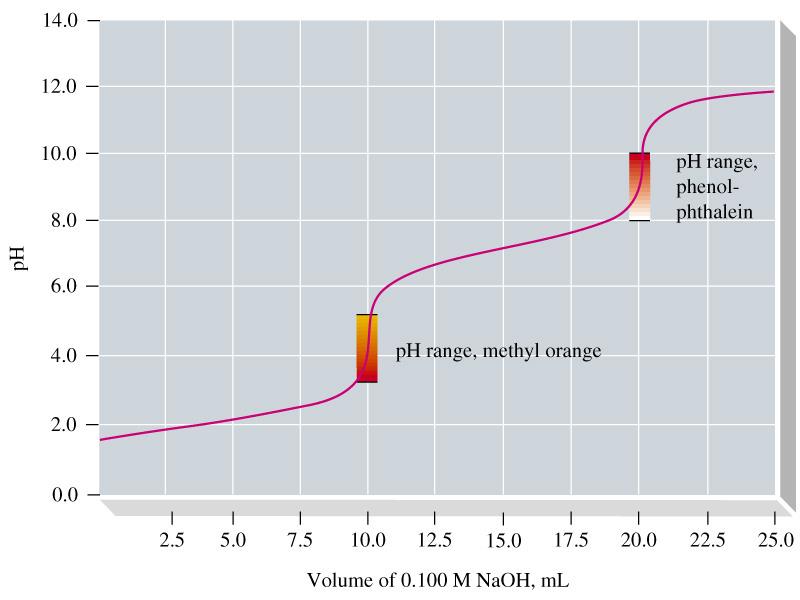
- נקודה אקולנטית - החומרים בכמויות שוות
- נקודת סיום - הנקודה שבה אנו רואים שינו המצביע על סיום הטיטרציה
- ככל שנקודת הסיום קרוב יותר לנקודה האויולנטית - התוצארה מדויקת יותר
מדידת רמת החומציות
ניתן למדוד רמת חומציות ב-2 דרכים:
1. אינדיקטור
- חומר המשנה את צבעו לפי רמת החומציות בתמיסה
- רוב האינדיקטורים הם בעצמם חומצות/בסיסים
- משנים את צבעם בעת קבלת/איבוד פרוטון
- המעבר בין הצורות מתרחש סמוך לKa של האינדיקטור
2. pH meter
- מכשיר חשמלי המשתמש בתכונות החשמליות של התמיסה
- מודד כמות יוני הידרוניום בצורה מדויקת
- החומציות משפיעה על התכונות החשמליות של התמיסה
- פוטנציאל החיזור של יוני הידרוניום מאפשר למדוד את ריכוזם בצורה מדויקת
- מכשיר טוב ומכויל דייק ברמת מאית הנקודה
בכל הטיטרציות
- נקודה אקויולנטית - הנקודה שבה שני החומרים נמצאים בכמויות שוות
- נקודת סיום - הנקודה שבה אנו רואים שינוי המצביע על סיום הטיטרציה
- ככל שנקודת הסיום קרובה יותר לנקודה האקויולנטית - התוצאה מדויקת יותר
זיהוי הנקודה האקויולנטית:
- בחירת אינדיקטור
- בחינת התנהגות טיטרציה-בסיס מסוגים שונים
סוגי טיטרציות

Images taken from here
1. טיטרציה חומצה-בסיס
מציאת ריכוז באמצעות סתירה עם חומצה או בסיס בריכוז ידוע. הצורה הכללית של תגובת סתירה:
\[ \text{AH}_{(aq)} + \text{BOH}_{(aq)} \rightarrow \text{A}^-_{(aq)} + \text{B}^+_{(aq)} + \text{H}_2\text{O}_{(l)} \]
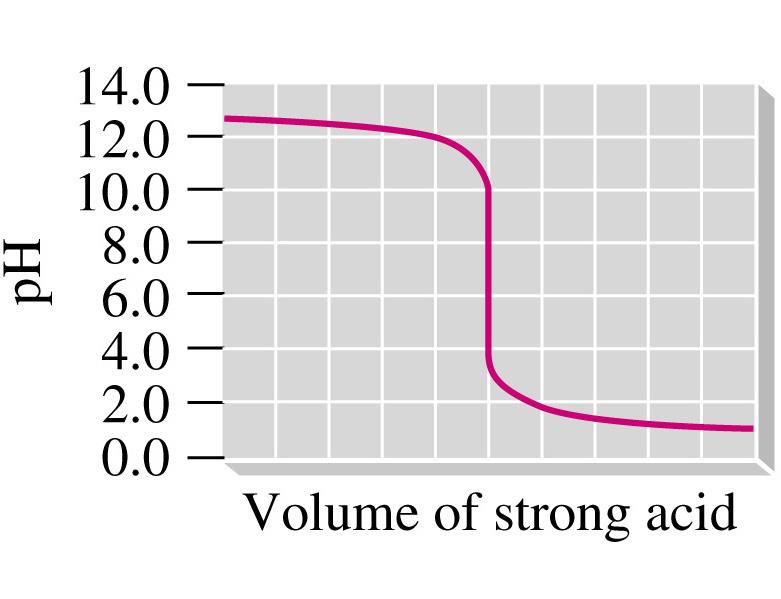
2. טיטרצית חומצה חזקה עם בסיס חזק
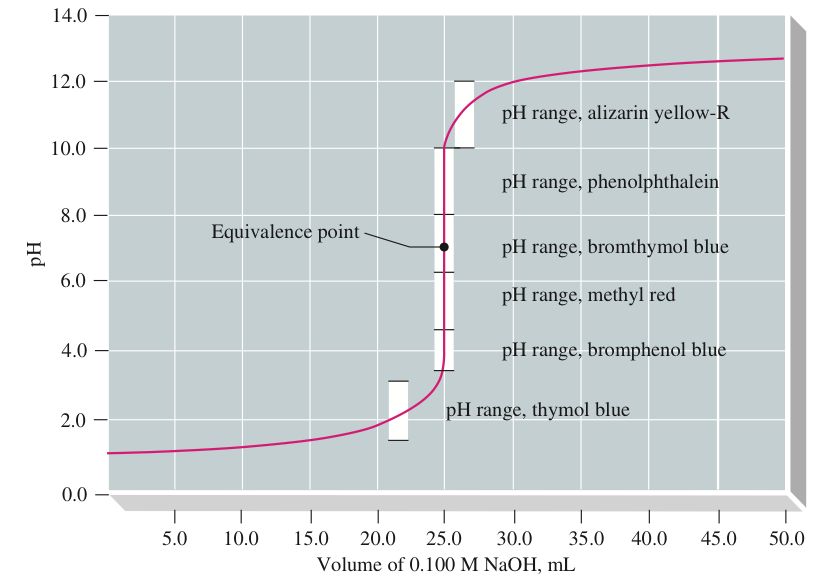
לדוגמה: טיטרציה של HCl עם NaOH
\[ \text{HCl}_{(aq)} + \text{NaOH}_{(aq)} \rightarrow \text{Cl}^-_{(aq)} + \text{Na}^+_{(aq)} + \text{H}_2\text{O}_{(l)} \]
- בנקודה האקויולנטית: תמיסה ניטרלית, pH=7
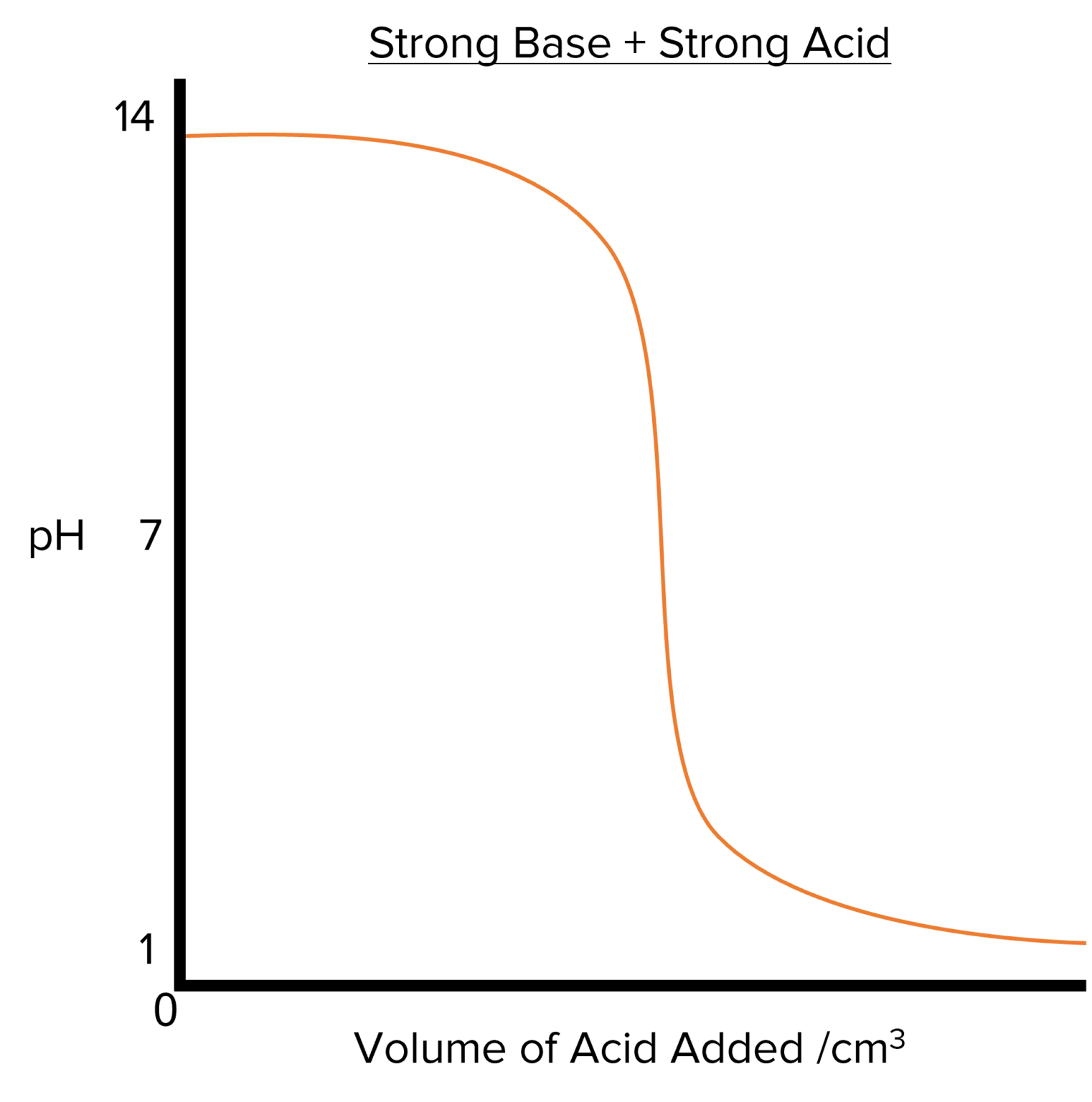
3. טיטרציית בסיס חזק עם חומצה חזקה
3. טיטרצית חומצה חלשה עם בסיס חזק
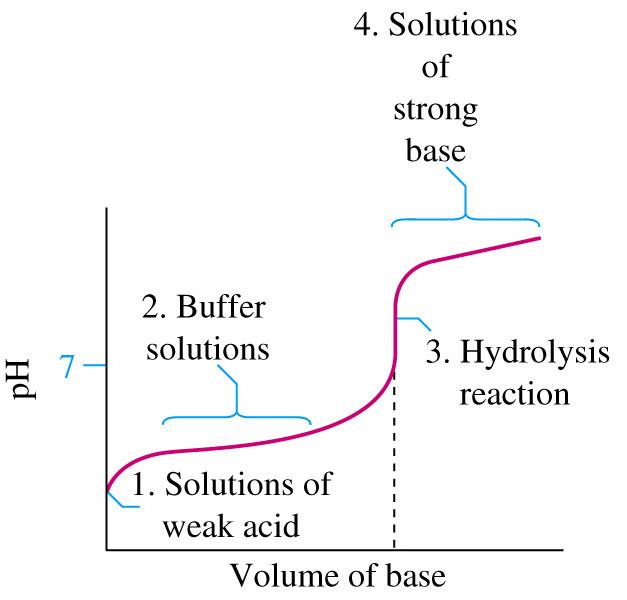
לדוגמה: טיטרציה של CH₃COOH עם NaOH
\[ \text{CH}_3\text{COOH}_{(aq)} + \text{NaOH}_{(aq)} \rightarrow \text{CH}_3\text{COO}^-_{(aq)} + \text{Na}^+_{(aq)} + \text{H}_2\text{O}_{(l)} \]
- בנקודה האקויולנטית: pH > 7, תמיסה בסיסית
- יון האצטט-בסיס המצומד לחומצה אצטית
- יגיב עם המים
4. טיטרצית בסיס חלש עם חומצה חזקה
לדוגמה: טיטרציה של NH₃ עם HCl
\[ \ce{NH_{3(aq)} + HCl_{(aq)} \rightarrow NH_4^+{(aq)} + Cl^-{(aq)}} \]
- בנקודה האקויולנטית: pH < 7, תמיסה חומצית
- יון האמוניום - חומצה המצומדת לאמוניה
- יגיב עם המים
חומצה רב פרוטית
לחומצה רב פרוטית יש מספר פרוטונים, ולכל אחד קבוע משלו
מספר הנקודות האקויולנטיות כמספר הפרוטונים. קפיצה ברמת החומציות בכל פעם שנסתור פרוטון אחד באופן מלא.
בתמונה תיתרציה של החומצה הפוליפרוטית החלשה H3PO4 עם הבסיס החזק NaOH
שאלה 5
חומצה קרבונית H₂CO₃ היא חומצה די פרוטית חלשה עם הקבועים הבאים:
Ka₂ = 4.7×10⁻¹¹
Ka₁ = 4.4×10⁻⁷
הנקודות האקויולנטיות הן ב-pH=4, pH=9
א) מה נפח של HCl 0.1M הדרוש לסתירה מלאה של 1 גרם NaHCO₃(s)?
ב) מה נפח של HCl 0.1M הדרוש לסתירה מלאה של 1 גרם Na₂CO₃(s)?
פתרון
נתוני התגובות וקבועי שיווי משקל
\[ \text{HCO}_3^- + \text{H}_3\text{O}^+ \stackrel{K_{a1} = 4.4 \times 10^{-7}}{\rightleftarrows} \text{H}_2\text{CO}_3 + \text{H}_2\text{O} \] \[ \text{CO}_3^{2-} + \text{H}_3\text{O}^+ \stackrel{K_{a2} = 4.7 \times 10^{-11}}{\rightleftarrows} \text{HCO}_3^- + \text{H}_2\text{O} \]
א. חישוב נפח HCl הדרוש ל-1 גרם NaHCO₃:
- Mw(NaHCO₃) = 84 gr/mol
- לכן 1 גרם = 0.012 מול
- בטיטרציה עם HCl מתרחשת למעשה התגובה הבאה:
\[ \text{NaHCO}_3(s) + \text{H}_2\text{O} \rightarrow \text{Na}^+ + \text{HCO}_3^- \] \[ \text{H}_2\text{CO}_3 + \text{H}_2\text{O} \stackrel{1/K_{a1} = 2.3 \times 10^6}{\rightleftarrows} \text{HCO}_3^- + \text{H}_3\text{O}^+ \]
- Moles: 0.012 0.1x
- n(HCO₃⁻) = n(H₃O⁺) → 0.012 = 0.1x → x = 0.12 liter = 120ml
ב. חישוב נפח HCl הדרוש ל-1 גרם Na₂CO₃:
- Mw(Na₂CO₃) = 106 g/mol
- לכן 1 גרם = 9.4×10⁻³ מול
- בטיטרציה עם HCl מתרחשות שתי התגובות הבאות:
\[ \text{Na}_2\text{CO}_3 \rightarrow 2\text{Na}^+(aq) + \text{CO}_3^{2-}(aq) \] \[ \text{HCO}_3^- + \text{H}_2\text{O} \stackrel{1/K_{a2}}{\rightleftarrows} \text{CO}_3^{2-} + \text{H}_3\text{O}^+ \] \[ \text{H}_2\text{CO}_3 + \text{H}_2\text{O} \stackrel{1/K_{a1}}{\rightleftarrows} \text{HCO}_3^- + \text{H}_3\text{O}^+ \]
- Moles: 9.4×10⁻³ 0.1x
- 2n(CO₃²⁻) = n(H₃O⁺)
- 2·9.4×10⁻³ = 0.1x → x = 0.188 liter = 188 ml
דור פסקל 




