מבוא וקשרים כימיים
הקורס בכימיה אורגנית הולך להיות מאתגר, כאשר החצי הראשון יתמקד ביצירת שפה משותפת של כימיה אורגנית - למידה של החוקים והדרך לדבר ולהבין כימיה אורגנית. בהדרגה נתחיל להיכנס לתגובות, אך המטרה העיקרית היא שמושגים כמו ציקלוהקסאן, ציקלופנטאן ודומיהם יהיו מובנים לכולם. החצי הראשון של הקורס ירגיש יותר כמו שינון וחוקים של שמות או איך לקרוא למולקולות, ואילו בחצי השני נכנס יותר לעומק של תגובות בכימיה אורגנית.
סוגי קשרים כימיים
ישנם מספר סוגי קשרים כימיים עיקריים:
- קשר קוולנטי - שיתוף של אלקטרונים בין אטומים, אשר מתחלק לשני סוגים:
- קשר קוולנטי טהור - האלקטרונים מתחלקים באופן שווה בין האטומים
- קשר קוולנטי פולרי - האלקטרונים נוטים יותר לאחד האטומים (לדוגמה, ב-$\ce{H-F}$ האלקטרונים נמשכים יותר ל-$\ce{F}$, ונוצר קיטוב עם $\ce{H^{δ+}}$ ו-$\ce{F^{δ-}}$)
- קשר יוני - אחד האטומים לוקח את האלקטרונים באופן מלא, ונוצרים יונים עם מטען חיובי ושלילי. האטום האלקטרונגטיבי יותר (עם נטייה גדולה יותר למשוך אלקטרונים) יקבל את האלקטרונים ויהפוך לאניון (מטען שלילי), והאטום שנותן את האלקטרונים יהפוך לקטיון (מטען חיובי).
אלקטרוני ערכיות ואוקטט
לא כל האלקטרונים באטום משתתפים ביצירת קשרים. האלקטרונים שמשתתפים בקשרים נקראים אלקטרוני ערכיות ונמצאים ברמת האנרגיה החיצונית של האטום. כל אטום שואף להגיע למבנה של אוקטט (שמונה אלקטרונים ברמת האנרגיה החיצונית), בדומה לגזים האצילים.
מספר הקשרים שכל אטום יכול ליצור תלוי במספר אלקטרוני הערכיות שלו:
- בורון ($\ce{B}$): 3 אלקטרוני ערכיות, יוצר 3 קשרים אך נשאר עם אוקטט חסר (6 אלקטרונים)
- פחמן ($\ce{C}$): 4 אלקטרוני ערכיות, יוצר 4 קשרים
- חנקן ($\ce{N}$): 5 אלקטרוני ערכיות, יוצר 3 קשרים ונשאר עם זוג אלקטרונים לא קושר
- חמצן ($\ce{O}$): 6 אלקטרוני ערכיות, יוצר 2 קשרים ונשאר עם שני זוגות אלקטרונים לא קושרים
- הלוגנים (כמו $\ce{F}$, $\ce{Cl}$): 7 אלקטרוני ערכיות, יוצרים קשר אחד ונשארים עם שלושה זוגות אלקטרונים לא קושרים
אטומים החל מהשורה השלישית בטבלה המחזורית (כמו גופרית $\ce{S}$) יכולים לעשות אוקטט מורחב משום שיש להם אורביטלי $d$ זמינים.
מבנה לואיס (Lewis Structures)
מבנה לואיס הוא ייצוג גרפי של האלקטרונים במולקולה, המראה כיצד האלקטרונים משותפים בין האטומים. ישנם מספר כללים ליצירת מבנה לואיס:
- קובעים מי יהיה האטום המרכזי במולקולה (בדרך כלל האטום הפחות אלקטרונגטיבי)
- מסדרים את האטומים האחרים סביב האטום המרכזי
- סופרים את סך כל אלקטרוני הערכיות במולקולה
- מחלקים את האלקטרונים כך שכל אטום יגיע לאוקטט (פרט למימן שזקוק רק לדופלט - שני אלקטרונים)
דוגמה: $\ce{CH3F}$
- האטום המרכזי הוא פחמן (פחות אלקטרונגטיבי מפלואור)
- המימנים והפלואור מסודרים מסביב לפחמן
- סופרים אלקטרוני ערכיות:
- פחמן: 4
- מימן: 3 × 1 = 3
- פלואור: 7
- סה”כ: 14 אלקטרונים
-
8 אלקטרונים משמשים ליצירת קשרים (4 קשרים × 2 אלקטרונים)
\[\begin{array}{ccc} & \text{H} & \\ & | & \\ \text{H} - & \text{C} & - \text{F} \\ & | & \\ & \text{H} & \\ \end{array}\] - 6 אלקטרונים נותרים משמשים להשלמת האוקטט של הפלואור
דוגמה נוספת: $\ce{SO4^{2-}}$
במקרה זה, הגופרית היא האטום המרכזי והחמצנים מסודרים סביבה. ניתן לצייר מספר מבני לואיס שונים למולקולה זו, כאשר המטען -2 מתחלק בין האטומים השונים.
מטען פורמלי (Formal Charge)
המטען הפורמלי הוא מטען תיאורטי על אטום במבנה לואיס, המחושב לפי הנוסחה:
$\text{Formal Charge} = \text{Valence Electrons} - \left( \text{Non-bonding Electrons} - \frac{1}{2} \times \text{Bonding Electrons} \right)$
כאשר סוכמים את כל המטענים הפורמליים במולקולה, התוצאה צריכה להיות שווה למטען הכולל של המולקולה. מבנה לואיס יציב יותר כאשר המטענים הפורמליים קטנים ומתרכזים על אטומים אלקטרונגטיביים.
רזוננס (Resonance)
רזוננס הוא תופעה שבה למולקולה יש מספר מבני לואיס אפשריים, שנקראים צורות רזוננטיביות. בפועל, המבנה האמיתי של המולקולה הוא היברידיזציה (ממוצע) של כל הצורות הרזוננטיביות.
חוקי רזוננס
- רזוננס מתרחש רק באלקטרונים במערכת ה-$\pi$ (קשרים כפולים, משולשים, אלקטרונים לא קושרים)
- קשרי $\sigma$ (סיגמה) אינם משתנים בצורות רזוננטיביות
- המטען הכולל של המולקולה אינו משתנה בין צורות רזוננטיביות
- אם מזיזים קשר כפול, חייבים לפתוח קשר כפול אחר (לא עוברים על מספר הקשרים המקסימלי שאטום יכול ליצור)
- רזוננס מייצב מטענים במולקולה על ידי פיזורם על מספר אטומים
דוגמאות לרזוננס
-
בנזן: מולקולה קלאסית לרזוננס עם שני מבנים רזוננטיביים עיקריים, כאשר המבנה האמיתי הוא ממוצע של שניהם. זה הוכח על ידי מדידת אורכי הקשרים, שנמצאו כממוצע בין קשר יחיד לכפול.
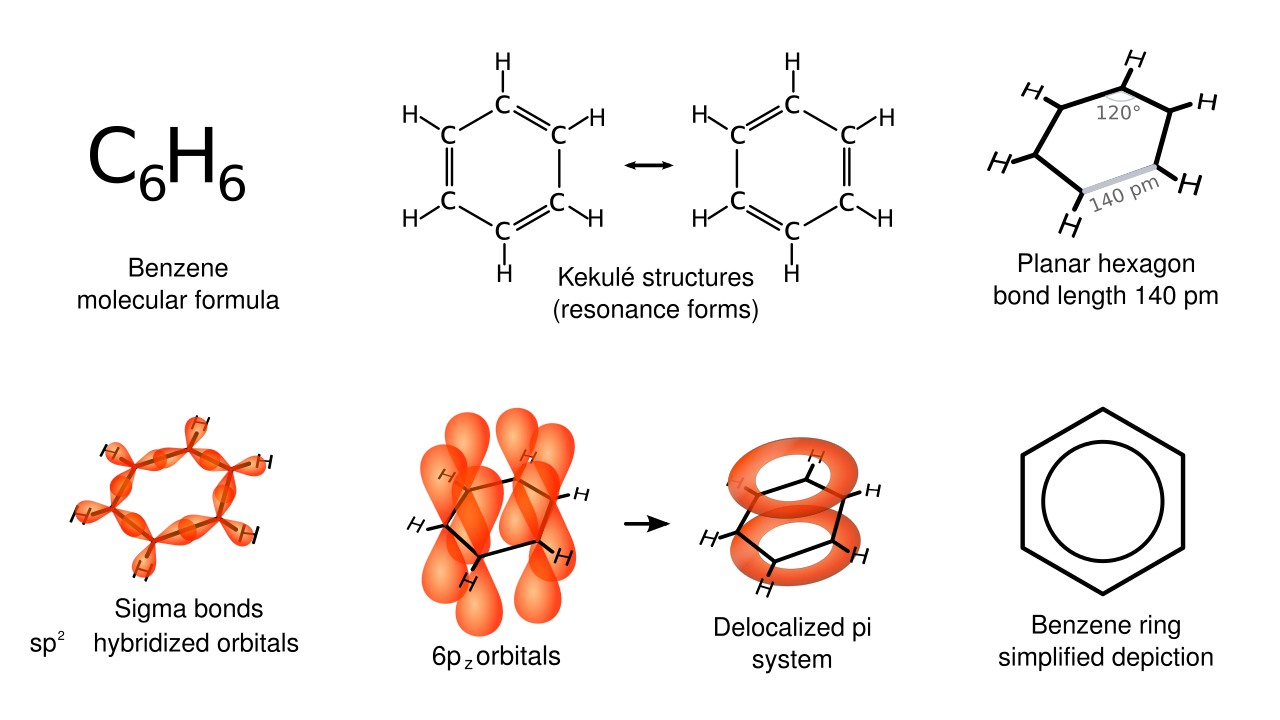
-
יון קרבוקסילט ($\ce{R-COO^-}$): המטען השלילי מתפזר בין שני אטומי החמצן, מה שמייצב את המולקולה.
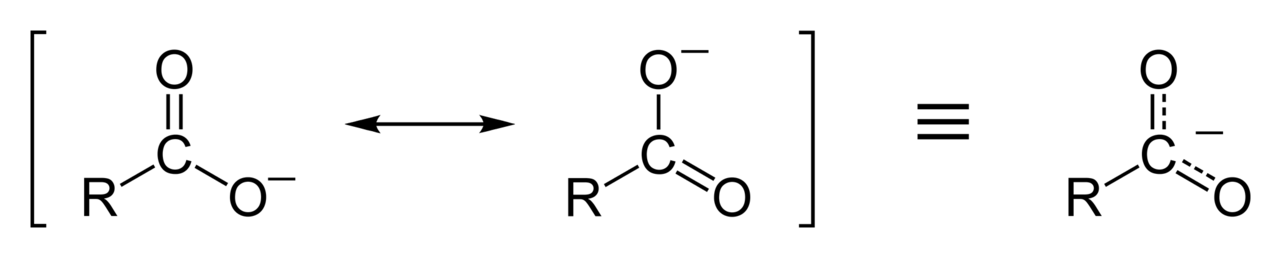
-
מערכת עם חנקן: כאשר יש זוג אלקטרונים לא קושר על חנקן ליד קשר כפול, הם יכולים לעבור למצב של קשר כפול והמטען החיובי יכול לזוז.
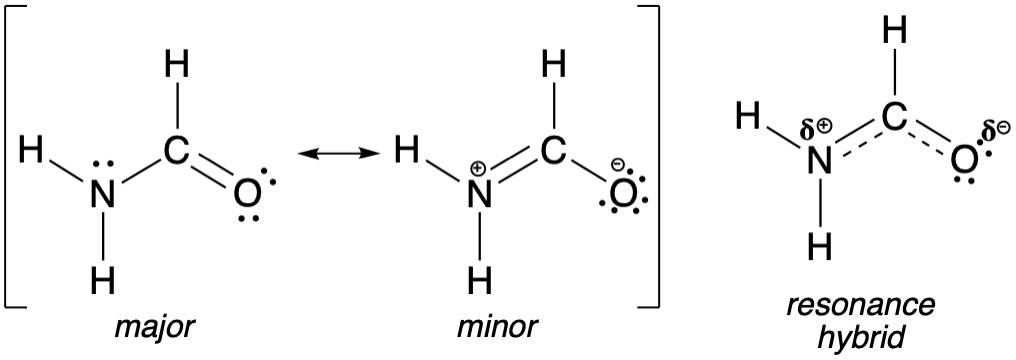
הברידיזציה ומבנה מרחבי
לואיס תיאר את המולקולות כמישוריות, אך במציאות המולקולות הן תלת-ממדיות. וספר (VSEPR) שכלל את התיאוריה והציע שהאלקטרונים (קושרים ולא קושרים) מסתדרים במרחב כך שירחקו זה מזה ככל האפשר. המרחביות של המולקולה נובעת מההיברידיזציה של האטומים.
סוגי הברידיזציה
- sp³: אטום עם 4 כיווני קשר (כולל זוגות אלקטרונים לא קושרים)
- צורה: טטרהדרלית (פחמן) או פירמידה משולשת (חנקן)
- זווית קשר: ~109.5° (פחמן), ~107° (חנקן - קטן יותר בגלל דחיית זוג האלקטרונים הלא קושר)
- הזוויות יותר קטנות בחנקן כי זוג האלקטרונים הלא קושר דוחף את ההתמרות האחרות
- sp²: אטום עם 3 כיווני קשר
- צורה: משולשית מישורית
- זווית קשר: 120°
- דוגמה: בורון ב-BH3
- sp: אטום עם 2 כיווני קשר
- צורה: קווית
- זווית קשר: 180°
סוגי קשרים והשפעתם המרחבית
- קשר $\sigma$ (סיגמא):
- נוצר מחפיפה של אורביטלי s
- מאפשר סיבוב חופשי סביב ציר הקשר
- כל קשר יחיד הוא קשר סיגמא
- קשר $\pi$ (פאי):
- נוצר מחפיפה צדדית של אורביטלי p
- צורתו כמו שני “בלונים” בניצב לציר הקשר
- אינו מאפשר סיבוב (מקובע במרחב)
- קשר כפול מורכב מקשר סיגמא אחד וקשר פאי אחד
דוגמאות
- פחמן ב-sp³: כמו ב-$\ce{CH4}$, צורה טטרהדרלית עם זווית קשר של 109.5°
- ארבעה כיווני קשר: שניים במישור, אחד יוצא מהמישור ואחד נכנס למישור
- זווית אידיאלית שבה כל ההתמרות רחוקות זו מזו
- חנקן ב-sp³: כמו ב-$\ce{NH3}$, צורה של פירמידה משולשת עם זווית קשר של ~107°
- שלושה קשרים לאטומי מימן וזוג אלקטרונים לא קושר
- הזווית קטנה יותר מ-109.5° בגלל הדחיפה החזקה של זוג האלקטרונים הלא קושר
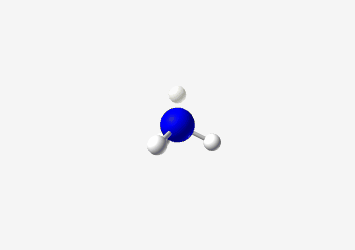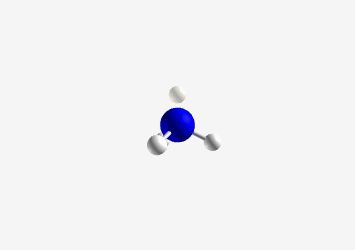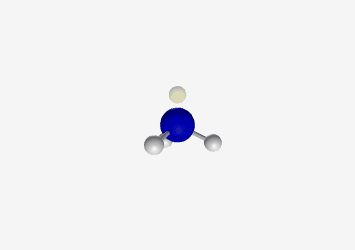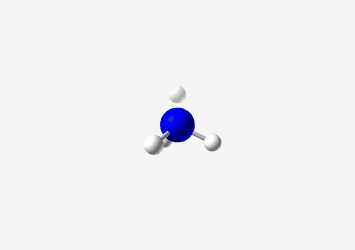
- בורון ב-sp²: כמו ב-$\ce{BH3}$, צורה משולשית מישורית עם זווית קשר של 120°
- שלושה כיווני קשר במישור אחד
- חמצן במים: $\ce{H2O}$, ההברידיזציה היא sp³ אך עם שני זוגות אלקטרונים לא קושרים
- הצורה היא זוויתית (או “מכופפת”)
- זווית הקשר קטנה משמעותית מ-109.5° בגלל שני זוגות האלקטרונים הלא קושרים
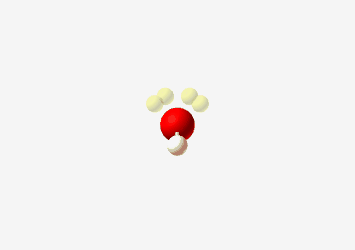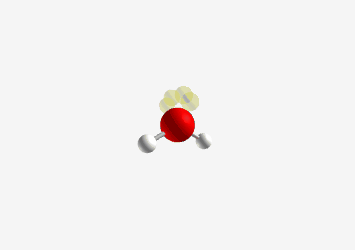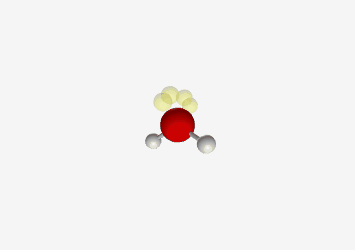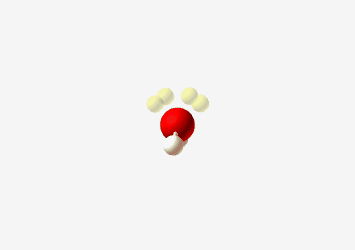
זיהוי הברידיזציה
הכלל:
\[\text{Number of Sigma Bonds} + \text{Number of Lone Pairs} - 1 = sp^x\]
ניתן לזהות את ההיברידיזציה של אטום לפי מספר כיווני הקשר שלו:
- 4 כיווני קשר = sp³
- 3 כיווני קשר = sp²
- 2 כיווני קשר = sp
חשוב לזכור: זוג אלקטרונים לא קושר נחשב ככיוון קשר!
כשיש רזוננס, רושמים את ההיברידיזציה הנמוכה. למשל במקרה של חנקן עם קשר כפול, נרשום sp² ולא sp³.
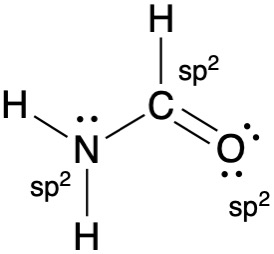
הברידיזציה מורחבת
אטומים החל משורה שלישית בטבלה המחזורית (כמו זרחן וגופרית) יכולים להשתמש באורביטלי d ולהגיע ל:
- אורביטל היברידי sp³d (5 כיווני קשר)
- אורביטל היברידי sp³d² (6 כיווני קשר)
שיטות כתיבה בכימיה אורגנית
בכימיה אורגנית משתמשים בשיטות כתיבה מקוצרות, בעיקר בגלל המורכבות של המולקולות האורגניות:
- כל נקודה מייצגת פחמן
- כל קו מייצג קשר (זוג אלקטרונים)
- מימנים לא מסומנים בדרך כלל, אלא אם כן הם חשובים במיוחד
לדוגמה, פנצילין - במקום לצייר את כל האטומים והקשרים, מציירים מבנה מקוצר שמקל על ההבנה והעבודה עם המולקולה.
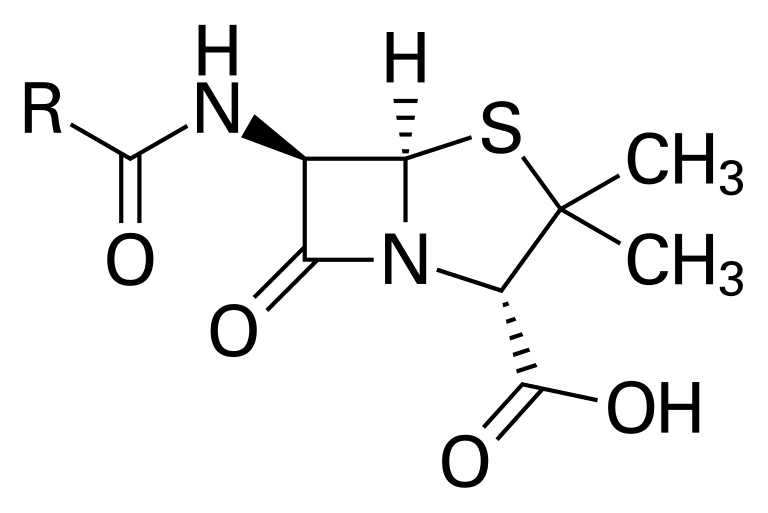
סיכום
הרצאה זו כיסתה את היסודות החשובים של הכימיה האורגנית: קשרים כימיים, מבני לואיס, רזוננס, הברידיזציה ומבנה מרחבי. אלו הם הכלים הבסיסיים שישמשו להבנת המולקולות האורגניות ותגובותיהן בהמשך הקורס. החומר מניח את היסודות לחצי השני של הקורס, שבו יעסקו בתגובות בכימיה אורגנית.
דור פסקל