לזכור:
מעבר בין פישר לבין תל מימדי:
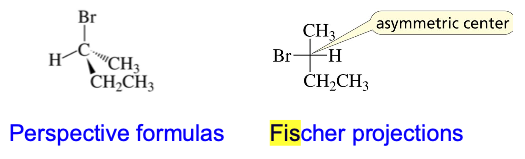
הקווים האופקיים מייצגים קשרים שמתרחקים מהצופה (▽ △), והקווים האנכיים מייצגים קשרים שמתקרבים לצופה (◀ ►).

סטריאוכמיה
מבוא
השיעור הנוכחי ממשיך את הדיון בכימיה אורגנית, ומתמקד בסיום נושא היטלי פישר (Fischer Projections) ומעבר לנושאים חדשים.
תזכורת:
Stereoisomers:
Molecules that have the same molecular formula and same connectivity (i.e., the atoms are bonded in the same order) but differ in their spatial arrangement.
הטלת פישר (Fischer Projections)
היטל פישר הוא שיטה למעבר מתיאור תלת-ממדי של מולקולה לתיאור דו-ממדי. המעבר לתצוגה דו-ממדית מקל על קביעת הקונפיגורציה והתכונות הפיזיקליות, במיוחד במולקולות מורכבות כמו אמינים וסוכרים.
שלבים למעבר מתצוגה תלת-ממדית לדו-ממדית

-
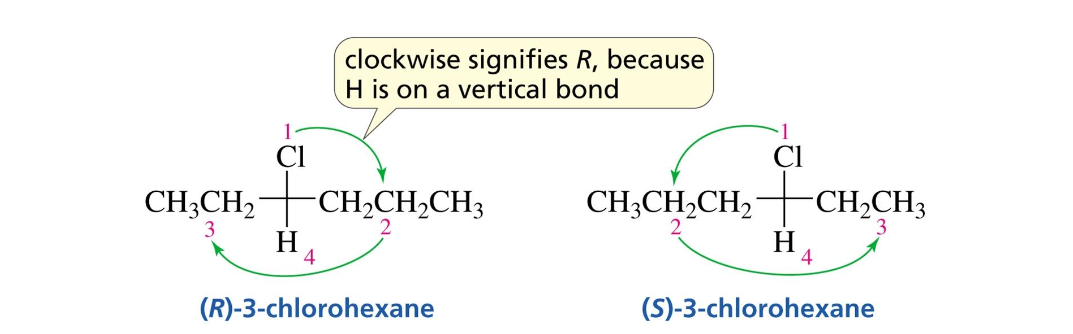
זיהוי פחמן כיראלי: פחמן כיראלי הוא פחמן שיש לו ארבעה מתמירים שונים. זהו השלב הראשון והבסיסי. רק פחמן כיראלי יכול להיות $\text{R}$ או $\text{S}$.
-
קביעת עדיפויות המתמירים: לאחר זיהוי הפחמן הכיראלי, יש למספר את ארבעת המתמירים ולתת להם עדיפויות מהמתמיר בעל העדיפות הגבוהה ביותר (1) ועד לזה בעל העדיפות הנמוכה ביותר (4). הקביעה נעשית על פי המספר האטומי של האטומים המחוברים לפחמן הכיראלי.
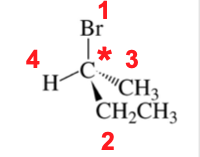
דוגמה:
במולקולה עם ברום, אתיל, מתיל ומימן:
- ברום בעל המספר האטומי הגבוה ביותר (35), לכן מקבל עדיפות 1.
- מימן בעל המספר האטומי הנמוך ביותר (1), לכן מקבל עדיפות 4.
- בין אתיל ($\ce{CH2CH3}$) ומתיל ($\ce{CH3}$), שניהם מכילים פחמן, יש לעבור לאטום הבא בשרשרת:
- במתיל ($\ce{CH3}$) מחוברים שלושה מימנים.
- באתיל ($\ce{CH2CH3}$) מחוברים שני מימנים ופחמן נוסף.
- מכיוון שפחמן בעל מספר אטומי גבוה יותר ממימן, האתיל מקבל עדיפות 2 והמתיל מקבל עדיפות 3.
לרוב, האתגר הוא בקביעת העדיפויות של הקבוצות האמצעיות (2 ו-3).
-
קביעת קונפיגורציה $\text{R}$ או $\text{S}$: הצעד הבא הוא לבדוק אם המתמיר בעדיפות 4 (העדיפות הנמוכה - בדרך כלל מימן) נמצא במישור הלוח (מסומן בקו מלא ▶) או אם הוא נכנס אל תוך מישור הלוח (מסומן בקו מקווקו).
אם המתמיר בעדיפות 4 לא נכנס לתוך הלוח, יש לבצע “החלפה” דמיונית של הקונפיגורציה כך שהמתמיר בעדיפות 4 ייכנס לתוך הלוח. כאשר מבצעים שינוי כזה, יש להחליף גם את הקביעה הסופית של $\text{R}$ ל-$\text{S}$ או להפך.
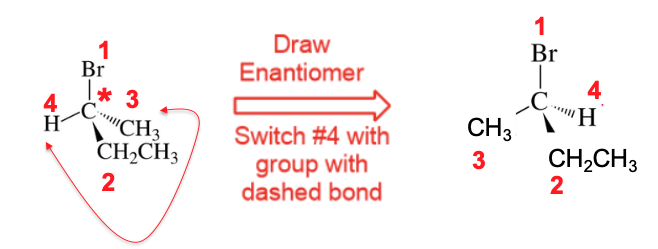
לאחר מכן, בודקים אם המסלול מ-1 ל-2 ל-3 הוא עם כיוון השעון או נגד כיוון השעון:
עם כיוון השעון נגד כיוון השעון $\text{R}$ $\text{S}$
- ↻ עם כיוון השעון: הקונפיגורציה היא R.
-
↺ נגד כיוון השעון: הקונפיגורציה היא S.
אם בוצעה החלפה, הקונפיגורציה הסופית הפוכה.
דוגמה:
במקרה שנדון, המימן (4) לא נכנס פנימה, ולכן היה צורך לבצע החלפה. לאחר ההחלפה הדמיונית, מתמירים 1, 2, ו-3 הלכו בכיוון השעון (R), אך מכיוון שבוצעה החלפה, הקונפיגורציה הסופית היא S.
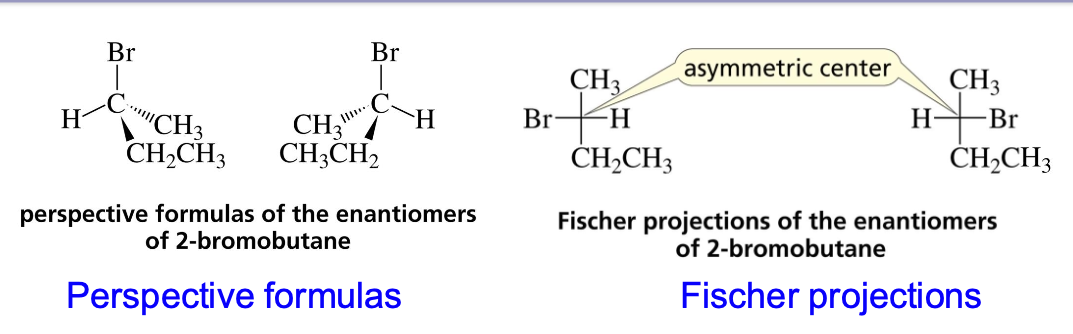
בהצגת פישר, הקווים האנכיים מייצגים קשרים שנכנסים אל תוך הדף, והקווים האופקיים מייצגים קשרים שיוצאים החוצה מהדף.
מתוך המצגת:
- Horizontal lines represent the bonds that project out of the plane of the paper toward the viewer.
- Vertical lines represent the bonds that extend back from the plane of the paper away from the viewer.
- The carbon chain is usually drawn vertically, with C-1 at the top.
הסיבה שיש להפוך את הקונפיגורציה לאחר החלפה היא שהמבנה התלת-ממדי של המולקולה שונה באופן מלאכותי.
לסיכום הקביעה:
- אם 1->2->3 מסתובב בכיוון השעון ו-4 נמצא מאחור (נכנס לתוך הלוח): $\text{R}$
- אם 1->2->3 מסתובב נגד כיוון השעון ו-4 נמצא מאחור (נכנס לתוך הלוח): S
- אם היה צורך לשנות את המבנה כדי להעביר את 4 לאחור, יש להחליף את התוצאה מ-R ל-$\text{S}$ או להפך.
ההבדל בין $\text{R}$ ו-$\text{S}$ יכול להיות משמעותי מאוד בתכונות המולקולה. כפי שנראה בדוגמת התלידומיד, לאחת הקונפיגורציות יכולה להיות פעילות ביולוגית שונה לחלוטין. רוב התכונות הפיזיקליות לא משתנות, אך תכונות ספציפיות כן.
אננטיומרים ודיאסטריאומרים
אננטיומרים (Enantiomers)
אננטיומרים הם מולקולות שהן תמונת מראה אחת של השנייה ואינן חופפות, בדומה ליד ימין ויד שמאל. כאשר לשתי מולקולות יש קונפיגורציות הפוכות (למשל, R ו-S), הן אננטיומרים.
תכונות אופטיות - שבירת אור
דרך נוספת לאפיין מולקולות כיראליות היא על פי האופן שבו הן מסובבות אור מקוטב. תכונה זו מסומנת ב-+ (dextrorotatory) או - (levorotatory).
חשוב להבחין בין:
- $\text{R}$ ו-$\text{S}$: מתארים את הקונפיגורציה המרחבית המוחלטת של המתמירים סביב המרכז הכיראלי.
+ו--: מתארים תכונה פיזיקלית נמדדת של סיבוב אור.
אין קשר ישיר בין R/S לבין +/-. מולקולה יכולה להיות R+ או R-, וכן S+ או S-.
הסימונים D/L הם דרך נוספת להגדיר קונפיגורציה, בדומה ל-R/S, ומשמשים בעיקר בביוכימיה (חומצות אמינו וסוכרים).
מולקולות עם מספר מרכזים כיראליים
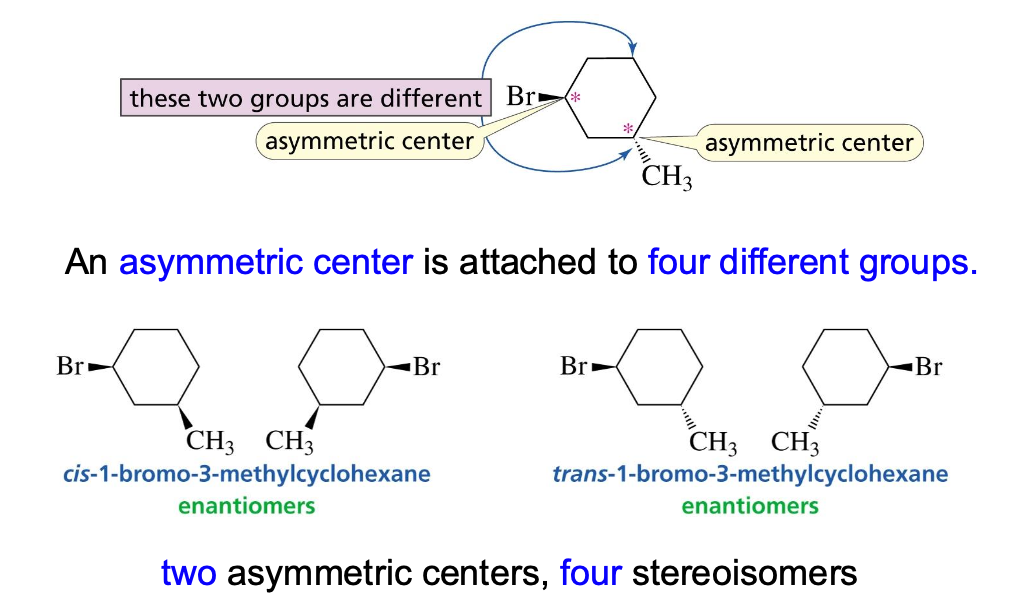
כאשר במולקולה יש יותר מפחמן כיראלי אחד (n), מספר הסטריאואיזומרים האפשרי הוא $2^n$. במקרה של שני פחמנים כיראליים, יש 4 איזומרים אפשריים.
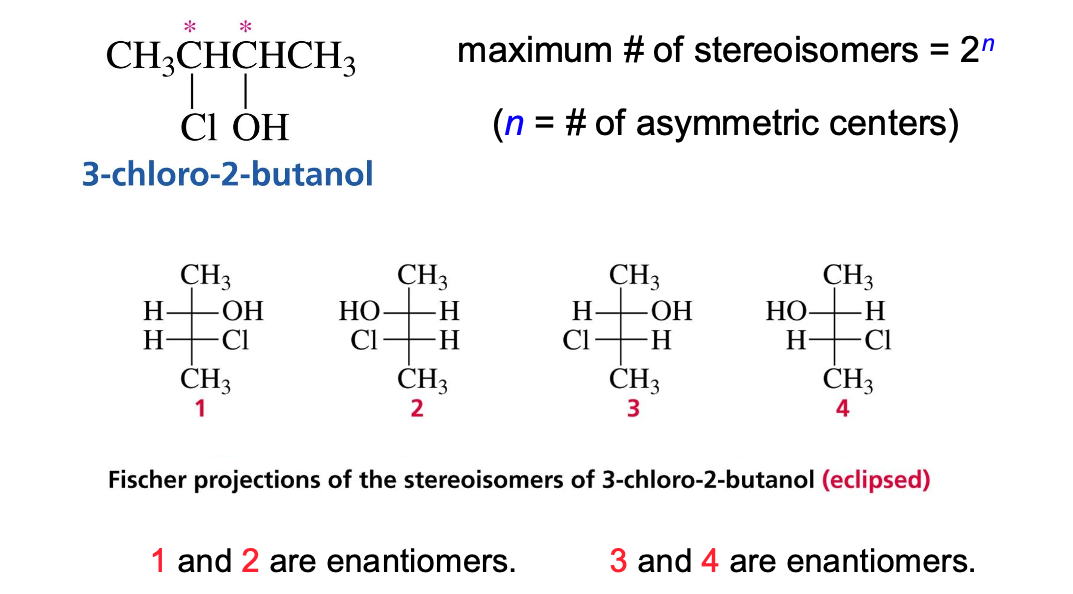
היחסים בין האיזומרים השונים:
- אננטיומרים: זוגות של תמונות מראה (למשל, 1 ו-2, 3 ו-4).
- דיאסטריאומרים: סטריאואיזומרים שאינם תמונות מראה (למשל, 1 ו-3, 1 ו-4).
Diastereomers: stereoisomers that are not enantiomers.
אריטרו ותריאו (Erythro & Threo)
אלו מושגים המשמשים לתיאור סטריאואיזומרים עם שני מרכזים כיראליים, בעיקר בהקשר של סוכרים:
- אריטרו: שתי קבוצות דומות נמצאות באותו צד בהיטל פישר.
- תריאו: הקבוצות הדומות נמצאות בצדדים מנוגדים.
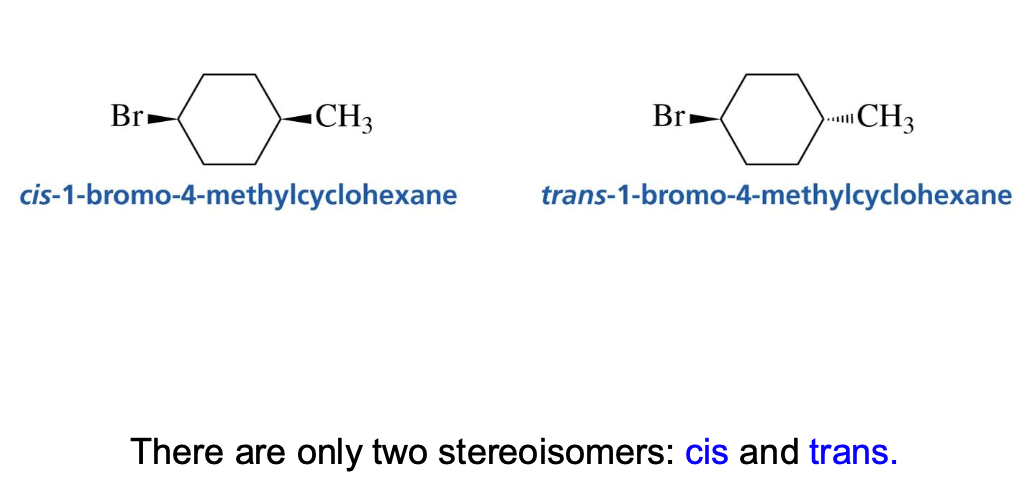
מולקולות ציקליות - Cis ו-Trans
במולקולות ציקליות, יש לזהות את המרכזים הכיראליים ולקבוע את הקונפיגורציה שלהם. למתמירים על טבעת יש שתי עמדות אפשריות: אקסיאלית ואקוואטוריאלית.
- ציס (cis): שני מתמירים נמצאים באותו צד של מישור הטבעת.
- טרנס (trans): המתמירים נמצאים בצדדים מנוגדים של מישור הטבעת.
זיהוי פחמן כיראלי במולקולות ציקליות
כדי לזהות פחמן כיראלי בטבעת, יש לבדוק את ארבעת המתמירים המחוברים אליו. שניים מה”מתמירים” הם מסלולי הטבעת עצמה, בכיוון השעון ונגד כיוון השעון. אם שני המסלולים הללו אינם זהים, הפחמן הוא כיראלי.
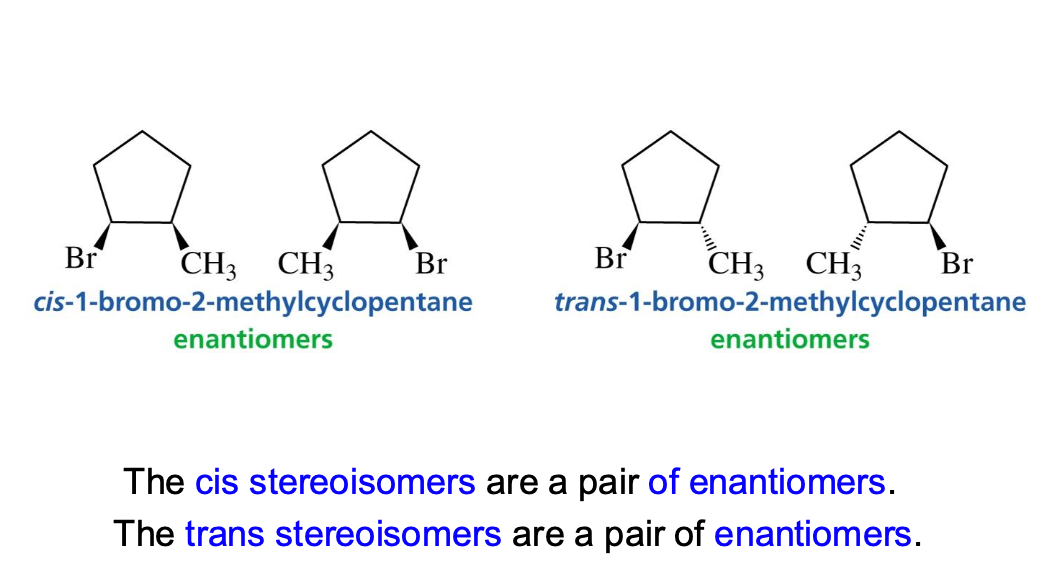
תזכורת: קו מקווקו מציין קשר שנכנס לתוך הדף.
דוגמה חשובה:
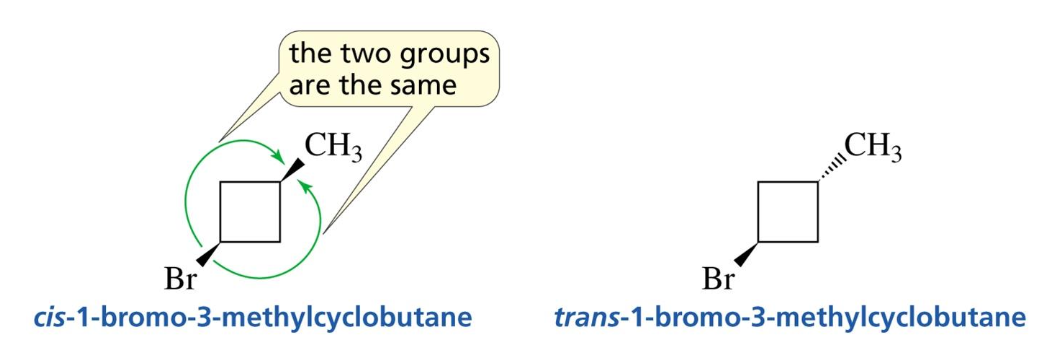
במולקולה ציקלית, יש להסתכל על כל השרשרת המחוברת בכל כיוון. אם כשנעים ימינה ושמאלה במבנה הציקלי פוגשים רצף אטומים זהה, הפחמן אינו כיראלי. אם הרצפים שונים, הפחמן כיראלי.
לדוגמה, בפחמן מסוים במולקולה:
- אם משני צדדיו בטבעת יש קבוצות $\ce{CH2}$, הוא אינו כיראלי.
- אם מצד אחד יש $\ce{CH2}$ ומצד שני $\ce{CHCl}$, הוא כיראלי (בהנחה ששני המתמירים האחרים שונים גם הם).
מקרים מיוחדים
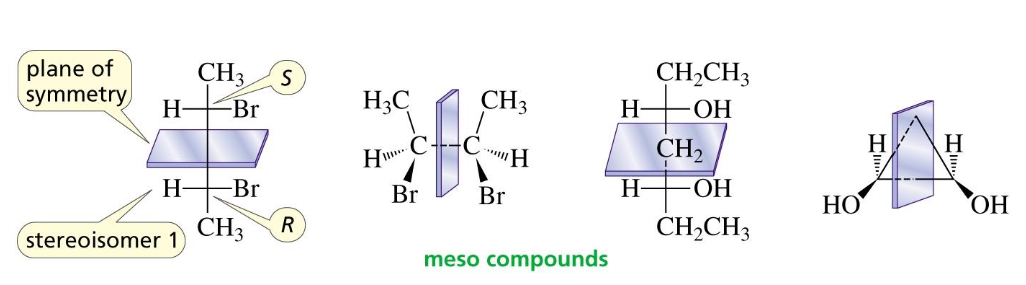
תרכובות מזו (Meso Compounds)
Meso compounds are optically inactive even though they have asymmetric centers.
תרכובות מזו הן מולקולות א-כיראליות המכילות מרכזים כיראליים. הסיבה לכך היא קיומו של מישור סימטריה פנימי במולקולה, הגורם לכך שהיא חופפת לתמונת המראה שלה.
חנקן עם שלושה מתמירים (Amine Inversion)
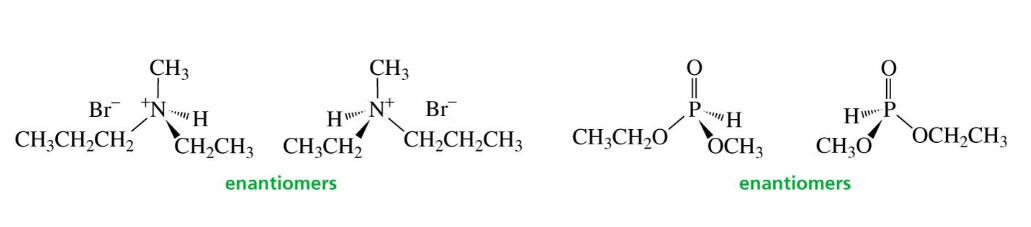
אטום חנקן עם שלושה מתמירים שונים וזוג אלקטרונים לא קושר הוא כיראלי. עם זאת, בטמפרטורת החדר, הוא עובר היפוך מהיר (inversion) בין שתי הקונפיגורציות. מכיוון שהמעבר בין הקונפיגורציות הוא חופשי, בדרך כלל לא ניתן לבודד אננטיומרים יציבים ולא מתייחסים לחנקנים כאלה במונחי R/S. במקרים חריגים שבהם ההיפוך מוגבל (מחסום אנרגטי גבוה), ניתן לבודד אננטיומרים.
חשיבות הקונפיגורציה R/S במולקולות ביולוגיות
לקונפיגורציה המרחבית יש חשיבות מכרעת במערכות ביולוגיות. רצפטורים ואנזימים בגוף הם כיראליים ויודעים להבדיל בין אננטיומרים (R ו-S), מה שמוביל לפעילות ביולוגית שונה. דוגמה קלאסית היא תרופת התלידומיד, שבה אננטיומר אחד היה יעיל כתרופה, בעוד השני גרם למומים מולדים קשים.
תרגילים לדוגמה
תרגיל 1: זיהוי פחמנים כיראליים במולקולה מורכבת
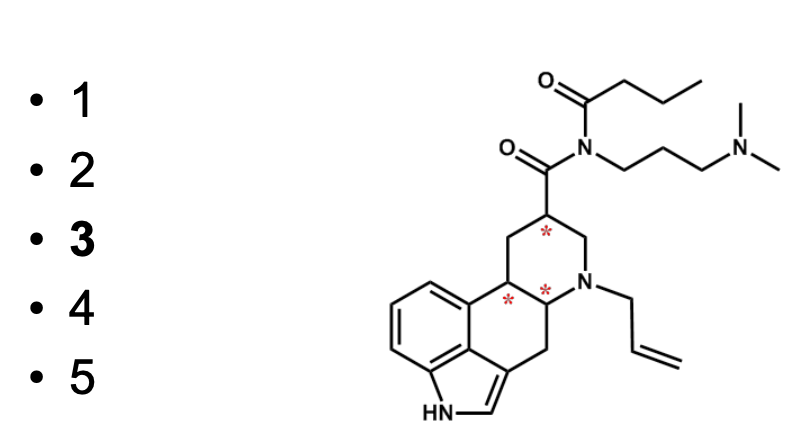
במולקולה זו יש שלושה פחמנים כיראליים.
- פחמנים עם קשר כפול אינם יכולים להיות כיראליים (יש להם רק שלושה מתמירים).
- עבור כל פחמן אחר, יש לבדוק אם ארבעת המתמירים שמחוברים אליו שונים זה מזה.
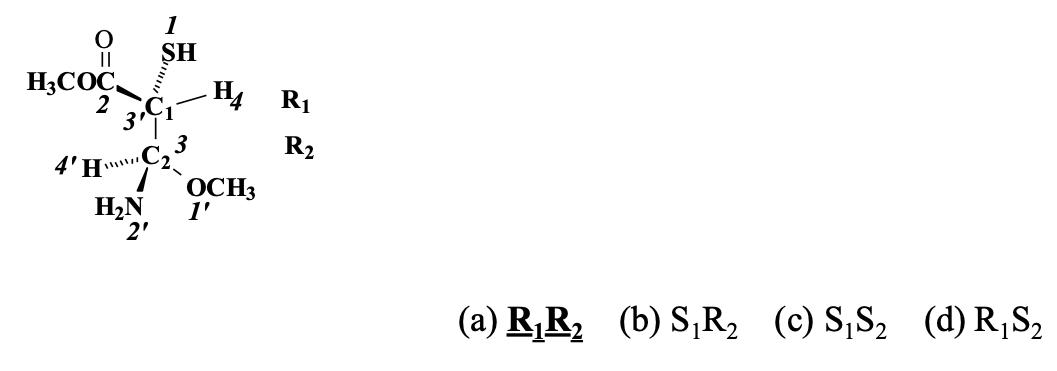
תרגיל 2: קביעת קונפיגורציה R/S
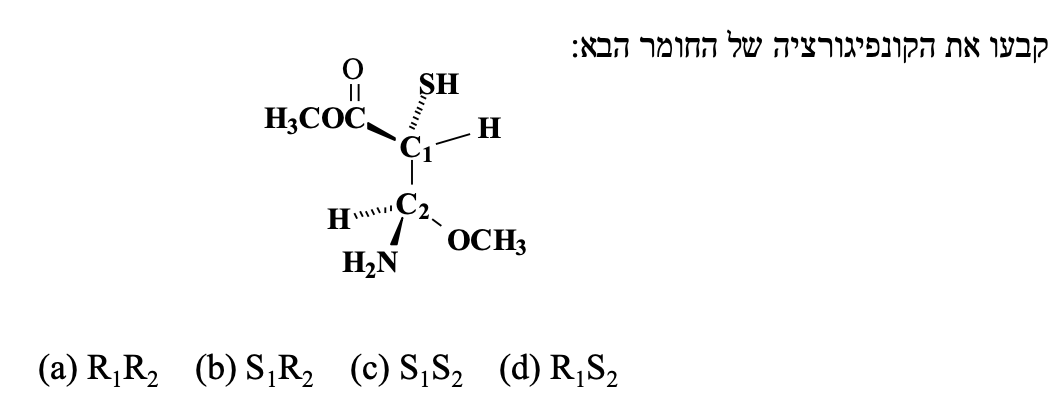
יש לקבוע את הקונפיגורציה של שני הפחמנים הכיראליים, C1 ו-C2.
עבור C1:
- עדיפויות: $\text{S}$ (גופרית) - 1, CO - 2, C - 3, H - 4.
- מיקום קבוצה 4: H (4) נמצא במישור הלוח (יוצא החוצה). נדרשת החלפה.
- כיוון: 1->2->3 הוא נגד כיוון השעון (S).
- תוצאה סופית: מכיוון שנדרשה החלפה, הקונפיגורציה היא R.
עבור C2:
- עדיפויות: O - 1, N - 2, קבוצה אחרת - 3, H - 4.
- מיקום קבוצה 4: H (4) נמצא מאחור (נכנס לתוך הלוח). לא נדרשת החלפה.
- כיוון: 1->2->3 הוא עם כיוון השעון (R).
- תוצאה סופית: הקונפיגורציה היא R.
הקונפיגורציה המלאה של המולקולה היא $\text{R}_1\text{R}_2$.
סיכום
הבנת מושגי הסטריאוכימיה, כולל היטלי פישר, קונפיגורציות R/S, אננטיומרים ודיאסטריאומרים, מהווה בסיס חיוני להבנת מנגנוני התגובה בכימיה אורגנית.
מעבר לחלק הבא: תגובות תמורה נוקלאופילית
תגובות התמרה נוקלאופילית
מבוא - תגובות התמרה נוקלאופילית
בחלק זה, המטרה העיקרית היא לדעת לסווג את סוג הריאקציה: $\mathrm{S_N1}$ או $\mathrm{S_N2}$ (ובהמשך גם E1 ו-E2).
חלק זה של הקורס עוסק בריאקציות בכימיה אורגנית, תוך התמקדות בשתי הריאקציות הבסיסיות ביותר:
- תגובות התמרה (Substitution) - החלפה של קבוצה פונקציונלית אחת באחרת.
- תגובות אלימינציה (Elimination) - סילוק של קבוצה מהמולקולה ליצירת קשר כפול.
הדיון יתחיל בתגובות התמרה נוקלאופילית.
תגובות התמרה נוקלאופילית (Nucleophilic Substitution)
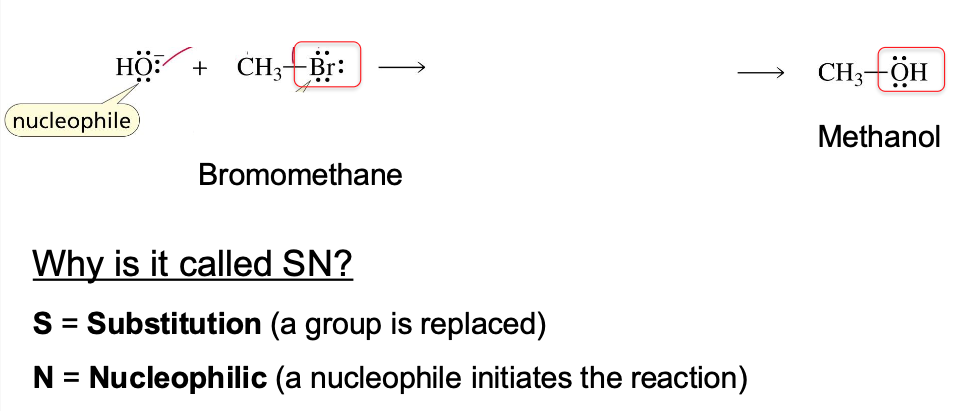
תגובות תמורה נוקלאופילית מתרחשות כאשר נוקלאופיל (מולקולה או יון עשיר באלקטרונים, עם זוג אלקטרונים לא קושר) תוקף אלקטרופיל (בדרך כלל אטום פחמן שקשור לקבוצה עוזבת). קיימים שני מנגנונים עיקריים של תגובות התמרה נוקלאופילית:
- $\mathrm{S_N1}$ - Substitution Nucleophilic Unimolecular
- $\mathrm{S_N2}$ - Substitution Nucleophilic Bimolecular
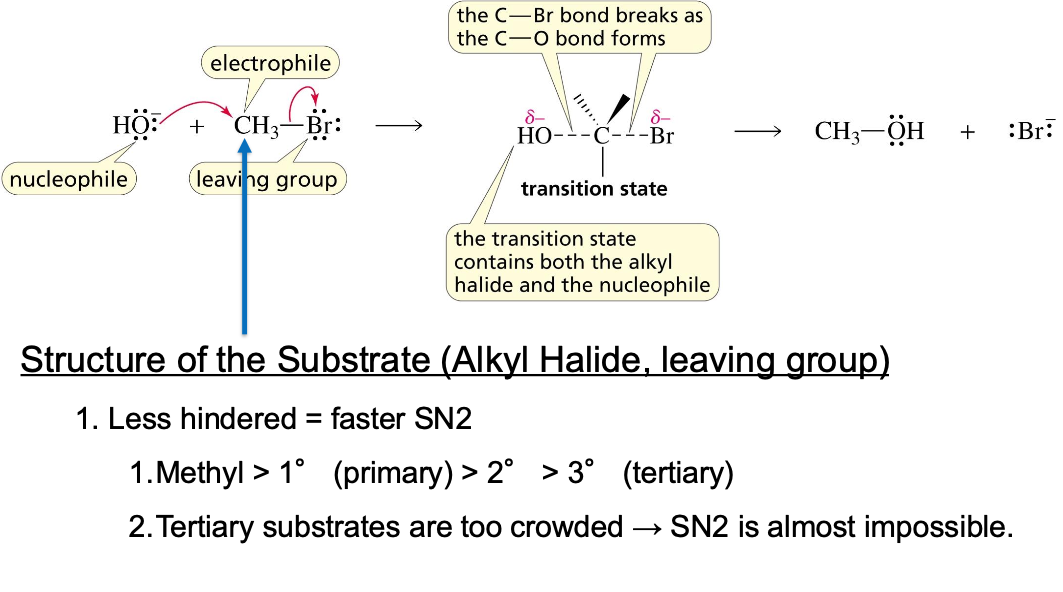
לדוגמה, בתגובה הבאה מתרחשת החלפה (substitution) של ברום ב-OH, והפיכת ברומומתאן למתנול:
\[\ce{CH3-Br + OH- -> CH3-OH + Br-}\]תגובת $\mathrm{S_N2}$
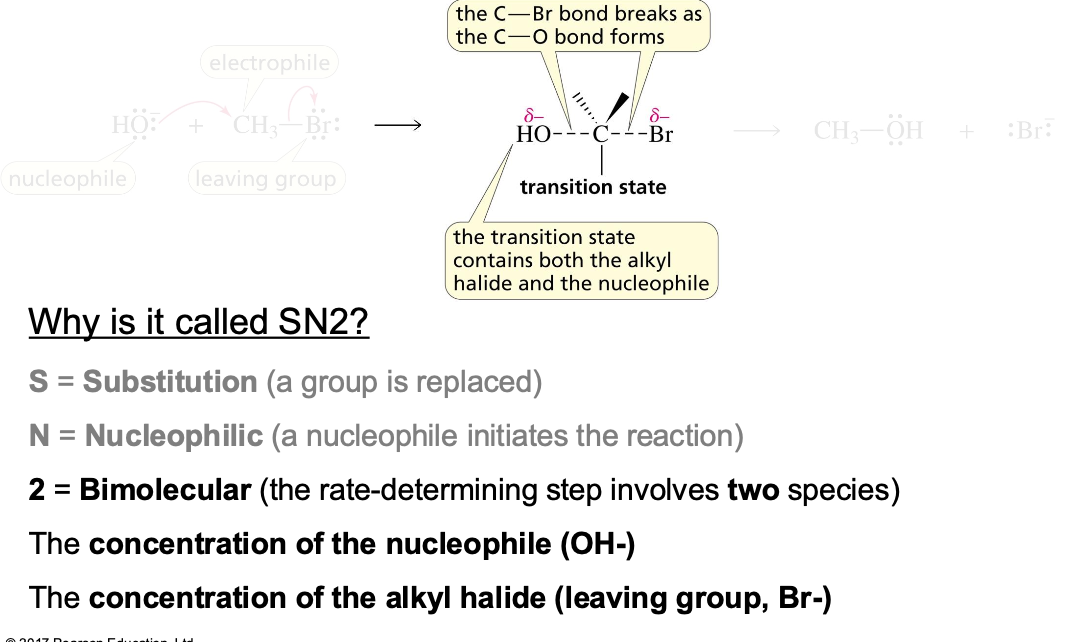
מנגנון
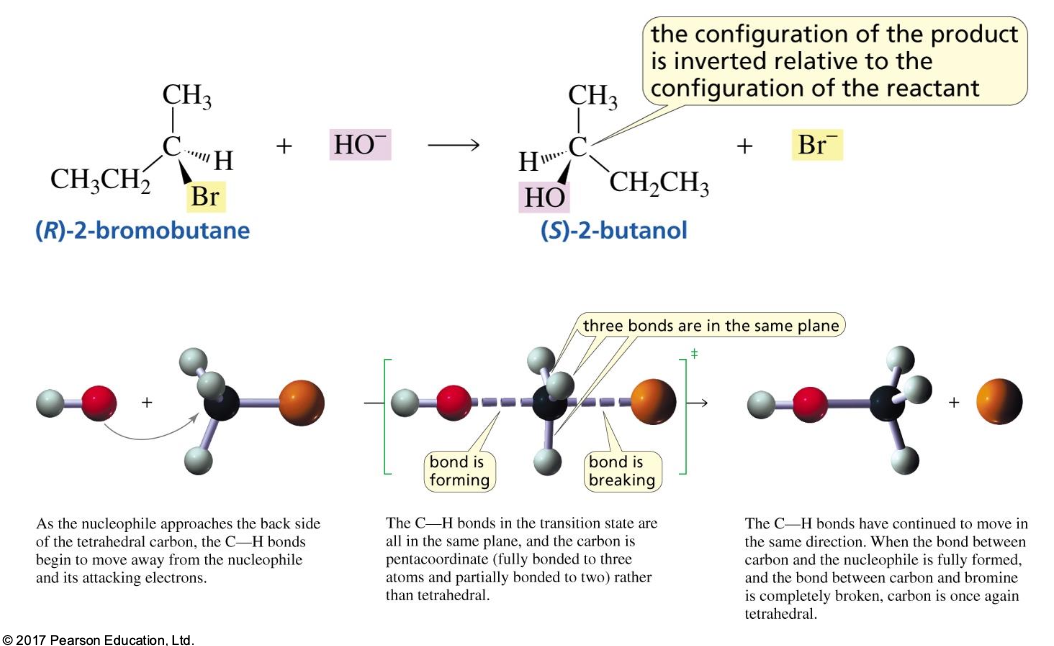
במנגנון $\mathrm{S_N2}$, התגובה מתרחשת בשלב אחד מתואם: הנוקלאופיל תוקף את הפחמן האלקטרופילי מהצד הנגדי לקבוצה העוזבת, ובאותו הזמן הקבוצה העוזבת מתנתקת.
במצב המעבר של התגובה, נוצר קשר חלקי עם הנוקלאופיל הנכנס וקשר חלקי עם הקבוצה העוזבת. זהו מצב אנרגטי גבוה ולא יציב.
המנגנון נקרא בימולקולרי (Bimolecular) מכיוון שקצב התגובה תלוי בריכוז של שני המגיבים: הנוקלאופיל והסובסטרט (האלקטרופיל).
נקודה חשובה: ההתקפה של הנוקלאופיל מתרחשת תמיד “מאחור” (backside attack), מהצד ההפוך לקבוצה העוזבת. זאת מכיוון שהקבוצה העוזבת, שהיא לרוב גדולה ובעלת מטען חלקי שלילי, יוצרת דחייה אלקטרוסטטית והפרעה סטרית המונעות התקפה מאותו הכיוון.
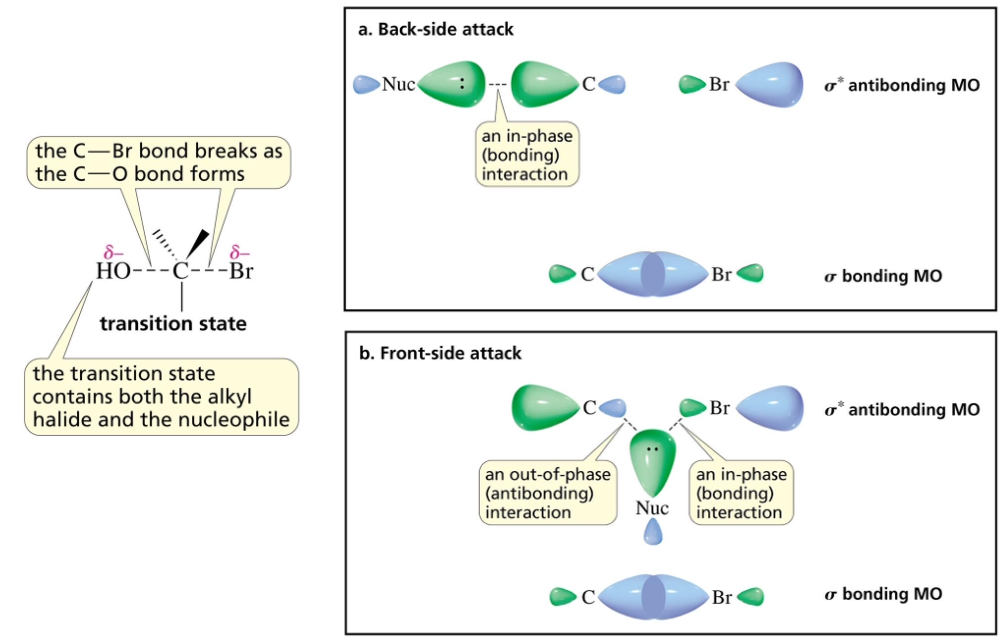
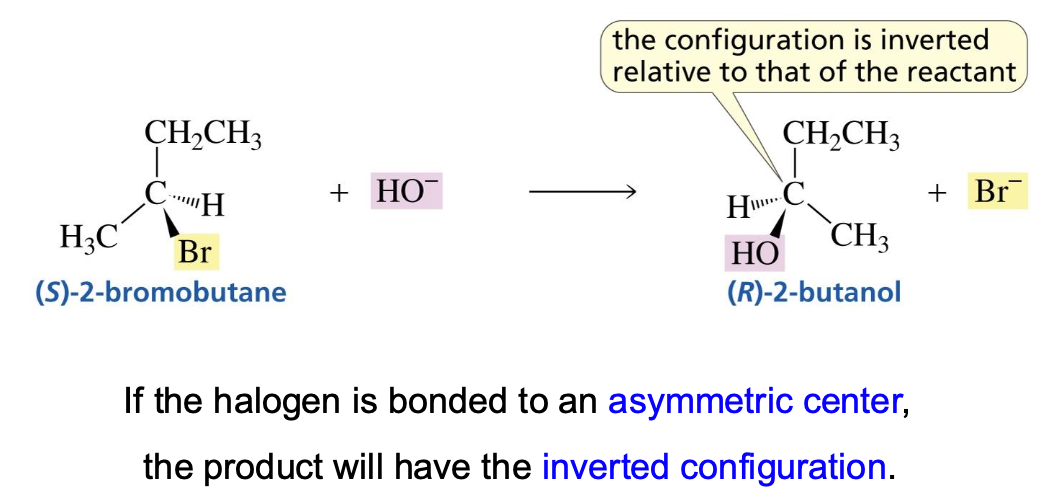
כתוצאה מהתקפה אחורית זו, מתרחש היפוך קונפיגורציה (inversion of configuration). אם הפחמן המותקף הוא מרכז כיראלי, קונפיגורציית $\text{R}$ תהפוך ל-$\text{S}$, ולהפך.
הגורמים המשפיעים על תגובת $\mathrm{S_N2}$
חמישה גורמים עיקריים משפיעים על קצב תגובת $\mathrm{S_N2}$:
1. מבנה הסובסטרט (האלקטרופיל)
ההפרעה הסטרית סביב הפחמן המותקף היא גורם מכריע:
- פחמן ראשוני ($\text{1}^\circ$): הכי מהיר ב-$\mathrm{S_N2}$ (הפרעה סטרית מינימלית).
- פחמן שניוני ($\text{2}^\circ$): יכול לעבור $\mathrm{S_N2}$, אך לאט יותר.
- פחמן שלישוני ($\text{3}^\circ$): כמעט ולא עובר $\mathrm{S_N2}$ בגלל הפרעה סטרית גדולה מדי שמונעת את גישת הנוקלאופיל.
ככל שיש יותר מתמירים גדולים על הפחמן, כך קשה יותר לנוקלאופיל לתקוף אותו מאחור.
2. הנוקלאופיל
א. חוזק הנוקלאופיל:
נוקלאופילים חזקים (כמו $\ce{OH-}$, $\ce{RO-}$, $\ce{CN-}$) מגיבים מהר יותר בתגובות $\mathrm{S_N2}$. נוקלאופילים חלשים (כמו $\ce{H2O}$, $\ce{ROH}$) מגיבים לאט.
גורמים המשפיעים על חוזק הנוקלאופיל:
- מטען: אניונים הם נוקלאופילים חזקים יותר מהמולקולות הניטרליות המקבילות ($\ce{OH-}$ > $\ce{H2O}$).
- אלקטרושליליות: ככל שהאטום פחות אלקטרושלילי, הוא נוקלאופיל חזק יותר (מוכן “לשתף” את האלקטרונים שלו בקלות רבה יותר).
- רזוננס: אם המטען השלילי מיוצב על ידי רזוננס (כמו ב-$\ce{RCOO-}$), הנוקלאופיל חלש יותר.
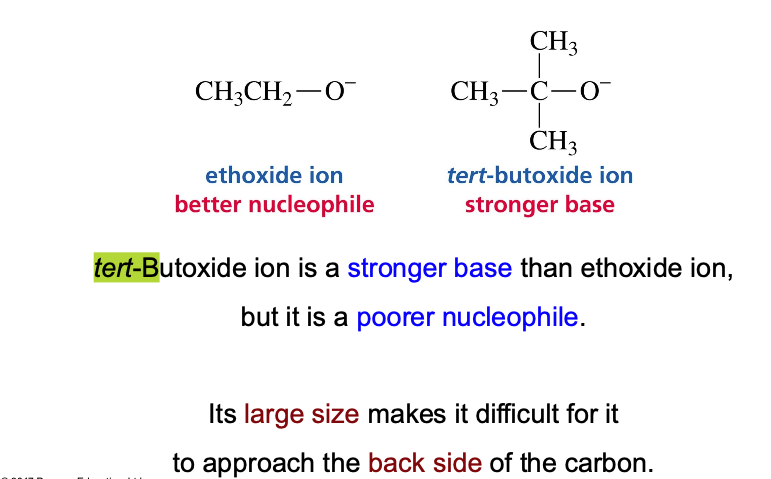
ב. גודל הנוקלאופיל (הפרעה סטרית):
נוקלאופילים גדולים ונפחיים (bulky) הם פחות יעילים ב-$\mathrm{S_N2}$ בגלל הפרעה סטרית. לדוגמה, tert-butoxide הוא בסיס חזק אך נוקלאופיל חלש יחסית בגלל גודלו.

אטומים גדולים יותר (באותה קבוצה בטבלה המחזורית) הם נוקלאופילים טובים יותר, מכיוון שהאלקטרונים שלהם מוחזקים באופן רופף יותר (פולריזביליות גבוהה).
3. הקבוצה העוזבת (Leaving Group)
קבוצה עוזבת טובה היא כזו שיכולה להתנתק מהפחמן וליצור יון יציב. קבוצות עוזבות טובות הן בסיסים חלשים. סדר היעילות של ההלוגנים כקבוצות עוזבות הוא:
\[\ce{I- > Br- > Cl- >> F-}\]יוד ($\ce{I-}$) הוא הקבוצה העוזבת הטובה ביותר מכיוון שהוא יון גדול ויציב (הבסיס המצומד של חומצה חזקה, HI). פלואור ($\ce{F-}$) הוא קבוצה עוזבת גרועה מאוד מכיוון שהוא בסיס חזק ולא יציב.
בסיס חלש = יציב = קבוצה עוזבת טובה. בסיס חזק = לא יציב = קבוצה עוזבת גרועה.
4. הממס
- ממס פולרי פרוטי (כמו מים, אלכוהול): ממס זה יכול ליצור קשרי מימן. הוא מייצב את הנוקלאופיל על ידי “עטיפתו” במולקולות ממס (solvation), מה שמפחית את התגובתיות שלו ומאט את קצב ה-$\mathrm{S_N2}$.
- ממס פולרי אפרוטי (כמו אצטון, DMSO, DMF): ממס זה אינו יכול ליצור קשרי מימן. הוא אינו מייצב את הנוקלאופיל באותה מידה, ולכן הנוקלאופיל “חופשי” ופעיל יותר. ממסים אלו מאיצים את קצב ה-$\mathrm{S_N2}$.
5. סטריאוכימיה
כאמור, מנגנון $\mathrm{S_N2}$ תמיד מתרחש עם היפוך קונפיגורציה מלא במרכז התגובה.
דוגמאות לתגובות $\mathrm{S_N2}$
-
התמרה של אלקיל הליד לאלכוהול:
\[\ce{R-X + OH- -> R-OH + X-}\] -
אלקילציה של אמינים:
\[\begin{aligned} &\ce{CH3I + NH3 -> CH3NH3+ I-} \\ \end{aligned}\]התוצר הראשוני יכול להמשיך ולהגיב, מה שמוביל לתערובת של תוצרים.
תגובת $\mathrm{S_N1}$
הקדמה לתגובת $\mathrm{S_N1}$
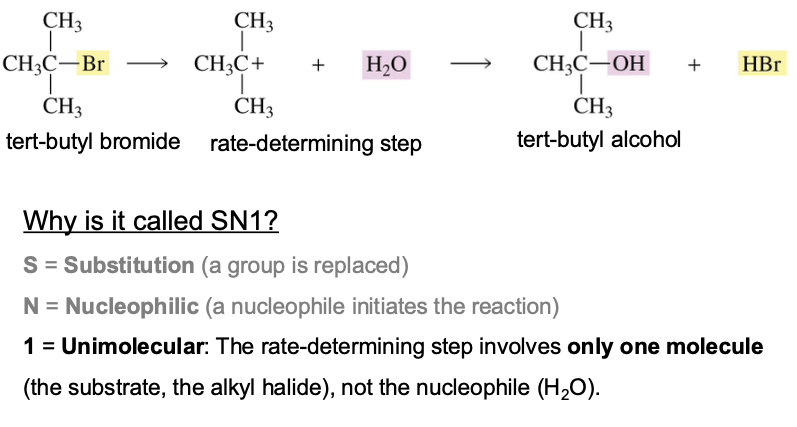
נבחן את התגובה הבאה:
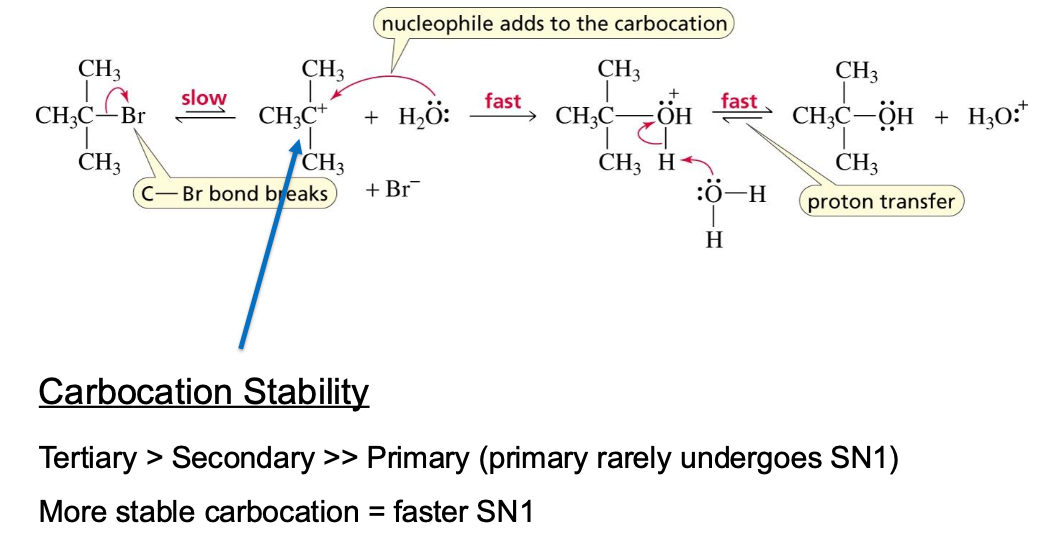
\[\ce{(CH3)3C-Br + H2O -> (CH3)3C-OH + HBr}\]תגובה זו אינה סבירה במנגנון $\mathrm{S_N2}$ מכיוון שהסובסטרט הוא שלישוני (הפרעה סטרית גדולה) והנוקלאופיל (מים) חלש. למרות זאת, התגובה מתרחשת, ואף במהירות. הדבר מצביע על קיומו של מנגנון חלופי: $\mathrm{S_N1}$.
מנגנון $\mathrm{S_N1}$
במנגנון $\mathrm{S_N1}$, התגובה מתרחשת בשני שלבים נפרדים:
-
שלב 1 (איטי, קובע מהירות): הקבוצה העוזבת מתנתקת באופן ספונטני ויוצרת תוצר ביניים מסוג קרבוקטיון (פחמן עם מטען חיובי).
\[\ce{(CH3)3C-Br \rightleftharpoons (CH3)3C+ + Br-}\] -
שלב 2 (מהיר): הנוקלאופיל תוקף את הקרבוקטיון המישורי.
\[\ce{(CH3)3C+ + H2O -> (CH3)3C-OH2+}\]לאחר מכן, שלב מהיר של דה-פרוטונציה נותן את התוצר הסופי.
\[\ce{(CH3)3C-OH2+ -> (CH3)3C-OH + H+}\]
המנגנון נקרא אונימולקולרי (Unimolecular) מכיוון שקצב התגובה תלוי רק בריכוז של מגיב אחד: הסובסטרט. הנוקלאופיל אינו משתתף בשלב קובע המהירות.
השם מגיע ממספר המרכיבים שמהירות הריאקציה תלויה בהם:
- $\mathrm{S_N2}$: תלויה בשני מרכיבים (הסובסטרט והנוקלאופיל).
- $\mathrm{S_N1}$: תלויה במרכיב אחד (הסובסטרט).
הגורמים המשפיעים על תגובת $\mathrm{S_N1}$
1. מבנה הסובסטרט
הגורם החשוב ביותר הוא יציבות הקרבוקטיון שנוצר בשלב הראשון. ככל שהקרבוקטיון יציב יותר, התגובה מהירה יותר.
סדר יציבות הקרבוקטיונים:
\[\text{tertiary} > \text{secondary} >> \text{primary} > \text{methyl}\]- פחמן שלישוני: הכי מתאים ל-$\mathrm{S_N1}$ (יוצר קרבוקטיון שלישוני יציב).
- פחמן שניוני: יכול לעבור $\mathrm{S_N1}$.
- פחמן ראשוני: כמעט ולא עובר $\mathrm{S_N1}$ (קרבוקטיון ראשוני אינו יציב).
2. הקבוצה העוזבת
בדומה ל-$\mathrm{S_N2}$, קבוצה עוזבת טובה (בסיס חלש ויציב) מאיצה את התגובה.
3. הנוקלאופיל
בניגוד ל-$\mathrm{S_N2}$, חוזק הנוקלאופיל כמעט אינו משפיע על מהירות תגובת $\mathrm{S_N1}$, מכיוון שהוא אינו מעורב בשלב קובע המהירות. לכן, תגובות $\mathrm{S_N1}$ מתרחשות לעיתים קרובות עם נוקלאופילים חלשים.
4. הממס - ממס פולרי פרוטי
ממס פולרי פרוטי (כמו מים, אלכוהול) מאיץ מאוד תגובות $\mathrm{S_N1}$. הסיבה היא שהממס מייצב גם את הקבוצה העוזבת האניונית וגם את הקרבוקטיון הקטיוני שנוצרים בשלב קובע המהירות, ובכך מוריד את אנרגיית השפעול.
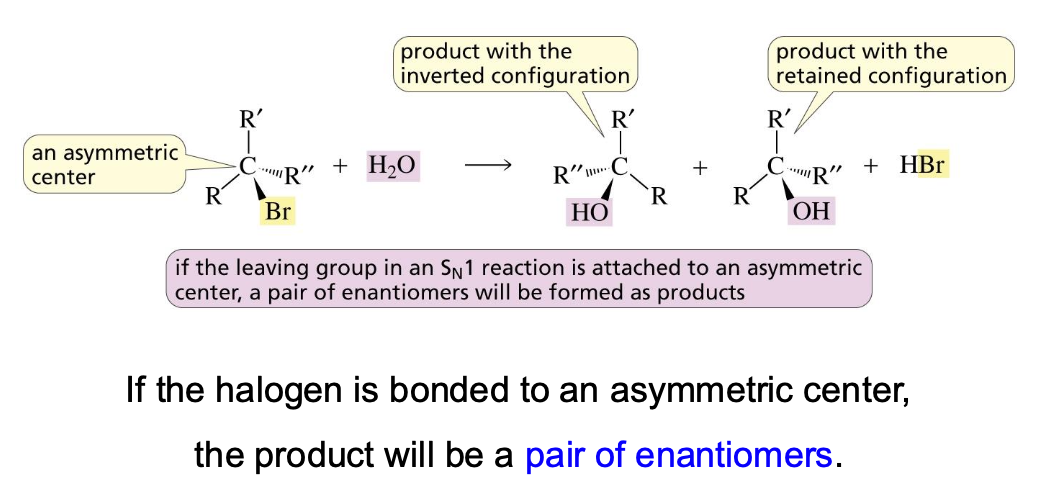
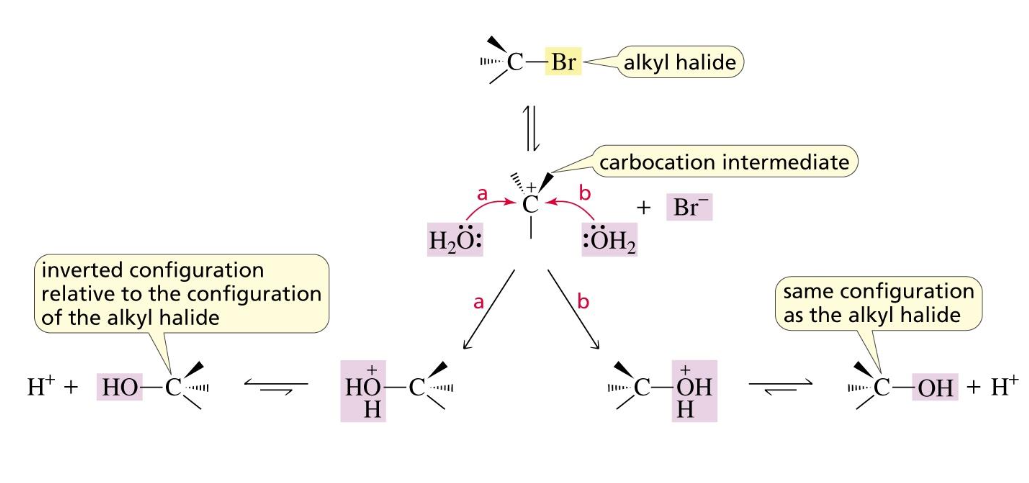
סטריאוכימיה של תגובות $\mathrm{S_N1}$
הקרבוקטיון שנוצר כתוצר ביניים הוא בעל גיאומטריה מישורית (היברידיזציה sp²). לכן, הנוקלאופיל יכול לתקוף אותו משני צדדים (מלמעלה ומלמטה) בסבירות כמעט שווה.
כתוצאה מכך:
- אם הפחמן המקורי היה כיראלי, תגובת $\mathrm{S_N1}$ מובילה ליצירת תערובת רצמית (תערובת 50:50 של שני האננטיומרים, R ו-S). התהליך נקרא רצמיזציה.
השוואה בין $\mathrm{S_N1}$ ו-$\mathrm{S_N2}$
| מאפיין | $\mathrm{S_N2}$ | $\mathrm{S_N1}$ |
|---|---|---|
| קינטיקה | שלב אחד, בימולקולרי | שני שלבים, אונימולקולרי |
| שלב קובע מהירות | התקפת הנוקלאופיל | יצירת קרבוקטיון |
| תלות בריכוז | תלוי ב-[סובסטרט] וב-[נוקלאופיל] | תלוי רק ב-[סובסטרט] |
| סובסטרט מועדף | מתיל > ראשוני > שניוני » שלישוני | שלישוני > שניוני » ראשוני, מתיל |
| השפעת הפרעה סטרית | מאטה מאוד | מאיצה (מייצבת קרבוקטיון) |
| חוזק נוקלאופיל | נוקלאופיל חזק מאיץ | כמעט ללא השפעה |
| סטריאוכימיה | היפוך קונפיגורציה (Inversion) | רצמיזציה (Racemization) |
| ממס מועדף | פולרי אפרוטי | פולרי פרוטי |
| תוצר ביניים | אין (מצב מעבר) | קרבוקטיון |
אסטרטגיה לפתרון שאלות
כדי לקבוע אם תגובה תתרחש במנגנון $\mathrm{S_N1}$ או $\mathrm{S_N2}$, יש לבחון את הגורמים הבאים:
-
הסובסטרט: זהו הגורם החשוב ביותר.
- ראשוני/מתיל: כמעט תמיד $\mathrm{S_N2}$.
- שלישוני: כמעט תמיד $\mathrm{S_N1}$.
- שניוני: יכול להיות שניהם. יש לבדוק את הגורמים האחרים.
-
הנוקלאופיל:
- חזק (למשל, $\ce{OH-}, \ce{CN-}, \ce{SH-}$): מעדיף $\mathrm{S_N2}$.
- חלש (למשל, $\ce{H2O}, \ce{ROH}$): מעדיף $\mathrm{S_N1}$.
-
הממס:
- פולרי פרוטי ($\ce{H2O}, \ce{ROH}$): מעדיף $\mathrm{S_N1}$.
- פולרי אפרוטי (DMSO, DMF, אצטון): מעדיף $\mathrm{S_N2}$.
-
הקבוצה העוזבת: קבוצה עוזבת טובה נדרשת לשני המנגנונים.
שאלות שעלו במהלך ההרצאה
-
מדוע הנוקלאופיל תוקף והקבוצה העוזבת מתנתקת? המוטיבציה העיקרית היא קיומו של נוקלאופיל (עשיר באלקטרונים) ואלקטרופיל (דל באלקטרונים) עם קבוצה עוזבת יציבה. התגובה מובילה ליצירת קשרים יציבים יותר.
-
מה קורה לפרוטון שעוזב בשלב האחרון של $\mathrm{S_N1}$? הפרוטון נקלט על ידי בסיס שנמצא בתמיסה, למשל מולקולת ממס (מים) או הקבוצה העוזבת (למשל, $\ce{Br-}$).
-
האם יש מוטיבציה ביולוגית לתגובות אלו בגוף? כן, תגובות דומות מתרחשות כל הזמן במערכות ביולוגיות. אנזימים מזרזים תגובות אלו על ידי ייצוב מצבי המעבר או תוצרי הביניים.
-
כיצד ניתן לדעת במבחן אם התגובה תהיה $\mathrm{S_N1}$ או $\mathrm{S_N2}$? יש לבצע ניתוח שיטתי של כל הגורמים: סוג הסובסטרט (הכי חשוב), חוזק הנוקלאופיל וסוג הממס.
- סובסטרט שלישוני עם נוקלאופיל חלש בממס פרוטי -> כמעט בוודאות $\mathrm{S_N1}$.
- סובסטרט ראשוני עם נוקלאופיל חזק -> כמעט בוודאות $\mathrm{S_N2}$.
- סובסטרט שניוני -> המקרה המורכב ביותר, שבו שאר התנאים (נוקלאופיל, ממס) יכריעו.