חזקים ב-PTMs?
נסו 10 שאלות בנושא, עם עדיפות לשאלות שלא הצלחתם. בסיום תקבלו ציון וסקירה על הטעויות שלכם. הצלחתם? גלו בחנים בדפים נוספים
תוצאות המבחן
היסטוריית מבחנים
טוען את השאלות...
אנא המתן...
מבוא: מהגנום לפרוטאום הפונקציונלי
המסע מהמידע הגנטי המקודד ב-DNA ועד לחלבון פעיל הוא מסע ארוך ומורכב. בפרקים הקודמים למדנו על ארגון הכרומטין, שעתוק גנים, עיבוד RNA, ותרגום חלבונים. אולם סינתזת החלבון היא רק תחילת הדרך - כדי שחלבון יוכל למלא את תפקידו הביולוגי, עליו לעבור סדרה של שינויים מבניים וכימיים המכונים “שינויים לאחר תרגום” (Post-Translational Modifications - PTMs).
הגנום האנושי מכיל כ-21,000 גנים, מספר דומה למספר הגנים בזבוב הפירות או בתולעת C. elegans. כיצד אם כן מתאפשרת המורכבות העצומה של האורגניזם האנושי? חלק מהתשובה טמון בשינויים לאחר תרגום. בעוד ששחבור אלטרנטיבי מגדיל את מגוון התעתיקים מ-21,000 ל-200,000, שינויים לאחר תרגום מרחיבים את המגוון הפונקציונלי עד לכמיליון חלבונים שונים בתפקודם.
יצירת החלבון הפונקציונלי: השלבים הראשונים
הסרת מתיונין ואצטילציה של הקצה האמיני

כל חלבון מתחיל את מסעו עם חומצת האמינו מתיונין, המקודדת על ידי קודון ההתחלה AUG. אולם בכ-70% מהחלבונים האוקריוטיים, המתיונין הראשון נחתך על ידי אנזימים ספציפיים בשם מתיונין אמינופפטידאזות (Methionine aminopeptidases). תהליך זה מתרחש בזמן התרגום עצמו (co-translationally).
לאחר הסרת המתיונין, חומצת האמינו השנייה בשרשרת עוברת לעתים קרובות אצטילציה - הוספת קבוצת אצטיל ($\ce{CH3CO-}$) לקבוצת האמינו החופשית. אנזימים מסוג N-acetyltransferases מבצעים את האצטילציה, אשר משפיעה על:
- יציבות החלבון: האצטילציה מגינה על החלבון מפני פירוק
- מטען החשמלי: שינוי המטען בקצה האמיני משפיע על אינטראקציות אלקטרוסטטיות
- הידרופוביות: הוספת הקבוצה האצטילית מגבירה את האופי ההידרופובי
- קיפול החלבון: השינוי במטען ובהידרופוביות משפיע על אופן קיפול החלבון
חשוב להבין שתהליכים אלה אינם אקראיים - הם מווסתים בקפידה ומשפיעים על גורל החלבון. פגיעה במנגנונים אלה קשורה למחלות התפתחותיות, מחלות ניווניות וסרטן.
חלבוני שפרון - שומרי הקיפול הנכון
Chaperones - ״חלבון סוכך״
קיפול החלבון למבנה התלת-ממדי הנכון הוא תהליך קריטי. חלבונים המכונים “שפרונים מולקולריים” (Molecular Chaperones) מסייעים בתהליך הקיפול. כאשר חלבון אינו מצליח להתקפל כראוי למרות עזרת השפרונים, הוא מסומן לפירוק על ידי מערכת האוביקוויטין-פרוטאזום (Proteasome), נושא שנרחיב עליו בהמשך.
השפרונים פועלים על פי מספר עקרונות:
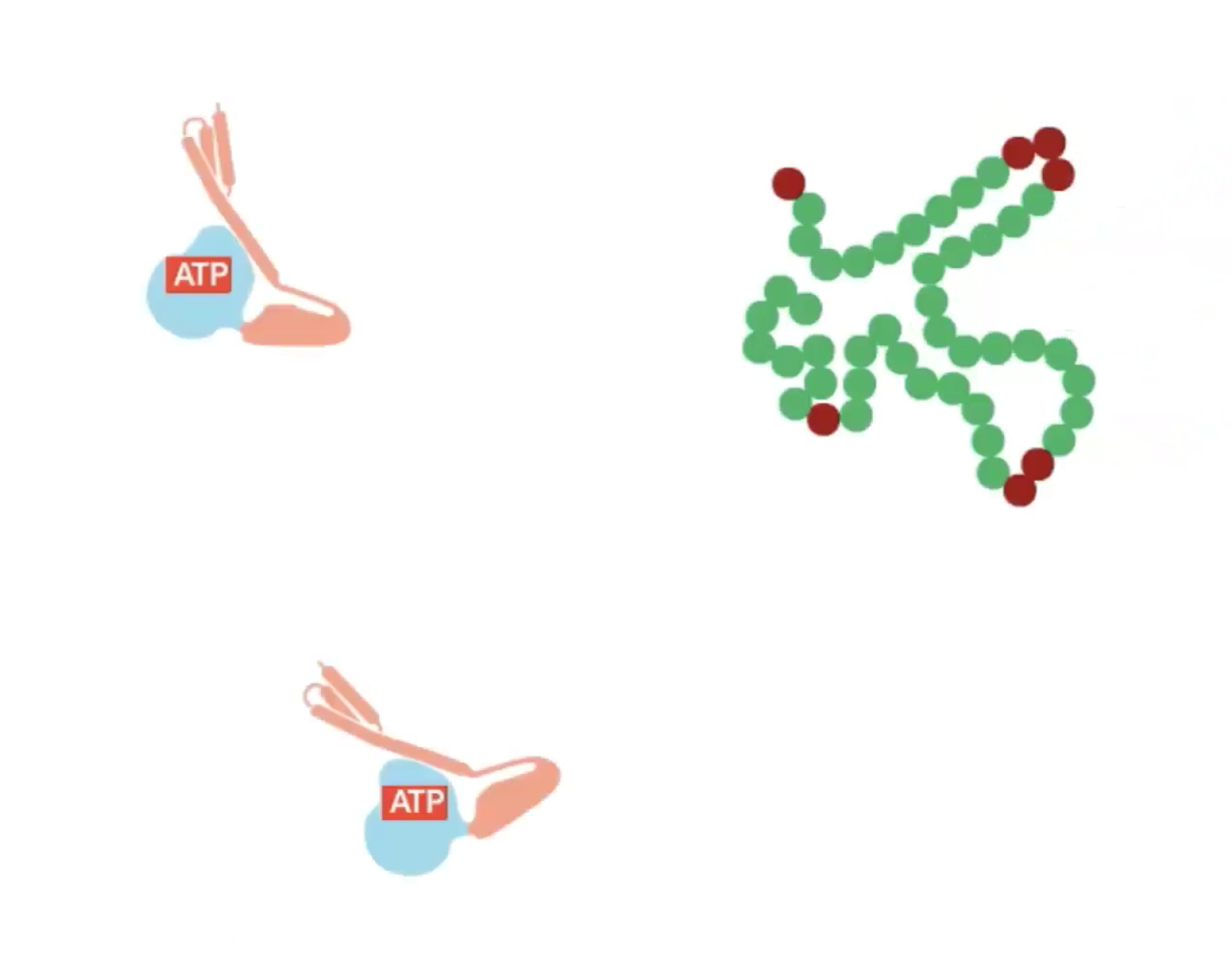
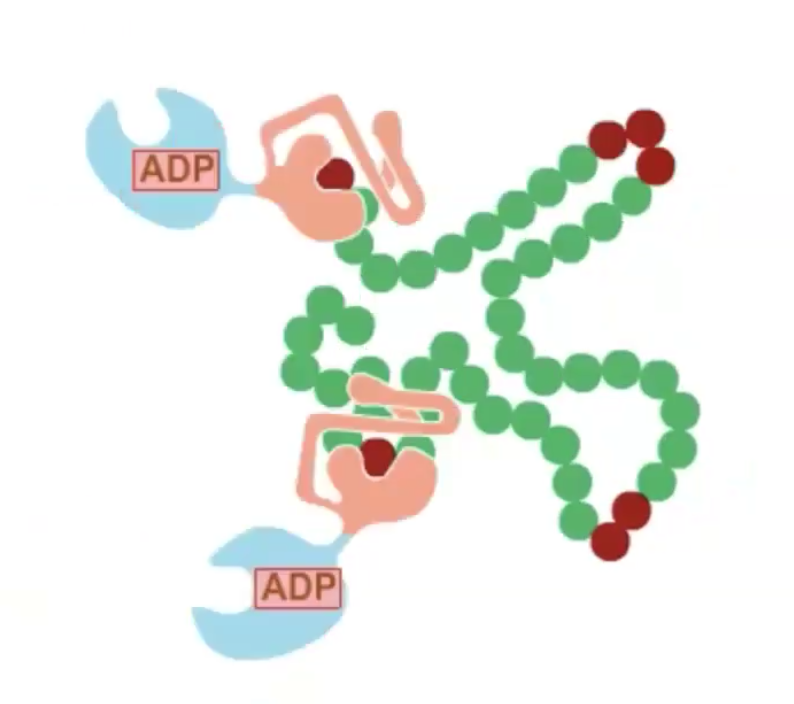
משפחת hsp70 (Heat Shock Protein 70)
חלבוני משפחת ה-hsp70 נקשרים לאזורים הידרופוביים בחלבון המתקפל, מונעים אגרגציה ומאפשרים קיפול הדרגתי. המנגנון כולל:
- זיהוי רצפים הידרופוביים חשופים
- קשירה תלוית ATP
- שחרור מבוקר המאפשר ניסיונות קיפול חוזרים
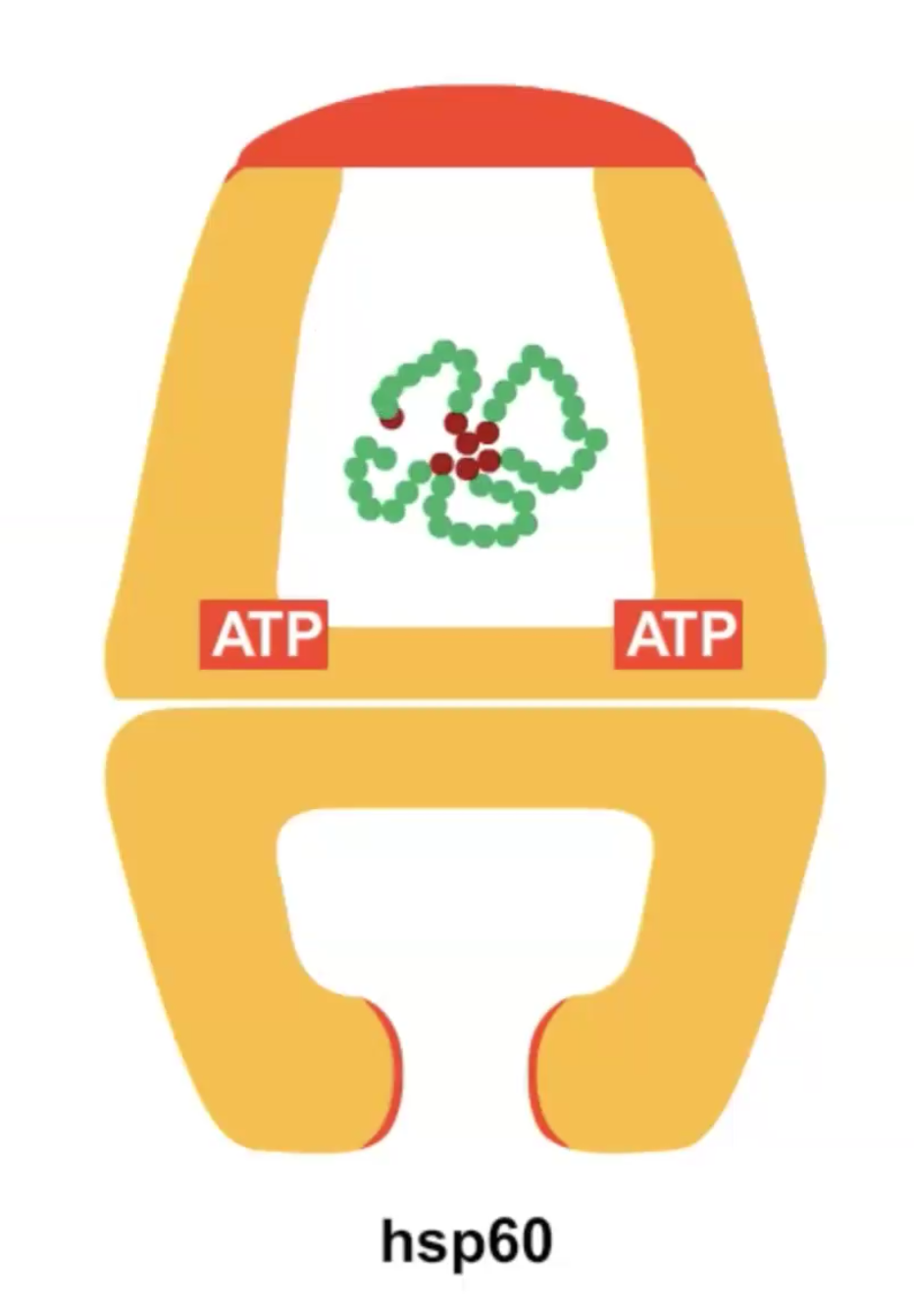
משפחת hsp60 (Heat Shock Protein 60)
משפחת hsp60 יוצרת מבנה דמוי חבית המספק סביבה מבודדת לקיפול (isolation chamber). החלבון נכנס לחלל הפנימי, שם הוא מוגן מאינטראקציות לא רצויות ויכול להתקפל בתנאים אופטימליים.
הקבוצות העיקריות של שינויים לאחר תרגום (PTMs)
המדע מכיר כיום בכ-200 סוגים שונים של שינויים לאחר תרגום. לצורך הבנה שיטתית, נהוג לחלק שינויים לאחר תרגום לארבע קבוצות עיקריות:
הוספת קבוצות פונקציונליות קטנות (e.g. methylation; Hydroxylation)
קבוצה זו כוללת את השינויים הנפוצים ביותר, בהם מתווספות קבוצות כימיות קטנות לחומצות אמינו ספציפיות.
זרחון (Phosphorylation)
זרחון הוא השינוי השכיח ביותר בפרוטאום (Proteome - סך החלבונים המתבטאים בתא). בתהליך זה, קבוצת פוספט ($\ce{PO4^3-}$) מתווספת בעיקר לחומצות האמינו סרין, תראונין וטירוזין. הזרחון משמש כ”מתג מולקולרי”:
- מפעיל או מדכא פעילות אנזימטית
- משנה את מיקום התוך-תאי של החלבון
- יוצר אתרי קישור לחלבונים אחרים
- מווסת אינטראקציות חלבון-חלבון
המנגנון כולל העברת קבוצת פוספט מ-ATP על ידי אנזימים הנקראים קינאזות, כאשר פוספטאזות מבצעות את התגובה ההפוכה.
הידרוקסילציה (Hydroxylation)
הוספת קבוצת הידרוקסיל (-OH) היא קריטית במיוחד לקולגן - החלבון הנפוץ ביותר בגוף האדם (25-35% מכלל החלבונים). פרולין הידרוקסילאז מזרז את התגובה:
פרולין + α-קטוגלוטרט + O₂ → הידרוקסיפרולין + סוקצינט + CO₂
ההידרוקסילציה של פרולין וליזין בקולגן חיונית ליציבותו. מחסור בוויטמין C, קו-פקטור חיוני לתגובה, גורם לצפדינה - מחלה בה הקולגן אינו יציב.
חשיבות נוספת של הידרוקסילציה התגלתה במחקר שזכה בפרס נובל לרפואה ב-2019. החוקרים וויליאם קיילין, פיטר רטקליף וגרג סמנזה גילו כיצד תאים חשים ברמות חמצן. בתנאי חמצן תקינים, פרולין הידרוקסילאז מבצע הידרוקסילציה של HIF (Hypoxia Inducible Factor), מה שמוביל לפירוקו. בתנאי היפוקסיה, ההידרוקסילציה נפגעת, HIF מתייצב ומפעיל גנים להתמודדות עם מחסור בחמצן.
הוספת חלבונים או פפטידים (e.g. Glycosylation; Ubiquitination)
גליקוזילציה - הוספת סוכרים
גליקוזילציה היא אחד השינויים המורכבים והחשובים ביותר. קיימים שני סוגים עיקריים:
N-גליקוזילציה: הוספת סוכרים לחנקן של אספרגין. מתרחשת ברשת האנדופלסמית (ER) בזמן התרגום ומאפיינת את רוב הרצפטורים על פני התא. התהליך כולל:
- זיהוי רצף הקונצנזוס Asn-X-Ser/Thr
- העברת אוליגוסכריד מורכב מ-dolichol
- עיבוד נוסף בגולג׳י
O-גליקוזילציה: הוספת סוכרים לחמצן של סרין או תראונין. מתרחשת בגולג׳י ומאפיינת במיוחד מוצינים - גליקופרוטאינים המרכיבים את הריר המגן על אפיתל.
הגליקוזילציה משפיעה על:
- מסיסות החלבון במים
- יציבות ואורך חיי החלבון
- זיהוי תאי ואינטראקציות
- קיפול נכון של החלבון
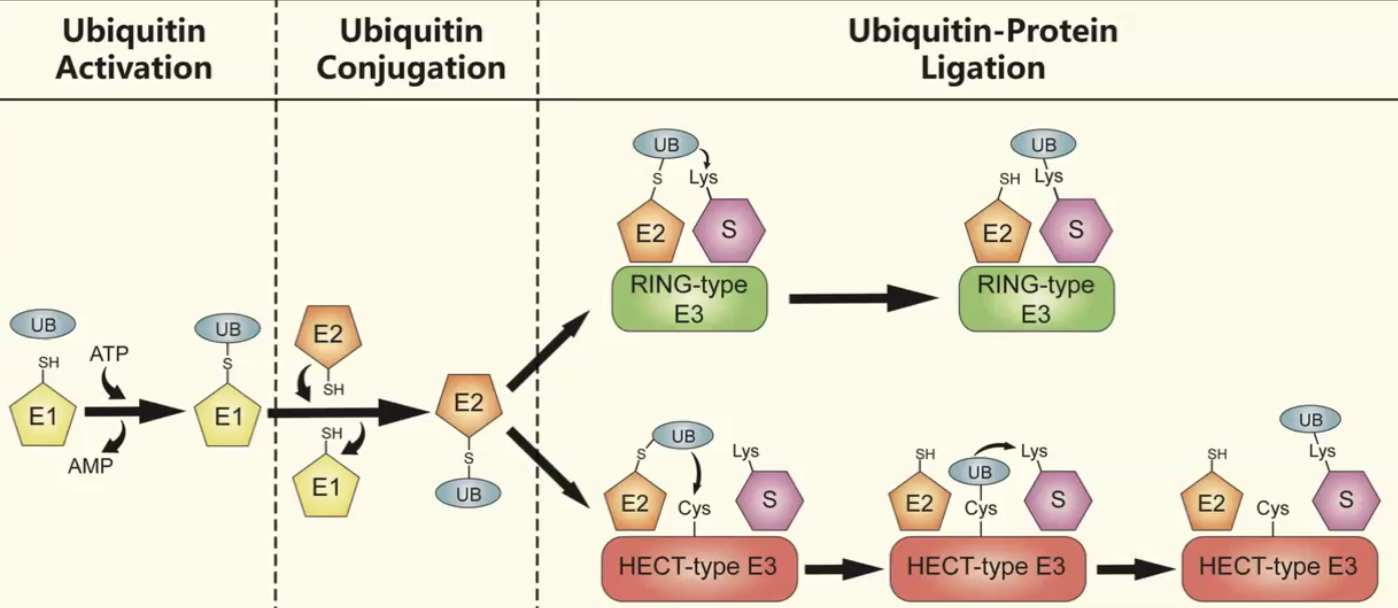
אוביקוויטינציה - סימון לגורלות שונים
למשל כשחלבון נפגע על ידי ROS
אוביקוויטין הוא חלבון קטן (76 חומצות אמינו) המתווסף לליזין בחלבוני מטרה. התהליך מערב שלושה סוגי אנזימים:
- E1: אנזים מפעיל
- E2: אנזים מצמיד
- E3: ליגאזה המקנה ספציפיות
סוג האוביקוויטינציה קובע את גורל החלבון:
- מונו-אוביקוויטינציה: משנה פעילות או מיקום
- פולי-אוביקוויטינציה דרך K48: סימון לפירוק בפרוטאזום
- פולי-אוביקוויטינציה דרך K63: תפקידים בתיקון DNA, אנדוציטוזה ועוד
Endocytosis - תהליך בו התא סופג חומרים מהסביבה על ידי יצירת שלפוחיות מהקרום התאי.
Biodistribution - התפשטות והפצה של חומרים בגוף, כמו חלבונים או תרופות, לאחר כניסתם לתוך התא או האורגניזם.
Enzymatic activity - פעילות אנזימטית, כלומר היכולת של אנזים לזרז תגובות כימיות ספציפיות.
Gene expression - ביטוי גנים, כלומר התהליך שבו מידע גנטי מתורגם לחלבון או RNA פעיל.
DNA repair - תיקון DNA, תהליכים המתקנים נזקים ב-DNA כדי לשמור על יציבות הגנום.
Autophagy - תהליך בו התא מפרק רכיבים לא נחוצים או פגומים כדי למחזר חומרים ולשמור על הומיאוסטזיס.
Proteasomal degradation - פירוק חלבונים על ידי הפרוטאזום, מערכת תאית המפרקת חלבונים לא נחוצים או פגומים.
שינוי הצורה הכימית של חומצת אמינו (citrullination)
ציטרולינציה - המרת ארגינין לציטרולין
בתהליך זה, אנזימים מסוג PAD (Peptidyl Arginine Deiminase) ממירים ארגינין לציטרולין:
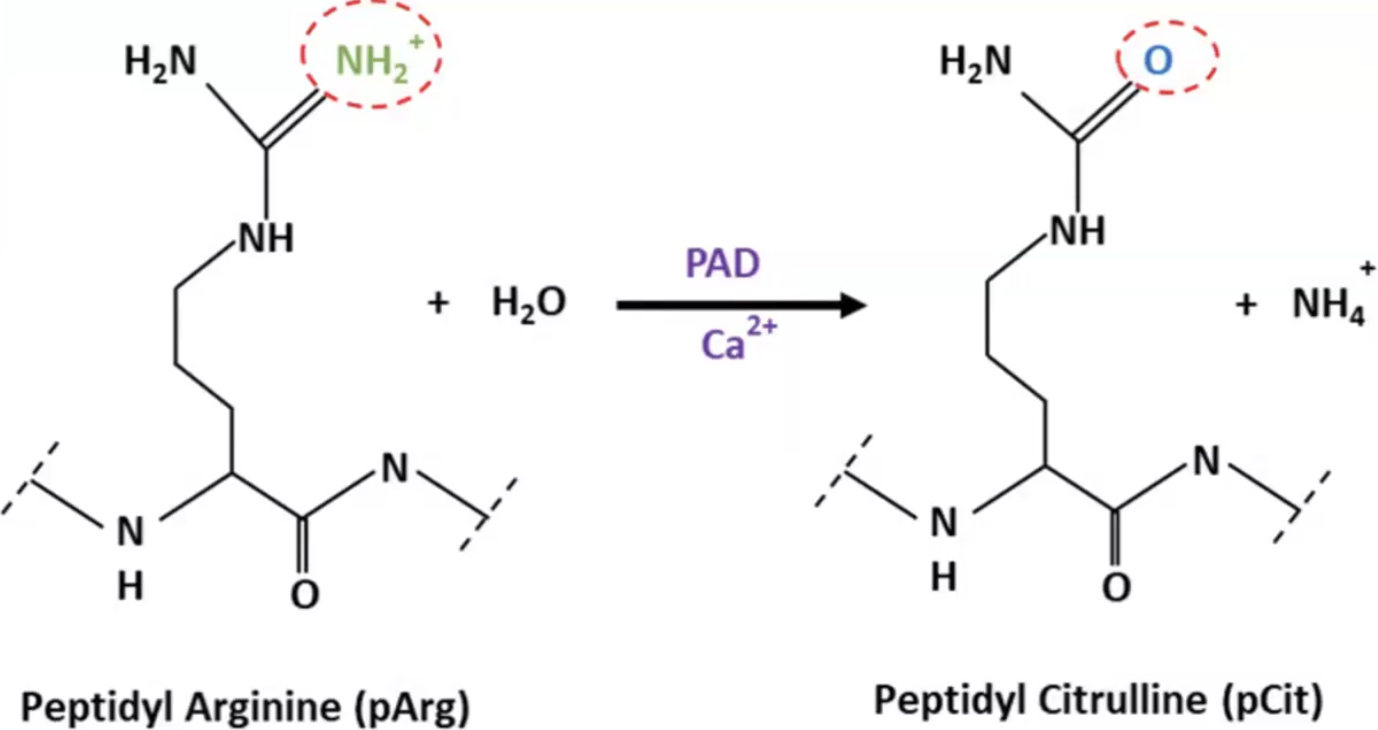
השינוי מקטין את המטען החיובי ומגביר הידרופוביות. בתנאים פיזיולוגיים, ציטרולינציה מתרחשת ב:
- היסטונים - משפיעה על מבנה הכרומטין
- פילגרין - חשוב להתמיינות תאי עור
- חלבוני מיאלין - בתאי עצב
ציטרולינציה חריגה קשורה למחלות אוטואימוניות כמו דלקת מפרקים שגרונית (Rheumatoid Arthritis), בה נוצרים נוגדנים נגד חלבונים מציטרולינים.
שינויים מבניים (disulfide bridges; proteolytic cleavage)
גשרים דיסולפידיים
קשרי S-S בין שני ציסטאינים חשובים ליציבות מבנית. בתנאים תקינים בציטופלזמה, הסביבה המחזרת מונעת יצירת גשרים אלה. אולם:
- בחלל הרשת האנדופלסמית הסביבה מחמצנת ומאפשרת יצירתם
- בתנאי עקה חמצונית נוצרים גשרים גם בציטופלזמה
- אנזימים כמו גלוטתיון פרוקסידאז ותיורדוקסין מווסתים את התהליך
חיתוך פרוטאוליטי
חיתוך מבוקר של חלבונים חיוני להפעלת חלבונים רבים. דוגמה קלאסית היא אינסולין:
- פרה-פרואינסולין (110 חומצות אמינו) מסונתז בריבוזומים
- חיתוך פפטיד האות ברשת האנדופלסמית יוצר פרואינסולין
- יצירת גשרים דיסולפידיים בין שרשראות A ו-B
- חיתוך שרשרת C בגרנולות ההפרשה יוצר אינסולין בוגר (51 חומצות אמינו)
חיתוך לקוי גורם לצורות מסוימות של סוכרת.
ויסות משך חיי החלבון
שינויים לאחר תרגום משפיעים דרמטית על משך חיי החלבון. מחצית החיים משתנה מדקות ועד עשרות שנים:
- קולגן: 20~ שנה
- קריסטלינים בעדשת העין: >70 שנה
- היסטונים: 6~ חודשים
- גורמי שעתוק רבים: דקות עד שעות
היציבות נקבעת על ידי:
- מידת הגליקוזילציה וההידרוקסילציה
- נוכחות סימוני אוביקוויטין
- שינויים הגורמים לחשיפת אזורים הידרופוביים
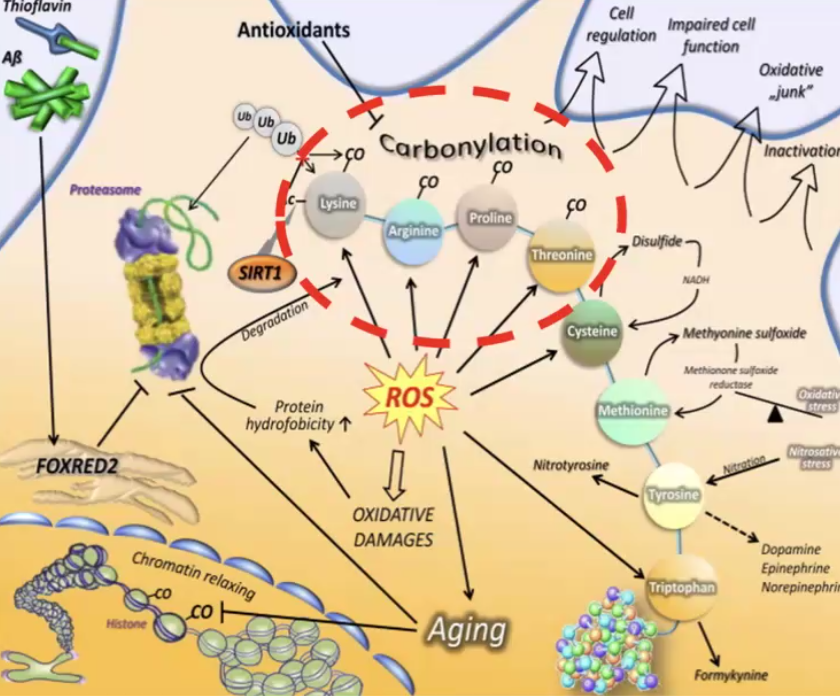
קרבמילציה - גשר בין סביבה לפתולוגיה
קרבמילציה היא הוספת קבוצת קרבמיל (NH₂CO-) לליזין או לקצה האמיני של חלבונים. בניגוד לשינויים רבים אחרים, זהו תהליך בלתי הפיך המתרחש:
- באופן ספונטני בנוכחות ציאנט או אוראה
- מוגבר בעישון ובחשיפה לזיהום אוויר
- מואץ באורח חיים בישיבה (sedentary lifestyle)

קרבמילציה של חלבונים כמו המוגלובין ואלבומין פוגעת בתפקודם ונחשבת לאחד המנגנונים המרכזיים בהזדקנות. רמות קרבמילציה גבוהות נמצאו במחלות ניווניות כמו אלצהיימר ופרקינסון.
אינטגרציה וחשיבות קלינית
הבנת השינויים לאחר תרגום חיונית להבנת:
- מסלולי העברת אותות: זרחון ושינויים אחרים מווסתים מסלולים כמו MAPK ו-PI3K
- בקרת מחזור התא: זרחון של חלבונים כמו p53 ו-Rb קריטי לבקרת חלוקה
- תגובות חיסוניות: גליקוזילציה של נוגדנים וציטרולינציה של אוטואנטיגנים
- מחלות: שינויים חריגים קשורים לסרטן, מחלות ניווניות ואוטואימוניות
המחקר בתחום מוביל לפיתוח תרופות חדשות:
- מעכבי קינאזות בטיפול בסרטן
- מעכבי PAD למחלות אוטואימוניות
- מווסתי אוביקוויטינציה למחלות ניווניות
סיכום
שינויים לאחר תרגום הם מפתח להבנת המורכבות הביולוגית. הם מגשרים בין המידע הגנטי הסטטי לבין הדינמיקה של החיים, מאפשרים לתא להגיב לשינויים סביבתיים ומווסתים כל היבט של פעילות החלבון. ללא הבנת התהליכים האלה, לא ניתן להבין לעומק את הביולוגיה של התא, העברת אותות, חלוקת תאים ופתולוגיה של מחלות.
בפרק הבא נלמד כיצד שינויים אלה משתלבים במסלולי העברת אותות, המאפשרים לתא לקלוט מידע מהסביבה ולהגיב בהתאם - תהליך המהווה בסיס לכל תגובה ביולוגית מורכבת.