מבוא
המרצה מציג את עצמו. פרופ׳ ניר.
מולקולות קטנות אורגניות.
תחום אחד ברפואה שבו התרופות לא מתחום של מולקולות אורניות - שם נותנים אורנו מתכתיות - מחלות נפש.
הקורס מחולק לשלושה חלקים:
- חזרה
19 במאי בוחן אמצע. 25 אחוז מהציון מגן.
המייל של המרצה: כתובת מייל
ספר הקורס:
Paula Yurkanis Bruice, “Organic Chemistry”, 8th edition, Pearson, 2016.
מה זה כימיה אורגנית ולמה זה חשוב
כימיה אורנית היא כימיה של תרכובות פחמן. כל מולקולוה עם פחמן מבחינתנו כימיה אורגנית.
הגדרה היסטוריה
בעבר סברו שכימיה ארוגנית היא דברים שבאים מיצורים חיים. למשל urea הייתה נחשבת למולקולה אורגנית, מפני שמצאו שהיא נמצאת אצל יצורים חיים. עם זאת, בשנת 1828, פריץ וולר סינטז את התרכובת urea מחומצה ציאנורית ואמוניה. זה הראה שאפשר ליצור תרכובות אורגניות מתרכובות לא אורגניות.
כלומר, נמצא שניתן לסנתז תרכובת אורגנית במעבדה, למשל אוראה:
\[\ce{NH4OCN ->[ \Delta ] NH2CONH2}\]חשיבות תרכובות אורגניות בתעשיית התרופות
מולקולת אספירין לדוגמה. לא נהוג לרשום חמצן:
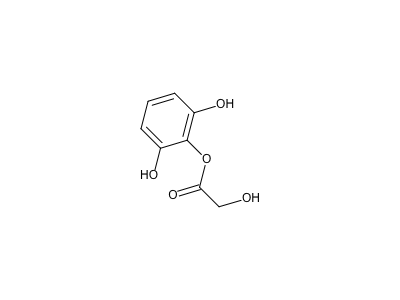
קשר כפול נקרא ״קרבוניל״ בין $\ce{C}$ ל-$\ce{O}$. קבוצת $\ce{OH}$ נקראת ״הידרוקסיל״. וכשיש $\ce{OH}$ חומצה קרבוקסילית.
הייחודיות של פחמן
מה שמיוחד בפחמן הוא יכול גם לקבל וגם לתת.
הוא נמצא במרכז השורה בטבלה המחזורית, מימנו יעידפו לקבל ומשמאלו למסור:
| $\ce{F}$ | $\ce{O}$ | $\ce{N}$ | $\ce{C}$ | $\ce{B}$ | $\ce{Be}$ | $\ce{Li}$ |
|---|---|---|---|---|---|---|
| מקבל אלקטרון אחד | מקבל שניים | מקבל שלושה | מוסר 3 | מוסר 2 | מוסר 1 |
פחמנים מימנים, למשל ברום, שייך לאלוגנים:
\[\ce{CH3CH2Br}\]לתרכובות פחמן יש שמות, זו למשל אתיל.
פחמן אחד (עם ארבעה מימנים) נקרא מתן.
שניים נקראים אתן.
שלושה נקראים פרופן.
חומצה אצטית. $\ce{COOH}$ סיומת של חומצה:
\[\ce{CH3COOH}\]לפי קבוצת R מצד שמאל נדע איזה סוג של חומצה.
מבחינה היסטורית המולקולות החשובות (אינ-אורגניות):
\[\ce{H2O, CO2, NH3, H2S}\]חומרים אי אורגנים שלא נלמד עליהם - כאלה בלי תרגונות פחמן, כמו אמוניה $\ce{NH3}$ ומלח שולחן $\ce{NaCl}$.
מבנה האטום חזרה
יש פרוטונים ואלקטרונים. למשל באטום הפחמן יש 6 פרוטונים ו6 אלקטרונים.
4 ייצרו קשרים בפחמן. הם ייצרו קשרים באורביטלים הבאים:
- שניים ב s
- שניים ב p, לא באותו אורביטלה לפי כלל האוטובוס.
איזוטופים
אטומים עם אותו מספר פרוטונים אבל מספר נייטרונים שונה.
סידור אלקטרונים ברמות אנרגיה
פיזור האלקטרונים בארבע הרמות הראשונות:
| רמה רביעית | רמה שלישית | רמה שנייה | רמה ראשונה | |
|---|---|---|---|---|
| אורביטל אטומי | $s,p,d,f$ | $s,p,d$ | $s,p$ | $s$ |
| מספר אורביטלים | $1,3,5,7$ | $1,3,5$ | $1,3$ | $1$ |
| מספר אלקטרונים מרבי | 32 | 18 | 8 | 2 |
הקונפיגורציות של האלקטרונים באטומים הקטנים:
\[\begin{array}{cccccccc} \text{H} & : & \boxed{\uparrow} & & & & & \\ & & 1s \\ \text{He} & : & \boxed{\uparrow\downarrow} & & & & & \\ & & 1s \\ \text{Li} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow} & & & & \\ & & 1s & 2s \\ \text{Be} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & & & & \\ & & 1s & 2s \\ \text{B} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow} & & & \\ & & 1s & 2s & 2p_x \\ \text{C} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow} & \boxed{\uparrow} & & \\ & & 1s & 2s & 2p_x & 2p_y \\ \text{N} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow} & \boxed{\uparrow} & \boxed{\uparrow} & \\ & & 1s & 2s & 2p_x & 2p_y & 2p_z \\ \text{O} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow} & \boxed{\uparrow} & \\ & & 1s & 2s & 2p_x & 2p_y & 2p_z \\ \text{F} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow} & \\ & & 1s & 2s & 2p_x & 2p_y & 2p_z \\ \text{Ne} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \\ & & 1s & 2s & 2p_x & 2p_y & 2p_z \\ \text{Na} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow} \\ & & 1s & 2s & 2p_x & 2p_y & 2p_z & 3s \end{array}\]ליטיום וסודניום (מהטור הראשון בטבלה המחזורית), יעדיפו לאבד אלקטרונים כדי להגיע לאוקטט:
\[\ce{Li. -> Li+ + e-}\] \[\ce{Na. ->[Na] Na+ + e-}\]מהצד השני פלור כלור יוד רוצים מאוד לקבל כדי להשלים לשמונה:
\[\ce{:\overset{.}{F}: + e- -> F-}\] \[\ce{:\overset{.}{Cl}: + e- -> Cl-}\]מימן יכול לקבל אלקטרון ובכך למלא את השכבה החיצונית שלו, או לחלופין לאבד אלקטרון ואז לא יהיו לו אלקטרונים בשכבה החיצונית.
\[\ce{.H + e- -> :H-}\]קצת על קשרים
רוב הקשרים שנדבר עליהם הם קשר קוולנטי וקשר יוני.
ההבדל ביניהם:
- קושר קוולנטי - שיתוף זוג אלקטרונים.
- קשר יוני - העברת אלקטרון מאטום לאטום. עוברים ליותר האלקטרושלילי.
קשרים נוספים שיש אגב הם קשרי מימן או ואן דר ואלס, בדר״כ בין מולקולות ולא בתוך.
דוגמאות לשני אטומים שיוצרים קשר, שני פלואורים:
\[\ce{F + F -> F2}\]שני מימנים:
\[\ce{H + H -> H2}\]קשרים בין אטומים שונים (לא מאותו סוג)
כמעט תמיד אטום מוסר ואטום מקבל. למשל מימן וכלור. נתינה חלקית קוולנטי, מלאה יוני. למשל $\ce{HCl}$.
\[\ce{\underset{.}{H} + :\overset{.}{Cl}: -> H-\overset{..}{\underset{..}{Cl}}:}\]כמה קשרים חרוצים לעשות?
למשל במים, חמצן ומימן:
\[\ce{H2O + H2 -> H3O+ + OH-}\]נייטרוגן רוצה לעשות שלושה קשרים כדי לקבל שלושה לכלל האוקטט:
\[\ce{NH3 + H+ -> NH4+}\]פחמן ברירת המחדל ירצה לעשות ארבעה קשרים:
\[\ce{CH4 + H+ -> CH5+}\]קוטביות
קשר קוולנטי שאינו קוטבי = בין שני אטומים מאותו סוג או עם אלקטרושליליות דומה:
\[\ce{H-H,F-F,C-C,C-H}\]קשר פולארי - כאשר יש פער באלקטורשליליות:
\[\ce{\overset{\delta +}{H}-\overset{\delta -}{Cl}}\]כשיש פער גדול באלקטרושליליות אומרים שמדובר בקשר יוני.
מומנט דיפול
הולך מהיותר חיובי ליותר שלישי.
צד אחד דלטה פלוס וצד שני דלטה מינוס:
\[\ce{HCl -> H+ + Cl-}\]$\delta ^+$ ו-$\delta ^-$
נוסיף לתיאוך במולקולות הבאות: $\ce{H2O, NH3, CH4}$
\[\ce{H2O -> H+ + OH-}\] \[\ce{NH3 -> NH4+ + NH2-}\] \[\ce{CH4 -> CH5+ + CH3-}\]סיכום על קשרים - נדבר בעיקר על קוולנטים ויונים. יש קוולנטים שאינם פולארים (למשל אותו יסוד, יש יוצאי דופן. אולי דיפול רגעי)
צבע אדום בדר״כ מסמן משהו שלישי יותר. למשל ב $\ce{HLi}$ המימן אדום. שני מימן ירוק. כחול בד״כ חיובי.
מבנה לואיס
…
מטען פורמאלי
כמה אלקטרונים יהיו בקליפה החיצונית.
\[\text{FC} = \text{VE} - \left( \text{Lone Pairs Electrons} + \frac{\text{Bonding Electrons}}{2} \right)\]למשל חמצן ומימן במולקולת המים $\ce{H2O}$:
| אטום | אלקטרוני ערכיות | זוגות אלקטרונים חופשיים | מטען פורמאלי |
|---|---|---|---|
| $\ce{O}$ | $6$ | $4$ | $6 - (4 + 4/2) = 0$ |
| $\ce{H}$ | $1$ | $0$ | $1 - (0 + 2/2) = 0$ |
N יכול ליצור שלושה קשרים, ואז יהיה אמוניה. יכול עוד קשר ויהיה הידרזין. יכול גם ארבעה ואז מטען חיובי, או שניים מטען שלילי.
\[\ce{NH3 -> NH4+ + NH2-}\] \[\ce{NH3 -> NH4+ + NH2-}\]קשרי חמצן עם שני קשרים:
הידרוגין פראוקסיד:
מי חמצן. קשר $\ce{O-O}$ לא יציב.
\[\ce{H2O2 -> H2O + O}\]רדיקלים גורמים סטרס.
קשרים בין מימן להלוגנים - קשר יחיד
הלגונים הם יסודות כימיים שנמצאים בקצה השמאלי של הטבלה המחזורית. כלור, פלואור, ברום, יוד. מקיימים קשר יחיד עם מימן. אם יש לו מטען אז זה יהיה רדיקל.
כללי אצבע: מספר האלקטרונים הקושרים + מספר האלא קושרים = 4
כללים להתמודדות עם lone pairs וקשרים. נראה שמספר הקשרים ועוד מספר זוגות הלו קושרים צריך להיות 4.
מיסודות למולקולות
מבנה לואיס - מומלץ לחזור על הפירוט בסיכום על קשרים כימיים.
קשר ראשון בקשר כפול הוא סיגמה ($\sigma$). קשר שני הוא פי ($\pi$).
איך לצייר מבנה אוקטט.
שלב חמישי - לבדוק את כלל האוקטט.
לצורת הרישום השנייה של הציום קוראים Kekulé structure.
יש גם Condensed structure.
מה שלא חלק מהשרשרת הארוכה - מתמיר - למשל $\ce{CH3}$ במולקולה:
מבנה שלד (Skeleton Structure)
מערכת מצומדת
היא מערכת שמורכבת משרשרת של קשר כפול וקשר יחיד. רזוננס זה מקרה פרטי. בדר״כ יהיה במערכת כזאת מעבר של אלקטרונים. בדר״כ הצבעים בטבע וגם ברפואה נובעים מהתכונה שלהם כמערכת מצומדת.
אורביטלות
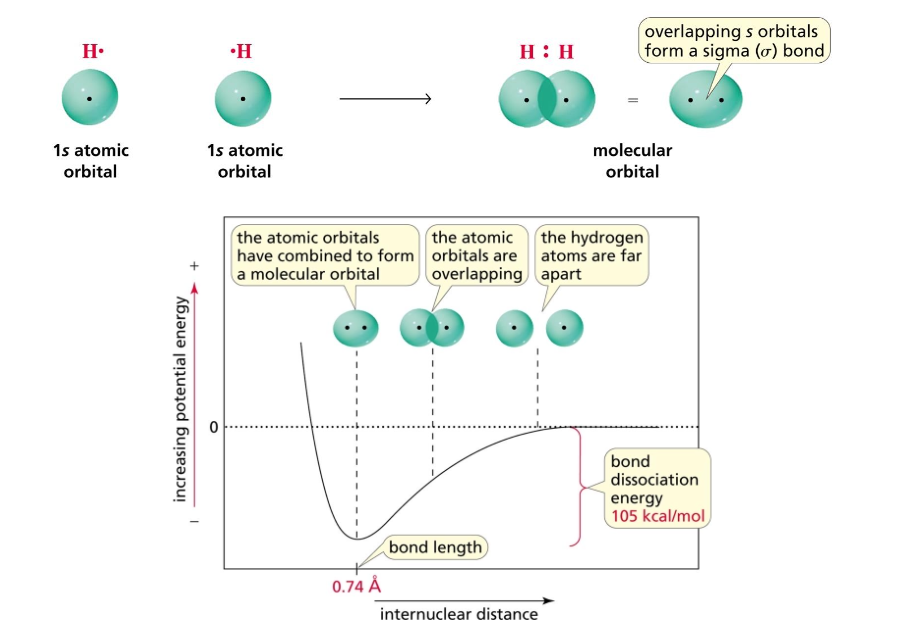
כששתי אורביטלות $1s$ נפגשות נקבל אורביטלה מולקולרית בשם $\sigma_{1s}$.
היברידיזציה
שני אורביטלי $1s$
רוב הריאקציות בהיברידיזציות. כששני אורביטלי $1s$ מתקרבים עם יוצרים שני אורביטלים חדשים - אחד נמוך באנרגיה ואחד גבוה באנרגיה: $\sigma_{1s}$ ו-$\sigma_{1s}^*$ בהתאמה. האלקטרונים יעדיפו את הנמוך. באופן טבעי יעדיפו את הרגיל ולא את ה״אנטי סיגמה״ או ה״סיגמה סטאר״ (שני שמות נכונים).
שני אורביטלי $p$
ייצרו בהתאמה אורביטלים $\pi_{2p_x}$ ו-$\pi_{2p_y}$. הם יהיו מעל ומתחת למישור הקשר של אורביטלי $\sigma_{1s}$ (הייתה על זה שאלה במבחן).
מבנה של מולקולות
Mathane ($\ce{CH4}$) מתאן
פחמן עם ארבעה מימנים סביבו (מולקולה עם ארבעה קשרים).
H
|
H - C - H
|
H
כל הקשרים באותו אורך של $1.1 \overset{\circ}{\text{A}}$. כל הזוויות $109.5^\circ$. מעלות. לכאורה לא הגיוני - כי יש לו שני ארביטלי $s$ ושני $p$. היינו מצפים שהקשרים יהיו באורך שונה - אבל זה לא כך.
מכאן שמה שיש כאן אלה לא אורביטלים רגילים - יש 4 קשרים שכאמור מאותו אורך, והם באמצעות אורביטלים מולקולריים שנקראים $sp^3$ ($sppp=sp^3$).
אורביטל אחד יעבוד ל $p$ נקבל ארבע אורביטלות אותו דבר: $sp^3$.
הקשרים ב ethane
האם עדיין יש $sp^3$ בקשר בין פחמן לפחמן. אבל הוא יהיה ארוך יותר, כי מגיעים מ $1s$.
מומלץ לחזור על הסיכום בנושא היברידיזציה.
\[\begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & \text{2p: } \boxed{ \uparrow \ \ | \uparrow \ \ | \ \ \ \ } \\[15pt] \uparrow & \text{2s: } \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & \text{sp}^3: \boxed{\uparrow \ \ | \uparrow \ \ | \uparrow \ \ | \uparrow \ \ } \end{array}\]נשים לב שבאופן כללי בטטראדר כל הקשרים באותו אורך וכל הזוויות באותו אורך. ההיברידיזציה של הפחמן היא $sp^3$.
אתאן ($\ce{C2H6}$)
קשר כפול (ethane - ethylene)
H H
| |
H - C - C - H
| |
H H
גם פה יש פחמן עם ארבעה קשרים אבל לפחמן יש קשר אחד עם פחמן במקום עם מימן.
אכן אותו דבר אבל כאן הקשרים יהיו ארוכים יותר ($1.54 \overset{\circ}{\text{A}}$).
- ארוך יותר זה חלש יותר.
- קצר יותר חזק יותר - כי יש יותר electron density.
במקרה הזה הקשרים מגיעים מהקליפה השנייה - $2s$ ל $2p$. ה $1s$ לא מעורב.
זה בולט בעיקר בהלוגנים - הקשר בין $\ce{H}$ ל$\ce{F}$ יהיה קשר יותר קצר וחזק, והקשר בין $\ce{H}$ ל$\ce{I}$ יהיה קשר יותר ארוך וחלש.
קשר כפול יש פי $\pi$ ופי $\sigma$.
הערה: הנושא של End-on overlap מתייחס לחפיפה החיובית והשלילית של האורביטלים - $\pi$ לעומת $\pi ^*$ למשל. הוא פחות רלוונטי לכימיה אורגנית.
אֶתֶן או אתילן ($\ce{C2H4}$)
\[\ce{C2H4 -> C2H4}\]מעורבים כאן שלושה אלקטרונים (ללא הכפול). הוא יצטרך שלוש אורביטלות מולקולריות, וישתמש בשבילן באורביטלים המולקולריים $s$ אחד, ושני $p$. יווצרו שלושה אורביטלים $sp^2$.
מבחינה אנרגטית, גבוה יותר מ$s$ ונמוך יותר מ$p$ ומ $sp^3$, כי אחוז ה $s$ גבוה יותר וכאמור ל $s$ אנרגיה נמוכה יותר.
מדובר במשולש מישורי, הזויית בין הקשרים היא $120^\circ$.
|
C
/ \
אצטילן ($\ce{C2H2}$)
\[\ce{H-C#C-H}\]בקשר סיגמה - בין לבין
בקשר פאי - מעל ומתחת ופנימה והחוצה.
ההיברידיזציה של הפחמן היא $sp$.
מקרים ספציפיים של מתאן
כאמור, מתאן זו מולקולה של פחמן עם ארבעה מתמירים של מימן ($\ce{CH4}$). אפשר לקחת לו את אחד המתמירים (המימנים) ולקבל רדיקל. איך תראה ההיברידיזציה?
מתאן (מטיל) שיש לו שלושה מימנים וטעון חיובית יהיה עם היברידיזיה של $sp^2$.
אם הוא רדיקל גם יהיה עם היברידיזיה של $sp^2$.
אם יהיה טעון שלילית (אניון) הוא כבר לא יהיה עם היברידיזיה של $sp^2$ אלא יהיה עם היברידיזיה של $sp^3$. דומה למים - יש זוג אלקטרונים עם דחייה גדולה יותר. אולי אף מרחקים קטנים יותר כי lone pair דוחף חזק יותר.
הקשרים באמוניה ($\ce{NH3}$)
..
H - N - H
|
H
בקצרה.
יש שלושה מימנים וזוג אלקטרונים. דומה למבנה שכבר הראנו של מטיל טעון שלילית $\ce{CH3-}$.
היברידיזציה של הניטרוגן היא $sp^3$.
חנקן אוהב לעשות שלושה קשרים ולא ארבעה. אם יש ארבעה יהיה עם מטען חיובי.
מים ($\ce{H2O}$)
..
H - O :
|
H
סיכום ביניים
- ככל שהקשר קצר יותר, כך הוא חזר יותר
- ככל שצפיפות האלקרונים גדולה יותר באזירו של החפיפה האורביטלית, הקשר חזק יותר
- ככל שיש יותר אותיות $s$, כך הקשר חזק יותר
- ככל שיש יותר אותיות $p$, כך הקשר גדול יותר
VSEPR
קשרי $\pi$ חלשים מקשר סיגמה $\sigma$.
קשרי דיפול חזרה - למשל $\ce{HF}$.
\[\text{H} \rightarrow \text{F}\]$\text{AX}_2$
למשל $\ce{CO2}$
| VSEPR | $\ce{AX2}$ |
|---|---|
| Geometry | Linear 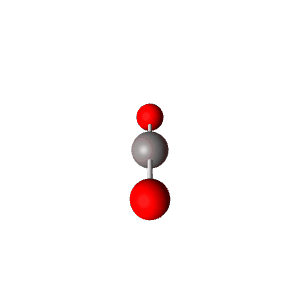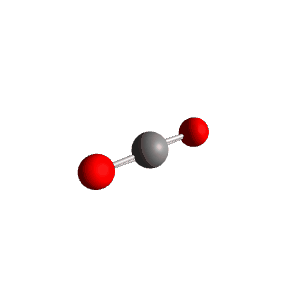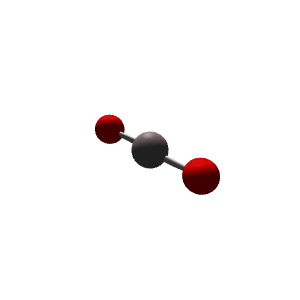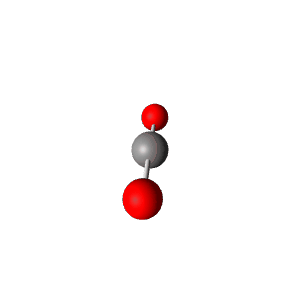 |
| Bond Angle | 180° |
| Name of Shape | Linear |
| Hybridization | $sp$ |
שישה שלבים לפתרון שאלה מהסוג הזה:
- מוצאים את האטום המרכזי - במקרה הזה פחמן. האטום המרכזי הוא בדרך כלל האטום הפחות אלקטרושלילי. בודקים כמה אלקטרוני ערכיות יש למרכזי (במקרה של פחמן 4).
- כמה קשרים יהיו לו? במקרה שלנו שני קשרים כפולים - כל אחד עם סיגמה אחד ופאי אחד, סה״כ שני $\pi$ ושני $\sigma$ וסה״כ ארבעה קשרים.
- כמה זוגות של אלקטרונים לא קושרים? במקרה של פחמן אפס.
$\text{AX}_3$
לדוגמה $\ce{BF3}$
| VSEPR | $\ce{AX3}$ |
|---|---|
| Geometry | Trigonal Planar  |
| Bond Angle | 120° |
| Name of Shape | Trigonal Planar |
| Hybridization | $sp^2$ |
| Example | $\ce{BF3}$ |
$\text{AX}_2\text{E}$
למשל $\ce{SO2}$
- לסוללפור 6 אלקטורני ערכיות
- שני קשרים כפולים (שני קשרי $\pi$ ושני קשרי $\sigma$)
- …
| VSEPR | $\ce{AX_2E}$ |
|---|---|
| Geometry | Bent |
| Bond Angle | 120° |
| Name of Shape | Bent |
| Hybridization | $sp^2$ |
| Example | $\ce{SO2}$ |
$\text{AX}_4$
למשל $\ce{CH4}$ מתן
| VSEPR | $\ce{AX_4}$ |
|---|---|
| Geometry | Tetrahedral |
| Bond Angle | 109.5° |
| Name of Shape | Tetrahedral |
| Hybridization | $sp^3$ |
| Example | $\ce{CH4}$ |
$\text{AX}_3\text{E}$
למשל $\ce{NH3}$ אמוניה
| VSEPR | $\ce{AX_3E}$ |
|---|---|
| Geometry | Trigonal Pyramidal  |
| Bond Angle | 107° |
| Name of Shape | Trigonal Pyramidal |
| Hybridization | $sp^3$ |
| Example | $\ce{NH3}$ |
$\text{AX}_2\text{E}_2$
למשל $\ce{H2O}$ מים
| VSEPR | $\ce{AX_2E_2}$ |
|---|---|
| Geometry | Bent 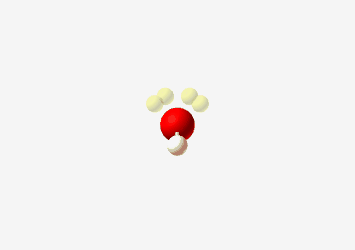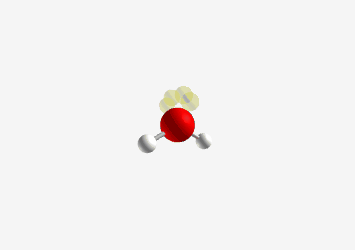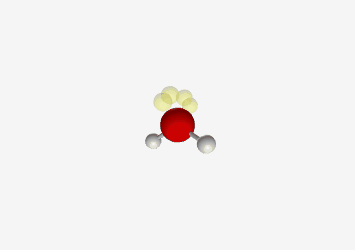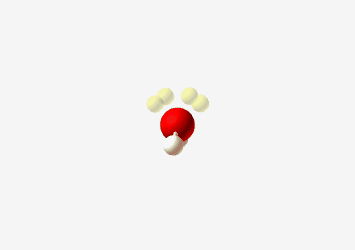 |
| Bond Angle | 104.5° |
| Name of Shape | Bent |
| Hybridization | $sp^3$ |
| Example | $\ce{H2O}$ |
שאלה ממבחן
לאיזה מהמולקולות הבאות יש אורביטל $p$ ריק?
- $\ce{BF3}$ and $\ce{NH3}$
- $\ce{(CH3)3C+}$ and $\ce{HCl}$
- $\ce{BF3}$ and $\ce{(CH3)3C+}$
- $\ce{NH3}$ and $\ce{HCl}$
- None
השאלה היא בעצם אם היסוד בהיברידיזציה של ?? כי אז יש אורביטלים שלא לוקחים חלק בקשרים.
$\ce{BF3}$ דוגמה לחריגה מכלל האוקטט.
נבחן כל תשובה
…
נבדוק את $\ce{(CH3)3C+}$
יש פחמן טעון חיובית…
ג נכון:
- $\ce{BF3}$ - יש שלושה קשרים קוולנטיים עם בורון, אבל אין לו אוקטט מלא. יש לו רק 6 אלקטרונים סביבו. לכן יש לו אורביטל $p$ ריק.
Determine the central atom C (carbon) Hybridization 1/ Valence Electorns: Carbon has 4 valance …
…
מהן סוגי האורביטלות המרכיבות כל קשר סביב האטום המסומן בתרכובת הבאה?
\[\ce{NH2CH2}\textcolor{red}{\ce{C}}\ce{CCH3}\]
- $\sigma - sp - sp^3, 1\sigma - sp - sp, \textcolor{red}{2\pi} -p-p$
- $1 \sigma - sp - sp^2 , 1 \sigma - sp - sp, 2 \pi - p - p$
קשרי $\pi$ הם באורביטלות p. קשר משולש בנוי משני קשרי $\pi$ וקשר $\sigma$. קשר משולש.
ננסה לצייר.
תחילה נפזר
שלב שני - נשלים אוקטט
Determint the central atom C (carbon) Hybridization
- Valence Electrongs: Carbon has 4 valance Electrongs
- Bont Formation: Carbon…
Resonance structures that arenot all equally contributive
Resonance Patterns
Negative Charge
עם מטען שלילי:
A non-bonding paair of Electrons
אין מטען על הפחמן אבל זוג אלקטרונים.
הזוג עובר.
הוא עובר להיות עם מטען חיובי והחבר שקיבל מטען שלילי.
A positive charge
…
דור פסקל