| Type of interference | Compounda | Target/mode of action |
|---|---|---|
| Inhibition of electron transfer |
| Inhibit cytochrome oxidase |
| Inhibition of electron transfer | Antimycin A | Blocks electron transfer from cytochrome b to cytochrome c1 |
| Inhibition of electron transfer |
| Prevent electron transfer from Fe-S center to ubiquinone |
| Inhibition of ATP synthase | Aurovertin | Inhibit F1 |
| Inhibition of ATP synthase |
| Inhibit F0 |
| Inhibition of ATP synthase | DCCD | Blocks proton flow through F0 |
| Uncoupling of phosphorylation from electron transfer |
| Hydrophobic proton carriers |
| Uncoupling of phosphorylation from electron transfer | Valinomycin | K+ ionophore |
| Uncoupling of phosphorylation from electron transfer | Uncoupling protein 1 | In brown adipose tissue, forms proton-conducting pores in inner mitochondrial membrane |
| Inhibition of ATP-ADP exchange | Atractyloside | Inhibits adenine nucleotide translocase |
תוכן עניינים:
- המשך מהשיעור הקודם - קומפלקס IV
- Respirasomes - סופר-קומפלקסים
- מסלולים נוספים להזנת אלקטרונים
- סיכום שרשרת מעבר האלקטרונים
- Malate-Aspartate Shuttle
- Glycerol-3-Phosphate Shuttle
- מה נוצר מכל התהליך הזה?
- רדיקלים חמצניים - ROS
- חמצון-חיזור (Redox) - רקע תיאורטי
- $\ce{NADH}$ ו-Flavins כנשאי אלקטרונים
- מה קורה בשרשרת מעבר האלקטרונים מבחינה אנרגטית?
- מעכבי שרשרת מעבר האלקטרונים
- הצימוד בין שרשרת מעבר האלקטרונים ל-
ATP Synthase ATP Synthase- המבנה- מנגנון הפעולה של
ATP Synthase - מנגנון ה-C-ring ויחידה a
- סיכום
- שאלות מומצאות
המשך מהשיעור הקודם - קומפלקס IV
סיימנו את השיעור הקודם עם הסכמה של קומפלקס IV. נזכיר: אנחנו בקומפלקס מספר 4, כשציטוכרום C מגיע ומעביר אלקטרונים. כל פעם הוא מעביר אלקטרון אחד, אז נדרשים ארבעה ציטוכרום C כדי להעביר ארבעה אלקטרונים.
האלקטרונים עוברים לנחושת, משם לקבוצת heme, ומשם למרכז ברזל-נחושת. יחד עם חמצן, נוצרות שתי מולקולות מים. בתהליך יש שימוש בארבעה פרוטונים מתוך המטריקס והעברה של ארבעה פרוטונים החוצה.
המשוואה הכללית של קומפלקס IV
\[\ce{4 Cyt c (reduced) + 8H+_{matrix} + O2 -> 4 Cyt c (oxidized) + 4H+_{intermembrane} + 2H2O}\]מה שחשוב להבין זה שזה תהליך - לא העברה של כל ארבעת הפרוטונים במקביל, אלא תהליך שמתרחש לאורך זמן עם כניסה של אלקטרונים ופרוטונים בשלבים.
Respirasomes - סופר-קומפלקסים
מחקרים מצאו שהקומפלקסים 1, 3 ו-4 יוצרים אינטראקציה ביניהם. קומפלקס 2 הוא בדרך כלל בודד. Respirasomes הם בעצם סופר-קומפלקסים שמכילים את קומפלקסים 1, 3 ו-4, ורואים את זה בכל מיני איזואנזימים.
ציטוכרום C עובר כמובן בדיפוזיה בין הקומפלקסים, אז לא רואים אותו כחלק מה-Respirasome.
מסלולים נוספים להזנת אלקטרונים
המסלול “הקנוני” של שרשרת מעבר האלקטרונים (ETC) מוזן בעיקר על ידי NADH (קומפלקס I) ועל ידי FADH₂ דרך סוקצינאט דהידרוגנאז (קומפלקס II). אבל יש גם מסלולים נוספים שמכניסים אלקטרונים לשרשרת לשרשרת מעבר האלקטרונים - וברובם, האלקטרונים נכנסים דרך מאגר היוביקווינון (Q pool), כלומר, מחזרים Ubiquinone (Q) ל־Ubiquinol (QH₂) ולעיתים “מדלגים” על קומפלקס I.
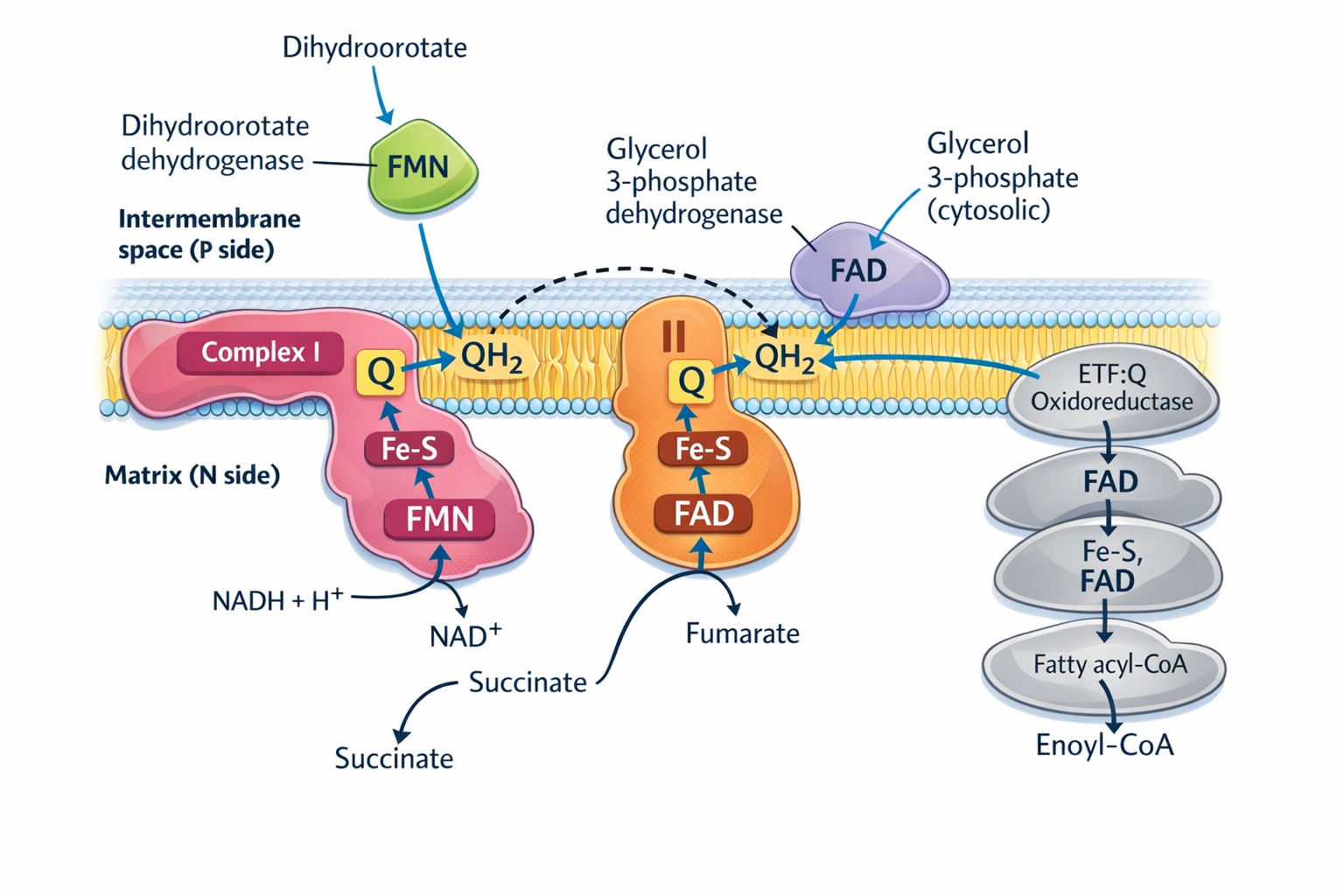
β-oxidation של חומצות שומן דרך ETF
בשלב הראשון של β-oxidation האנזים Acyl-CoA Dehydrogenase מחמצן Fatty Acyl-CoA ומעביר את האלקטרונים ל־ETF (Electron Transfer Flavoprotein) - נשא אלקטרונים שהוא פלאבופרוטאין עם FAD.
ה־ETF מעביר את האלקטרונים ל־ETF:Q Oxidoreductase, שמוסר אותם ל־Ubiquinone (Q) וכך נוצר Ubiquinol (QH₂).
שורה תחתונה: β-oxidation מזינה את השרשרת על ידי יצירת QH₂ דרך:
גליצרול-3-פוספט
גליצרול-3-פוספט יכול להגיע:
- מהגליקוליזה (באמצעות המעבר
DHAP ↔ גליצרול-3-פוספט), - וגם מפירוק טריגליצרידים.
הוא מתחמצן על ידי Glycerol-3-Phosphate Dehydrogenase (אנזים צמוד לממברנת המיטוכונדריה), וכך האלקטרונים עוברים ל־Ubiquinone (Q) ומחזרים אותו ל־Ubiquinol (QH₂).
שורה תחתונה: גליצרול-3-פוספט “שופך” אלקטרונים ישירות ל־Q pool ומייצר QH₂.
DHODH (Dihydroorotate Dehydrogenase)
DHODH הוא אנזים במסלול סינתזת פירימידינים (לבניית בסיסים ל־DNA ול־RNA). גם הוא מסוגל להעביר אלקטרונים ל־Ubiquinone (Q), ולכן תורם ליצירת QH₂.
שורה תחתונה: גם מסלול סינתזת פירימידינים מתחבר ל־ETC דרך Q.
מה העיקרון הכללי?
יש שלושה מסלולים נוספים שמזינים את שרשרת מעבר האלקטרונים בכך שהם מחזרים Ubiquinone (Q) ל־Ubiquinol (QH₂).
ככה המיטוכונדריה “ממקסמת” את ניצול כוח החיזור: יותר אלקטרונים זורמים בשרשרת, נבנה מפל פרוטונים שמפעיל את ATP synthase, וכך מתאפשרת הפוספורילציה של ADP + P_i ל-ATP.
סיכום שרשרת מעבר האלקטרונים
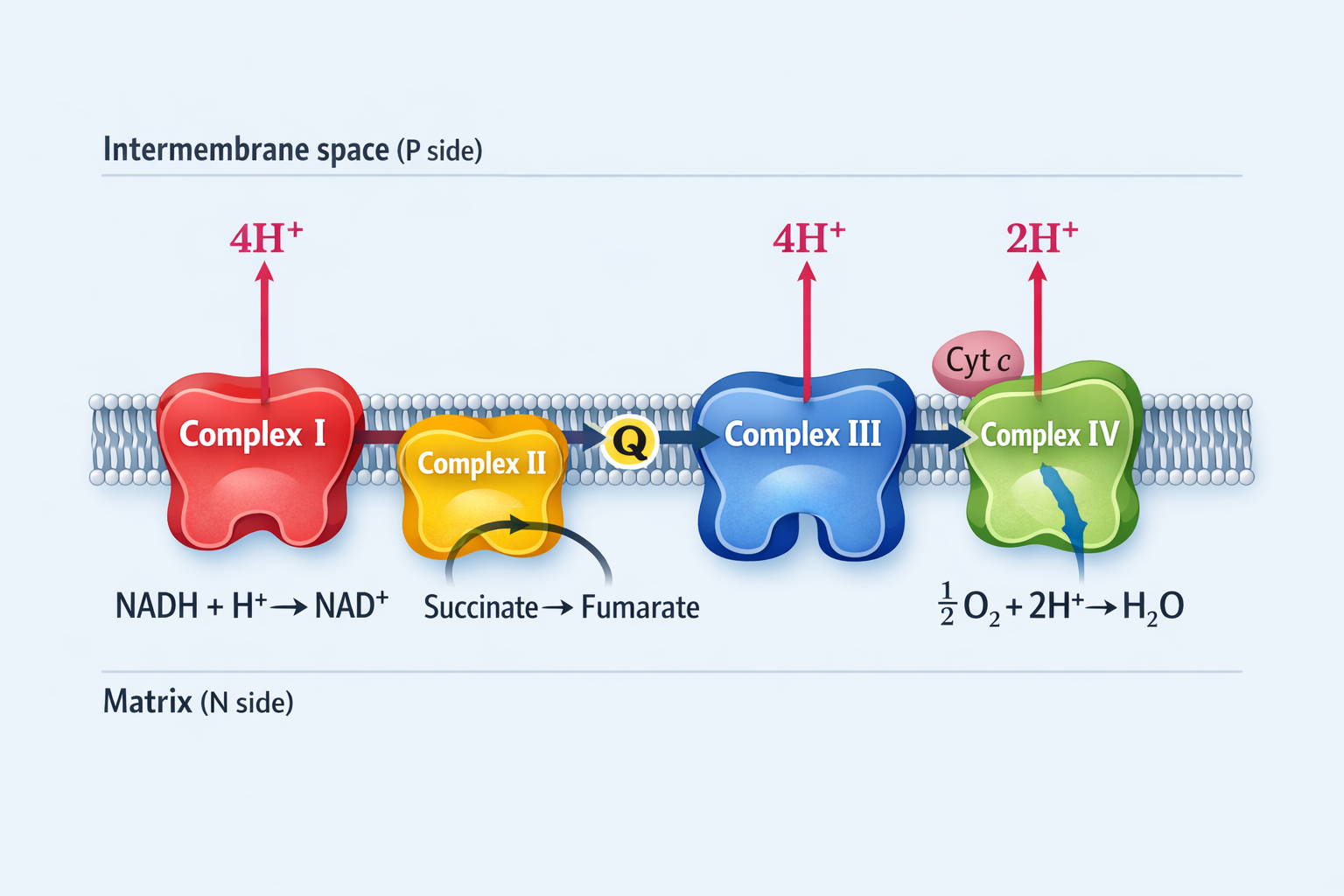
Complex I - NADH Dehydrogenase
- לוקח אלקטרונים מ-$\ce{NADH}$, הופך אותו ל-$\ce{NAD+}$
- מעביר ארבעה פרוטונים לתווך הבין-ממברנלי
- מחזר $\ce{Ubiquinone}$ ל-$\ce{Ubiquinol}$
Complex II - Succinate Dehydrogenase
- לוקח את ה-Succinate, הופך אותו ל-Fumarate
- מעביר אלקטרונים ל-$\ce{Ubiquinone}$ ← $\ce{Ubiquinol}$
- אין העברת פרוטונים!
- זה גם חלק ממעגל קרבס (יוצר $\ce{FADH2}$)
Complex III - Cytochrome bc₁ Complex
- לוקח 2 פרוטונים מהמטריקס
- מעביר יחד עם ה-$\ce{Ubiquinol}$ 4 פרוטונים החוצה
- מעגל Q - קושר פעמיים, שני אתרי קישור ל-Ubiquinone ו-Ubiquinol
Complex IV - Cytochrome c Oxidase
- מקבל אלקטרונים מציטוכרום C (אלקטרון אחד בכל פעם)
- לוקח חמצן ומחזר אותו למים
- מוציא 4-2 פרוטונים החוצה
מולקולות מקשרות
- $\ce{QH2}$ (Ubiquinol) - מסיס בליפידים, נמצא בתוך הממברנה
- ציטוכרום C - קצת מעל הממברנה, לא בתוכה
המשוואה הכללית
\[\ce{2NADH + 22H+_{matrix} + O2 -> 2NAD+ + 20H+_{intermembrane} + 2H2O}\]יש שני פרוטונים שחסרים בין המגיבים לתוצרים - הם משמשים ליצירת שתי מולקולות מים.
Malate-Aspartate Shuttle
בשיעור הקודם דיברנו על כך שבגליקוליזה נוצר $\ce{NADH}$, ואנחנו צריכים לנצל את זה גם כן. בשביל זה קיים ה-Malate-Aspartate Shuttle.
הבעיה
רוצים להעביר את כוח החיזור מהציטוזול למיטוכונדריה, כדי לנצל אותו ליצירת $\ce{ATP}$. הממברנה החיצונית של המיטוכונדריה חדירה, אבל הממברנה הפנימית בלתי חדירה - אין טרנספורטרים ל-$\ce{NADH}$ או ל-$\ce{NAD+}$.
הפתרון - השאטל
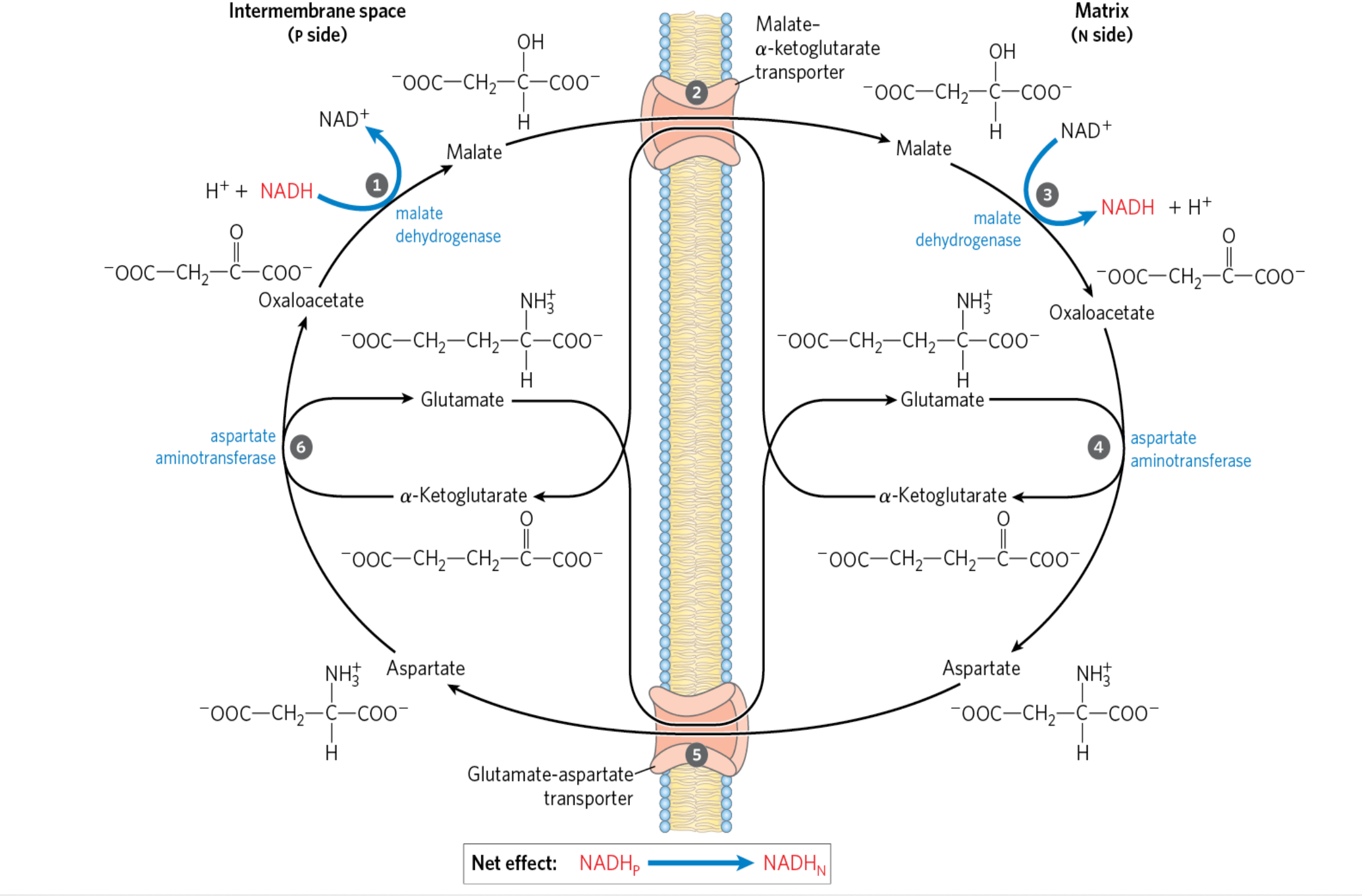
שלב 1: מתחילים עם אוקסלואצטט (מגיב ממעגל קרבס). עם ה-$\ce{NADH}$, האנזים Malate Dehydrogenase מחמצן את ה-$\ce{NADH}$ ל-$\ce{NAD+}$ והופך את האוקסלואצטט למלאט.
שלב 2: בממברנה הפנימית יש טרנספורטר Malate-α-Ketoglutarate Transporter. הוא מכניס מלאט ומוציא α-Ketoglutarate החוצה (מהמטריקס לתווך הבין-ממברנלי).
שלב 3: בתוך המטריקס, Malate Dehydrogenase (מיטוכונדריאלי) מחזר את ה-$\ce{NAD+}$ ל-$\ce{NADH}$ ומחמצן את המלאט ליצירת אוקסלואצטט. התחלנו עם אוקסלואצטט והפכנו אותו למלאט, ועכשיו הפכנו את המלאט חזרה לאוקסלואצטט.
שלב 4: למדנו בטרנסאמינציה - יש לנו את Aspartate Aminotransferase. לוקחים גלוטמט, הופכים אותו ל-α-Ketoglutarate, ויחד עם האוקסלואצטט זה הופך לאספרטט.
שלב 5: יש טרנספורטר נוסף - Glutamate-Aspartate Transporter.
שלב 6: בציטוזול, עוד פעם יש את Aspartate Aminotransferase (אותו אנזים, כיוונים הפוכים - זה תהליך רברסיבילי). לוקח את האספרטט, הופך אותו לאוקסלואצטט, תוך כדי הפיכה של α-Ketoglutarate לגלוטמט.
מה השגנו?
יש בתהליך ניצול מקסימלי של כוח החיזור ושל כל המולקולות, והן משחקות את הטרנסאמינאזות. הכנסנו את כוח החיזור - לא את ה-$\ce{NADH}$ עצמו, אלא את הכוח המחזר. זו המטרה המרכזית.
השאטל הזה נמצא בלב, בכליות ובכבד.
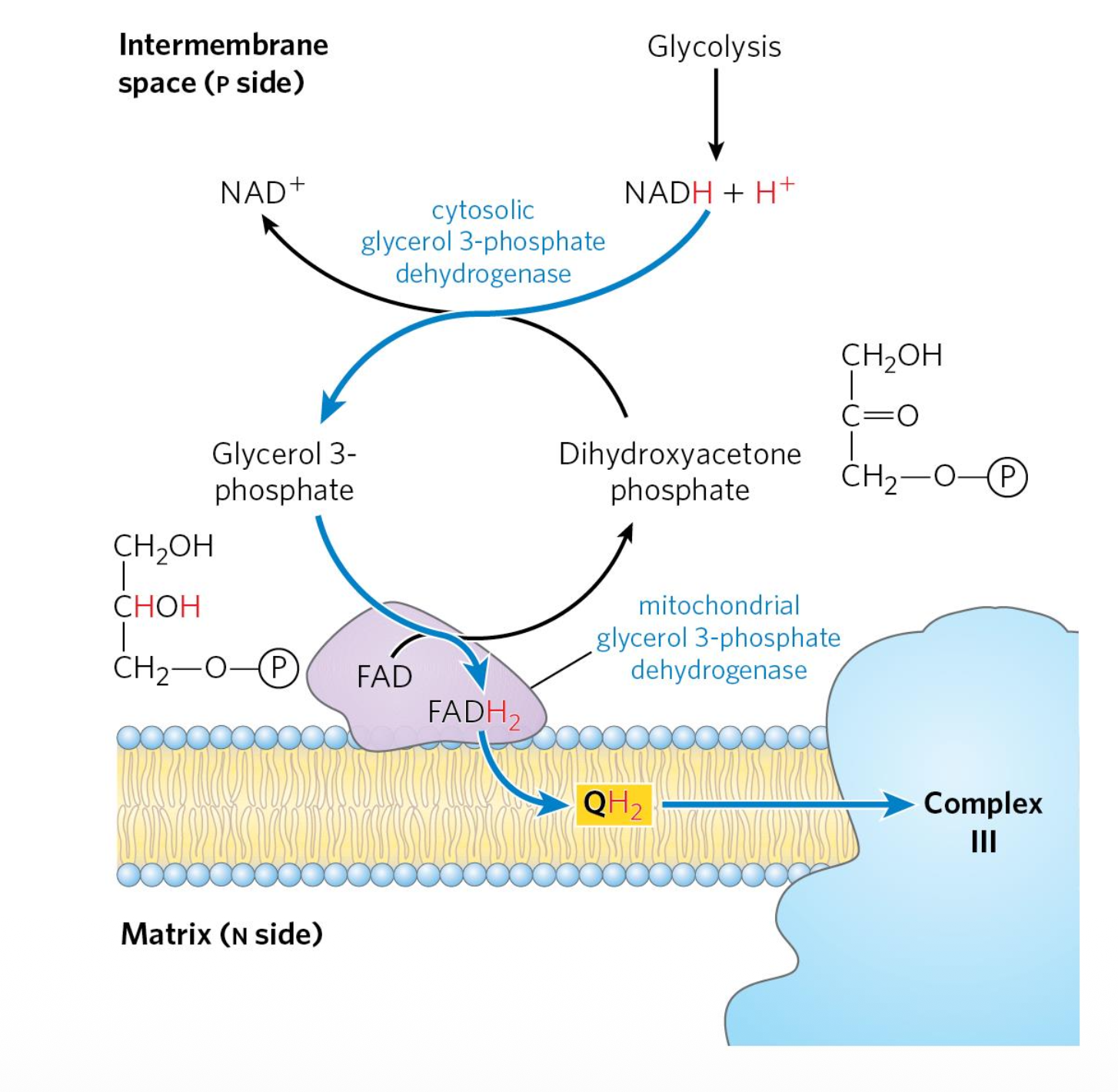
Glycerol-3-Phosphate Shuttle
בשרירים ובמוח יש שאטל דומה שנקרא Glycerol-3-Phosphate Shuttle.
במהלך גליקוליזה יש לנו $\ce{NADH}$ ועוד פרוטון. האנזים Glycerol-3-Phosphate Dehydrogenase (ציטוזולי) לוקח את ה-$\ce{NADH}$ מגליקוליזה, ויחד עם Dihydroxyacetone Phosphate (DHAP) הופך אותו לGlycerol-3-Phosphate, תוך חמצון של ה-$\ce{NADH}$ ל-$\ce{NAD+}$.
ואז יש אנזים שנקרא Glycerol-3-Phosphate Dehydrogenase (מיטוכונדריאלי, על הממברנה) - שימו לב, זה ציטוזולי וזה מיטוכונדריאלי. יש לו קבוצת $\ce{FAD}$, הוא לוקח את ה-Glycerol-3-Phosphate ויוצר $\ce{Ubiquinol}$ שמשמש להזנה של קומפלקס III.
מה נוצר מכל התהליך הזה?
כל הזמן דוחפים פרוטונים החוצה, ונוצרים שני סוגים של כוחות שדוחפים את המערכת:
1. פוטנציאל כימי (מפל ריכוזים)
העברנו פרוטונים, יש ריכוז מאוד גבוה של פרוטונים בתווך הבין-ממברנלי לעומת מה שקורה בתוך המטריקס. לכן יש שיפוע אנרגטי להיכנס לתוך המטריקס.
2. פוטנציאל חשמלי (מתח)
הפרוטונים הם מטען חיובי, והמטריקס הוא שלילי (N-side = Negative side), בעוד התווך הבין-ממברנלי הוא חיובי (P-side = Positive side).
הגוף מנצל את מה שנקרא Proton Motive Force - הכוח של הפרוטונים - כדי ליצור עבודה, וזה ה-ATP Synthase.
רדיקלים חמצניים - ROS
חשוב לציין שבמסגרת שרשרת מעבר האלקטרונים, נוצרים רדיקלים חמצניים (Reactive Oxygen Species - ROS), במיוחד כשיש חיזור לא מבוקר של חמצן.
באזור של ה-Ubiquinol יש יצירה מרובה של רדיקלים. באופן קבוע, יש רמה נמוכה שאמורה לשמש גם כאיתות, ולגוף יש דרך לטפל באותם רדיקלים.
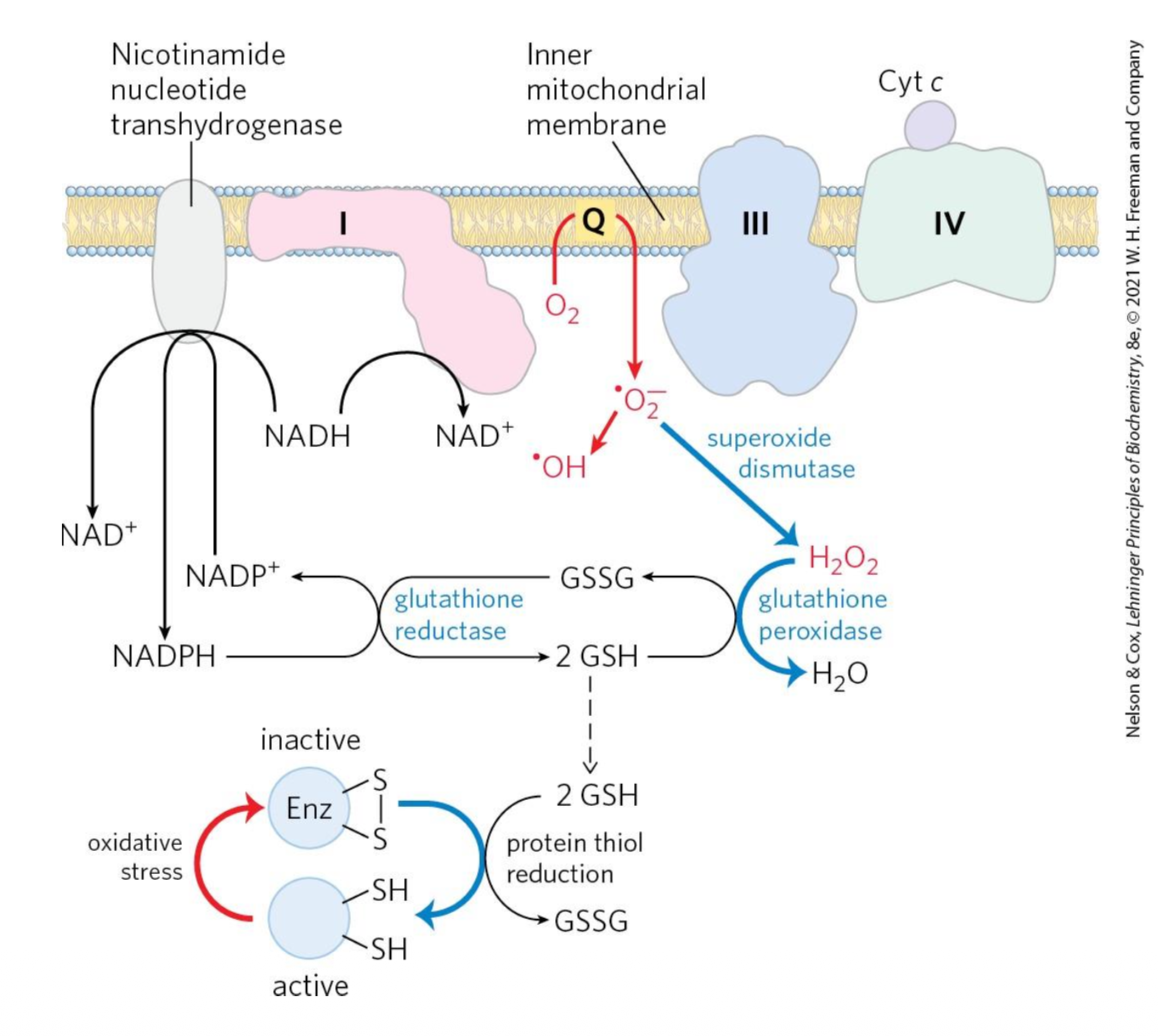
מערכת ההגנה
Superoxide Dismutase (SOD) לוקח רדיקלים חמצניים ויוצר מי חמצן ($\ce{H2O2}$).
Glutathione Peroxidase - נפגשנו איתו כבר - לוקח את מי החמצן והופך אותם למים. בתהליך הזה הוא מחמצן את ה-Glutathione.
Glutathione Reductase מחזר את ה-Glutathione המחומצן על ידי $\ce{NADPH}$.
מאיפה מגיע ה-$\ce{NADPH}$? חזרנו על מעגל הפנטוזות - זה מה שמשמש ל-$\ce{NADPH}$ כדי לחזר את ה-Glutathione, שאחר כך שומר לנו על הסביבה המחוזרת בתא.
NNT - Nicotinamide Nucleotide Transhydrogenase
יש גם אנזים שנקרא NNT שמנצל את מפל הפרוטונים. הוא מחמצן $\ce{NADH}$ ל-$\ce{NAD+}$, ובמקביל מחזר $\ce{NADP+}$ ל-$\ce{NADPH}$. אנחנו צריכים את ה-$\ce{NADPH}$ להגן על התא.
חמצון-חיזור (Redox) - רקע תיאורטי
כשמדברים על חמצון-חיזור, למעשה מדברים על מעבר של אלקטרונים.
- חמצון = איבוד אלקטרונים
- חיזור = קבלת אלקטרונים
- המחזר עובר חמצון (הוא תורם אלקטרונים)
- המחמצן עובר חיזור (הוא מקבל אלקטרונים)
דוגמה עם ברזל ונחושת
\[\ce{Fe^{2+} -> Fe^{3+} + e^-}\]הברזל איבד אלקטרון, אז המצב היוני יותר חיובי - הוא עבר חמצון.
\[\ce{Cu^{2+} + e^- -> Cu^+}\]הנחושת קיבלה אלקטרון - היא עברה חיזור.
רמות חמצון של פחמן
לכל אטום יש אלקטרושליליות שונה. הסדר הוא: חמצן > חנקן > פחמן > מימן.
כשמסתכלים על מתאן ($\ce{CH4}$), האלקטרונים שייכים לפחמן כי הפחמן יותר אלקטרושלילי מהמימן. ככל שמוסיפים קשרים עם חמצן (שהוא יותר אלקטרושלילי), הפחמן מאבד שליטה על האלקטרונים - הוא נהיה יותר מחומצן.
הצורה הכי מחומצנת של פחמן היא $\ce{CO2}$ - שם כל האלקטרונים נמשכים לחמצנים.
דרכים להעביר אלקטרונים בתא
- אלקטרונים ישירות - קופצים ממולקולה למולקולה
- מימן - העברת אטום מימן (פרוטון + אלקטרון)
- הידריד - $\ce{H^-}$ = פרוטון + שני אלקטרונים (רלוונטי ל-$\ce{NADH}$)
- עם חמצן - הוספת חמצן למולקולה
פוטנציאל חיזור
פוטנציאל החיזור ($E°$) זה האפיניות של האטומים לאלקטרונים. מדדו את זה ברמה הניסויית עם שתי כוסות זכוכית (ביקרים) ובדקו לאן האלקטרונים עוברים.
חשוב: הפוטנציאל הסטנדרטי נמדד ב-pH 0, אבל בתאים זה תלוי גם בריכוזים וב-pH, לפי משוואת נרנסט.
ככל שהפוטנציאל יותר שלילי - המולקולה נוטה לתרום אלקטרונים. ככל שהפוטנציאל יותר חיובי - המולקולה נוטה לקבל אלקטרונים.
$\ce{NADH}$ ו-Flavins כנשאי אלקטרונים
$\ce{NAD+}$ / $\ce{NADH}$
\[\ce{NAD+ + 2e^- + H+ -> NADH}\]ה-$\ce{NAD+}$ קושר הידריד (מימן אחד ושני אלקטרונים) ומשחרר פרוטון לתמיסה. אפשר לזהות את ההבדל בין $\ce{NADH}$ ל-$\ce{NAD+}$ על ידי בליעה - ל-$\ce{NADH}$ יש פיק ב-$340 \, \mathrm{nm (UV)}$.
$\ce{FAD}$ / $\ce{FMN}$ (Flavins)
בניגוד ל-$\ce{NADH}$, הפלאבינים יכולים ליצור רדיקל - הם יכולים לקבל רק אלקטרון אחד!
\[\ce{FAD + e^- -> FAD^. (semiquinone)}\] \[\ce{FAD^. + e^- + 2H+ -> FADH2}\]הנקודה מסמנת שזה רדיקל. אפשר עם מימן או בלי מימן. בסוף, עם שני אלקטרונים, מקבלים $\ce{FADH2}$.
נקודה חשובה: פוטנציאל החיזור של $\ce{FAD}$ מאוד תלוי באינטראקציה שלו עם החלבון שאליו הוא קשור. זו קבוצה פרוסתטית שמושפעת מהאינטראקציה.
מה קורה בשרשרת מעבר האלקטרונים מבחינה אנרגטית?
אם נסתכל על גרף של אנרגיה חופשית לעומת רמות אלקטרושליליות, נראה שלוקחים את ה-$\ce{NADH}$ ויש לנו פשוט כמו מגלשה של מעבר אלקטרונים, שלב אחרי שלב, לכיוון קומפלקס IV, שבסופו של דבר גורם לחיזור של חמצן למים.
מעכבי שרשרת מעבר האלקטרונים
יש בספר טבלה של מעכבים (Agents that Inhibit Oxidative Phosphorylation). דיברנו בשיעור הקודם על מעכבים של קומפלקס 1 (Rotenone, Amytal, Piericidin A, Myxothiazol).
ציאניד - חוסם את המעבר מציטוכרום אוקסידאז (קומפלקס IV) לחמצן. כשמוסיפים ציאניד רואים ירידה בצריכת חמצן וביצור $\ce{ATP}$.
טבלה 19-4: מעכבים של שרשרת מעבר האלקטרונים
הצימוד בין שרשרת מעבר האלקטרונים ל-ATP Synthase
חשוב להבין שקיים צימוד (Coupling) בין הפעילות של ATP Synthase לשרשרת מעבר האלקטרונים:
- כדי שה-
ATP Synthaseיעבוד, שרשרת מעבר האלקטרונים נדרשת לשם יצירת מפל הפרוטונים - כדי ששרשרת מעבר האלקטרונים תעבוד, צריכים גם כן ליצור $\ce{ATP}$ - אם לא, יהיה שיווי משקל ולא יהיה מניע להמשיך את התהליך.
ניסויים להבנת הצימוד
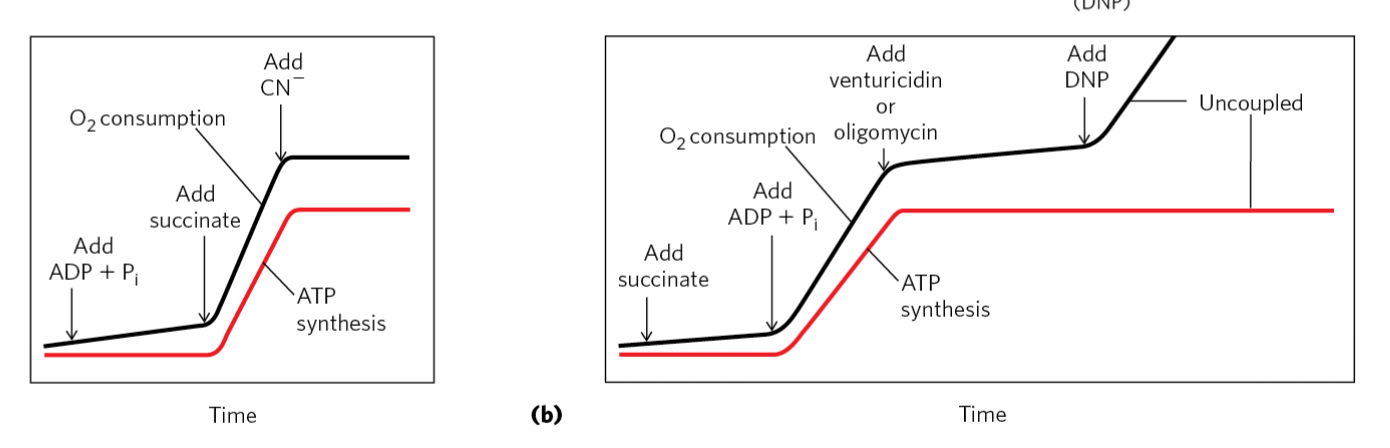
בניסויים, כשמוסיפים $\ce{ADP}$ + פוספט אורגני (הסובסטרטים לתהליך), לא נוצר כלל $\ce{ATP}$ ויש עלייה מינימלית בלבד בצריכת חמצן.
כשמוסיפים Succinate (סובסטרט לקומפלקס 2), רואים פתאום צריכה מוגברת של חמצן תוך כדי יצירה של $\ce{ATP}$.
כשמוסיפים Oligomycin או Venturicidin (חוסמים את ה-ATP Synthase), יש ירידה גם בצריכת החמצן וגם בייצור $\ce{ATP}$ - כי יש צימוד! חסמנו את ה-ATP Synthase, אבל בגלל הצימוד גם שרשרת מעבר האלקטרונים עוצרת.
| תנאי | צריכת $\ce{O2}$ | ייצור $\ce{ATP}$ | הסבר |
|---|---|---|---|
| ללא סובסטרט | זניחה | זניח | אין מקור אלקטרונים |
| הוספת Succinate | עולה | עולה | סובסטרט לקומפלקס II ← שרשרת עובדת ← $\ce{ATP}$ נוצר |
| הוספת Cyanide | נעצרת | נעצר | חוסם קומפלקס IV ← אין צריכת $\ce{O2}$ ← אין גרדיאנט ← אין $\ce{ATP}$ |
| הוספת Oligomycin/Venturicidin | נעצרת | נעצר | חוסם $\ce{FO}$ ← אין ייצור $\ce{ATP}$ ← גרדיאנט גדל ← שרשרת נעצרת |
| הוספת DNP/FCCP | עולה מאוד | נעצר | פרוטונים עוברים דרך הממברנה בלי ATP Synthase ← שרשרת “רצה” בלי בלם ← אין ייצור $\ce{ATP}$ |
מפרי צימוד (Uncouplers)
מפרי צימוד הם חומרים ששוברים את הקשר בין ATP Synthase לשרשרת מעבר האלקטרונים.
כשמוסיפים DNP או FCCP, רואים עלייה בצריכת החמצן (קומפלקס IV עובד), אבל לא נוצר $\ce{ATP}$!
איך זה עובד? מפרי הצימוד האלה הם נשאי פרוטונים - הם יכולים להיכנס לממברנה ולהעביר פרוטונים פנימה, בלי לעבור דרך ה-ATP Synthase. כך שרשרת מעבר האלקטרונים יכולה לעבוד (כי יש לאן לדחוף פרוטונים), אבל לא נוצר $\ce{ATP}$.
יש גם Valinomycin שהוא סוג של יונופור - אנטיביוטיקה שמסיסה בממברנה ומאפשרת כניסה של יונים פנימה.
זה רלוונטי גם ל-Thermogenesis - ברקמת שומן חומה יש מנגנון מקביל שמאפשר כניסה של פרוטונים בלי יצירת $\ce{ATP}$, כדי לייצר חום.
| קטגוריה | דוגמאות | מנגנון פעולה |
|---|---|---|
| עיכוב שרשרת הובלת אלקטרונים | Cyanide, CO, Rotenone, Antimycin A | חוסמים קומפלקסים שונים בשרשרת |
עיכוב ATP Synthase | Oligomycin, Venturicidin, DCCD | חוסמים את $\text{F}_{\text{O}}$ או $\text{F}_1$ |
| מפרידי צימוד (Uncouplers) | DNP, FCCP | נשאי פרוטונים הידרופוביים - מעבירים $\ce{H+}$ דרך הממברנה בלי ATP Synthase |
| יונופורים | Valinomycin | מאפשר כניסת $\ce{K+}$ לממברנה, מפרק את הגרדיאנט |
| עיכוב חילוף ATP-ADP | Atractyloside | חוסם את ה-Adenine Nucleotide Translocase |
ATP Synthase - המבנה
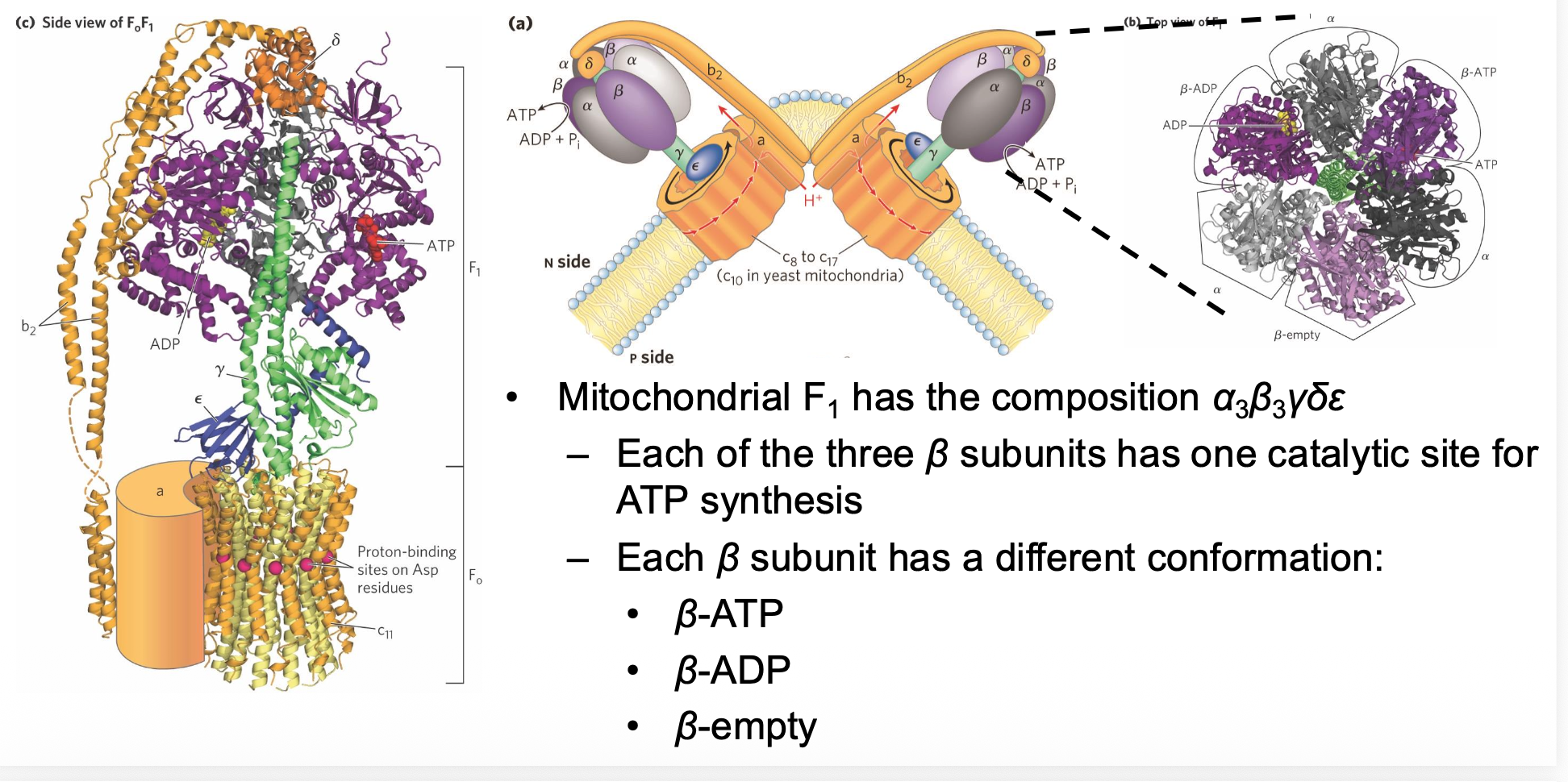
סוף סוף הגענו לקומפלקס מספר 5 - ATP Synthase!
שני החלקים העיקריים
F₀ - החלק הממברנלי
- F₀ - זה לא “F-אפס” אלא אתר קישור ל-Oligomycin (בגלל זה F-O)
- זה החלק הממברנלי
F₁ - החלק הקטליטי
- נמצא מעל הממברנה, בתוך המטריקס
- כאן מתרחשת הסינתזה של $\ce{ATP}$
מבנה F₁
F₁ בנוי מ:
- 3 יחידות α (אלפא) - תומכות מבנית, אין להן פעילות קטליטית
- 3 יחידות β (ביתא) - כאן קורה הקטליזה! כל אחת קושרת $\ce{ATP}$
- יחידת γ (גמא) - הציר המרכזי, כמו ציר של צנטריפוגה
כל יחידת β נמצאת באותו רגע במצב שונה:
- O (Open) - ריקה, לא קושרת כלום
- L (Loose) - קושרת $\ce{ADP + P_i}$
- T (Tight) - קושרת $\ce{ATP}$
לא ייתכן שברגע נתון כולן יהיו באותו מצב! שלושת המצבים תמיד קיימים במקביל.
| תת-יחידה | כמות | תפקיד |
|---|---|---|
| α (אלפא) | 3 | תמיכה מבנית, ללא פעילות קטליטית |
| β (בטא) | 3 | האתר הקטליטי - כאן נוצר ATP |
| γ (גמא) | 1 | ציר מרכזי מסתובב |
| δ (דלתא) | 1 | מחבר בין \(\text{F}_{1}\) ל- $\text{F}_{\text{O}}$ |
| ε (אפסילון) | 1 | רגולציה |
מבנה F₀ (משובץ בממברנה)

F₀ בנוי מ:
- יחידות a - שתי תת-יחידות שמאפשרות מעבר של פרוטונים מצד אחד לצד השני
- יחידות b - מחברות בין F₀ ל-F₁
- C-ring - טבעת שמורכבת מ-17-8 יחידות c (תלוי באורגניזם)
ה-C-ring הוא המפתח - הוא מאפשר את מעבר הפרוטונים למטריקס.
| תת-יחידה | כמות | תפקיד |
|---|---|---|
| a | 1 | חלבון ממברנלי, מכיל את תעלת הפרוטונים |
| b | 2 | מחברים את $\text{F}_{\text{O}}$ ל-$\text{F}_1$, יוצרים את ה-“סטטור” (החלק הקבוע) |
| c ring | 15-8 (תלוי באורגניזם) | טבעת מסתובבת, מאפשרת מעבר פרוטונים למטריקס |
הערה: בתאים אאוקריוטיים,
ATP Synthaseנמצא כדימר (שני קומפלקסים צמודים) בקצוות הקריסטות של המיטוכונדריה.
מנגנון הפעולה של ATP Synthase
עיקרון הפעולה
הסינתזה של $\ce{ATP}$ בכל אחת מתת-יחידות β נעשית בתורות. נדרשים שלושה פרוטונים ליצירת $\ce{ATP}$ אחד.
השינויים המבניים בין המצבים השונים (O, L, T) נגרמים על ידי מעבר של פרוטונים מה-F₀ ל-F₁. זה גורם לסיבוב של ה-C-ring, שמסובב את יחידת γ, וזה מוביל לשינויים מבניים בתת-יחידות α-β.
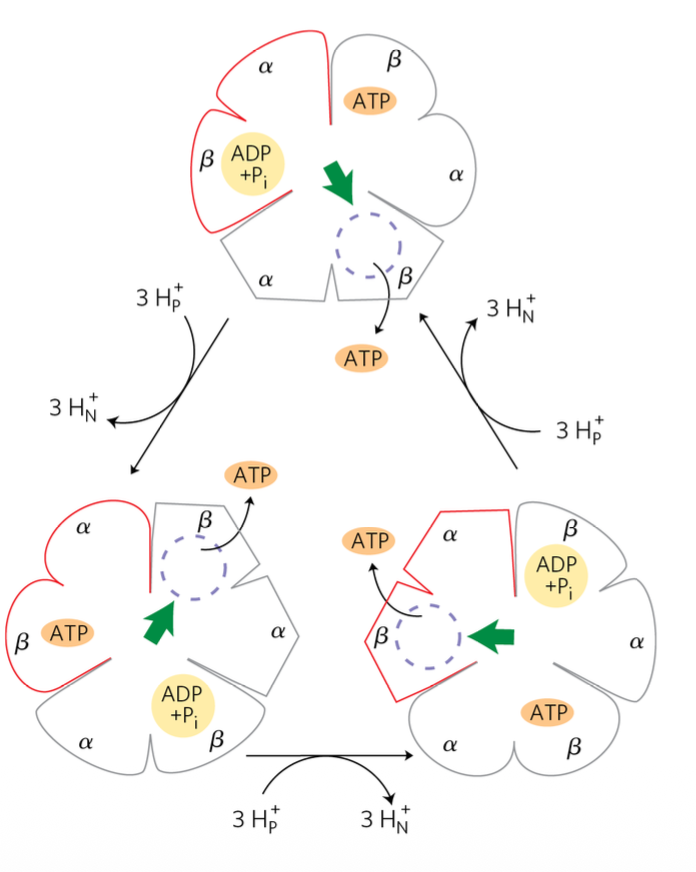
המחזור
נעקוב אחרי יחידת β אחת (האדומה):
- מצב התחלתי: יש לה $\ce{ADP + P_i}$ (מצב L - Loose, מופיע באיור למעלה).
- עוברים 3 פרוטונים ← היחידה האדומה עוברת ממצב L למצב T, נוצר $\ce{ATP}$. האחרות גם משנות מצב.
- עוד 3 פרוטונים ← היחידה האדומה משחררת את ה-$\ce{ATP}$ (עוברת למצב O). האחרות ממשיכות להסתובב.
- עוד 3 פרוטונים ← היחידה האדומה קולטת $\ce{ADP + P_i}$ חדשים (מצב L). וחוזר חלילה.
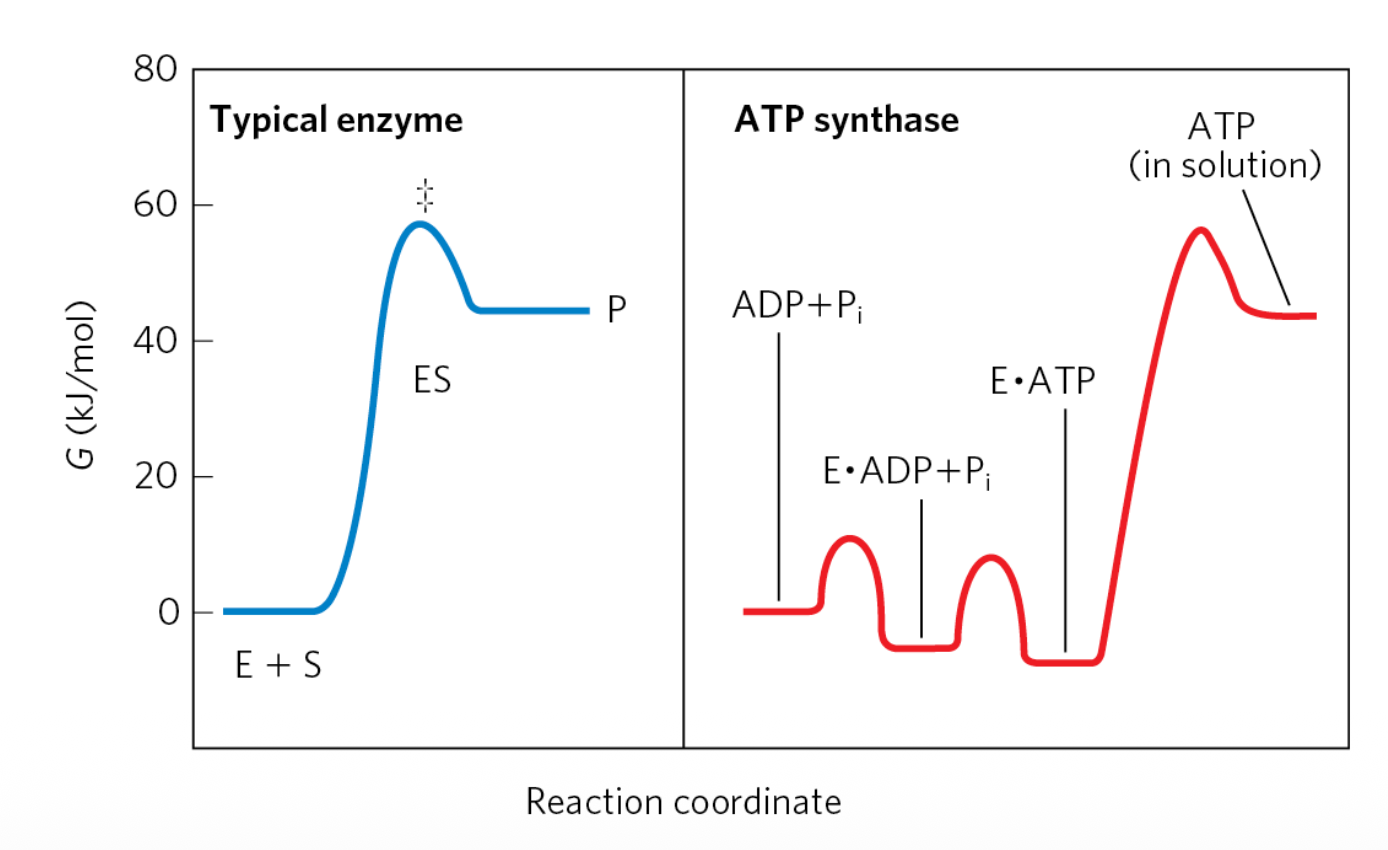
נקודה מפתיעה - המחסום האנרגטי
ב-ATP Synthase, המחסום האנרגטי המרכזי הוא לא יצירת $\ce{ATP}$, אלא השחרור שלו מהאנזים. בהיעדר מפל ריכוזים של פרוטונים, לא משתחרר $\ce{ATP}$ מה-ATP Synthase - מפל הריכוזים נדרש אפוא לשחרור ה-$\ce{ATP}$.
מנגנון ה-C-ring ויחידה a
איך עוברים הפרוטונים?
יחידות a יוצרות כמו שני חצאי תעלה - אחת מהצד החיובי (P-side) ואחת מהצד השלילי (N-side). במרכז יש את ה-C-ring.
אפשר לחשוב על זה כמו משחק ילדים - יש תעלה שעוברת בה גולה, ואז הסיבוב של ה-C-ring מעביר את הגולה לכיוון השני של התעלה השנייה. ממש כמו טורבינת מים!
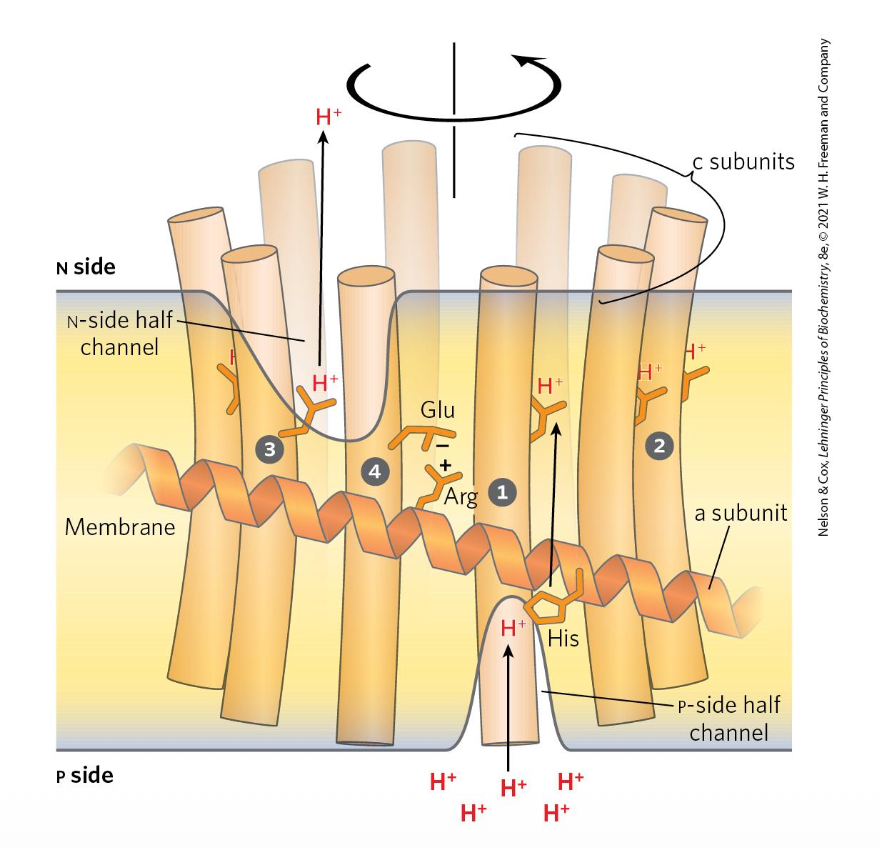
המנגנון המולקולרי
- פרוטון נכנס מה-P-side ונקשר להיסטידין על יחידת a
- הפרוטון עובר לגלוטמט (או אספרטט) על יחידת c
- הקישור גורם לאיבוד המטען השלילי של הגלוטמט
- זה מוביל לשינוי מבני - סיבוב של ה-C-ring
- כשמגיעים לצד השני (N-side), האזור יותר בסיסי
- הפרוטון משתחרר למטריקס
- התנועה נמשכת…
למה הסיבוב רק בכיוון אחד?
יש אינטראקציות אלקטרוסטטיות עם ארגינין שלילי על יחידת a. כשפרוטון נטען מצד התווך הבין-ממברנלי, ה-C-ring לא יכול להסתובב אחורה בגלל דחייה אלקטרוסטטית - זה לא נוח אנרגטית.
לעומת זאת, סיבוב בכיוון השני (נגד כיוון השעון) הוא נוח אנרגטית כי אין אינטראקציות דוחות.
בנוסף לכך, יש מפל ריכוזים שמעדיף קישור של פרוטונים מצד התווך הבין-ממברנלי ושחרור מצד המטריקס.
סיכום
בשיעור הזה כיסינו:
- השלמה של קומפלקס IV ו-Respirasomes
- מסלולים נוספים שמזינים את שרשרת מעבר האלקטרונים (ETF, Glycerol-3-P, DHODH)
- סיכום שרשרת מעבר האלקטרונים והפרוטונים שעוברים
- Malate-Aspartate Shuttle ו-Glycerol-3-Phosphate Shuttle
- הגנה מפני רדיקלים חמצניים (ROS)
- רקע על חמצון-חיזור ופוטנציאל חיזור
- הצימוד בין שרשרת מעבר האלקטרונים ל-
ATP Synthase - מפרי צימוד ומעכבים
- מבנה
ATP Synthase(F₀ ו-F₁) - מנגנון הסינתזה - קטליזה סיבובית
- מנגנון ה-C-ring והעברת פרוטונים
שאלות מומצאות
תשומת הלב שהשאלות הבאות לא בהכרח משקפות את הרמה או את התוכן שרלוונטיים למבחן, ובכל מקרה - כמו כל תוכן אחר באתר - אינן בהכרח נכונות.
שאלה 1: שאטלים להעברת כוח מחזר
מה ההבדל העיקרי בין Malate-Aspartate Shuttle לבין Glycerol-3-Phosphate Shuttle מבחינת התפוקה האנרגטית?
- שני השאטלים מעבירים אלקטרונים ישירות לקומפלקס I ולכן התפוקה זהה.
- ב-Malate-Aspartate Shuttle נוצר NADH במיטוכונדריה (נכנס לקומפלקס I), בעוד ב-Glycerol-3-Phosphate Shuttle האלקטרונים מועברים ישירות ל-Ubiquinone (עוקפים קומפלקס I) - ולכן התפוקה נמוכה יותר.
- ב-Glycerol-3-Phosphate Shuttle נוצר יותר ATP כי התהליך מהיר יותר.
- שני השאטלים מעבירים את ה-NADH עצמו למיטוכונדריה ולכן אין הבדל בתפוקה.
פתרון
התשובה הנכונה היא (2).
Malate-Aspartate Shuttle (בלב, כליות וכבד): מעביר את כוח החיזור כך שנוצר NADH במטריקס המיטוכונדריאלי. ה-NADH נכנס לקומפלקס I ומעביר 4 פרוטונים - תפוקה מקסימלית.
Glycerol-3-Phosphate Shuttle (בשרירים ובמוח): האנזים Glycerol-3-Phosphate Dehydrogenase המיטוכונדריאלי מכיל קבוצת FAD ומעביר אלקטרונים ישירות ל-Ubiquinone, תוך עקיפת קומפלקס I. לכן מועברים פחות פרוטונים ונוצר פחות ATP.
חשוב לזכור: הממברנה הפנימית של המיטוכונדריה בלתי חדירה ל-NADH - לכן צריך שאטלים בשביל להעביר את כוח החיזור, לא את המולקולה עצמה.
שאלה 2: מפרי צימוד (Uncouplers)
בניסוי מעבדה הוסיפו DNP (Dinitrophenol) למיטוכונדריות מבודדות. מה צפוי לקרות?
- ירידה בצריכת חמצן וירידה בייצור ATP.
- עלייה בצריכת חמצן ועלייה בייצור ATP.
- עלייה בצריכת חמצן וירידה/עצירה בייצור ATP.
- ירידה בצריכת חמצן ועלייה בייצור ATP.
פתרון
התשובה הנכונה היא (3).
DNP ו-FCCP הם מפרי צימוד (Uncouplers) - נשאי פרוטונים הידרופוביים שיכולים להיכנס לממברנה ולהעביר פרוטונים מהתווך הבין-ממברנלי למטריקס בלי לעבור דרך ATP Synthase.
התוצאה:
- צריכת חמצן עולה - שרשרת מעבר האלקטרונים “רצה” ללא בלם כי אין הצטברות של פרוטונים
- ייצור ATP נעצר - הפרוטונים לא עוברים דרך
ATP Synthaseאלא “דולפים” דרך הממברנה
זה ההבדל בין מפרי צימוד לבין מעכבי ATP Synthase (כמו Oligomycin) - במעכבים, גם צריכת החמצן יורדת בגלל הצימוד. במפרי צימוד, הצימוד נשבר ולכן שרשרת מעבר האלקטרונים ממשיכה לעבוד.
רלוונטיות קלינית: מנגנון דומה קיים ברקמת שומן חומה (Thermogenesis) ליצירת חום.
שאלה 3: מנגנון ATP Synthase
מהו המחסום האנרגטי העיקרי בפעילות ATP Synthase, ומדוע נדרש מפל ריכוזים של פרוטונים?
- המחסום העיקרי הוא יצירת הקשר בין ADP לפוספט, ומפל הפרוטונים מספק את האנרגיה ליצירת הקשר.
- המחסום העיקרי הוא שחרור ה-ATP מהאנזים, ומפל הפרוטונים גורם לשינויים קונפורמציוניים שמשחררים את ה-ATP.
- המחסום העיקרי הוא קישור ה-ADP לאנזים, ומפל הפרוטונים מגביר את האפיניות לסובסטרט.
- אין מחסום אנרגטי משמעותי, מפל הפרוטונים רק מאיץ תהליך ספונטני.
פתרון
התשובה הנכונה היא (2).
באופן מפתיע, המחסום האנרגטי המרכזי ב-ATP Synthase הוא לא יצירת ATP, אלא השחרור שלו מהאנזים!
מנגנון הפעולה (Binding-Change Model):
- לכל יחידת β יש שלושה מצבים: O (Open), L (Loose), T (Tight)
- מעבר של 3 פרוטונים דרך ה-C-ring גורם לסיבוב של יחידת γ
- הסיבוב גורם לשינויים קונפורמציוניים בתת-יחידות β
- יחידה במצב T (שמכילה ATP) עוברת למצב O ומשחררת את ה-ATP
בהיעדר מפל ריכוזים של פרוטונים, ה-ATP נשאר קשור לאנזים במצב T ולא משתחרר. מפל הפרוטונים מספק את האנרגיה לשינוי הקונפורמציוני שמאפשר את השחרור.