מבוא
חשיבות האלקֵנים בטבע ובתעשייה
אלקֵנים (קשרים כפולים) מהווים אבני בניין חשובות בכימיה אורגנית ובמערכות ביולוגיות. אלקֵנים, המכילים קשר $\ce{C=C}$, נמצאים בכל מקום - החל מתרכובות הטעם והריח במזון שלנו, דרך ויטמינים חיוניים לגוף, ועד לחומצות השומן הבלתי רוויות שנחוצות לתפקוד התא.
דוגמה מצוינת לחשיבות האלקֵנים היא מולקולת β-קרוטן, הפיגמנט הכתום בגזר ובירקות כתומים אחרים. β-קרוטן משמש כפרקורסור לוויטמין A במטבוליזם שלנו. כאשר הגוף מעבד β-קרוטן, הוא מבקע את המולקולה לשני חלקים וכך יוצר ויטמין A, הידוע כחיוני לתפקוד הראייה התקין. למרות שאכילת גזר רב לא תחליף משקפיים, היא אכן תורמת לבריאות העיניים דרך מנגנון ביוכימי מדויק זה.
עובדה מעניינת נוספת היא שצריכה מופרזת של מזונות עשירים בβ-קרוטן יכולה להוביל למצב הנקרא קרוטנמיה - תופעה לא מסוכנת שבה העור מקבל גוון כתום עקב הצטברות הפיגמנט ברקמות.
עקרונות יסוד בתגובות סיפוח
הגדרה ומושג בסיסי
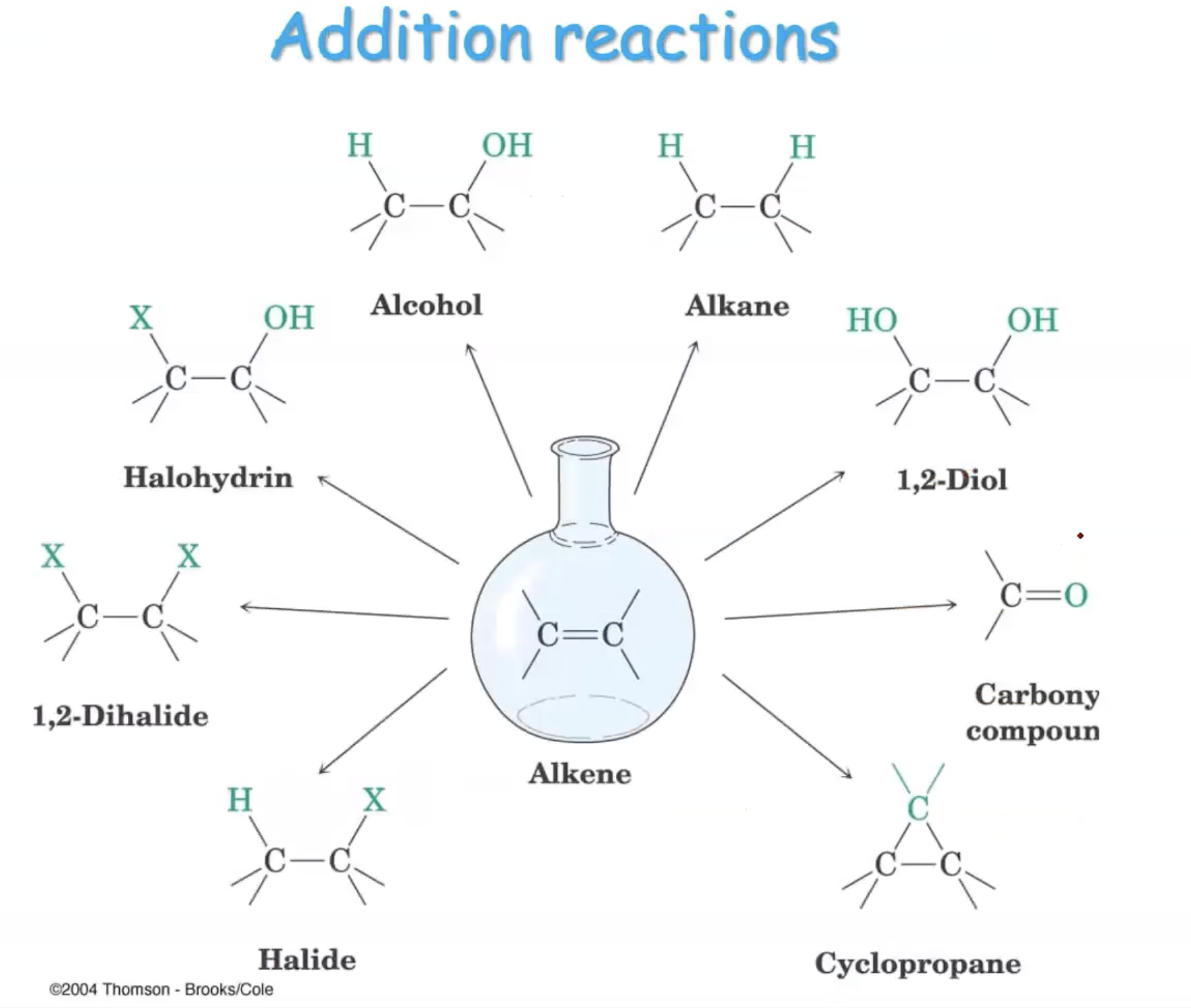
תגובת סיפוח על קשר כפול היא תהליך כימי שבו מולקולה פשוטה מתחברת לקשר $\ce{C=C}$ ויוצרת תרכובת גדולה יותר. תגובת סיפוח היא בעצם ההפך מתגובת אלמינציה - במקום ליצור קשר כפול, אנחנו “פורקים” אותו ויוצרים במקומו שני קשרים פשוטים חדשים.
המנגנון הבסיסי כולל שבירה של קשר $\pi$ (פאי) והיווצרות של שני קשרי $\sigma$ (סיגמה) חדשים. כאשר מתחילים עם אלקן ומגיבים אותו עם מולקולה מהצורה $\ce{X-Y}$, התוצאה היא מולקולה שבה $\ce{X}$ מחובר לפחמן אחד ו-$\ce{Y}$ מחובר לפחמן השני מהקשר הכפול המקורי:
\[\ce{R_1R_2C=CR_3R_4 + X-Y -> R_1R_2C(X)-C(Y)R_3R_4}\]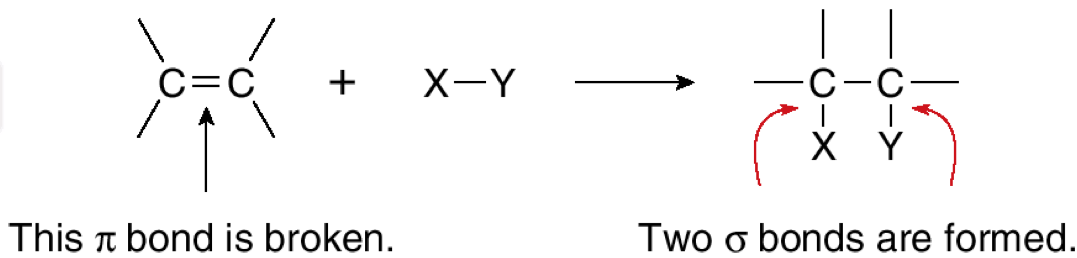
הכוח המניע - תרמודינמי
הסיבה שתגובות סיפוח מתרחשות ביעילות נעוצה ביציבות היחסית של סוגי הקשרים השונים: קשר $\sigma$ חזק יותר ויציב יותר מקשר $\pi$, מכיוון שהוא כולל חפיפה רבה יותר של האורביטלים האטומיים. כשאנחנו שוברים קשר $\pi$ אחד ויוצרים במקומו שני קשרי $\sigma$ חדשים, המערכת עוברת למצב אנרגטי נמוך יותר ויציב יותר - זה הכוח המניע התרמודינמי שמאפשר לתגובות הסיפוח להתרחש באופן ספונטני.
סטריאוכימיה של סיפוח
תגובות סיפוח יכולות להתרחש בשתי דרכים עיקריות מבחינה מרחבית:
סיפוח סין מתאפיין בהתחברות של שתי הקבוצות $\ce{X}$ ו-$\ce{Y}$ לאותו הצד של הקשר הכפול המקורי. במילים אחרות, אם נדמיין את הקשר הכפול כמישור, שתי הקבוצות הנוספות מגיעות מאותו הצד של המישור.
סיפוח אנטי מתרחש כאשר שתי הקבוצות מתחברות משני הצדדים הנגדיים של הקשר הכפול. תופעה זו משפיעה באופן משמעותי על הסטריאוכימיה של התוצר הסופי, במיוחד כאשר נוצרים מרכזים כיראליים חדשים במהלך התגובה.

הידרוגנציה קטליטית
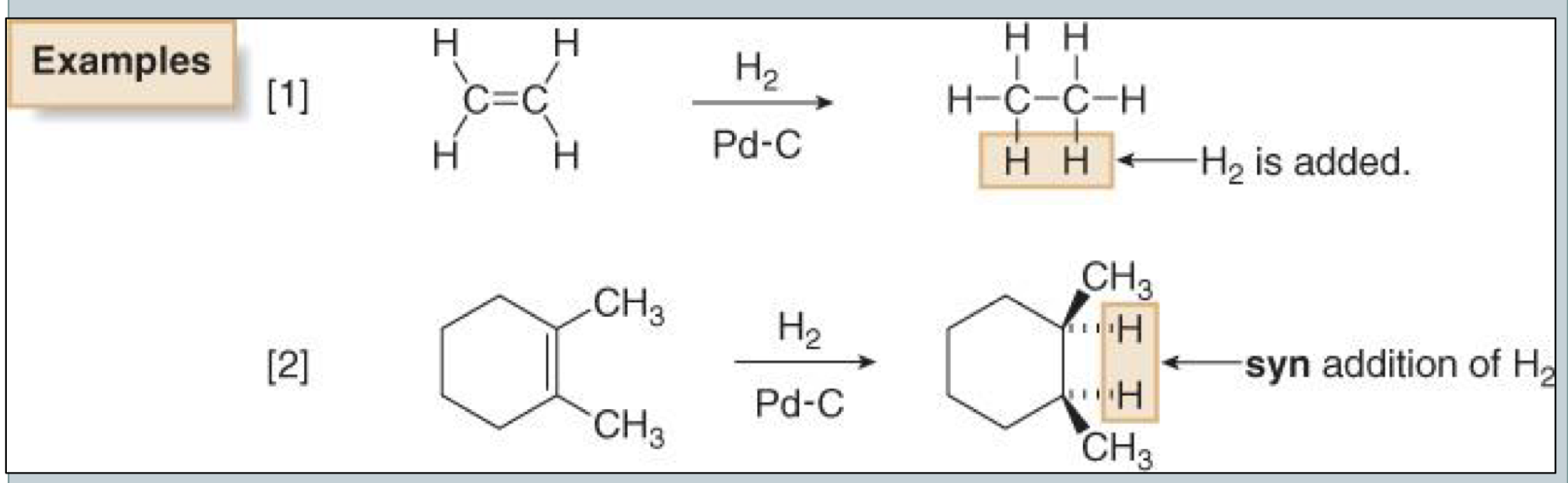
מתחילים מאַלְקֵן ומקבלים אַלְקָאן
הקשר הכפול למעשה הופך תהליך חיזור (הוספת מימן) של האַלְקֵן לאַלְקָאן.
הסיפוח הוא סין ($\textcolor{red}{syn}$) - שני אטומי המימן מתחברים לאותו הצד של הקשר הכפול המקורי.

מושג כללי ומאפיינים
הידרוגנציה קטליטית היא אחת התגובות החשובות והנפוצות ביותר בכימיה אורגנית. התגובה כוללת הוספת מולקולת מימן ($\ce{H2}$) לקשר כפול בנוכחות קטליזטור מתכתי, מה שמוביל לחיזור של האַלְקֵן לאַלְקָאן מקביל:
\[\ce{R_1R_2C=CR_3R_4 + H2 ->[metal catalyst] R_1R_2CH-CHR_3R_4}\]הידרוגנציה קטליטית מתאפיינת בסיפוח סין - שני אטומי המימן מתחברים לאותו הצד של הקשר הכפול המקורי. מאפיין זה הוא תוצאה ישירה של המנגנון הייחודי שבו מתרחשת התגובה על פני שטח המתכת.
קטליזטורים נפוצים ותכונותיהם
הקטליזטורים הנפוצים ביותר בהידרוגנציה הם מתכות מעבר הידועות ביכולתן לקשור הן מימן והן אלקֵנים על פני השטח שלהן:
פלטינה ($\ce{Pt}$) מהווה קטליזטור יעיל מאוד המסוגל לפעול בתנאי לחץ וטמפרטורה מתונים. המתכת יוצרת קשרים חזקים עם מימן ומאפשרת הידרוגנציה מהירה ויעילה.
פלדיום ($\ce{Pd}$), במיוחד כאשר הוא נישא על פחמן פעיל ($\ce{Pd/C}$), מציג יעילות גבוהה ונדיבות במגוון רחב של תנאי תגובה. הקטליזטור הזה פופולרי מאוד במעבדה ובתעשייה.
ניקל ($\ce{Ni}$), למרות שדורש תנאים קשים יותר (לחץ וטמפרטורה גבוהים), הוא זול יחסית ומשמש רבות בתהליכים תעשייתיים, במיוחד בהידרוגנציה של שמנים צמחיים.
מנגנון מולקולרי מפורט
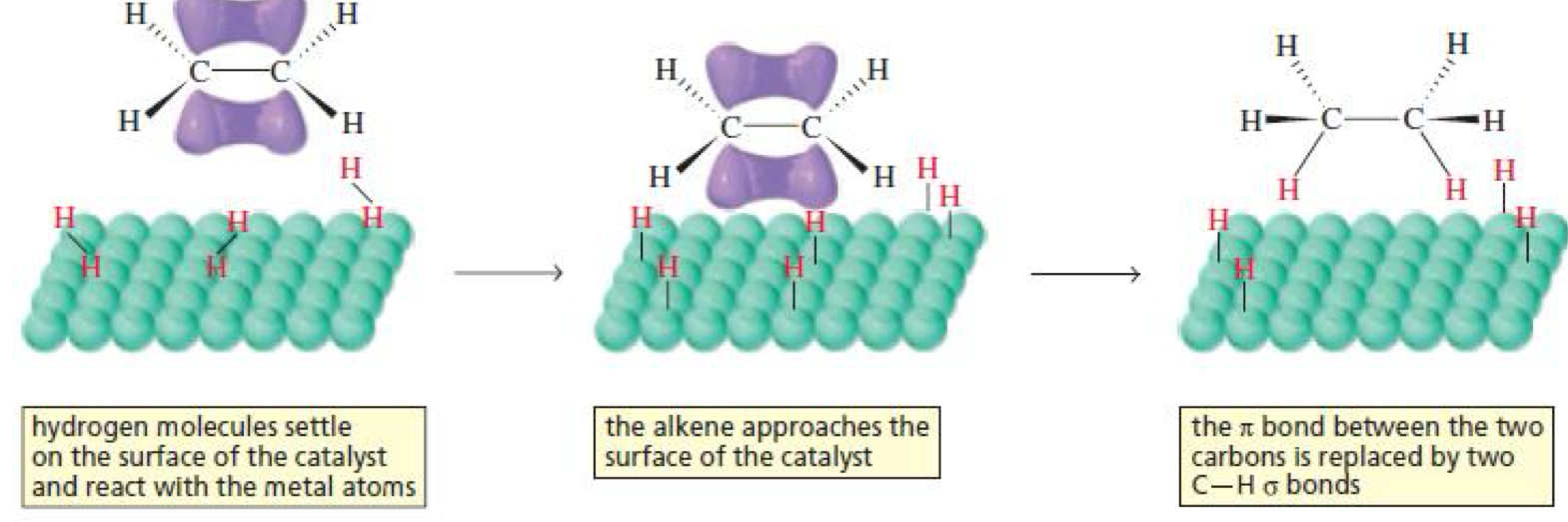
המנגנון של הידרוגנציה קטליטית מתרחש בשלבים מוגדרים על פני שטח המתכת:
בשלב הראשון מתרחשת אדסורפציה של מימן על פני שטח המתכת. מולקולת $\ce{H2}$ מתקשרת לאטומי המתכת ועוברת הומוליזה - הקשר $\ce{H-H}$ נשבר והאטומים הופכים ליונים $\ce{H^-}$ הקשורים לפני השטח. תהליך זה נקרא הפעלת מימן והוא חיוני ליעילות התגובה.
בשלב השני, מולקולת האַלְקֵן מתקרבת לפני השטח המכוסה באטומי מימן. האורביטלים $\pi$ של הקשר הכפול יוצרים אינטראקציה עם המתכת, מה שמפחית את צפיפות האלקטרונים בקשר ומכין אותו לתגובה.
השלב הסופי כולל מעבר מתואם של שני אטומי המימן מפני השטח אל שני הפחמנים של הקשר הכפול. מכיוון ששני האטומים מועברים באופן בו-זמני מאותו הצד (מפני השטח), התוצאה היא סיפוח סין.
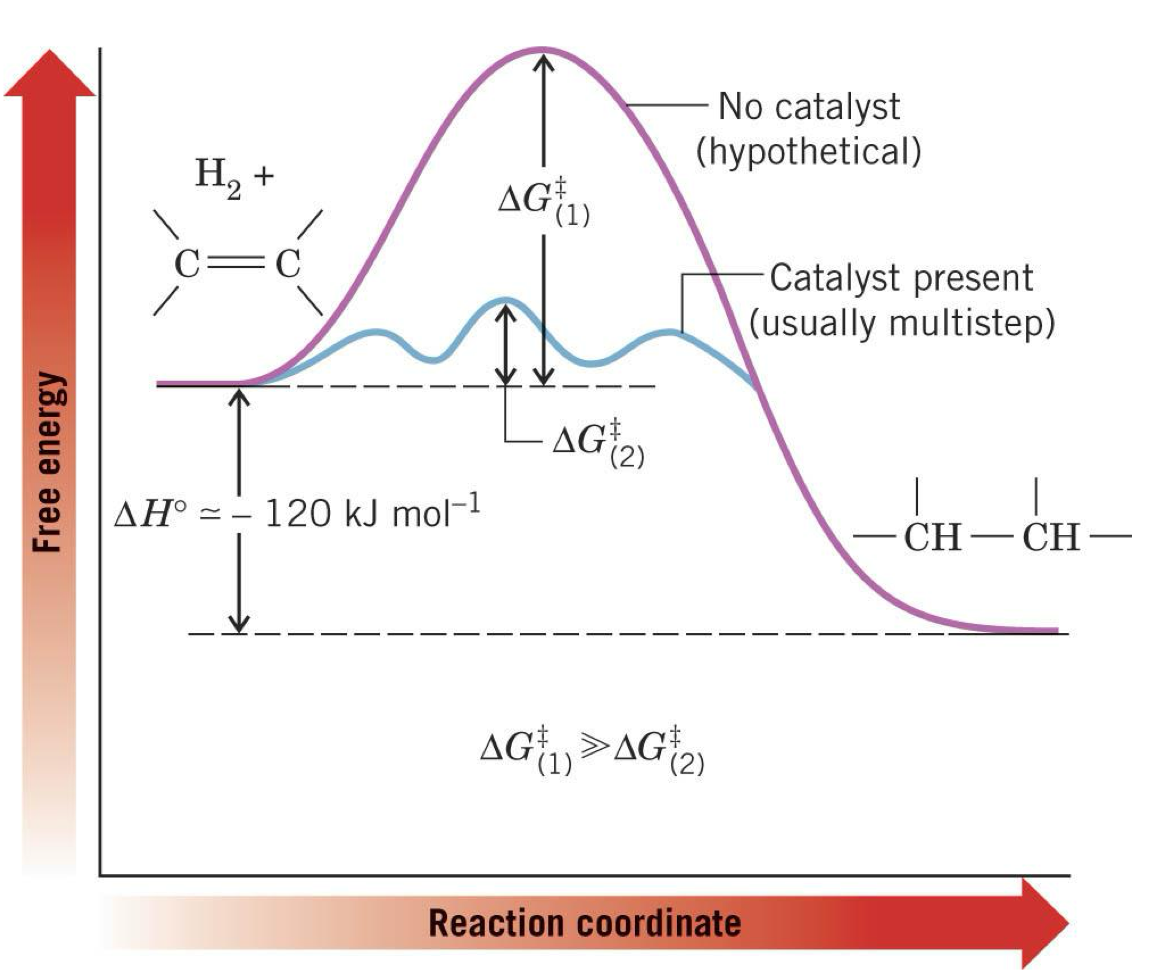
תמונה אנרגטית והשפעת הקטליזטור
השוואה בין התגובה עם ובלי קטליזטור מראה בבירור את חשיבותו. בהיעדר קטליזטור, התגובה בין אַלְקֵן למימן דורשת אנרגיית אקטיבציה גבוהה מאוד ($\Delta G^{\ddagger}$ גבוה), מה שהופך אותה לאיטית ולא מעשית בתנאים רגילים.
נוכחות הקטליזטור משנה באופן דרמטי את הפרופיל האנרגטי. המנגנון החדש, למרות שהוא מורכב יותר וכולל מספר שלבים ביניים, מציג אנרגיית אקטיבציה נמוכה משמעותית. התוצאה היא תגובה שמתרחשת במהירות ובתנאים מתונים.
סיפוח אלקטרופילי על קשרים כפולים
הטבע האלקטרוני של קשרים כפולים
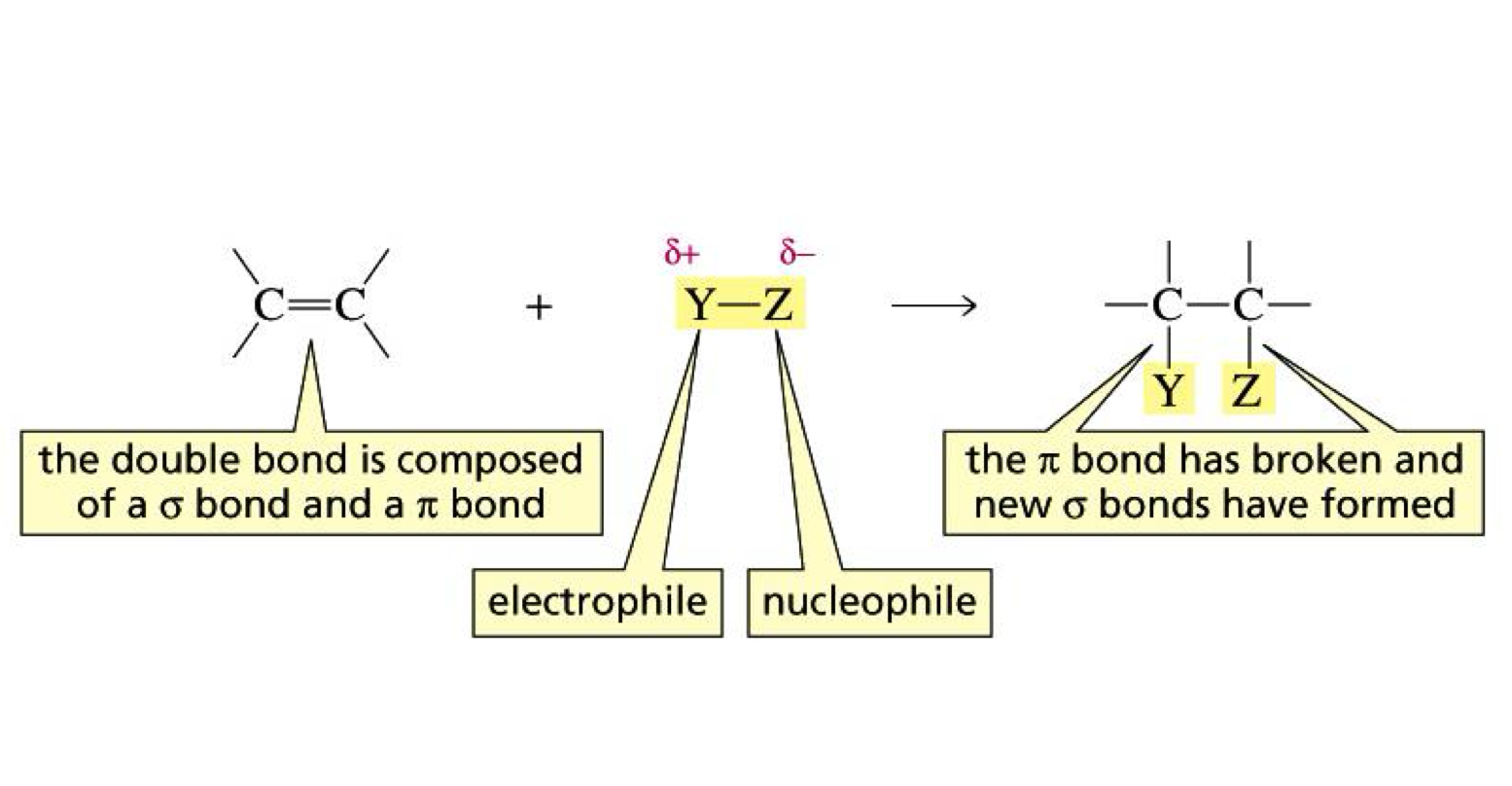
כדי להבין את התגובתיות של קשרים כפולים, חשוב לנתח את המבנה האלקטרוני שלהם. קשר כפול מורכב מקשר $\sigma$ אחד וקשר $\pi$ אחד, מה שמקנה לו צפיפות אלקטרונים גבוהה יחסית. האלקטרונים של קשר ה-$\pi$ נמצאים באורביטלים שנפרסים מעל ומתחת למישור המולקולה, מה שהופך אותם לנגישים יותר לאינטראקציות כימיות.
תכונה זו הופכת את הקשר הכפול לנוקליאופיל טבעי - חומר עשיר באלקטרונים שמסוגל לתרום צפיפות אלקטרונים לחומרים אחרים. הנוקליאופיליות הזו גדלה כאשר הקשר הכפול הוא יותר “מותמר” - כלומר, כאשר הוא מוקף בקבוצות אלקיל שתורמות צפיפות אלקטרונים לקשר הכפול דרך אפקטים אינדוקטיביים והיפר-היפר-קוניוגטיביים.
מנגנון כללי של סיפוח אלקטרופילי
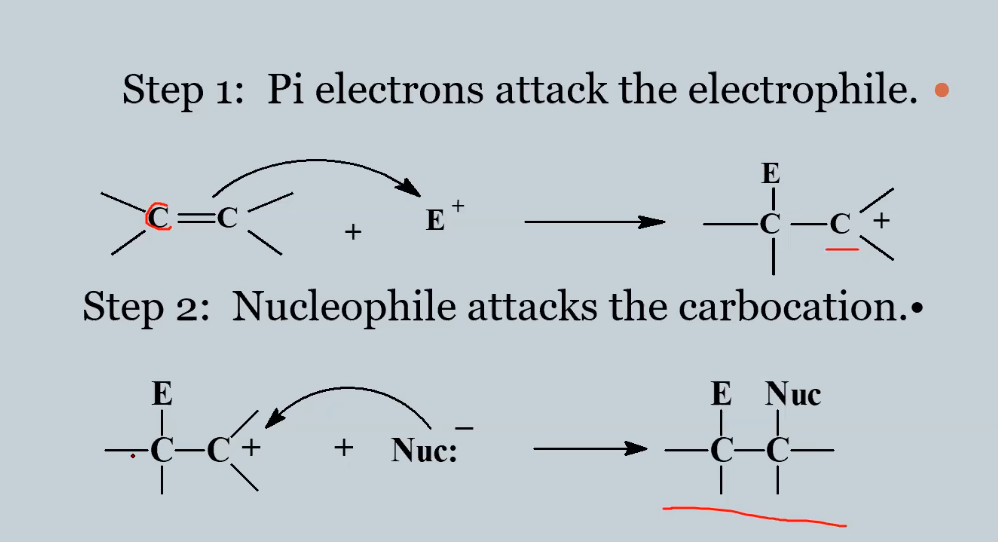
סיפוח אלקטרופילי מתרחש במנגנון דו-שלבי שמזכיר את מנגנון $\mathrm{S_\mathrm{N}1}$. הבנת הדמיון בין המנגנונים חיונית לחיזוי התוצרים והסטריאוכימיה של התגובות.
-
בשלב הראשון מתרחשת התקפה אלקטרופילית. הקשר הכפול, הפועל כנוקליאופיל, תוקף את האלקטרופיל ותורם לו צפיפות אלקטרונים. האלקטרופיל מתחבר לאחד משני הפחמנים של הקשר הכפול, בעוד שהפחמן השני הופך לקרבוקטיון. שלב זה הוא השלב קובע הקצב מכיוון שהוא כולל היווצרות של יון חיובי מאוד לא יציב.
-
השלב השני הוא התקפה נוקליאופילית. הנוקליאופיל (לעתים קרובות זהו האניון שנוצר כאשר האלקטרופיל איבד אלקטרונים בשלב הראשון) תוקף את הקרבוקטיון החיובי ויוצר את התוצר הסופי. שלב זה מהיר יחסית מכיוון שהוא כולל אינטראקציה בין מטען חיובי למטען שלילי.
המנגנון הדו-שלבי הזה מסביר מדוע התגובה רגישה לגורמים שמשפיעים על יציבות הקרבוקטיון הביניים, ומדוע הוא מציג דמיון רב למנגנון $\mathrm{S_\mathrm{N}1}$.
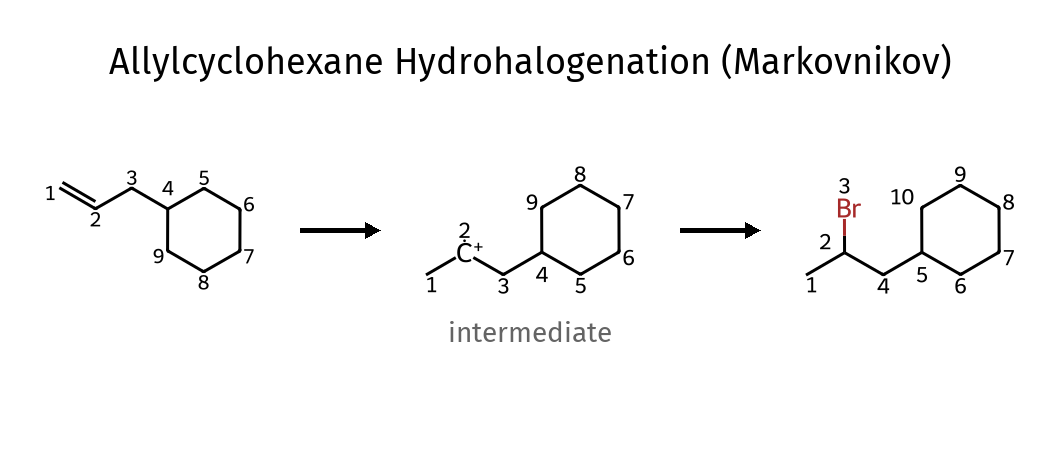
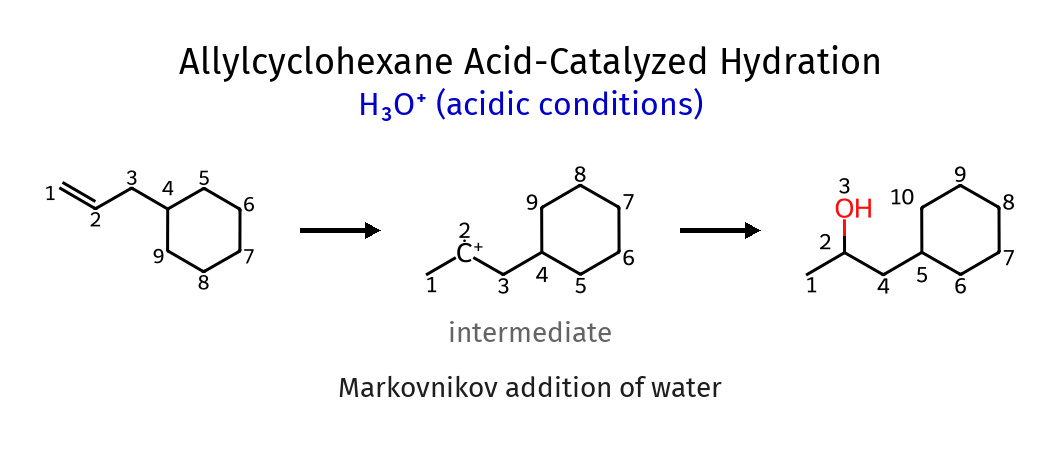
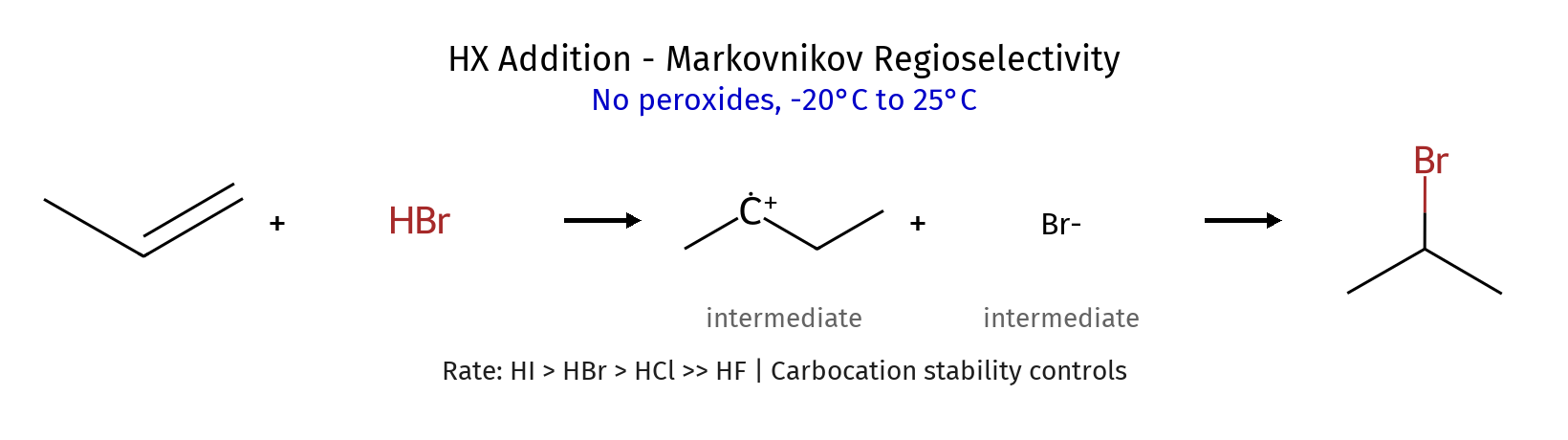
כלל מרקובניקוב ויישומיו
היסטוריה ונוסחה של הכלל
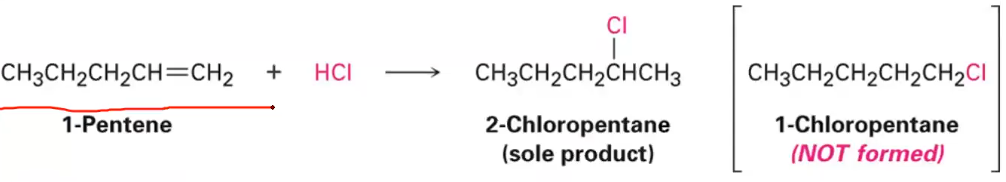
ולדימיר מרקובניקוב, כימאי רוסי מהמאה ה-19, ניסח כלל אמפירי שמנבא את הרגיוסלקטיבית בתגובות סיפוח של חומצות מימניות ($\ce{HX}$) לאַלְקֵנים לא סימטריים. הכלל קובע ש״במסגרת תגובת סיפוח של $\ce{HX}$ לאַלְקֵן, אטום המימן מתחבר לפחמן שכבר מכיל מספר רב יותר של אטומי מימן״.
במילים מדעיות מדויקות יותר: אטום המימן מתחבר לפחמן הפחות מותמר של הקשר הכפול, כך שהקרבוקטיון הביניים ייווצר על הפחמן היותר מותמר ולכן היותר יציב.
הבסיס התיאורטי לכלל
הבנת הבסיס התיאורטי לכלל מרקובניקוב נעוצה בכימיה של קרבוקטיונים ($\ce{C+}$). ידוע לנו שיציבות הקרבוקטיון גדלה עם מידת ההתמרה - כלומר, ככל שמידת ההתמרה של הקרבוקטיון עולה, כך עולה גם יציבותו.
יציבות: קרבוקטיון מתילי $\ce{CH3^+}$ < קרבוקטיון ראשוני $\ce{RCH2^+}$ < קרבוקטיון שניוני $\ce{R2CH^+}$ < קרבוקטיון שלישוני $\ce{R3C^+}$
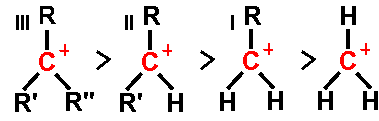
היציבות הגדולה של קרבוקטיונים מותמרים נובעת מאפקטים אלקטרוניים מגוונים. קבוצות אלקיל תורמות צפיפות אלקטרונים לפחמן החיובי דרך אפקטים אינדוקטיביים (תרומת $\sigma$-אלקטרונים) והיפר-קונגוגטיביים (חפיפה של קשרי $\ce{C-H}$ הסמוכים עם האורביטל הריק של הקרבוקטיון).
מכיוון שהיווצרות הקרבוקטיון היא השלב הקובע-קצב, המערכת “בוחרת” את המסלול שמוביל לקרבוקטיון היותר יציב, גם אם זה אומר שאטום המימן יתחבר לפחמן הפחות מותמר.
דוגמאות מפורטות
בואו נבחן את התגובה בין 2-מתיל-2-בוטן ו-$\ce{HCl}$:
\[\ce{(CH3)2C=CHCH3 + HCl -> ?}\]לפי כלל מרקובניקוב, אטום המימן יתחבר לפחמן הימני (הפחות מותמר) של הקשר הכפול, מה שיוצר קרבוקטיון שלישוני על הפחמן השמאלי. לאחר מכן, יון הכלוריד ($\ce{Cl^-}$) יתקוף את הקרבוקטיון ויווצר 2-כלורו-2-מתיל-בוטן כתוצר עיקרי:
\[\ce{(CH3)2C=CHCH3 + HCl -> (CH3)2C(Cl)-CH2CH3}\]התוצר החלופי, שבו המימן מתחבר לפחמן השמאלי והכלור לפחמן הימני, יוצר קרבוקטיון שניוני פחות יציב ולכן מהווה מסלול תגובה פחות מועדף.
סטריאוכימיה של סיפוח אלקטרופילי
היבטים מרחביים ותוצרים מרובים
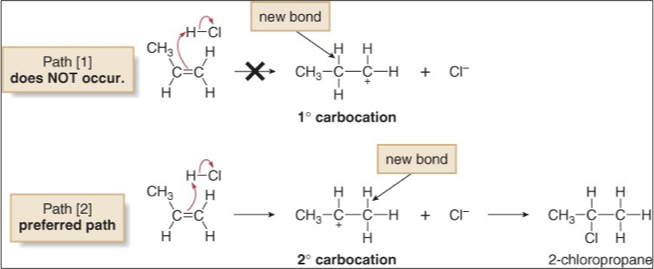
אחד האתגרים המרכזיים בהבנת תגובות סיפוח נעוץ בסטריאוכימיה שלהן. בניגוד להידרוגנציה קטליטית שמתאפיינת בסיפוח סין, סיפוח אלקטרופילי אינו מציג סלקטיביות מרחבית מוגדרת.
הסיבה לכך נעוצה במנגנון הדו-שלבי. לאחר היווצרות הקרבוקטיון בשלב הראשון, השלב השני כולל התקפה של נוקליאופיל על פחמן שהפך למישורי (היברידיזציה $sp^2$). הנוקליאופיל יכול להתקרב מכל צד של המישור, מה שמוביל לתערובת של תוצרי סיפוח סין ואנטי.
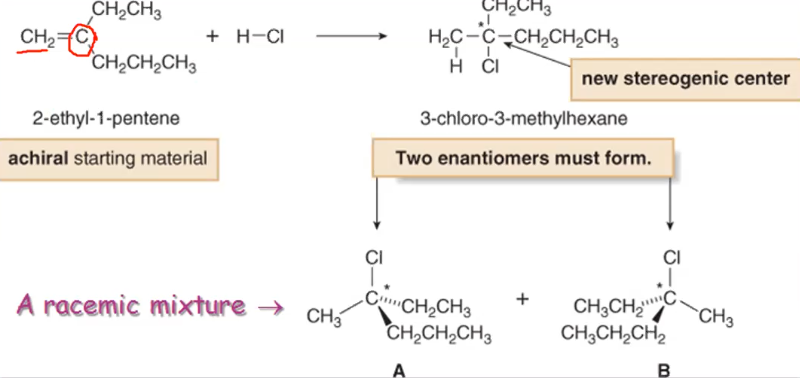
היווצרות מרכזים כיראליים ותערובות רצמיות
כאשר תגובת הסיפוח יוצרת מרכז כיראלי חדש במהלך התהליך, התוצאה היא תערובת רצמית של שני האננטיומרים. תופעה זו נובעת מהעובדה שהנוקליאופיל יכול להתקרב לקרבוקטיון המישורי משני הצדדים בהסתברות שווה.
לדוגמה, בתגובה של 1-בוטן עם $\ce{HBr}$:
\[\ce{CH3CH2CH=CH2 + HBr -> CH3CH2CHBrCH3}\]הפחמן השני בתוצר הופך לכיראלי (נושא ארבע קבוצות שונות: $\ce{H}$, $\ce{Br}$, $\ce{CH3}$, ו-$\ce{CH2CH3}$). התוצר שנוצר הוא תערובת של שני אננטיומרים בחלקים שווים - תערובת רצמית.
שחלופי קרבוקטיון ותוצרים לא צפויים
מושג השחלוף המולקולרי
אחד ההיבטים המורכבים ביותר בתגובות שכוללות קרבוקטיונים הוא האפשרות לשחלופים מולקולריים. תופעה זו, שנצפתה לראשונה בתגובות $\mathrm{S_\mathrm{N}1}$, מתרחשת גם בסיפוח אלקטרופילי וחשובה מאוד לחיזוי התוצרים הנכונים.
שחלוף 1,2 הוא הסוג הנפוץ ביותר ומתרחש כאשר קבוצה הסמוכה לקרבוקטיון (אטום מימן או קבוצת אלקיל) נודדת יחד עם זוג האלקטרונים שלה לפחמן הנושא את המטען החיובי. התוצאה היא הפיכת מיקום הקרבוקטיון ויציבותו.
מנגנון השחלוף המפורט
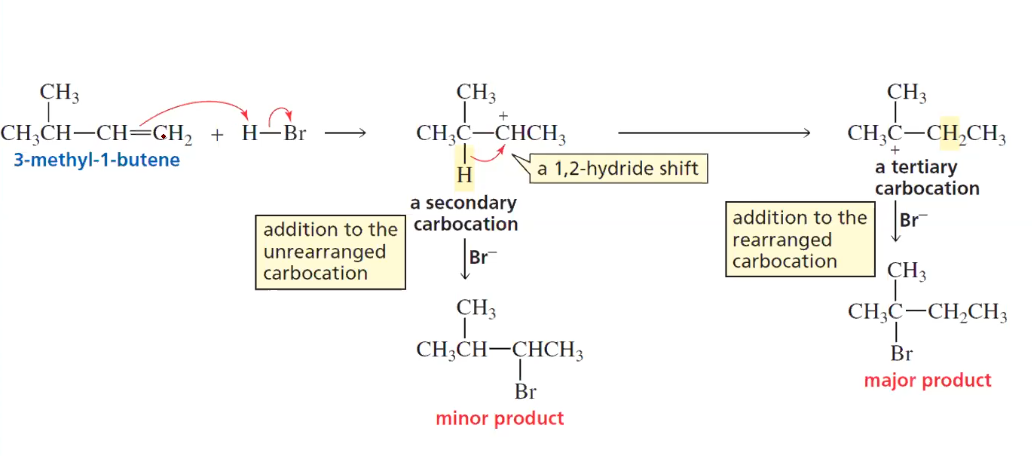
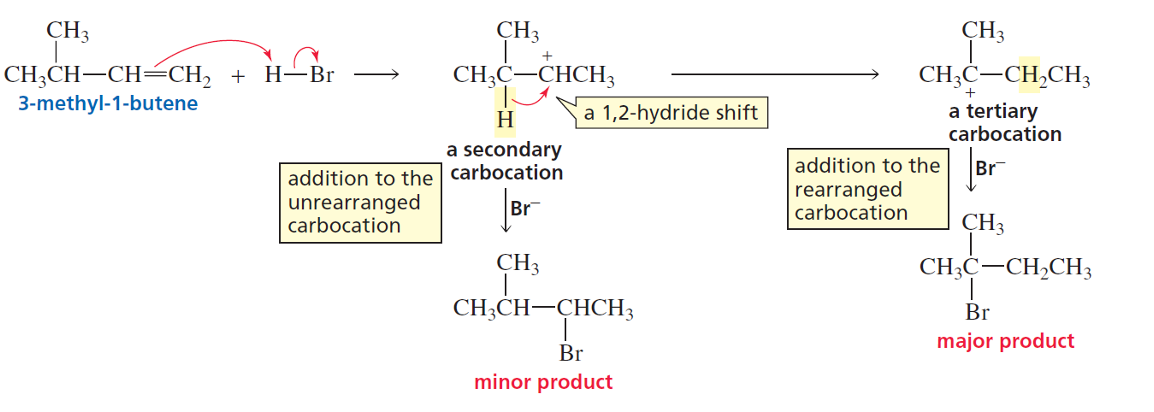
בואו נבחן דוגמה ספציפית של שחלוף בתגובת סיפוח:
כאשר 3-מתיל-1-בוטן מגיב עם $\ce{HCl}$, השלב הראשון יוצר קרבוקטיון שניוני:
\[\ce{(CH3)2CHCH2CH=CH2 + H^+ -> (CH3)2CHCH2CH2CH2^+}\]אולם, הקרבוקטיון השניוני יכול לעבור שחלוף 1,2 של אטום מימן מהפחמן השלישוני הסמוך:
\[\ce{(CH3)2CHCH2CH2CH2^+ -> (CH3)2C^+CH2CH2CH3}\]התוצאה היא קרבוקטיון שלישוני יציב יותר. הנוקליאופיל ($\ce{Cl^-}$) יתקוף את הקרבוקטיון החדש, מה שמוביל לתוצר שהוא 2-כלורו-3-מתיל-בוטן במקום התוצר “הצפוי” לפי כלל מרקובניקוב הפשוט.
חשיבות זיהוי השחלופים
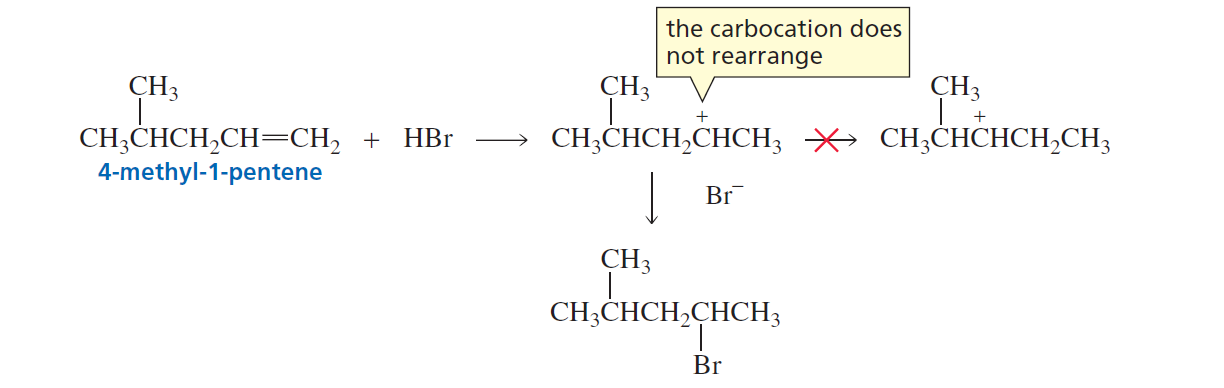
הבנה נכונה של שחלופי קרבוקטיון חיונית לפתרון בעיות בכימיה אורגנית. בכל תגובה שכוללת יצירת קרבוקטיון, חובה לבדוק:
ראשית, האם קיימת אפשרות לשחלוף שיוצר קרבוקטיון יציב יותר? אם הקרבוקטיון ההתחלתי סמוך לפחמן שלישוני או לפחמן הנושא קבוצות תורמות אלקטרונים, שחלוף כזה סביר מאוד.
שנית, מהו הקרבוקטיון היציב ביותר שניתן ליצור במערכת הנתונה? זהו הקרבוקטיון שיוביל לתוצר העיקרי של התגובה.
שלישית, מהו התוצר שנוצר מהקרבוקטיון לאחר השחלוף? זהו התוצר שיש לצפות לו במציאות, לא בהכרח התוצר הנחזה על פי כלל מרקובניקוב הפשוט.
מבוא - סקירה של תגובת הידרוהלוגנציה
בחלק הקודם למדנו על תגובת הידרוהלוגנציה - סיפוח של $\ce{HX}$ על אלקֵן:
- $\ce{H}$ נכנס לפחמן הפחות מותמר
- $\ce{X}$ נכנס לפחמן היותר מותמר
- התגובה פועלת לפי כלל מרקובניקוב
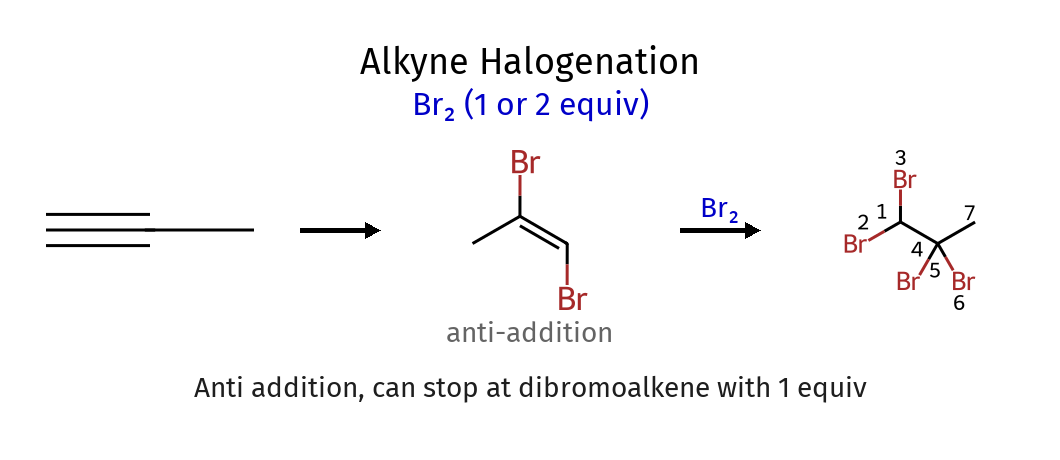
תגובת הלוגנציה (Halogenation)
הגדרה ומנגנון כללי
תגובת הלוגנציה היא תגובה שבה לוקחים אלקֵן עם $\ce{X2}$ (כאשר $\ce{X}$ הוא הלוגן), ו-$\ce{X2}$ מתפרק ונכנס לכל אחד מהפחמנים של הקשר הכפול.
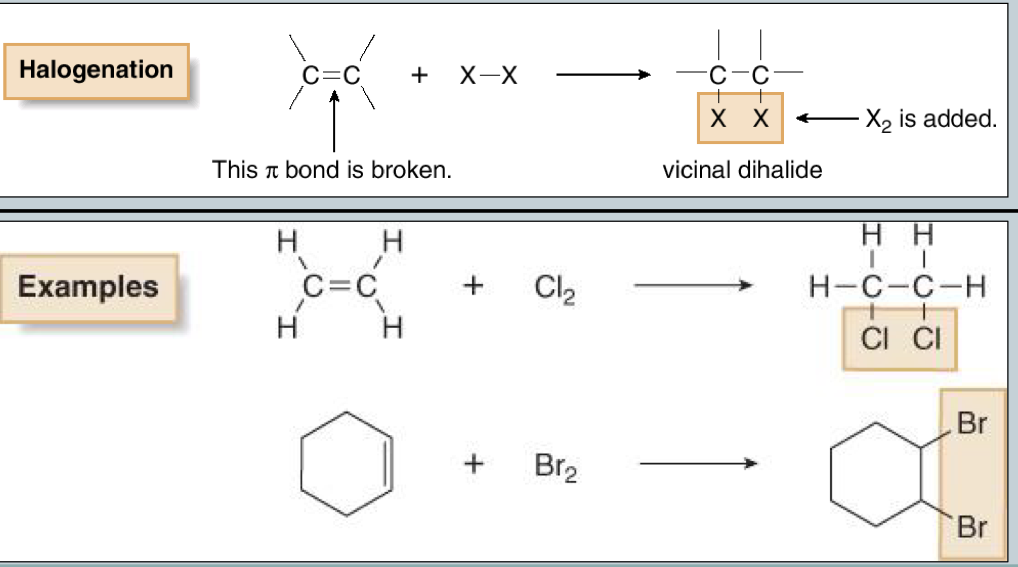
דוגמאות:
- $\ce{C2H4 + Cl2 -> CH2Cl-CH2Cl}$ (דיכלוריד)
- $\ce{C2H4 + Br2 -> CH2Br-CH2Br}$ (דיברומיד)
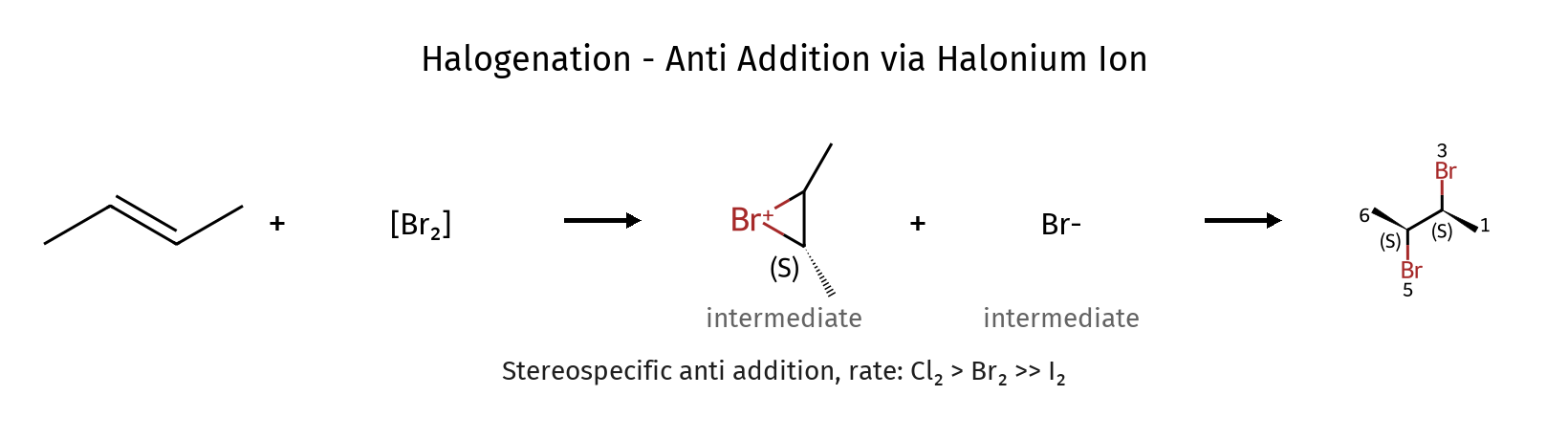
מנגנון התגובה - תגובה אלקטרופילית
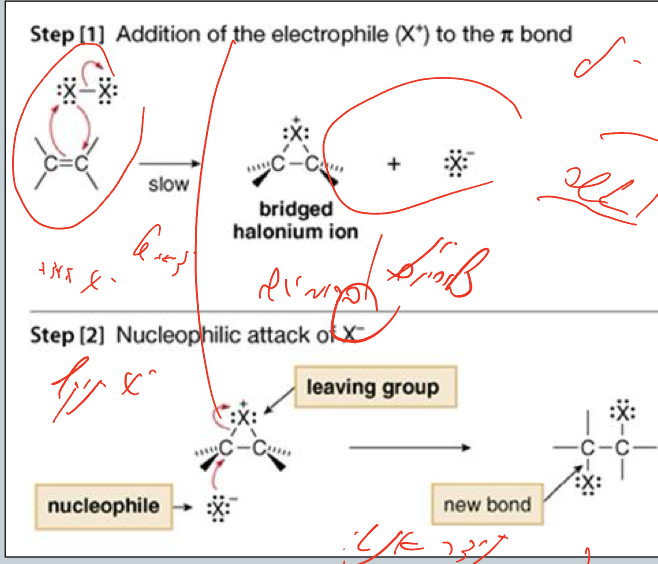
התגובה מתרחשת במנגנון של תגובה אלקטרופילית בשני שלבים:
שלב ראשון - יצירת יון הלוגנוניום
- במולקול $\ce{X2}$ יש דיפול רגעי: $\ce{X^{\delta+} - X^{\delta-}}$
- הקשר הכפול (עשיר באלקטרונים) תוקף את $\ce{X^{\delta+}}$
- $\ce{X^-}$ יוצא כקבוצה עוזבת
- נוצר יון הלוגנוניום (ברומוניום/כלורוניום) - גשר תלת-מימדי
שלב שני - פתיחת הגשר
- $\ce{X^-}$ תוקף את אחד הפחמנים מהצד השני של הגשר
- הקשר $\ce{C-X}$ של הגשר נפתח
- מתקבל התוצר הסופי עם סיפוח אנטי
מאפיין חשוב - סיפוח אנטי
בגלל מבנה הגשר התלת-מימדי, הנוקלאופיל ($\ce{X^-}$) חייב לתקוף מהצד הנגדי, מה שמוביל לסיפוח אנטי - שני ההלוגנים מתמקמים בכיוונים נגדיים במרחב.
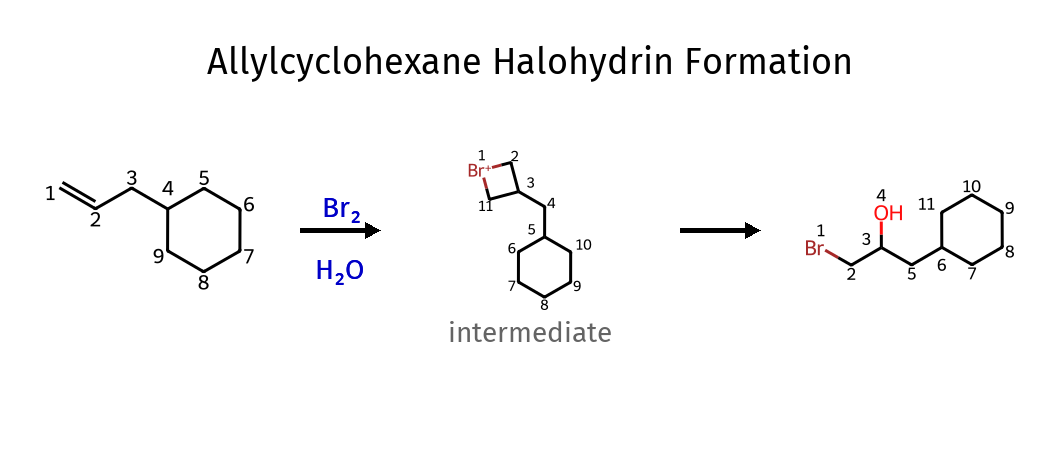
הלוגנציה במים - יצירת הלוהידרינים
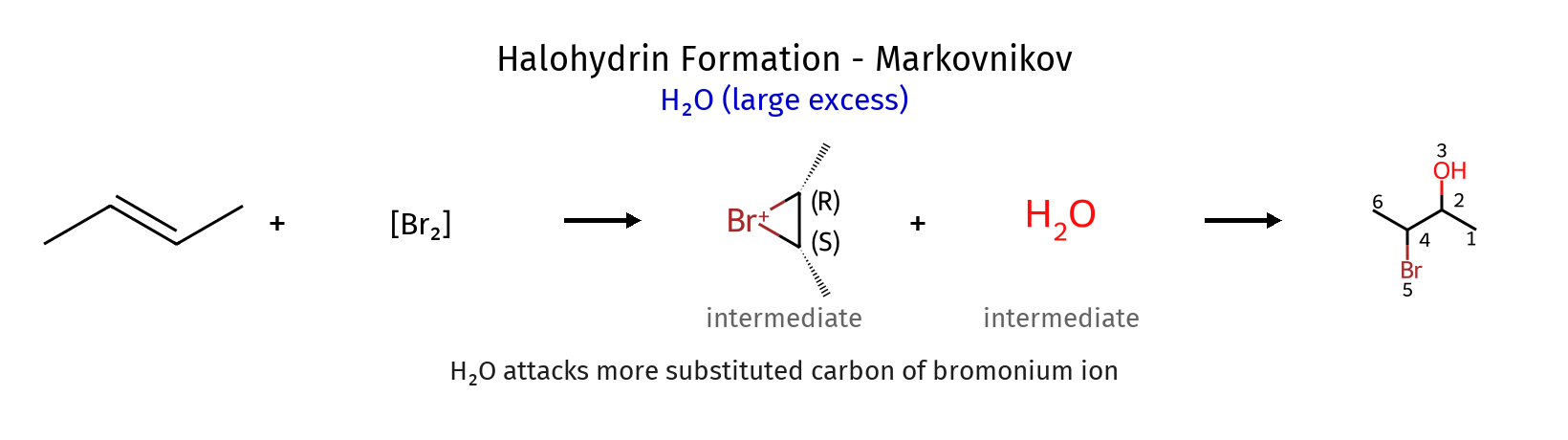
תיאור התגובה
כאשר מבצעים תגובת הלוגנציה בממס מים, מתקבל תוצר שונה:
\[\ce{C=C + X2 + H2O -> X-C-C-OH + HX}\]במקום $\ce{X-X}$, מתקבל $\ce{X-OH}$ (הלוהידרין)
מנגנון התגובה
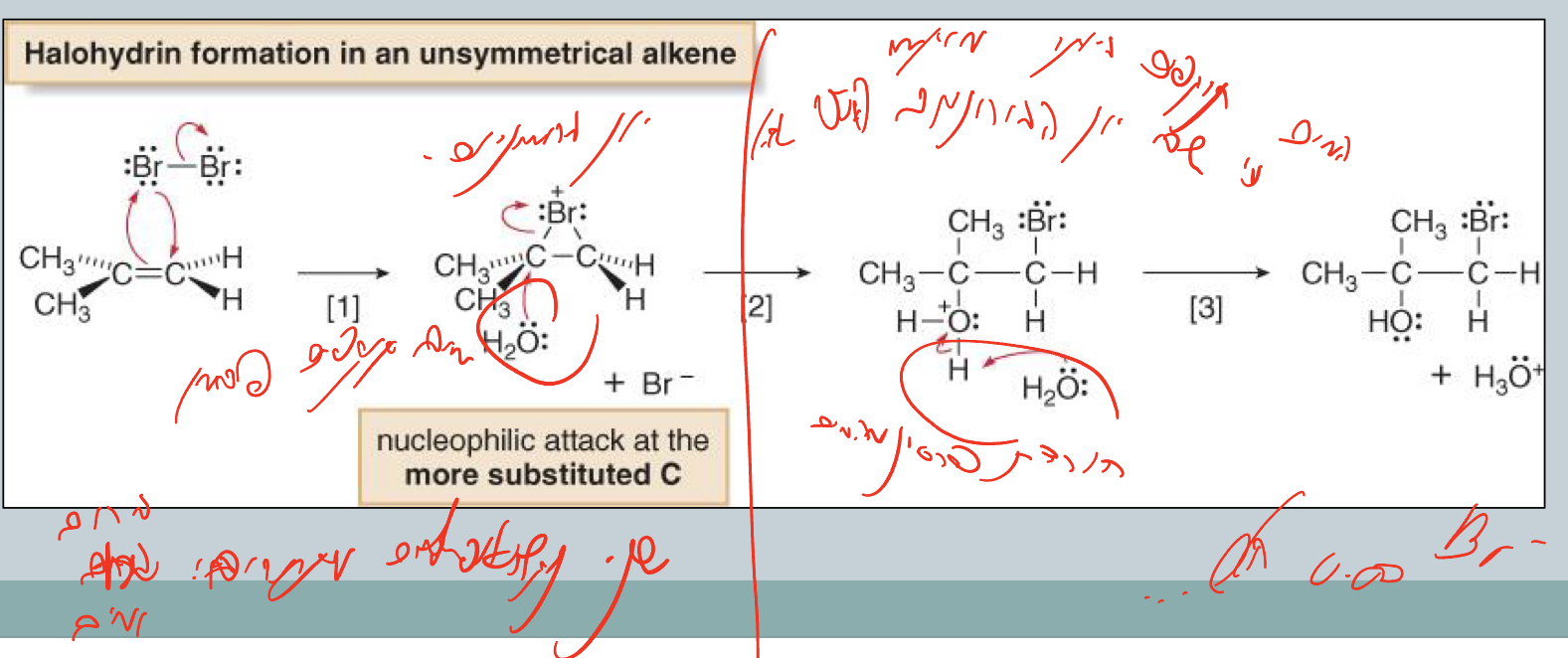
שלב ראשון - זהה לקודם
יצירת יון הלוגנוניום (ברומוניום/כלורוניום)
שלב שני - תחרות בין נוקלאופילים
במערכת יש כעת שני נוקלאופילים מתחרים:
- $\ce{X^-}$ (מהשלב הראשון)
- $\ce{H2O}$ (הממס)
מדוע המים מנצחים?
מסיבה הסתברותית פשוטה - יש כמות עצומה של מים בתור ממס, ולכן הם פועלים כנוקלאופיל תחרותי יעיל יותר.
שלב שלישי - התקפת המים והורדת פרוטון
- המים תוקפים את הפחמן היותר מותמר (בגלל צפיפות מטען חיובי גבוהה יותר)
- נוצר $\ce{C-OH2^+}$
- הורדת פרוטון: $\ce{C-OH2^+ -> C-OH + H^+}$
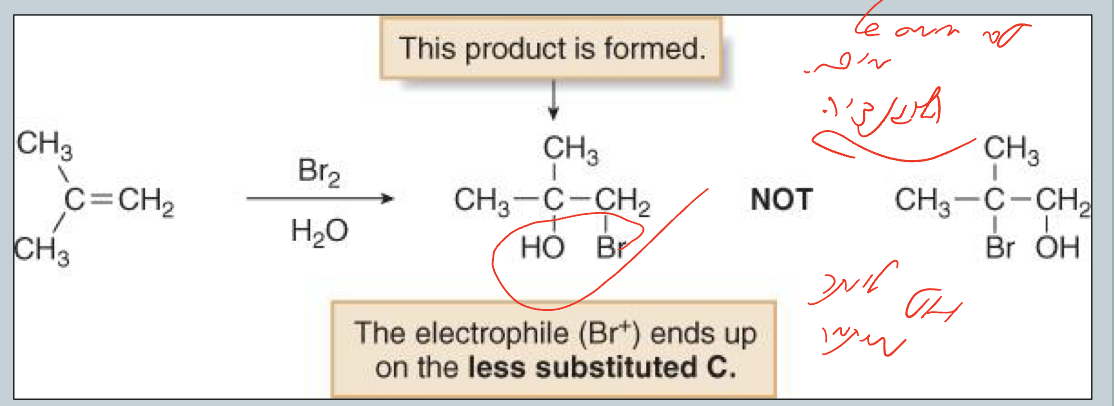
רגיוסלקטיביות - מדוע OH נכנס ליותר מותמר?
יון הברומוניום יכול להיפתח בשני כיוונים:
- פתיחה לכיוון הפחמן הפחות מותמר ← מטען חיובי פחות יציב
- פתיחה לכיוון הפחמן היותר מותמר ← מטען חיובי יותר יציב ($\delta^+$ גדול יותר)
המים תוקפים בעדיפה את הפחמן היותר מותמר בגלל הצפיפות החיובית הגבוהה יותר שם.
תוצאה: $\ce{OH}$ על הפחמן היותר מותמר, $\ce{X}$ על הפחמן הפחות מותמר
שאלות תרגול
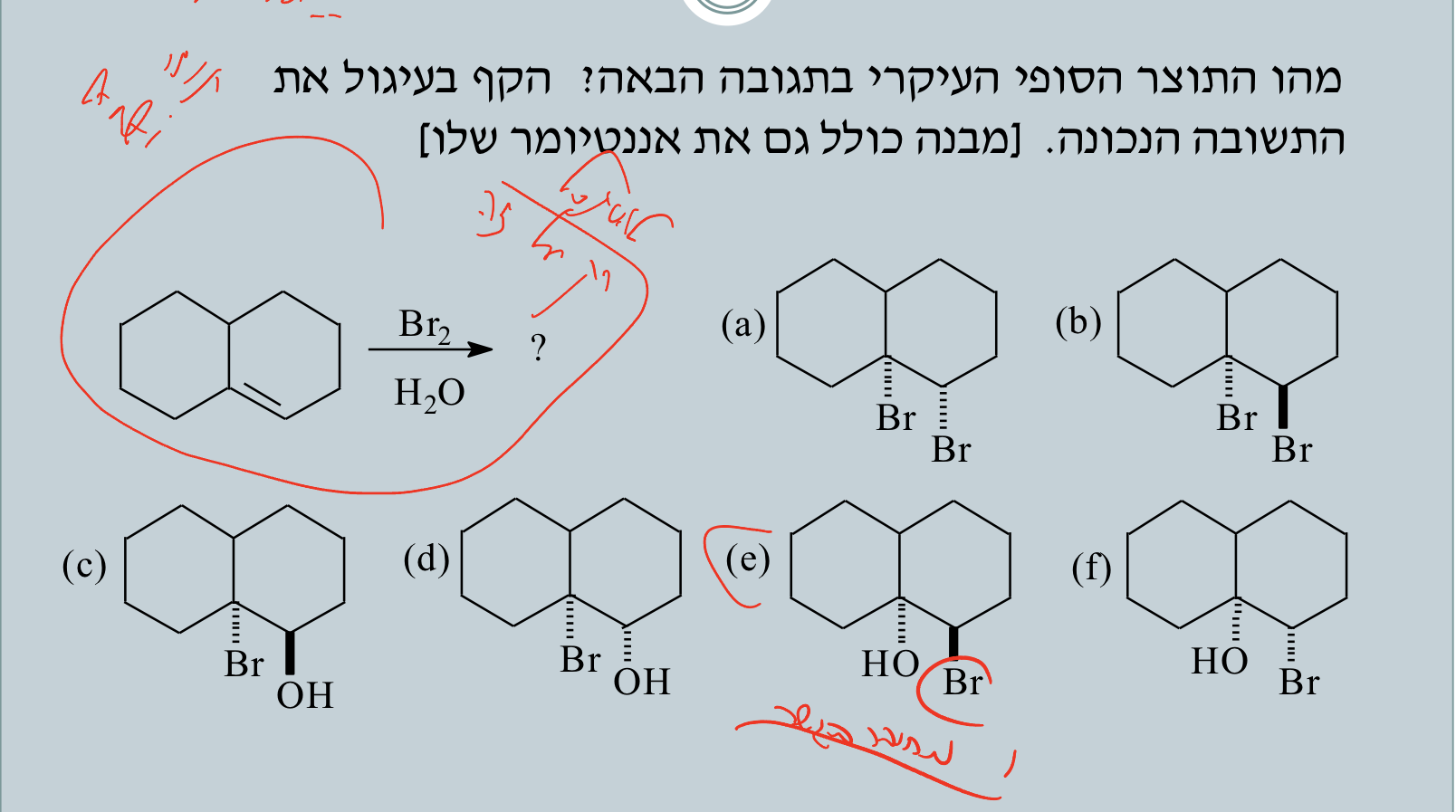
שאלה 1: $\ce{Br2}$ על אלקן עם מים
שאלה 2: $\ce{HBr}$ על אלקן בחושך
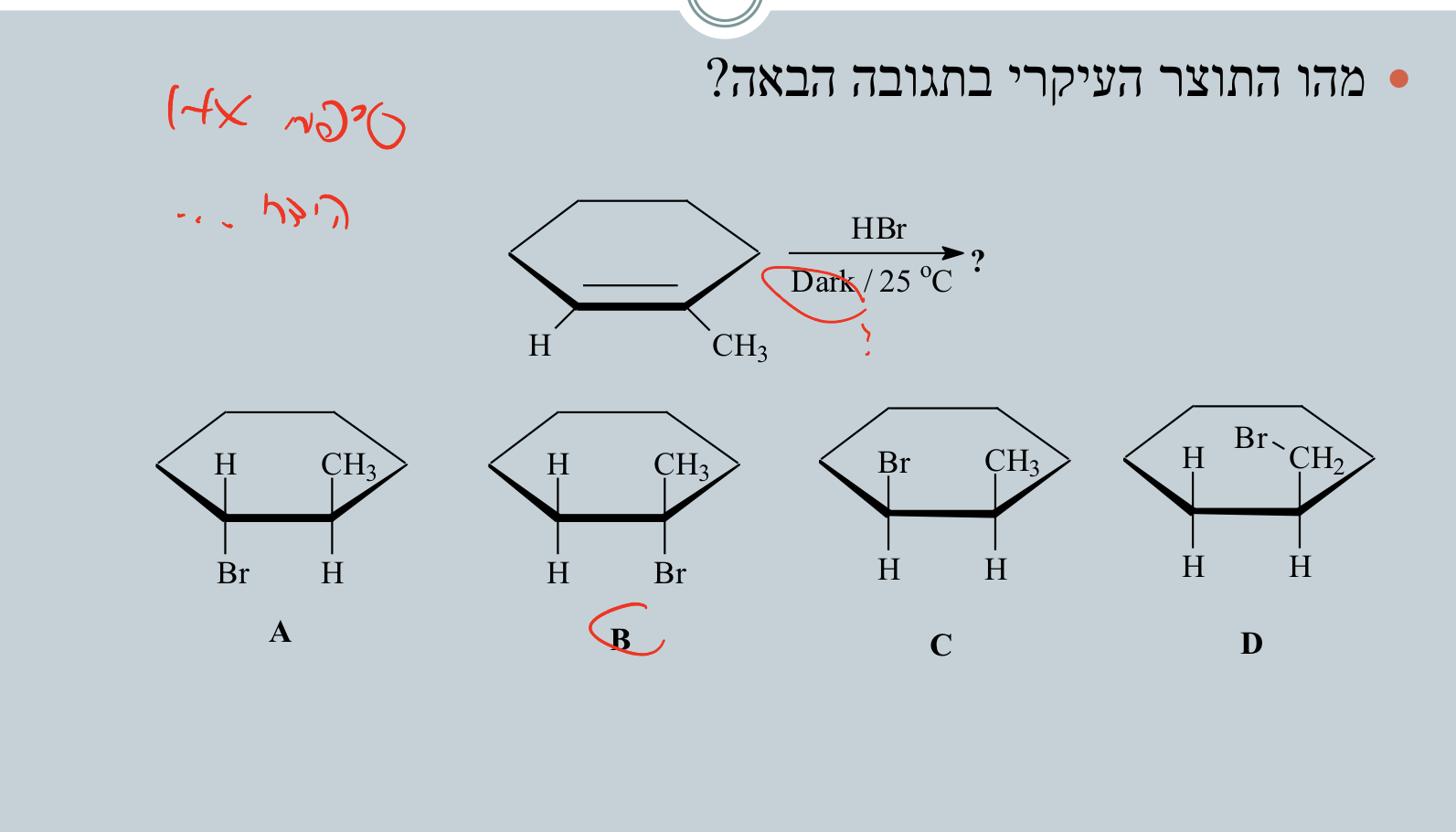
בסיפוח $\ce{HX}$ ה-$\ce{H}$ נכנס לפחמן הפחות מותמר וה-$\ce{X}$ נכנס לפחמן היותר מותמר.
שאלה 3 - גשר כלורוניום
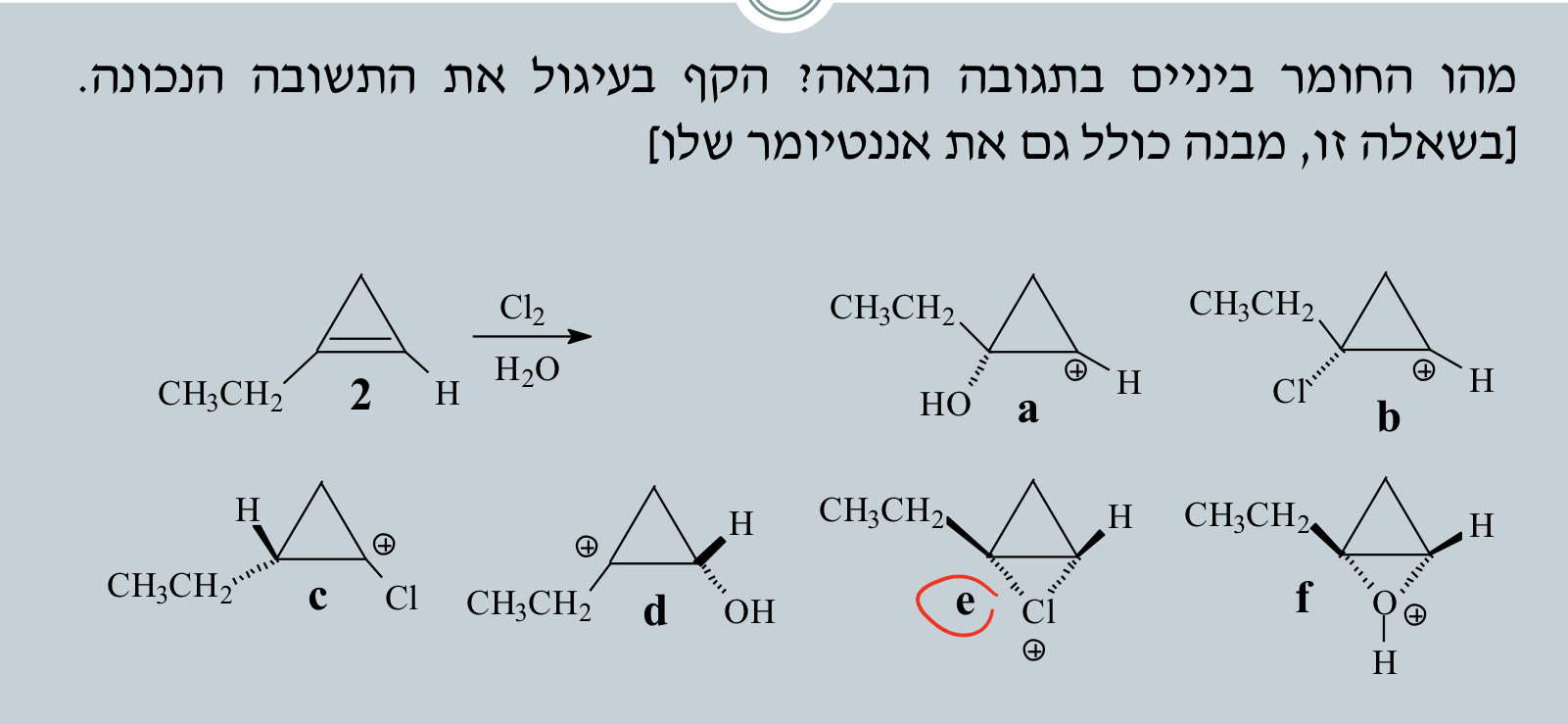
כשלוקחים כלור במים, התוצר של השלב הראשון הוא הגשר כלורוניום.
הגשר יכול להיות למעלה או למטה.
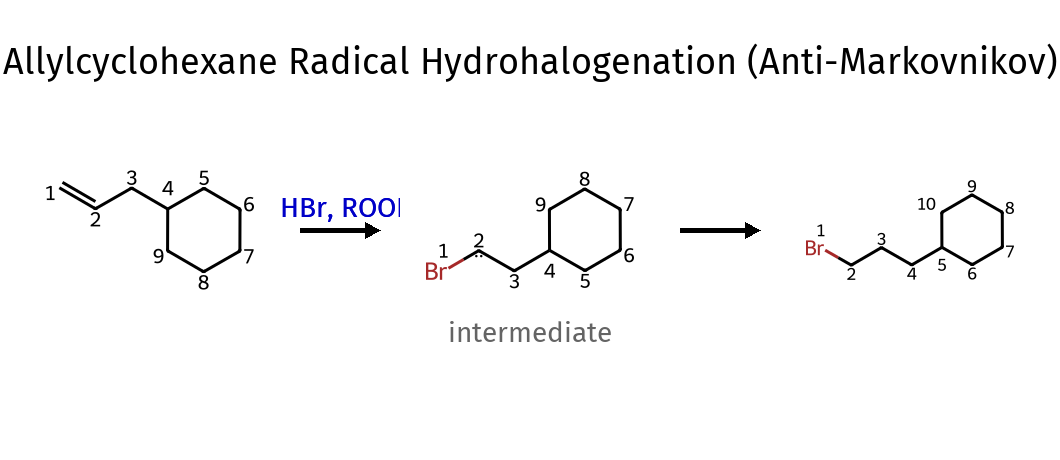
הידרוהלוגנציה אנטי-מרקובניקוב (עם פרוקסידים)
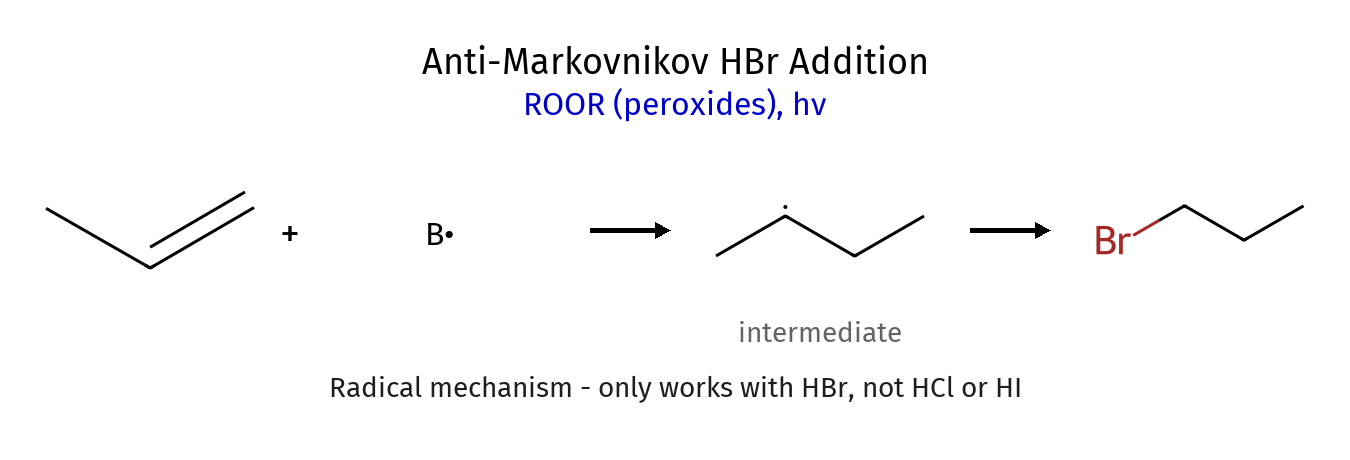
תנאי התגובה ותוצאותיה
תנאים מיוחדים:
- $\ce{HX}$ (בדרך כלל $\ce{HBr}$)
- נוכחות פרוקסידים או אור
תוצאה:
\[\ce{C=C + HBr ->[ROOR][or h\nu] H-C-C-Br}\]בניגוד לתגובה הרגילה, כאן $\ce{X}$ נכנס לפחמן הפחות מותמר (אנטי-מרקובניקוב).
מנגנון רדיקלי
התגובה פועלת במנגנון רדיקלי בשלושה שלבים:
Initiation (התחלה)
-
פירוק הפרוקסיד:
\[\ce{RO-OR ->[\Delta][or h\nu] 2 RO \bullet}\] -
יצירת רדיקל X:
\[\ce{RO\bullet + HX -> ROH + X\bullet}\]
Propagation (התפשטות)
-
התקפת הרדיקל על הקשר הכפול:
\[\ce{X\bullet + C=C -> X-C-C\bullet}\]הרדיקל $\ce{X\bullet}$ מתחבר לפחמן הפחות מותמר כדי ליצור רדיקל יותר יציב על הפחמן היותר מותמר.
-
השלמת התגובה:
\[\ce{X-C-C• + HX -> X-C-C-H + X•}\]
Termination (סיום)
שילוב רדיקלים שונים: $\ce{X• + X• -> X2}$, $\ce{R• + X• -> RX}$, וכו’.
ההבדל העקרוני בין שני מנגנוני הסיפוח בהידרוהלוגנציה
| מנגנון יוני (רגיל, כלל מרקובניקוב) | מנגנון רדיקלי (אנטי-מרקובניקוב) |
|---|---|
| $\ce{H^+}$ תוקף ראשון את הקשר הכפול | הרדיקל $\ce{X•}$ תוקף ראשון את הקשר הכפול |
| נוצר קרבוקטיון ביניים | נוצר רדיקל ביניים |
| התוצר נקבע לפי יציבות הקרבוקטיון | התוצר נקבע לפי יציבות הרדיקל |
| ההלוגן $\ce{X}$ נכנס לפחמן היותר מותמר | ההלוגן $\ce{X}$ נכנס לפחמן הפחות מותמר |
| דוגמה: סיפוח $\ce{HBr}$ בלבד | דוגמה: סיפוח $\ce{HBr}$ בנוכחות פרוקסיד ($\ce{ROOR}$) |
סיכום התגובות שנלמדו
טבלת תגובות סיפוח על אלקֵנים
| סוג התגובה | ריאגנטים | תוצר | הערות מיוחדות |
|---|---|---|---|
| הלוגנציה | $\ce{X2}$ | דיהליד | סיפוח אנטי |
| הלוגנציה במים | $\ce{X2, H2O}$ | הלוהידרין | $\ce{OH}$ ליותר מותמר, $\ce{X}$ לפחות מותמר, אנטי |
| הידרוגנציה | $\ce{H2, Pd/Ni/Pt}$ | אלקאן | פעולה של זרז מתכת, סיפוח syn של מימנים |
| הידרוהלוגנציה | $\ce{HX}$ | אלקיל הליד | כלל מרקובניקוב: $\ce{X}$ ליותר מותמר |
| הידרוהלוגנציה רדיקלית | $\ce{HBr, ROOR/ h \nu}$ | אלקיל הליד | אנטי-מרקובניקוב: $\ce{Br}$ לפחות מותמר |
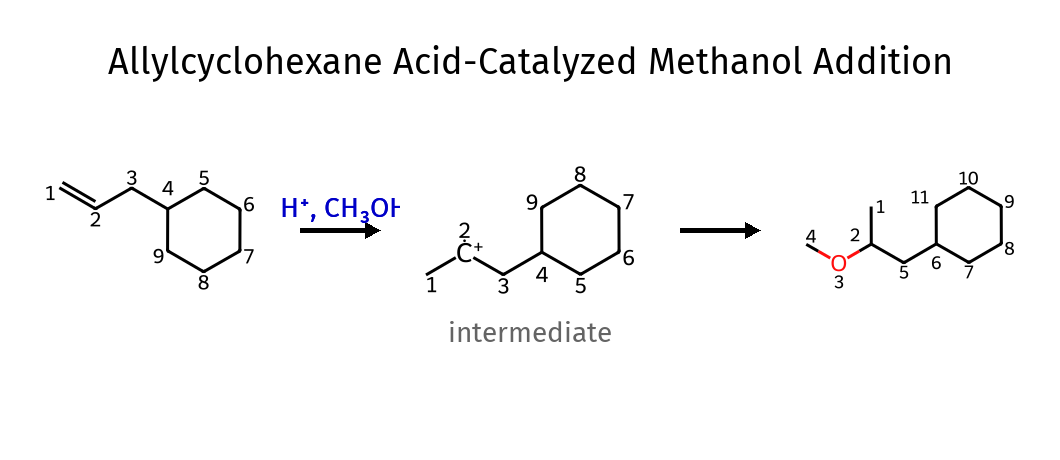
| הידרציה | $\ce{H2O, H^+}$ | אלכוהול | $\ce{OH}$ ליותר מותמר |
| הידרציה עקיפה | $\ce{ROH, H^+}$ | אתר | $\ce{OR}$ ליותר מותמר |
עקרונות מנחים חשובים
- זיהוי סוג המנגנון: נוכחות פרוקסידים/אור ← מנגנון רדיקלי
- סטריאוכימיה: הלוגנציה תמיד נותנת סיפוח אנטי
- רגיוסלקטיביות: תלויה במנגנון - יוני או רדיקלי
- יציבות מתווכים: קרבוקטיונים vs רדיקלים קובעת את הכיוון
תרגילים ושאלות לדוגמה
שאלה 4 - זיהוי תגובות
בהינתן אלקֵן נתון, זהה את הריאגנטים הנדרשים עבור כל תוצר:
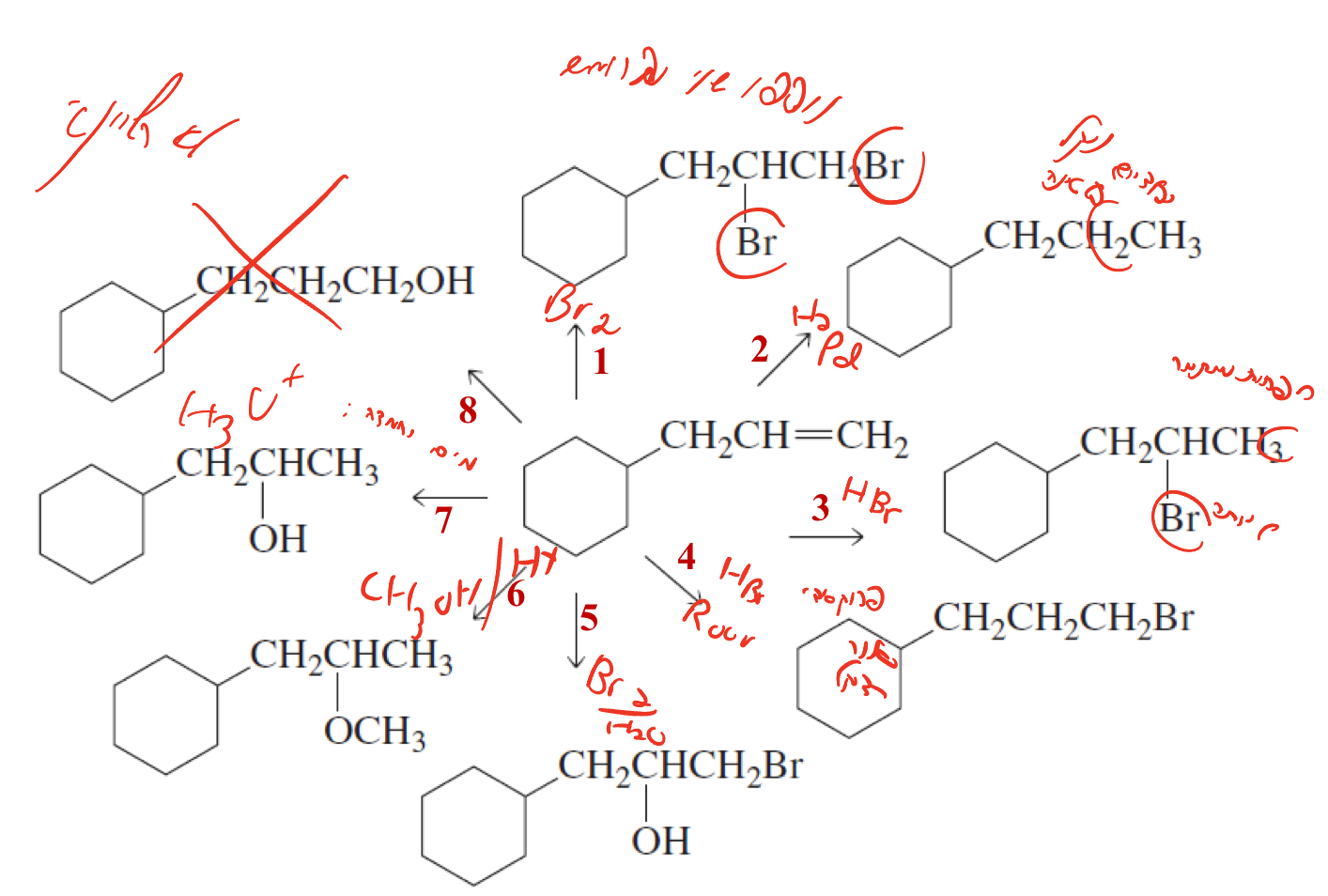
- הקשר הכפול נפתח ונוספו שני ברומים - הריאגנט הוא $\ce{Br2}$. סוג התגובה הוא הלוגנציה.
- הקשר הכפול נפתח ונוספו שני מימנים - הריאגנט הוא $\ce{H2}$ עם קטליזטור מתכתי ($\ce{Pd}$ ניקל או פלטינה גם?). סוג התגובה הוא הידרוגנציה.
- הקשר הכפול נפתח ונוספו $\ce{Br}$ ליותר מותמר, ו-$\ce{H}$ לפחות מותמר - הריאגנט הוא $\ce{HBr}$ .סוג התגובה הוא הידרוהלוגנציה מרקובניקוב.
- הקשר הכפול נפתח והפעם $\ce{Br}$ נכנס לפחמן הפחות מותמר - הריאגנט הוא $\ce{HBr}$ עם פרוקסיד או אור. סוג התגובה הוא הידרוהלוגנציה רדיקלית (אנטי-מרקובניקוב).
- הקשר הכפול נפתח ונוספה קבוצת $\ce{OH}$ ליותר מותמר ו-$\ce{Br}$ לפחות מותמר - הריאגנט הוא $\ce{Br2}$ במים. סוג התגובה הוא הלוגנציה במים.
- הקשר הכפול נפתח ונוספה קבוצת $\ce{OCH3}$ ליותר מותמר ו-$\ce{H}$ לפחות מותמר - הריאגנט הוא $\ce{H+}$ עם חומצה ($\ce{CH3OH}$). סוג התגובה הוא (לא בטוח).
- הקשר הכפול נפתח ונוספה קבוצת $\ce{OH}$ ליותר מותמר ו-$\ce{H}$ לפחות מותמר - הריאגנט הוא $\ce{H2O}$ עם חומצה. סוג התגובה הוא הידרציה.
שאלה 5 - חומר ביניים
מהו חומר הביניים בתגובה של $\ce{Cl2}$ עם אלקֵן במים?
תשובה: יון כלורוניום (גשר כלור תלת-מימדי)
זאת תגובת הלוגנציה במים.
עקרונות לפתרון שאלות
- להתחיל בזיהוי התנאים - האם יש פרוקסידים/אור?
- חיפוש רגיוסלקטיביות - איפה נכנסות הקבוצות?
- תשומת לב לסטריאוכימיה - סין או אנטי?
- שינון דפוסים: מרקובניקוב vs אנטי-מרקובניקוב
תגובות חימצון על אלקֵנים
מבוא לתגובות חמצון
אנחנו ממשיכים בסדרת התגובות על אלקנים עם תגובות חמצון.
מה קורה בתגובות חמצון?
- מצב החמצון של הפחמן עולה כתוצאה מתוספת של חמצנים למולקולה
- הקשר הכפול עובר שינויים מבניים משמעותיים
תגובת דיהידרוקסילציה (dihydroxylation) עם KMnO₄
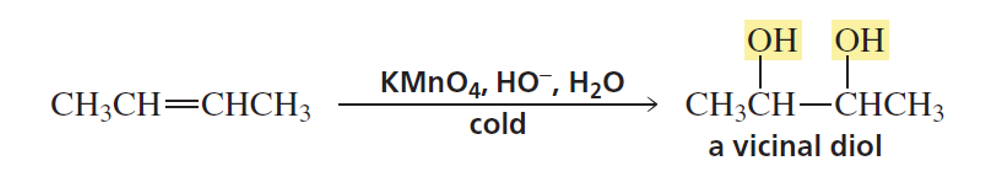
תיאור תגובת דיהידרוקסילציה
-
ריאגנטים: $\ce{KMnO4}$ (פוטסיום פרמנגנט), $\ce{NaOH}$, $\ce{H2O}$
\[\ce{C=C + KMnO4 + NaOH + H2O -> C(OH)-C(OH)}\] -
תוצר: דיול (diol) - מולקולה עם שתי קבוצות $\ce{OH}$ על פחמנים סמוכים
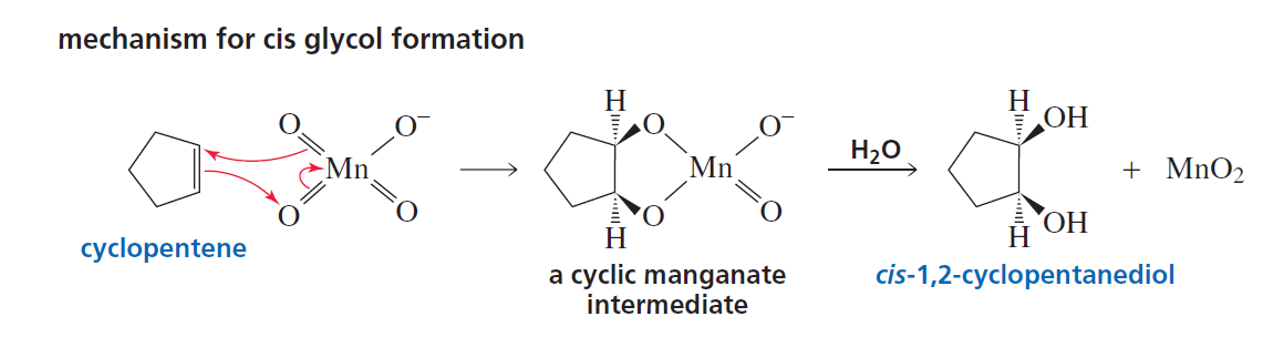
מנגנון תגובת דיהידרוקסילציה
שלב ראשון - יצירת מתווך ציקלי
התגובה מתרחשת במנגנון ציקלי בשלב אחד:
- $\ce{KMnO4}$ מופיע כ-$\ce{K^+ MnO4^-}$
- הקשר הכפול מעביר אלקטרונים לחמצן של $\ce{MnO4^-}$
- נוצר מתווך ציקלי בין המנגן לשני הפחמנים
- התגובה מתרחשת בו-זמנית - כמו “מעגל” של העברת אלקטרונים
תבנית המתווך הציקלי:
O
/|\
Mn O
/ | \
C O C
\ | /
\|/
O
שלב שני - הידרוליזה
- המתווך הציקלי עובר הידרוליזה
- הקשרים $\ce{C-O-Mn}$ נשברים
- מתווספים מימנים ($\ce{H}$) לחמצנים
- נוצר הדיול הסופי + $\ce{MnO2}$
מאפיין סטריאוכימי חשוב - סיפוח סין
בגלל המנגנון הציקלי שמתרחש בו-זמנית, שתי קבוצות ה-$\ce{OH}$ מתווספות מאותו צד של הקשר הכפול.
תוצאה: סיפוח סין - שתי קבוצות ה-$\ce{OH}$ נמצאות באותו כיוון מרחבי.
תגובת אוזונוליזה (Ozonolysis)
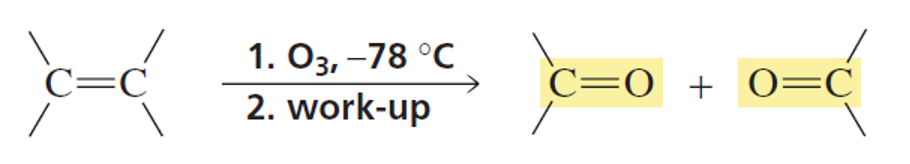
הגדרה וחשיבות
תגובת אוזונוליזה היא תגובה חשובה בכימיה אורגנית שגורמת לביקוע חמצוני של קשרים כפולים.
מה זה ביקוע חמצוני?
הקשר הכפול “נחתך” לשתי מולקולות נפרדות, כאשר כל פחמן מקבל קשר כפול לחמצן (קרבוניל).
\[\ce{R1-CH=CH-R2 + O3 -> R1-CHO + R2-CHO}\]תזכורת: קרבוניל הוא $\ce{C=O}$, כלומר פחמן עם קשר כפול לחמצן.
המולקולה - אוזון ($\ce{O3}$)
אוזון הוא מולקולה בעלת חשיבות כפולה:
- חשיבות גלובלית: הגנה מפני קרינת UV באטמוספירה
- חשיבות כימית: ריאגנט יעיל לביקוע חמצוני
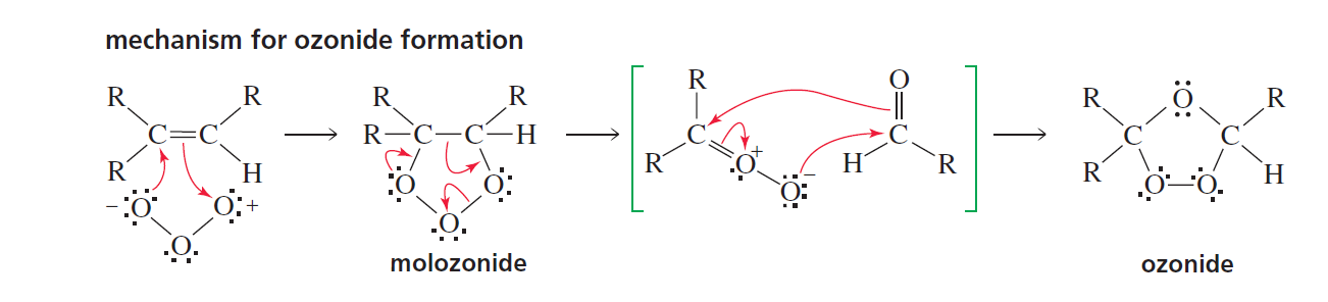
מנגנון תגובת אוזונוליזה (ביקוע חמצוני)
המנגנון מורכב מאוד (כ-8 שלבים), לכן נתמקד ברעיון הכללי:
- שלב ראשון: $\ce{O3}$ מגיב עם הקשר הכפול
- יצירת אוזוניד: מתווך לא יציב
- פירוק האוזוניד: תהליך מרובה שלבים
- תוצר סופי: שני קרבונילים
תלות בתנאי ה-Work-up
התוצרים הסופיים תלויים בשלב השני של התגובה:
תנאים מחזרים (Reducing conditions)
ריאגנטים: $\ce{Zn}$ או $\ce{(CH3)2S}$
תוצאה: המימנים ($\ce{H}$) נשארים ללא שינוי
\[\ce{R-CH=CH-R' ->[1. O3][2. Zn] R-CHO + R'-CHO}\]תנאים מחמצנים (Oxidizing conditions)
ריאגנטים: $\ce{H2O2}$
תוצאה: כל $\ce{H}$ מתחמצן ל-$\ce{OH}$
\[\ce{R-CH=CH2 ->[1. O3][2. H2O2] R-COOH + HCOOH}\]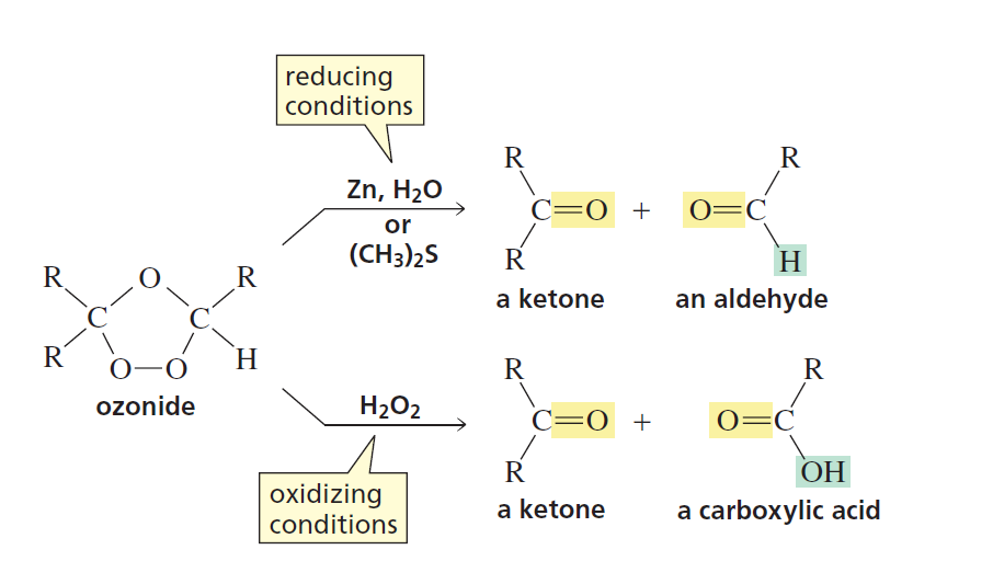
אסטרטגיית פתרון שאלות
כיוון א׳: מבנה התחלתי ← תוצרי אוזונוליזה
שלבי פתרון:
- זהה את התנאים (מחזרים/מחמצנים)
- “חתוך” את הקשר הכפול מנטלית
- הוסף $\ce{=O}$ לכל פחמן
- אם תנאים מחמצנים: $\ce{H -> OH}$
כיוון ב׳: תוצרי אוזונוליזה ← מבנה התחלתי
שלבי פתרון:
- זהה את הקרבונילים בתוצרים
- “מחק” את $\ce{=O}$ מכל קרבוניל
- חבר את הפחמנים בקשר כפול
- השלם את שאר הקבוצות
כלל חשוב:
- שני תוצרים נפרדים ← מגיב היה שרשרת פתוחה
- תוצר אחד ← מגיב היה מולקולה ציקלית
דוגמאות
דוגמה 1: תנאים מחמצנים
\[\ce{CH3-CH=CH-CH2CH3 ->[1. O3][2. H2O2] CH3-COOH + CH3CH2-COOH}\]דוגמה 2: תנאים מחזרים
\[\ce{Cyclohexene ->[1. O3][2. Zn] CHO-CH2-CH2-CH2-CH2-CHO}\]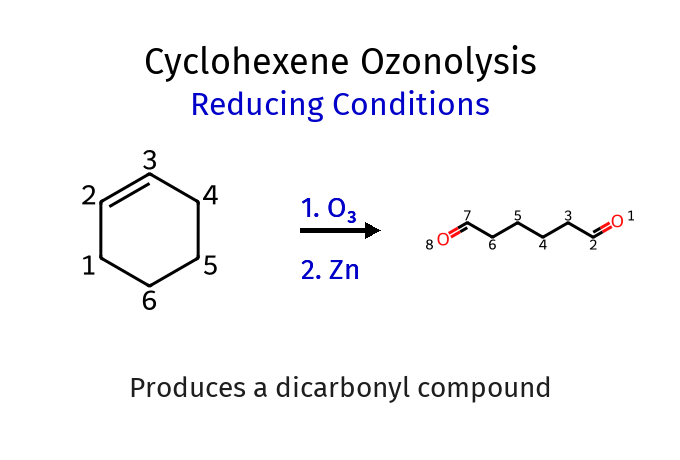
תגובות פתיחת אפוקסיד
פחות חשוב להבין את המגנון של יצירת אפוקסיד. מה שחשוב להבין הוא שכשיש קשר כפול, והוא מגיב עם פר־חומצה, נוצר אפוקסיד שהוא נוקלאופיל מצוין. המשך התגובה (פתיחת האפוקסיד) תלוי בתנאים חומציים או בסיסיים: בתנאים חומציים יתקוף בפחמן היותר מותמר ובתנאים בסיסיים יתקוף בפחמן הפחות מותמר.
ההתקפה תמיד תהיה 180 מעלות לחמצן והנוקלאופיל וההכהל שנוצר יהיו באנטי אחד לשני.
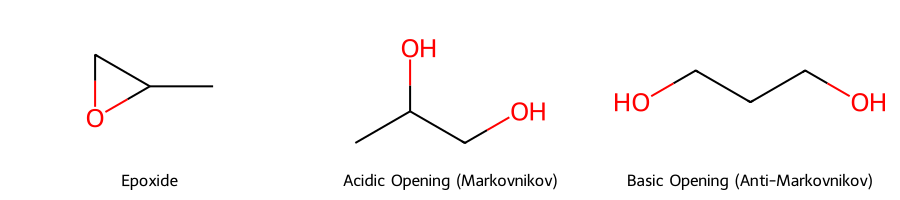
אפוקסידים הם אלקטרופילים מצוינים ולכן נוקלאופילים יכולים לתקוף אותם ולפתוח את הטבעת.
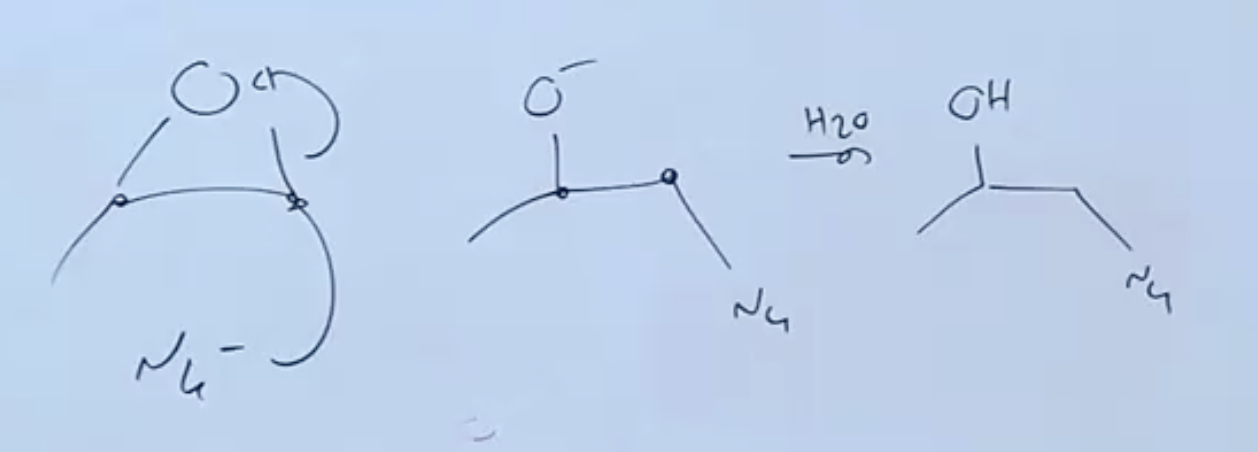
נזכיר שהנוקלאופילים החזקים נמצאים בסביבה בסיסית.
נוקלאופיל חזק יכול לתקוף את הפחמן ולשחרר $\ce{O-}$ החוצה.
בשלב השני מוסיפים מים, מעניקים פרוטונים לחמצן ובכל מקבלים כוהל.
גם כאן ההתקפה חייבת להיות 180 מעלות.
לסיכום, יתקף הפחמן שהכי פחות מעוכב סטרית, הכי קל לתקוף אותו.
בסביבה חומצית, יש חמצנים במערכת שהם מעט בסיסיים. אם מולם חומצה חזקה הם יעשו פרוטונציה, ואז נקבל שלב ביניים שעוזר לתקוף - ישתחרר $\ce{OH}$ מולקולה נייטרילית.
הפעם יתקפו את היותר מותמר.
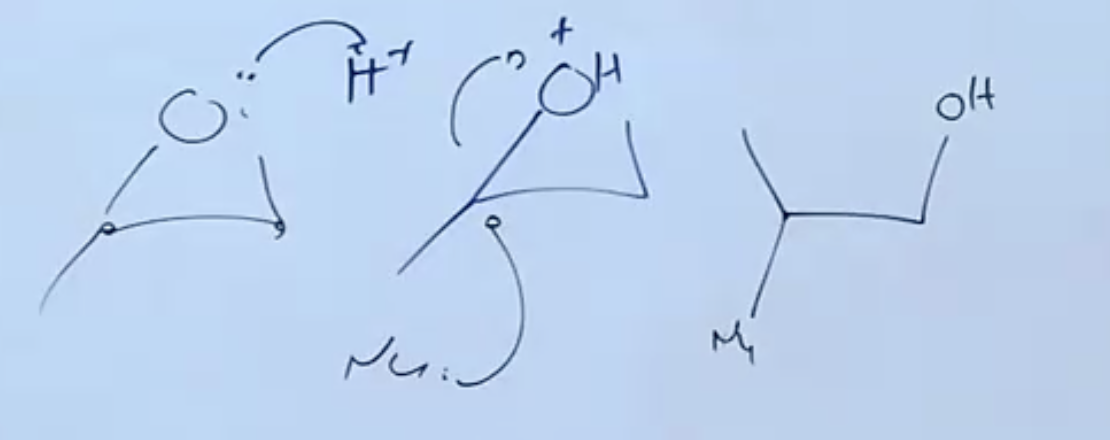
התוצר יהיה אנטי (הנוקלאופיל וה-$\ce{OH}$ יהיו בכיוונים מנוגדים).
ההבדל רק האם תקף את היותר מותמר או את הפחות מותמר.
סיכום תגובות החמצון
| סוג תגובה | ריאגנטים | תוצר עיקרי | מאפיין סטריאוכימי |
|---|---|---|---|
| דיהידרוקסילציה | $\ce{KMnO4, NaOH, H2O}$ | דיול | סיפוח סין |
| אוזונוליזה מחזרת | $\ce{O3}$ ואז $\ce{Zn}$ | אלדהידים/קטונים | ביקוע מוחלט |
| אוזונוליזה מחמצנת | $\ce{O3}$ ואז $\ce{H2O2}$ | חומצות קרבוקסיליות | ביקוע מוחלט |
| אפוקסידציה | פר־חומצה | אפוקסיד | שמירת מבנה |
עקרונות מנחים לפתרון שאלות
לזיהוי תגובות:
- שים לב לריאגנטים הספציפיים
- זהה האם יש ביקוע של הקשר הכפול או שמירה עליו
- בדוק תנאי work-up (מחזרים/מחמצנים)
לחיזוי תוצרים:
- בדוק סטריאוכימיה (סין/אנטי)
- שים לב לרגיוסלקטיביות בפתיחת אפוקסיד
- זכור את ההבדל בין תנאים חומציים ובסיסיים
שאלה 6 - זיהוי מבנה מולקולה
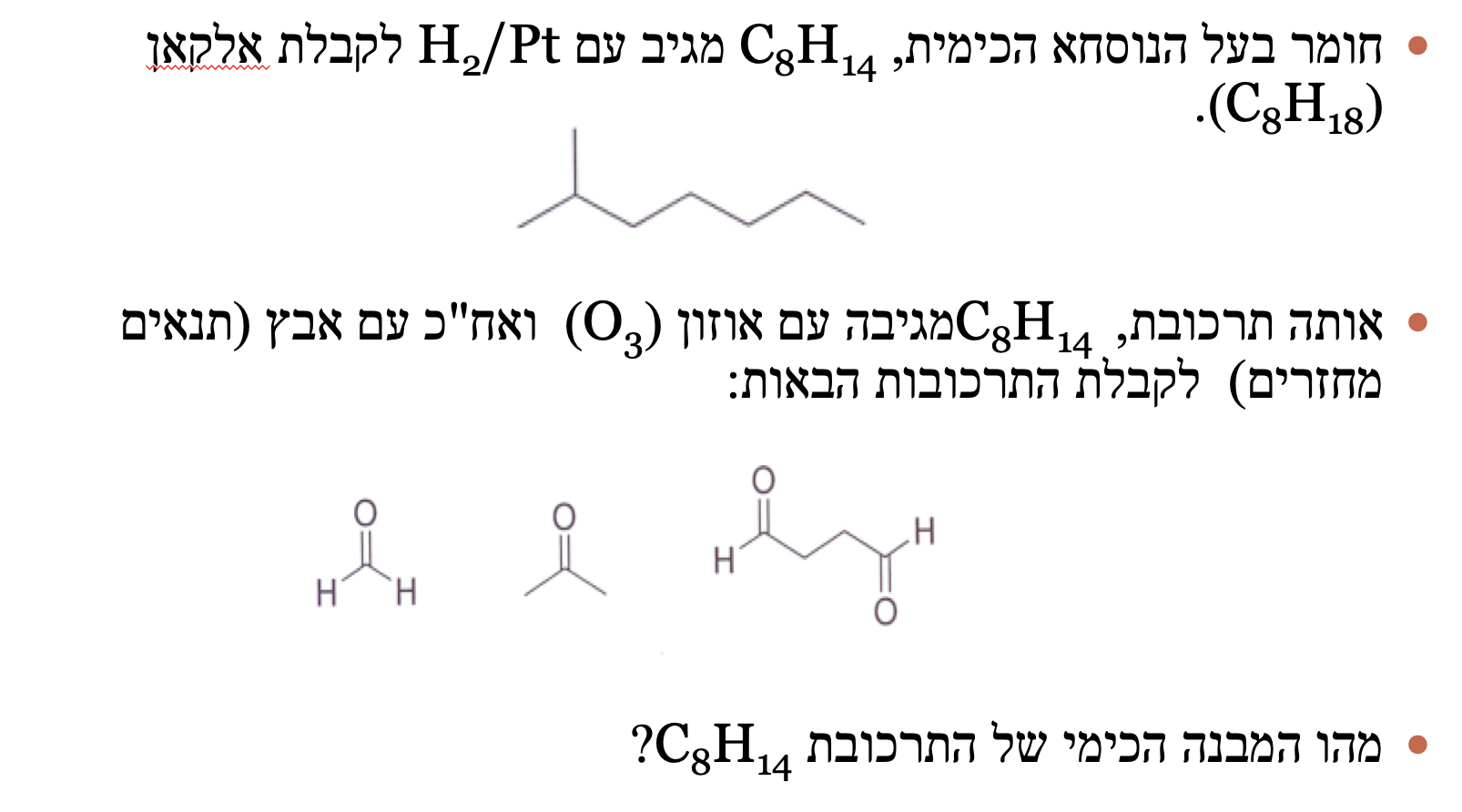
השאלה:
נתון: מולקולה עם נוסחה $\ce{C8H14}$ שמגיבה עם $\ce{H2/Pt}$ לקבלת אלקאן $\ce{C8H18}$.
אותה מולקולה מגיבה עם אוזונוליזה בתנאים מחזרים ונותנת תוצרים ספציפיים.
מטרה: לקבוע את המבנה של $\ce{C8H14}$
צעדי פתרון
שלב 1 - קביעת מספר קשרים כפולים
מהמידע על ההידרוגנציה:
- $\ce{C8H14 + 2H2 -> C8H18}$
- נדרשים 2 מימנים ← יש שני קשרים כפולים
שלב 2 - ניתוח תוצרי האוזונוליזה
מתוצרי הביקוע החמצוני (אוזונוליזה) ניתן לדעת איפה היו הקשרים הכפולים:
שלב 3 - בנייה לאחור
על סמך התוצרים, נבנה את המבנה המקורי:
- זהוי הקרבונילים בתוצרים
- “מחיקת” קבוצות הקרבוניל
- חיבור הפחמנים בקשרים כפולים
- השלמת המבנה
עקרון כללי: הזזת קשרים כפולים
כלל יסוד חשוב
“תמיד כשקשר כפול זז ממקום אחד למקום סמוך, זה חייב להיות סיפוח HX ואלימינציה”.
הסבר העקרון
- סיפוח HX: מוסיף $\ce{H}$ ו-$\ce{X}$ על הקשר הכפול
- אלימינציה: מסיר $\ce{H}$ ו-$\ce{X}$ ויוצר קשר כפול במקום חדש
אסטרטגיית פתרון תגובות רצף
עבודה לאחור:
- התחל מהתוצר הסופי
- זהה איזו תגובה יכולה לייצר אותו
- המשך לאחור שלב אחר שלב
- בדוק שהרצף הגיוני
שאלה 7: יצירת דיול סין ממבנה נתון
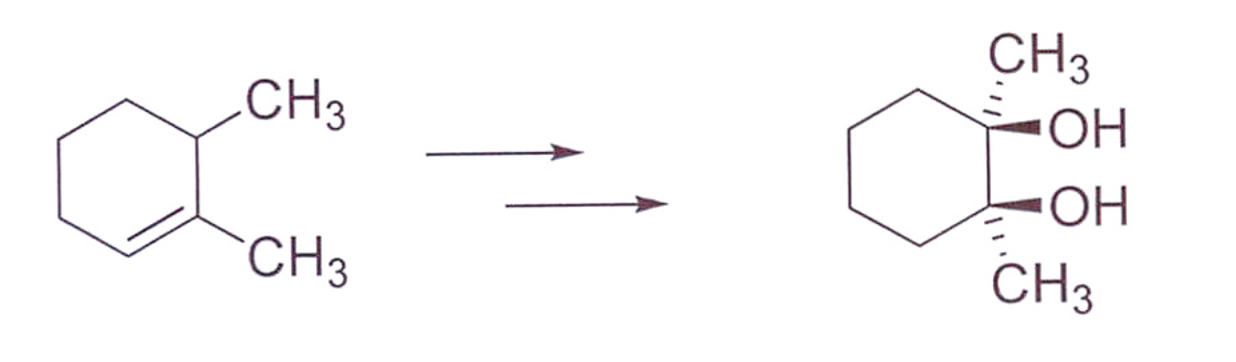
שלב אחרון ← קדימה:
שלב 1 - זיהוי התוצר הרצוי
דיול סין נוצר מ-$\ce{KMnO4}$ עם אלקן:
\[\ce{Alkene + KMnO4/NaOH/H2O -> Syn diol}\]שלב 2 - זיהוי הצורך בהזזת קשר כפול
אם הקשר הכפול לא במקום הנכון ← צריך להזיז אותו
שלב 3 - תכנון ההזזה
סיפוח + אלימינציה:
- סיפוח HBr: על האלקן המקורי (מרקובניקוב או אנטי-מרקובניקוב)
- אלימינציה: עם בסיס מתאים לקבלת הקשר הכפול במקום הרצוי
שלב 4 - ביצוע הרצף
\[\ce{Original alkene ->[HBr] Alkyl bromide ->[Base] New alkene ->[KMnO4] Diol}\]בחירת ריאגנטים לפי המטרה
סיפוח HX
| מטרה | ריאגנטים | תוצאה |
|---|---|---|
| X ליותר מותמר | $\ce{HX}$ (רגיל) | מרקובניקוב |
| X לפחות מותמר | $\ce{HX + פרוקסידים/אור}$ | אנטי-מרקובניקוב |

אלימינציה
| מטרה | בסיס | תוצאה |
|---|---|---|
| קשר כפול יותר מותמר | בסיס קטן וחזק | Saytzeff |
| קשר כפול פחות מותמר | בסיס גדול ומרחבי | Hofmann |
סיכום תגובות אלקנים - טבלה מלאה
תגובות הסיפוח
| תגובה | ריאגנטים | תוצר | מאפיינים |
|---|---|---|---|
| הידרוגנציה | $\ce{H2, Pd/Ni/Pt}$ | אלקן | סין, זרז מתכת |
| הידרוהלוגנציה | $\ce{HX}$ | אלקיל הליד | מרקובניקוב |
| הידרוהלוגנציה רדיקלית | $\ce{HBr, ROOR/h \nu}$ | אלקיל הליד | אנטי-מרקובניקוב |
| הידרציה | $\ce{H2O, H^+}$ | אלכוהול | מרקובניקוב |
| הידרציה עקיפה | $\ce{ROH, H^+}$ | אתר | מרקובניקוב |
| הלוגנציה | $\ce{X2}$ | דיהליד | אנטי |
| הלוגנציה במים | $\ce{X2, H2O}$ | הלוהידרין | אנטי, OH ליותר מותמר |
תגובות החמצון
| תגובה | ריאגנטים | תוצר | מאפיינים |
|---|---|---|---|
| דיהידרוקסילציה | $\ce{KMnO4, NaOH, H2O}$ | דיול | סין |
| אוזונוליזה מחזרת | $\ce{O3}$ ואז $\ce{Zn}$ | קרבונילים | ביקוע מוחלט |
| אוזונוליזה מחמצנת | $\ce{O3}$ ואז $\ce{H2O2}$ | חומצות | ביקוע מוחלט + חמצון |
| אפוקסידציה | פר־חומצה | אפוקסיד | שמירת מבנה |
תגובות נוספות
| תגובה | ריאגנטים | תוצר | הערות |
|---|---|---|---|
| פתיחת אפוקסיד חומצית | $\ce{Nu^- + H^+}$ | דיול | Nu ליותר מותמר |
| פתיחת אפוקסיד בסיסית | $\ce{Nu^-}$ | דיול | Nu לפחות מותמר |
עקרונות מנחים לפתרון שאלות
זיהוי תגובות
- שים לב לריאגנטים הספציפיים
- בדוק תנאי התגובה (אור/פרוקסידים, חומצי/בסיסי)
- זהה את הסטריאוכימיה הנדרשת (סין/אנטי)
תכנון רצפי תגובות
- עבוד לאחור מהתוצר הסופי
- זהה כל הזזת קשר כפול כסיפוח+אלימינציה
- בחר ריאגנטים לפי הרגיוסלקטיביות הנדרשת
- ודא שכל שלב אפשרי וגיוני
טיפים למבחן
- זכור את הכללים הבסיסיים: מרקובניקוב, סטריאוכימיה
- התרגל על זיהוי תגובות מריאגנטים
- תרגל תכנון רצפים בכיוון הפוך
- שם לב להבדלים הדקים בתנאים
עוברים מאלקנים לאלקינים.
הבהרות חשובות לגבי תגובות אלקנים
הבחנה בין מושגים שונים
הבהרה חשובה: יש להבחין בין שני סוגי “אנטי” שונים:
- אנטי-מרקובניקוב: התייחסות לרגיוסלקטיביות - איפה נכנס ההלוגן
- מתרחש רק במנגנון רדיקלי (עם פרוקסידים/אור)
- $\ce{X}$ נכנס לפחמן הפחות מותמר
- סיפוח אנטי: התייחסות לסטריאוכימיה - מאיזה צד נכנסות הקבוצות
- מתרחש בהלוגנציה רגילה ($\ce{X2}$)
- שתי הקבוצות נכנסות מצדדים נגדיים
הבהרת מנגנון הלוגנציה במים
בתגובת $\ce{X2}$ במים:
- שלב ראשון: יצירת יון הלוגנוניום (ברומוניום/כלורוניום) - גשר
- שלב שני: המים תוקפים את הפחמן היותר מותמר (בגלל צפיפות מטען חיובי גבוהה)
- תוצאה: $\ce{OH}$ על הפחמן היותר מותמר, $\ce{X}$ על הפחמן הפחות מותמר
חשוב לזכור: המים אינם קשורים למנגנון רדיקלי. זהו מנגנון יוני עם תחרות בין נוקלאופילים.
סיכום מלא תגובות אלקנים
טבלת תגובות סיפוח - עם דגשים חשובים
| תגובה | ריאגנטים | תוצר | דגש מרכזי |
|---|---|---|---|
| הידרוגנציה | $\ce{H2, Pd/Ni/Pt}$ | אלקן | סין - שני H באותו צד |
| הידרוהלוגנציה | $\ce{HX}$ | אלקיל הליד | מרקובניקוב - X ליותר מותמר |
| הידרוהלוגנציה רדיקלית | $\ce{HBr, ROOR/אור}$ | אלקיל הליד | אנטי-מרקובניקוב - Br לפחות מותמר |
| הידרציה | $\ce{H2O, H^+}$ או $\ce{H2SO4/H2O}$ | אלכוהול | מרקובניקוב - OH ליותר מותמר |
| אלקוהוליזה | $\ce{ROH, H^+}$ | אתר | מרקובניקוב - OR ליותר מותמר |
| הלוגנציה | $\ce{X2}$ | דיהליד | אנטי - X מצדדים נגדיים |
| הלוגנציה במים | $\ce{X2, H2O}$ | הלוהידרין | אנטי + OH ליותר מותמר |
תגובות חמצון
| תגובה | ריאגנטים | תוצר | דגש מרכזי |
|---|---|---|---|
| דיהידרוקסילציה | $\ce{KMnO4, NaOH, H2O}$ | דיול | סין - שני OH באותו צד |
| אפוקסידציה | פר־חומצה ($\ce{RCO3H}$) | אפוקסיד | יצירת טבעת תלת-מימדית |
פתיחת אפוקסיד
| תנאים | מנגנון דמוי | רגיוסלקטיביות | סטריאוכימיה |
|---|---|---|---|
| תנאים חומציים | $\mathrm{S_\mathrm{N}1}$ | נוקלאופיל ליותר מותמר | אנטי |
| תנאים בסיסיים | $\mathrm{S_\mathrm{N}2}$ | נוקלאופיל לפחות מותמר | אנטי |
הערה מרכזית: בשני המקרים התוצר הוא אנטי כי הנוקלאופיל תמיד מגיע מהצד הנגדי לגשר האפוקסיד.
מבוא לאלקינים
הגדרה ומבנה
אלקינים הם פחמימנים הידרוקרבונים המכילים קשר משולש ($\ce{C≡C}$).
מאפיינים מבניים
- שני קשרי פאי במקום אחד (בנוסף לקשר סיגמא)
- גיאומטריה ליניארית: זווית של 180°
- הברידיזציה: $sp$ על הפחמנים המעורבים בקשר המשולש
חשיבות ביולוגית ורפואית
אלקינים נמצאים במולקולות רבות בעלות פעילות ביולוגית:
- תרופות אנטי-סרטניות
- תרופות לטיפול בלחץ דם
- תרכובות טבעיות רבות
תגובות אלקינים - עקרונות כלליים
עיקרון מרכזי
“כל התגובות של האלקנים הן גם התגובות של האלקינים”.
ההבדל העיקרי: במקום תגובה אחת, מתרחשות שתי תגובות עוקבות (בגלל שני קשרי הפאי).
\[\ce{Alkyne ->[H2, catalyst] Alkene ->[H2, catalyst] Alkane}\] \[\ce{R-C#C-R' ->[H2, Pt/Pd/Ni] RCH=CHR' ->[H2, Pt/Pd/Ni] RCH2-CH2R'}\]תגובת הידרוגנציה של אלקינים
הידרוגנציה מלאה (רגילה)
ריאגנטים: $\ce{H2}$ עם זרז מתכת ($\ce{Pd, Ni, Pt}$)
\[\ce{R-C≡C-R' + 2H2 ->[Pd] R-CH2-CH2-R'}\]מה קורה בתגובה:
- שלב ראשון: אלקין ← אַלְקֵן (סיפוח $\ce{H2}$ ראשון)
- שלב שני: אַלְקֵן ← אלקאן (סיפוח $\ce{H2}$ שני)
בעיה: לא ניתן לעצור את התגובה באמצע - היא ממשיכה אוטומטית עד הסוף.
הידרוגנציה חלקית - זרז לינדלר
פתרון לבעיה: שימוש בזרז לינדלר (Lindlar Catalyst)
ריאגנטים: $\ce{H2}$ + זרז לינדלר
\[\ce{R-C≡C-R' + H2 ->[Lindlar Cat.] R-CH=CH-R'}\]יתרון הזרז לינדלר:
- עוצר את התגובה באַלְקֵן - לא ממשיך לאלקאן
- מאפשר סינתזה סלקטיבית של אַלְקֵנים מאלקינים
דרכי סינתזה שונות
| מטרה | ריאגנטים | תוצר |
|---|---|---|
| אלקין ← אַלְקֵן | $\ce{H2}$ + זרז לינדלר | אלקן |
| אלקין ← אלקן | $\ce{H2}$ + זרז רגיל ($\ce{Pd/Ni/Pt}$) | אלקאן |
הערה מנגנונית: המנגנון המדויק של זרז לינדלר אינו מובן לחלוטין. ידוע רק שהוא מונע המשך התגובה לאחר הסיפוח הראשון.
תגובת הידרוהלוגנציה של אלקינים
עקרון כללי
כמו באַלְקֵנים, רק פעמיים עוקבות:
\[\ce{R-C≡C-R' + HX -> R-CHX-CH=R' + HX -> R-CHX-CHX-R'}\]מנגנון מפורט - שלב אחר שלב
שלב ראשון - סיפוח HX ראשון
לפי כלל מרקובניקוב:
- $\ce{H^+}$ תוקף את הפחמן הפחות מותמר של הקשר המשולש
- נוצר קרבוקטיון על הפחמן היותר מותמר
- $\ce{X^-}$ תוקף את הקרבוקטיון
- תוצר ביניים: אַלְקֵן עם $\ce{X}$ על הפחמן היותר מותמר
שלב שני - סיפוח HX שני
התגובה ממשיכה עם מולקולת $\ce{HX}$ נוספת:
- $\ce{H^+}$ שוב תוקף את הפחמן הפחות מותמר (של הקשר הכפול החדש)
- נוצר קרבוקטיון על הפחמן היותר מותמר
- $\ce{X^-}$ תוקף שוב את הקרבוקטיון
- תוצר סופי: שני $\ce{X}$ על אותו פחמן (הפחמן היותר מותמר מהמקור)
דוגמה קונקרטית
\[\ce{CH3-C≡C-H + HBr -> CH3-CHBr-CH2 + HBr -> CH3-CHBr-CHBr-H}\]ניתוח התוצר:
- שני הברומים נמצאים על פחמנים שונים
- כל ברום הגיע לפחמן היותר מותמר בכל שלב
בקרת התגובה
עצירה בשלב הביניים
איך לעצור באַלְקֵן: שימוש במול אחד של $\ce{HX}$
- יחס מולרי 1:1 בין אלקין ל-$\ce{HX}$
- מונע המשך התגובה לשלב השני
המשך לתוצר הסופי
איך להגיע לתוצר הסופי: שימוש ב$\ce{HX}$ בעודף
- יחס מולרי 2:1 או יותר
- התגובה ממשיכה אוטומטית עד הסוף
הערות מסכמות לאלקינים
עקרונות מנחים
- כל תגובת אַלְקֵן ← תגובת אלקין (פעמיים)
- מנגנונים זהים לאלקנים, רק חוזרים פעמיים
- בקרת כמות ריאגנט מאפשרת עצירה באמצע או המשך לסוף
- כלל מרקובניקוב חל בכל שלב בנפרד
יתרונות סינתטיים
אלקינים מספקים גמישות סינתטית רבה:
- אפשרות ליצור אַלְקֵנים (עצירה באמצע)
- אפשרות ליצור תוצרים עם שתי קבוצות פונקציונליות
- בחירה בסוג הקבוצות הפונקציונליות (לפי הריאגנט)
הכנה לשיעור הבא
בשיעור הבא נמשיך עם:
- תגובות הלוגנציה של אלקינים ($\ce{X2}$)
- תגובות חמצון של אלקינים
- תגובות ייחודיות לאלקינים (שאינן קיימות באלקנים)
סיכום השוואתי: אַלְקֵנים vs אלקינים
| תגובה | אלקנים | אלקינים |
|---|---|---|
| הידרוגנציה | $\ce{C=C + H2 -> C-C}$ | $\ce{C≡C + 2H2 -> C-C}$ |
| הידרוהלוגנציה | $\ce{C=C + HX -> C-C}$ (X על יותר מותמר) | $\ce{C≡C + 2HX -> C-C}$ (שני X על יותר מותמר) |
| מספר שלבים | תגובה אחת | שתי תגובות עוקבות |
| בקרת תגובה | אין אפשרות עצירה | אפשרות עצירה באמצע |
מסקנה: אלקינים מרחיבים את הארסנל הסינתטי ומאפשרים יצירת מגוון רחב יותר של תוצרים בצורה מבוקרת.
דור פסקל