מבוא לקבוצת הקרבוניל
קבוצת הקרבוניל ($\ce{C=O}$) מהווה את אחת הקבוצות הפונקציונליות החשובות והנפוצות ביותר בכימיה אורגנית. בפרק זה נתמקד בשני סוגי הקרבונילים הבסיסיים: קֵטוֹנים ($\ce{R-CO-R’}$) ואלדהידים ($\ce{R-CHO}$). נגזרות הקרבוניל האחרות, כגון חומצות קרבוקסיליות, אסטרים, אמידים ואנהידרידים, יידונו בפרקים עוקבים העוסקים בנגזרות חומצה קרבוקסילית.
\[\begin{array}{ccc}& \text{keton} & \\[6pt]& \textcolor{red}{\ce{O}} & \\[-6pt]& \vert\vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup }{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\]\[\begin{array}{ccc} & \text{Aldehyde} & \\[6pt] & \textcolor{red}{\ce{O}} & \\[-6pt] & \parallel \\[-6pt] & \ce{C} & \\[-6pt]& \overset{\quad \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{H}} & \\[-6pt]\end{array}\]מקור המילה “אלדהיד” בלטינית: זהו קיצור של אלכוהול דהידרוֹגֵנָטוּם, “כוהל נטול מימן”. ויקיפדיה
מבנה מולקולרי ותכונות פיזיקליות
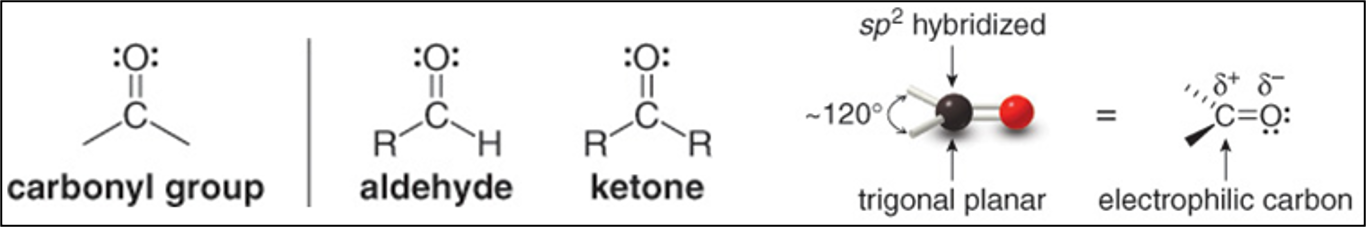
הפחמן הקרבונילי מאופיין בהיברידיזציה $sp^2$, המעניקה לו גיאומטריה משולשת-מישורית עם זוויות קשר של כ-120°. הקשר הכפול $\ce{C=O}$ מורכב מקשר $\sigma$ אחד ומקשר $\pi$ אחד, כאשר החמצן, בשל האלקטרושליליות הגבוהה שלו, משך את הצפיפות האלקטרונית אליו ויוצר פיזור מטען בקשר.
פיזור המטען הזה מביא לכך שהפחמן הקרבונילי נושא מטען חלקי חיובי ($\delta^+$) והחמצן נושא מטען חלקי שלילי ($\delta^-$). תכונה זו הופכת את הפחמן הקרבונילי לאלקטרופיל ואת החמצן לנוקלאופיל פוטנציאלי.
מבחינת כוחות בין-מולקולריים, קרבונילים אינם יוצרים קשרי מימן בין-מולקולריים (שכן אין להם קשר $\ce{O-H}$ או $\ce{N-H}$), אולם הם כן מפגינים אינטראקציות דיפול-דיפול חזקות בשל הקוטביות הגבוהה של הקשר $\ce{C=O}$. כתוצאה מכך, נקודות הרתיחה וההיתוך של קרבונילים גבוהות יותר מאלה של אלקנים בעלי משקל מולקולרי דומה, אך נמוכות יותר מאלה של אלכוהולים מקבילים.
ריאקטיביות והשפעות אלקטרוניות
סדר הריאקטיביות של קרבונילים
הריאקטיביות של קרבונילים כלפי התקפה נוקלאופילית נקבעת על פי גודל המטען החלקי החיובי על הפחמן הקרבונילי. ככל שהמטען החלקי החיובי גדול יותר, כך הפחמן הקרבונילי יהיה יותר אלקטרופילי ולכן יותר ריאקטיבי. סדר הריאקטיביות הוא:
\[\begin{array}{c} \text{Reactivity Order} \\ \text{Formaldehyde} > \text{Aldehyde} > \text{Ketone} \end{array}\]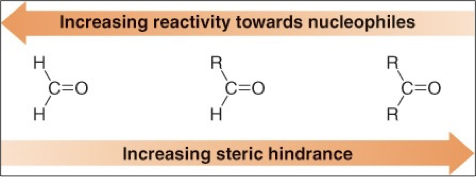
| קטון | אלדהיד | פורמלדהיד |
|---|---|---|
| \(\begin{array}{c} \textcolor{red}{\ce{O}} \\[-6pt] \vert \vert \\[-6pt] \ce{C} \\[-6pt] \overset{\quad \diagup}{\ce{R_1}} \quad \overset{\diagdown \quad}{\ce{R_2}} \end{array}\) | \(\begin{array}{c} \textcolor{red}{\ce{O}} \\[-6pt] \vert \vert \\[-6pt] \ce{C} \\[-6pt] \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{H}} \end{array}\) | \(\begin{array}{c} \textcolor{red}{\ce{O}} \\[-6pt] \vert \vert \\[-6pt] \ce{C} \\[-6pt] \overset{\quad \diagup}{\ce{H}} \quad \overset{\diagdown \quad}{\ce{H}} \end{array}\) |
| פחמן קרבונילי הקשור לשתי קבוצות אלקיל | פחמן קרבונילי הקשור לקבוצת אלקיל אחת ולמימן אחד | האלדהיד הפשוט ביותר, בו שני מימנים קשורים לפחמן הקרבונילי |
הריאקטיביות יורדת משמאל לימין בשל השפעת קבוצות האלקיל הדוחפות אלקטרונים
הסבר מכני לסדר הזה נעוץ בהשפעה של קבוצות האלקיל ($\ce{C_nH_{2n+1}}$) על הפחמן הקרבונילי. קבוצות אלקיל הן קבוצות דוחפות אלקטרונים (בשל ההשפעה ההיפרקונג׳וגטיבית), והן פועלות למתן המטען החלקי החיובי על הפחמן הקרבונילי. בפורמלדהיד ($\ce{H2CO}$) אין קבוצות אלקיל, ולכן המטען החלקי החיובי הוא הגדול ביותר. באלדהידים יש קבוצת אלקיל אחת המפחיתה מעט את האלקטרופיליות, ובקטונים יש שתי קבוצות אלקיל המפחיתות עוד יותר את הריאקטיביות.
קטליזה חומצית וטעמה
במקרים רבים, קטונים אינם ריאקטיביים מספיק כדי שנוקלאופילים יתקפו אותם בתנאים ניטרליים. במצבים כאלה נעשה שימוש בקטליזה חומצית כדי להגביר את הריאקטיביות. כאשר חומצה מתווספת למערכת, החמצן הקרבונילי, שמשמש כבסיס לואיס, קוטף פרוטון ויוצר יון אוקסוניום:
\[\ce{R2C=O + H^+ -> R2C=OH^+}\]הפרוטונציה הופכת את הפחמן הקרבונילי ממטען חלקי חיובי למטען חיובי מלא, מה שמגביר משמעותית את האלקטרופיליות שלו ומקל על ההתקפה הנוקלאופילית. התהליך הזה חיוני בתגובות רבות ובתהליכים ביולוגיים.
חומציות מימני אלפא
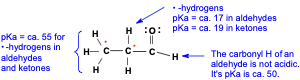
המימן החומצי ביותר בקרבונילים
אחת התכונות החשובות של קרבונילים היא החומציות היחסית של מימני האלפא - המימנים הקשורים לפחמנים הסמוכים לקבוצת הקרבוניל. מימני האלפא הם החומציים ביותר במולקולת הקרבוניל, עם ערכי $pK_a$ של כ-19-20 (לעומת ערך של כ-25 למימנים על פחמנים רגילים).
החומציות הגבוהה של מימני האלפא נובעת מהיציבות של האניון שנוצר לאחר סילוק הפרוטון. כאשר בסיס חזק קוטף את מימן האלפא, נוצר אניון (אנולט) שיכול להיות מיוצב על ידי רזוננס:
\[\ce{R-CH2-CO-R' ->[OH-] [R-CH^--CO-R' <-> R-CH^--C^+=O^--R']}\]המטען השלילי מתחלק בין הפחמן אלפא לבין החמצן הקרבונילי, מה שמעניק יציבות משמעותית לאנולט. רזוננס זה הוא הגורם העיקרי לחומציות המוגברת של מימני האלפא.
\[\begin{array}{rcl} \ce{R-CH2-CO-R'} & + & \ce{B^-} \\[6pt] \downarrow & & \\[6pt] \ce{R-CH^{\ominus}-CO-R'} & \ce{<=>} & \ce{R-CH^{\ominus}-C^{\oplus}=O^{\ominus}-R'} \end{array}\]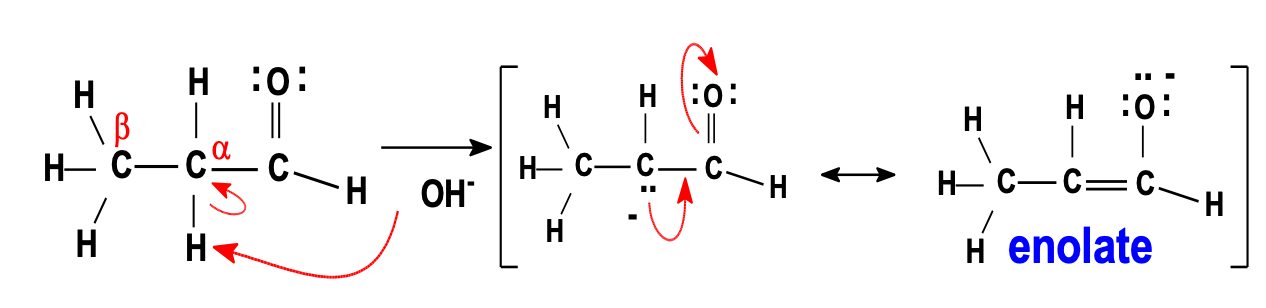
השלכות סינתטיות
התכונה הזו של מימני האלפא חשובה במיוחד בסינתזה אורגנית, שכן היא מאפשרת לקרבונילים לשמש כנוקלאופילים באמצעות פחמן האלפא, בנוסף לתפקידם כאלקטרופילים באמצעות הפחמן הקרבונילי. הדואליות הזאת הופכת את הקרבונילים לבעלי ערך סינתטי רב.
שיטות הכנה של אלדהידים וקטונים
הכנת אלדהידים ($\ce{R-CHO}$)
חמצון אלכוהולים ראשוניים
השיטה הנפוצה ביותר להכנת אלדהידים היא חמצון מבוקר של אלכוהולים ראשוניים. אלכוהול ראשוני יכול להתחמצן לאלדהיד ואז להמשיך להתחמצן לחומצה קרבוקסילית:
\[\ce{R-CH2OH ->[O] R-CHO ->[O] R-COOH}\]כדי לעצור את התהליך בשלב האלדהיד, נעשה שימוש בריאגנט חמצון ספציפי $\ce{PCC}$ (פירידיניום כלורוכרומט) בממס אורגני ללא מים:
\[\ce{R-CH2OH + PCC -> R-CHO}\]השימוש ב-PCC ובתנאים נטולי מים מונע את המשך ההתחמצנות לחומצה קרבוקסילית.
אוזונוליזה בתנאים מחזרים
שיטה נוספת להכנת אלדהידים היא אוזונוליזה של אלקנים בתנאים מחזרים:
\[\ce{R-CH=CH-R' + O3 -> R-CHO + R'-CHO}\]כאשר האוזונוליזה מתבצעת בנוכחות זרחן ו-$\ce{H2O}$ (תנאים מחזרים), התוצרים הם אלדהידים.
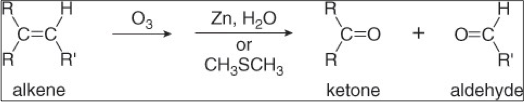
אם התגובה מתבצעת בתנאים מחמצנים (למשל עם $\ce{KMnO4}$ או $\ce{H2O2}$), האלדהידים ימשיכו להתחמצן לחומצות קרבוקסיליות.
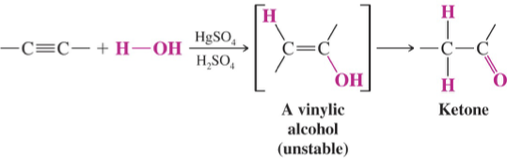
הכנת קטונים
חמצון אלכוהולים שניוניים
קטונים מתקבלים בקלות מחמצון של אלכוהולים שניוניים. בניגוד לאלכוהולים ראשוניים, אלכוהולים שניוניים יכולים להתחמצן רק לקטונים ולא יותר מכך:
\[\ce{R-CHOH-R' + [O] -> R-CO-R'}\]ניתן להשתמש במגוון ריאגנטי חמצון, כולל $\ce{H2CrO4}$, $\ce{PCC}$, או ריאגנט ג׳ונס.
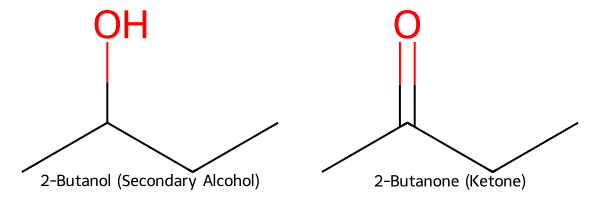
אוזונוליזה של אלקנים
כמו באלדהידים, גם קטונים יכולים להתקבל מאוזונוליזה של אלקנים בתנאים מחזרים.
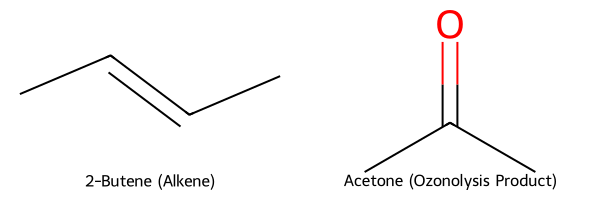
הידרציה של אלקינים
שיטה נוספת להכנת קטונים היא הידרציה של אלקינים בנוכחות חומצה. התגובה עוברת דרך אנול כתוצר ביניים, שמתארגן מיד לקטון בשיווי משקל טאוטומרי:
\[\ce{R-C#C-R' + H2O + H^+ -> R-CO-CH2-R'}\]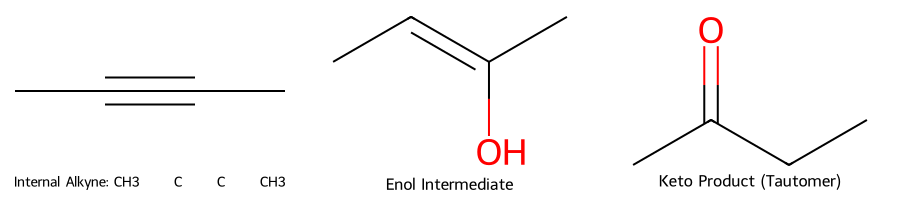
דוגמאות ותרגילים מההרצאה
שאלה 1: זיהוי סוג אלכוהול וחיזוי תוצר חמצון
באיזה תהליך תשתמש כדי להפוך 1-פרופנול (1-propanol) לפרופאנול (propanal)?
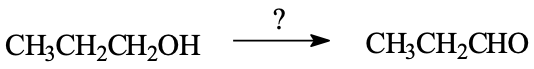
נזהה את סוג האלכוהול - מדובר באלכוהול ראשוני. התוצר הוא אלדהיד, ולכן נשתמש בחמצון מבוקר של אלכוהול ראשוני כדי לקבל את התוצר המבוקש. ריאגנט מתאים הוא $\ce{PCC}$ (פירידיניום כלורוכרומט), אשר ימיר את 1-פרופנול לפרופאנל.
הבהרה: למדנו שני ריאגנטים מתאימים לחמצון - PCC או חומצה כרומית ($\ce{H2CrO4}$). PCC עוצר באלדהיד (לא ממשיך לחומצה קרבוקסילית), בעוד חומצה כרומית יכולה להמשיך לחמצן לאלדהיד או לחומצה קרבוקסילית. במקרה זה, PCC הוא הבחירה הנכונה.
שאלה 2: ריאקטיבי
איזה קרבוניל מגיב הכי מהר עם נוקליאופילים?
- אלדהיד
- חומצה
- אסטר
- קטון
התשובה היא 1. אלדהיד.
נזכיר שריאקטיביות של קרבונילים נובעת מעד כמה שה-$\delta^+$ על הפחמן הקרבונילי גדול. ככל שהאלקיל דוחף יותר אלקטרונים, כך המטען החיובי קטן יותר והקרבוניל פחות ריאקטיבי. אלדהידים הם הריאקטיביים ביותר, אחריהם קטונים, ואז אסטרים וחומצות קרבוקסיליות.

השאר דוחפים אלקטרונים וזה מוריד דלטה פלוס הוא מרגיש פחות אלקטרוילי.
שאלה 3: תגובת מים עם 1-בוטין
מה התוצר הסופי שמקתבל מתגובת מים עם 1-בוטין (אלקין טרמינלי: $\text{1-Butyne}$)?
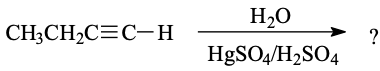
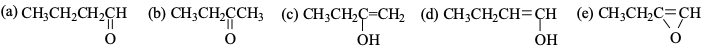
התשובה היא $\mathbf{(b)}$ - קטון.
בסיפוח מים על אלקין בהתחלה מתקבל אנול ($\ce{OH}$ על הפחמן היותר מותמר), ולאחר מכן הוא מתארגן לקטון. התגובה מתבצעת בנוכחות חומצה, והאנול מתארגן לקטון בשיווי משקל טאוטומרי.
תשומת הלב ש c הוא לפני שיווי המשקל.
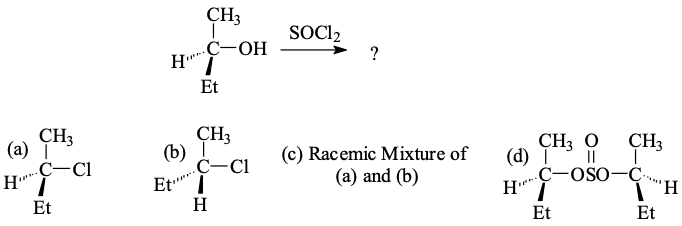
שאלה 4: הפיכת כוהל לקבוצה עוזבת טובה עם $\ce{SOCl2}$
התשובה היא שוב $\mathbf{(b)}$.
התהליך:
- $\ce{O}$ תוקף את הגופרית, מוציא כלור החוצה
- הכלור שיצא תוקף את הפחמן
הפחמן כיראלי, הכלור תוקף במנגנון $\mathrm{S_N2}$, ויש היפוך קונפיגורציה.
לא תערובת רצמית! במנגנון $\mathbf{S_N2}$ יש היפוך קונפיגורציה, כלומר מתקבל רק איזומר אחד.
שאלה 5: הבחנה בין תקיפת קרבוניל לתקיפת אפוקסיד ועוד
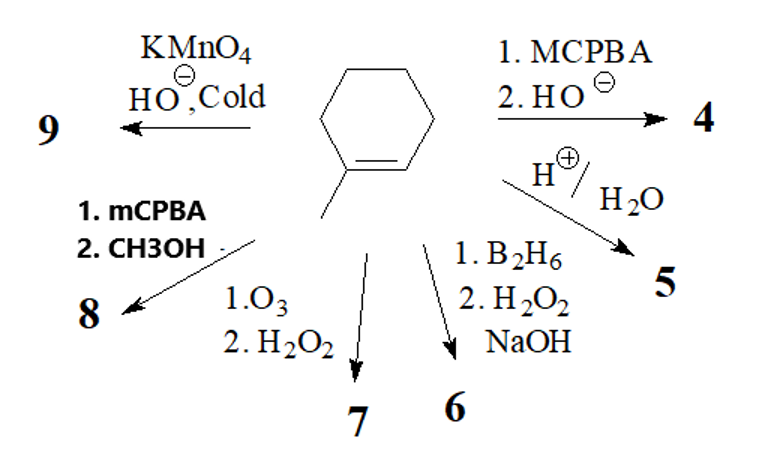
שאלות מספר 5 ו-6 לא בחומר. האפשרויות:
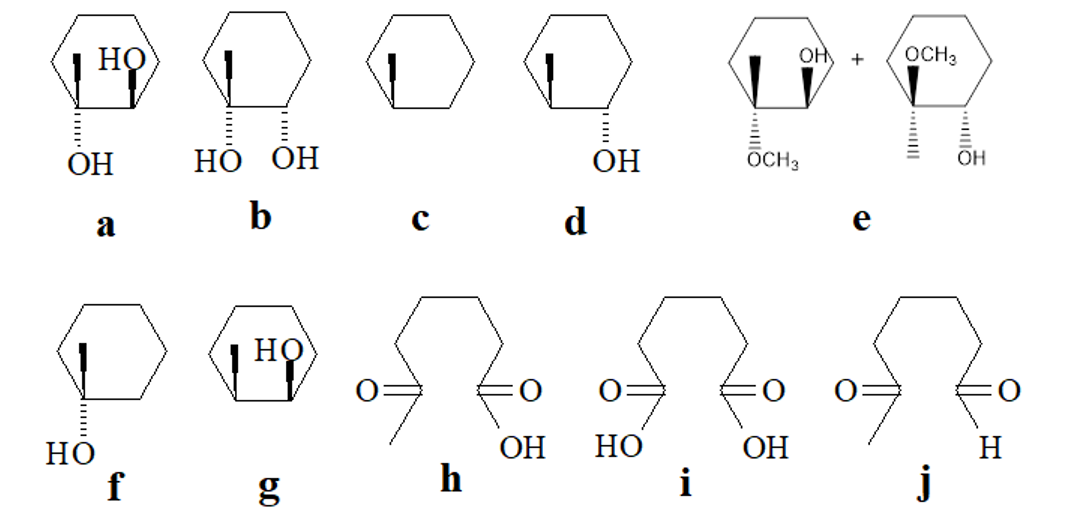
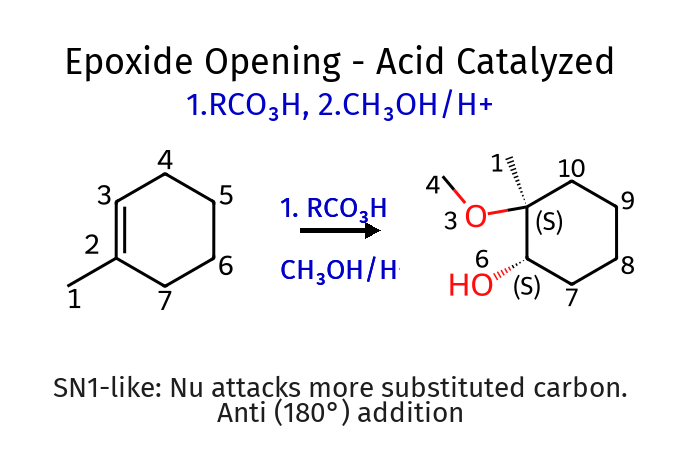
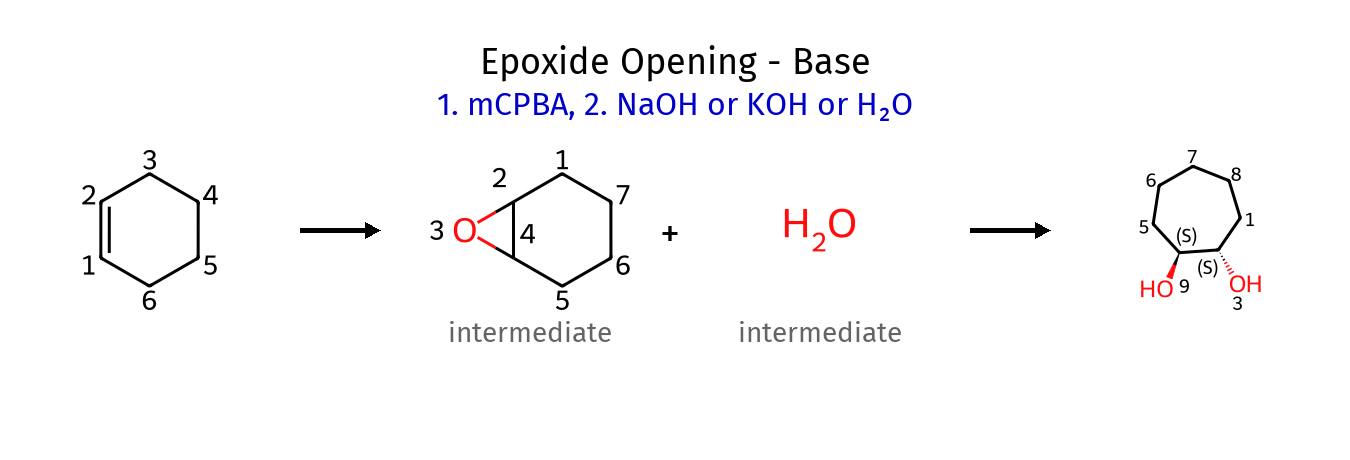
התשובה של 4 היא $\mathbf{(a)}$ - בפתיחת אפוקדיס בסביבה בסיסית הנוקלאופיל תוקף את הגשר מהצד השני, כך ששתי קבוצות הכוהל באנטי זו לזו.
 |  |
לגבי 7 - התשובה היא $\mathbf{(h)}$ - אוזוליזה בתנאים מחמצנים תיתן חומצה קרבוקסילית, ואילו בתנאים מחזרים תיתן אלדהיד או קטון.
לגבי $\ce{KMnO4}$:
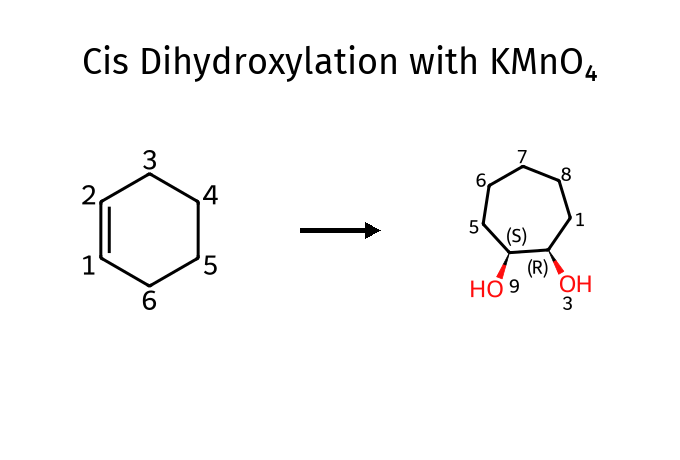
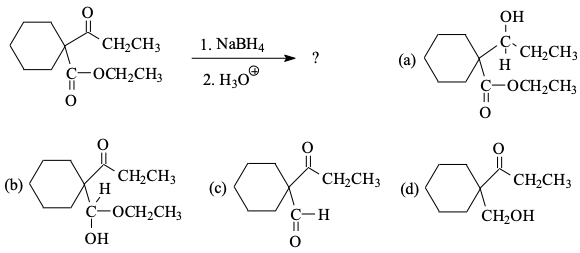
שאלה 6: חיזור באמצעות סודיום בורוהידריד
התשובה היא a.
סודיום בורוהידריד ($\ce{NaBH4}$) תוקף את הפחמן הקרבונילי עם ה-$\ce{H}$ שלו, והופך קטון ואלדהיד לכוהל. הוא לא נוגע בשאר הקרבונילים (אסתר, אלקיל הליד, חומצה קרבוקסילית). הוא בעצם מחזר את הפחמן הקרבונילי ומכניס $\ce{H-}$.
שאלה 7: תגובות עוקבות
שאלה: מה קורה כאשר מתחילים מ-$\ce{CH3MgBr}$, מגיבים עם $\ce{CH3Br}$, ואז עם עודף $\ce{HBr}$?
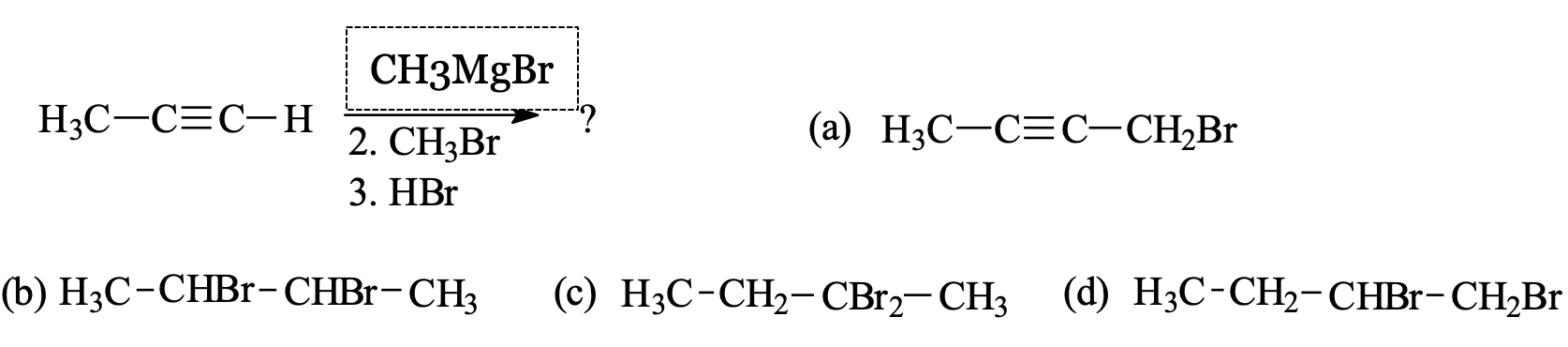
פתרון:
-
$\ce{CH3MgBr}$ קוטף פרוטון מאצטילן, במקום $\ce{H}$ יהיה מינוס.
\[\ce{H3C-C#C-H ->[CH3MgBr] H3C-C#C^{\ominus}}\] -
התוצר מגיב עם $\ce{CH3Br}$ בתגובת $\mathbf{S_N2}$ - המינוס תוקף את הפחמן של $\ce{CH3Br}$, ויוצר $\ce{H3C-C#C-CH3}$.
\[\ce{H3C-C#C^{\ominus} ->[CH3Br] H3C-C#C-CH3 + Br^-}\] -
$\ce{HBr}$ על אלקין מכניס $\ce{H}$ לפחות מותמר ו-$\ce{Br}$ ליותר מותמר. פה הם אותו הדבר אבל בכל מקרה הוא עושה את זה שוב ושוב. בסוף הקשר המשולש נפתח לחלוטין כאשר ברומים נכנסים מצד אחד ומימנים מהצד השני. התור הוא תשוב c כי כל המימנים נכנסים מצד אחד והברומים מהצד השני.
\[\ce{H3C-C#C-CH3 ->[HBr] H3C-CH2-CBr2-CH3}\]
הערה: אם לא כתוב $\text{1 equiv.}$, אז יש עודף של $\ce{HBr}$, כלומר התגובה מתמשכת עד שהקשר המשולש נפתח לחלוטין. ברירת המחדל היא שמגיבים בעודף.
תגובות נוקלאופיליות על קרבונילים
תגובת reductive amination - אמינציה חוזרת
תגובת האמינציה החוזרת מהווה שיטה יעילה וחשובה להכנת אמינים מקרבונילים. תגובה זו מתבצעת בשני שלבים עוקבים: תחילה יצירת האמין או האנאמין, ולאחר מכן חיזור של הקשר הכפול $\ce{C=N}$ לקבלת האמין הסופי.
השלב הראשון - יצירת האמין
כפי שנלמד קודם לכן, קטון או אלדהיד מגיבים עם אמין ראשוני ליצירת אמין:
\[\ce{R-CO-R' + RNH2 ->[H^+] R-C(=NR)-R' + H2O}\]השלב השני - חיזור האמין
האמין שנוצר ניתן לחיזור באמצעות הידרוגנציה קטליטית, המתבצעת בנוכחות זרחן ומימן במסגרת טמפרטורה ולחץ מתונים:
\[\ce{R-C(=NR)-R' + H2 ->[Pd/C] R-CH(NHR)-R'}\]בתגובת ההידרוגנציה, הקשר הכפול $\ce{C=N}$ נשבר, וכל אטום פחמן וחנקן מקבל אטום מימן אחד. התוצר הסופי הוא אמין שניוני במקום האמין הראשוני המקורי.
יישומים סינתטיים
התגובה מתאימה הן לאמינים ראשוניים והן לאמינים שניוניים:
- עם $\ce{NH3}$: מקבלים אמין ראשוני
- עם אמין ראשוני: מקבלים אמין שניוני
- עם אמין שניוני: מקבלים תחילה אנאמין ולאחר החיזור - אמין שלישוני
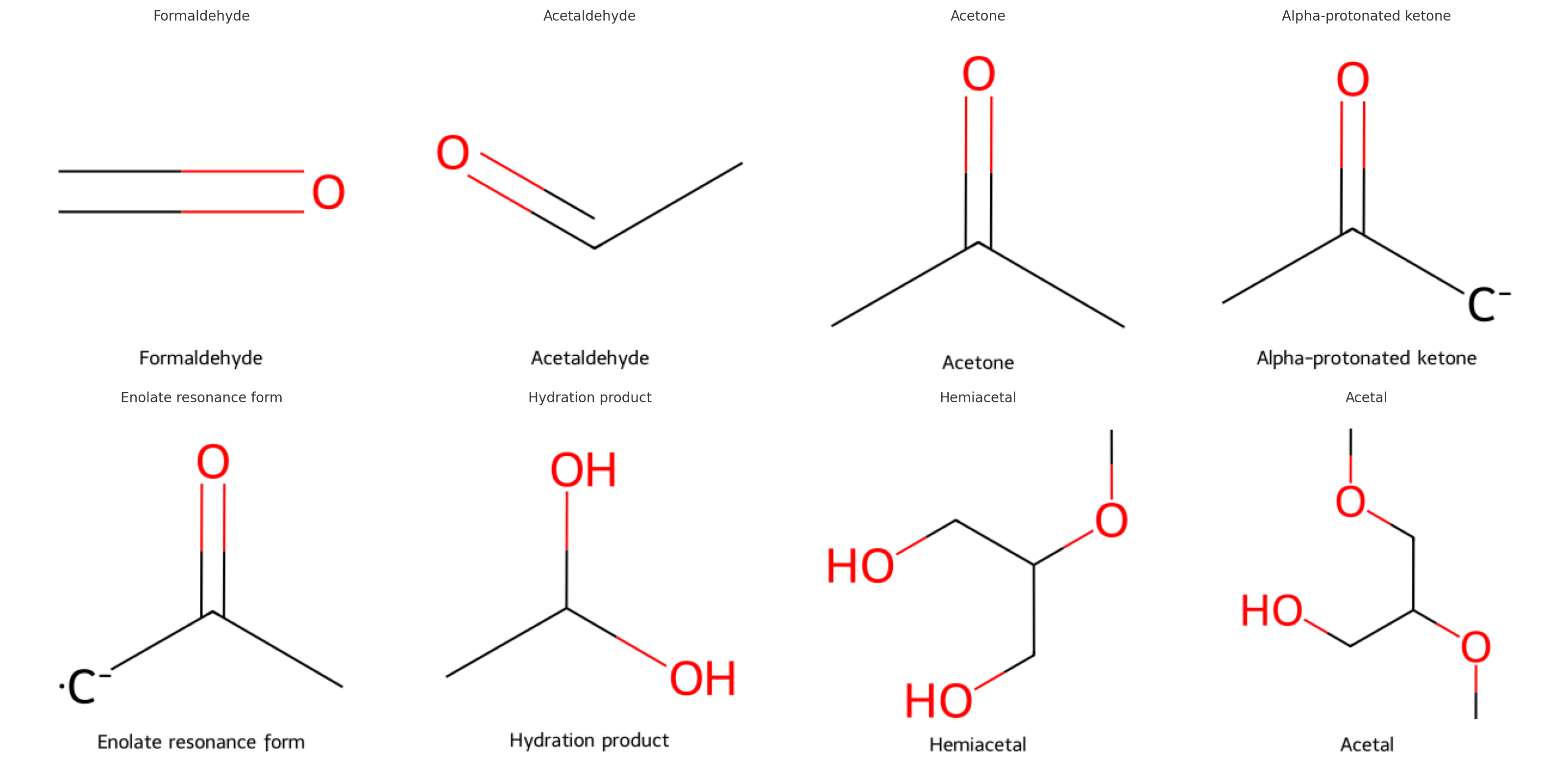
תגובת הידרציה - יצירת הידרטים
תגובת ההידרציה כוללת תוספת של מולקולת מים לקרבוניל, המביאה לייצור הידרט (gem-diol). בהידרט, על אותו פחמן נמצאות שתי קבוצות הידרוקסיל.
שיווי משקל והיציבות
מיקום שיווי המשקל בין הקרבוניל להידרט תלוי ברמת האלקטרופיליות של הפחמן הקרבונילי:
- פורמלדהיד: שיווי המשקל נוטה מאוד לכיוון ההידרט בשל האלקטרופיליות הגבוהה
- אלדהידים אחרים: שיווי משקל בינוני, תלוי בטבע הקבוצות המחוברות
- קטונים: שיווי המשקל נוטה לכיוון הקרבוניל המקורי בשל ההשפעה המייצבת של שתי קבוצות האלקיל
מנגנון בקטליזה בסיסית
בתנאים בסיסיים, יון הידרוקסיד משמש כנוקלאופיל חזק ותוקף ישירות את הפחמן הקרבונילי:
\[\ce{R-CO-R' + OH^- -> R-C(OH)(O^-)-R'}\] \[\ce{R-C(OH)(O^-)-R' + H2O -> R-C(OH)2-R' + OH^-}\]מנגנון בקטליזה חומצית
בתנאים חומציים, התגובה מתחילה בפרוטונציה של החמצן הקרבונילי להגברת האלקטרופיליות:
\[\ce{R-CO-R' + H^+ -> R-C(OH^+)-R'}\] \[\ce{R-C(OH^+)-R' + H2O -> R-C(OH)(OH2^+)-R'}\] \[\ce{R-C(OH)(OH2^+)-R' -> R-C(OH)2-R' + H^+}\]הפרוטונציה המקדימה הופכת את הפחמן ממטען חלקי חיובי ($\delta^+$) למטען חיובי מלא, מה שמאפשר למים (נוקלאופיל חלש יחסית) לתקוף ביעילות.
תגובת יצירת אצטלים וקטלים
תגובה זו מהווה הרחבה של תגובת ההידרציה, כאשר במקום מים כנוקלאופיל משתמשים באלכוהול. התוצר הסופי נקרא אצטל (מאלדהיד) או קטל (מקטון).
המבנה הכללי של אצטלים
באצטל, הפחמן המקורי של הקרבוניל קשור לשתי קבוצות אלקוקסי ($\ce{-OR}$) במקום החמצן הקרבונילי:
\[\ce{R-CHO + 2ROH <=> R-CH(OR)2 + H2O}\] \[\ce{R-CO-R' + 2ROH <=> R-C(OR)2-R' + H2O}\]חשיבות כקבוצות הגנה
אצטלים וקטלים משמשים כקבוצות הגנה חיוניות בסינתזה אורגנית מורכבת. קבוצת הגנה היא קבוצה פונקציונלית שמוספת זמנית למולקולה כדי למנוע תגובות לא רצויות באתר מסוים, תוך אפשרה לביצוע תגובות באתרים אחרים במולקולה.
יתרונות האצטלים כקבוצות הגנה:
- יציבות בתנאים בסיסיים ובנוכחות נוקלאופילים
- אינרטיות כלפי ריאגנטי חיזור ואלקילציה
- אפשרות הסרה קלה בתנאים חומציים מימיים
מנגנון יצירת האצטל
התגובה מתבצעת בקטליזה חומצית ויש בה דמיון רב למנגנוני היצירה שנלמדו קודם:
שלב ראשון - התקפה נוקלאופילית ראשונה:
\[\ce{R-CHO + H^+ -> R-CH(OH^+)}\](פרוטונציה)
\[\ce{R-CH(OH^+) + ROH -> R-CH(OH)(ORH^+)}\](התקפה נוקלאופילית)
\[\ce{R-CH(OH)(ORH^+) -> R-CH(OH)(OR) + H^+}\](דפרוטונציה)
התוצר של השלב הראשון נקרא המיאצטל - מולקולה הכוללת קבוצת הידרוקסיל אחת וקבוצת אלקוקסי אחת על אותו פחמן.
שלב שני - יצירת האצטל המלא:
\[\ce{R-CH(OH)(OR) + H^+ -> R-CH(OH2^+)(OR)}\](פרוטונציה של ההידרוקסיל)
\[\ce{R-CH(OH2^+)(OR) -> R-CH^+(OR) + H2O}\](יציאת מים ויצירת קרבוקטיון)
\[\ce{R-CH^+(OR) + ROH -> R-CH(ORH^+)(OR)}\](התקפה נוקלאופילית שנייה)
\[\ce{R-CH(ORH^+)(OR) -> R-CH(OR)2 + H^+}\](דפרוטונציה סופית)
מאפייני המנגנון
השלב השני דומה במהותו לתגובת $S_N1$ - יציאת מים יוצרת קרבוקטיון זמני שמיוצב על ידי האלקטרונים הלא קושרים של החמצן הסמוך (יציבות על ידי רזוננס). מולקולת האלכוהול השנייה תוקפת את הקרבוקטיון המיוצב ויוצרת את האצטל המלא.
הפיכות התגובה
תגובת יצירת האצטל היא הפיכה לחלוטין. בתנאים חומציים מימיים ניתן לבצע הידרוליזה של האצטל ולקבל חזרה את הקרבוניל המקורי:
\[\ce{R-CH(OR)2 + H2O + H^+ -> R-CHO + 2ROH}\]מנגנון ההידרוליזה הוא הפוך למנגנון היצירה - פרוטונציה של אחת מקבוצות האלקוקסי, יציאתה כאלכוהול ויצירת קרבוקטיון, התקפה של מים, ולבסוף יציאת האלכוהול השני.
השלמת מנגנון יצירת האצטלים
השלב השני - התקפה נוקלאופילית שנייה
לאחר היווצרות המיאצטל (תוצר הביניים עם קבוצת הידרוקסיל אחת וקבוצת אלקוקסי אחת), התגובה ממשיכה לשלב השני המוביל לאצטל המלא. שלב זה דומה במהותו לשלב הראשון, אך כרוכב בהחלפת קבוצת ההידרוקסיל במולקולת אלכוהול נוספת.
פרוטונציה וטירור קבוצה עוזבת
השלב מתחיל בפרוטונציה של קבוצת ההידרוקסיל, המסבה להופכה לקבוצה עוזבת טובה:
\[\ce{R-CH(OH)(OR') + H^+ -> R-CH(OH2^+)(OR')}\]כפי שלמדנו בתגובות קודמות, $\ce{OH^-}$ היא קבוצה עוזבת גרועה, בעוד $\ce{H2O}$ היא קבוצה עוזבת טובה משמעותית.
יציאת המים וירושה קרבוקטיון
לאחר הפרוטונציה, מולקולת המים עוזבת ויוצרת קרבוקטיון זמני. קרבוקטיון זה מיוצב על ידי רזוננס עם הזוג האלקטרונים הלא קושר של החמצן הסמוך:
\[\ce{R-CH(OH2^+)(OR') -> R-CH^+(OR') + H2O}\]הקרבוקטיון יכול להיות מתואר על ידי מבני רזוננס:
\[\ce{R-CH^+(OR') <-> R-CH=O^+R'}\]יציבות רזוננטית זו הופכת את הקרבוקטיון לביניים יציב יחסית, בדומה למנגנון $S_N1$.
התקפה נוקלאופילית שנייה
מולקולת האלכוהול השנייה תוקפת את הקרבוקטיון המיוצב:
\[\ce{R-CH^+(OR') + R'OH -> R-CH(OR')(OR'H^+)}\] \[\ce{R-CH(OR')(OR'H^+) -> R-CH(OR')2 + H^+}\]לבסוף, דפרוטונציה משחררת את החומצה ויוצרת את האצטל המלא.
אצטלים מחזוריים - יצירה מדיולים
כאשר משתמשים בדיול (מולקולה עם שתי קבוצות הידרוקסיל) במקום שתי מולקולות אלכוהול נפרדות, התגובה יכולה ליצור אצטל מחזורי. תהליך זה מועדף אנטרופית מאחר שמדובר בתגובה אינטרמולקולרית (בתוך אותה מולקולה) במקום אינטרמולקולרית.
דיול אתילן כדוגמה:
\[\ce{R-CHO + HOCH2CH2OH ->[H^+] R-CH + H2O}\]כאשר הטבעת המתקבלת כוללת חמישה או שישה אטומים, היא יציבה מבחינה תרמודינמית ולכן התגובה מתקדמת ביעילות. בדוגמה זו, נוצרת טבעת של חמישה אטומים (שני פחמנים ושני חמצנים מהדיול, פלוס הפחמן המקורי של הקרבוניל).
גורמים מבניים מסייעים
יצירת האצטל המחזורי מועדפת גם בשל אפקט הקירבה - שתי קבוצות ההידרוקסיל בדיול נמצאות בקרבה מרחבית זו לזו, מה שמקל על התגובה האינטרמולקולרית. בנוסף, מבנה הדיול מאפשר יצירת קשרי מימן אינטרמולקולריים שמייצבים את המבנה לפני התגובה.
קבוצות הגנה בסינתזה אורגנית
האצטלים והקטלים משמשים כקבוצות הגנה חיוניות בסינתזה אורגנית מתקדמת. קבוצת הגנה היא קבוצה פונקציונלית שמוחברת זמנית לאתר ריאקטיבי במולקולה כדי למנוע ממנו להגיב בתנאים מסוימים, תוך שמירה על היכולת להסיר אותה בשלב מאוחר יותר.
הצורך בקבוצות הגנה
בסינתזה של מולקולות מורכבות, כגון תרופות, קיימות לעיתים קרובות מספר קבוצות פונקציונליות ריאקטיביות באותה מולקולה. כאשר רוצים לבצע תגובה ספציפית על אתר אחד בלבד, קיים סיכון שהריאגנט יגיב גם עם אתרים אחרים. קבוצות ההגנה פותרות בעיה זו על ידי “הסתרה” זמנית של אתרים מסוימים.
דוגמה סינתטית מעשית
נניח שיש לנו מולקולה המכילה גם קטון וגם אסטר, ואנו רוצים לחזר רק את האסטר באמצעות ליטיום אלומיניום הידריד ($\ce{LiAlH4}$). מאחר ש-$\ce{LiAlH4}$ מגיב הן עם קטונים והן עם אסטרים, הוא יחזר את שני האתרים.
אסטרטגית ההגנה:
- הגנה: הפיכת הקטון לאצטל/קטל באמצעות אלכוהול וקטליזה חומצית
- תגובה: חיזור האסטר באמצעות $\ce{LiAlH4}$
- הסרת הגנה: הידרוליזה של האצטל/קטל בתנאים חומציים מימיים לקבלת הקטון המקורי
יתרונות האצטלים כקבוצות הגנה:
- יציבות בתנאים בסיסיים: האצטלים אינם מגיבים עם בסיסים או נוקלאופילים חזקים
- יציבות בתנאים מחזרים: עמידים בפני ריאגנטי חיזור כמו $\ce{LiAlH4}$ ו-$\ce{NaBH4}$
- הסרה קלה: ניתנים להסרה בקלות בתנאים חומציים מימיים מתונים
- ספציפיות: משחררים את הקרבוניל המקורי ללא שינויים מבניים אחרים
דוגמאות מעשיות ותרגילים מסכמים
תרגיל רב-שלבי מורכב
בתרגיל המובא בהרצאה, התבקשנו להמיר אלקן פשוט למולקולה מורכבת באמצעות רצף תגובות. תרגילים כאלה בודקים את היכולת לחבר תגובות שונות ולתכנן נתיב סינתטי הגיוני.
אסטרטגיית פתרון:
כאשר פותרים תרגיל סינתטי מורכב, מומלץ לעבוד “לאחור” מהתוצר הסופי:
- ניתוח התוצר הסופי: זיהוי הקבוצות הפונקציונליות והמבנה
- זיהוי התגובה האחרונה: מה הייתה התגובה שיצרה את התוצר הסופי?
- עבודה לאחור: מה היה חומר המוצא לתגובה האחרונה?
- המשך הרצף: חזרה על התהליך עד להגעה לחומר המוצא הנתון
חזרה על תגובות אלקנים
בסוף ההרצאה נסקרו תגובות אלקנים חשובות:
תוספת HBr לאלקנים:
\[\ce{R-CH=CH-R' + HBr -> R-CHBr-CH2-R'}\]התגובה פועלת לפי כלל מרקובניקוב - הפרוטון מתחבר לפחמן הפחות מותמר של הקשר הכפול, והברום לפחמן היותר מותמר.
תוספת $\ce{Cl2}$ לאלקנים:
\[\ce{R-CH=CH-R' + Cl2 -> R-CHCl-CHCl-R'}\]תגובה זו מתבצעת באמצעות מנגנון אנטי-תוספת, כאשר שני אטומי הכלור מתחברים מצדדים מנוגדים של הקשר הכפול המקורי.
השפעות סטריאוכימיות:
בתרגילים הנדונים הודגמה חשיבות הסטריאוכימיה בתגובות אורגניות. כאשר הפחמנים הם כיראליים, יש לקחת בחשבון את הקונפיגורציה של התוצרים ואת המנגנון הספציפי (למשל, האם מדובר בתוספת סין או אנטי).
דור פסקל