חומצה גופרתית - Sulfuric Acid: A Unique Case
רוב החומצות שלמדנו עליהן הן חומצות חד-פרוטיות (מונופרוטיות), כלומר, שלמולקולות שלהן יש רק אטום $\text{H}$ אחד שניתן ליינון (הוצאה ומסירה). חומצות עם יותר מאטום מימן אחד כזה, $\left(\text{H}_3\text{PO}_4\right)$ למשל, נקראות חמצות רב-פרוטיות (פוליפרוטיות). חומצות עם שני אטומי מימן נקראות חומצות דו-פרוטיות, חומצות עם שלושה אטומי מימן נקראות חומצות תלת-פרוטיות, וכן הלאה.
דוגמה לחומצה יחסית חריגה היא החומצה הגופריתית $\left(\text{H}_2\text{SO}_4\right)$. זו חומצה דו-פרוטית, ולכן עוברת ייוניזציה פעמיים: בפעם הראשונה היא מתפקדת כחומצה חזקה:
\[\text{H}_2\text{SO}_4 + \text{H}_2\text{O} \rightarrow \text{H}_3\text{O}^+ + \text{HSO}_4^-\]אך בפעם השנייה היא מתפקדת כחומצה חלשה:
\[\text{HSO}_4^- + \text{H}_2\text{O} \leftrightharpoons \text{H}_3\text{O}^+ + \text{SO}_4^{2-}\] \[\text{K}_{a1} = \text{very large} \quad \text{K}_{a2} = 1.1 \times 10^{-2}\] \[\text{p}K_{a1} \lt 0 \quad \text{p}K_{a2} = -\log(1.1 \times 10^{-2}) = 1.96\]מלחים של חומצות - הידרוליזה
הידרוליזה היא תגובה בין יון לבין מים. בתהליך הידרוליזה בסיס חלש או חומצה חלשה מגיבים עם מים, ומתפרקים לקבלת חומצה ובסיס חלשים בהתאם לקבוע שיווי המשקל שלהם.
תמיסה מימית של $\text{NaCl}$ נחשבת נייטרלית. נתרן (סודיום)$\left( \text{Na}^+ \right)$ במים נשאר כמות שהוא וכך גם כלור $\left( \text{Cl}^- \right)$.
\[\text{Na}^+ + \text{H}_2\text{O} \rightarrow \text{Na}^+ + \text{H}_2\text{O}\] \[\text{Cl}^- + \text{H}_2\text{O} \rightarrow \text{Cl}^- + \text{H}_2\text{O}\]מלחים (יונים) רגילים, לא יובילו לתגובה. עם זאת, יון שנובע מחומצה, כמו $\text{C}_2\text{H}_3\text{O}_2^-$, דווקא כן יגיב עם המים - יון כזה ייצור את החומצה בחזרה, יחד עם $\text{OH}^-$:
\[\text{C}_2\text{H}_3\text{O}_2^- + \text{H}_2\text{O} \rightarrow \text{C}_2\text{H}_3\text{O}_2\text{H} + \text{OH}^-\]המקור ליון הזה היא המלח שלו - $\text{NaC}_2\text{H}_3\text{O}_2$. כאשר מוסיפים את המלח למים, הוא יתפרק ליון חומצה וליון בסיס.
ה-$\text{pH}$ של תמיסות מלחים
-
מלחים רגילים $\left(\text{NaCl}\right)$ (דור: של חומצות חזקות או בסיסים חזקים, להבנתי) לא עושים שינוי ל $\text{pH}$ של המים.
-
מלח של חומצה חלשה $\left(\text{NaC}_2\text{H}_3\text{O}_2\right)$ יעבור הידרוליזה (יתפרק) ויתנהג כבסיס - ה$\text{pH} \gt 7 $ שנקבל יהיה גבוה יותר.
-
מלח של בסיס חלש $\left(\text{NH}_4\text{Cl}\right)$ יעבור הידרוליזה ויתנהג כחומצה - ה$\text{pH} \lt 7$ שנקבל יהיה נמוך יותר.
-
במקרים נדירים מלח יהיה בנוי מבסיס חלש ומחומצה חלשה, למשל $\left(\text{NH}_4\text{Cl}_2\text{H}_3\text{O}^2\right)$ - יתפרק ליון חומצה וליון בסיס. במקרה כזה ה-$\text{pH}$ יהיה תלוי בקבועי הפירוק של כל אחד מהם $\left( K_a \right)$, $\left( K_b \right)$.
נקודה שעלולים לטעות בה: המלחים מתפרקים ונותנים צורון שיכול להגיב עם המים: מתפרק ויוצר חומצה ובמקביל נותן בסיס. התוצאה תלויה בקבוע הפירוק של כל אחד.
ניתן דוגמה כאשר $ph = 7 $:
\[\text{Cacl}_2 + 2\text{H}_2\text{O} \rightarrow \text{Ca}^{2+} + 2\text{Cl}^-\]…
עכשיו אנחנו יכולים חומצה כמו מונוסודיום גלוטומת רק מונוסודיות ציטרת:
\[\text{C}_2\text{H}_3\text{O}_2^+\text{Na}^+ \rightarrow \text{C}_2\text{H}_3\text{O}_2\text{Na}^+\]… עכשיו אפשר לקחת אמוניום כפלוס (מלח) ועול מלח:
\[\text{NH}_4^+\text{Cl}^- \rightarrow \text{NH}_4\text{Cl}\]אז מה יהיה ה ph כי הרי שניהם נותנים חומצה ובסיס והם יכולים להגיב עם המים.
\[\text{NH}_4^+\text{Cl}^- + 2\text{H}_2\text{O} \rightarrow \text{NH}_4\text{OH} + \text{HCl}\]תלוי ב $K$ של כל אחד מהם.
מדוע חומר מסוים הוא חומצה חזקה ומדוע חומר מסוים חלשה
לא חשוב לדעת
אפקט היון המשותף
התגובות והשאלות שעסקנו בהן בפרק הקודם הניחו המסה של חומר יחיד בתמיסה מימית, ועסקו בקביעת ריכוזי החלקיקים במצב של שיווי משקל. עם זאת, תמיסות (של חומצות חלשות או בסיסים חלשים) בדרך כלל מכילות מראש מקור אחר שיוצר את היונים. אנחנו אומרים שהיון הנוסף הזה משותף לחומצה החלשה או לבסיס החלש, וכפי שנראה, יש לו השפעות חשובות.
נתבונן למשל בתמיסה שכוללת בו זמנית 0.100 מולר $\text{CH}_3\text{COOH}$ ו-0.100 מולר $\text{HCl}$. נוכל לכתוב בנפרד את הפירוק של כל אחד מהמלחים:
\[\text{CH}_3\text{COOH} + \text{H}_2\text{O} \leftrightharpoons \text{CH}_3\text{COO}^- + \text{H}_3\text{O}^+\] \[\text{HCl} + \text{H}_2\text{O} \rightarrow \text{Cl}^- + \text{H}_3\text{O}^+\]בגלל שהיון $\text{H}_3\text{O}^+$ נוצר בשני תהליכי היינון, אנחנו נגיד שהוא יון משותף. בגלל ש-$\left[ \text{H}_3\text{O}^+ \right]$ מופיע בקבוע שיווי המשקל של שתי התגובות, שתי הריאקציות משפיעות אחת על השנייה: הפירוק של החומצה החלשה $\left( \text{CH}_3\text{COOH} \right)$ משפיע על הפירוק של החומצה החזקה $\left( \text{HCl} \right)$ ולהיפך.
החומצה החזקה $\left( \text{HCl} \right)$ מתפרקת לחלוטין, בלי קשר לנוכחות של החומצה החלשה $\left( \text{CH}_3\text{COOH} \right)$, וכתוצאה מכך (עקרון לה שטלייה), הפירוק של החומצה החלשה מדוכא באופן משמעותי. כלומר, הנוכחות (או ההוספה) של החומצה החזקה מפחיתה באופן משמעותי את הפירוק של החומצה החלשה.
ניקח חומצה חלשה $\text{CH}_3\text{COO}_2\text{H} 0.100\text{ M}$ ונחשב את הריכוזים של [H3O+] ו-[CH3COO^-]. לאחר מכן נחשב שוב את הריכוזים בתמיסה שבה הוסיפו $\text{HCl} 0.100\text{ M}$, כלומר, תמיסה של 0.100 מולר - גם של החומצה החלשה וגם של החומצה החזקה.
חישוב הריכוזים במצב רגיל
\[\text{CH}_3\text{COO}_2\text{H} + \text{H}_2\text{O} \leftrightharpoons \text{H}_3\text{O}^+ + \text{CH}_3\text{COO}^-\]| $\text{CH}_3\text{COO}_2\text{H}$ | $\text{H}_2\text{O}$ | $\text{H}_3\text{O}^+$ | $\text{CH}_3\text{COO}^-$ | |
|---|---|---|---|---|
| initial concns: | 0.100 M | |||
| changes | $-x$ M | $+x$ M | $+x$ M | |
| equil concns | $(0.100 - x)$ M | $x$ M | $x$ M |
מהטבלה אנחנו יודעים ש$K_a = 1.8 \times 10^{-5}$
\[K_a = \frac{[\text{H}_3\text{O}^+][\text{CH}_3\text{COO}^-]}{[\text{CH}_3\text{COO}_2\text{H}]} = \frac{x^2}{0.100 - x} = 1.8 \times 10^{-5}\]ניתן לפתור את המשוואה בעזרת נוסחת השורשים, אבל בספר מציעים להניח שערכו של $x$ זניח ביחס ל-$0.100$, ועל כן, $0.100-x \approx 0.100$. מכאן נקבל:
\[x^2 = 0.100 \times 1.8 \times 10^{-5} = 1.8 \times 10^{-6}\] \[x = \sqrt{1.8 \times 10^{-6}} = 1.3 \times 10^{-3}\] \[\left[\text{H}_3\text{O}^+\right] = \left[\text{CH}_3\text{COO}^-\right] = \boxed{1.3 \times 10^{-3} \ \ \text{M} }\]חישוב הריכוזים בתמיסה עם היון המשותף
אנחנו צריכים להתייחס לריכוז של $\text{H}_3\text{O}^+$ שמופיע כתוצאה מהתגובה של החומצה החזקה. נקבל:
\[\text{CH}_3\text{COO}_2\text{H} + \text{H}_2\text{O} \leftrightharpoons \text{H}_3\text{O}^+ + \text{CH}_3\text{COO}^-\]| $\text{CH}_3\text{COO}_2\text{H}$ | $\text{H}_2\text{O}$ | $\text{H}_3\text{O}^+$ | $\text{CH}_3\text{COO}^-$ | |
|---|---|---|---|---|
| initial concns: | 0.100 M | |||
| changes | $-x$ M | $+x$ M | $+x$ M | |
| equil concns | $(0.100 - x)$ M | $x$ M | $x$ M |
נניח שוב ש-$x$ זניח ביסח ל 0.100 ועל כן
\[\frac{x \cdot (0.100 + x)}{0.100 - x} \approx \frac{\cancel{0.100} \cdot x}{\cancel{0.100}} \Rightarrow x = 1.8 \times 10^{-5}\] \[\boxed{\left[\text{CH}_3\text{COO}^-\right] = 1.8 \times 10^{-5} \ \text{M}} \ \ \ \text{ compared to} \ 1.3 \times 10^{-3} \ \text{M}\] \[[\text{H}_3\text{O}^+] = 0.100 + x \approx 0.100 \ \text{M}\]Le Chatelier’s Principle:
\[\text{When a system at equilibrium is disturbed, the system adjusts to minimize the disturbance.}\]החומצה פחות התפרקה לפי עקרון לה שטיליה - כאשר מוסיפים חומצה חזקה לחומצה חלשה, החומצה חלשה תתפרק פחות.
יצירת יון משותף בעזרת מלח החומצה
דרך אחרת ליצור יון משותף היא בעזרת הוספת המלח של הבסיס המצומד (במקרה של חומצה חלשה), או המלח של החומצה המצומדת (במקרה של בסיס חלש).
למשל, בתמיסה שמכילה חומצה חלשה $0.100 \, \text{ M } \, \text{CH}_3 \text{COOH}$ ומלח של הבסיס המצומד-$\text{NaCH}_3 \text{COO } 0.100 \, \text{ M}$, שני דברים גורמים ליצירת $\left[ \text{CH}_3 \text{COO}^- \right]$:
\[\text{NaCH}_3 \text{COO}\left(\text{aq}\right) \rightarrow \text{Na}^+\left(\text{aq}\right) + \textcolor{blue}{\text{CH}_3\text{COO}^-}\left(\text{aq}\right)\] \[\boxed{\text{Added CH}_3\text{COO}^-}\] \[\text{CH}_3\text{COOH}\left(\text{aq}\right) + \text{H}_2\text{O}\left(\text{l}\right) \leftrightharpoons \text{H}_3\text{O}^+\left(\text{aq}\right) + \textcolor{blue}{\text{CH}_3\text{COO}^-\left(\text{aq}\right)}\] \[\boxed{\text{The equilibrium shifts to the left.}\\ \text{ The ionization of CH}_3\text{COOH is suppressed.}}\]באופן דומה, בתמיסה שמכילה בסיס חלש $\text{NH}_3 \, 0.100 \, \text{M}$ ומלח של החומצה המצומדת $\text{NH}_4\text{Cl} \, 0.100 \, \text{M}$, שני דברים גורמים ליצירת $\left[ \text{NH}_4^+ \right]$
תמיסות בופר
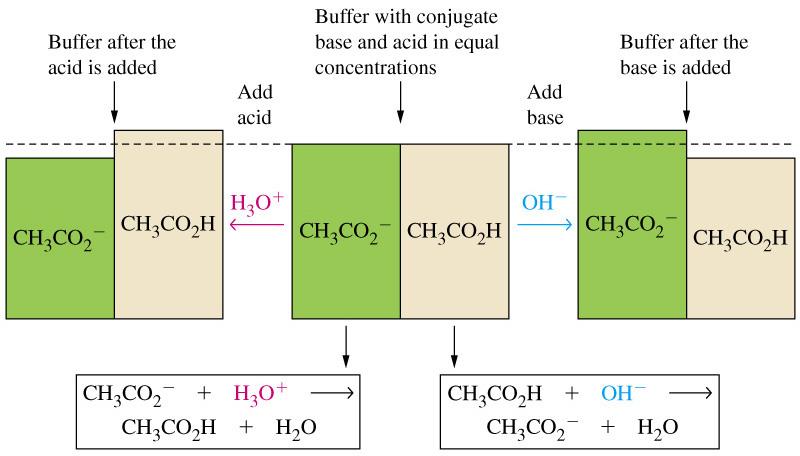
בתמיסות מהסוג $\left( \text{CH}_3\text{COOH} \right)$ עם המלח $\left( \text{NaCH}_3\text{COO} \right)$ ראינו כי יינון החומצה החלשה דוכא באופן משמעותית עקב נוכחות המלח. בעקבות זאת, במצב של שיווי משקל, התמיסה כללה כמויות מכובדת גם של $\text{CH}_3\text{COOH}$ וגם של הבסיס המצומד שלה $\left( \text{CH}_3\text{COO}^- \right)$. תמיסות כאלו נקראות תמיסות בופר, בשל היכולת שלהן לשמוע על ערך $\text{pH}$ כמעט קבוע, גם כאשר מוסיפים להן חומצות חזקות, בסיסים חזקים, או מוהלים אותן במים.
עקרון הפעולה הוא ניטרול של כמויות קטנות של חומצות או בסיסים חזקים שמוספים, בעזרת תגובה דווקא של אחד מרכיבי הבופר ליצירת תוצר של הרכיב השני עם מים.
הרכיבים של תמיסת הבופור יכולים לנטרל הוספה של חומצה או בסיס לתמיסה, אבל לא את רכיב הבופר השני שנמצא איתם בתמיסה מראש. כלומר, מרכיבי הבופר יכולים להימצא יחדיו בלי תגובה נטו ביניהם. על פניו, בתמיסה של $\text{CH}_3\text{COOH}, \, 0.100 \, \text{ M}$ ו-$\text{NaCH}_3\text{COO}, \, 0.100 \, \text{ M}$, ״ניטרול״ של $\text{CH}_3\text{COOH}$ יכול למעשה להתרחש על ידי $\text{CH}_3\text{COO}^-$, אבל בפועל, אין לו השפעה על התמיסה, שכן אין שינוי נטו במאזן הפרוטונים, כפי שאפשר לראות מהמשוואה:
\[\text{CH}_3\text{COOH} + \text{CH}_3\text{COO}^- \leftrightharpoons \text{CH}_3\text{COO}^- + \text{CH}_3\text{COOH}\]תמיסות בופר מתקבלות משתי חלופות:
- כמות רבה גם של החומצה החלשה $\left(\text{HA}\right)$ וגם של הבסיס המצומד שלה $\left(\text{A}^-\right)$, או
- כמות רבה של בסיס חלש $\left(\text{B}\right)$ ושל החומצה המצומדת שלו $\left(\text{BH}^+\right)$.
הדרישה היא שתהיה כמות רבה גם של הבסיס החלש וגם של החומצה המצומדת שלו, או להפך - גם של החומצה החלשה וגם של הבסיס המצומד שלה.
The ionization of a weak acid HA never produces an appreciable amount of A - . Similarly, the hydrolysis of A - (a weak base) never produces an appreciable amount of HA. Therefore, neither 0.100 M CH3COOH nor 0.100 M NaCH3COO is a buffer solution, but a solution that is simultaneously 0.100 M CH3COOH and 0.100 M NaCH3COO is a buffer solution.
תמיסות בופר מוגבלות בחסינות שלהן לשינויים. למשל, התמיסה בדוגמה הקודמת יכולה לשמור רק $\text{pH}$ כמעט קבוע רק בטווח של 2 יחידות מ-$\text{pH} = \text{p}K_a = 4.74$.
הוספת חומצה חזקה לבופר
נתבונן בתמיסה מהדוגמה הקודמת:
\[\begin{aligned} \left[\text{CH}_3\text{CO}_2\text{H}\right] &= [\text{CH}_3\text{CO}_2^-] = 0.100 \, \text{M} \\ \left[\text{H}_3\text{O}^+\right] &= 1.8 \times 10^{-5} \, \text{M} \\ \text{pH} &= 4.74 \end{aligned}\]תחילה נתבונן במקרה שבו נוספת כמות קטנה של חומצה חזקה לבופר:
\[\boxed{ \begin{array}{ccccccc} \text{CH}_3\text{COO}^- & + & \text{H}_3\text{O}^+ & \rightarrow & \text{CH}_3\text{COOH} & + & \text{H}_2\text{O} \\ \text{Weak base} & & \text{Strong acid} & & \text{Weak acid} & & & \\ \text{(from the buffer)} & & \text{(added to the buffer)} & & \text{(released to the buffer)} & & & \end{array} }\]תשומת הלב שתגובת הנטרול מתרחשת עד תום $\left(\rightarrow\right)$ בגלל שמדובר בהוספה של חומצה חזקה. כאשר יש חומצה חזקה או בסיס חזק - התגובה תתרחש באופן מלא.
נבין את פעולת הבופור בעזרת בחינת ההשפעה של נוכחות כמות מכובדת של בסיס מצומד ושל החומצה בו זמנית:
\[K_a = \frac{[\text{H}_3\text{O}^+][\text{CH}_3\text{COO}^-]}{[\text{CH}_3\text{COO}\text{H}]}\]אפשר לשים לב אגב שבגלל שיש כמות רבה ודומה ויחס זהה, הבסיס המצומד והחומצה החלשה מצטמצמים וקבוע הפרוק תלוי רק בריכוז יוני $\left[\text{H}_3\text{O}^+\right]$ שכמעט לא השתנה.
\[K_a = \frac{[\text{H}_3\text{O}^+]}{1} = [\text{H}_3\text{O}^+]\]מכאן:
\[[\text{H}_3\text{O}^+] = K_a = 1.8 \times 10^{-5}\]נחשב את ה-$\text{pH}$:
\[pH = -\log[\text{H}_3\text{O}^+] = -\log K_a = -\log(1.8 \times 10^{-5}) = 4.74\]בספר מעט מרחיבים את ההסבר - קבוע הפרוק של החומצה קבוע, וריכוז יוני $\left[\text{H}_3\text{O}^+\right]$, שלמעלה קובע את ערך ה-$\text{pH}$, מוכפל בגורם קרוב מאוד לאחד כאשר $\left[\text{CH}_3\text{COO}^-\right] \approx \left[\text{CH}_3\text{COOH}\right]$.
\[\begin{aligned} K_a &= \frac{[\text{H}_3\text{O}^+][\text{CH}_3\text{COO}^-]}{[\text{CH}_3\text{COO}\text{H}]} \\ \frac{\left[\text{CH}_3\text{COOH}\right]}{\left[\text{CH}_3\text{COO}^-\right]} \times K_a &= \left[\text{H}_3\text{O}^+\right] \\ \left[\text{H}_3\text{O}^+\right] &= \underbrace{\frac{\left[\text{CH}_3\text{COOH}\right]}{\left[\text{CH}_3\text{COO}^-\right]}}_{\approx 1} \times K_a \end{aligned}\]כלומר, כשהוספנו כמות קטנה של חומצה חזקה:
- הריכוז של הבסיס המצומד $\left[\text{CH}_3\text{COO}^-\right]$ ירד מעט בגלל התגובה שלו עם החומצה החזקה:
- $\text{CH}_3\text{COO}^- + \text{H}_3\text{O}^+ \rightarrow \text{CH}_3\text{COOH} + \text{H}_2\text{O}$
- הריכוז של החומצה החלשה $\left[\text{CH}_3\text{COOH}\right]$ עלה מעט בגלל התוצר של התגובה:
- $\text{CH}_3\text{COO}^- + \text{H}_3\text{O}^+ \rightarrow \text{CH}_3\text{COOH} + \text{H}_2\text{O}$
- היחס $\frac{\left[\text{CH}_3\text{COOH}\right]}{\left[\text{CH}_3\text{COO}^-\right]}$ מעט גדול מ-1.
- הריכוז של $[\text{H}_3\text{O}^+]$ כמעט לא השתנה, ולכן ה-$\text{pH}$ נשאר יחסית קבוע (עם ירידה קטנה).
Buffers work because they consist of a weak acid and its conjugate base (or a weak base and its conjugate acid). When a strong acid or strong base is added, the buffer reacts with the added ions to minimize the change in pH.
הוספת בסיס חזק לבופר
כעת נסתכל על המקרה השני - הוספת כמות קטנה של בסיס חזק לתמיסת הבופר:
\[\boxed{ \begin{array}{ccccccc} \text{CH}_3\text{COOH} & + & \text{OH}^- & \rightarrow & \text{CH}_3\text{COO}^- & + & \text{H}_2\text{O} \\ \text{Weak acid} & & \text{Strong base} & & \text{Weak base} & & & \\ \text{(from the buffer)} & & \text{(added to the buffer)} & & \text{(released to the buffer)} & & & \end{array} }\]בגלל התגובה של החומצה החלשה עם הבסיס החזק, $\left[\text{CH}_3\text{COOH}\right]$ יורד מעט, והריכוז של $\left[\text{CH}_3\text{COO}^-\right]$ עולה מעט. כמו כן, הריכוז של $\left[\text{H}_3\text{O}^+\right]$ כמעט לא השתנה, ולכן ה-$\text{pH}$ נשאר יחסית קבוע.
איך מחשבים ph של תמיסת בופר?
נתון שהמיסו 25.5 גרם של $\text{NaCH}_3\text{COO}$ בנפח מספיק של תמיסת $0.550 \, \text{M} \, \text{CH}_3\text{COOH}$ כך שהתקבל 500 מ”ל של תמיסת בופר. שואלים אותי מה ה-$\text{pH}$ של התמיסה. נזכיר שהוספת המלח של החומצה החלשה, מובילה ליצירית יון משותף של $\text{CH}_3\text{COO}^-$ ו-$\text{H}_3\text{O}^+$:
\[\text{NaCH}_3\text{COO} \rightarrow \text{Na}^+ + \text{CH}_3\text{COO}^-\]התגובה שהתרחשה:
\[\underbrace{\text{CH}_3\text{COOH}}_{\text{weak acid}} + \text{H}_2\text{O} \leftrightharpoons{} \text{H}_3\text{O}^+ + \underbrace{\text{CH}_3\text{COO}^-}_{\text{conjugate base}}\]נחשב את הריכוזים ההתחלתיים:
ביחס לחומצה החלשה $\left( \text{CH}_3\text{COOH} \right)$, נתון שהריכוז שלה הוא 0.550 מולר.
הדרישה הנוספת בשאלה הזו היא למצוא את המולריות של היון המשותף, כלומר הבסיס המצומד $\left(\text{CH}_3\text{COO}^-\right)$, בשביל לפתור את הנעלמים במצב של שיווי משקל.
לא נתון לנו כמה גרם שלו יש, אבל כן נתון לנו שביחס למלח $\left(\text{NaCH}_3\text{COO} \right)$, המסה היא 25.5 גרם. כמו כן, המשקל המולרי של המלח הוא 82.03 גרם למול. נקבל את הריכוז של הבסיס המצומד בעזרת חישוב מספר המולים של המלח, כיוון שבעת הוספת המלח מתרחש פירק מלא ומתקבלים מולים של הבסיס המצומד ביחס של 1:1 למלח.
מספר המולים של המלח הם:
\[\text{moles}=\frac{\text{mass (g)}}{\text{molar mass (g/mol)}} = \frac{25.5 \, \text{g}}{82.03 \, \text{g/mol}} = 0.311 \, \text{mol}\]המולריות של הבסיס המצומד היא:
\[M = \frac{\text{moles}}{\text{volume (L)}} = \frac{0.311 \, \text{mol}}{0.500 \, \text{L}} = 0.622 \, \text{M}\]ולכן נקבל שהריכוזים הם:
\[\begin{aligned} \text{Weak acid:} & \quad 0.550 \, \text{M} \\ \text{Conjugate base (salt):} & \quad \frac{25.5 \, \text{g}}{82.03 \, \text{g/mol} \cdot 0.500 \, \text{L}} = 0.622 \, \text{M} \end{aligned}\]נניח שהתפרקו $x$ מול של החומצה החלשה ונכתוב את הפרשי הריכוזים במצב של שיווי משקל:
\[\begin{aligned} \text{Weak acid:} & \quad (0.550 - x) \, \text{M} \\ \text{Conjugate base:} & \quad (0.622 + x) \, \text{M} \\ \text{Hydronium ions:} \left(\text{H}_3\text{O}^+\right) & \quad x \, \text{M} \end{aligned}\]אנחנו יודעים שקבוע התגובה של החומצה החלשה הוא $1.8 \times 10^{-5}$. נכתוב את הביטוי לקבוע התגובה ונפתור אותו:
\[K_a = \frac{[\text{H}_3\text{O}^+][\text{CH}_3\text{COO}^-]}{[\text{CH}_3\text{COO}_2\text{H}]} = \frac{x \cdot (0.622 + x)}{0.550 - x} = 1.8 \times 10^{-5}\]נניח ש-$x$ זניח, כלומר:
\[0.550 - x \approx 0.550, \quad 0.622 + x \approx 0.622\]ונקבל:
\[=\frac{x \cdot 0.622}{0.550} = 1.8 \times 10^{-5}\] \[x = \frac{1.8 \times 10^{-5} \cdot 0.550}{0.622} = 1.6 \times 10^{-5} \, \text{M}\]ולכן:
\[[\text{H}_3\text{O}^+] = x \, \text{M} = 1.6 \times 10^{-5} \, \text{M}\]נסיים בחישוב ערך ה-$\text{pH}$:
\[\text{pH} = -\log[\text{H}_3\text{O}^+] = -\log(1.6 \times 10^{-5})\] \[\text{pH} = 4.80\]משוואת הנדרסון-האסלבאך
דרך אחרת לפתור את השאלה במקום השימוש בקבוע היוניזציה היא להשתמש במשוואת הנדרסון-האסלבאך, שמתארת את היחס בין ריכוזי החומצה החלשה והבסיס המצומד שלה:
\[\text{pH} = \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]}\]ובגרסה עבור בסיסים נוכל לקבל:
\[\text{pOH} = \text{p}K_b + \log \frac{[\text{conjugate acid}]}{[\text{base}]}\]ניתן להשתמש במשוואה רק כאשר ריכוזי החומצה והבסיס יכולים לשמש כריכוזי שיווי משקל. זה מגביל את השימוש בה לחומצות ובסיסים חלשים.
נפתור את השאלה הקודמת בעזרת משוואת הנדרסון-האסלבאך:
\[pH = pK_a + \log\left(\frac{[\text{Conjugate base}]}{[\text{Weak acid}]}\right)\]נציב $pK_a = -\log(1.8 \times 10^{-5}) = 4.74$:
\[pH = 4.74 + \log\left(\frac{0.622}{0.550}\right)\]נפשט:
\[pH = 4.74 + \log(1.131) = 4.74 + 0.053 = 4.79\]תוצאה: ערך $\text{pH}$ של התמיסה הוא כ-4.79.
הרעיון מאחורי המשוואה
אם נסתכל על חומצה חלשה כלשהי $\left(\text{HA}\right)$ ועל המלח שלה $\left(\text{NaA}\right)$:
התגובה:
\[\text{HA} + \text{H}_2\text{O} \leftrightharpoons{} \text{A}^- + \text{H}_3\text{O}^+\]הביטוי לקבוע שיווי המשקל:
\[\textcolor{blue}K_a = \frac{[\text{H}_3\text{O}^+][\text{A}^-]}{[\text{HA}]}\]נפתור עבור $[\text{H}_3\text{O}^+]$:
\[[\text{H}_3\text{O}^+] = K_a \cdot \frac{[\text{HA}]}{[\text{A}^-]}\]נוציא לוגריתם שלילי:
\[-\log[\text{H}_3\text{O}^+] = -\log K_a + \log \frac{[\text{A}^-]}{[\text{HA}]}\]נציב $\text{pH} = -\log[\text{H}_3\text{O}^+]$ and $\text{p}K_a = -\log K_a$:
\[\text{pH} = \text{p}K_a + \log \frac{[\text{A}^-]}{[\text{HA}]}\]Henderson-Hasselbalch Equation
Important Notes:
- The equation is only valid when the initial concentrations of the acid and salt can be used as equilibrium concentrations.
- This limits its applicability to weak acids and bases.
Conditions for Validity
\[0.1 \lt \frac{[\text{A}^-]}{[\text{HA}]} \lt 10\]The concentration of $[\text{HA}]$ and $[\text{A}^-]$ must be much greater than $K_a$ by a factor of at least 100:
\[[\text{HA}], [\text{A}^-] \gg K_a\]Preparing Buffer Solutions
Based on the Henderson-Hasselbalch equation, there are two ways to prepare a buffer solution with a given pH:
- Find an acid whose $\text{p}K_a$ is close to the required pH, and prepare a solution with equal molarities of the acid and its salt.
- Adjust the ratio of acid to conjugate base to achieve the desired pH.
Example: Preparing a Buffer Solution with a Desired pH
Problem: What mass of $\text{NaC}_2\text{H}_3\text{O}_2$ must be dissolved in $0.300 \, \text{L}$ of $0.25 \, \text{M} \, \text{HC}_2\text{H}_3\text{O}_2$ to produce a solution with $\text{pH} = 5.09 $? Assumption: The solution volume remains constant at $0.300 \, \text{L}$.
Reaction:
\[\text{HC}_2\text{H}_3\text{O}_2 + \text{H}_2\text{O} \leftrightharpoons{} \text{C}_2\text{H}_3\text{O}_2^- + \text{H}_3\text{O}^+\]Equilibrium expression:
\[K_a = \frac{[\text{H}_3\text{O}^+][\text{C}_2\text{H}_3\text{O}_2^-]}{[\text{HC}_2\text{H}_3\text{O}_2]}\]Given $K_a = 1.8 \times 10^{-5}$, and using the Henderson-Hasselbalch equation:
\[\text{pH} = \text{p}K_a + \log \frac{[\text{C}_2\text{H}_3\text{O}_2^-]}{[\text{HC}_2\text{H}_3\text{O}_2]}\]Substituting:
\[5.09 = 4.74 + \log \frac{[\text{C}_2\text{H}_3\text{O}_2^-]}{0.25}\]Solving:
\[\log \frac{[\text{C}_2\text{H}_3\text{O}_2^-]}{0.25} = 0.35\] \[\frac{[\text{C}_2\text{H}_3\text{O}_2^-]}{0.25} = 10^{0.35} \approx 2.24\] \[[\text{C}_2\text{H}_3\text{O}_2^-] = 0.25 \times 2.24 = 0.56 \, \text{M}\]The mass of $\text{NaC}_2\text{H}_3\text{O}_2$ required:
\[\text{Mass} = 0.56 \, \text{M} \times 0.300 \, \text{L} \times 82.03 \, \text{g/mol} = 13.78 \, \text{g}\]Final Answer: Dissolve $13.78 \, \text{g} \, \text{NaC}_2\text{H}_3\text{O}_2$ in $0.300 \, \text{L} \, \text{HC}_2\text{H}_3\text{O}_2$ to produce a solution with $\text{pH} = 5.09 $.
חישוב שינויים בבופרים
When a neutralization reaction occurs, assume the reaction proceeds to completion. The new stoichiometric concentrations can be calculated as follows:
- Determine the amount of acid or base added to the buffer.
- Adjust the concentrations of the acid and conjugate base based on the stoichiometry of the reaction.
- Use the new stoichiometric concentrations in the equilibrium constant expression to solve for $[\text{H}_3\text{O}^+]$: \(K_a = \frac{[\text{H}_3\text{O}^+][\text{A}^-]}{[\text{HA}]}\)
The resulting $[\text{H}_3\text{O}^+]$ can then be used to calculate the new pH of the buffer.
Buffer Capacity and Range
Buffer Capacity: The amount of acid or base that a buffer can neutralize before its pH changes appreciably.
- Maximum buffer capacity exists when $[\text{HA}]$ and $[\text{A}^-]$ are large and approximately equal to each other.
Buffer Range: The pH range over which a buffer effectively neutralizes added acids and bases.
- Practically, the range is approximately: \(\text{p}K_a \pm 1\)
Acid-Base Indicators
The color of some substances depends on the pH. Acid-base indicators change color over a specific pH range.
Indicator Behavior:
- When >90% of the indicator is in the acid form, the color appears as the acid color.
- When >90% of the indicator is in the base form, the color appears as the base color.
- Intermediate colors are seen between these two states.
The complete color change occurs over a range of approximately 2 pH units.
Reaction for an indicator:
\[\text{HIn} + \text{H}_2\text{O} \leftrightharpoons{} \text{In}^- + \text{H}_3\text{O}^+\]The equilibrium expression for an indicator:
\[\text{pH} = \text{p}K_{\text{HIn}} + \log \frac{[\text{In}^-]}{[\text{HIn}]}\]Neutralization Reactions and Titration Curves
תהליך של תיתרציה זה מעקב אחר ph
Key Terms
Equivalence Point:
- The point in the reaction at which both acid and base have been consumed completely.
- Neither acid nor base is present in excess; only ions are formed.
End Point (of the Indicator):
- The point at which the indicator changes color.
-
The end point must match the equivalence point.
- Choose an indicator that changes color over a pH range including the equivalence point.
Titrant:
- The known solution added to the solution of unknown concentration during a titration.
Titration Curve:
- A plot of pH vs. volume of titrant added.
The Selection of the Indicator
- The indicator must be chosen based on the pH of the equivalence point.
The Millimole
In titrations:
- The volume of titrant added is typically less than 50 mL.
- The concentration of titrant is usually less than 1 mol/L.
- Titrations use a few thousandths of a mole of acid and base.
Calculation example:
\[\text{Millimole (mmol)} = \text{Molarity (M)} \times \text{Volume (mL)}\]For titration:
\[\text{mmol} = \text{mol}/1000 \quad \text{or} \quad \text{L}/1000\]Titration of a Strong Acid with a Strong Base
עולה ככל שמוסיף בסיס עד שאין שינוי - זו הנקוד שבה
- At the start of the titration, the pH has a low value.
- The pH changes slowly until just before the equivalence point.
- At the equivalence point, the pH rises sharply by approximately 6 units for the addition of only 0.10 mL of base.
- Beyond the equivalence point, the pH rises slowly again.
- Water has no buffer capacity during this process.
Indicator Selection:
- Any acid-base indicator whose color changes in the pH range of 4–10 is suitable for this titration.
Titration of a Strong Base with a Strong Acid
The process is the reverse of the titration of a strong acid with a strong base:
- At the start, the pH is high.
- The pH decreases slowly until just before the equivalence point.
- At the equivalence point, the pH drops sharply.
- Beyond the equivalence point, the pH decreases slowly again.
Example: Calculating Points on a Titration Curve
Scenario: A weak acid is titrated with a strong base. Determine the pH at the following points during the titration of $25.00 \, \text{mL}$ of $0.100 \, \text{M} \, \text{HC}_2\text{H}_3\text{O}_2$ with $0.100 \, \text{M} \, \text{NaOH}$.
Points to Calculate:
- (a) Before the addition of any $\text{NaOH}$ (initial pH)
- (b) After the addition of $10.00 \, \text{mL} \, \text{NaOH}$ (before equivalence point)
- (c) After the addition of $12.50 \, \text{mL} \, \text{NaOH}$ (half-neutralization)
- (d) After the addition of $25.00 \, \text{mL} \, \text{NaOH}$ (equivalence point)
- (e) After the addition of $26.00 \, \text{mL} \, \text{NaOH}$ (after equivalence point)
Solution - Calculating Points on a Titration Curve
(a) Before the addition of any $\text{NaOH}$ (initial pH)
The initial concentration of $\text{HC}_2\text{H}_3\text{O}_2$ is $0.100 \, \text{M}$. The reaction is:
\[\text{CH}_3\text{CO}_2\text{H} + \text{H}_2\text{O} \leftrightharpoons{} \text{CH}_3\text{CO}_2^- + \text{H}_3\text{O}^+\]Initial concentrations:
\[[\text{HC}_2\text{H}_3\text{O}_2] = 0.100 \, \text{M}, \quad [\text{CH}_3\text{CO}_2^-] = 0 \, \text{M}, \quad [\text{H}_3\text{O}^+] = 0 \, \text{M}\]Changes at equilibrium:
\[[\text{HC}_2\text{H}_3\text{O}_2] = 0.100 - x, \quad [\text{CH}_3\text{CO}_2^-] = x, \quad [\text{H}_3\text{O}^+] = x\]Substituting into $K_a$:
\[K_a = \frac{[\text{H}_3\text{O}^+][\text{CH}_3\text{CO}_2^-]}{[\text{HC}_2\text{H}_3\text{O}_2]} = \frac{x \cdot x}{0.100 - x} \approx \frac{x^2}{0.100}\]Solving for $x$:
\[x^2 = K_a \cdot 0.100 = (1.8 \times 10^{-5}) \cdot 0.100 = 1.8 \times 10^{-6}\] \[x = \sqrt{1.8 \times 10^{-6}} = 1.3 \times 10^{-3} \, \text{M}\]Therefore:
\[[\text{H}_3\text{O}^+] = 1.3 \times 10^{-3} \, \text{M}, \quad \text{pH} = -\log(1.3 \times 10^{-3}) = 2.89\](b) After the addition of $10.00 \, \text{mL} \, \text{NaOH}$ (before equivalence point)
Calculate moles of $\text{NaOH}$ added:
\[\text{Moles of NaOH} = 0.100 \, \text{M} \times 0.01000 \, \text{L} = 1.00 \times 10^{-3} \, \text{mol}\]Initial moles of $\text{HC}_2\text{H}_3\text{O}_2$:
\[0.100 \, \text{M} \times 0.02500 \, \text{L} = 2.50 \times 10^{-3} \, \text{mol}\]Moles of $\text{HC}_2\text{H}_3\text{O}_2$ remaining:
\[2.50 \times 10^{-3} - 1.00 \times 10^{-3} = 1.50 \times 10^{-3} \, \text{mol}\]Moles of $\text{CH}_3\text{CO}_2^-$ formed:
\[1.00 \times 10^{-3} \, \text{mol}\]Using the Henderson-Hasselbalch equation:
\[\text{pH} = \text{p}K_a + \log \frac{[\text{CH}_3\text{CO}_2^-]}{[\text{HC}_2\text{H}_3\text{O}_2]}\]Substituting:
\[\text{pH} = 4.74 + \log \frac{1.00 \times 10^{-3}}{1.50 \times 10^{-3}} = 4.74 + \log(0.667) = 4.74 - 0.176 = 4.56\](c) After the addition of $12.50 \, \text{mL} \, \text{NaOH}$ (half-neutralization)
At half-neutralization, $[\text{CH}_3\text{CO}_2^-] = [\text{HC}_2\text{H}_3\text{O}_2]$. Therefore:
\[\text{pH} = \text{p}K_a = 4.74\](d) After the addition of $25.00 \, \text{mL} \, \text{NaOH}$ (equivalence point)
At the equivalence point, all $\text{HC}_2\text{H}_3\text{O}_2$ has reacted to form $\text{CH}_3\text{CO}_2^-$. The pH is determined by the hydrolysis of $\text{CH}_3\text{CO}_2^-$:
\[\text{CH}_3\text{CO}_2^- + \text{H}_2\text{O} \leftrightharpoons{} \text{CH}_3\text{CO}_2\text{H} + \text{OH}^-\]Concentration of $\text{CH}_3\text{CO}_2^-$:
\[\frac{2.50 \times 10^{-3} \, \text{mol}}{0.02500 \, \text{L} + 0.02500 \, \text{L}} = 0.0500 \, \text{M}\]Using $K_b = \frac{K_w}{K_a} = \frac{1.0 \times 10^{-14}}{1.8 \times 10^{-5}} = 5.56 \times 10^{-10}$:
\[[\text{OH}^-] = \sqrt{K_b \cdot [\text{CH}_3\text{CO}_2^-]} = \sqrt{(5.56 \times 10^{-10}) \cdot 0.0500} = 5.27 \times 10^{-6} \, \text{M}\] \[\text{pOH} = -\log(5.27 \times 10^{-6}) = 5.28, \quad \text{pH} = 14 - 5.28 = 8.72\](e) After the addition of $26.00 \, \text{mL} \, \text{NaOH}$ (after equivalence point)
Excess $\text{NaOH}$:
\[\text{Excess moles} = (0.100 \, \text{M}) \cdot (0.02600 \, \text{L}) - 2.50 \times 10^{-3} = 1.00 \times 10^{-4} \, \text{mol}\]Concentration of excess $\text{OH}^-$:
\[\frac{1.00 \times 10^{-4} \, \text{mol}}{0.05000 \, \text{L}} = 2.00 \times 10^{-3} \, \text{M}\] \[\text{pOH} = -\log(2.00 \times 10^{-3}) = 2.70, \quad \text{pH} = 14 - 2.70 = 11.30\]שאלות לדוגמה
שאלה 4 ממטלה 8
מטטרים 50 מ”ל תמיסת $\text{NaCN}$ בריכוז 0.100M עם 0.200M $\text{HCl}$ $\left(K_b(\text{CN}^-) = 2.0 \times 10^{-5}\right)$. חשב את ה-$\text{pH}$:
- א. לאחר הוספת 15.0 מ”ל 0.200M $\text{HCl}$
- ב. לאחר הוספת 30.0 מ”ל 0.200M $\text{HCl}$
פתרון
\[\underbrace{\text{CN}^-}_{\text{NaCN}} + \text{H}_3\text{O}^+ \rightleftharpoons \text{HCN} + \text{H}_2\text{O}\]נפח:
\[V = 15 \text{ ml} + 50 \text{ ml} = 65 \text{ ml} = 0.065 \text{ L}\] \[\text{mol CN}^- = C\times V = 0.1 \text{ M} \times 0.05L = 5\times10^{-3} \text{ mols}\] \[\text{mol HCN} = C\times V = 0.2\text{ M} \times 0.015L = 3\times10^{-3} \text{ mols}\]לאחר התגובה: \(\text{mol CN}^- = 5\times10^{-3} - 3\times10^{-3} = 2\times10^{-3} \text{ mols}\)
\[\text{mol HCN} = 3\times10^{-3} \text{ mols}\] \[\left[\text{CN}^-\right] = \frac{2\times10^{-3}}{0.065\text{ L}} = 0.03076\] \[\left[\text{HCN} \right] = \frac{3\times10^{-3}}{0.065\text{ L}} = 0.04615\] \[\text{pOH} = \text{p}K_b + \log\left(\frac{[\text{HCN}]}{[\text{CN}^-]}\right) = -\log(2\times10^{-5}) + \log\left(\frac{0.04615}{0.03076}\right) = 4.7 + 0.15 = 4.875\] \[\text{pOH} = 4.875 \Rightarrow \text{pH} = 14 - 4.875 = 9.125\] \[\boxed{\text{pH} = 9.12}\]לאחר הוספת 30 מ”ל
נפח כולל:
\[V = 50 \text{ ml} + 30 \text{ ml} = 80 \text{ ml} = 0.08 \text{ L}\]כמות $\text{CN}^-$ בתמיסה לפני התגובה:
\[\text{mol CN}^- = 0.1 \text{ M} \times 0.05L = 5\times10^{-3} \text{ mols}\]כמות $\text{HCl}$ שנוספה:
\[\text{mol HCl} = 0.2 \text{ M} \times 0.03L = 6\times10^{-3} \text{ mols}\]התגובה הכימית:
\[\text{CN}^- + \text{H}_3\text{O}^+ \rightleftharpoons \text{HCN} + \text{H}_2\text{O}\]לאחר התגובה: כמות $\text{CN}^-$ בתמיסה:
\[\text{mol CN}^- = 5\times10^{-3} - 6\times10^{-3} = -1\times10^{-3} \text{ mols}\]כלומר שכל ה-$\text{CN}^-$ התפרק, והתמיסה כעת חומצית. נחשב את ריכוז יוני $\text{H}_3\text{O}^+$:
\[\left[\text{H}_3\text{O}^+\right] = 10^{-3} \times 6 - 10^{-3} \times 5 = 10^{-3} \text{ mols}\] \[\left[\text{H}_3\text{O}^+\right] = \frac{10^{-3}}{0.08} = 0.0125\] \[\text{pH} = -\log\left[\text{H}_3\text{O}^+\right] = -\log(0.0125) \approx 1.9\] \[\boxed{\text{pH} = 1.9}\]שאלה 5
ממיסים 0.400 גרם חומצה פרופיונית, CH₃CH₂CO₂H , (נסמן בקיצור: $\text{HPr}$) ב- במים לקבלת תמיסה בנפח של 50.0 מ”ל. תמיסה זו טוטרה עם 0.150M $\text{NaOH}$ נתון: $K_a(\text{HPr}) = 1.3 \times 10^{-5}$. חשב את ה-$\text{pH}$ בנקודה האקויולנטית.
\[\text{HPr} + \text{OH}^- \rightleftharpoons \text{Pr}^- + \text{H}_2\text{O}\] \[\text{mol HPr} = \frac{0.400g}{74.09g/mol} = 0.0054 \text{ moles}\]בנקודה האקוויולנטית, כמות הבסיס הנדרשת שווה למספר המולים של החומצה:
\[\text{mol NaOH} = \text{mol HPr} = 0.0054 \text{ moles}\]נפח $\text{NaOH}$ בנקודה האקוויולנטית (לנטרול החומצה):
\[V_{\text{NaOH}} = \frac{\text{mol NaOH}}{0.150 \text{ M}} = \frac{0.0054 \text{ moles}}{0.150 \text{ M}} = 0.0361\text{ L}\]נפח התמיסה הכולל:
\[V_{\text{total}} = V_{\text{HPr}} + V_{\text{NaOH}} = 50.0 \text{ mL} + 36.1 \text{ mL} = 0.0861\text{ L}\]נחשב את הריכוז
\[\left[\text{Pr}^-\right] = \frac{ \text{mol Pr}^-}{V_{\text{total}}} = \frac{0.0054 \text{ moles}}{0.0861 \text{ L}} = 0.0628 \text{ M}\] \[K_b = \frac{K_w}{K_a} = \frac{10^{-14}}{1.3\times10^{-5}} = 7.69\times10^{-10}\]נחשב את ריכוז ה-$\text{OH}^-$:
\[\left[\text{OH}^-\right] = \sqrt{K_b \times \left[\text{Pr}^-\right]} = \sqrt{7.69\times10^{-10} \times 0.0628} = 0.000006949 \text{ M}\]נחשב את ה-$\text{pOH}$:
\[\text{pOH} = -\log\left[\text{OH}^-\right] = -\log(0.000006949) = 5.16\]ולכן:
\[\text{pH} = 14 - 5.16 = 8.84\] \[\boxed{\text{pH} = 8.84}\]שאלה 15 מתוך קובץ שאלות לבחינה
חומצה ציאנית מתפרקת לפי הנוסחה:
\[\text{HCN}_{\text{(aq)}} + \text{H}_2\text{O}_{\text{(l)}} \rightleftharpoons \text{H}_3\text{O}^+_{\text{(aq)}} + \text{CN}^-_{\text{(aq)}}\] \[K_a = 6.3 \times 10^{-10}\]הערה: בשאלה המקורית היה שימוש בחץ לא כפול, למרות שלהבנתי מדובר בתגובה שמגיעה לשיווי משקל.
- א. מה יהיה ה-$\text{pH}$ התמיסה בריכוז $0.4 \, \text{M}$?
- ב. מה יהיה ה-$\text{pH}$ אם נוסיף 50 מ״ל של $0.2 \, \text{M}$ $\text{NaOH}$ לתוך 50 מ״ל של התמיסה הנ״ל?
- ג. מה יהיה ה-$\text{pH}$ לאחר הוספת 50 מ״ל נוספים של $0.2 \, \text{M}$ $\text{NaOH}$ לתמיסה של סעיף ב׳?
פתרון סעיף א
התגובה מאוזנת.
נחשב את ה-$\text{pH}$ של התמיסה בריכוז 4 מולר:
| $\text{HCN}_{\text{(aq)}}$ | \(\text{H}_3\text{O}^+_{\text{(aq)}}\) | $\text{CN}^-_{\text{(aq)}}$ | |
|---|---|---|---|
| init | $0.4$ | - | - |
| change | $-x \text{ M}$ | $+x \text{ M}$ | $+x \text{ M}$ |
| eq | $0.4 -x \text{ M}$ | $x \text{ M}$ | $x \text{ M}$ |
נשתמש בנתון על קבוע הפירוק של החומצה:
\[\frac{x^2}{0.4 -x} = 6.3 \times 10^{-10}\]$x$ זניח נקבל:
\[\frac{x^2}{0.4 -x} \approx \frac{x^4}{0.4} = 6.3 \times 10^{-10}\] \[x^2 = 0.4 \times 6.3 \times 10^{-10}\] \[x = \sqrt{0.4 \times 6.3 \times 10^{-10}} = 1.6\times 10^{-5}\]נציב בהגדרת $\text{pH}$:
\[\text{pH} = -\log \left[\text{H}^+ \right] = -\log 1.6\times 10^{-5} = \boxed{4.8}\]פתרון סעיף ב
החומר שנוסיף יתפרק במים ויגיב עם החומצה:
\[\text{NaOH} \rightarrow \text{Na}^+ + \text{OH}^-\] \[\text{HCN} + \text{OH}^- \rightarrow \text{H}_2\text{O} + \text{CN}^-\]ניעזר במשוואת הנדרסון האסלבאך עבור החומצה $\text{HCN}$ והבסיס המצומד שלה $\text{CN}^-$, לשם כך נמצא את הריכוזים בתום התגובה.
מספר המולים של $\text{HCN}$ שהיו בהתחלה, לפני התגובה הם:
\[0.4 \text{ M} \times 0.05 \text{ L} = \boxed{0.02 \text { mols}}\]מספר המולים של הבסיס המצומד $\text{CN}^-$ לאחר הוספת $\text{NaOH}$ נוצרים ביחס של $1:1$ עם המולים של $\text{NaOH}$:
\[0.2 \text{ M} \times 0.05 \text{ L} = \boxed{0.01 \text { mols}}\]מכאן, מספר המולים של החומצה לאחר התגובה:
\[0.02 - 0.01 = \boxed{0.01 \text { mols}}\]הנפח של התמיסה לאחר התגובה הוא $\boxed{0.1 \text{ L}}$, מכאן שהריכוזים הם:
\[\text{conc.} = \frac{\text{mols}}{\text{V}} = \frac{0.01}{0.1} = \boxed{0.1 \text{ M}}\]אפשר גם לחשוב על זה כהכפלה ב-$10$: אם ב-$100 \text{ ml}$ מצאנו 0.1 מולס, אז בשביל לקבל את מספר המולים בליטר אחד נצטרך לכפול בעשר.
נפתור:
\[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(6.3 \times 10^{-10}\right) + \log \frac{[0.1]}{[0.1]} \\ &= 9.2 + 0 \\ &= \boxed{9.2} \end{aligned}\]פתרון סעיף ג
נשים לב שלאחר הוספת $50 \text{ ml}$ נוספים של $\text{NaOH}$ כל החומצה תתפרק. כדי לחשב את ה-$\text{pH}$ ניעזר בקבוע הפירוק של המים, שכן התהליך שימשיך להתרחש בכלי הוא תגובה של המים כחומצה, עם עודף של $\text{CN}^-$ שנוצר:
\[\text{CN}^-_{\text{(aq)}} + \text{H}_2\text{O}_{\text{(l)}} \rightleftharpoons \text{OH}^-_{\text{(aq)}} + \text{HCN}_{\text{(aq)}}\]קבוע הפירוק של החומצה $\text{HCN}$ נתון לנו בשאלה וקבוע הפירוק של המים ידוע. נוכל להיעזר בנוסחה הבאה כדי לקבל את קבוע הבירוק של הבסיס $\text{CN}^-$, וממנו לקבל את הערך של $\text{pOH}$
\[k_w = k_a \times k_b \Rightarrow k_b = \frac{k_w}{k_a}\] \[k_b = \frac{10^{-14}}{6.3\times 10^{-10}} = \boxed{1.6\times 10^{-5}}\]כעת נעבור לחישוב הערך של $\text{pOH}$ בעזרת הנוסחאות:
\[k_b = \frac{\text{conjugate acid}}{\text{weak base}}\] \[\text{pOH} = -\log \text{(weak base)}\]כאשר במקרה שלנו $\text{CN}^-$ הוא הבסיס החלש ו-$\text{HCN}$ החומצה המצומדת.
הריכוז ההתחלתי של $\text{CN}^-$ הוא:
\[\frac{0.02 \text{ mols}}{0.150 \text{ L}} = \boxed{0.13 \text{ M}}\]נסמן ב-$x$ את הריכוז שירד בעת התפרקות ויצירת $\text{HCN}$ ו-$\text{OH}^-$, מכאן שבשיווי משקל הריכוז של הבסיס הוא $0.13-x$. נמצא את החלק שהתפרק ונוצא בעזרת קבוע הפירוק של הבסיס:
\[\begin{aligned} \frac{\left[\text{OH}^-\right]\left[\text{HCN}\right]}{\left[\text{CN}^-\right]_{\text{eq}}} &= \frac{x^2}{0.13-x} = 1.6\times 10^{-5} \\ x &= \sqrt{0.13 \times 1.6\times 10^{-5} } \\ &= \boxed{1.4 \times 10^{-3}} \end{aligned}\]מכאן נקבל:
\[\begin{aligned} \text{pOH} &= - \log 1.4 \times 10^{-3} \\ &= \boxed{2.8} \end{aligned}\]מכאן:
\[\begin{aligned} \text{pH} + \text{pOH} &= 14 \\ \text{pH} &= 14 - 2.8 \\ &= \boxed{11.2} \end{aligned}\]שאלה 13 מתוך קובץ שאלות לדוגמה
חומצה בנזואית $\text{C}_6\text{H}_5\text{COOH}$ היא חומצה חד-פרויטית בעלת קבוע פירוק $K_a = 6.3 \times 10^{-5}$. מכינים תמיסת בופר על ידי המסה של 2 גרם חומצה בנזואית עם 2 גרם של המלח של החומצה $\text{NaC}_6\text{H}_5\text{COO}$ בתוך $750 \text{ ml}$ מים.
\[\text{C}_6\text{H}_5\text{COOH} + \text{H}_2\text{O} \rightleftharpoons \text{C}_6\text{H}_5\text{COO}^- + \text{H}_3\text{O}^+\] \[K_a = 6.3 \times 10^{-5}\]- א. מה$\text{pH}$ שיתקבל בתמיסת הבופר?
- ב. חשבו את ערך ה$\text{pH}$ אם מוסיפים לתמיסת הבופר $10 \text{ ml}$ של $\text{KOH}$ בריכוז $0.2 \text{ M}$.
- ג. חשבו את ערך ה$\text{pH}$ אם מוסיפים לתמיסת הבופר $100 \text{ ml}$ של תמיסת $\text{HCl}$ בריכוז $0.01 \text{ M}$.
- ד. איזה מרכיב של הבופר וכמה גרם ממנו צריך להוסיף לתמיסת הבופר שבסעיף א׳ על מנת לשנות את ה$\text{pH}$ של תמיסת הבופר המקורית ל-$4$?
פתרון סעיף א
נחשב את השפעת היון המשות:
\[\text{NaC}_6\text{H}_5\text{COO} \rightarrow \text{Na}^+ + \text{C}_6\text{H}_5\text{COO}^-\]מספר מולים של חומצה בנזואית בתמיסה המקורית - לא נתון הריכוז נצטרך לחשב את הגרמים והמשקל המולרי כדי לקבל מולים.
\[\begin{aligned} m_w \left[\text{C}_6\text{H}_5\text{COOH}\right] &= 12 \times 7 + 6 + 16 \times 2 \\ &= 122 \text{ gr} \end{aligned}\] \[\begin{aligned} \text{mols} &= \frac{\text{M}}{\text{molar weight}} \\ &= \frac{2}{122} \\ &\approx \boxed{1.6 \times 10^{-2} \text{ mols}} \end{aligned}\]מספר המולים של הבסיס המצומד הם ביחס של 1:1 למלח שנוסף, נחפש את המולים את המלח:
\[\begin{aligned} m_w \left[\text{NaC}_6\text{H}_5\text{COO}\right] &= 23 + 12 \times 7 + 5 + 16 \times 2 \\ &= 144 \text{ gr} \end{aligned}\] \[\begin{aligned} \text{mols} &= \frac{\text{M}}{\text{molar weight}} \\ &= \frac{2}{144} \\ &\approx \boxed{1.4 \times 10^{-2} \text{ mols}} \end{aligned}\]הריכוז ההתחלתי של החומצה הוא:
\[\text{conc.} = \frac{\text{mols}}{\text{V}} = \frac{1.6 \times 10^{-2}}{0.750} = \boxed{2.1\times 10^{-2} \text{ M}}\]הריכוז של הבסיס המצומד:
\[\text{conc.} = \frac{\text{mols}}{\text{V}} = \frac{1.4 \times 10^{-2}}{0.750} = \boxed{1.9\times 10^{-2} \text{ M}}\]נציב במשוואת הנדרסון-האסלבאך:
\[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(6.3 \times 10^{-5}\right) + \log \frac{0.019}{0.021} \\ &= 4.2 - 4.3 \times 10^{-2} \\ &\approx \boxed{4.2} \end{aligned}\]סעיף ב - ריכוז לאחר הוספת בסיס
הבסיס שנוסיף יתפרק ליוני $\text{OH}^-$ שיגיבו עם החומצה החלשה:
\[\text{C}_6\text{H}_5\text{COOH} + \text{OH}^- \rightarrow \text{C}_6\text{H}_5\text{COO}^- + \text{H}_2\text{O}\]נמצא את השינויים - מספר המולים של $\text{OH}^-$ הם ביחס ישיר לבסיס שנוסיף:
\[\begin{aligned} \text{mols}_{\text{OH}^-} &= 0.2 \text{ M} \times 0.010 \text { L} \\ &= \boxed{2.0 \times 10^{-3}} \end{aligned}\]נמצא את הריכוזים החדשים:
| $\text{C}_6\text{H}_5\text{COOH}$ | $\text{OH}^-$ | $\text{C}_6\text{H}_5\text{COO}^-$ | $\text{H}_2\text{O}$ | |
|---|---|---|---|---|
| original buffer: | $0.0160 \text{ mol}$ | $0.0190 \text{ mol}$ | ||
| add: | $0.0020 \text{ mol}$ | |||
| changes: | $-0.0020 \text{ mol}$ | $-0.0020 \text{ mol} ?$ | $+0.0020 \text{ mol}$ | |
| final buffer: | ||||
| amounts: | $0.0140 \text{ mol}$ | $\approx 0$ | $0.0210 \text{ mol}$ | |
| concens: | $\frac{0.0140 \text{ mol}}{0.760 \text{ L}} = 0.0180 \text{ M}$ | $\approx 0$ | $\frac{0.0210 \text{ mol}}{0.760 \text{ L}} = 0.0280 \text{ M}$ |
נחשב את ה-$\text{pH}$ החדש:
\[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(6.3 \times 10^{-5}\right) + \log \frac{0.0280}{0.0180} \\ &= 4.2 + 0.19 \\ &= \boxed{4.39} \end{aligned}\]סעיף ג - ריכוז לאחר הוספת חומצה
נחזור על התהליך מסעיף ב׳. החומצה שנוסיף תתפרק ליוני הידרוניום שייצרו עם המים $\text{H}_3\text{O}^+$:
\[\text{C}_6\text{H}_5\text{COO}^- + \text{H}_3\text{O}^+ \rightarrow \text{C}_6\text{H}_5\text{COOH} + \text{H}_2\text{O}\]מספר יוני ההידרוניום שיווצרו יהיה ביחס 1:1 לחומר שנוסיף:
\[\begin{aligned} \text{mols}_{\text{H}_3\text{O}^+} &= 0.01 \text{ M} \times 0.100 \text { L} \\ &= \boxed{1.0 \times 10^{-3}} \end{aligned}\]| $\text{C}_6\text{H}_5\text{COO}^-$ | $\text{H}_3\text{O}^+$ | $\text{C}_6\text{H}_5\text{COOH}$ | $\text{H}_2\text{O}$ | |
|---|---|---|---|---|
| original buffer: | $0.0190 \text{ mol}$ | $0.0160 \text{ mol}$ | ||
| add: | $0.0010 \text{ mol}$ | |||
| changes: | $-0.0010 \text{ mol}$ | $-0.0010 \text{ mol} ?$ | $+0.0010 \text{ mol}$ | |
| final buffer: | ||||
| amounts: | $0.0180 \text{ mol}$ | $\approx 0$ | $0.0170 \text{ mol}$ | |
| concens: | $\frac{0.0180 \text{ mol}}{0.850 \text{ L}} = 0.021 \text{ M}$ | $\approx 0$ | $\frac{0.0170 \text{ mol}}{0.850 \text{ L}} = 0.020 \text{ M}$ |
סעיף 4 - מציאת כמות וחומר שיש להוסיף
כדי שהתמיסה המקורית תהיה 4 אנחנו רוצים יותר חומצה. נציב כנעלם את הריכוז הנדרש:
\[\begin{aligned} 4.2 + \log \frac{0.019}{x} &= 4 \\ \log \frac{0.019}{x} &= -0.2 \\ \frac{0.019}{x} &= 10^{-0.2} \\ x &= 0.019 / 10^{-0.2} \\ &= 0.0301 \end{aligned}\]כעת נחזור כדי למצוא את הכמות הנדרשת לריכוז זה:
\[\begin{aligned} \frac{\text{mols}}{0.750 \text{ L}} &= 0.0301 \\ \text{mols} &= \boxed{0.0226} \end{aligned}\] \[\begin{aligned} \text{mass} &= 122 \text{ g/mol} \times 0.0226 \text{ mol} \\ &= \boxed{2.75 \text{ gr}} \end{aligned}\]כלומר שנדרש להוסיף עוד $0.75$ גרם של $\text{C}_6\text{H}_5\text{COOH}$ לקבלת הריכוז המבוקש.
שאלה 9 מתוך קובץ שאלות לדוגמה
חומצה לקטית (חומצת חלב) $\text{HC}_3\text{H}_5\text{O}_3$ מאוד חשובה בתהליכים ביולוגים. משוואת הפירוק שלה במים היא:
\[\text{HC}_3\text{H}_5\text{O}_3 (\text{aq}) + \text{H}_2\text{O} \rightarrow \text{H}^+ (\text{aq}) + \text{C}_3\text{H}_5\text{O}_3^- (\text{aq})\]ידוע כי בטמפרטורה של $298 \text{K}$ קבוע הפירוק של החומצה הוא $K_a = 1.38 \times 10^{-4}$.
- א. חשבו את ערך ה$\text{pH}$ של תמיסת חומצה לקטית בריכוז $0.5 \text{ M}$
- ב. לתמיסה בנפח $250 \text{ ml}$ של חומצה לקטית בריכוז $0.5 \text{ M}$ מוסיפים $0.045$ מול של המלח של החומצה $\text{NaC}_3\text{H}_5\text{O}_3$. מה יהיה ה$\text{pH}$ של התמיסה?
- ג. לתמיסה שהוכנה בסעיף ב׳ מוסיפים $100 \text{ ml}$ של תמיסת $\text{NaOH}$ בריכוז $0.01 \text{ M}$. מה יהיה ה$\text{pH}$ לאחר ההוספה?
- ד. חשבו מה הנפח של תמיסת $\text{HCl}$ בריכוז $0.1 \text{ M}$ שיש להוסיף לתמיסה בסעיף ג בכדי לחזור ל$\text{pH}$ המקורי של התמיסה שהוכנה בסעיף ב׳.
פתרון סעיף א - ערך $\text{pH}$ של חומצה לקטית
נתון לנו קבוע פירוק, מכאן שמדובר בחומצה חלשה.
ניעזר בקבוע הפירוק.
נסמן את כמות החומצה שהתפרקה ב-$x$, ובגלל היחסים זהו גם ריכוז $\left[\text{H}_3\text{O}^+\right]=x$. נחשב:
\[\begin{aligned} \frac{x^2}{0.5} &\approx 1.38 \times 10^{-4} \\ x &= \sqrt{6.90 \times 10^{-5}} = \boxed{8.31\times 10^{-3}} \end{aligned}\]לא לשכוח - כדי לקבל את ערך $\text{pH}$ נציב:
\[\begin{aligned} \text{pH} &= - \log \left(8.31\times 10^{-3}\right) \\ &= \boxed{2.08} \end{aligned}\]פתרון סעיף ב - לאחר הוספת המלח
המלח $\text{NaC}_3\text{H}_5\text{O}_3$ יתפרק וייתן את הבסיס המצומד לחומצה הלקטית כך שיתקבל יון משותף:
\[\text{NaC}_3\text{H}_5\text{O}_3 \rightarrow \text{Na}^+ + \text{C}_3\text{H}_5\text{O}_3^-\]ניעזר במשוואת הנדרסון האסלבך, תחילה נדרש למצוא את ריכוז המלח המצומד.
\[\begin{aligned} \left[\text{HC}_3\text{H}_5\text{O}_3\right]_{\text{weak acid}} &= \boxed{0.5} \end{aligned}\]נתנו לנו את מספר המולים, נקבל את הריכוז בעזרת חלוקה בנפח - בשונה מהמקרה בו נתון לנו הריכוז.
\[\begin{aligned} \left[{\text{C}_3\text{H}_5\text{O}_3^-}\right]_{\text{conjugate base}} &= \frac{0.045}{0.250 \text { L}} = \boxed{0.180} \end{aligned}\] \[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(1.38 \times 10^{-4}\right) + \log \frac{0.180}{0.5} \\ &= 3.86 - 0.444 = \boxed{3.42} \end{aligned}\]פתרון סעיף ג - הוספת בסיס לתמיסת בופר?
התמיסה שנוצרה היא תמיסת בופר, להבנתי, הוספת הבסיס תביא לתגובה עם החומצה החלשה ומים:
\[\text{HC}_3\text{H}_5\text{O}_3 + \text{OH}^- \rightarrow \text{H}_2\text{O} + \text{C}_3\text{H}_5\text{O}_3^-\]נחשב כמה מולים של בסיס נוספו:
\[0.01 \times 0.100 \text{ L} = \boxed{0.001 \text{ mol}}\]נחשב את הריכוזים החדשים - השינוי השפיע גם על נפח התמיסה, ומכאן שצריך לחשב את הריכוזים מחדש ולא רק לחסר מהקודמים:
\[\begin{aligned} \left[\text{HC}_3\text{H}_5\text{O}_3\right] &= \frac{0.5 \text{ M} \times 0.250 \text{ L} - 0.001}{0.350 \text{ L}} \\ &= \frac{0.124 \text{ mol}}{0.350 \text{ L}} = \boxed{0.354} \end{aligned}\] \[\begin{aligned} \left[{\text{C}_3\text{H}_5\text{O}_3^-}\right] &= \frac{0.045 + 0.001}{0.350 \text{ L}} \\ &= \frac{0.046 \text{ mol}}{0.350 \text{ L}} = \boxed{0.131} \end{aligned}\]נציב את הריכוזים במשוואת הנדרסון האסלבאך ונקבל:
\[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(1.38 \times 10^{-4}\right) + \log \frac{0.131}{0.354} \\ &= 3.86 - 0.432 = \boxed{3.43} \end{aligned}\]עליה קלה בערף $\text{pH}$ אכן מתאימה למקרה של הוספת בסיס חזק לבופר.
סעיף ד - ערך של חומצה חזקה שנדרש כדי לחזור
נמצא את הנפח הדרוש. הוספת החומצה תוביל לתגובה הבאה:
\[\text{C}_3\text{H}_5\text{O}_3^- + \text{H}_3\text{O}^+ \rightarrow \text{H}_2\text{O} + \text{HC}_3\text{H}_5\text{O}_3\] \[\begin{aligned} 3.42 &= 3.86 + \log \frac{0.131 - x}{0.354 + x} \\ -0.44 &= \log \frac{0.131 - x}{0.354 + x} \\ 10^{-0.44} &= \frac{0.131 - x}{0.354 + x} \\ 0.363 x + 0.129 &= 0.131 - x \\ 1.363 x &= 0.002 \\ x &= \boxed{0.00147} \end{aligned}\]מצאנו את מספר המולס הדרוש, נעבור לנפח:
\[\begin{aligned} x \text { L} \times 0.1 \text{ M} &= 0.00147 \text{ mol} \\ x &= \frac{0.00147}{0.1} = \boxed{0.0147 \text{ L}} \end{aligned}\] דור פסקל