תרגול שאלות נומנקלטורה
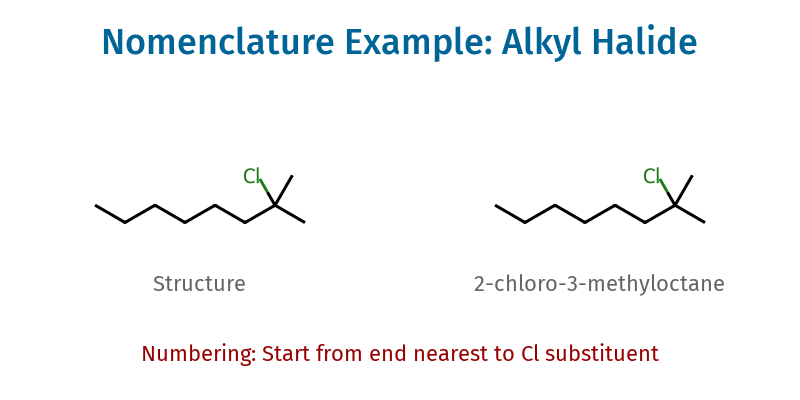
תרגול שאלה 1
מספור הפחמנים: 1, 2, 3, 4, 5, 6, 7, 8
המתמירים:
- כלורו
- מתיל
השם: 2-כלורו-3-מתיל-אוקטאן
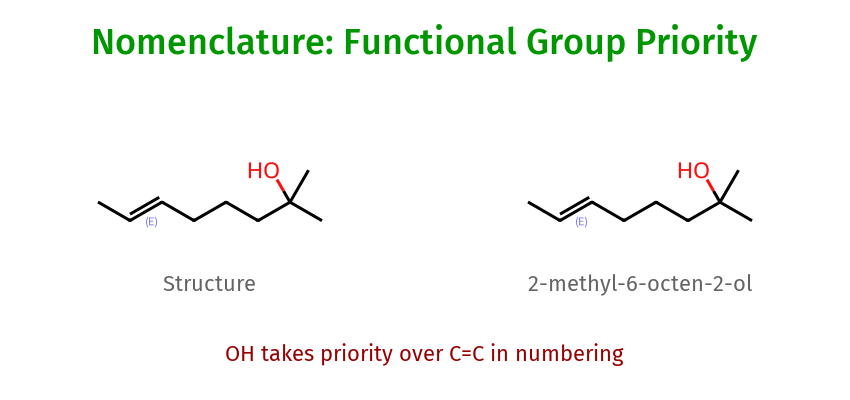
תרגול שאלה 2
במולקולה השנייה יש שתי קבוצות פונקציונליות: קשר כפול ואלכוהול.
כשיש קשר כפול, הוא מקבל עדיפות בנומנקלטורה ומופיע ראשון בפחמן מספר 2.
השם הנכון: 2-מתיל-6-אוקטן-2-אול
הערה: בנומנקלטורה של הלוגנים, הם מקבלים סיומת “ו”:
- יוד ← יודו
- כלור ← כלורו
- ברום ← ברומו
דוגמה נוספת לנומנקלטורה
כאשר יש מולקולה עם מספר קבוצות מתמירות, השם ניתן לפי הכללים:
- 4-כלורו-3-אתיל-הקסאן
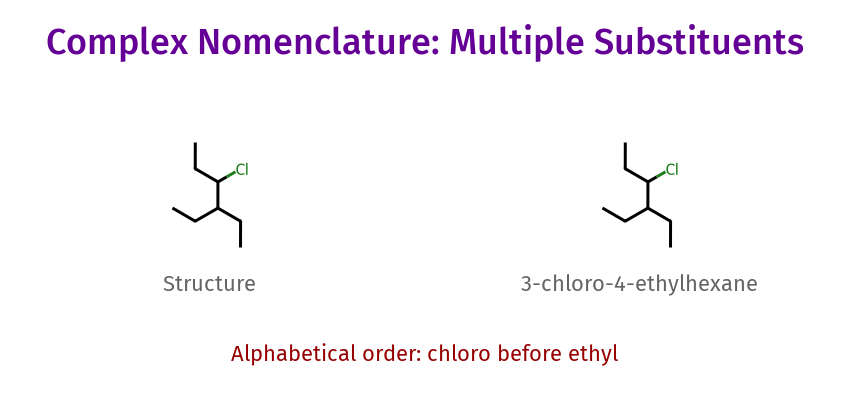
חשוב לזכור שבנומנקלטורה מחפשים את השרשרת הארוכה ביותר עם מספר רב של מתמירים.
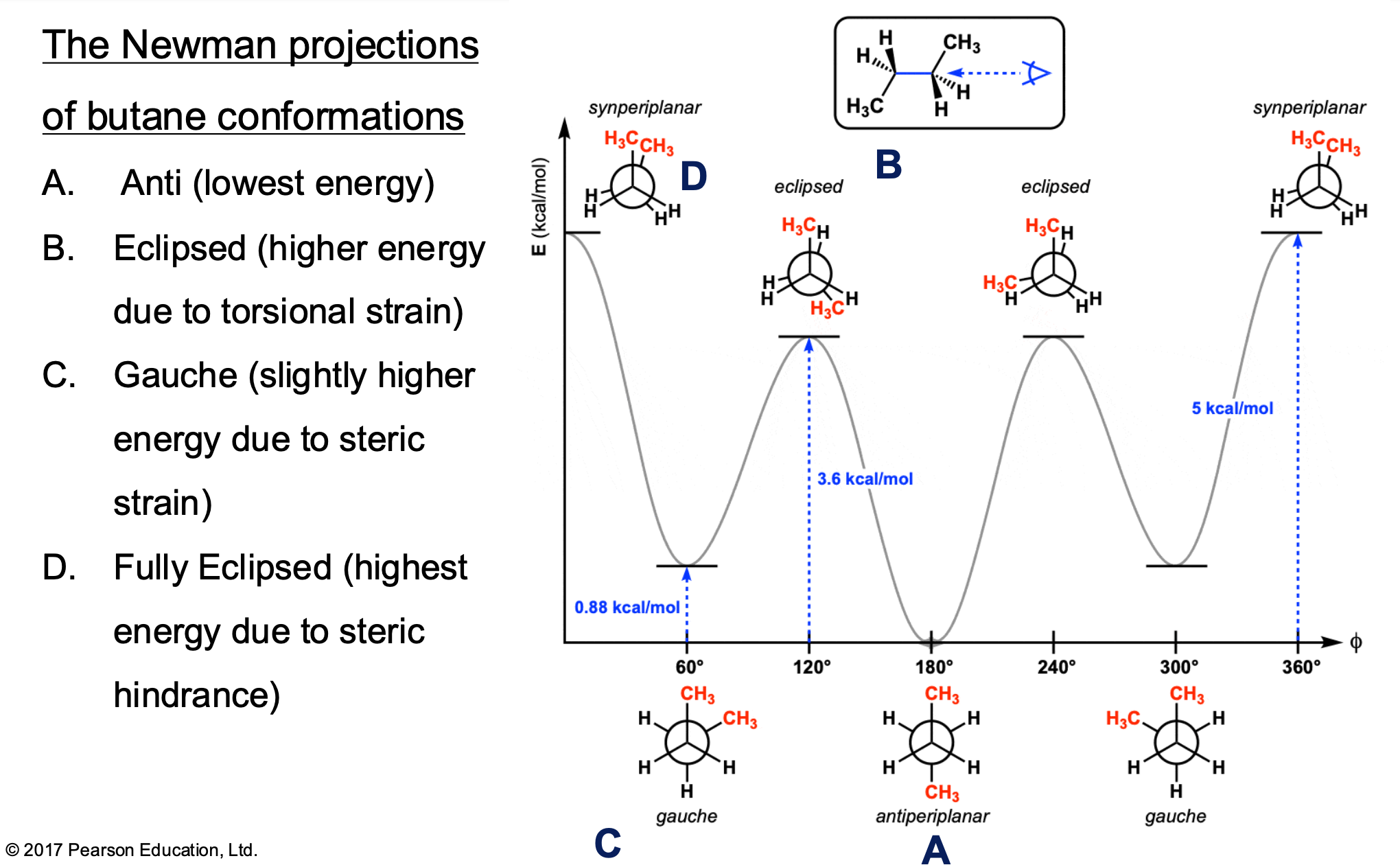
איזומריה מרחבית: ציס/טרנס ו-E/Z
קשרים כפולים במרחב
להבדיל מקשרים יחידים, לקשרים כפולים אין סיבוב חופשי במרחב.
השוואה:
- אלקאן בוטאן ($\ce{C4H10}$): יכול להסתובב חופשי סביב קשרי $\ce{C-C}$ (קשרי סיגמא)
- קשר כפול ($\ce{C=C}$): קשר הפאי מקובע ולא מאפשר סיבוב
כתוצאה מכך, יש משמעות למיקום המרחבי של המתמירים על הפחמנים של הקשר הכפול.
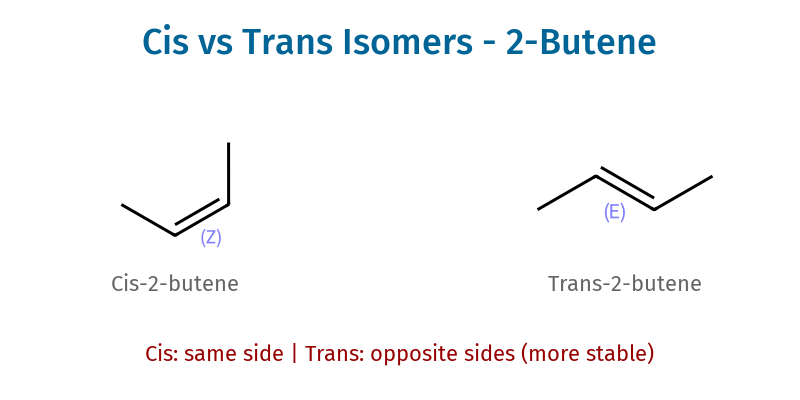
ציס וטרנס
כאשר יש שני מתמירים (אחד על כל פחמן של הקשר הכפול):
- טרנס: המתמירים בכיוונים מנוגדים
- ציס: המתמירים באותו צד של הקשר הכפול
חשוב: ציס וטרנס הם איזומרים מרחביים שונים לחלוטין - מולקולות שונות עם תכונות שונות. הטרנס לרוב יציב יותר - המתמירים רחוקים זה מזה ולא מפריעים.
E/Z נומנקלטורה
כשיש יותר משני מתמירים על הקשר הכפול, משתמשים במערכת $\ce{E/Z}$.
איך קובעים E או Z:
- לכל פחמן בקשר הכפול, מזהים את הקבוצה בעלת העדיפות הגבוהה (לפי כללי CIP)
- אם שתי הקבוצות בעלות העדיפות הגבוהה באותו צד - איזומר Z (Zusammen = “יחד”)
- אם בצדדים מנוגדים - איזומר E (Entgegen = “מנוגד”)

דוגמה עם עדיפויות:
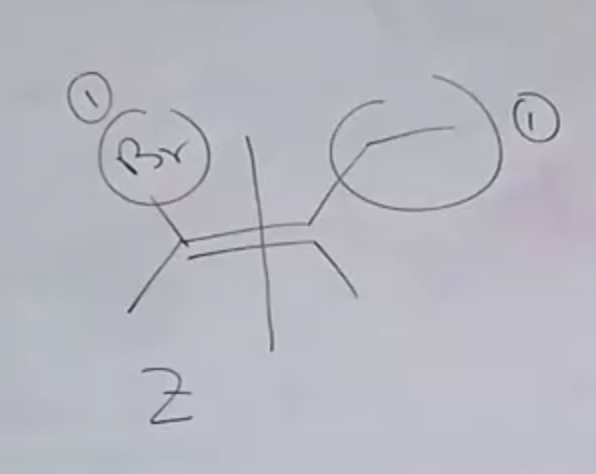
(לא הצלחתי לייצר את התמונה של גרסת ה-E)
כללי קביעת עדיפות (CIP)
- העדיפות נקבעת לפי המסה האטומית של האטום הראשון
- אם האטומים הראשונים זהים, ממשיכים לאטום הבא
- הלוגנים (Br, Cl, I) בעלי עדיפות גבוהה מפחמנים
- אתיל ($\ce{C2H5}$) > מתיל ($\ce{CH3}$)
- מימן תמיד בעל העדיפות הנמוכה ביותר
מקרים מיוחדים
- כאשר יש אותו מתמיר על אותו פחמן - אי אפשר להגדיר E/Z
- בקשר כפול טרמינלי - אין משמעות לאיזומריה מרחבית

סימון בנומנקלטורה
האיזומריה המרחבית מצוינת בהתחלה בסוגריים:
- $(E)$-2-פנטן
- $(Z)$-3-הקסן
- $(2E,4Z)$-2,4-הקסדיאן (מספר קשרים כפולים)
ציקלואלקאנים ומתח טבעתי
מתח טבעתי
ציקלואלקאנים קטנים במתח עקב זוויות קשר לא אופטימליות:


- ציקלופרופאן: זווית 60° (במקום 109.5° האופטימלית) - לא יציב
- ציקלובוטאן: זווית 90° - מתח זוויתי משמעותי
- ציקלופנטאן: יותר יציב אך לא אופטימלי
- ציקלוהקסאן: הטבעת היציבה ביותר
קונפורמציית כיסא בציקלוהקסאן
ציקלוהקסאן מקבל צורת “כיסא” במרחב:
- פחמן אחד מתרומם מעלה
- הפחמן הנגדי יורד מטה
קונפורמציות אחרות:
- ספינה (boat) - פחות יציבה
- צורה מישורית - הכי פחות יציבה

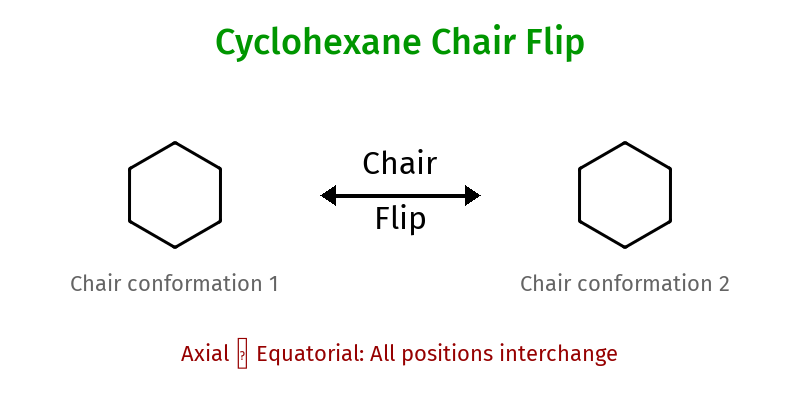
עמדות אקסיאליות ואקווטוריאליות
עמדה אקסיאלית
- מכוונים מאונך לטבעת (למעלה/למטה)
- מתמירים על פחמנים 1,3 יכולים ליצור “הפרעה 1,3-דיאקסיאלית”
- פחות יציבה למתמירים גדולים
עמדה אקווטוריאלית
- במישור הטבעת (לכיוון החוץ)
- יותר יציבה - אין הפרעות סטריות
- מועדפת למתמירים גדולים
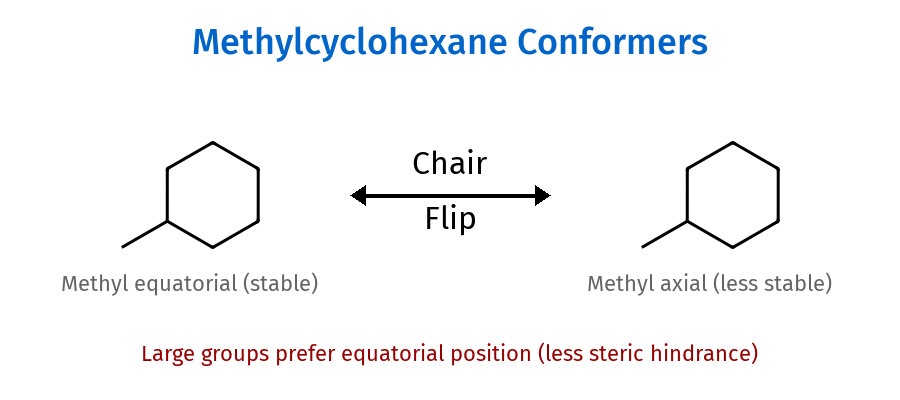
סיכום: אקסיאלי = למעלה/למטה ← פחות יציב אקווטוריאלי = החוצה ← יותר יציב
יחסי ציס/טרנס בטבעות
התייחסות למיקום המתמירים ביחס למישור הטבעת:
- ציס: שני מתמירים באותו צד (שניהם מעל או שניהם מתחת)
- טרנס: שני מתמירים בצדדים מנוגדים (אחד מעל, אחד מתחת)

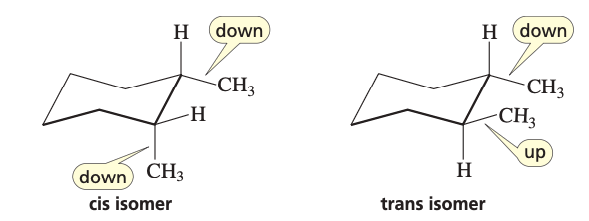
דוגמאות ספציפיות:
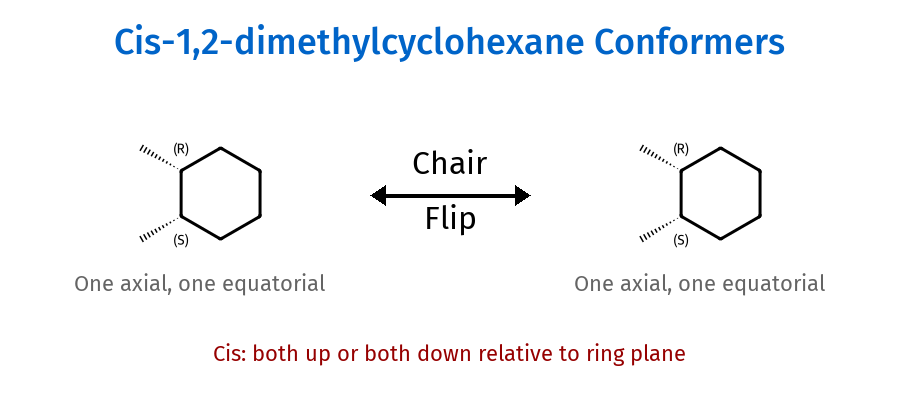
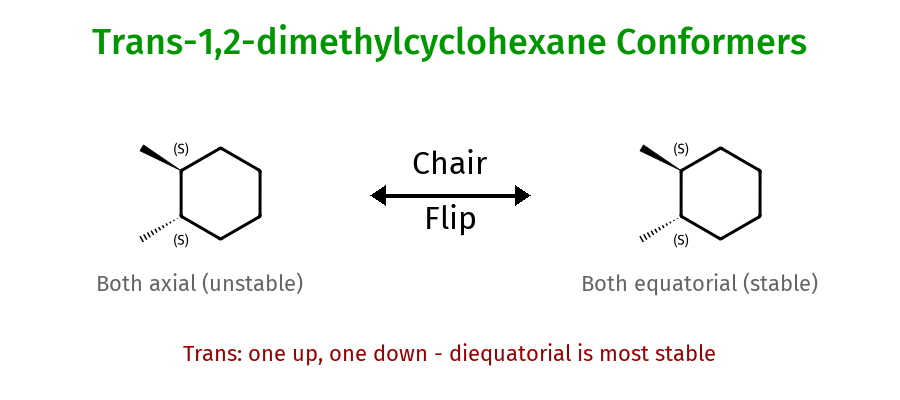
היפוך כיסא (Chair Flip)
ציקלוהקסאן יכול לעבור “היפוך כיסא”:
תוצאת ההיפוך:
- כל מתמיר אקסיאלי ← אקווטוריאלי
- כל מתמיר אקווטוריאלי ← אקסיאלי
- כיוון המתמירים (למעלה/למטה) נשמר
חשוב: הגדרת ציס/טרנס לא משתנה בהיפוך כיסא!
המרה ממולקולה מישורית לקונפורמציית כיסא
כלל חשוב:
- קו מקווקו (מתחת למישור) ← תמיד למטה בכיסא
- טריז מלא (מעל המישור) ← תמיד למעלה בכיסא
יציבות קונפורמרים
יציבות נקבעת על פי:
- מספר המתמירים האקווטוריאליים (יותר = יציב יותר)
- גודל המתמירים (גדולים מעדיפים אקווטוריאלי)
יציבות בכימיה:
- יציב = אנרגיה נמוכה
- לא יציב = אנרגיה גבוהה
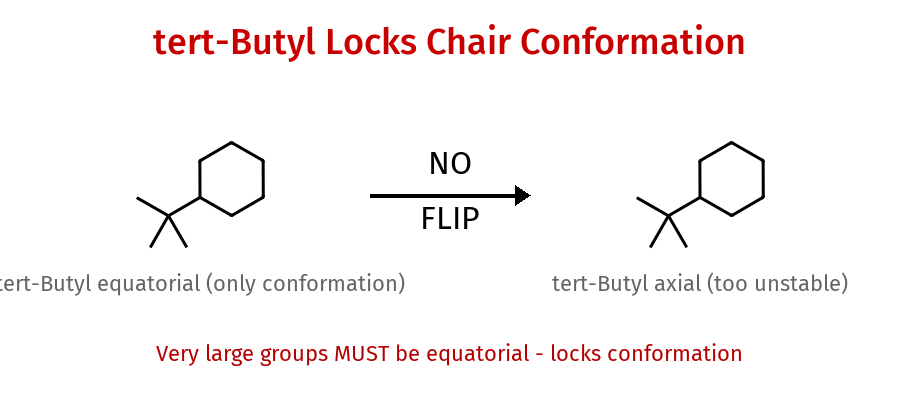
מקרים מיוחדים - קיבוע קונפורמציה
קבוצות גדולות מאוד:
- טרט-בוטיל ($\ce{C(CH3)3}$)
- איזופרופיל ($\ce{CH(CH3)2}$)
חייבות להיות בעמדה אקווטוריאלית - מקבעות את הכיסא!

סיכום מושגים בסטריאוכימיה
סוגי איזומרים
- איזומרים מבניים - אותה נוסחה, קשרים שונים
- איזומרים מרחביים - אותה נוסחה וקשרים, סידור שונה במרחב:
- איזומרים גיאומטריים (ציס/טרנס או E/Z) בקשרים כפולים
- איזומרים גיאומטריים בטבעות
- איזומרים כיראליים
- קונפורמרים - צורות שונות מסיבוב סביב קשרים יחידים
הכללים העיקריים
- ציס/טרנס בציקלואלקאנים: מיקום ביחס למישור הטבעת
- אקסיאלי/אקווטוריאלי: כיוון ביחס לטבעת
- היפוך כיסא: משנה עמדות אך לא משנה ציס/טרנס
- יציבות: אקווטוריאלי יציב יותר, במיוחד למתמירים גדולים
הבנת האיזומריה המרחבית חשובה מאוד - איזומרים שונים מציגים תכונות שונות לחלוטין, עם השפעה רבה על פיתוח תרופות וחומרים חדשים.
דור פסקל