חזרה על מבנה מולקולרי
ההרצאה נפתחה בתרגיל חזרה על החומר משיעור קודם, שמטרתו הייתה לחזק את הבנת המבנה המולקולרי של תרכובות אורגניות. התלמידים התבקשו לנתח את המולקולה אצטוניטריל ($\ce{CH3CN}$), מולקולה פשוטה יחסית בעלת שני פחמנים, שלושה מימנים וחנקן. הניתוח היה מקיף וכלל מספר היבטים חשובים בהבנת המבנה המולקולרי: מבנה לואיס, צורות רזוננס אפשריות, היברידיזציה של האטומים, וסוגי הקשרים במולקולה.
מבנה האצטוניטריל ניתן לייצוג באופן הבא:
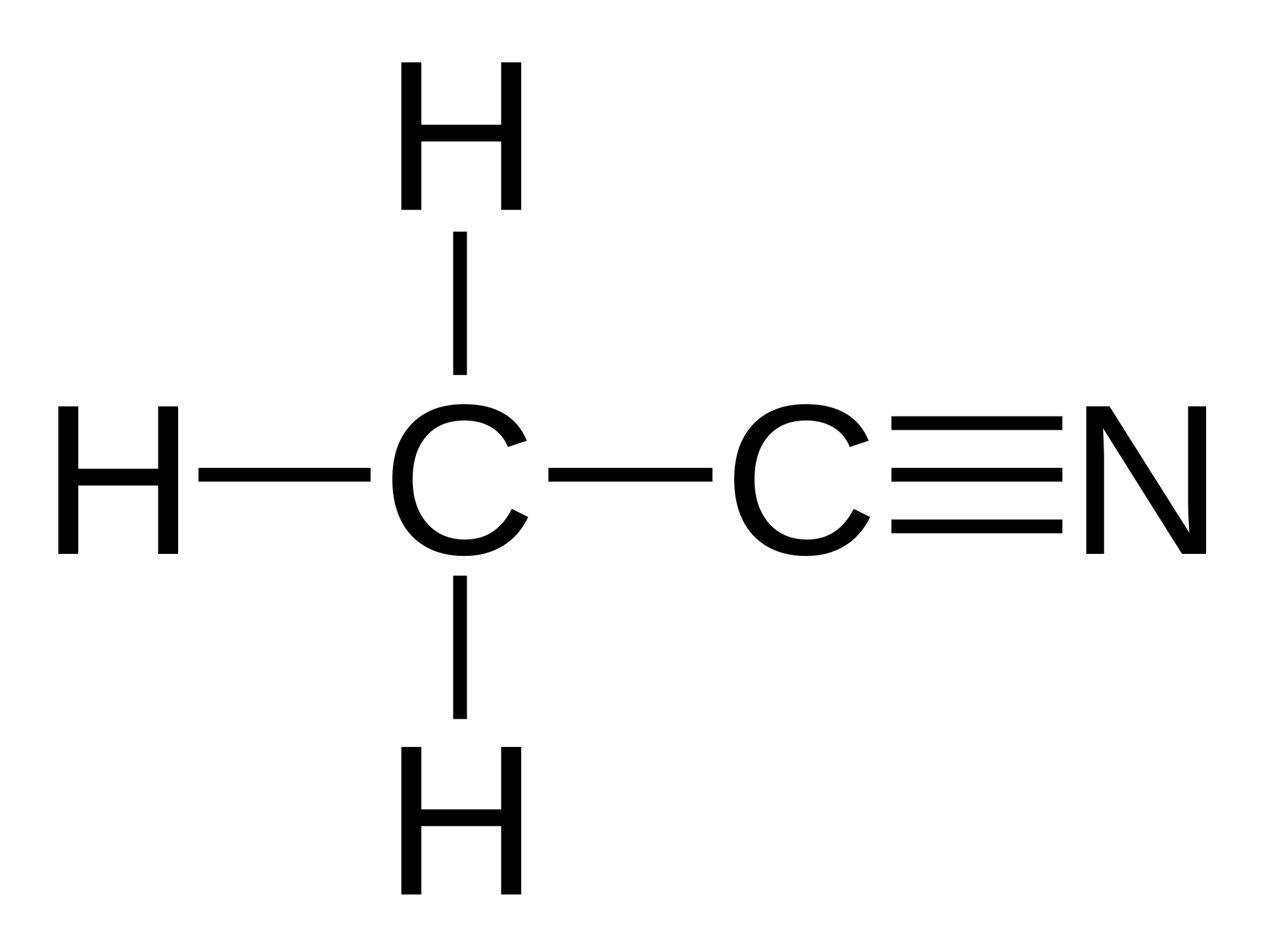
בניתוח מבנה המולקולה, זוהו מספר מאפיינים חשובים:
הפחמן הראשון (המחובר לשלושה מימנים) נמצא בהיברידיזציה $sp^3$, דבר המקנה לו גיאומטריה טטראדרית. הדבר מתיישב עם העובדה שהוא יוצר ארבעה קשרים: שלושה עם מימנים וקשר אחד עם הפחמן השני. היברידיזציה זו מאפשרת לפחמן ליצור ארבעה קשרים סיגמא ($\sigma$) בכיוונים שונים במרחב.
הפחמן השני (המחובר לחנקן) נמצא בהיברידיזציה $sp$, המקנה לו גיאומטריה לינארית. הדבר מתיישב עם העובדה שהוא יוצר קשר משולש עם החנקן (קשר אחד $\sigma$ ושני קשרים $\pi$) וקשר בודד עם הפחמן הראשון.
גם החנקן נמצא בהיברידיזציה $sp$, התורמת אף היא לגיאומטריה הלינארית של חלק זה במולקולה. החנקן יוצר קשר משולש עם הפחמן השני ונושא זוג אלקטרונים לא קושר.
במהלך הדיון בכיתה עלתה שאלה לגבי צורות הרזוננס האפשריות של המולקולה. הוסבר כי קיימת צורה רזוננטיבית, בה זוג האלקטרונים מהפחמן עובר לחנקן, כך שהחנקן נטען במטען שלילי והפחמן במטען חיובי:
\[\begin{array}{ccccccccc} \ce{H} & & & & \ce{H} & \\ \mid & & & & \mid & \\ \ce{H-C-C} & \equiv & \ce{N:} & \xrightarrow{} & \ce{H-C-C+} & = & \ce{\ddot{N:}^-} \\ \mid & & & & \mid & \\ \ce{H} & & & & \ce{H} & \end{array}\]אחת השאלות המעניינות שעלו בדיון הייתה מדוע בצורת הרזוננס החנקן מקבל מטען שלישי והפחמן מטען חיובי, ולא להיפך. ההסבר לכך טמון באלקטרוניגטיביות של האטומים: החנקן הוא אטום אלקטרוניגטיבי יותר מהפחמן, ולכן בדרך כלל יעדיף למשוך אליו אלקטרונים. אולם בצורת רזוננס אפשרית, חל תהליך הפוך, שבו זוג האלקטרונים “מועבר” מהחנקן לפחמן. צורה זו אינה המבנה העיקרי של המולקולה, אלא רק תורמת במידה מסוימת לתמונה המלאה של פיזור הענן האלקטרוני במולקולה:
\[\begin{array}{ccccccccc} \ce{H} & & & & \ce{H} & \\ \mid & & & & \mid & \\ \ce{H-C-C} & \equiv & \ce{N:} & \xrightarrow{} & \ce{H-C-\ddot{C}-} & = & \ce{N:^+} \\ \mid & & & & \mid & \\ \ce{H} & & & & \ce{H} & \end{array}\]חומצות ובסיסים
המרצה הדגישה כי תהליכים רבים בכימיה אורגנית מתבססים על תגובות חומצה-בסיס, ועל כן הבנה מעמיקה של תחום זה היא קריטית למי שרוצה להבין כימיה אורגנית. הדיון התחיל בהגדרות בסיסיות של מושגים מרכזיים.
הגדרות יסוד
פרוטון ($\ce{H+}$) הוא גרעין של אטום מימן, ללא אלקטרונים. בתגובות חומצה-בסיס, הפרוטון עובר מהחומצה לבסיס.
חומצה היא חומר שנותן (תורם) פרוטון. בהקשר של תגובות חומצה-בסיס בכימיה אורגנית, היכולת של חומר להתנהג כחומצה תלויה במידה רבה ביכולתו לייצב את המטען השלילי שנוצר לאחר שהפרוטון עוזב.
בסיס הוא חומר שמקבל פרוטון. יכולתו של חומר להתנהג כבסיס תלויה ביכולתו לספק זוג אלקטרונים ליצירת קשר עם הפרוטון.
תגובה כללית בין חומצה ובסיס ניתן לייצג באופן הבא:
\[\ce{HA + B^- \rightleftharpoons A^- + HB}\]כאשר:
- $\ce{HA}$ היא החומצה
- $\ce{B^-}$ הוא הבסיס
- $\ce{A^-}$ הוא הבסיס המצומד של החומצה
- $\ce{HB}$ היא החומצה המצומדת של הבסיס
חוזק חומצות ובסיסים
קיים קשר הפוך בין חוזק החומצה לחוזק הבסיס המצומד שלה. חומצה חזקה תתן פרוטון בקלות, ולכן הבסיס המצומד שלה יהיה חלש (לא ירצה לקבל את הפרוטון בחזרה). לעומת זאת, חומצה חלשה לא תתן פרוטון בקלות, ולכן הבסיס המצומד שלה יהיה חזק (ירצה לקבל את הפרוטון בחזרה).
חומצה חזקה = לא יציבה
בסיס חלש = יציב
דוגמה ויזואלית לכך:
חומצה חזקה: H-A → H⁺ + A⁻ (קל מאוד)
A⁻ = בסיס מצומד חלש (לא רוצה את H⁺ בחזרה)
חומצה חלשה: H-B ⇌ H⁺ + B⁻ (לא קל)
B⁻ = בסיס מצומד חזק (רוצה את H⁺ בחזרה)
במהלך השיעור נשאלה השאלה מדוע כשחומצה חזקה, הבסיס המצומד שלה חלש. ההסבר שניתן הוא שאם החומצה ויתרה בקלות על הפרוטון, סביר שלא תהיה לה נטייה חזקה לקבל אותו בחזרה. במונחים אנרגטיים, אם המולקולה המקורית (החומצה) לא יציבה עם הפרוטון, אז המולקולה ללא הפרוטון (הבסיס המצומד) תהיה יציבה יותר, ולכן לא תרצה לקבל את הפרוטון בחזרה.
תגובות בין חומצות ובסיסים תלויות בחוזק היחסי שלהם:
-
חומצה חזקה + בסיס חלש: תגובה תתרחש, אם כי הבסיס החלש לא להוט במיוחד לקבל את הפרוטון. עם זאת, מאחר שהחומצה חזקה מאוד ו”דוחפת” את הפרוטון, התגובה תתרחש.
-
חומצה חלשה + בסיס חזק: תגובה תתרחש, מאחר שהבסיס החזק “מושך” את הפרוטון מהחומצה החלשה.
-
חומצה חזקה + בסיס חזק: תגובה אגרסיבית מאוד תתרחש, כיוון ששני הצדדים מעודדים את מעבר הפרוטון.
-
חומצה חלשה + בסיס חלש: כמעט ולא תתרחש תגובה, כיוון שהחומצה החלשה לא נוטה לשחרר את הפרוטון והבסיס החלש לא נוטה לקבל אותו.
$pK_a$ - מדד לחומציות
$pK_a$ הוא מדד מקובל לחוזק החומצה, והוא מחושב כמינוס הלוגריתם של קבוע פירוק החומצה ($K_a$):
\[pK_a = -\log(K_a)\]ככל ש-$pK_a$ נמוך יותר, החומצה חזקה יותר. חשוב להדגיש שמדובר בסקאלה לוגריתמית, כך שהבדל של יחידה אחת ב-$pK_a$ מייצג פי 10 הבדל בחוזק החומצה.
גורמים המשפיעים על חוזק חומצה
הרעיון הכללי:
ככל שהחומצה ״מוותרת״ על הפרוטון בקלות רבה יותר, כך היא חזקה יותר. במילים אחרות, ככל שהבסיס המצומד שלה יציב יותר = חלש יותר (אין לו בעיה להסתדר בלי הפרוטון = מייצב טוב יותר מטען שלישי), כך החומצה חזקה יותר.
שני גורמים עיקריים משפיעים על חוזק חומצה בכימיה אורגנית:
-
רזוננס: רזוננס הוא תופעה בה אלקטרונים “מתפזרים” על פני חלקים שונים של המולקולה, מה שמייצב אותה. ככל שיש יותר צורות רזוננטיביות שמייצבות את המטען השלילי בבסיס המצומד, כך החומצה תהיה חזקה יותר. זאת מכיוון שהמטען השלילי מפוזר על פני חלקים רבים יותר של המולקולה, מה שמפחית את הדחייה האלקטרוסטטית ומייצב אותה.
-
השפעה אינדוקטיבית: אטומים אלקטרוניגטיביים (כמו הלוגנים) מושכים אלקטרונים אליהם ובכך מייצבים מטען שלילי הנמצא בקרבתם. ככל שיש יותר אטומים אלקטרוניגטיביים בקרבת המרכז החומצי, כך החומצה תהיה חזקה יותר.
קבוצות שמושכות אלקטרונים: הלוגנים, למשל, מושכים אלקטרונים.
קבוצות שדוחפות אלקטרונים: מובילות לעלייה ב $pK_a$ (חומצה חלשה יותר). כלומר, חומצה פחות חזקה.
מספר דוגמאות שהוצגו בשיעור להמחשת העקרונות הללו:
-
אתנול ($\ce{CH3CH2OH}$):
\[\begin{array}{cccccc} & & \ce{H} & & \ce{H} & \\ & & \vert & & \vert & & \\ \ce{H} & - & \ce{C} & - & \ce{C} & - \ce{O} - \ce{H} \\ & & \vert & & \vert & \\ & & \ce{H} & & \ce{H} & \end{array}\]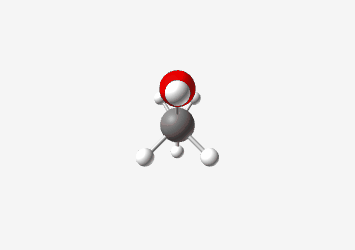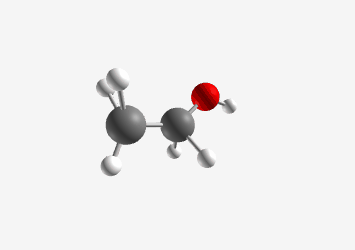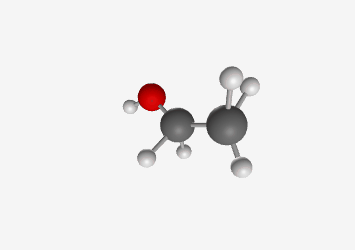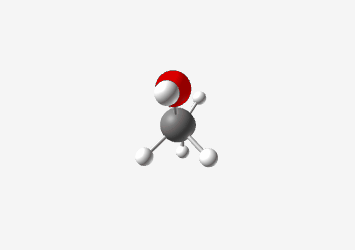
האתנול הוא חומצה חלשה מאוד עם $pK_a$ בסביבות 16. הפרוטון החומצי הוא זה המחובר לחמצן. החמצן האלקטרוניגטיבי מייצב במידת מה את המטען השלילי שנוצר לאחר שהפרוטון עוזב, אך אין רזוננס לייצוב נוסף.
כשאנחנו מדברים על $pK_a$ של חומצה, אנחנו מתכוונים ל-$pK_a$ של הפרוטון החומצי. כלומר, ככלל, לא קוטפים מימנים שמחוברים לפחמן (מקרים חריגים בהמשך).
איזו חומצה חזקה יותר: אתנול ($\ce{CH3CH2OH}$) או מתנול ($\ce{CH3OH}$)?
התשובה: מתנול ($\ce{CH3OH}$)
-
חוזק חומצה – מבוסס על יציבות הבסיס המצומד:
כאשר אלכוהול תורם פרוטון $\ce{H+}$, הוא הופך לבסיס המצומד – יון שלילי על החמצן:
\[\ce{CH3CH2OH -> CH3CH2O^- + H+}\] \[\ce{CH3OH -> CH3O^- + H+}\]ככל שהיון $\ce{RO^-}$ יציב יותר, כך החומצה חזקה יותר.
-
אפקט השרשרת האלילית (Inductive Effect):
באתנול, קבוצת האתיל $\ce{-CH2CH3}$ דוחפת אלקטרונים לכיוון החמצן (אפקט אינדוקטיבי), מה שמעלה את צפיפות האלקטרונים על החמצן והופך את היון $\ce{CH3CH2O^-}$ לפחות יציב.
במתנול, קבוצת המתיל קטנה יותר ולכן האפקט הדוחף פחות חזק ← היון יציב יותר ← החומצה חזקה יותר.
מסקנה:
- $\textbf{pKa of Methanol}$ ≈ 15.5
- $\textbf{pKa of Ethanol}$ ≈ 16.0
- ← מתנול חומצה חזקה יותר (pKa נמוך יותר)
-
-
חומצה אצטית ($\ce{CH3COOH}$):
\[\begin{array}{cccccc} & & \ce{H} & & & \\ & & \vert & & & & \\ \ce{H} & - & \ce{C} & - & \ce{C} & - \ce{\underset{\cdot\cdot}{\ddot{O}}} - \textcolor{red}{\ce{H}} \\ & & \vert & & \parallel & \\ & & \ce{H} & & \ce{:O:} & \end{array}\]Acetic Acid (CH₃COOH) 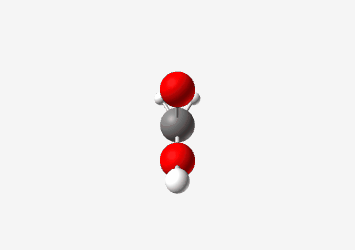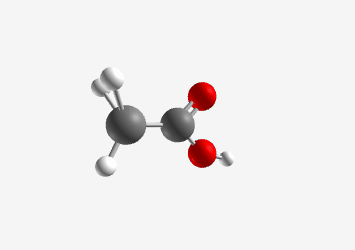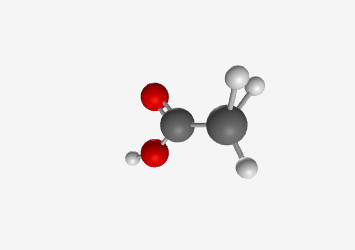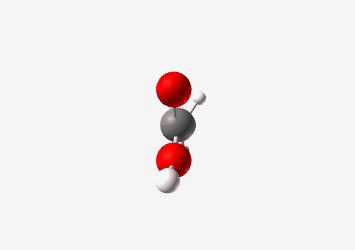
Tetrahedral pKa: 4.76 Carboxyl group stabilizes conjugate base through resonance החומצה האצטית היא חומצה חזקה יותר עם $pK_a$ בסביבות 4.8. הפרוטון החומצי הוא זה המחובר לחמצן הקרבוקסילי. האניון שנוצר לאחר שהפרוטון עוזב מיוצב על ידי רזוננס בין שני אטומי החמצן, כך שהמטען השלילי “מתפזר” ביניהם:
\[\begin{array}{ccccccccccc} \ce{H} & \ce{:\ddot{O}:^-} & & \ce{H} & \ce{O} & \\ \mid & \mid & & \mid & \parallel & \\ \ce{H-C}-- & \ce{C} & \ce{=O} \ \xleftrightarrow{} &\ \ce{H-C}-- & \ce{C} & \ce{-O^-} \\ \mid & & & \mid & & & \\ \ce{H} & & & \ce{H} & & \end{array}\] -
טריפלורואצטיק אסיד ($\ce{CF3COOH}$):
\[\begin{array}{cccccc} & & \ce{F} & & & \\ & & \vert & & & & \\ \ce{F} & - & \ce{C} & - & \ce{C} & - \ce{O} - \ce{H} \\ & & \vert & & \parallel & \\ & & \ce{F} & & \ce{O} & \end{array}\]הטריפלורואצטיק אסיד הוא חומצה חזקה מאוד עם $pK_a$ קרוב ל-0. כאן, בנוסף לייצוב הרזוננטיבי שקיים גם בחומצה אצטית, קיימת גם השפעה אינדוקטיבית חזקה של שלושת אטומי הפלואור (מאוד אלקטרוניגטיביים), שמושכים אלקטרונים ומייצבים עוד יותר את המטען השלילי.
חומצת פלורו לא משולשת:

בדיון בכיתה נשאלה השאלה מדוע חומצה עם פלואור בקרבת מרכז החומציות תהיה חזקה יותר מחומצה עם כלור הרחוק ממרכז החומציות. ההסבר שניתן הוא שההשפעה האינדוקטיבית פוחתת עם המרחק. כלומר, אטום אלקטרוניגטיבי ישפיע בעיקר על האטומים הקרובים אליו, וככל שמתרחקים ממנו, השפעתו פוחתת. לכן, כלור הרחוק מהמרכז החומצי כמעט ולא ישפיע על יכולתו של הפרוטון להשתחרר.
זיהוי פרוטונים חומציים
אחד הנושאים המרכזיים בשיעור היה זיהוי פרוטונים חומציים במולקולות אורגניות. המרצה הדגישה שלא כל פרוטון במולקולה הוא פרוטון חומצי, וחשוב לדעת לזהות אילו פרוטונים עשויים להיות חומציים.
דוגמאות למולקולות עם פרוטונים חומציים
-
אתנול ($\ce{CH3CH2OH}$): באתנול, הפרוטון החומצי הוא זה המחובר לחמצן (ה-OH). פרוטון זה חומצי יחסית בגלל האלקטרוניגטיביות של החמצן, שמושכת אלקטרונים ומייצבת את המטען השלילי שנוצר כאשר הפרוטון עוזב. ה-$pK_a$ של אתנול הוא בסביבות 16, מה שמסווג אותו כחומצה חלשה. בהשוואה, הפרוטונים המחוברים לפחמנים באתנול הם בעלי $pK_a$ בסביבות 42, ולכן אינם נחשבים לחומציים בהקשרים רגילים.
-
חומצה אצטית ($\ce{CH3COOH}$): בחומצה אצטית, הפרוטון החומצי הוא שוב זה המחובר לחמצן, אך הפעם מדובר בחמצן של קבוצה קרבוקסילית (-COOH). פרוטון זה חומצי הרבה יותר מזה שבאתנול בגלל הרזוננס שמתקיים בין שני אטומי החמצן בקבוצה הקרבוקסילית. הרזוננס מייצב את המטען השלילי שנוצר לאחר שהפרוטון עוזב, מה שמקל על שחרור הפרוטון. ה-$pK_a$ של חומצה אצטית הוא בסביבות 4.8, מה שהופך אותה לחומצה חזקה משמעותית מאתנול.
-
אלקין טרמינלי ($\ce{RC≡CH}$):
\[\ce{R-C≡C-H}\]זהו מקרה מיוחד ומעניין בו פרוטון המחובר לפחמן הוא חומצי. באלקין טרמינלי, הפחמן האחרון נמצא בהיברידיזציה $sp$, מה שנותן לו אופי $s$ חזק. אטומי פחמן בעלי אופי $s$ חזק נוטים להיות קרובים יותר לגרעין, ולכן האלקטרונים סביבם מרוכזים יותר, מה שמייצב את המטען השלילי שנוצר כאשר הפרוטון עוזב. ה-$pK_a$ של אלקין טרמינלי הוא בסביבות 25, שזה נמוך בהרבה מה-$pK_a$ של פרוטונים רגילים המחוברים לפחמנים בהיברידיזציה $sp^3$ (כ-42).

חשוב לציין שבדרך כלל, פרוטונים המחוברים לפחמנים רגילים (בהיברידיזציה $sp^3$) אינם חומציים, ולכן בהקשר של תגובות חומצה-בסיס רגילות, הם אינם משתתפים בתגובה. אך במקרים מיוחדים, כמו באלקינים טרמינליים, הם עשויים להיות חומציים מספיק כדי להגיב עם בסיסים חזקים מאוד.
תכונות בסיסיות של מולקולות אורגניות
בנוסף לתכונות חומציות, בשיעור נדונו גם תכונות בסיסיות של מולקולות אורגניות. מולקולות יכולות להיות בסיסיות אם יש להן זוג אלקטרונים לא קושר שיכול לקבל פרוטון.
שתי קבוצות עיקריות של חומרים בסיסיים בכימיה אורגנית הן:
-
אמינים: אלו הם חומרים המכילים חנקן עם זוג אלקטרונים לא קושר. החנקן יכול לתרום את זוג האלקטרונים ליצירת קשר עם פרוטון, ובכך להפוך למטען חיובי:
\[\ce{R3N: + H+ -> R3NH+}\]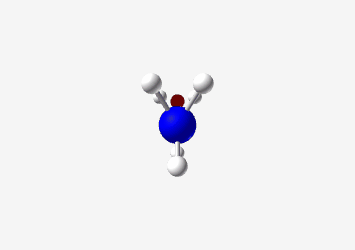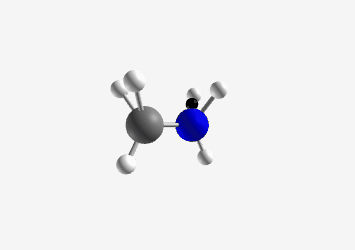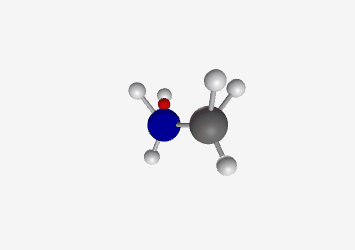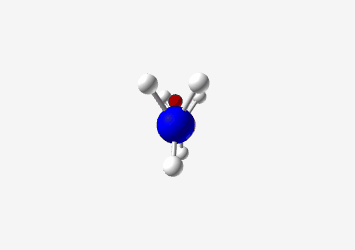
Ammonium ion (CH₃NH₃⁺) Amine (CH₃NH₂) 
Ethylammonium ion (C₂H₅NH₃⁺) Ethylamine (C₂H₅NH₂) Ammonia (NH₃) 
Trigonal pyramidal pKa: 38 Common base with lone pair on nitrogen that can accept a proton דוגמה פשוטה לאמין היא אמוניה ($\ce{NH3}$), אך בכימיה אורגנית נפוצים גם אמינים ראשוניים ($\ce{RNH2}$), שניוניים ($\ce{R2NH}$) ושלישוניים ($\ce{R3N}$), כאשר $\ce{R}$ מסמל קבוצה אורגנית.
-
אתרים: אלו הם חומרים המכילים חמצן עם זוגות אלקטרונים לא קושרים. בדומה לאמינים, החמצן יכול לתרום זוג אלקטרונים ליצירת קשר עם פרוטון, אם כי הוא פחות בסיסי מחנקן:
\[\ce{R2O: + H+ -> R2OH+}\]או בכתיבה מפורטת יותר:
\[\begin{array}{ccccccccccc} & \ce{R} & & & & & & \ce{R} & & \\ & \mid & & & & & & \mid & & \\ &\ce{:O:} & + & \ce{H^+} & \xrightarrow{} & & & \ce{OH+} \\ & \mid & & & & & & \mid & & \\ & \ce{R} & & & & & & \ce{R} & & \end{array}\]אתרים הם בסיסיים יחסית חלשים, ובדרך כלל יגיבו רק עם חומצות חזקות. דוגמאות לאתרים כוללות דיאתיל אתר ($\ce{CH3CH2OCH2CH3}$) וטטרהידרופוראן (THF).
בנוסף, נדונה גם תופעת הרזוננס באלדהידים ובקטונים, המאפשרת להם להתנהג כבסיסים חלשים במקרים מסוימים. החמצן בקבוצת הקרבוניל יכול לתרום זוג אלקטרונים ליצירת קשר עם פרוטון, כאשר המטען החיובי שנוצר מיוצב על ידי רזוננס:
\[\begin{array}{ccccc} \ce{:O:} & & & & \ce{OH^+} \\ \parallel & & & & \parallel \\ \ce{R-C-R'} & + & \ce{H^+} & \xrightarrow{} & \ce{R-C-R'} \end{array}\] \[\begin{array}{cccc} \ce{OH+} & & & \ce{OH} \\ \parallel & & & \vert \\ \ce{R-C-R'} & & \xleftrightarrow{} & \ce{R--C+-R'} \end{array}\]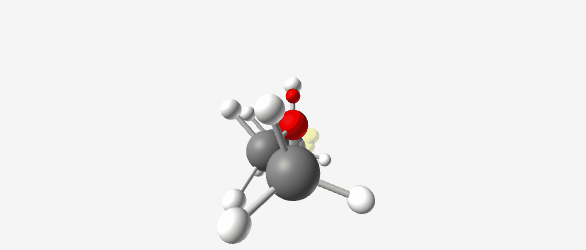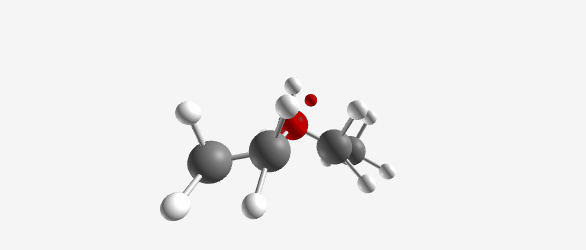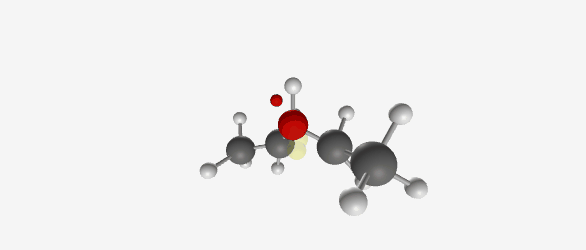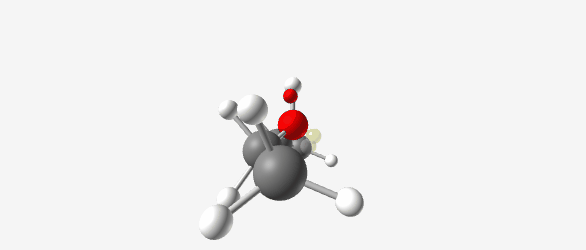 |  |
|---|---|
| $\ce{(CH3CH2)2OH+}$ (Diethyloxonium ion) פרוטונציה של די-אתיל אתר. חמצן מתרים זוג אלקטרונים ליצירת קשר עם פרוטון, המטען החיובי מיוצב על ידי רזוננס | Diethyl ether (C₂H₅OC₂H₅) |
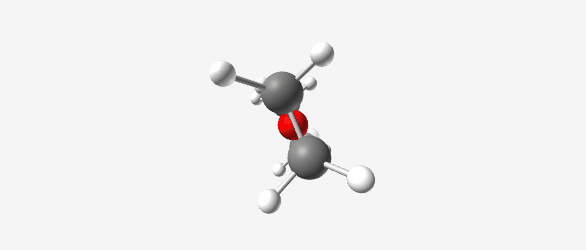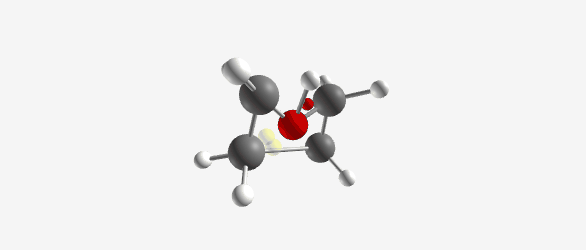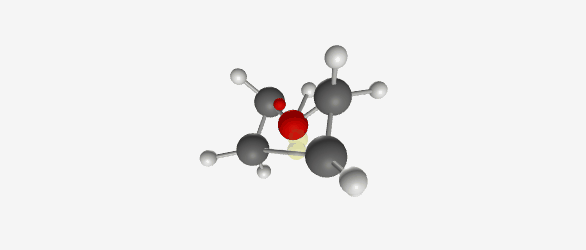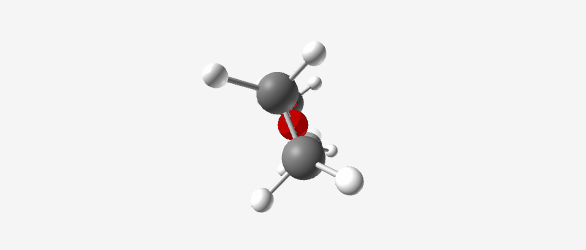 |  |
|---|---|
| $\ce{C4H9O+}$ (Tetrahydrofuran) פרוטונציה של טטרהידרופוראן. חמצן מתרים זוג אלקטרונים ליצירת קשר עם פרוטון, המטען החיובי מיוצב על ידי רזוננס | Tetrahydrofuran (THF) |
סיווג פחמנים
חלק חשוב נוסף בשיעור היה סיווג פחמנים בתרכובות אורגניות. הסיווג מתבסס על מספר אטומי הפחמן האחרים המחוברים ישירות לפחמן הנדון:
- פחמן ראשוני: מחובר לפחמן אחד אחר (ולאטומים אחרים כמו מימן)
- פחמן שניוני: מחובר לשני פחמנים אחרים
- פחמן שלישוני: מחובר לשלושה פחמנים אחרים
- פחמן רבעוני: מחובר לארבעה פחמנים אחרים
מטאן ($\ce{CH4}$), שבו הפחמן אינו מחובר לפחמנים אחרים כלל, הוא מקרה מיוחד שלעתים מסווג כ”פחות מראשוני”.
בנוסף, הוצגו סוגים מיוחדים של פחמנים הנושאים מטען:
- קרבוקטיון: פחמן הטעון במטען חיובי, בהיברידיזציה $sp^2$. נוצר בדרך כלל כאשר זוג אלקטרונים (יחד עם האטום שאליו היו מחוברים) עוזב את הפחמן.
- קרבואניון: פחמן הטעון במטען שלילי, נוצר בדרך כלל על ידי הוצאת פרוטון מפחמן.
הבנת סיווג הפחמנים חיונית להבנת התגובות בכימיה אורגנית, מכיוון שסוגים שונים של פחמנים מתנהגים באופן שונה בתגובות כימיות.
הקדמה לנומנקלטורה
בחלק האחרון של השיעור, הוצגה הקדמה לנומנקלטורה - מערכת השמות השיטתית בכימיה אורגנית. הוסברו שלושה סוגים עיקריים של שרשראות פחמימניות:
1. אלקאנים (Alkanes)
לפי ויקיפדיה נקראים גם ״פחמימנים רוויים״
אלו הן שרשראות פחמימניות המכילות רק קשרים יחידים (קשרי $\sigma$) בין אטומי הפחמן. כל אטום פחמן יוצר ארבעה קשרים, וכאשר לא כל הקשרים הם עם פחמנים אחרים, השאר הם עם מימנים. הנוסחה הכללית של אלקנים היא $\ce{C_nH_{2n+2}}$, כאשר $n$ הוא מספר אטומי הפחמן.
דוגמאות לאלקנים פשוטים:
- מתאן ($\ce{CH4}$)
- אתאן ($\ce{C2H6}$)
- פרופאן ($\ce{C3H8}$)
- בוטאן ($\ce{C4H10}$)
 | 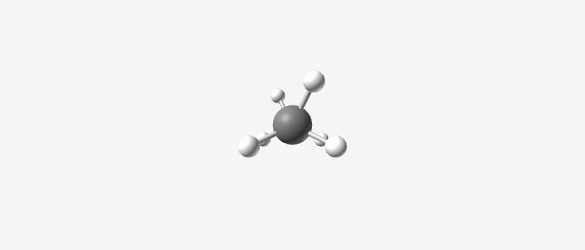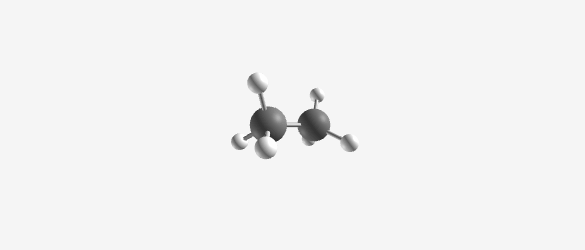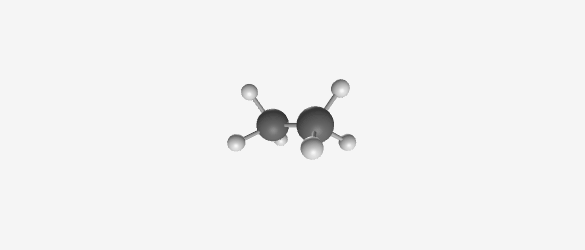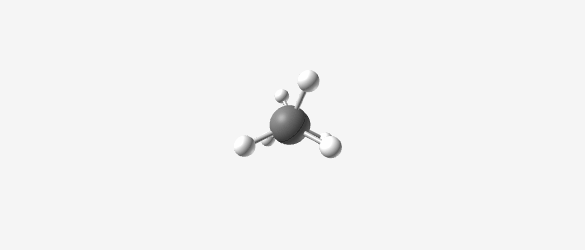 | 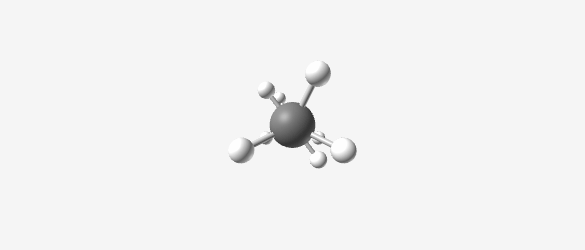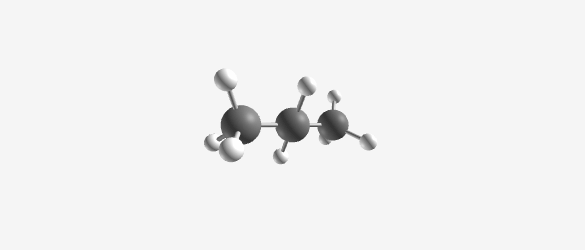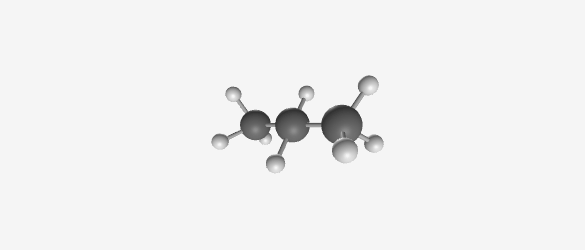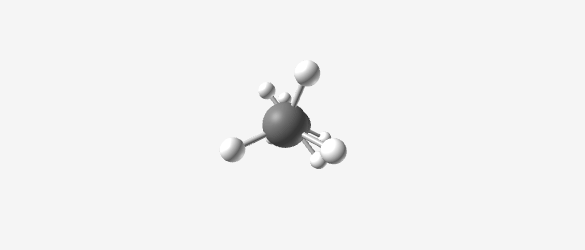 | 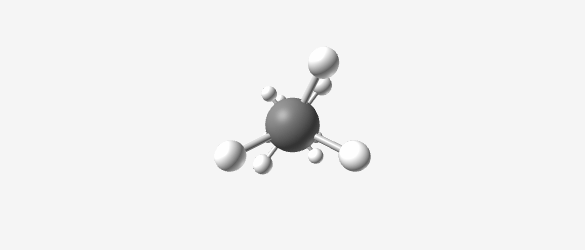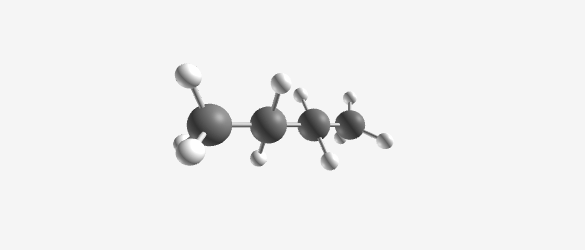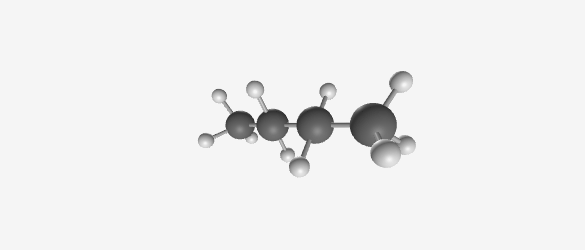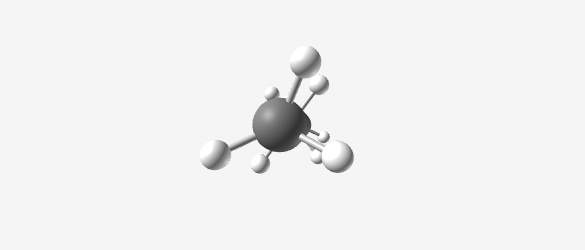 |
|---|---|---|---|
| Methane (CH₄) | Ethane (C₂H₆) | Propane (C₃H₈) | Butane (C₄H₁₀) |
2. אַלקֵנים (Alkenes)
תרכובות אורגניות בלתי רוויות.
אלו הן שרשראות פחמימניות המכילות לפחות קשר כפול אחד בין אטומי פחמן. הנוסחה הכללית של אלקנים היא $\ce{C_nH_{2n}}$.
דוגמאות לאלקנים פשוטים:
- אֶתֶן ($\ce{C2H4}$)
- פּרוֹפֵן ($\ce{C3H6}$)
- בוּטֵן ($\ce{C4H8}$)
 |  |  |
|---|---|---|
| Ethene (C₂H₄) | Propene (C₃H₆) | Butene (C₄H₈) |
3. אלקינים (Alkynes)
אלו הן שרשראות פחמימניות המכילות לפחות קשר משולש אחד בין אטומי פחמן. הנוסחה הכללית של אלקינים היא $\ce{C_nH_{2n-2}}$.
דוגמאות לאלקינים פשוטים:
- אתין (אצטילן) ($\ce{C2H2}$)
- פרופין ($\ce{C3H4}$)
- בוטין ($\ce{C4H6}$)
| Acetylene/Ethyne (C₂H₂) |
|---|
 |
| Linear pKa: 25 |
| Terminal hydrogen is acidic due to $sp$ hybridization |
דרגת אי-רוויון
במהלך השיעור הוסבר המושג “דרגת אי-רוויון”, המתייחס למספר הקשרים הכפולים או המשולשים (או טבעות) במולקולה. כל איבוד של שני מימנים מהנוסחה המולקולרית של אלקאן ($\ce{C2H}_{2n+2}$) מקביל לדרגת אי-רוויון אחת, שיכולה להיות מיוצגת על ידי קשר כפול אחד, חצי קשר משולש, או טבעת אחת.
איזומרים
נושא חשוב נוסף שנדון הוא איזומריה - תופעה בה שתי מולקולות או יותר בעלות אותה נוסחה מולקולרית אך מבנה שונה. הוצגו שני סוגים עיקריים של איזומרים:
-
איזומרים מבניים: מולקולות בעלות אותה נוסחה מולקולרית אך סידור שונה של הקשרים בין האטומים.
דוגמה: בוטאן ($\ce{C4H10}$) יכול להיות:

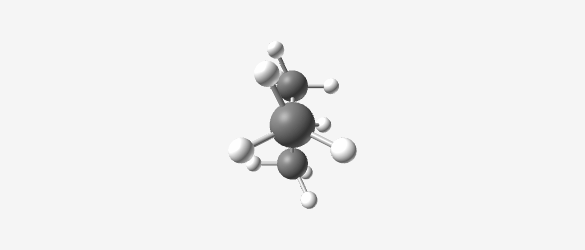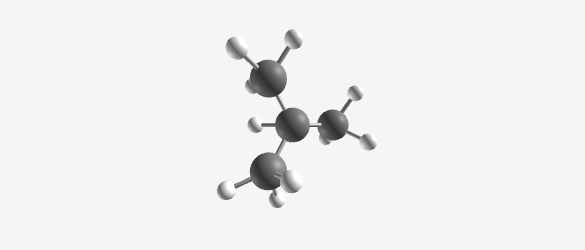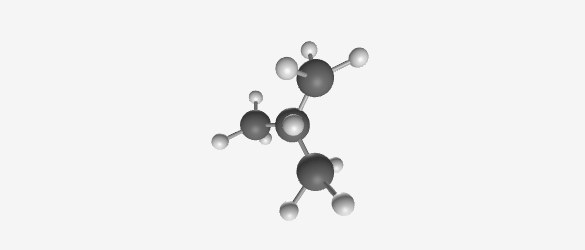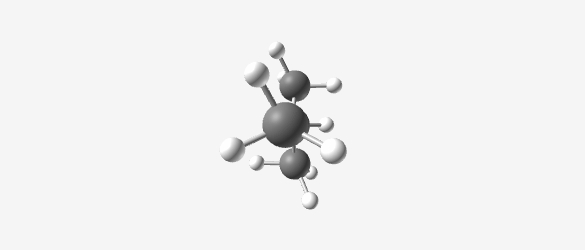
Butane (C₄H₁₀) Isobutane (C₄H₁₀) -
איזומרים מרחביים: מולקולות בעלות אותה נוסחה מולקולרית ואותו סידור קשרים, אך סידור שונה של האטומים במרחב. דוגמה נפוצה היא איזומרים של ציס/טרנס באלקנים.
בשיעור הודגש כי מולקולות שונות, גם אם הן בעלות אותה נוסחה מולקולרית, עשויות להיות בעלות תכונות פיזיקליות וכימיות שונות מאוד, ולכן חשוב להבין ולהבחין ביניהן.
סיכום
הרצאה זו העניקה מבט מעמיק על מספר מושגי יסוד חשובים בכימיה אורגנית:
- ההבנה של מבנה מולקולרי, היברידיזציה וסוגי קשרים היא בסיס להבנת התנהגות מולקולות אורגניות.
- חוזק חומצה ובסיס מושפע ממספר גורמים, כשהעיקריים שבהם הם רזוננס והשפעות אינדוקטיביות.
- זיהוי פרוטונים חומציים הוא מיומנות חיונית להבנת תגובות בכימיה אורגנית.
- סיווג פחמנים והבנת מושג האיזומריה מספקים בסיס להבנת מגוון רחב של תגובות ותכונות של מולקולות אורגניות.
בשיעור הבא יתמקדו בנומנקלטורה בצורה מעמיקה יותר, ויעסקו בקביעת שמות וזיהוי מבנים של תרכובות אורגניות.
דור פסקל