זאת ההרצאה המסכמת של החלק בווירולוגיה. כעת, אחרי שלמדנו את מחזור החיים של הווירוס ואת תגובות התא, אפשר לעשות שני דברים מרכזיים:
- להבין איך מתכננים תרופות אנטי-ויראליות ע”י מיקוד בשלבים שונים במחזור החיים;
- להבין שיש נגיפים/כלים ויראליים שיכולים להיות מועילים, למשל בהנדסה גנטית, בפאג’-תרפיה, ובאונקוליטיק-וירוס.
בסוף חזרנו על המסרים הגדולים של הקורס: וירוסים אמיתיים, משתנים כל הזמן באבולוציה, וכדאי להתחסן.
1) מחזור החיים של וירוס כ”מפת מטרות” לתרופות
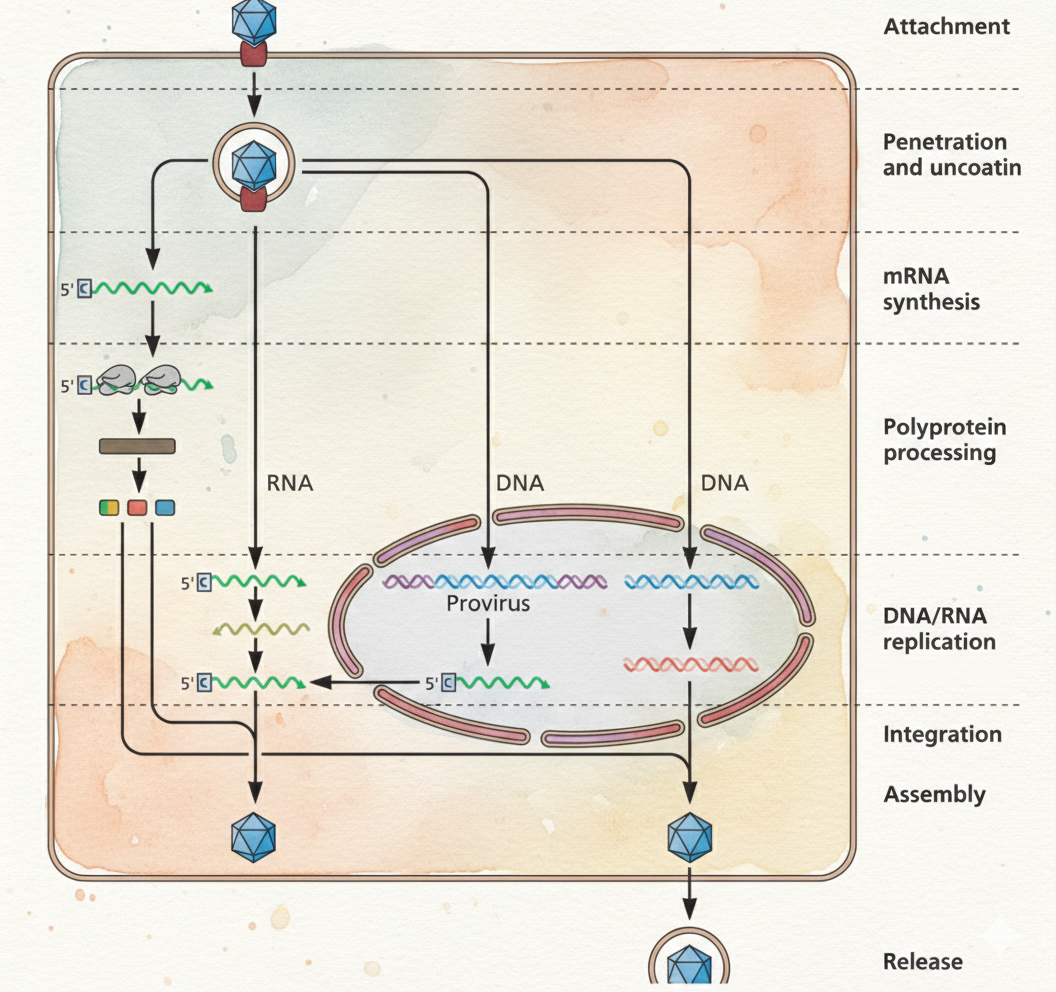
חזרה שלבי ההדבקה שראינו בקורס:
- Attachment (היצמדות)
- Entry (כניסה)
- Uncoating (שחרור הגנום)
- mRNA synthesis (יצירת mRNA)
- Protein synthesis & processing (תרגום ועיבוד חלבונים; כולל פוליפרוטאין ופרוטאז במקרים מסוימים)
- Replication (רפליקציה של הגנום)
- Integration (אינטגרציה - רלוונטי בעיקר לרטרו-וירוסים)
- Assembly & Release (הרכבה ושחרור)
הרעיון: אם עוצרים את הווירוס בכל אחד מהשלבים האלה, הוא כבר לא יוכל להשלים ריבוי, ולכן לא יתפשט.
2) שתי אסטרטגיות למטרה תרופתית: ויראלית מול תאית
הוצגו שתי אפשרויות בסיסיות לתכנון תרופה:
- לכוון למטרה נגיפית (חלבון נגיפי/מרכיב נגיפי).
- לכוון למטרה תאית (חלבון/מנגנון של התא המאחסן שהווירוס תלוי בו).
יתרון/חיסרון במטרה נגיפית
- יתרון: יותר ספציפי לנגיף ← פחות סיכון לפגיעה בתהליכים תאיים ולכן פחות תופעות לוואי.
- חיסרון מרכזי: הווירוס משתנה. בשימוש ממושך/תחת לחץ תרופתי יכולה להתפתח עמידות.
יתרון/חיסרון במטרה תאית
- יתרון: פחות סיכוי לעמידות (לא אפס, אבל נמוך יותר), כי התא פחות “מתחלף” מהר כמו הווירוס.
- חיסרון: יותר סיכון לתופעות לוואי, כי פוגעים במנגנון של התא. המרצה ציין שגם כאן עמידות אפשרית: וירוס יכול אבולוציונית למצוא דרך עקיפה (למשל להשתמש במסלול/קישור חלופי).
| אסטרטגיה | יתרונות | חסרונות |
|---|---|---|
| מטרה נגיפית | ספציפיות גבוהה לנגיף ← פחות תופעות לוואי | סיכון גבוה לעמידות בגלל שינוי וירוס |
| מטרה תאית | פחות סיכון לעמידות (תא פחות משתנה) | יותר סיכון לתופעות לוואי (פגיעה בתא) |
3) למה בדרך כלל מכוונים לאנזימים ולא לחלבוני קפסיד
המרצה שאל מה עדיף כמטרה: אנזימים או חלבונים מבניים (קפסיד), והדגיש שאנזימים לרוב עדיפים:
- לאנזימים יש אתר פעיל - נוח לעיכוב (אם עיכבת את האתר הפעיל, עצרת פונקציה קריטית).
- חלבוני קפסיד נמצאים בכמויות מאוד גדולות. לכן גם אם יש מעכב, צריך כמויות גדולות מאוד כדי “לכסות” מספיק מהם. בנוסף לכך, אם עיכבת רק חלק מהקפסיד (המרצה נתן דוגמה של 20%~), זה לא בהכרח יעצור את ההרכבה.
חזר בשאלה לדוגמה בסוף השיעור: מי לא מטרה (target) טוב? - קפסיד.
4) איך בונים Screen יעיל לפני שסורקים 200,000 תרכובות
לא מתחילים ישר עם הדבקות וניסויי תרבית ענקיים לכל תרכובת, אלא קודם, בונים סקרין שנותן Readout מהיר.
דוגמת פוליו-וירוס: פרוטאז כטארגט וסקרין פלואורסצנטי
המרצה חזר לפוליו-וירוס כוירוס +RNA שמייצר פוליפרוטאין. בגלל שפוליפרוטאין חייב להיחתך כדי ליצור חלבונים פעילים, הפרוטאז חיוני.
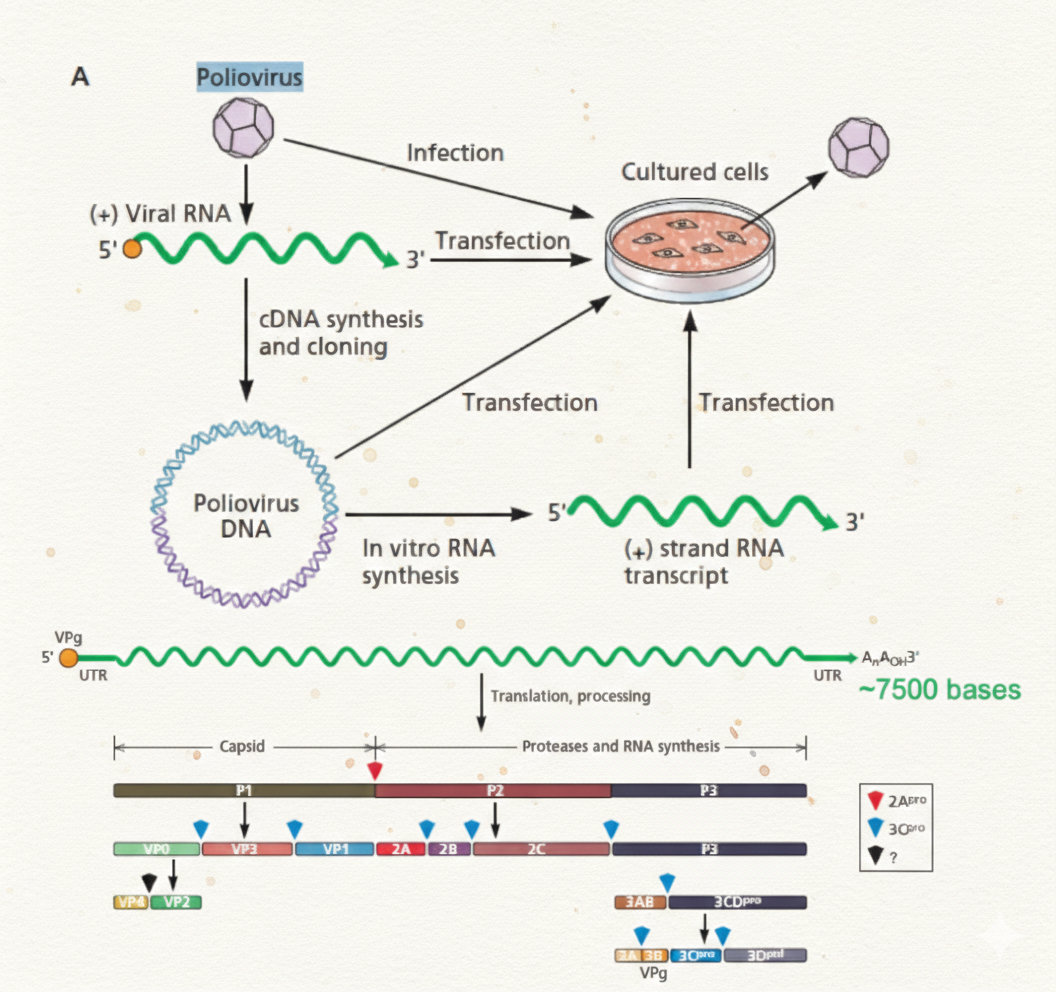
השלבים לבניית סקרין:
- משחזרים/משכפלים את הגנום כקלון בפלסמיד כדי לאפשר מוטציות וסריקה של חיוניות חלבונים (איזה מוטציות משביתות רפליקציה).
- מזהים רצף חיתוך שהפרוטאז מזהה (הוא ציין רצף ספציפי שהפרוטאז מזהה וחותך).
- בונים assay:
- מחברים פלואורופור לפפטיד שמכיל את רצף החיתוך, ומחברים אותו ל-bead.
- כל עוד הפלואורופור קשור ל-bead והוא שוקע - אין אור בתמיסה.
- אם הפרוטאז חותך - הפלואורופור משתחרר לתמיסה ← יש אור.
- אם שמים מעכב פרוטאז - פחות חיתוך ← פחות אור.
- כך אפשר לעשות המון בארות במקביל: בכל באר תרכובת אחרת, ולפי האות הפלואורסצנטי מוצאים מועמדים.
דגש עקרוני: בתרופות אנטי-ויראליות לרוב מכוונים לנגיף ספציפי, לא “תרופה כללית לכל וירוס”.
דוגמת “סלקציה” בחיידקים למציאת מעכבי HIV פרוטאז
דוגמה נוספת של סקרין עקיף:
- יש חלבון ממברנלי שמקנה עמידות לטטרציקלין בחיידקים.
- מכניסים בלולאה תוך-תאית שלו רצף חיתוך שמוכר ע”י HIV פרוטאז.
- אם HIV פרוטאז פעיל - הוא חותך ← החלבון לעמידות נהרס ← החיידקים לא גדלים בנוכחות טטרציקלין.
- אם מוסיפים מעכב HIV פרוטאז - אין חיתוך ← החלבון נשאר שלם ← החיידקים גדלים. כאן ה-readout הוא פשוט “יש/אין גדילה”, סלקציה חזקה.
העמידות לטטרציקלין במקרה הזה היא רק כלי ניסויי (לא קשורה ישירות לתרופה הסופית), כדי להפעיל מערכת סלקציה פשוטה.
5) גישה מבנית: תכנון תרופה לפי מבנה חלבון
מעבר לסקרינים, קיימת תיאר גישה נוספת:
- לזהות את המבנה התלת-ממדי של החלבון (קריסטלוגרפיה או כיום גם חיזוי/כלים כמו AlphaFold),
- למצוא כיס פעיל,
- לתכנן מולקולה שנכנסת לכיס ומעכבת (הוא תיאר זאת “כמו סובסטרט” שנקשר אבל נתקע ולא מאפשר המשך פעילות).
אחרי שמוצאים “Hit” ראשוני, תמיד ממשיכים אופטימיזציה: פעילות בריכוזים נמוכים יותר, יציבות גבוהה יותר בתאים, ועוד.
6) ריכוז תרופה ועמידות: למה מינון לא אופטימלי מסוכן
הסיכון לעמידות עולה כאשר הריכוז לא אופטימלי:
- בריכוז אופטימלי: הווירוס נעצר מוקדם ולא מתרבה ← סיכוי נמוך מאוד להופעת זנים עמידים.
- בריכוז נמוך מדי: חלק מהווירוסים “שורדים” ומתרבים בנוכחות התרופה ← נוצרת סלקציה לזנים עמידים, ובהמשך העמידים משתלטים.
מדובר בנושא נפרד מהנושא של “משך טיפול”: כאן הדגש היה כמות/מינון של המעכב.
כדי להקטין עמידות בנגיפים משתנים במיוחד, משתמשים לעיתים בקוקטייל של כמה מעכבים במקביל, כדי שהנגיף יצטרך לפתח עמידות בכמה מטרות שונות בבת אחת.
7) דוגמאות קונקרטיות לתרופות לפי שלב במחזור חיים
(א) עיכוב Attachment ב-HIV
נזכיר את התיאור של HIV:
- gp120 (חלבון נגיפי) נקשר ל-CD4 ואז לרצפטור משני (הוזכר CCR5).
- הוזכר מעכב שמפריע לקישור לרצפטור המשני.
(ב) עיכוב Uncoating באינפלואנזה A דרך M2
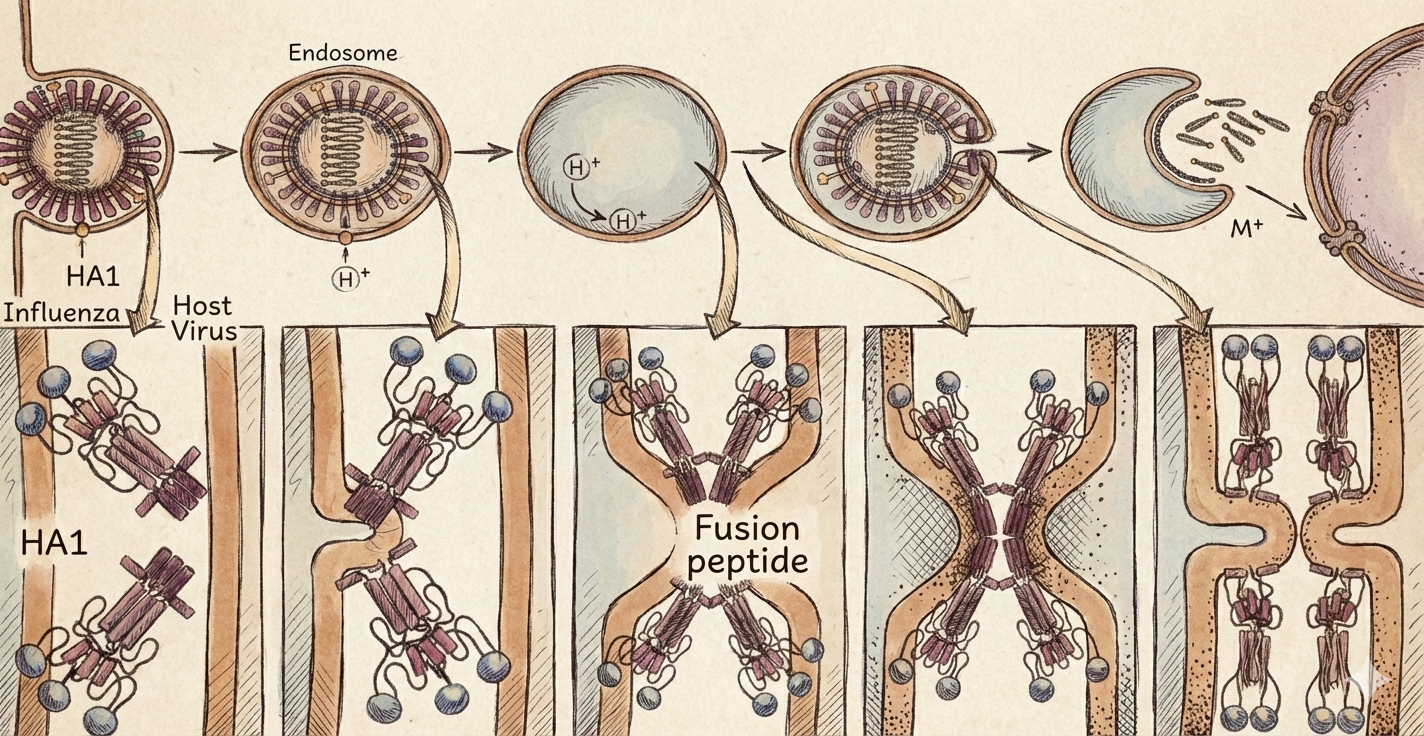
האיור ממחיש את המנגנון המולקולרי המדויק שמתואר בטקסט לגבי חדירת נגיף השפעת (Influenza) לתא:
- שלב ה-Entry והאנדוזום: באיור רואים את הנגיף נכנס אל התא בתוך שלפוחית (Endosome). בטקסט מצוין: “הווירוס נכנס באנדוציטוזה”.
- ירידת ה-pH (כניסת פרוטונים ): באיור מופיעים סימוני שנכנסים לתוך האנדוזום ולאחר מכן לתוך חלקיק הנגיף עצמו. הטקסט מסביר: “ה-pH באנדוזום יורד… חלבון M2 הוא תעלת יונים שמכניסה פרוטונים”.
- שינוי קונפורמציה ב-HA (המולין): החלק התחתון של האיור מציג תקריב של חלבון ה-HA (המחולק ל-HA1 ופפטיד פיוז’ן). ניתן לראות כיצד החלבון “נפתח” ומשנה את צורתו בעקבות החומציות כדי לאפשר את איחוי הממברנות (Fusion).
- שחרור הגנום (Uncoating): בשלב האחרון באיור (צד ימין למעלה), רואים את הממברנות מתאחות ואת המקטעים הגנטיים של הווירוס משתחררים לתוך הציטופלזמה. בטקסט נכתב: “החמצה גורמת לשחרור קומפלקסים/גנום (uncoating)”.
למה זה חשוב מבחינה תרופתית?
כפי שמוסבר בסעיף 7 בסיכום, האיור הזה הוא ה”מפה” להבנת הפעילות של תרופות כמו אמנטדין (Amantadine). התרופה חוסמת את תעלת ה-M2 (החצים של ה- באיור), מונעת את החמצת פנים הנגיף, ובכך עוצרת את כל התהליך שרואים באיור – הנגיף נשאר “כלוא” ולא יכול לשחרר את הגנום שלו.
באינפלואנזה (Influenza):
- הווירוס נכנס באנדוציטוזה, ה-pH באנדוזום יורד וזה קריטי ל-fusion.
- חלבון M2 הוא תעלת יונים שמכניסה פרוטונים, והחמצה גורמת לשחרור קומפלקסים/גנום (uncoating) כדי שיגיעו לגרעין.
- אם חוסמים את M2 (למשל אמנטדין): אין כניסת פרוטונים ← אין uncoating ← אין הדבקה.
הערות:
- התרופה הזאת קיימת שנים, יעילה מול אינפלואנזה A.
- אינפלואנזה B “אסטרטגיה אחרת” ולכן לא אותו עיכוב.
- בגלל שימוש ממושך, קיימת גם עמידות.
- לא מפזרים/לא נותנים לכל אחד כדי לא להגביר עמידות; נותנים בעיקר במקרים קשים כדי להקל ולקצר מחלה.
יש גם להבדיל בין תרופה לבין חיסון: חיסון לא דורש להבין מנגנונים, אלא חושף חלבון מעטפת כדי שמערכת החיסון תייצר נוגדנים לעתיד.
(ג) Prodrug: אציקלוביר והרפס סימפלקס
נסביר את מושג ה-Prodrug דרך אציקלוביר:
- נוקלאוזיד = בלי פוספט; נוקלאוטיד = עם פוספט.
- בהרפס סימפלקס יש Thymidine kinase ויראלי שמסוגל לבצע פוספורילציה ראשונית.
- התאים לבד לא מבצעים את הזרחון הראשון באותה תרופה ← לכן התרופה “מופעלת” בעיקר בתאים שבהם הווירוס נמצא במצב ליטי ומבטא TK.
- אחרי הפוספורילציה הראשונה, אנזימי התא יכולים להשלים לשני/שלישי ← מתקבל נוקלאוטיד פעיל שמעכב פולימראז של הרפס ולכן רפליקציה. המרצה הוסיף שימוש רעיוני נוסף: אם מכריחים תא סרטני לבטא TK, אפשר להפוך את זה לכלי שממית תאים מסוימים (הוא הזכיר שמשתמשים בזה גם בהקשרים אנטי-סרטניים/אונקוליטיים בהמשך).
(ד) נוקלאוטידים אנלוגיים ועיכוב רפליקציה
המרצה חזר על עיקרון רחב: רפליקציה היא שלב קריטי ולכן הרבה תרופות מכוונות ל-פולימראז/RT. הוא הסביר שווירוסים “פחות בררנים” (הוא השתמש במושג פרומיסקואס) ולכן לפעמים משלבים נוקלאוטידים “לא מושלמים” שמכניסים שגיאה/עוצרים הארכה. הוא הדגיש את העיקרון של חוסר OH בעמדה 3’ ← chain termination (אי אפשר להאריך).
8) למה אין “תרופה אחת לכל הווירוסים”, אבל יש לפעמים לקבוצות
המרצה הדגיש שברוב המקרים אין תרופה כללית לכל הווירוסים כי לכל וירוס חלבונים ואסטרטגיות שונים. עם זאת, הוא ציין שכן קיימות תרופות שיכולות לעבוד על קבוצה של וירוסים דומים אם אנזים מרכזי (כמו פולימראז/פרוטאז) שמור יחסית.
9) שימושים “מועילים” בנגיפים
(א) וקטורים ל-Gene therapy וביטוי ממושך
המרצה השווה:
- טרנספקציה בפלסמיד: ביטוי זמני (כמה ימים) ואז הפלסמיד הולך לאיבוד.
- רטרו/לנטי-וירוס: נכנס דרך אינטגרציה ל-DNA ← ביטוי ארוך טווח.
אבל הוא הדגיש בעיה קשה בג’ין-תרפיה עם רטרו-וירוסים: אינטגרציה ליד אונקוגן עלולה לגרום בהמשך ללוקמיה; מספיק אירוע נדיר בתא אחד מתוך מיליונים כדי שבמשך שנים התא ישגשג ויהפוך לסרטן.
לכן עוברים יותר ל-AAV (וירוס קטן, ssDNA), שבדרך כלל לא עושה אינטגרציה; ואם יש אינטגרציה - זה באזור ספציפי רחוק מגנים, ולכן נחשב בטוח יותר יחסית.
(ב) Phage therapy (בקטריופאג’ים) לטיפול בזיהומי חיידקים
בקטריופאג’ים הם וירוסים שמדביקים חיידקים. המרצה תיאר את הרעיון של פאג’-תרפיה:
- פאג’ים מדביקים חיידקים ספציפיים והורגים אותם, בניגוד לאנטיביוטיקה שמחסלת גם חיידקים טובים.
- אפשר להשתמש בזה גם כדי להשפיע על המיקרוביום: להפחית חיידקים “רעים” בלי לפגוע בשאר.
יש כבר טיפולים וניסויים קליניים, שמאפשרים מתן פאג’ים במגוון דרכים:
- קפסולה דרך הפה, אינהלציה, טיפות עיניים, זריקה לשריר/לאזור נגוע/לדם, או מריחה על פצע.
איך מוצאים פאג’ לחולה ספציפי (גישה פרסונלית)
המרצה תיאר תהליך:
- לוקחים מהחולה את החיידק הפתוגני ומגדלים תרבית.
- מחפשים פאג’ים שיכולים להרוג אותו - ממאגר/סטוקים, וגם ממקור עשיר כמו ביוב (שם יש מגוון פאג’ים גדול).
- עושים מבחן פלאקים: יוצרים שכבת חיידקים (monolayer), מוסיפים פאג’ים, מזהים פלאק (אזור הרג).
- מבודדים את הפאג’ מהפלאק, מרבים אותו, ואז משתמשים לטיפול.
המרצה הדגיש שזה כיום חסם כי זה לוקח זמן, ולכן מתאים במיוחד לזיהומים כרוניים (כמו פצעים כרוניים) ולא למצבי חירום אקוטיים.
יתרונות וחסרונות של Phage therapy
יתרונות:
- ספציפיים לזנים מסוימים, לא פוגעים בשאר החיידקים הטובים.
- מתרבים רק על המאחסן: כשנגמרים החיידקים - הפאג’ים מפסיקים להתרבות ונעלמים.
- עמידות יכולה להתרחש, אבל הוצגה כסיכוי יחסית נמוך.
חסרונות/דאגות:
- זמן אפיון החיידק ומציאת/הנדסת הפאג’ מתאים.
- פאג’ים (במיוחד ליזוגניים) עלולים לשאת/להעביר גנים, כולל כאלה שמקנים עמידות לאנטיביוטיקה. המרצה אמר שאחד הפתרונות הוא ריצוף של הפאג’ שנבחר כדי לוודא שאין גנים בעייתיים, למרות שזה מוסיף זמן.
- אם הורגים חיידקים בתוך הדם, החיידקים מתפרקים/”מתפוצצים” ומשחררים תכולה שעלולה לגרום לתגובה מערכתית קשה (המרצה הזכיר חשש להלם).
- שימוש חוזר יכול ליצור תגובה חיסונית נגד הפאג’ים עצמם.
פתרון שהוזכר: להשתמש רק בחלבונים שהפאג’ים מייצרים לפירוק דופן החיידק (אנזימים שמפרקים פפטידוגליקן) במקום בכל הפאג’.
המרצה גם הזכיר טכנולוגיה חדשה (מאמר “מהשנה”) שבה משתמשים בבקטריופאג’ כדי להכניס גן ש”מרפא” בתוך המעי ע”י הדבקת חיידקים וגרימה לביטוי גן ספציפי - אבל הדגיש שזה כבר נכנס להנדסה מולקולרית.
10) וירוסים אונקוליטיים (Oncolytic viruses) - וירוסים שמחסלים סרטן
המרצה הסביר את האתגר: סרטן הוא “התאים שלנו” שעברו שינוי, ולכן קשה להבדיל. כימותרפיה רגילה פוגעת בכל תא מתחלק ולכן יש תופעות לוואי (עור, ריריות, שיער וכו’). האונקוליטיק-וירוס נועד להיות ספציפי לתאים סרטניים.
עיקרון הספציפיות
- ספציפיות בשלב הכניסה: הווירוס דורש רצפטור. אם גידול מבטא אנטיגן/חלבון ייחודי, אפשר לכוון אליו. המרצה נתן דוגמה לפרוסטט: PSA.
- ספציפיות אחרי כניסה (פרמיסיביות): גם אם הווירוס נכנס, הוא לא תמיד יכול להתרבות בכל תא. אפשר לנצל את זה כדי שיתרבה בעיקר בתאים סרטניים.
- אם הווירוס מתרבה בתא הסרטני ← הוא גורם ל-lysis ← משתחררים וירוסים חדשים שמדביקים עוד תאי סרטן.
דוגמת אדנו-וירוס עם deletion של E1B (מנצל p53)
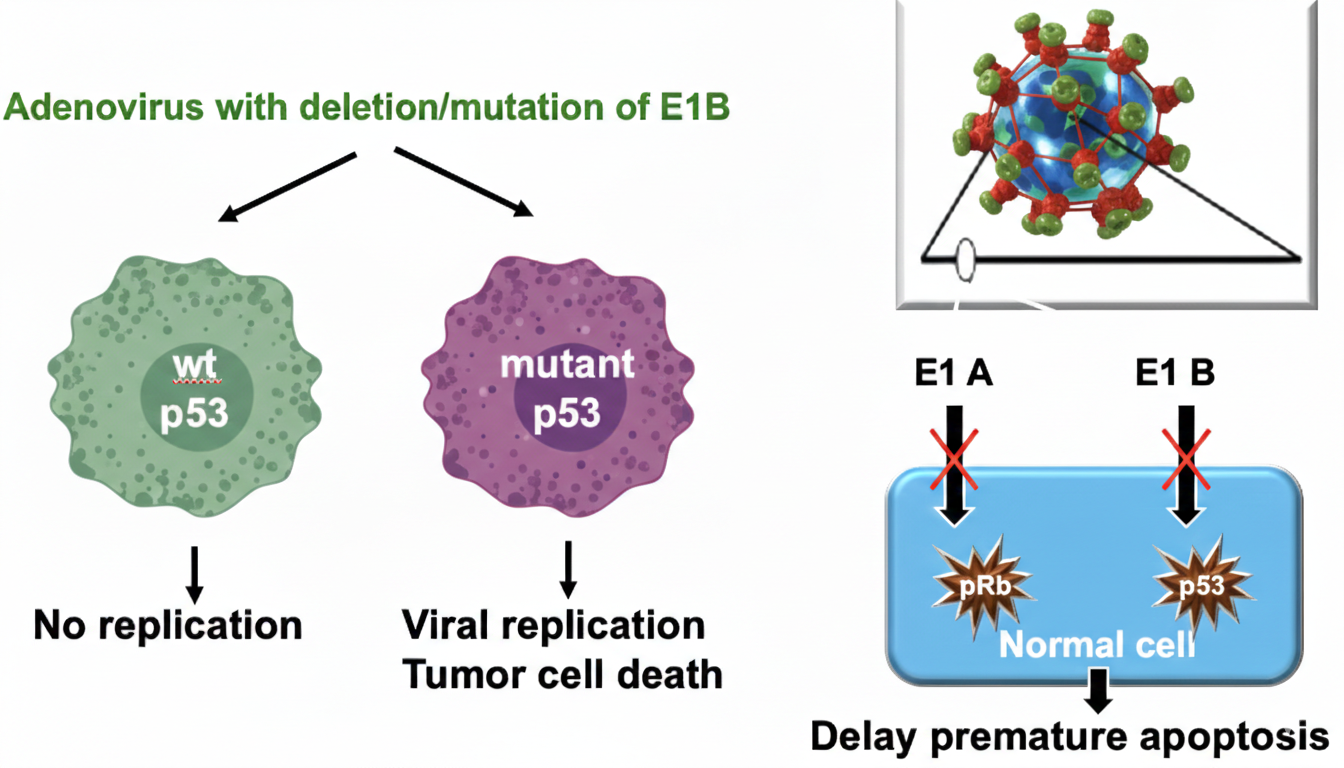
המרצה תיאר:
- לאדנו-וירוס יש גנים שדוחפים תא להתחלק (E1A), ואז התא מגיב עם p53 שעוצר חלוקה/משרה מוות כדי להגן על הגנום.
- לוירוס יש E1B שמדכא p53 כדי לאפשר רפליקציה.
- אם עושים דלישן ל-E1B:
- בתא נורמלי: p53 פעיל ← עוצר את הווירוס ← הווירוס לא מתרבה.
- בתא סרטני שבו p53 פגום/מוטנטי (המרצה ציין שכ~50% מהסרטנים): אין בלם ← הווירוס מתרבה והורג את התא הסרטני.
לפי ההרצאה, טיפול כזה מאושר במדינות מסוימות, אבל לרוב לא עובד “מאה אחוז”, ולכן הכיוון כיום הוא שילובים (אונקוליטיק + טיפולים אחרים).
נקודה פרקטית מניסויים: בסין אישרו מוקדם טיפולים כאלה; בארה”ב לעיתים מפסיקים ניסויים עם עליית חום, בעוד שבגישה שתיאר בסין לא בהכרח מפסיקים - והמרצה אמר שחום יכול להיות “טוב” כי הוא מעיד על הפעלת מערכת החיסון, שהיא חלק מהאפקט נגד הגידול.
טבעיים מול מהונדסים
יש שני סוגים עיקריים של וירוסים אונקוליטיים (Oncolytic Viruses):
- וירוסים טבעיים שמעדיפים תאים סרטניים בלי הנדסה (דוגמאות כלליות שהביא).
- וירוסים מהונדסים (למשל אדנו, HSV) שמסירים מהם גנים מסוימים כדי להחליש פתוגניות ולהגביר ספציפיות.
דוגמות לשימושים/אישורים
- “Rigvir” (לטביה): אנטרו-וירוס שמצאו שמעדיף להרוג תאים סרטניים; אושר בלטביה (2004), בגאורגיה (2015), ובארמניה (2016).
- אדנו-וירוס עם דלישן: אושר בסין (המרצה תיאר למה תהליך האישור שונה בין ארה”ב לסין).
- הרפס סימפלקס אונקוליטי: המרצה אמר שאושר ע”י ה-FDA “לפני כמה שנים” לטיפול בסרטן (ועדיין לא שגרתי/בסל, אך צפוי להתרחב בעתיד).
איך מהנדסים HSV להיות אונקוליטי
כמה דוגמאות לשינויים:
- מחיקות שמקטינות טוקסיות/יכולת רפליקציה בתאים נורמליים/נוירונים.
- מחיקה של מנגנוני התחמקות חיסונית (כדי שהמערכת החיסונית “תראה” את ההדבקה).
- הוספת גן אנושי שמושך מערכת חיסון, GM-CSF, כדי לחזק תגובה נגד הטומור.
11) מסרים מסכמים של הקורס
- וירוסים קיימים - והמרצה אמר שהוא מקווה שהקורס שכנע גם את מי שצחק בתחילת הקורס על “אי אפשר לראות וירוס”.
- כדאי להתחסן.
- וירוסים לא “חושבים” - הם פועלים לפי אבולוציה דרוויניסטית: מוטציות + סלקציה. המרצה נתן דוגמה מקורונה: בתחילה זן שגרם מחלה קשה יותר ופחות מדבק; בהמשך עבר אבולוציה לכיוון מדבק יותר ומחלה קלה יותר.
- המטרה בקורס הייתה להבין מנגנונים מולקולריים של וירוסים, לא להעמיס מחלות ספציפיות (את המחלות תלמדו בהמשך בקורסים הקליניים).