מבנה ותכונות של חומצות קרבוקסיליות
המבנה הכימי והקיטוב המולקולרי
חומצה קרבוקסילית מוגדרת כתרכובת אורגנית המכילה קבוצת קרבוקסיל ($\ce{-COOH}$), המורכבת מפחמן קרבונילי ($\ce{C=O}$) הקשור לקבוצת הידרוקסיל ($\ce{-OH}$). המבנה הכללי של חומצה קרבוקסילית הוא $\ce{R-COOH}$, כאשר $\ce{R}$ יכול להיות מימן (במקרה של חומצה פורמית, $\ce{HCOOH}$) או שרשרת אלקילית כלשהי.
החומצה הקרבוקסילית היא מולקולה פולרית במיוחד, תכונה הנובעת משני גורמים עיקריים. ראשית, הקשר הקרבונילי עצמו הוא פולרי, כאשר הפחמן נושא מטען חלקי חיובי ($\delta^+$) והחמצן נושא מטען חלקי שלילי ($\delta^-$). שנית, קבוצת ההידרוקסיל תורמת לפולריות נוספת, כאשר החמצן מושך אלקטרונים מהמימן, ומעניק לו אופי חומצי יחסי.
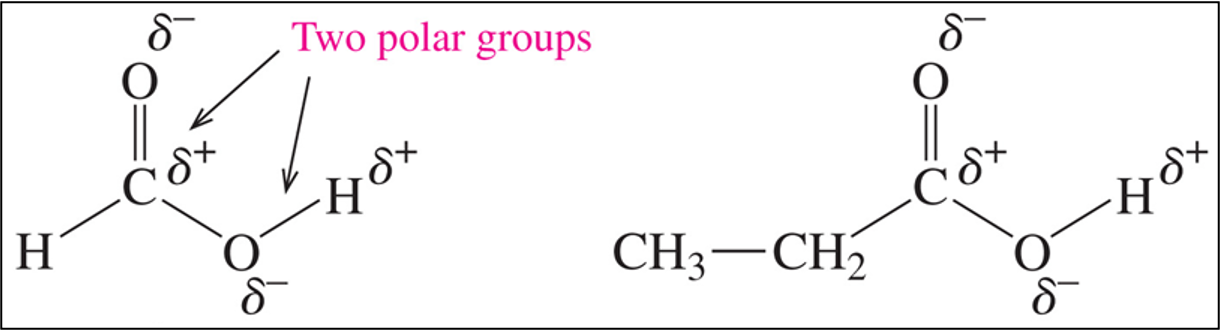
הפחמן הקרבונילי בחומצה קרבוקסילית מאופיין בהיברידיזציה $sp^2$, היוצרת מבנה מישורי עם זוויות קשר של $120°$ סביב הפחמן המרכזי. מבנה זה מאפשר התקפות נוקליאופיליות על הפחמן הקרבונילי האלקטרופילי.
מבנים רזונטיביים
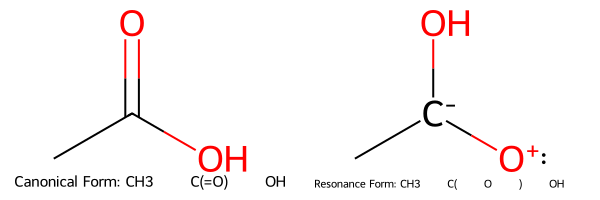
למרות שהמבנה הבסיסי של חומצה קרבוקסילית מתואר בדרך כלל כ-$\ce{R-C(=O)-OH}$, קיימת תרומה משמעותית של מבנה רזונטיבי נוסף. במבנה רזונטיבי זה, זוג אלקטרונים בלתי קושר מהחמצן ההידרוקסילי נתרם ליצירת קשר כפול עם הפחמן, בעוד שהקשר הכפול הקרבונילי המקורי הופך לזוג אלקטרונים בלתי קושר על החמצן הקרבונילי:
\[\ce{R-C(=O)-OH <-> R-C(^-O)-OH^+}\]מבנה רזונטיבי זה, אף שהוא פחות יציב מהמבנה הבסיסי בשל הפרדת המטענים, תורם לייצוב הכללי של המולקולה ומשפיע על התכונות הכימיות שלה.
קשרי מימן וכוחות בין-מולקולריים
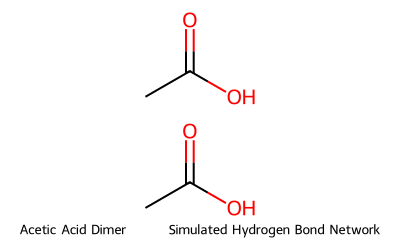
חומצות קרבוקסיליות יוצרות קשרי מימן חזקים במיוחד, בתבנית דימרית ייחודית. בתבנית זו, החמצן הקרבונילי של מולקולה אחת יוצר קשר מימני עם המימן ההידרוקסילי של מולקולה שנייה, ובמקביל מתרחש התהליך ההפוך. כתוצאה מכך נוצרת מסגרת טבעתית מחזורית בעלת שמונה איברים:
\[\ce{R-C(=O)-OH...O=C-R}\] \[\ce{|\_\_\_\_\_\_\_\_\_\_\_\_\_\_\_|}\] \[\ce{H-O...H}\]מבנה דימרי זה יוצר קשרי מימן חזקים יותר מאלו הנוצרים בכוהלים, מה שמסביר מדוע לחומצות קרבוקסיליות נקודות רתיחה והיתוך גבוהות משמעותית מכוהלים בעלי מסה מולרית דומה. לדוגמה, חומצה אצטית ($\ce{CH3COOH}$) רותחת ב-$118°C$, בעוד אתנול ($\ce{CH3CH2OH}$) רותח ב-$78°C$ בלבד.
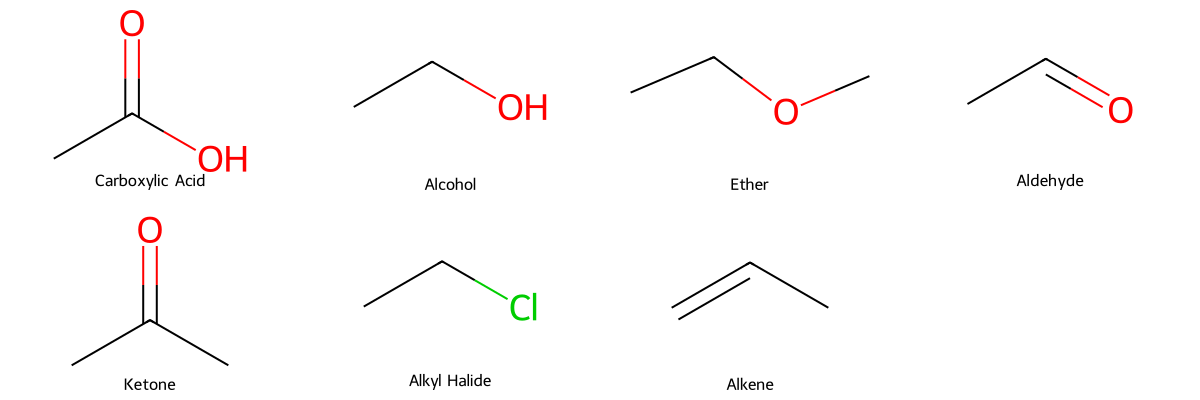
בהשוואה לקבוצות פונקציונליות אחרות, סדר החוזק של הכוחות הבין-מולקולריים הוא (מהחזק לחלש):
- חומצות קרבוקסיליות
- כוהלים
- אתרים ≈ אלדהידים ≈ קטונים
- אלקיל הלידים
- אלקאנים
מסיסות במים
המסיסות של חומצות קרבוקסיליות במים תלויה באופן משמעותי באורך השרשרת הפחמנית ($\ce{R}$). קבוצת הקרבוקסיל ההידרופילית מסוגלת ליצור קשרי מימן עם מולקולות המים, בעוד שהשרשרת הפחמנית ההידרופובית נוטה להפחית את המסיסות.
באופן כללי, חומצות קרבוקסיליות מסיסות במים עם שרשרת של עד ארבעה פחמנים ($\ce{C1-C4}$). החל מחמישה אטומי פחמן, המסיסות יורדת משמעותית, וחומצות עם שרשראות ארוכות יותר כמעט ואינן מסיסות במים.
החומציות של חומצות קרבוקסיליות
השוואה לכוהלים ומנגנון החומציות
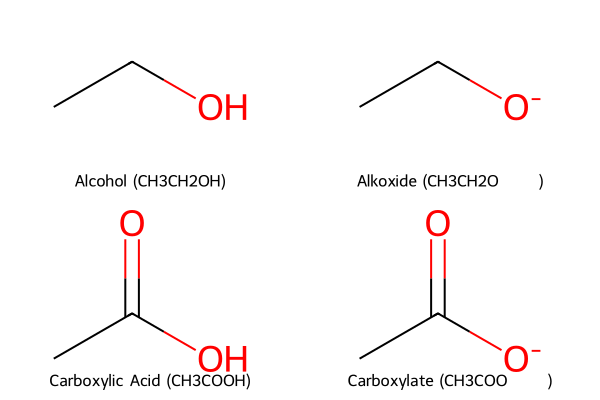
החומציות של חומצות קרבוקסיליות גבוהה משמעותית מזו של כוהלים. בעוד שה-$pK_a$ של כוהלים טיפוסיים נע סביב 16, ה-$pK_a$ של חומצות קרבוקסיליות נע בטווח של 5-3. ההבדל של יותר מעשרה סדרי גודל נובע מהיציבות היחסית של הבסיסים המצומדים.
כאשר כוהל מאבד פרוטון, נוצר אניון אלקוקסיד ($\ce{RO^-}$) שבו המטען השלילי ממוקם על אטום חמצן בודד:
\[\ce{R-OH + B^- <=> R-O^- + BH}\]לעומת זאת, כאשר חומצה קרבוקסילית מאבדת פרוטון, נוצר אניון קרבוקסילט המיוצב על ידי רזוננס:
\[\ce{R-COOH + B^- -> R-COO^- + BH}\]באניון הקרבוקסילט, המטען השלילי מפוזר באופן שווה בין שני אטומי החמצן באמצעות רזוננס:
\[\ce{R-C(=O)-O^- <-> R-C(-O^-)-O}\]פיזור המטען הזה מייצב משמעותית את האניון ומוריד את האנרגיה שלו, מה שהופך את תהליך הדיסוציאציה לחומצה למועדף יותר תרמודינמית.
השפעת מתמירים על החומציות - האפקט האינדוקטיבי
נוכחות של קבוצות מושכות אלקטרונים בשרשרת הפחמנית, במיוחד בעמדת אלפא לקבוצת הקרבוקסיל, משפיעה דרמטית על החומציות. האפקט האינדוקטיבי פועל דרך קשרי סיגמא ומתפשט עד למרחק של כארבעה קשרים מהמרכז הטעון.
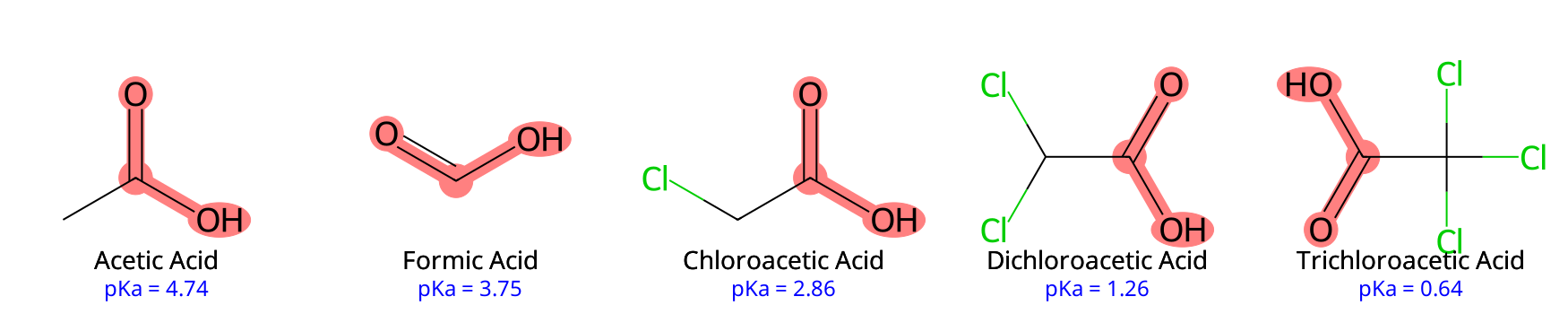
דוגמה בולטת היא סדרת החומצות הכלורואצטיות:
- חומצה אצטית ($\ce{CH3COOH}$): $pK_a = 4.74$
- חומצה כלורואצטית ($\ce{ClCH2COOH}$): $pK_a = 2.86$
- חומצה דיכלורואצטית ($\ce{Cl2CHCOOH}$): $pK_a = 1.26$
- חומצה טריכלורואצטית ($\ce{Cl3CCOOH}$): $pK_a = 0.64$
כל אטום כלור נוסף מושך צפיפות אלקטרונית דרך הקשרים, מייצב את האניון הקרבוקסילט הנוצר, ובכך מגביר את החומציות. חומצה טריכלורואצטית נחשבת כבר לחומצה חזקה.
באופן הפוך, קבוצות דוחפות אלקטרונים כמו קבוצות אלקיל מפחיתות את החומציות. לכן חומצה פורמית ($\ce{HCOOH}$, $pK_a = 3.75$) חומצית יותר מחומצה אצטית ($\ce{CH3COOH}$, $pK_a = 4.74$), שכן קבוצת המתיל דוחפת אלקטרונים ומפחיתה את יציבות האניון הקרבוקסילט.
מיקום החומצות הקרבוקסיליות בסולם החומציות
בהשוואה לחומרים אחרים, חומצות קרבוקסיליות ממוקמות בטווח הביניים של סולם החומציות:
- חזקות מ: מתאן ($pK_a \approx 50$), אמינים ($pK_a \approx 35$), אלקינים ($pK_a \approx 25$), כוהלים ($pK_a \approx 16$), מים ($pK_a = 15.7$)
- חלשות מ: חומצה פחמתית ($\ce{H2CO3}$, $pK_a \approx 6.4$), חומצה הידרופלואורית ($\ce{HF}$, $pK_a \approx 3$), חומצות מינרליות חזקות ($pK_a < 0$)
סינתזה של חומצות קרבוקסיליות
אוזונליזה של אלקן (הופיע בתרגול)
בתנאים מחמצנים.
חמצון של כוהלים ראשוניים
השיטה הקלאסית להכנת חומצות קרבוקסיליות היא חמצון מלא של כוהלים ראשוניים. בתגובה זו משתמשים בחומרי חמצון חזקים כמו אשלגן דיכרומט ($\ce{K2Cr2O7}$) או חומצה כרומית ($\ce{H2CrO4}$) בתנאים חומציים:
\[\ce{R-CH2OH ->[K2Cr2O7/H+] R-CHO ->[K2Cr2O7/H+] R-COOH}\]החמצון מתרחש בשני שלבים: תחילה הכוהל הראשוני מתחמצן לאלדהיד, ולאחר מכן האלדהיד ממשיך להתחמצן לחומצה קרבוקסילית. חשוב לציין שבתנאים של חומרי חמצון חזקים לא ניתן לעצור את התגובה בשלב האלדהיד.
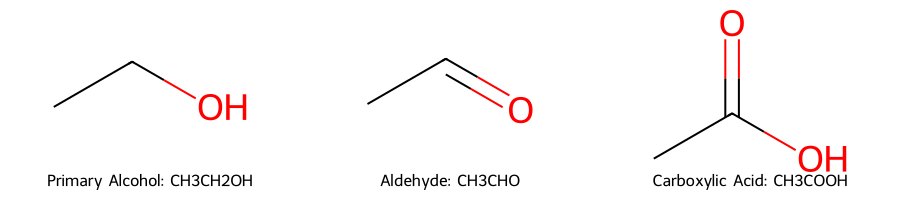
אם רוצים לעצור את התגובה בשלב האלדהיד, יש להשתמש בחמצון עדין יותר כמו $\ce{PCC}$ (פירידיניום כלורוכרומט):
\[\ce{R-CH2OH ->[PCC] R-CHO}\]קרבוקסילציה של ריאגנטי גריניאר
שיטה סינתטית חשובה נוספת היא תגובה של ריאגנטי גריניאר עם פחמן דו-חמצני. ריאגנט גריניאר ($\ce{RMgX}$) מוכן מאלקיל הליד ומגנזיום מתכתי בממס אתרי אנהידרי:
\[\ce{R-X + Mg ->[ether] R-MgX}\]הפחמן בריאגנט גריניאר נושא אופי נוקליאופילי חזק ותוקף את הפחמן האלקטרופילי של $\ce{CO2}$:
\[\ce{R-MgX + CO2 -> R-COO^-MgX^+}\]לאחר הוספת חומצה מימית, מתקבלת החומצה הקרבוקסילית:
\[\ce{R-COO^-MgX^+ ->[H3O+] R-COOH}\]באמצע מתקבל קרבוקסילט שהוא הבסיס המצומד של חומצה קרבוקסילית, אך הוא אינו יציב במצב חופשי ולכן לא ניתן לבודדו.
קרבוקסילציה של ריאגנטי גריניאר מאפשרת הארכת שרשרת פחמנית באטום פחמן אחד תוך יצירת קבוצה פונקציונלית של חומצה קרבוקסילית.
נגזרות של חומצות קרבוקסיליות
סקירת הנגזרות העיקריות
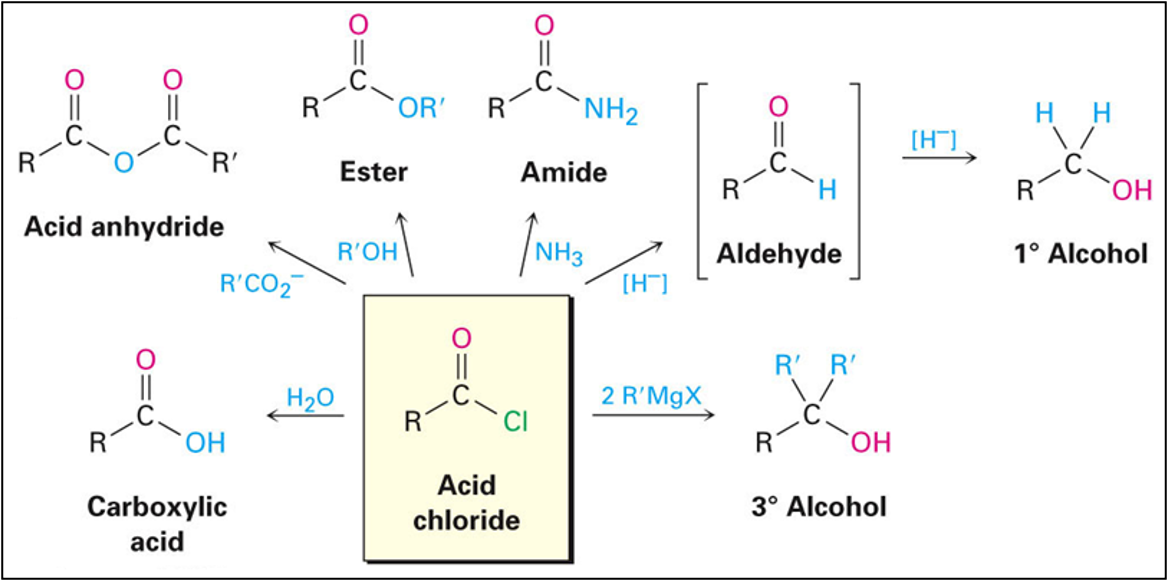
חומצות קרבוקסיליות יכולות להמיר למגוון נגזרות חשובות, כאשר בכולן קבוצת ההידרוקסיל מוחלפת בקבוצה אחרת:
- אציל הלידים (acid chloride) ($\ce{R-CO-X}$): החלפת $\ce{-OH}$ בהלוגן (בעיקר $\ce{Cl}$)
- אנהידרידים ($\ce{R-CO-O-CO-R’}$): החלפת $\ce{-OH}$ בקבוצת אציל אוקסי
- אסטרים ($\ce{R-CO-OR’}$): החלפת $\ce{-OH}$ בקבוצת אלקוקסי ($\ce{-OR’}$)
- אמידים ($\ce{R-CO-NR’R’’}$): החלפת $\ce{-OH}$ בקבוצת אמינו
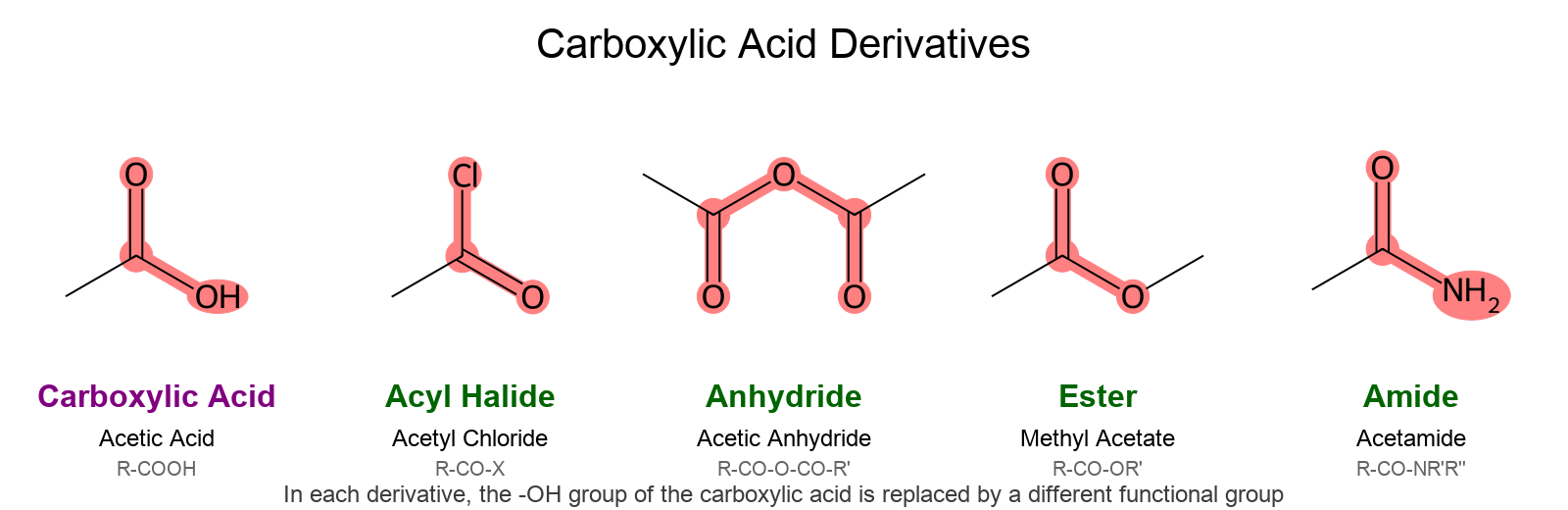
לא נלמד השנה nitrile.
מנגנון התגובה הכללי - החלפה נוקליאופילית אצילית
בניגוד לאלדהידים וקטונים שעוברים התקפה נוקליאופילית פשוטה, נגזרות חומצה קרבוקסילית עוברות מנגנון של החלפה נוקליאופילית אצילית. ההבדל המרכזי הוא שבנגזרות חומצה קיימת קבוצה עוזבת פוטנציאלית.
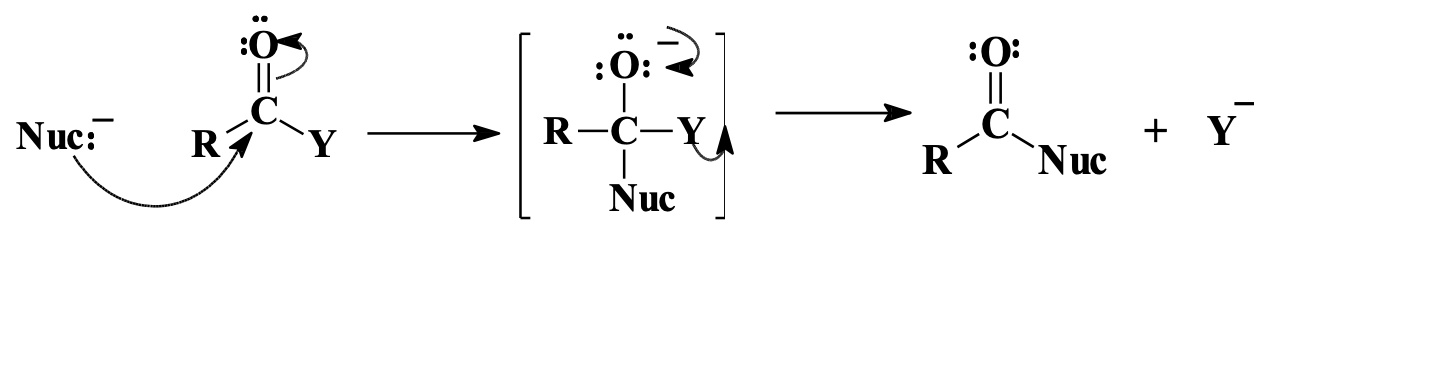
המנגנון הכללי כולל שני שלבים עיקריים:
- התקפה נוקליאופילית: הנוקליאופיל תוקף את הפחמן הקרבונילי האלקטרופילי, ויוצר תוצר ביניים טטרהדרלי
- סילוק קבוצה עוזבת: שחזור הקשר הכפול הקרבונילי תוך סילוק הקבוצה העוזבת
תוצר הביניים הטטרהדרלי לעתים אינו מבודד ואף לא נצפה, והתגובה עשויה להתרחש במנגנון מתואם שבו ההתקפה והסילוק מתרחשים בו-זמנית.
ריאקטיביות של נגזרות חומצה קרבוקסילית
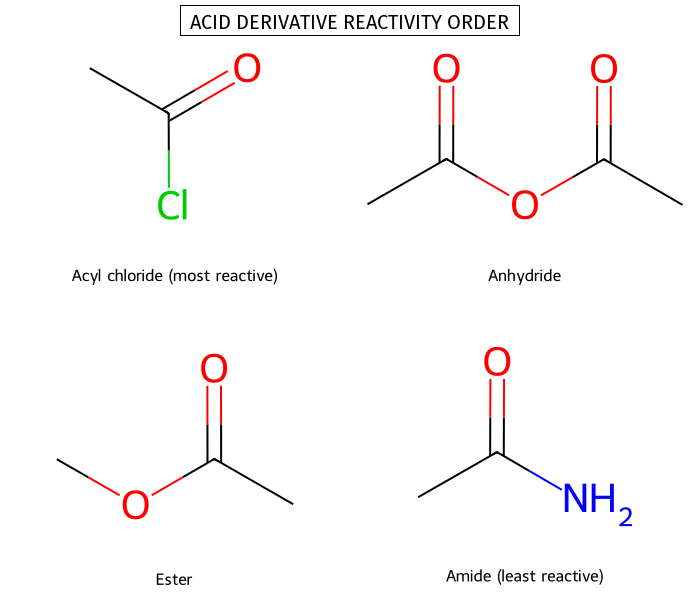
גורמים המשפיעים על הריאקטיביות
הריאקטיביות של נגזרות חומצה קרבוקסילית כלפי התקפה נוקליאופילית נקבעת על ידי שני גורמים מרכזיים המשפיעים זה על זה:
-
האלקטרופיליות של הפחמן הקרבונילי: עוצמת המטען החלקי החיובי ($\delta^+$) על הפחמן הקרבונילי קובעת את נטייתו למשוך נוקליאופילים. קבוצות מושכות אלקטרונים מגבירות את האלקטרופיליות, בעוד קבוצות דוחפות אלקטרונים מפחיתות אותה.
-
יכולת העזיבה של הקבוצה העוזבת: היציבות של הקבוצה העוזבת כאניון קובעת את קלות סילוקה. ככל שהקבוצה העוזבת יציבה יותר (בסיסית פחות), כך התגובה מתרחשת ביתר קלות.
סדר הריאקטיביות היורד
על בסיס שני הגורמים הללו, סדר הריאקטיביות של נגזרות חומצה קרבוקסילית הוא:
\[\ce{Acyl halide > Anhydride > Ester > Amide}\]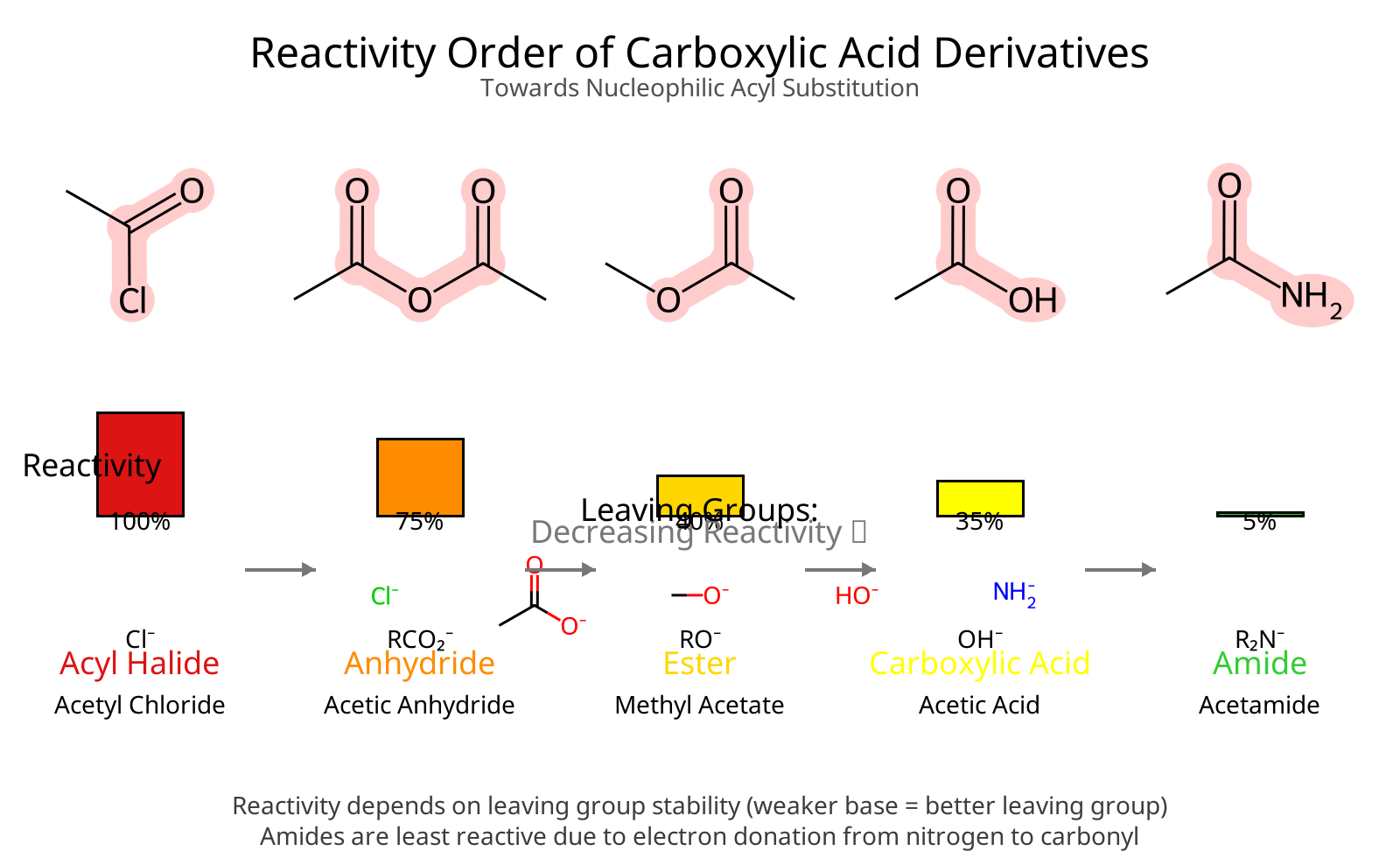
קרבוקסילט ($\ce{RCOO^-}$) אינו ריאקטיבי כלל, שכן $\ce{O^{2-}}$ אינה קבוצה עוזבת ריאלית בתנאים רגילים.
-
אציל הלידים הם הריאקטיביים ביותר משתי סיבות: ההלוגן מושך אלקטרונים אינדוקטיבית מהפחמן הקרבונילי, מגביר את האלקטרופיליות שלו, וההליד ($\ce{Cl^-}$ או $\ce{Br^-}$) הוא קבוצה עוזבת מצוינת.
-
אנהידרידים פחות ריאקטיביים מאציל הלידים. הקבוצה העוזבת היא קרבוקסילט ($\ce{RCOO^-}$), המיוצב על ידי רזוננס אך עדיין פחות יציב מהליד. הפחמן הקרבונילי השני מושך אלקטרונים אינדוקטיבית, אך במידה פחותה מהלוגן.
-
אסטרים מציגים ריאקטיביות מופחתת בשל תרומה רזונטיבית של זוג האלקטרונים הבלתי קושר על החמצן:
\[\ce{R-C(=O)-OR' <-> R-C^+(-O^-)-OR'}\]תרומה רזונטיבית זו מפחיתה את המטען החיובי החלקי על הפחמן הקרבונילי. בנוסף, אלקוקסיד ($\ce{RO^-}$) הוא קבוצה עוזבת גרועה יחסית.
-
אמידים הם הפחות ריאקטיביים. החנקן פחות אלקטרושלילי מחמצן, ולכן התרומה הרזונטיבית של זוג האלקטרונים שלו משמעותית יותר:
\[\ce{R-C(=O)-NR'2 <-> R-C^+(-O^-)-NR'2}\]המטען החיובי על הפחמן הקרבונילי מופחת משמעותית, ואמיד ($\ce{R2N^-}$) הוא קבוצה עוזבת גרועה ביותר בשל בסיסיותו הגבוהה.
החומצה הקרבוקסילית עצמה הכי פחות ריאקטיבית, שכן $\ce{OH^-}$ הוא בסיס חזק מאוד ואינו קבוצה עוזבת ריאלית בתנאים רגילים.
סינתזה של אציל הלידים
אפשר להמיר אציל הלידים לחומרים רבים (להלן). השאלה היא איך להכין אציל הלידים.
המרה באמצעות תיוניל כלוריד
אציל כלורידים מוכנים ביעילות מחומצות קרבוקסיליות באמצעות תיוניל כלוריד ($\ce{SOCl2}$):
\[\ce{R-COOH + SOCl2 -> R-COCl + SO2 + HCl}\]
מנגנון התגובה:
-
התקפה נוקליאופילית על הגופרית: החמצן הקרבוקסילי תוקף את אטום הגופרית האלקטרופילי של $\ce{SOCl2}$, תוך סילוק יון כלוריד:
\[\ce{R-C(=O)-OH + SOCl2 -> R-C(=O)-O-SOCl + HCl}\] -
החלפה נוקליאופילית אצילית: יון הכלוריד שנוצר תוקף את הפחמן הקרבונילי. תוצר הביניים הטטרהדרלי מתפרק תוך סילוק $\ce{SO2}$ ו-$\ce{Cl^-}$:
\[\ce{R-C(=O)-O-SOCl + Cl^- -> R-C(=O)Cl + SO2 + Cl^-}\]
היתרון של שיטה זו הוא שתוצרי הלוואי ($\ce{SO2}$ ו-$\ce{HCl}$) הם גזיים ומתנדפים מתערובת התגובה, מה שמאפשר בידוד קל של התוצר.
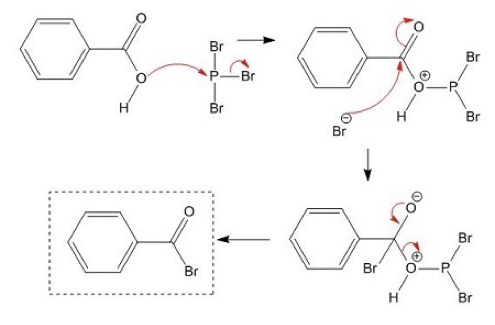
המרה באמצעות פוספור טריברומיד
אציל ברומידים מוכנים באמצעות פוספור טריברומיד ($\ce{PBr3}$):
\[\ce{3R-COOH + PBr3 -> 3R-COBr + H3PO3}\]מנגנון התגובה:
-
החמצן הקרבוקסילי תוקף את הזרחן, מסלק ברומיד:
\[\ce{R-COOH + PBr3 -> R-C(=O)-O-PBr2 + HBr}\] -
יון הברומיד תוקף את הפחמן הקרבונילי בהחלפה נוקליאופילית אצילית:
\[\ce{R-C(=O)-O-PBr2 + Br^- -> R-COBr + HOPBr2}\]
תגובות של אציל הלידים
עקרון כללי
אציל הלידים, בהיותם הנגזרות הריאקטיביות ביותר, יכולים להמיר לכל שאר הנגזרות של חומצה קרבוקסילית. כל התגובות מתרחשות במנגנון החלפה נוקליאופילית אצילית זהה.
הידרוליזה - פירוק על ידי מים לחומצה קרבוקסילית
הערה: בכל נגזרות החומצה תגובה עם מים תביא לחומצה קרבוקסילית. ההבדל הוא שבחלק צריך קטליזה חומצית.
תגובה עם מים מניבה חומצה קרבוקסילית:
\[\ce{R-COCl + H2O -> R-COOH + HCl}\]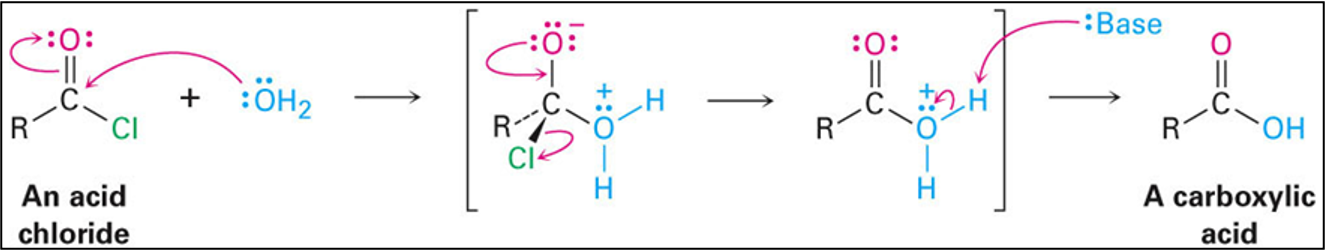
מנגנון: המים תוקפים את הפחמן הקרבונילי, נוצר תוצר ביניים טטרהדרלי שמתפרק תוך סילוק כלוריד. לאחר מכן מתרחשת דה-פרוטונציה על ידי בסיס (שיכול להיות כלוריד או מולקולת מים נוספת).
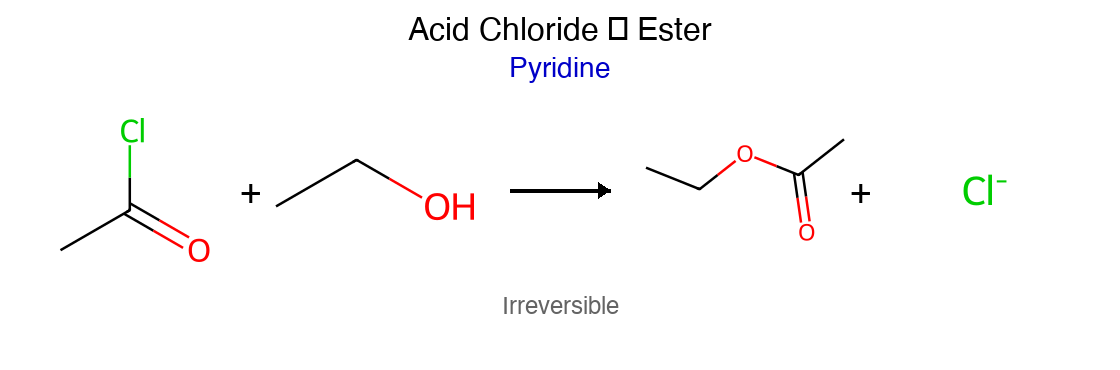
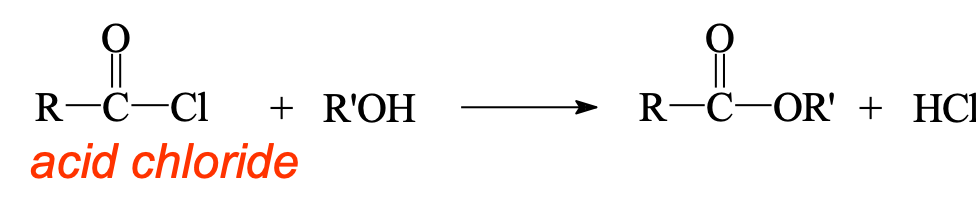
אסטריפיקציה - יצירת אסטרים מאציל כלוריד
תגובה עם כוהלים מניבה אסטרים:
\[\ce{R-COCl + R'OH -> R-COOR' + HCl}\]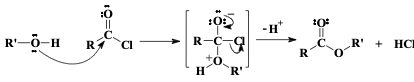
התגובה מתרחשת באופן ספונטני בטמפרטורת החדר. לעתים מוסיפים בסיס כמו פירידין או טריאתילאמין לנטרול ה-$\ce{HCl}$ הנוצר ולהאצת התגובה.
ניתן לבחור את הכוהל $\ce{R’OH}$ כדי לשלוט על סוג האסטר המתקבל. לדוגמה, שימוש באתנול יניב אסתר אתילי.
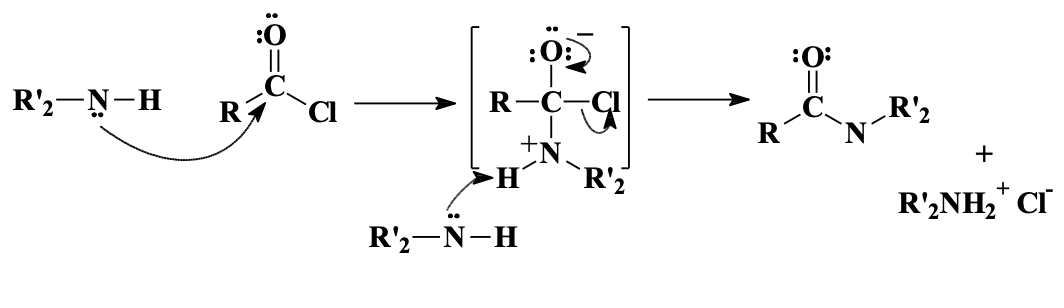
אמינוליזה לאמידים
אמין שלישוני לא יעבוד. גם כאן קבוצות ה-$\ce{R’}$ יכולה להיות כל אמין, וניתן לשלוט על סוג האמיד המתקבל.
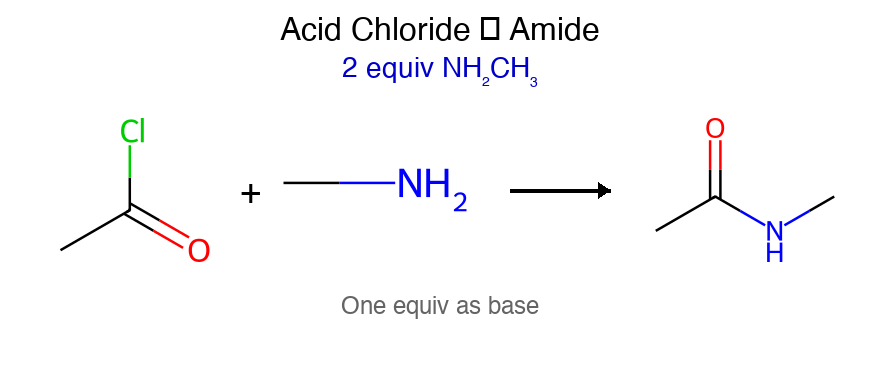
תגובה עם אמינים מניבה אמידים:
\[\ce{R-COCl + 2R'2NH -> R-CON(R')2 + R'2NH2^+Cl^-}\]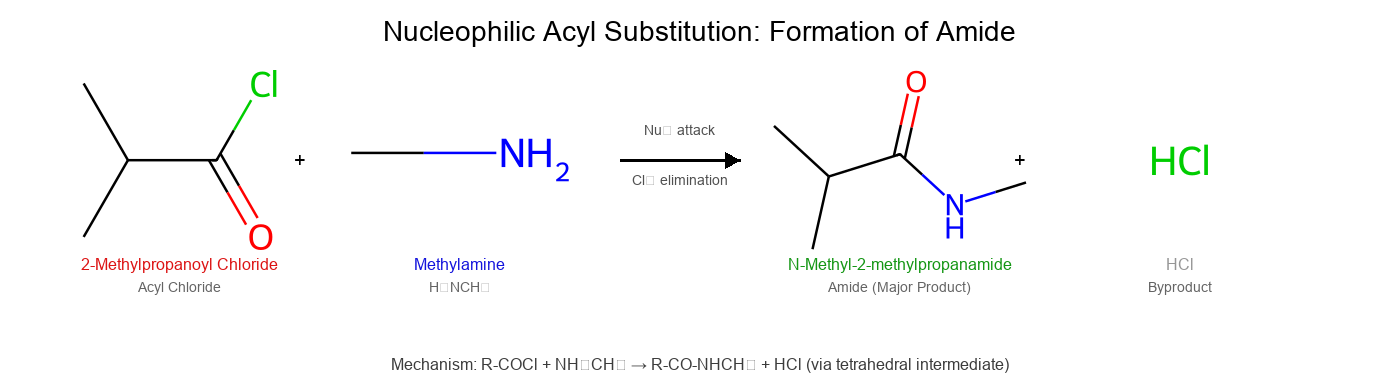
נדרשות שתי מולקולות של אמין - אחת כנוקליאופיל והשנייה כבסיס לנטרול ה-$\ce{HCl}$ הנוצר.
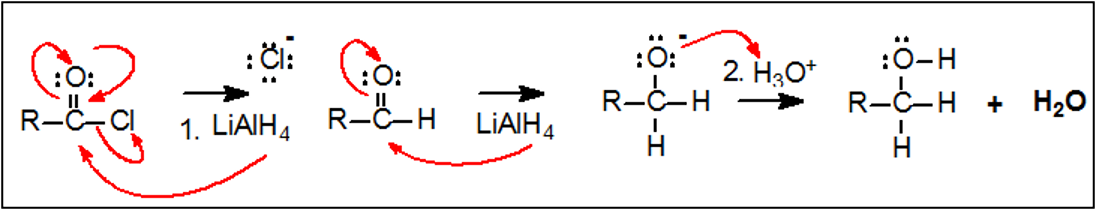
רדוקציה לאלדהידים ולכוהלים
רדוקציה חלקית לאלדהידים: ליתיום אלומיניום הידריד ($\ce{LiAlH4}$) מחזר אציל הלידים לכוהלים ראשוניים דרך אלדהיד כתוצר ביניים:
\[\ce{R-COCl ->[LiAlH4][H3O+] R-CH2OH}\]המנגנון כולל שתי התקפות עוקבות של יון הידריד:
-
התקפה ראשונה של $\ce{H^-}$ מניבה אלדהיד:
\[\ce{R-COCl + H^- -> R-CHO + Cl^-}\] -
התקפה שנייה על האלדהיד מניבה אניון אלדהידי:
\[\ce{R-CHO + H^- -> R-CH2O^-}\] -
פרוטונציה של האניון אלדהידי מניבה כוהל ראשוני:
\[\ce{R-CH2O^- + H^+ -> R-CH2OH}\]
בתנאים רגילים לא ניתן לעצור את התגובה בשלב האלדהיד בשל הריאקטיביות הגבוהה של $\ce{LiAlH4}$.
תגובה עם ריאגנטי גריניאר
ריאגנטי גריניאר מגיבים עם אציל הלידים ליצירת כוהלים שלישוניים, כאשר קבוצות ה-$\ce{R’}$ שיווספו מגיעות מריאגנט גריניאר:
\[\ce{R-COCl + 2R'MgX ->[H3O+] R-C(OH)(R')2}\]התגובה מתרחשת בשני שלבים:
-
התקפה ראשונה של ריאגנט גריניאר על אציל הליד מניבה קטון (נזכיר שהחלק בריאגרנט גריניאר שתוקף הוא פחמן טעון שלילית):
\[\ce{R-COCl + R'MgX -> R-CO-R' + MgXCl}\] -
התקפה שנייה של ריאגנט גריניאר על הקטון מניבה אניון קטוני:
\[\ce{R-CO-R' + R'MgX -> R-C(OMgX)(R')2}\] -
הידרוליזה של האניון הקטוני מניבה כוהל שלישוני:
\[\ce{R-C(OMgX)(R')2 + H3O+ -> R-C(OH)(R')2}\]
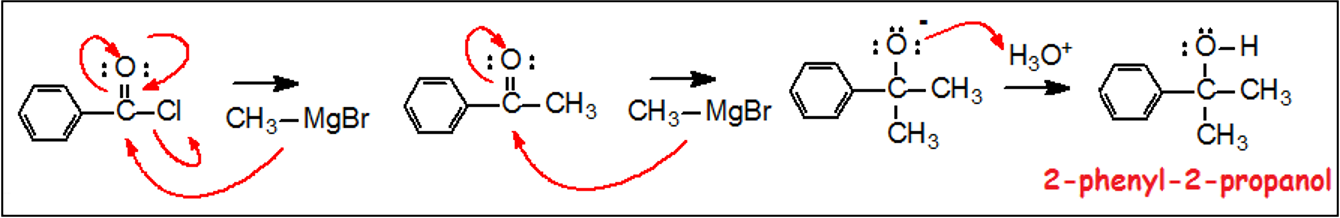
כמו במקרה של $\ce{LiAlH4}$, הריאקטיביות הגבוהה של ריאגנט גריניאר מונעת עצירת התגובה בשלב הקטון.
יצירת אנהידרידים מאציל הלידים
תגובה עם קרבוקסילט מניבה אנהידריד:
\[\ce{R-COCl + R'COO^- -> R-CO-O-CO-R' + Cl^-}\]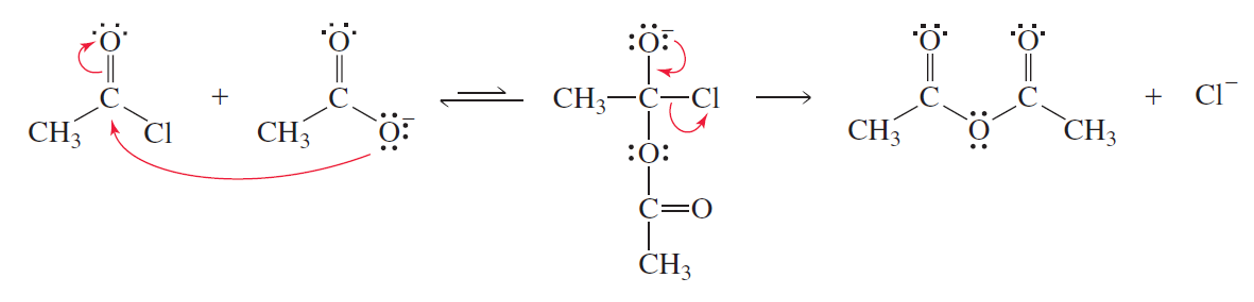
שיטה זו שימושית במיוחד להכנת אנהידרידים מעורבים (כאשר $\ce{R ≠ R’}$).
במקום הכלור מתווסף הקרבוקסילט.
תגובות של אנהידרידים
אנהידרידים מגיבים באופן דומה לאציל הלידים, אך בריאקטיביות מופחתת. הקבוצה העוזבת בכל התגובות היא קרבוקסילט:
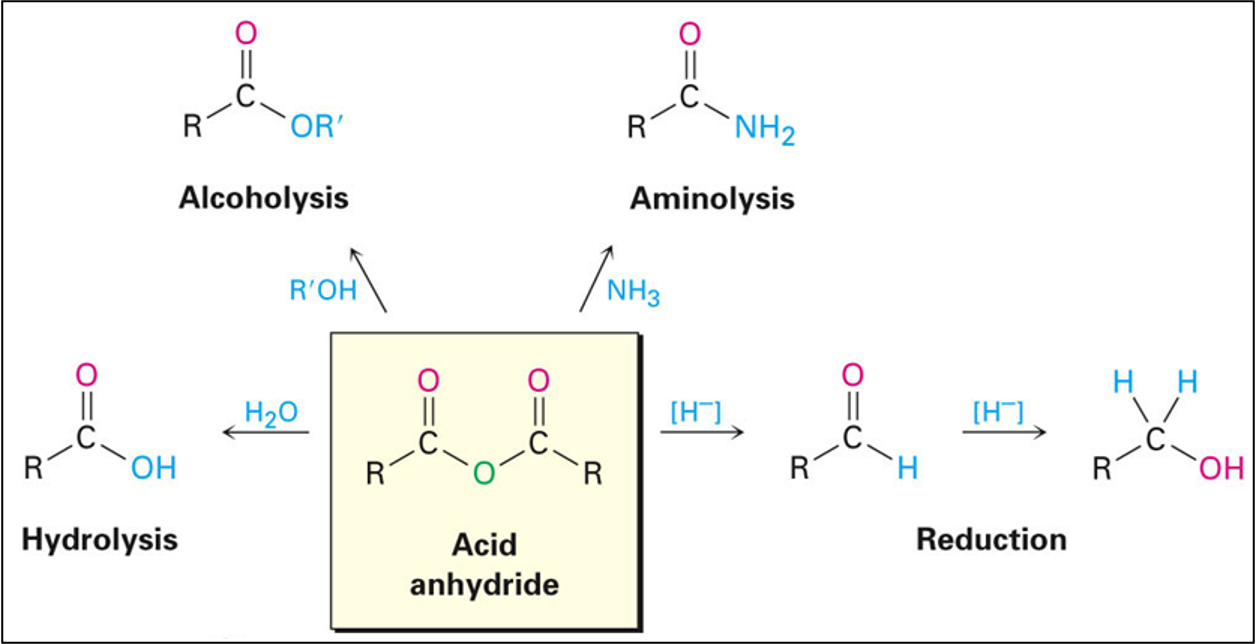
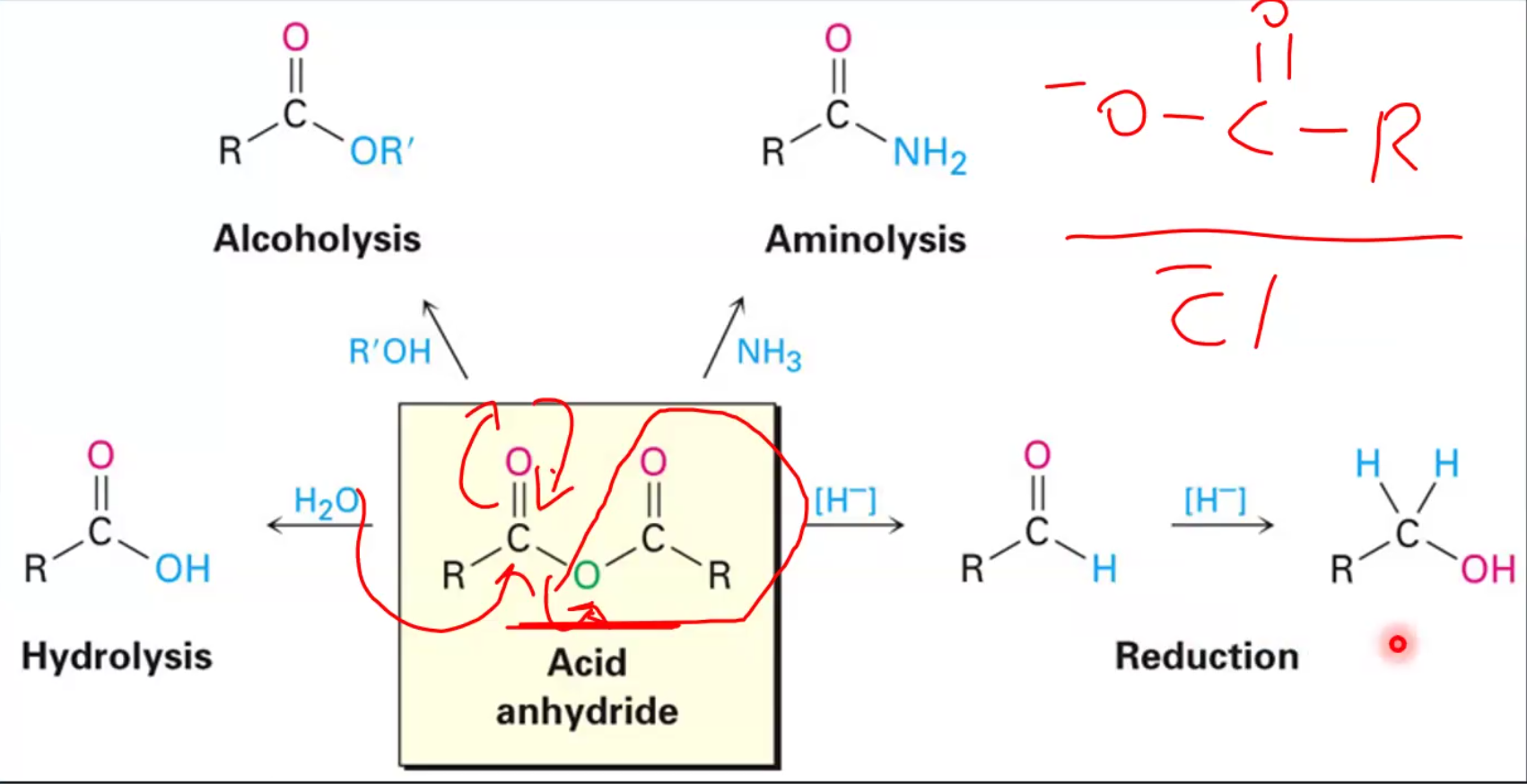
הידרוליזה
\[\ce{(RCO)2O + H2O -> 2RCOOH}\]אלכוהוליזה
\[\ce{(RCO)2O + R'OH -> RCOOR' + RCOOH}\]אמינוליזה
\[\ce{(RCO)2O + 2R'NH2 -> RCONHR' + RCOO^-NH3R'^+}\]רדוקציה
\[\ce{(RCO)2O ->[LiAlH4][H3O+] 2RCH2OH}\]היתרון העיקרי של אנהידרידים על פני אציל הלידים הוא שתוצר הלוואי (חומצה קרבוקסילית) פחות קורוזיבי מ-$\ce{HCl}$, מה שהופך אותם למועדפים בתגובות רגישות לחומצה.
שאלה 1
בתגובה בין אצטיל כלורי ומתנול, מהו החומר הביניים המרכזי?
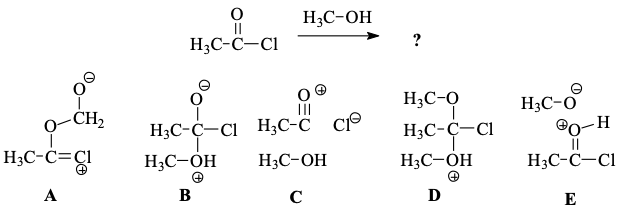
אציל אליד עם כוהול - מה חומר הביניים?
החמצן תוקף את הפחמן, אלקטרונים עולים, אז חוזרים והכלור יוצא. התשובה היא B.
שאלה 2
מה יהיה התוצר של התגובה הבאה?
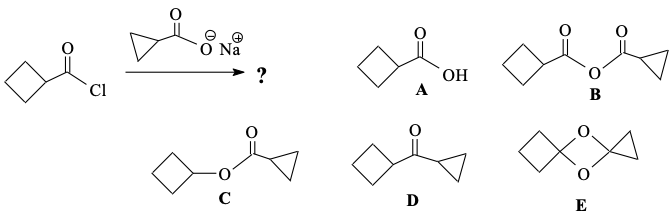
הכלור יוצא כקבוצה עוזבת, והאו מינוס של הקרבוקסיטלט תוקף ומציא כלור מינוס. התוצר יהיה ב- B.
הכלור עזב, ומי שמחובר לתבנית שנשארה הוא החמצן (שהיה נוקלאופיל).
שאלה 3
התגובה הרשומה מטה תהיה הכי איטית כש-X הוא …….?
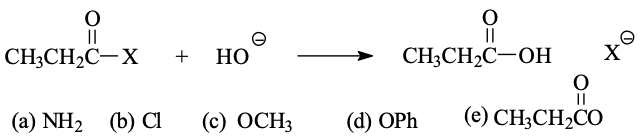
הקבוצה העוזבת הכי גרועה הי ה $\ce{NH2}$, היא תהיה הכי איטית.
הכי מהיר זה $\ce{Cl}$, אחר כך $\ce{Br}$, אחר כך $\ce{I}$, אחר כך $\ce{OH}$, ואחרון $\ce{NH2}$.
אסטרים: תכונות, סינתזה ותגובות
חשיבות ביולוגית ותעשייתית של אסטרים
אסטרים מהווים קבוצה פונקציונלית בעלת חשיבות רבה הן במערכות ביולוגיות והן בתעשייה. מבחינה ביולוגית, אסטרים נמצאים בליפידים חיוניים כגון טריגליצרידים ופוספוליפידים, המשמשים כמאגרי אנרגיה ורכיבי ממברנות תאיות. בטבע, אסטרים אחראים לריחות ולטעמים האופייניים של פירות רבים. תרכובות אלו נוצרות באופן טבעי בתהליכי הבשלה של הפרי ומהוות חלק מרכזי בפרופיל הארומטי שלו.
סינתזה של אסטרים
קיימות מספר שיטות מרכזיות להכנת אסטרים, כל אחת בעלת יתרונות ומגבלות משלה:
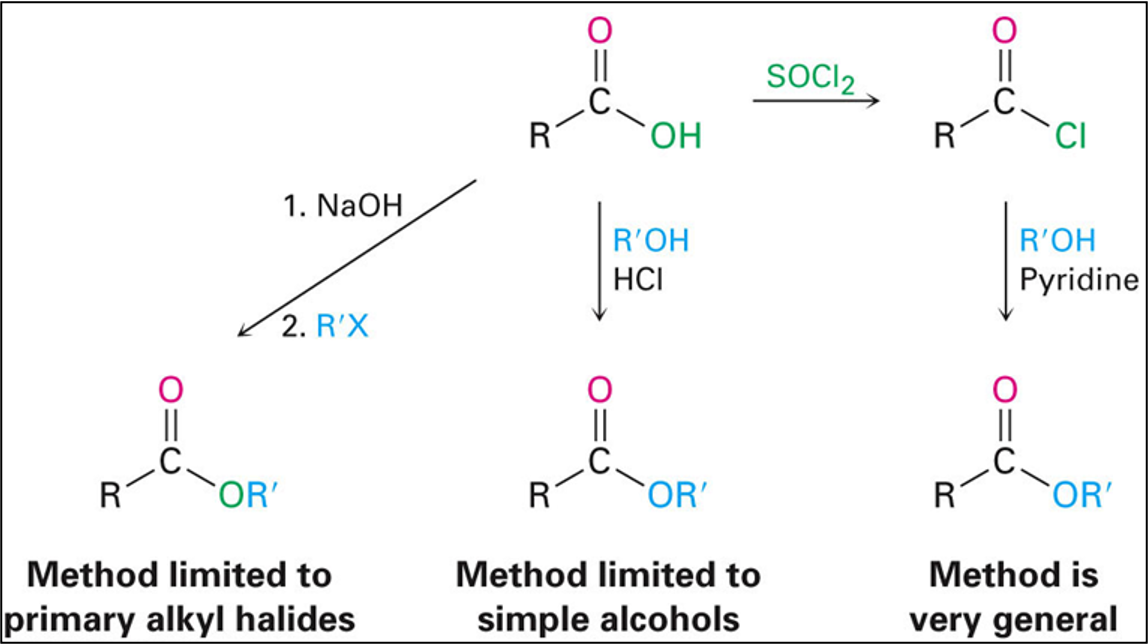
1. סינתזה דרך אציל הלידים
השיטה הישירה ביותר כוללת המרה של חומצה קרבוקסילית לאציל הליד, ולאחר מכן תגובה עם כוהל:
\[\ce{R-COOH ->[SOCl2] R-COCl ->[R'OH] R-COOR' + HCl}\]יתרון השיטה הוא במהירות התגובה וביעילותה הגבוהה. החיסרון העיקרי הוא הצורך בשני שלבי סינתזה והיווצרות $\ce{HCl}$ כתוצר לוואי קורוזיבי.
2. אלקילציה של קרבוקסילט
בשיטה זו, חומצה קרבוקסילית מומרת תחילה לאניון קרבוקסילט באמצעות בסיס חזק (כמו $\ce{NaOH}$), ולאחר מכן מגיבה עם אלקיל הליד במנגנון $\mathrm{S_N2}$:
\[\ce{R-COOH ->[base] R-COO^- ->[R'X] R-COOR'}\]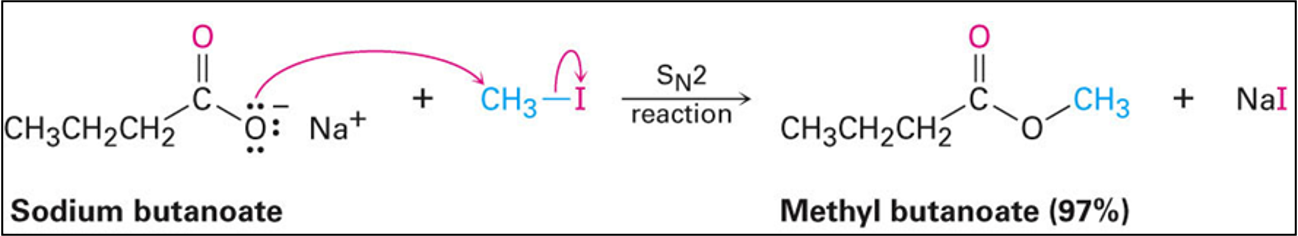
השיטה מתאימה במיוחד לאלקיל הלידים ראשוניים ומתיליים, אך פחות יעילה עם אלקיל הלידים משניים ושלישוניים בשל תחרות עם תגובות אלימינציה.
3. אסטריפיקציה של פישר
האסטריפיקציה של פישר היא השיטה הקלאסית והנפוצה ביותר להכנת אסטרים ישירות מחומצה קרבוקסילית וכוהל:
\[\ce{R-COOH + R'OH <=>[H+] R-COOR' + H2O}\]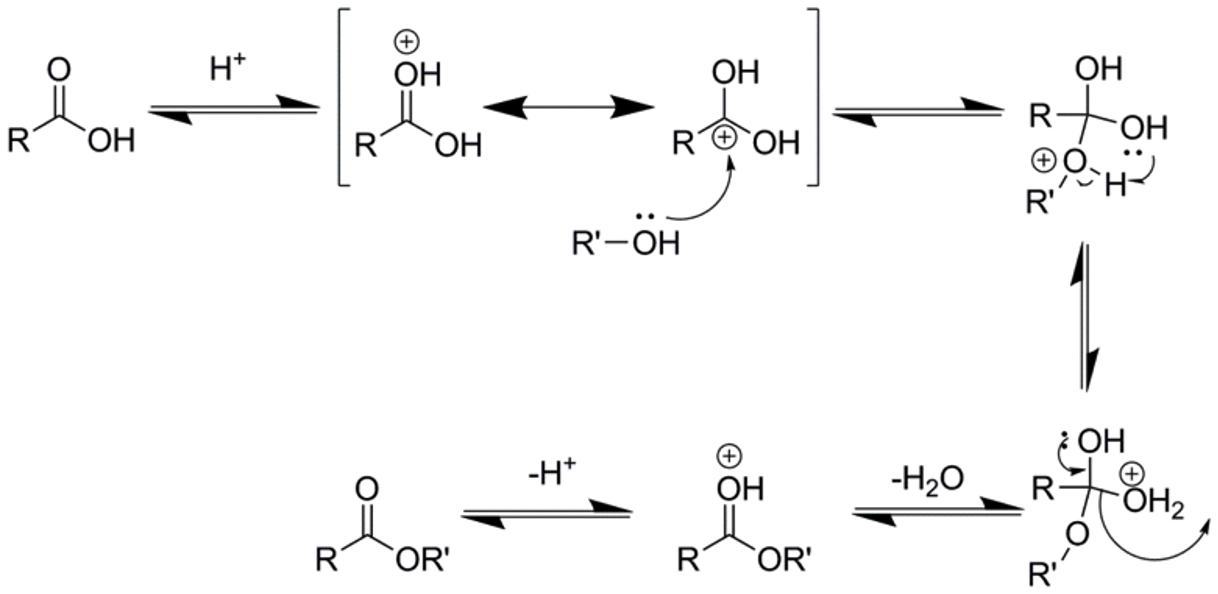
התגובה מתרחשת בשיווי משקל ודורשת קטליזה חומצית. להסטת שיווי המשקל לכיוון התוצרים משתמשים בעודף של אחד המגיבים או מסלקים מים מתערובת התגובה.
מנגנון האסטריפיקציה של פישר
מנגנון האסטריפיקציה מורכב יותר מהחלפה נוקליאופילית אצילית רגילה, שכן $\ce{OH^-}$ אינה קבוצה עוזבת טובה. הקטליזה החומצית פותרת בעיה זו על ידי המרת קבוצת ההידרוקסיל למים - קבוצה עוזבת מצוינת.
שלב 1: פרוטונציה של הקרבוניל
החמצן הקרבונילי עובר פרוטונציה (קוטף פרוטון $\ce{H^+}$), מה שמגביר את האלקטרופיליות של הפחמן, ומקל על הניוקלאופיל הכוהלי לתקוף:
\[\ce{R-C(=O)-OH + H^+ <=> R-C(=OH^+)-OH}\]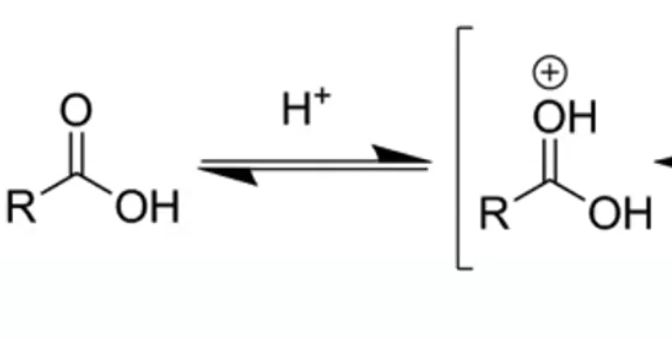
הפרוטונציה הופכת את הפחמן הקרבונילי לאלקטרופילי יותר על ידי הפיכת צורת הרזוננס $\ce{R-C^+(-OH)-OH}$ לדומיננטית יותר.
שלב 2: התקפה נוקליאופילית
הכוהל תוקף את הפחמן הקרבונילי המופעל, ויוצר תוצר ביניים טטרהדרלי:
\[\ce{R-C(=OH^+)-OH + R'OH -> R-C(OH)(OH)(OR'H^+)}\]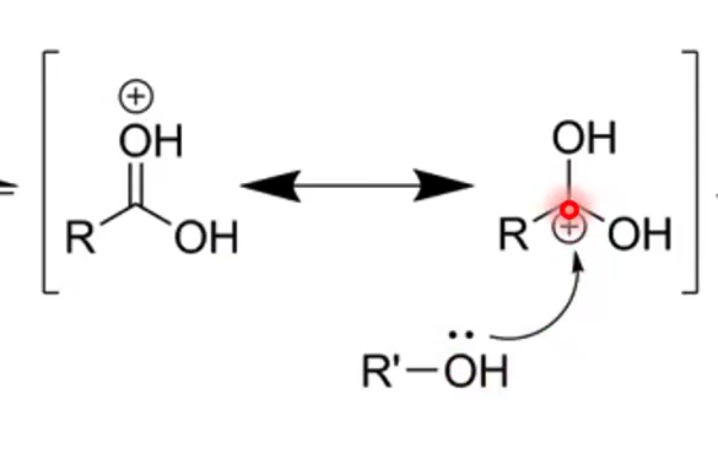
שלב 3: העברת פרוטון
מתרחשת העברת פרוטון תוך-מולקולרית מקבוצת האלכוהול שהתקיפה לקבוצת ההידרוקסיל המקורית:
\[\ce{R-C(OH)(OH)(OR'H^+) -> R-C(OH)(OH2^+)(OR')}\]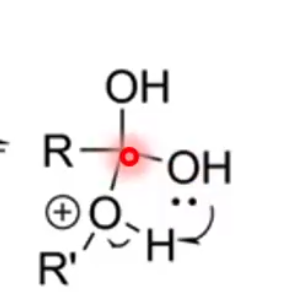
שלב זה הופך את קבוצת ההידרוקסיל למים - קבוצה עוזבת מצוינת.
שלב 4: סילוק מים ושחזור הקרבוניל
זוג אלקטרונים מהחמצן האלכוהולי יוצר קשר כפול עם הפחמן, תוך סילוק מולקולת מים:
\[\ce{R-C(OH)(OH2^+)(OR') -> R-C(=OH^+)(OR') + H2O}\]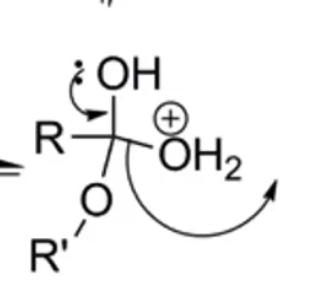
שלב 5: דה-פרוטונציה
החמצן הקרבונילי מאבד פרוטון ומתקבל האסטר:
\[\ce{R-C(=OH^+)(OR') -> R-C(=O)(OR') + H^+}\]חשוב לציין שכל שלבי המנגנון הם הפיכים, ולכן התגובה מגיעה לשיווי משקל. בתנאים חומציים ובנוכחות מים, אסטר יכול לעבור הידרוליזה חזרה לחומצה קרבוקסילית וכוהל במנגנון הפוך.
תגובות של אסטרים
אסטרים, בהיותם פחות ריאקטיביים מאציל הלידים ואנהידרידים, עוברים מגוון תגובות בתנאים שונים:
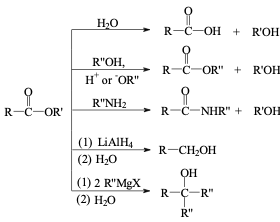
הידרוליזה חומצית
בנוכחות חומצה ומים, אסטרים עוברים הידרוליזה לחומצה קרבוקסילית וכוהל במנגנון ההפוך לאסטריפיקציה:
\[\ce{R-COOR' + H2O <=>[H+] R-COOH + R'OH}\]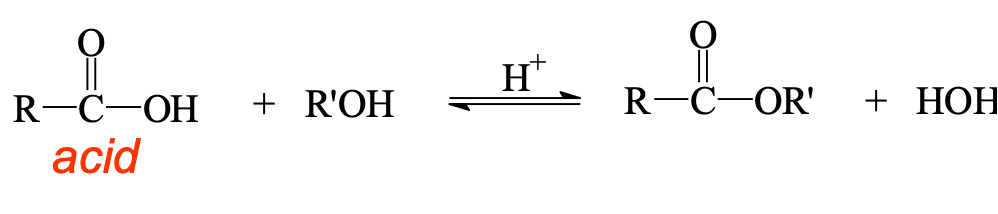
טרנסאסטריפיקציה
החלפת קבוצת האלכוקסי באסטר בקבוצה אחרת מתרחשת בנוכחות כוהל אחר וקטליזה חומצית:
\[\ce{R-COOR' + R''OH <=>[H+] R-COOR'' + R'OH}\]תגובה זו חשובה בייצור ביודיזל מטריגליצרידים.
אמינוליזה
תגובה עם אמינים מניבה אמידים:
\[\ce{R-COOR' + R''NH2 -> R-CONHR'' + R'OH}\]החנקן תוקף את הפחמן הקרבונילי
האלקרטונים עולים למעלה
יורדים למטה
יציאה החוצה של קבוצה עוזבת ($\ce{Cl-}$)
האלקוקסיד, ויוצרים אמיד.
בניגוד לתגובות הקודמות, תגובה זו אינה דורשת קטליזה חומצית, שכן אמינים הם נוקליאופילים חזקים דיים.
תגובות עם נוקליאופילים חזקים
נוקליאופילים חזקים במיוחד כמו $\ce{LiAlH4}$ וריאגנטי גריניאר אינם דורשים הפעלה חומצית ומסוגלים לסלק אפילו קבוצות עוזבות גרועות כמו אלקוקסיד.
רדוקציה עם ליתיום אלומיניום הידריד (LAH)
$\ce{LiAlH4}$ מחזר אסטרים לכוהלים ראשוניים בתגובה דו-שלבית:
\[\ce{R-COOR' ->[LiAlH4][H3O+] R-CH2OH + R'OH}\]מנגנון התגובה:
-
התקפה ראשונה והיווצרות אלדהיד: יון הידריד תוקף את הפחמן הקרבונילי, מסלק אלקוקסיד ויוצר אלדהיד:
\[\ce{R-COOR' + H^- -> R-CHO + R'O^-}\] -
התקפה שנייה על האלדהיד: האלדהיד הריאקטיבי מגיב מיד עם יון הידריד נוסף:
\[\ce{R-CHO + H^- -> R-CH2O^-}\] -
פרוטונציה: הוספת חומצה מימית מניבה את הכוהל הראשוני:
\[\ce{R-CH2O^- + H3O^+ -> R-CH2OH + H2O}\]
החוזק יוצא הדופן של $\ce{LiAlH4}$ כנוקליאופיל מאפשר לו לסלק אפילו אלקוקסיד, למרות היותה קבוצה עוזבת גרועה. בשל ריאקטיביות זו, לא ניתן לעצור את התגובה בשלב האלדהיד בתנאים רגילים.
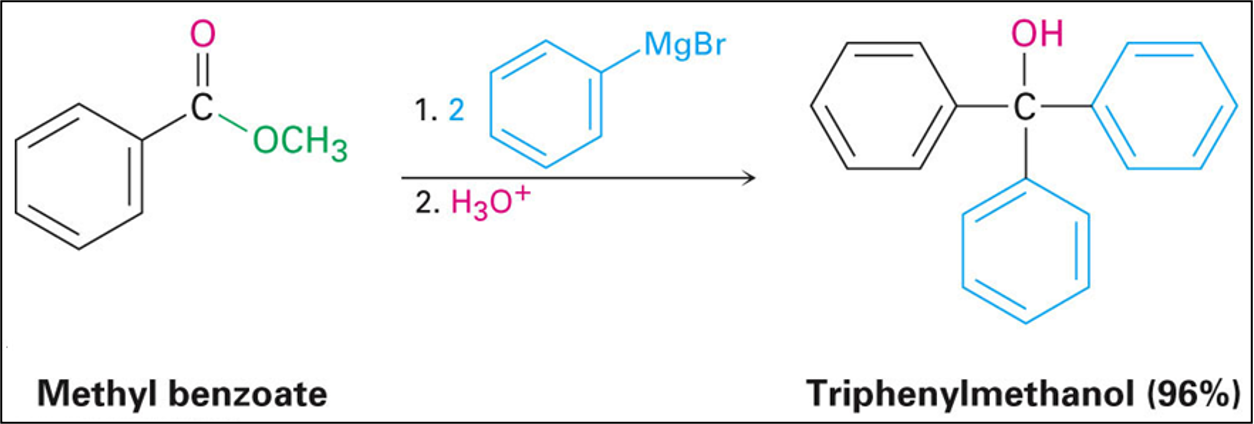
תגובות עם ריאגנטי גריניאר
בדומה ל-$\ce{LiAlH4}$, ריאגנטי גריניאר מגיבים עם אסטרים בתגובה דו-שלבית המניבה כוהלים שלישוניים:
\[\ce{R-COOR' + 2R''MgX ->[H3O+] R-C(OH)(R'')2 + R'OH}\]מנגנון התגובה:
-
התקפה ראשונה: הפחמן הנוקליאופילי בריאגנט גריניאר תוקף את הפחמן הקרבונילי, מסלק אלקוקסיד ויוצר קטון:
\[\ce{R-COOR' + R''MgX -> R-CO-R'' + R'OMgX}\] -
התקפה שנייה: הקטון הריאקטיבי מגיב מיד עם מולקולה נוספת של ריאגנט גריניאר:
\[\ce{R-CO-R'' + R''MgX -> R-C(OMgX)(R'')2}\] -
הידרוליזה חומצית: פרוטונציה של האלקוקסיד מניבה את הכוהל השלישוני:
\[\ce{R-C(OMgX)(R'')2 + H3O+ -> R-C(OH)(R'')2}\]
חשוב להדגיש שבתגובות של נגזרות חומצה עם $\ce{LiAlH4}$ או ריאגנטי גריניאר מתרחשות תמיד שתי התקפות - בניגוד לקטונים ואלדהידים שעוברים התקפה בודדת בלבד.
שימוש בקבוצות הגנה בתגובות סלקטיביות
כאשר במולקולה קיימים גם קטון וגם אסטר, ורוצים להגיב סלקטיבית רק עם האסטר, יש להשתמש בקבוצת הגנה לקטון. השיטה הנפוצה היא יצירת אצטל מחזורי:
תהליך ההגנה והתגובה:
- הגנת הקטון: תגובה עם אתילן גליקול בקטליזה חומצית יוצרת אצטל מחזורי
- תגובה סלקטיבית: $\ce{LiAlH4}$ או ריאגנט גריניאר מגיבים כעת רק עם האסטר
- הסרת ההגנה: הוספת $\ce{H3O+}$ (בריכוז גבוה, כ-6M) מחזירה את הקטון
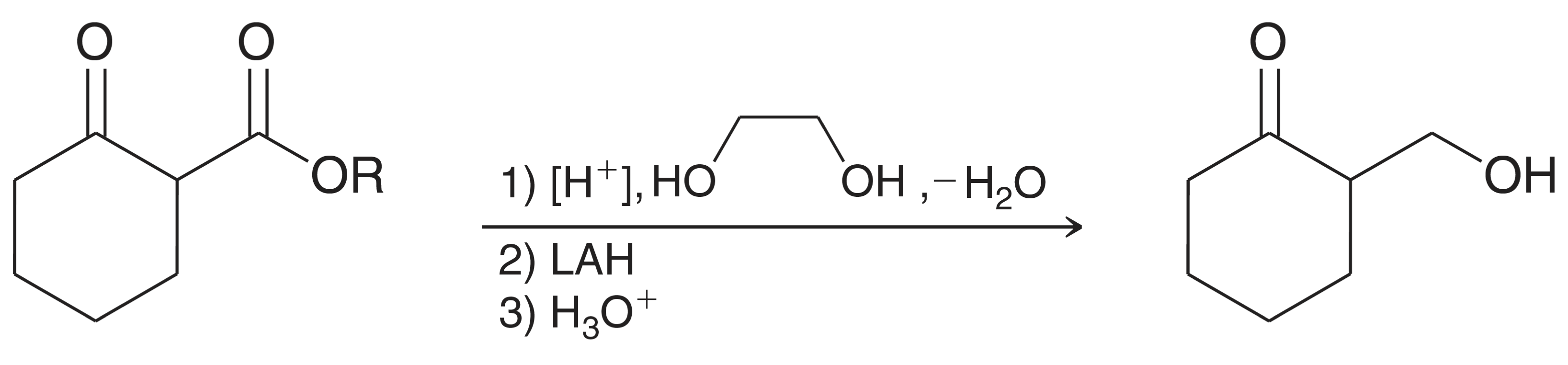
דוגמה למולקולה מחזורית (לקטון): כאשר לקטון מגיב עם $\ce{LiAlH4}$, תחילה נפתח הקשר $\ce{C-O}$ של האסטר המחזורי, ולאחר מכן מתרחשת רדוקציה של האלדהיד הנוצר. התוצר הסופי הוא דיול עם שרשרת פתוחה.
תגובות אסטרים בקטליזה חומצית
הידרוליזה חומצית של אסטרים
הידרוליזה של אסטרים בתנאים חומציים היא התגובה ההפוכה לאסטריפיקציה:
\[\ce{R-COOR' + H2O <=>[H+] R-COOH + R'OH}\]המנגנון זהה למנגנון האסטריפיקציה אך בכיוון ההפוך. התגובה היא איטית ומגיעה לשיווי משקל. להסטת שיווי המשקל לכיוון ההידרוליזה משתמשים בעודף מים.
טרנסאסטריפיקציה
החלפת קבוצת האלקוקסי באסטר בקבוצת אלקוקסי אחרת:
\[\ce{R-COOR' + R''OH <=>[H+] R-COOR'' + R'OH}\]המנגנון דומה לאסטריפיקציה רגילה: פרוטונציה של הקרבוניל, התקפת הכוהל החדש, העברת פרוטון, וסילוק הכוהל המקורי. תגובה זו חשובה בייצור ביודיזל מטריגליצרידים.
חשיבות ביולוגית של אסטרים - טריגליצרידים
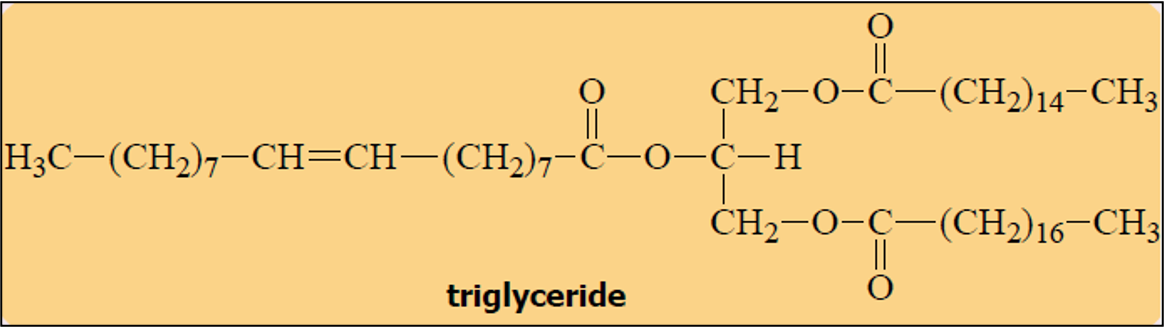
מבנה ותפקיד ביולוגי
טריגליצרידים הם אסטרים של גליצרול עם שלוש חומצות שומן:
\[\ce{CH2(OCOR)-CH(OCOR')-CH2(OCOR'')}\]תרכובות אלו משמשות כמאגר האנרגיה העיקרי בגוף האדם ומאוחסנות ברקמת השומן. המבנה ההידרופובי שלהן, הנובע משרשראות הפחמן הארוכות של חומצות השומן, הופך אותן לבלתי מסיסות במים.
רמות גבוהות של טריגליצרידים בדם מהוות גורם סיכון למחלות לב וכלי דם, ולכן מהוות פרמטר חשוב בבדיקות דם שגרתיות.
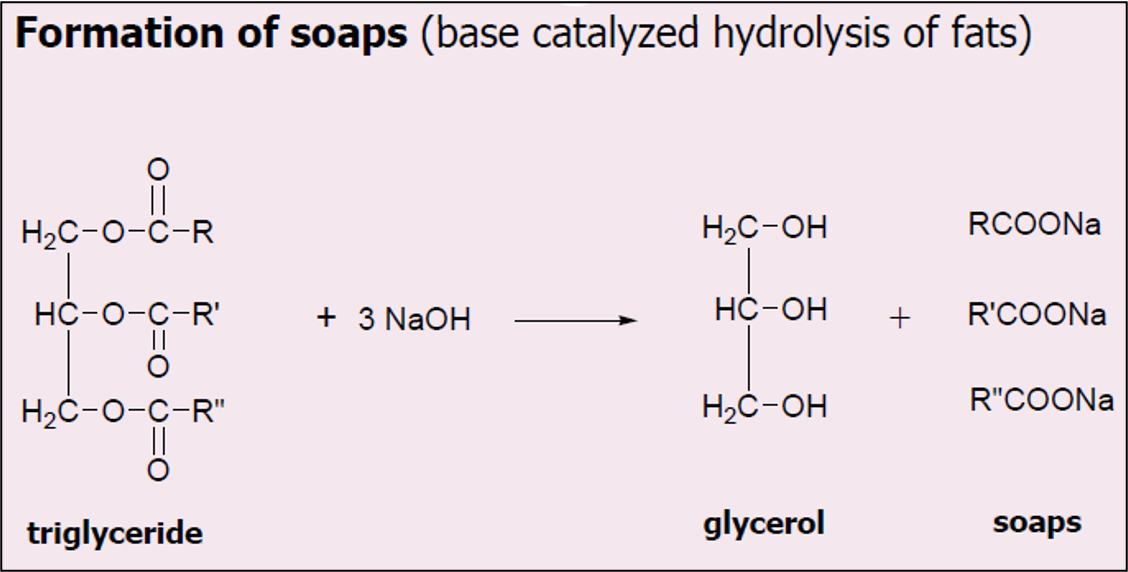
סינתזה וביקוע של טריגליצרידים
סינתזה (אסטריפיקציה):
\[\ce{Glycerol + 3 Fatty Acids ->[H+] Triglyceride + 3H2O}\]ביקוע (סיפון) - ייצור סבון:
\[\ce{Triglyceride + 3OH^- -> Glycerol + 3 Carboxylate of Fatty Acid}\]התהליך של ייצור סבון (סיפון) הוא הידרוליזה בסיסית של טריגליצרידים. הסבון המתקבל הוא מלח של חומצת שומן.
תכונות הסבון
מולקולות הסבון הן אמפיפיליות - בעלות ראש הידרופילי (קבוצת הקרבוקסילט) וזנב הידרופובי (שרשרת הפחמנים הארוכה):
- הזנב ההידרופובי: נקשר לשומנים ולכלוך על ידי כוחות ואן דר ואלס
- הראש ההידרופילי: מאפשר סילוק הסבון והלכלוך במים
מבנה דו-קוטבי זה מאפשר לסבון לפעול כחומר ניקוי יעיל.
חומצות שומן - סיווג ותכונות
סיווג חומצות שומן
חומצות שומן מסווגות לפי מידת הרוויה בקשרים כפולים:
1. חומצות שומן רוויות (Saturated):
- ללא קשרים כפולים $\ce{C=C}$
- מבנה ליניארי המאפשר אריזה צפופה
- מוצקות בטמפרטורת החדר
- מקור: שומן מן החי (בשר, חמאה)
- כוחות בין-מולקולריים חזקים
- נקודות היתוך גבוהות
2. חומצות שומן בלתי רוויות (Unsaturated): מחולקות לשתי תת-קבוצות:
א. חומצות שומן cis:
- קשרים כפולים בקונפיגורציית cis
- מבנה מכופף המקשה על אריזה צפופה
- נוזליות בטמפרטורת החדר
- מקור: שמן זית, אבוקדו, אגוזים, דגים
- נחשבות לבריאות ביותר לצריכה
ב. חומצות שומן trans:
- קשרים כפולים בקונפיגורציית trans
- מבנה דמוי-ליניארי המאפשר אריזה צפופה יחסית
- נוצרות בעיקר בתהליכי הידרוגנציה חלקית תעשייתיים
- נחשבות למזיקות ביותר לבריאות
השפעות בריאותיות
סדר המזיקות לבריאות (מהמזיק לפחות מזיק):
- חומצות שומן trans: מעלות משמעותית את הסיכון למחלות לב וכלי דם
- חומצות שומן רוויות: מעלות את רמות ה-LDL (“הכולסטרול הרע”) אך הגוף מסוגל להתמודד איתן
- חומצות שומן cis: מועילות לבריאות, מורידות את רמות ה-LDL ומעלות את ה-HDL (“הכולסטרול הטוב”)
ההבדלים בהשפעות הבריאותיות נובעים מהיכולת של הגוף לזהות ולעבד את המבנים השונים. חומצות שומן טבעיות (רוויות ו-cis) מוכרות למערכות האנזימטיות בגוף, בעוד שחומצות trans מלאכותיות אינן מעובדות ביעילות.
הכוחות הבין-מולקולריים בחומצות שומן והשפעתם על התכונות הפיזיקליות
הכוחות הבין-מולקולריים בחומצות שומן משפיעים באופן דרמטי על תכונותיהן הפיזיקליות ועל השפעתן הביולוגית. חומצות שומן ציס בלתי רוויות מאופיינות בכוחות בין-מולקולריים חלשים יחסית בשל המבנה המכופף שנוצר סביב הקשר הכפול. כיפוף זה מונע אריזה צפופה של המולקולות, מפחית את האינטראקציות ביניהן, ומוביל לנקודות היתוך נמוכות ולמצב צבירה נוזלי בטמפרטורת החדר.
חומצות שומן trans, למרות היותן בלתי רוויות, מתנהגות באופן דומה לחומצות רוויות מבחינת האריזה המולקולרית. המבנה הליניארי שלהן מאפשר אריזה צפופה וכוחות בין-מולקולריים חזקים יותר.
המקור התעשייתי של חומצות שומן trans דרך תהליכי הידרוגנציה חלקית יוצר בעיה ביולוגית משמעותית. בתהליך זה, חומצות שומן ציס טבעיות עוברות הידרוגנציה חלקית על זרז פלדיום:
\[\ce{R-CH=CH-R' (cis) ->[H2/Pd][חלקי] R-CH=CH-R' (trans)}\]האנזימים בגוף האדם, שהתפתחו להכיר ולעבד חומצות שומן טבעיות (רוויות או ציס), אינם מסוגלים לעבד ביעילות את חומצות ה-trans המלאכותיות. תרכובות אלו נוטות להצטבר בכלי הדם, לגרום לדלקות כרוניות ולהגביר משמעותית את הסיכון למחלות לב וסוכרת מסוג 2.
אמידים: הנגזרת החשובה ביותר בביולוגיה
מבנה ותכונות של אמידים
אמידים ($\ce{R-CO-NR’R’’}$) הם נגזרות חומצה קרבוקסילית שבהן קבוצת ההידרוקסיל הוחלפה בקבוצת אמינו. הם מהווים את הקבוצה הפונקציונלית החשובה ביותר במערכות ביולוגיות, שכן הקשר האמידי (הפפטידי) הוא אבן הבניין של כל החלבונים.
התכונות הייחודיות של אמידים נובעות מהרזוננס המשמעותי בין החנקן לקרבוניל:
\[\ce{R-C(=O)-NR'2 <-> R-C^+(-O^-)-NR'2}\]רזוננס זה מעניק לקשר $\ce{C-N}$ אופי של קשר כפול חלקי, מה שמוביל למספר תכונות חשובות:
- הקשר $\ce{C-N}$ קצר מקשר בודד רגיל
- סיבוב מוגבל סביב הקשר $\ce{C-N}$
- גיאומטריה מישורית סביב החנקן
- יכולת יצירת קשרי מימן חזקים
סינתזה של אמידים
1. מאציל הלידים
השיטה הפשוטה והישירה ביותר:
\[\ce{R-COCl + 2R'2NH -> R-CONR'2 + R'2NH2^+Cl^-}\]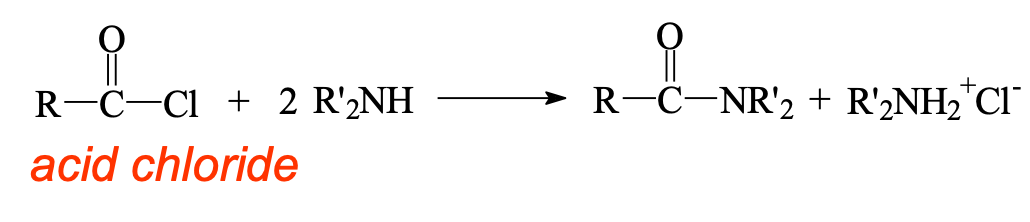
נדרשות שתי מולקולות של אמין - אחת כנוקליאופיל והשנייה לנטרול ה-$\ce{HCl}$ הנוצר.
2. מאנהידרידים ואסטרים
תגובות דומות מתרחשות עם נגזרות פחות ריאקטיביות:
\[\ce{(RCO)2O + 2R'NH2 -> RCONHR' + RCOO^-NH3R'^+}\] \[\ce{RCOOR' + R''NH2 -> RCONHR'' + R'OH}\]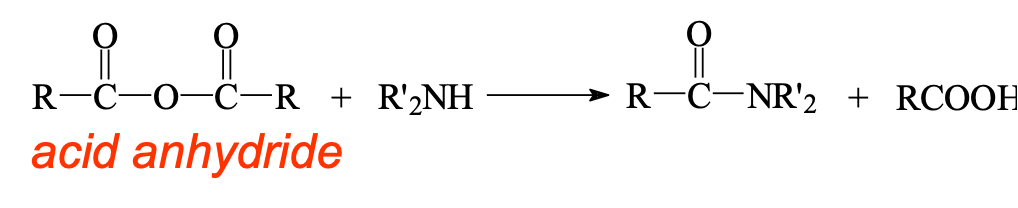
3. צימוד ישיר של חומצה קרבוקסילית עם אמין
בניגוד לתגובות הקודמות, חיבור ישיר של חומצה קרבוקסילית עם אמין אינו מתרחש ספונטנית. $\ce{OH^-}$ אינה קבוצה עוזבת טובה דיה, ולכן נדרש ריאגנט צימוד מיוחד.
תגובת צימוד עם DCC
עקרון הפעולה
דיציקלוהקסילקרבודיאימיד (DCC) הוא ריאגנט צימוד נפוץ המאפשר יצירת קשרים אמידיים בתנאים עדינים. תפקידו העיקרי הוא להפוך את קבוצת ההידרוקסיל של החומצה הקרבוקסילית לקבוצה עוזבת טובה.
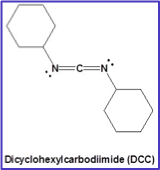
מנגנון התגובה
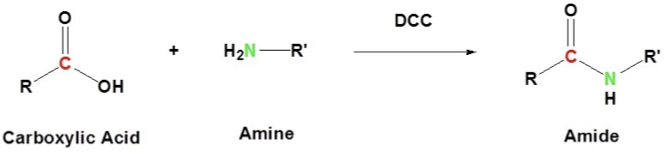
שלב 1: הפעלת החומצה הקרבוקסילית
החנקן האימיני של DCC פועל כבסיס וקוטף פרוטון מהחומצה הקרבוקסילית:
\[\ce{R-COOH + DCC -> R-COO^- + DCC-H^+}\]הקרבוקסילט הנוצר תוקף את הפחמן המרכזי של DCC, ונוצר תוצר ביניים מופעל:
\[\ce{R-COO^- + DCC-H^+ -> R-CO-O-DCC}\]שלב 2: התקפה נוקליאופילית של האמין
האמין תוקף את הפחמן הקרבונילי המופעל:
\[\ce{R-CO-O-DCC + R'NH2 -> [R-C(O^-)(NHR')(O-DCC)]}\]שלב 3: העברת פרוטון
החנקן של DCC קוטף פרוטון מהאמין שהתקיף:
\[\ce{[R-C(O^-)(NHR')(O-DCC)] -> [R-C(O^-)(NR')(O-DCC-H)]}\]שלב 4: סילוק וקבלת התוצר
שחזור הקשר הקרבונילי תוך סילוק DCU (דיציקלוהקסילאוריאה):
\[\ce{[R-C(O^-)(NR')(O-DCC-H)] -> R-CO-NR' + DCU}\]התוצר הסופי הוא האמיד הרצוי, ו-DCU כתוצר לוואי שמשקע מהתמיסה.
שאלה 4
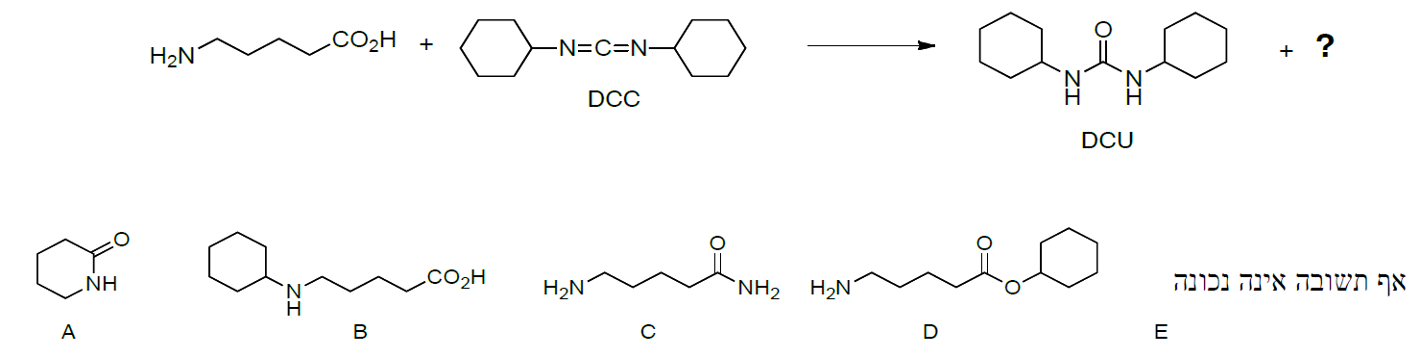
התשובה היא A.
יש לי חומצה ואמין בשרשרת, שמגיבים עם DCC. הם ייצרו טבעת: החנקן של האמין תוקף את הפחמן הקרבונילי של החומצה, ויוצר קשר יוצא החוצה ה- $\ce{OH}$ של החומצה, ויוצר קשר פפטידי (קשר אמידי) בין שני החומרים.
החנקן מחובר לפחמן הקרבונילי (אחרי שתקף אותו והתחבר אליו). סופרים את הפחמנים ומזהים שצריך לקבל טבעת עם שישה אטומים.
בנוסף לאמיד נוצר ה-DCU, שהוא תוצר לוואי של התגובה.
קשרים פפטידיים וחומצות אמינו
מבנה חומצות אמינו
חומצות אמינו הן תרכובות המכילות גם קבוצה אמינית וגם קבוצה קרבוקסילית. בחומצות α-אמינו, שתי הקבוצות מחוברות לאותו אטום פחמן (פחמן α):
\[\ce{H2N-CHR-COOH}\]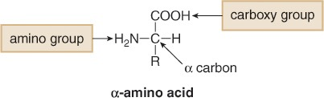
הפחמן α הוא כירלי ברוב החומצות האמיניות (למעט גליצין שבה $\ce{R = H}$), וכל החומצות האמיניות הטבעיות הן מהתצורה L.
מצב צוויטריוני
בתנאים פיזיולוגיים, חומצות אמינו קיימות כצוויטריונים:
\[\ce{^+H3N-CHR-COO^-}\]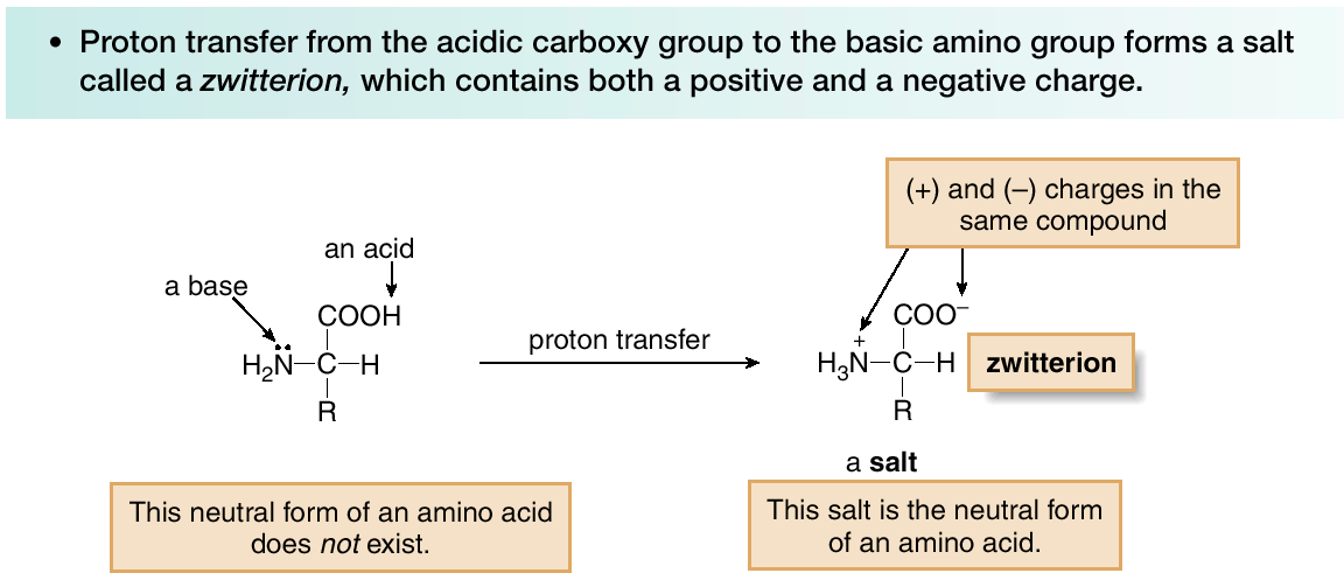
הקבוצה האמינית פרוטונית ($pK_a \approx 9$) והקבוצה הקרבוקסילית דה-פרוטונית ($pK_a \approx 2$), מה שיוצר מולקולה דו-קוטבית עם מטען כולל אפס.
יצירת הקשר הפפטידי
הקשר הפפטידי נוצר בתגובת עיבוי בין הקבוצה הקרבוקסילית של חומצה אמינית אחת לקבוצה האמינית של חומצה אמינית שנייה:
\[\ce{H2N-CHR-COOH + H2N-CHR'-COOH -> H2N-CHR-CO-NH-CHR'-COOH + H2O}\]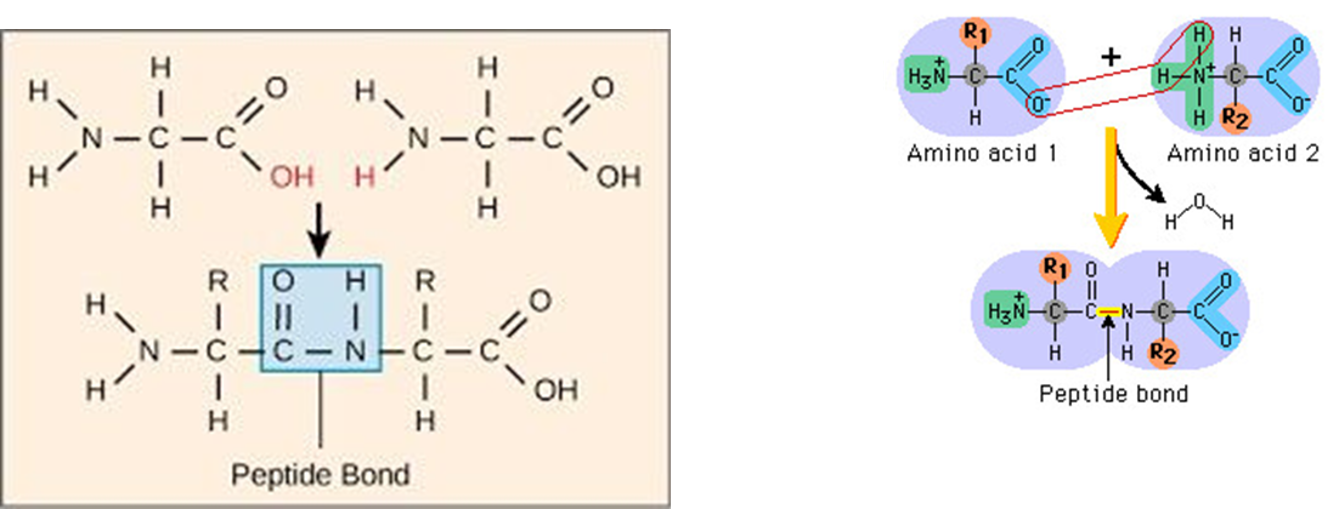
במערכות ביולוגיות, תהליך זה מתרחש בריבוזומים ומזורז על ידי מערכת אנזימטית מורכבת. במעבדה, נדרש שימוש בריאגנטי צימוד כמו DCC.
דוגמאות ביולוגיות חשובות
אספרטיים - ממתיק מלאכותי על בסיס פפטיד
אספרטיים הוא דיפפטיד סינתטי המורכב מחומצה אספרטית ופנילאלנין, עם קבוצת מתיל אסטר על הקצה הקרבוקסילי:
\[\ce{H2N-CH(CH2COOH)-CO-NH-CH(CH2Ph)-COOCH3}\]למרות היותו פפטיד פשוט, אספרטיים מתוק פי 200 מסוכרוז. המבנה המרחבי הספציפי שלו מאפשר קישור אופטימלי לקולטני המתיקות בלשון.
אוקסיטוצין - הורמון פפטידי
אוקסיטוצין הוא הורמון פפטידי המורכב מתשע חומצות אמינו, המיוצר בהיפותלמוס ומופרש מבלוטת יותרת המוח האחורית. מבנהו כולל טבעת מחזורית הנוצרת על ידי גשר דיסולפידי בין שני שיירי ציסטאין.
תפקידים פיזיולוגיים עיקריים:
- בלידה: גורם להתכווצויות הרחם במהלך הלידה ואחריה
- בהנקה: מעודד התכווצות של תאי השריר החלק סביב צינוריות החלב
- בהתנהגות חברתית: מעורב ביצירת קשרים רגשיים, אמפתיה והפחתת מתח
השימוש הרפואי באוקסיטוצין סינתטי נפוץ לזירוז לידה ולטיפול בדימומים לאחר לידה.
תרגילים ופתרונות בנגזרות חומצה קרבוקסילית
שאלה 5: זיהוי ריאגנטים בתגובות אסטרים
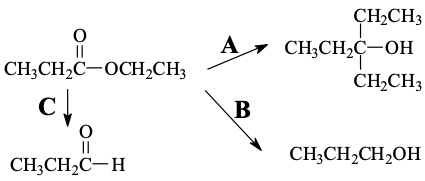
נתון אסטר $\ce{CH3CH2COOCH2CH3}$ שמגיב ליצירת שני תוצרים (לא למדנו על C):
- תוצר A: כוהל שלישוני עם שתי קבוצות $\ce{CH2CH3}$
- תוצר B: כוהל ראשוני $\ce{CH3CH2CH2OH}$
מהם הריאגנטים המתאימים ליצירת תוצר A וליצירת תוצר B?
הפתרון:
תוצר A - המרה לכוהל שלישוני: יצירת כוהל שלישוני מאסטר מתרחשת עם ריאגנט גריניאר $\ce{CH3CH2MgBr}$:
\[\ce{CH3CH2COOCH2CH3 + 2CH3CH2MgBr ->[H3O+] CH3CH2C(OH)(CH2CH3)2}\]שתי מולקולות של ריאגנט גריניאר מתווספות - אחת מחליפה את האלקוקסי ויוצרת קטון, והשנייה מתווספת לקטון.
תוצר B - המרה לכוהל ראשוני: כאשר אסטר הופך לכוהל ראשוני, הריאגנט היחיד המתאים הוא $\ce{LiAlH4}$:
\[\ce{CH3CH2COOCH2CH3 ->[LiAlH4][H3O+] CH3CH2CH2OH + CH3CH2OH}\]המנגנון כולל שתי התקפות של הידריד, כאשר הראשונה מניבה אלדהיד והשנייה מחזרת אותו לכוהל ראשוני.
שאלה 6: תגובות גריניאר עם מגוון קרבונילים
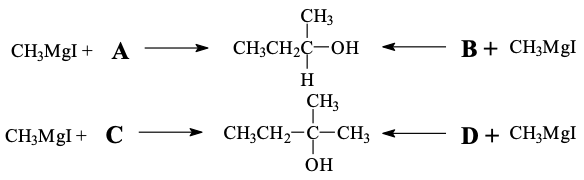
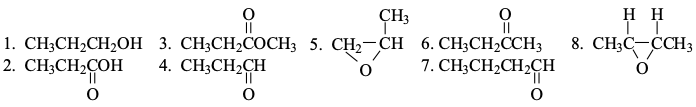
העיקרון המנחה:
- עם אלדהידים וקטונים: התקפה אחת בלבד (ישאר $\ce{H}$ - כלומר $\ce{CH3}$ ייכנס פעם אחת)
- עם נגזרות חומצה קרבוקסילית: שתי התקפות (למעט חומצה קרבוקסילית עצמה) , (כלומר $\ce{CH3}$ ייכנס פעמיים)
דוגמאות:
- גריניאר + אלדהיד ← כוהל משני (התקפה אחת)
- גריניאר + קטון ← כוהל שלישוני (התקפה אחת)
- גריניאר + אסטר ← כוהל שלישוני עם שתי קבוצות זהות (שתי התקפות)
- גריניאר + אפוקסיד ← כוהל עם הארכת שרשרת (התקפה על הפחמן הפחות מותמר)
חשוב: ריאגנטי גריניאר אינם מגיבים עם חומצות קרבוקסיליות ישירות, שכן הם פועלים כבסיסים וכותפים את הפרוטון החומצי.
התשובות:
- A: 4
- B: 5 - אפוקסיד עם גריניאר. $\ce{CH3}$ יתקוף את הפחמן הפחות מותמר (הימני באפוקסיד שבתמונה).
- פתיחת אפוקסיד בתנאים בסיסיים מדמה $\mathrm{S_N2}$, ולכן $\ce{CH3}$ יתקוף את הפחמן הפחות מותמר.
- גריניאר נוקלאופיל חזק, ולכן לא נדרש…
תרגיל 3: סדר ריאקטיביות של קרבונילים
השאלה: סדר את הקרבונילים הבאים לפי ריאקטיביות יורדת כלפי נוקליאופילים: אלדהיד, אנהידריד, אסטר, קטון
התשובה: \(\text{אלדהיד > אנהידריד > קטון > אסטר}\)
ההסבר:
- אלדהיד: הריאקטיבי ביותר - מימן אינו דוחף אלקטרונים, $\delta^+$ מקסימלי על הפחמן
- אנהידריד: קבוצה עוזבת טובה, אלקטרופיליות גבוהה
- קטון: דחיפת אלקטרונים אינדוקטיבית מקבוצות אלקיל
- אסטר: הפחות ריאקטיבי - דחיפת אלקטרונים רזונטיבית חזקה מהחמצן
תרגיל 4: רדוקטיבית אמינציה
התגובה: המרת קטון לאמין דרך תוצר ביניים של אימין או אנאמין
המנגנון:
- קטון + אמין משני ← אנאמין (+ $\ce{H2O}$)
- אנאמין + $\ce{H2/Ni}$ ← אמין שלישוני
תרגיל 5: תגובת אלדול
זיהוי תוצרי אלדול: כאשר רואים מערכת $\alpha,\beta$-בלתי רווייה (קטון עם קשר כפול בעמדת $\beta$), יש לחשוד בתגובת אלדול.
אסטרטגיית פתרון:
- זיהוי הקשר החדש שנוצר בתגובה
- “פירוק” מנטלי של המולקולה לשני קרבונילים המקוריים
- זיהוי איזה פחמן $\alpha$ תקף איזה קרבוניל
דוגמה: תוצר אלדול מיובש מתפרק מנטלית ל:
- נוקליאופיל: פחמן $\alpha$ של קטון/אלדהיד אחד
- אלקטרופיל: פחמן קרבונילי של קטון/אלדהיד שני
כללים חשובים לפתרון תרגילים
1. זיהוי תבניות תגובה
- אסטר ← כוהל ראשוני = $\ce{LiAlH4}$
- אסטר ← כוהל שלישוני = ריאגנט גריניאר
- קטון ← אמין = רדוקטיבית אמינציה
- מערכת $\alpha,\beta$-בלתי רווייה = אלדול
2. כללי ריאקטיביות
- נוקליאופילים חזקים ($\ce{LiAlH4}$, גריניאר) אינם דורשים הפעלה חומצית
- נוקליאופילים חלשים (מים, כוהלים) דורשים קטליזה חומצית
- קבוצות עוזבות טובות: $\ce{Cl^- > RCOO^- > RO^- > R2N^-}$
3. מגבלות תגובה
- גריניאר לא מגיב עם חומצות קרבוקסיליות (תגובת חומצה-בסיס)
- בנגזרות חומצה, גריניאר ו-$\ce{LiAlH4}$ תמיד מגיבים פעמיים
- אפוקסידים עם גריניאר - התקפה על הפחמן הפחות מותמר
:סיכום תגובות חומצות קרבוקסיליות ונגזרותיהן
סינתזה של חומצות קרבוקסיליות
| שיטת סינתזה | ריאגנטים | מנגנון | הערות |
|---|---|---|---|
| חמצון כוהל ראשוני | $\ce{K2Cr2O7/H+}$ | חמצון דו-שלבי | $\ce{R-CH2OH -> R-CHO -> R-COOH}$ |
| קרבוקסילציה של גריניאר | $\ce{RMgX + CO2}$ ואז $\ce{H3O+}$ | התקפה נוקליאופילית על $\ce{CO2}$ | הארכת שרשרת באטום פחמן אחד |
סדר ריאקטיביות נגזרות חומצה קרבוקסילית
| סדר ריאקטיביות | נגזרת | סיבת הריאקטיביות | קבוצה עוזבת |
|---|---|---|---|
| 1 (הכי ריאקטיבי) | אציל הליד | הלוגן מושך אלקטרונים אינדוקטיבית | $\ce{X^-}$ (מצוין) |
| 2 | אנהידריד | אפקט אינדוקטיבי מקרבוניל שני | $\ce{RCOO^-}$ (טוב) |
| 3 | אסטר | רזוננס מחמצן מפחית אלקטרופיליות | $\ce{RO^-}$ (גרוע) |
| 4 (הכי פחות ריאקטיבי) | אמיד | רזוננס חזק מחנקן | $\ce{R2N^-}$ (גרוע מאוד) |
סינתזה של אציל הלידים
| ריאגנט | תגובה | תוצרי לוואי | יתרונות |
|---|---|---|---|
| תיוניל כלוריד | $\ce{R-COOH + SOCl2 -> R-COCl + SO2 + HCl}$ | גזיים (מתנדפים) | בידוד קל של התוצר |
| פוספור טריברומיד | $\ce{3R-COOH + PBr3 -> 3R-COBr + H3PO3}$ | נוזלי | יצירת אציל ברומידים |
תגובות אציל הלידים - המרכז הסינתטי
| נוקליאופיל | תוצר | מנגנון | הערות מיוחדות |
|---|---|---|---|
| מים | $\ce{R-COCl + H2O -> R-COOH + HCl}$ | החלפה נוקליאופילית אצילית | הידרוליזה |
| כוהל | $\ce{R-COCl + R’OH -> R-COOR’ + HCl}$ | החלפה נוקליאופילית אצילית | יצירת אסטר |
| אמין | $\ce{R-COCl + 2R’2NH -> R-CON(R’)2 + R’2NH2^+Cl^-}$ | החלפה נוקליאופילית אצילית | נדרשות 2 מולקולות אמין |
| קרבוקסילט | $\ce{R-COCl + R’COO^- -> R-CO-O-CO-R’ + Cl^-}$ | החלפה נוקליאופילית אצילית | יצירת אנהידריד |
תגובות רדוקציה ותוספת של אציל הלידים
| ריאגנט | תוצר | מספר התקפות | הערות |
|---|---|---|---|
| $\ce{LiAlH4}$ | $\ce{R-COCl -> R-CH2OH}$ | שתיים (דרך אלדהיד) | כוהל ראשוני |
| ריאגנט גריניאר | $\ce{R-COCl + 2R’MgX -> R-C(OH)(R’)2}$ | שתיים (דרך קטון) | כוהל שלישוני |
תגובות אנהידרידים
| תגובה | ריאגנטים | תוצר | קבוצה עוזבת |
|---|---|---|---|
| הידרוליזה | $\ce{(RCO)2O + H2O}$ | $\ce{2RCOOH}$ | $\ce{RCOO^-}$ |
| אלכוהוליזה | $\ce{(RCO)2O + R’OH}$ | $\ce{RCOOR’ + RCOOH}$ | $\ce{RCOO^-}$ |
| אמינוליזה | $\ce{(RCO)2O + 2R’NH2}$ | $\ce{RCONHR’ + RCOO^-NH3R’^+}$ | $\ce{RCOO^-}$ |
| רדוקציה | $\ce{(RCO)2O + LiAlH4}$ | $\ce{2RCH2OH}$ | - |
סינתזה של אסטרים - שלוש שיטות עיקריות
| שיטה | ריאגנטים | יתרונות | מגבלות |
|---|---|---|---|
| דרך אציל הליד | $\ce{R-COOH ->[SOCl2] R-COCl ->[R’OH] R-COOR’}$ | מהיר, יעיל | שני שלבים, $\ce{HCl}$ קורוזיבי |
| אלקילציה של קרבוקסילט | $\ce{R-COOH ->[base] R-COO^- ->[R’X] R-COOR’}$ | שלב אחד | רק עם אלקיל הלידים ראשוניים |
| אסטריפיקציה של פישר | $\ce{R-COOH + R’OH <=>[H+] R-COOR’ + H2O}$ | ישיר, זול | שיווי משקל, איטי |
מנגנון אסטריפיקציה של פישר - 5 שלבים
| שלב | תהליך | תוצר ביניים | הערה |
|---|---|---|---|
| 1 | פרוטונציה של קרבוניל | $\ce{R-C(=OH^+)-OH}$ | הגברת אלקטרופיליות |
| 2 | התקפת כוהל | $\ce{R-C(OH)(OH)(OR’H^+)}$ | תוצר ביניים טטרהדרלי |
| 3 | העברת פרוטון | $\ce{R-C(OH)(OH2^+)(OR’)}$ | הכנת קבוצה עוזבת |
| 4 | סילוק מים | $\ce{R-C(=OH^+)(OR’)}$ | שחזור קרבוניל |
| 5 | דה-פרוטונציה | $\ce{R-C(=O)(OR’)}$ | אסטר סופי |
תגובות אסטרים
תגובות עם נוקליאופילים חלשים (דורשות קטליזה חומצית)
| תגובה | תנאים | תוצר | שיווי משקל |
|---|---|---|---|
| הידרוליזה חומצית | $\ce{H2O/H+}$ | $\ce{R-COOH + R’OH}$ | הפיך |
| טרנסאסטריפיקציה | $\ce{R’‘OH/H+}$ | $\ce{R-COOR’’ + R’OH}$ | הפיך |
תגובות עם נוקליאופילים חזקים
| ריאגנט | תוצר | מספר התקפות | מנגנון |
|---|---|---|---|
| אמין | $\ce{R-COOR’ + R’‘NH2 -> R-CONHR’’ + R’OH}$ | אחת | החלפה נוקליאופילית |
| $\ce{LiAlH4}$ | $\ce{R-COOR’ -> R-CH2OH + R’OH}$ | שתיים | דרך אלדהיד |
| ריאגנט גריניאר | $\ce{R-COOR’ + 2R’‘MgX -> R-C(OH)(R’‘)2 + R’OH}$ | שתיים | דרך קטון |
סינתזה של אמידים
| שיטה | ריאגנטים | יעילות | הערות |
|---|---|---|---|
| מאציל הליד | $\ce{R-COCl + 2R’2NH}$ | גבוהה | נדרשות 2 מולקולות אמין |
| מאנהידריד | $\ce{(RCO)2O + 2R’NH2}$ | בינונית | פחות קורוזיבי |
| מאסטר | $\ce{R-COOR’ + R’‘NH2}$ | נמוכה | איטי |
| צימוד DCC | $\ce{R-COOH + R’NH2 + DCC}$ | גבוהה | תנאים עדינים |
מנגנון צימוד DCC
| שלב | תהליך | תוצר ביניים |
|---|---|---|
| 1 | הפעלת חומצה | $\ce{R-CO-O-DCC}$ |
| 2 | התקפת אמין | $\ce{[R-C(O^-)(NHR’)(O-DCC)]}$ |
| 3 | העברת פרוטון | $\ce{[R-C(O^-)(NR’)(O-DCC-H)]}$ |
| 4 | סילוק DCU | $\ce{R-CO-NR’ + DCU}$ |
קשרים פפטידיים
| מאפיין | ערך | השלכה |
|---|---|---|
| רזוננס C-N | $\ce{R-C(=O)-NR’2 <-> R-C^+(-O^-)-NR’2}$ | מגבלת סיבוב |
| גיאומטריה | מישורית | מבנה חלבון יציב |
| קשרי מימן | חזקים | מבנה משני של חלבונים |
כללים מנחים לפתרון תרגילים
זיהוי תבניות תגובה מרכזיות
| תבנית בתוצר | ריאגנט מתאים | מספר התקפות |
|---|---|---|
| נגזרת חומצה ← כוהל ראשוני | $\ce{LiAlH4}$ | שתיים |
| נגזרת חומצה ← כוהל שלישוני | ריאגנט גריניאר | שתיים |
| קטון/אלדהיד ← כוהל | $\ce{LiAlH4}$ או גריניאר | אחת |
עקרונות מפתח
- נוקליאופילים חזקים ($\ce{LiAlH4}$, גריניאר) - לא דורשים הפעלה חומצית
- נגזרות חומצה - תמיד שתי התקפות עם נוקליאופילים חזקים
- אציל הלידים - הריאקטיביים ביותר, מרכז סינתטי
- DCC - לצימוד עדין של חומצה ואמין
- אסטריפיקציה - הפיכה, דורשת הסטת שיווי משקל
מגבלות חשובות
- גריניאר + חומצה קרבוקסילית = תגובת חומצה-בסיס (לא צימוד)
- אמידים = הכי פחות ריאקטיביים (רזוננס חזק)
- קבוצות הגנה = נדרשות לתגובות סלקטיביות