לשנן
סיפוח HBr - מרקובניקוב vs אנטי-מרקובניקוב
- סיפוח HBr רגיל ← מרקובניקוב (H הולך לפחות מותמר)
- סיפוח HBr עם פרוקסידים ← אנטי-מרקובניקוב (מנגנון רדיקלי)
- משפט מפתח: “הברום בהכרח ייכנס לפחות מותמר כדי לתת רדיקל יציב יותר”
אוזונוליזה - שבירת קשר כפול
- “אוזונוליזה - התגובה היחידה ששוברת קשר בין שני פחמנים”
- תנאים מחזרים (Zn/DMS) ← אלדהידים וקטונים
- תנאים מחמצנים (H₂O₂) ← חומצות קרבוקסיליות
- אזהרה: תגובה מאוד אקזותרמית, עובדים ב-78°C-
אפוקסידים
- יצירה: קשר כפול + פר-חומצה (MCPBA)
- פתיחה בסביבה בסיסית: נוקלאופיל תוקף את הפחמן הפחות מותמר
- פתיחה בסביבה חומצית: נוקלאופיל תוקף את הפחמן היותר מותמר
- תמיד: התקפה אנטי (180 מעלות)
חמצון קשרים כפולים
- KMnO₄ ← תמיד נותן ציס-דיול (שני OH באותו כיוון)
- “אפשר לעשות E1 בכהלים רק בתנאים מאוד ספציפיים: H₂SO₄ חזקה + חימום”
- “חימום - כדי להעדיף אלימינציה על פני SN1”
תגובות ייחודיות לאלקינים
- חיזור עם H₂/Pd ← אלקאן (אי אפשר לעצור באמצע)
- חיזור עם לינדלר ← אלקן ציס (עוצר אחרי סיפוח אחד)
- סיפוח HX פעמיים ← שני האלוגנים על אותו פחמן
- סיפוח מים בקטליזה חומצית ← אינול ← טאוטומריזציה לקטון
אלקינים טרמינליים
- pKa ≈ 25 - פרוטון חומצי יחסית
- עם NaNH₂ ← יוצר אניון אצטיליד (נוקלאופיל חזק)
- משפט מפתח: “אופי s מייצב מטענים שליליים”
- “ברום על קרבוקטיון - מייצב רזונטיבית (למרות שהוא אלקטרונגטיבי)”
- “לכן שני ברומים בהכרח על אותו פחמן באלקין”
אתרים
סינתזת אתרים (Williamson)
- “תמיד נעדיף שהפחמן הפחות מותמר יהיה זה שיותקף” (למניעת E2)
- “אלקוקסידים הם גם בסיסים חזקים - יכולים לעשות E2”
- “אם ביקשו אתר - חפש מה היה כהל ומה היה אלקיל הליד”
- “פחמן שעליו OH באינול - הופך להיות הקרבוניל”
גריניאר - יצירת כוהל והארכת שרשרת
- גריניאר מוסיף פחמנים
- אסור פרוטונים חומציים במערכת - הגריניאר יקטוף פרוטון ויהרס
- תוקף קרבונילים ← תמיד נותן כהל
- פורמאלדהיד ← כהל ראשוני
- אלדהיד ← כהל שניוני
- קטון ← כהל שלישוני
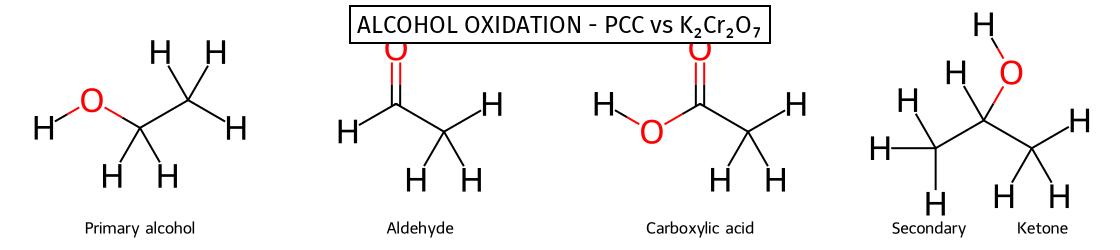
חיזור קרבונילים - יצירת כהלים
- חיזור מוסיף מימנים
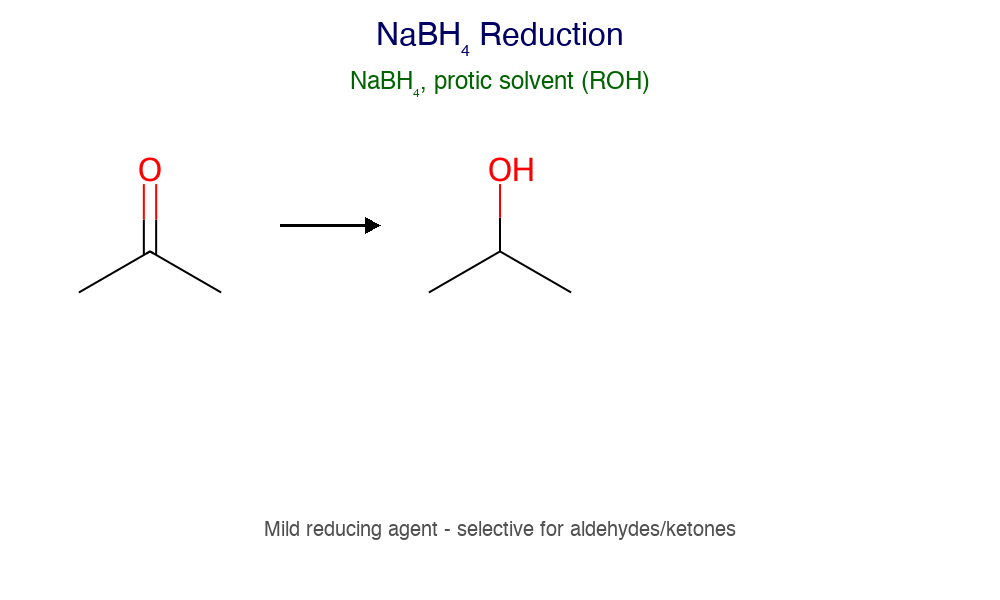
- NaBH₄ - מחזר רק קטונים ואלדהידים
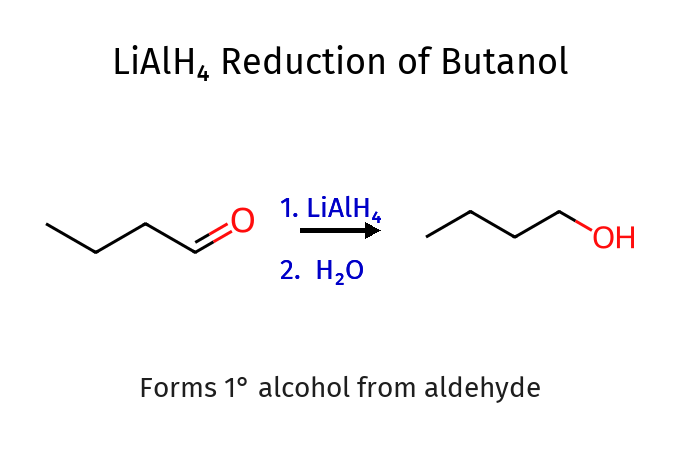
- LiAlH₄ - מחזר הכל (כולל חומצות ואסטרים)
- תמיד: חומצה קרבוקסילית/אסטר ← כהל ראשוני
כללי זהב
- “תמיד כשתוקפים אפוקסיד - התוצר הוא דיול”
- “ברגע שנוצר אינול - הוא עובר לקטון”
- “סיפוח לאלקין אפשר לעצור באמצע - חיזור אי אפשר (רק עם לינדלר)”
- “גריניאר רואה פרוטון חומצי - נהרס”
- אלקאנים לא עושים שום דבר חוץ מסיפוח רדיקלי ($\ce{->[Br2][hν]}$) כלור בדר״כ עדיף $\ce{Br2}$
- למה ברום ולא כלור ברדיקלים? “כלור נותן מלא תוצרים, ברום סלקטיבי - נכנס רק למותמר ביותר”
- “HBr לא יכול לעשות שבירה הומוליטית - אי אפשר ליצור מימן רדיקלי”
- “כל מנגנון רדיקלי חייב טרמינציה בסוף”
סיפוח על קשרים כפולים - מבוא
תגובות סיפוח לקשרים כפולים מהוות אחד הנושאים המרכזיים בכימיה אורגנית, ומספקות כלי חשוב להמרה של אלקנים למולקולות מורכבות יותר. תגובות אלו מתחלקות לשלוש קטגוריות עיקריות על פי המנגנון דרכו הן מתרחשות:
- תגובות שעוברות דרך חומר ביניים קרבוקטיוני - מנגנונים המערבים יצירת קרבוקטיון כחומר ביניים
- תגובות שעוברות דרך יון המגשר ($\text{Bridged ION}$) - מנגנונים הכוללים יצירת גשר הלוניום (ברומוניום או כלורוניום)
- מנגנונים מיוחדים - תגובות בעלות מנגנונים ייחודיים או תגובות ללא מנגנון מוגדר שיש להכיר
סיפוח הלוגנידי מימן: השוואה בין מנגנון יוני למנגנון רדיקלי
סיפוח $\ce{HBr}$ לפי כלל מרקובניקוב
כשמוסיפים $\ce{HBr}$ ($\text{Hydrobromic acid}$) לאַלקֵן בתנאים רגילים, התגובה עוברת דרך מנגנון קרבוקטיוני ומתרחשת לפי כלל מרקובניקוב:
- הברום ($\ce{Br}$) מתחבר לפחמן שיש עליו פחות מימנים, או באופן שקול, הפחמן שמחובר ליותר קבוצות אלקיל - יותר מותמר.
- המימן ($\ce{H}$) מתחבר לפחמן שיש עליו יותר מימנים, או באופן שקול, הפחמן שמחובר לפחות קבוצות אלקיל - פחות מותמר.
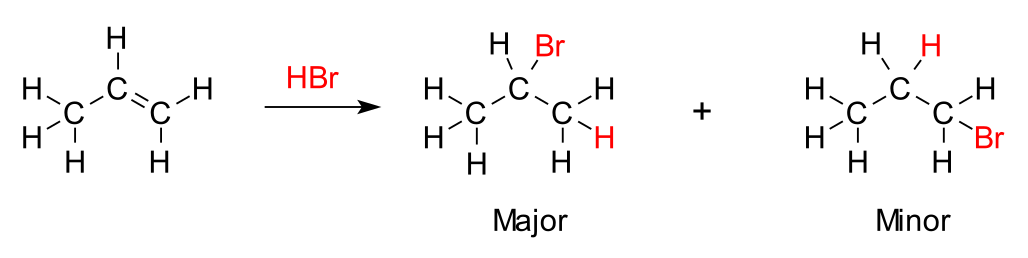
הבסיס התרמודינמי לכלל מרקובניקוב נעוץ ביציבות הקרבוקטיון שנוצר כחומר ביניים: קרבוקטיונים שלישוניים יציבים יותר משניוניים, ואלו יציבים יותר מראשוניים, בשל אפקט האינדוקציה החיובי של קבוצות אלקיל הסמוכות. לכן, התגובה מועדפת בכיוון שיוצר את הקרבוקטיון היציב ביותר.
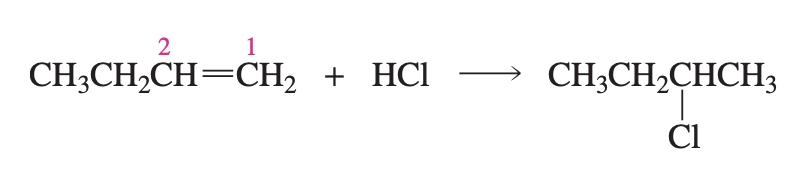 |
|---|
| The electrophile adds preferentially to the $sp^2$ carbon, bonded to the most hydrogens. |
סיפוח אנטי-מרקובניקוב: מנגנון רדיקלי
כאשר מבצעים את אותה תגובת סיפוח בנוכחות פרוקסידים, מתקבל תוצר הפוך - סיפוח אנטי-מרקובניקוב. במקרה זה, הברום מתחבר דווקא לפחמן הפחות מותמר, והמימן לפחמן היותר מותמר.
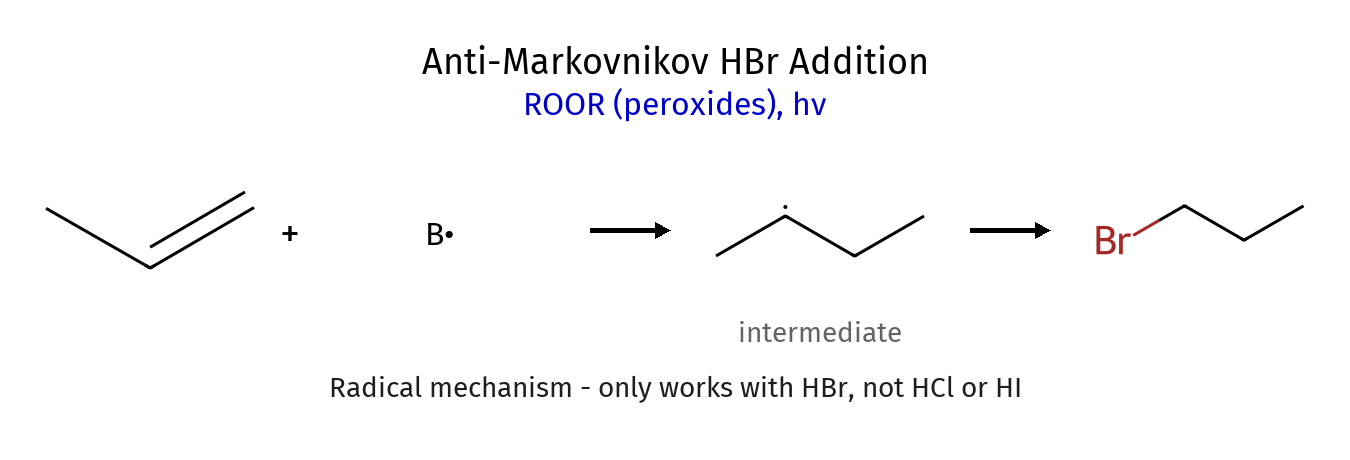
המנגנון הרדיקלי
התגובה מתחילה עם פירוק הומוליטי של פרוקסיד ($\ce{R-O-O-R}$) תחת קרינה או חימום:
\[\ce{R-O-O-R ->[$h\nu$] 2 R-O^.}\]הרדיקל $\ce{R-O^.}$ תוקף את מולקולת $\ce{HBr}$ ומפרק אותה הומוליטית:
\[\ce{R-O^. + H-Br -> R-O-H + Br^.}\]חשוב לציין שלא ניתן לבצע פירוק הומוליטי ישיר של $\ce{HBr}$ מכיוון שלא נוצרים רדיקלים יציבים של מימן. לכן השימוש בפרוקסידים הכרחי ליצירת הרדיקל הראשוני.
הרדיקל $\ce{Br^.}$ תוקף את הקשר הכפול ומתחבר לפחמן הפחות מותמר, מה שמותיר רדיקל על הפחמן היותר מותמר:
\[\ce{Br^. + RCH=CH2 -> RCH(Br)-CH2^.}\]הסיבה להעדפה זו דומה לזו של קרבוקטיונים - רדיקלים שלישוניים יציבים יותר משניוניים ומראשוניים.
הרדיקל הפחמני תוקף מולקולת $\ce{HBr}$ נוספת:
\[\ce{RCH(Br)-CH2^. + H-Br -> RCH(Br)-CH3 + Br^.}\]התגובה מסתיימת בשלב טרמינציה, בו שני רדיקלים מתחברים ליצירת מולקולה ניטרלית.
חיזור של הקשר הכפול - הוספת מימנים
תגובה עם קטליזטור מתכת - פירוט מלא נמצא בשיעור 9.
חמצון של קשר כפול: מנגנונים ותגובות
תגובת אוזונוליזה: פירוק חמצוני של קשרים כפולים
אוזונוליזה היא תגובה ייחודית המאפשרת שבירה של קשר כפול ויצירת תרכובות קרבוניליות. זוהי התגובה היחידה שלמדנו עד כה המסוגלת לשבור קשר בין שני אטומי פחמן.
מנגנון ותוצרים
כאשר אוזון ($\ce{O3}$) מגיב עם אַלקֵן ($\ce{C=C}$), הקשר הכפול נשבר וכל פחמן מקבל קבוצת קרבוניל:
-
פחמן מותמר בשני פחמנים הופך לקטון
\[\ce{R2C=CR2 + O3 -> R2C(=O)-CR2(=O)}\] \[\begin{array}{ccc} & \text{Ketones} & \\[6pt] & \textcolor{red}{\ce{O}} & \\[-6pt] & \vert \vert \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R1}} \quad \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt] \end{array}\] -
פחמן מותמר בפחמן אחד ומימן הופך לאלדהיד
\[\ce{RCH=CR2 + O3 -> RCHO + R2C(=O)}\] \[\begin{array}{ccc} & \text{Aldehyde} & \\[6pt] & \textcolor{red}{\ce{O}} & \\[-6pt] & \parallel \\[-6pt] & \ce{C} & \\[-6pt]& \overset{\quad \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{H}} & \\[-6pt]\end{array}\]
התוצר הסופי תלוי בתנאי העבודה:
בתנאים מחזרים (בנוכחות $\ce{Zn}$ או $\ce{Me2S= (CH3)2S}$):
- נוצרים אלדהידים וקטונים (בתמונה - הקבוצה השמאלית בתוצר היא אלדהיד, והימנית היא קטון). כלומר, השמאלית הייתה במקור הפחמן שמסומן ב3, והימנית הייתה במקור הפחמן שמסומן ב2 שמחובר לעוד קבוצת מתיל.
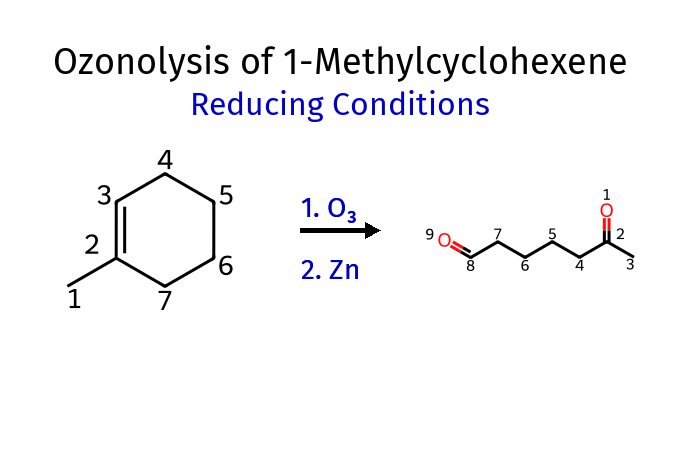
בתנאים מחמצנים (בנוכחות $\ce{H2O2}$):
-
אלדהידים מתחמצנים לחומצות קרבוקסיליות
\[\begin{array}{ccc} & \text{Carboxylic Acids} & \\[6pt] & \textcolor{red}{\ce{O}} & \\[-6pt] & \vert \vert \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R1}} \quad \quad \overset{\diagdown \quad}{\textcolor{red}{\ce{OH}}} & \\[-6pt] \end{array}\] -
קטונים נשארים ללא שינוי
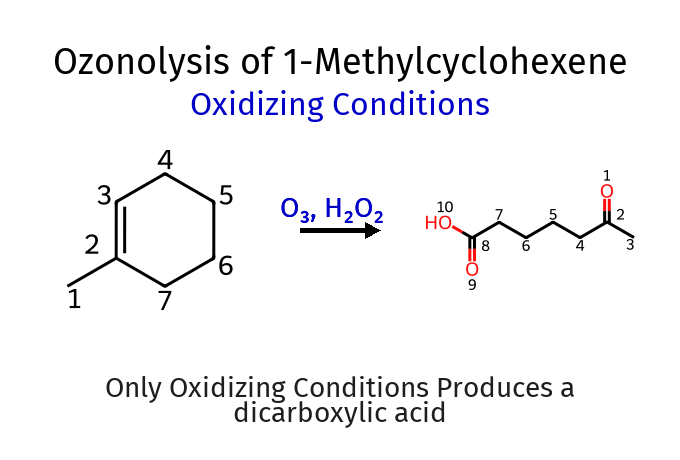
אזהרות בטיחות
תגובת האוזונוליזה היא תגובה אקסותרמית מאוד ויש לבצעה בטמפרטורה של $-78°C$ תחת בקרה קפדנית. חוסר זהירות עלול להוביל לפיצוץ ולפציעות חמורות.
חמצון עם $\ce{KMnO4}$: יצירת דיולים
הוספת שני חמצנים לקשר כפול
תגובה עם $\ce{KMnO4}$ (אשלגן פרמנגנט) מאפשרת הוספת שתי קבוצות הידרוקסיל לקשר כפול ביצירת ציס-דיול:
\[\ce{RCH=CHR' + KMnO4 -> RCH(OH)-CH(OH)R'}\]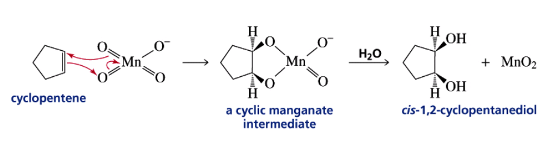
שתי קבוצות ה-$\ce{OH}$ נוספות מאותו צד של הקשר הכפול (סיפוח סין), מה שמוביל לסטריאוכימיה ציס. התגובה עוברת דרך יצירת טבעת ביניים מחומשת שכוללת את המנגן.
שאלה 1: כיצד תבצעו את התגובה הבאה
חשוב:
איך מעלימים קבוצות פונקציונאליות?
עושים חיזור - סיפוח מימנים על קשר כפול.
קשר כפול אפשר לעשות דרך E1 או E2.
במקרה שלנו יש כוהל - רק E1.
אבל אפשר דהידרציה - בסביבה חומצית.
אפשר לעשות בכהלים אך ורק מנגנון של E1 בתנאים מאוד ספציפיים: חומצה חזקה וחימום.
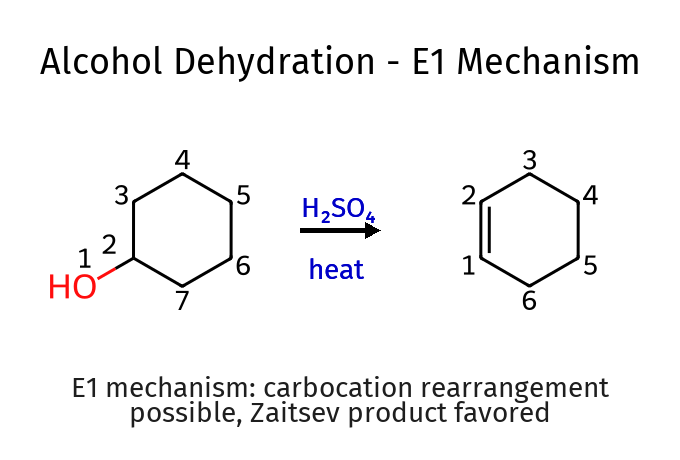
התשובה:
\[\ce{->[H2SO4, heat] ->[H2 / Pd]}\]שאלה 2: כיצד תבצעו את התגובה הבאה
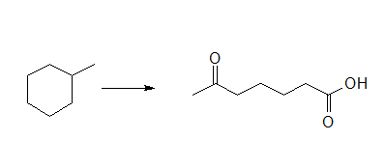
מהסוף להתחלה - אפשר לזהות ניתוק של קשר ומכך להסיק אוזונליזה (התגובה היחידה שלמדנו שמפרקת קשר בין שני פחמנים).
כדי ליצור את הקשר הכפול נתחיל בהלוגנציה רדיקלית על האלקאן:
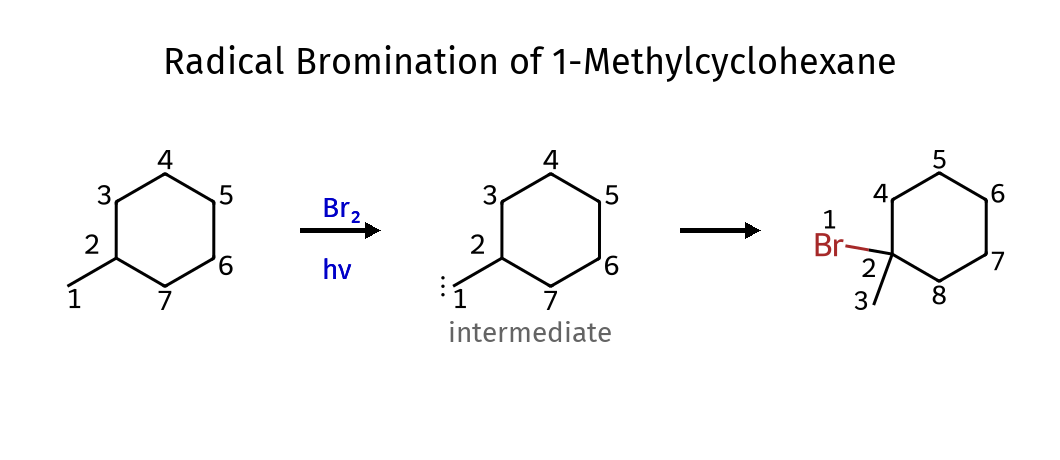
בשלב הבא נמשיך ליצירת הקשר הכפול דרך מנגנון $\text{E2}$:
נשתמש בבסיס חזק וקטן (כי אנחנו רוצים זייצב, שלא יהיה הופמן עיקרי) - למשל $\ce{NaOH}$. (בתמונה אגב חסרה קבוצת מתיל).
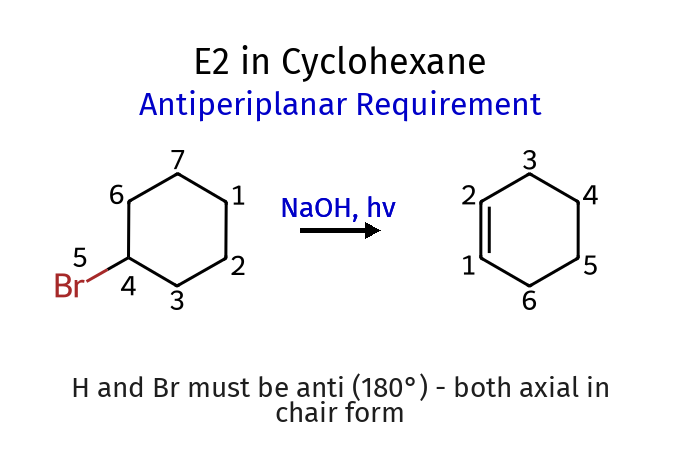
התנאים של האוזונליזה מחמצנים - כי יש חומצה קרבוקסילית בתוצר הסופי.

שאלה 3: מה התוצר בתגובה הבאה?
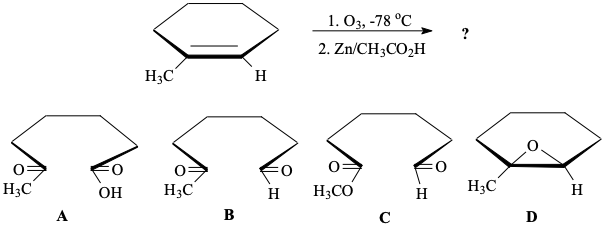
התשובה B.
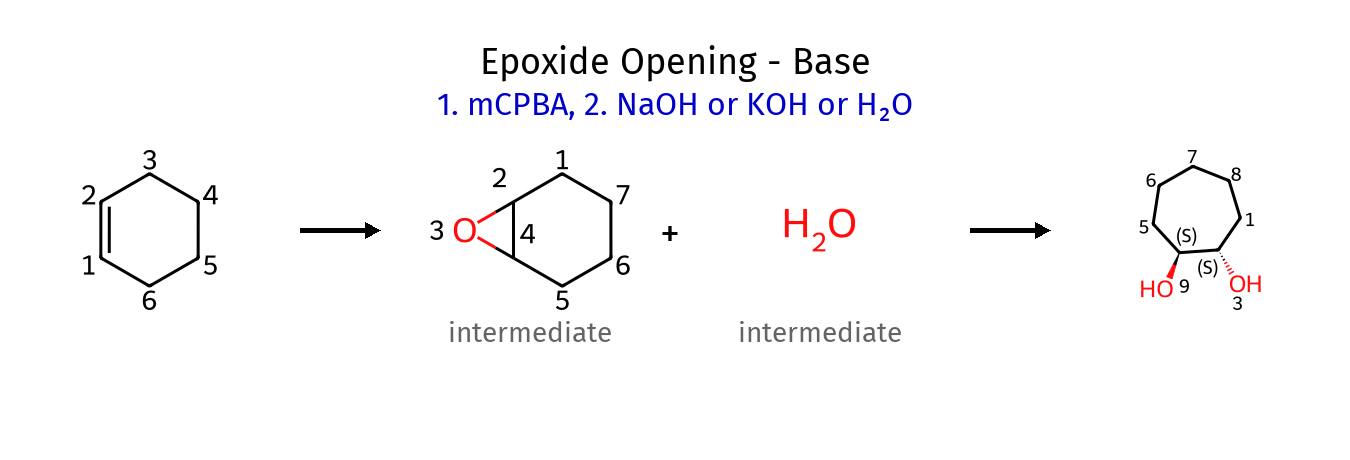
יצירה ופתיחה של אפוקסידים
יצירת אפוקסידים (פחות חשוב)
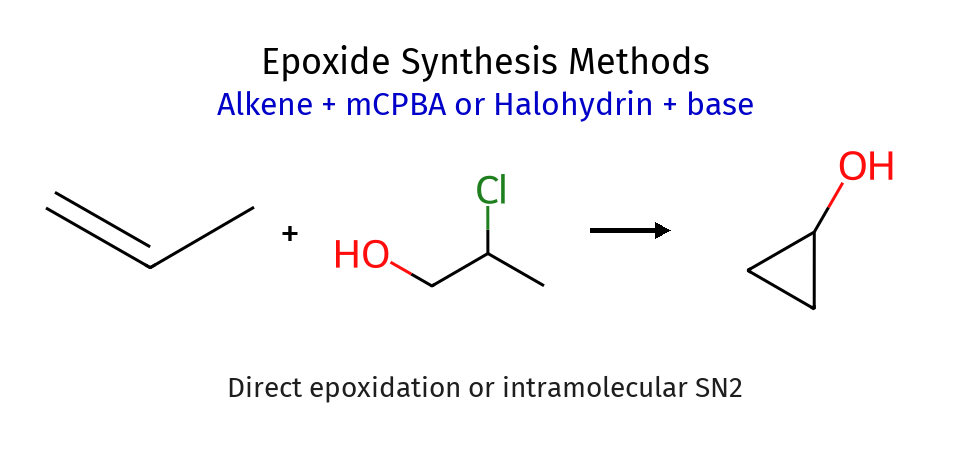
אפוקסידים הם אתרים ציקליים תלת-איבריים המכילים אטום חמצן. הם נוצרים מתגובה חד-שלבית מתואמת בין אַלקֵן לפר-חומצה (כמו $\ce{mCPBA}$ - חומצה מטא-כלורופרבנזואית).
המנגנון כולל התקפה של הקשר הכפול על החמצן האלקטרופילי של הפר-חומצה, תוך יצירת קשר $\ce{C-O}$ ושבירת קשר $\ce{O-O}$. התגובה מתרחשת בצורה סטריאוספציפית - הגיאומטריה של האַלקֵן נשמרת באפוקסיד הנוצר.
תכונות ותגובתיות
אפוקסידים הם אלקטרופילים חזקים בשל:
- מתח זוויות - הזוויות בטבעת התלת-איברית הן כ-60° במקום 109.5° האידיאליות
- אפקט אינדוקטיבי - החמצן מושך אלקטרונים מהפחמנים הסמוכים
שילוב זה הופך את האפוקסידים לרגישים במיוחד להתקפה נוקלאופילית.
פתיחת אפוקסידים (יותר חשוב)
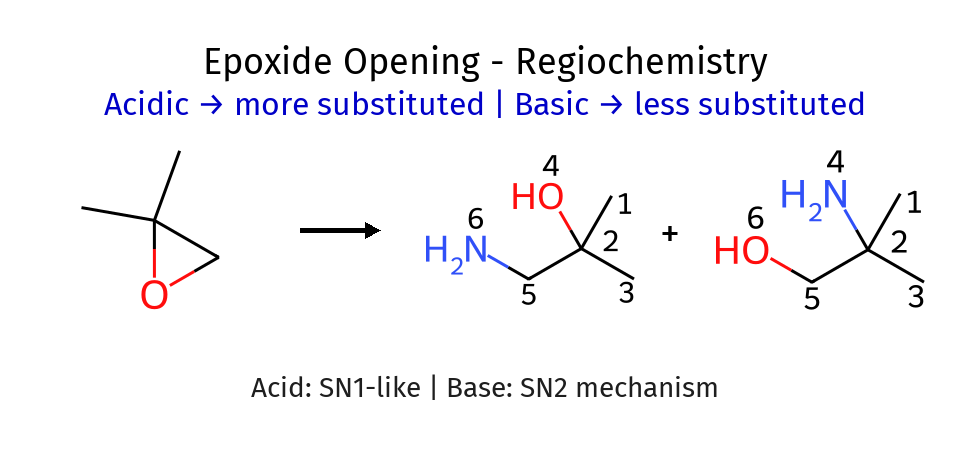
הרגיו-סלקטיביות בפתיחת האפוקסיד תלויה באופן קריטי בתנאי התגובה:
תנאים בסיסיים (מנגנון $\ce{S_N2}$)
בנוכחות נוקלאופיל חזק, ההתקפה מתרחשת ישירות על הפחמן הפחות מותמר (מינימום הפרעה סטרית):
\[\ce{Nu^- + R2C-CHR -> Nu-CR2-CH(O^-)R -> Nu-CR2-CH(OH)R}\] \[\quad\quad\quad\quad\quad\backslash\quad/\] \[\quad\quad\quad\quad\quad\quad\ce{O}\]תנאים חומציים (מנגנון דמוי-$\ce{S_N1}$)
החמצן עובר תחילה פרוטונציה, והופך לקבוצה עוזבת טובה. הנוקלאופיל החלש תוקף את הפחמן היותר מותמר, שם צפיפות המטען החיובי גבוהה יותר:
\[\ce{R2C-CHR + H^+ -> R2C-CHR}\] \[\quad\backslash\quad/\quad\quad\quad\quad\quad\quad\backslash\quad/\] \[\quad\quad\ce{O}\quad\quad\quad\quad\quad\quad\quad\ce{O^+H}\] \[\ce{Nu-H + R2C-CHR -> Nu-CR2-CH(OH)R}\] \[\quad\quad\quad\quad\quad\backslash\quad/\] \[\quad\quad\quad\quad\quad\quad\ce{O^+H}\]נקודה חשובה: בשני המקרים ההתקפה מתרחשת מהצד הנגדי לחמצן (אנטי), והתוצר הסופי הוא תמיד אלכוהול עם הנוקלאופיל בעמדה אנטי לקבוצת ההידרוקסיל (180 מעלות).
שאלה 4: מה התוצר בתגובה הבאה?
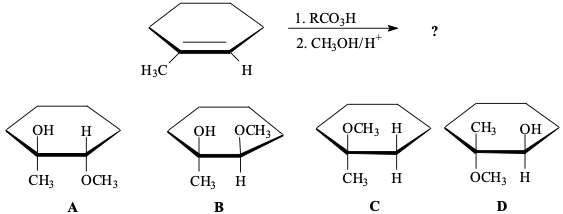
התשובה הנכונה היא $\mathrm{D}$.
בשלב הראשון נוצר אפוקסיד מהקשר הכפול עם $\ce{RCO3H}$.
בשלב השני תוקף אותו בתנאים חומציים.
מכאן שהפחמן היותר מותמר הוא זה שנתקף.
התוקף הוא מתנול ($\ce{CH3OH}$), ולכן התוצר הסופי הוא מתוקסיד.
נצפה למצוא תוצר שבו המתנול יושב על הפחמן עם המתיל (הפחמן המותמר יותר), וה-$\ce{OH}$ יושב על הפחמן השני. היחס בין ה-או-מטיל (מה שנשאר מהמתנול) צריך להיות אנטי.
$\ce{OCH3}$ צריך לשבת איפה שהמתיל.
שאלה 5: כיצד נבצע את התגובות הבאות
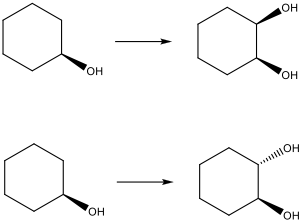
שתי תגובות על אותו התוצר - אחד יוצר ציס דיול, והשני אנטי.
שתי התגובות עובדות על קשר כפול, אז בשלב הראשון נעשה הידרציה כדי ליצור קשר כפול:

בשלב השני:
בשביל הראשונה נשתמש ב-$\ce{KMnO4}$, שמוסיף שני חמצנים באותו צד של הקשר הכפול (סיפוח סין). נקבל ציס דיול.
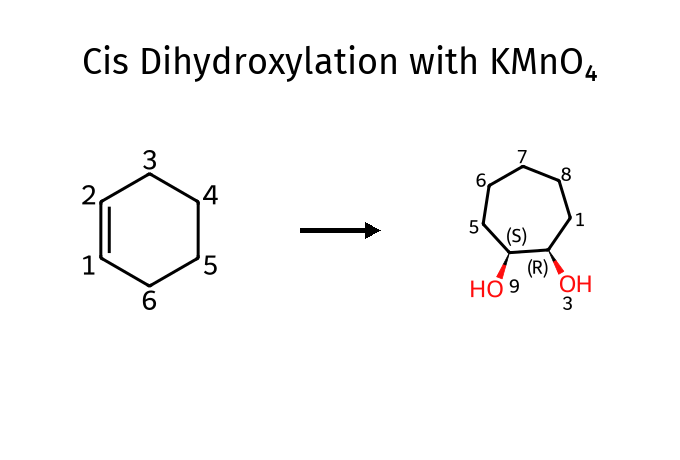
בשביל השנייה נשתמש ב-$\ce{mCPBA}$, שמייצרת אפוקסיד, ואז נתקוף עם מים או $\ce{NaOH}$ - משהו שיתן $\ce{OH-}$, שיובילו לפתיחת האפוקסיד והוספת שני חמצנים בעמדות אנטי.
תגובות אלקינים
אלקינים, המכילים קשר משולש בין פחמנים, מגיבים בתגובות סיפוח דומות לאלקנים, אך עם מספר הבדלים חשובים. ניתן לבצע סיפוח אחד (ליצירת אַלקֵן) או שני סיפוחים (ליצירת אלקאן). חלק מהתגובות ניתנות לעצירה אחרי סיפוח אחד, בעוד שאחרות ממשיכות אוטומטית עד לסיפוח מלא.
חיזור קטליטי של אלקינים
חיזור מלא לאלקאן - הידרוגנציה hydrogenation
חיזור עם $\ce{H2}$ בנוכחות זרז פלדיום ($\ce{Pd}$) מוביל לחיזור מלא של האלקין לאלקאן. התגובה אינה ניתנת לעצירה בשלב הביניים:
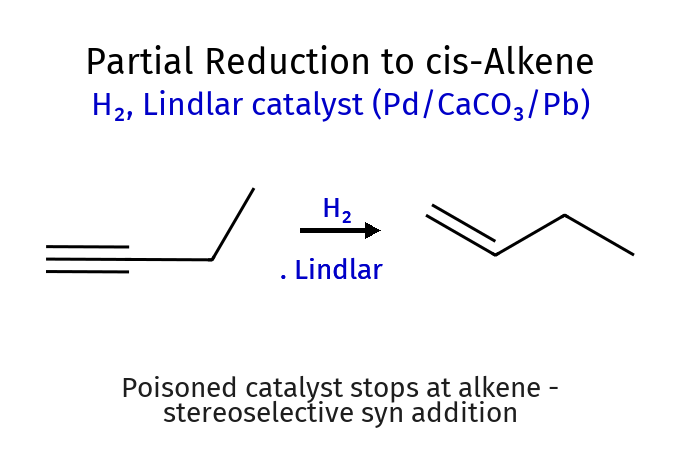
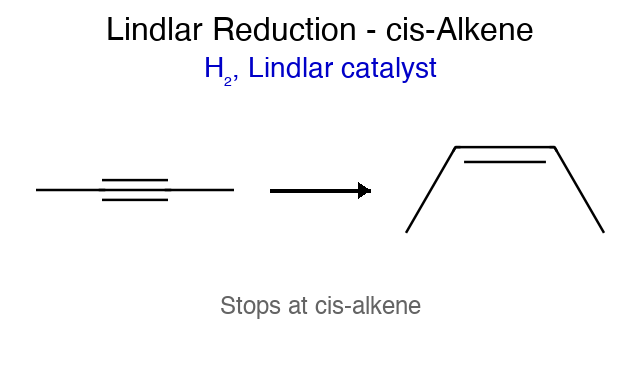
\[\ce{RC#CR' ->[\ce{H2/Pd}] RC=CR' ->[\ce{H2/Pd}] RCH2-CH2R'}\]חיזור חלקי עם זרז לינדלר
כדי לעצור את החיזור בשלב האַלקֵן, משתמשים בזרז לינדלר (Lindlar’s catalyst) - זרז פלדיום מורעל המאפשר חיזור סלקטיבי:
\[\ce{RC#CR' ->[\text{Lindlar}] RCH=CHR'}\]שני אטומי המימן נוספים מאותו צד (סיפוח סין), ולכן נוצר אַלקֵן בעל קונפיגורציה ציס.
 |  |
סיפוח HBr לאלקינים (Hydrohalogenation)
סיפוח $\ce{HX}$ לאלקינים מתרחש לפי כלל מרקובניקוב, עובר דרך קרבוקטיון ויניל. התגובה ניתנת לעצירה אחרי סיפוח אחד:
\[\ce{RC#CH ->[\ce{HBr}] RC(Br)=CH2}\]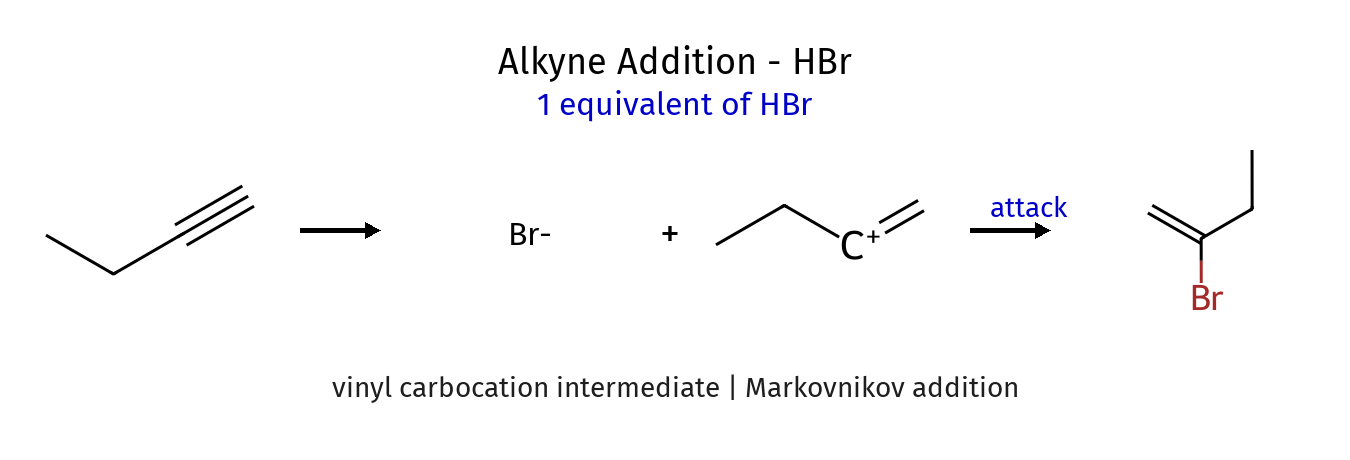
עם עודף של $\ce{HBr}$, מתרחש סיפוח נוסף כאשר שני אטומי הברום מתחברים לאותו פחמן:
\[\ce{RC(Br)=CH2 ->[\ce{HBr}] RC(Br)2CH3}\]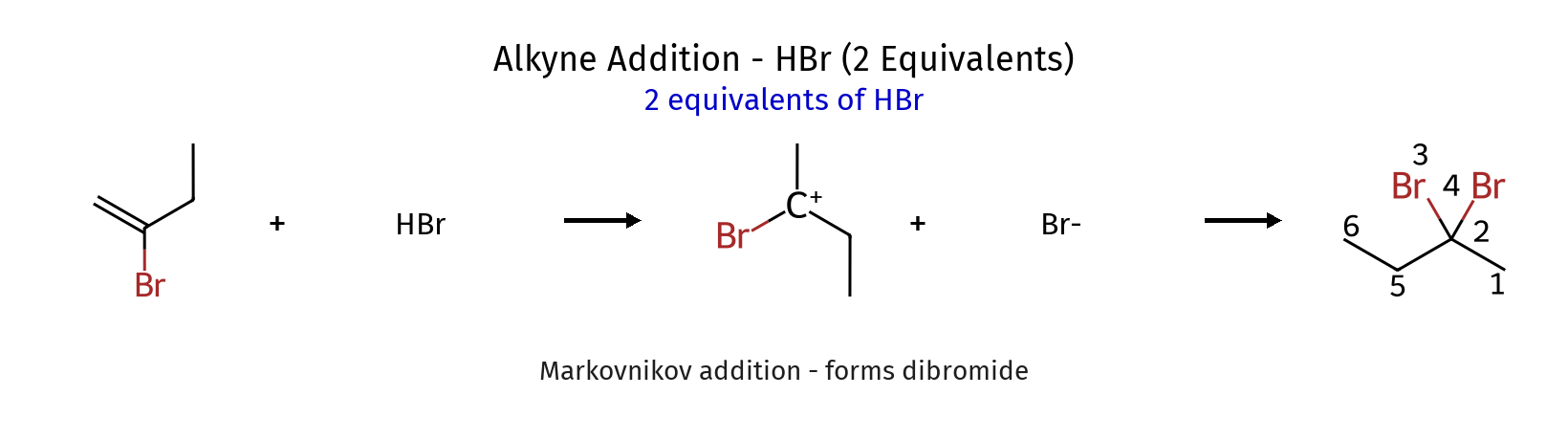
התופעה נובעת מיציבות יוצאת דופן של קרבוקטיון עם ברום סמוך, הנובעת מאפקט רזונטיבי.
סיפוח הלוגנים $\ce{X2}$ לאלקינים (Halogenation)
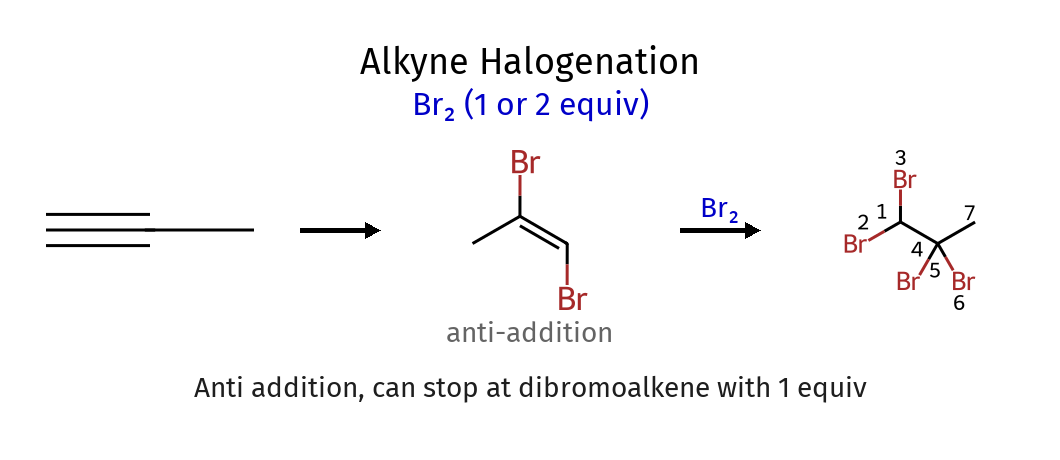
סיפוח של $\ce{X2}$ מתרחש דרך יון הלוניום מגושר, בדומה לאלקנים. ניתן לעצור את התגובה אחרי סיפוח אחד:
\[\ce{RC#CR' ->[\ce{Br2}] RC(Br)=C(Br)R'}\]שני אטומי הברום נמצאים בעמדות אנטי זה לזה. עם עודף של $\ce{Br2}$, מתקבל טטרהלואלקאן.
הידרציה של אלקינים - יצירת קטונים
הידרציה של אלקינים בקטליזה חומצית מובילה תחילה ליצירת אנול (אלכוהול ויניל):
\[\ce{RC#CH ->[\ce{H2O/H^+}] RC(OH)=CH2}\]אנולים אינם יציבים ועוברים טאוטומריזציה מהירה לצורת הקטו היציבה יותר:
\[\ce{RC(OH)=CH2 <=> RC(=O)CH3}\]התהליך מכונה טאוטומריזציה קטו-אנול, ושיווי המשקל נוטה באופן מובהק לכיוון הקטון. חשוב להדגיש שהפחמן שנושא את קבוצת ה-$\ce{OH}$ באנול הוא זה שהופך לפחמן הקרבונילי בקטון.
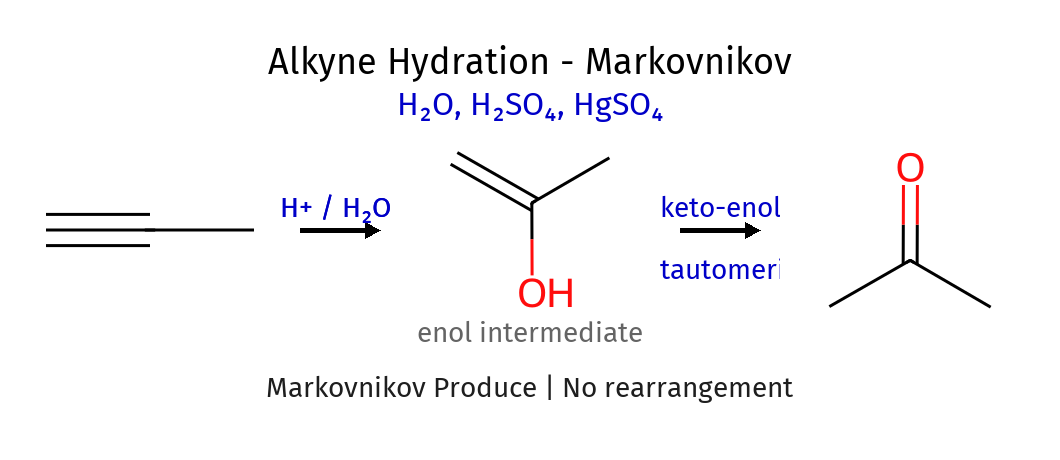
אלקינים טרמינליים - תגובות ייחודיות
חומציות פרוטון אצטילני
אלקינים טרמינליים ($\ce{RC#C-H}$) מתאפיינים בחומציות יחסית של הפרוטון הקשור לפחמן $sp$. ערך ה-$pK_a$ של פרוטון אצטילני הוא כ-25, נמוך משמעותית מאלקאנים ($pK_a \approx 50$) ואלקנים ($pK_a \approx 44$).
החומציות המוגברת נובעת מהאופי ה-$s$ הגבוה של האורביטל $sp$ ($50\%$ אופי $s$), שמקרב את צפיפות האלקטרונים לגרעין ומייצב את האניון הנוצר.
יצירת אצטילידים והארכת שרשרת
בסיסים חזקים כמו $\ce{NaNH2}$ (נתרן אמיד) מסוגלים לקטוף את הפרוטון האצטילני:
\[\ce{RC#C-H + NaNH2 -> RC#C^- Na^+ + NH3}\]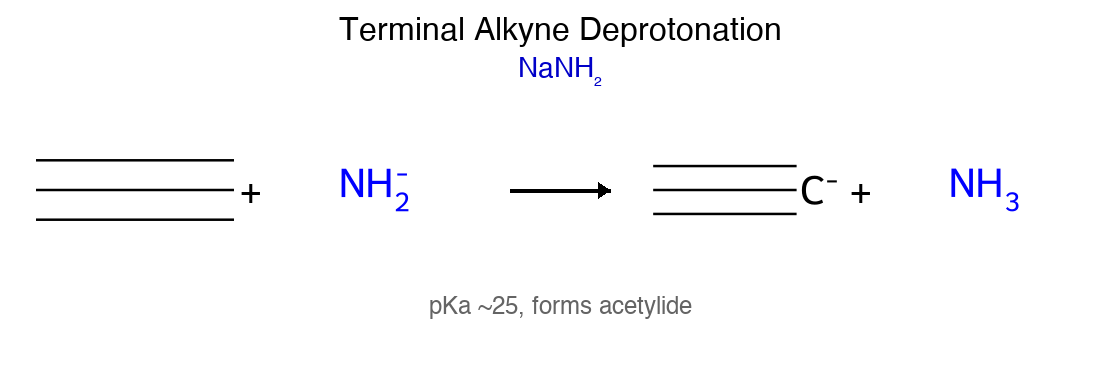
האניון האצטילידי שנוצר הוא נוקלאופיל חזק ויכול להגיב בתגובות $\ce{S_N2}$ עם אלקיל הלידים ראשוניים:
\[\ce{RC#C^- + R'CH2Br -> RC#C-CH2R' + Br^-}\]התגובה של $\ce{RC#C^-}$ מאפשרת הארכת שרשרת פחמנית ויצירת אלקינים פנימיים. השימוש באלקיל הלידים ראשוניים הכרחי כדי למנוע תגובות אלימינציה מתחרות.
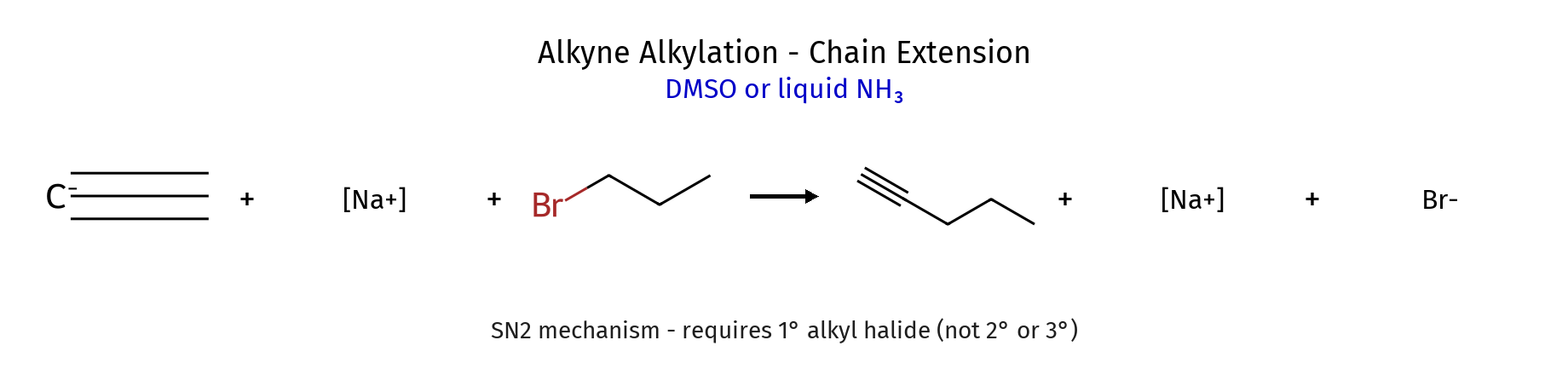
שיקולים סינתטיים
בעת תכנון סינתזה המערבת אלקינים, יש לשקול:
- סלקטיביות במולקולות לא סימטריות - כאשר קיים יותר מקשר משולש אחד, יש לוודא שהתגובה מתרחשת במיקום הרצוי
- בקרה על מספר הסיפוחים - בחירת ריאגנטים ותנאים המאפשרים עצירה בשלב הרצוי
- סטריאוכימיה - הבנת האם התוצר יהיה ציס או טרנס, סין או אנטי
שאלות לתרגול
שאלה 5: מה התוצר של התגובה הבאה?
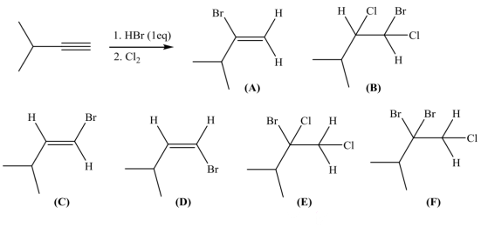
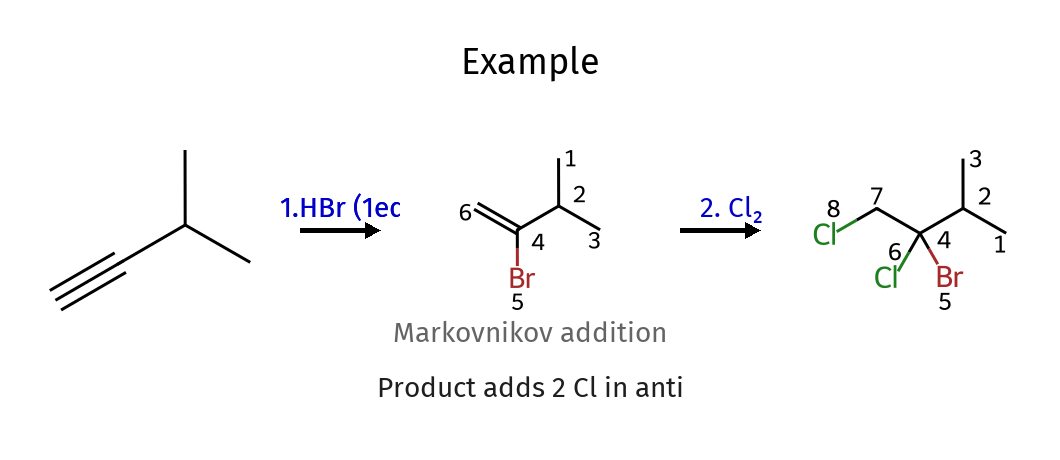
התשובה הנכונה היא $\mathrm{E}$.
בשלב ראשון הקשר המשולש הופך לאלקן דרך $\ce{HBr (1eq)}$.
לאחר מכן מתבצע סיפוח של $\ce{Cl2}$.
שאלה 6: מה התוצר של התגובה הבאה?
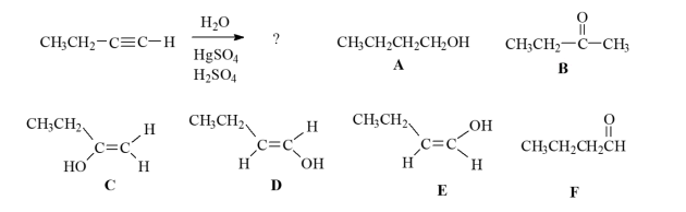
הערה: $\ce{HgSO4}$ מיותר, לפי ההסבר בשיעור. מה שחשוב לזהות בתגובה הזאת זה מים עם $\ce{H2SO4}$ על אלקיל.
התשובה הנכונה היא $\mathrm{B}$.
בשלב ראשון נוספים $\ce{OH}$ ו-$\ce{H}$ על הקשר המשולש, מה שמוביל ליצירת אנול: $\ce{OH}$ על הפחמן היותר מותמר, ו-$\ce{H}$ על הפחות מותמר.
המים נוספים דרך מנגנון קרבוקטיון.
H OH H
/ \ /
[+]== -> ==
/ \ / \
__/ H __/ H
בשלב שני, האנול עובר טאוטומריזציה לקטון, כאשר הפחמן היותר מותמר נשאר עם קבוצת הקרבוניל.
OH H O H
\ / \\ /
== -> -- ---H
/ \ / \
__/ H __/ H
שאלה 7: השלם חומר מוצא
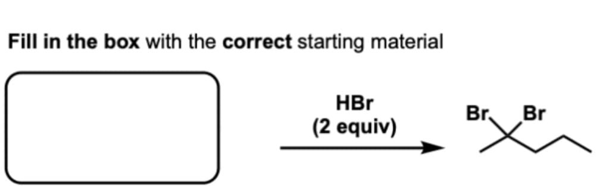
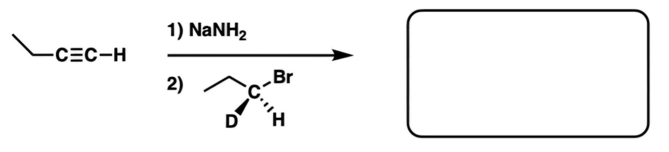
שאלה 8: מה התוצר העיקר בתגובה הבאה?
אתרים
\[\begin{array}{ccccc} & : & & : & \\ & & \ce{O} & & \\ & \diagup & & \diagdown & \\ \ce{R} & & & & \ce{R'} \\ \end{array}\]דומים למים ($\ce{H2O}$), ולאלכוהולים ($\ce{R-OH}$), אבל עם שני פחמנים במקום אחד.
הסיבה שאתרים הם לא נוקלאופילים טובים היא שאין להם עם מי לתקוף - כשהאחרים תוקפים החמצן נהיה בפלוס, ואז צריך לקטוף לו פרוטון (להחזיר לו אלקטרונים) שיחזור להיות נייטרלי.
לכן כשמים תקפו התוצר היה כוהל.
כשכוהל תקף התוצר היה אתר.
אין לנו איך לנטרל חמצן עם שלושה קשרים.
במעבדה אתר הוא בדרך כלל רק ממס, ולא שימושי הרבה יותר מזה.
סינתוז אתרים - Williamson Ether Synthesis (סינתזת ויליאמסון)
ניקח כוהל ונשים אותו עם בסיס - נקבל $\ce{R-O^-}$ (אלקוקסיד - alkoxide).
האלקוקסיד הוא נוקלאופיל (בסיס) חזק, ולכן הוא יכול לתקוף אלקיל הליד ראשוני (או שניוני) דרך מנגנון $\ce{S_N2}$:
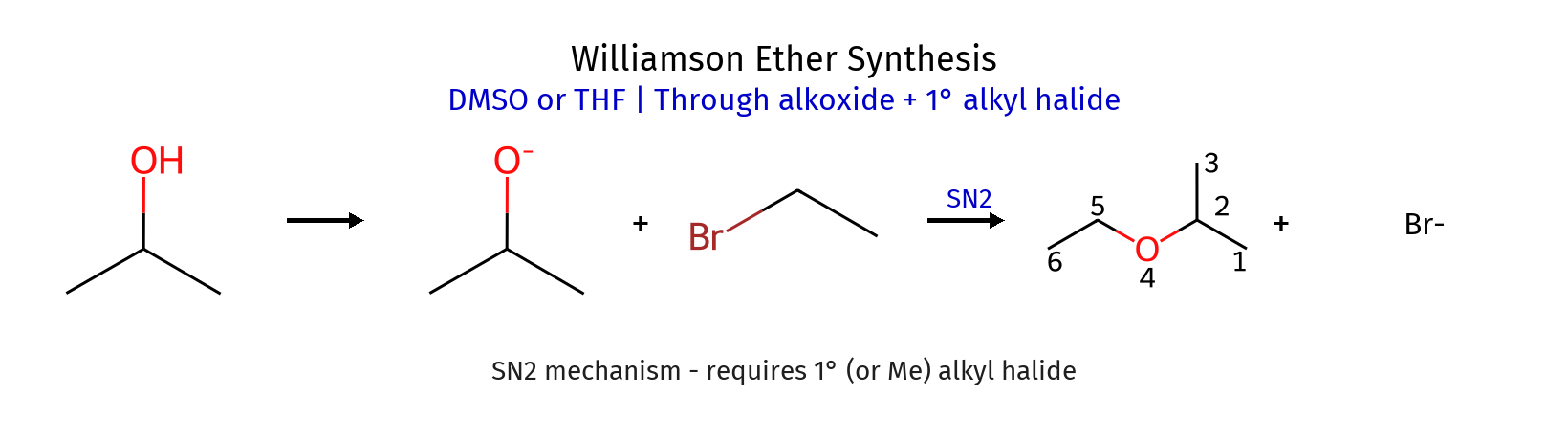
דרך נוספת היא סיפוח כהל לקשר כפול או תגובת SN1 עם כהל (כאשר כהל תוקף, התוצר הוא אתר)
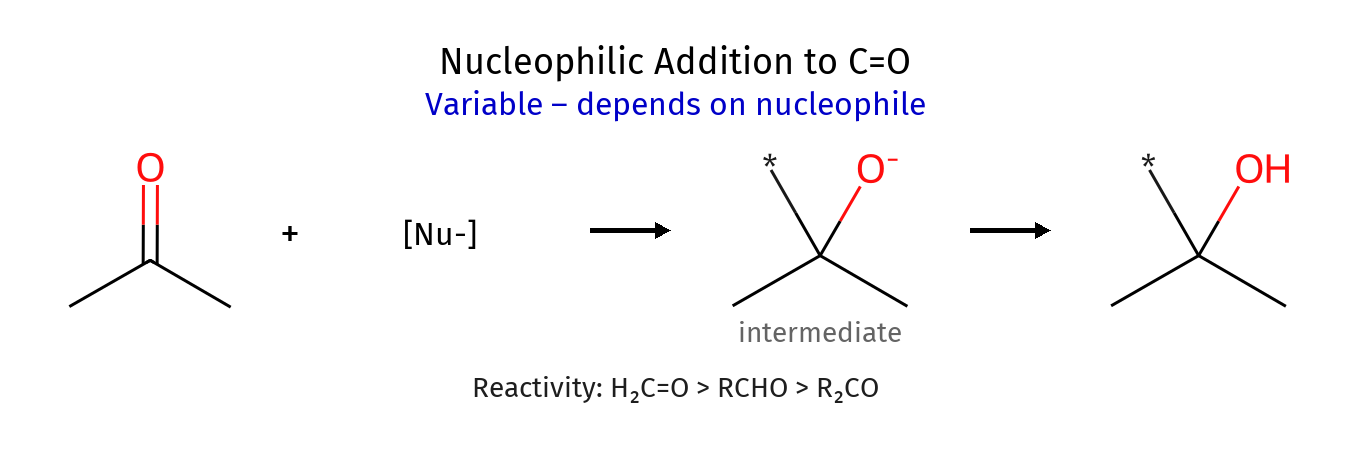
כהלים
תכונות של כהלים
כמו מים, כהלים במצבם הניטרלי (ROH) הם גם חומצה וגם בסיס חלש.
בסביבה חומצית, הכהל משמש כבסיס וקוטף פרוטון (פרוטונציה) לקבלת יון האוקסוניום (קבוצה עוזבת טובה)
בסביבה בסיסית, הכהל משמש כחומצה שנקטף ממנו הפרוטון (דה פרוטונציה).
הכנה של כהלים
תגובות שכבר למדנו:
- התמרה עם $\ce{OH}$ או מים -
- $\ce{R-X + H2O -> R-OH + HX}$
- $\ce{R-X + OH- -> R-OH + X-}$
- סיפוח מים לקשרים כפולים בקטליזה חומצית (הידרציה) -
- $\ce{H2O}$ תוקף את הקטון, ויוצר אנול, שעובר טאוטומריזציה לקטון.
תגובה חדשה: גריניאר
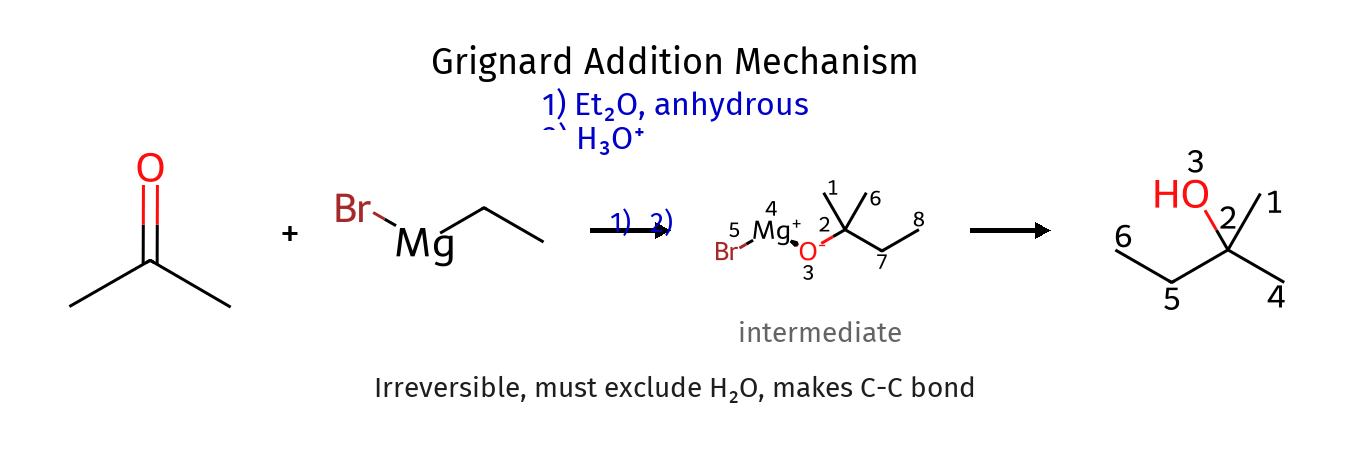
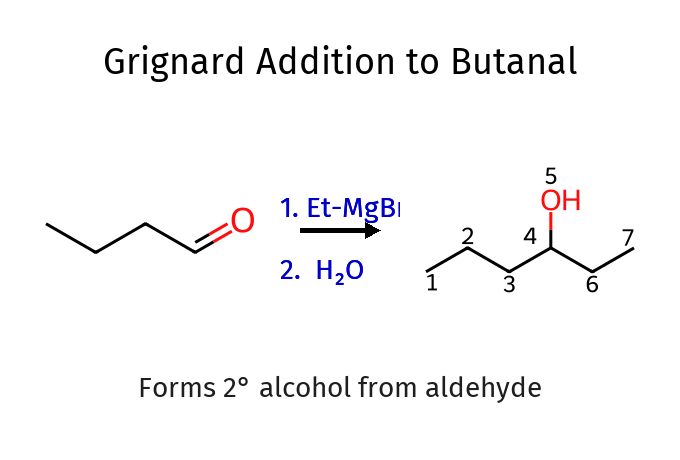
תגובת גריניאר - הכנת כהלים והארכת שרשרת
גריניאר הינו מגיב מאוד חשוב בכימיה אורגנית. בין הדרכים הבודדות להפוך פחמן לנוקלאופיל.
גריניאר תוקף רק פחמנים בהכלאה של SP2 כמו קרבונילים ואפוקסידים.
כמו שגריניאר הוא נוקלאופיל חזק, הוא גם בסיס מאוד חזק ולכן אסור שיהיו פרוטונים חומציים בקרבתו.
ההכנה פחות מהותית לנו (קשר אוגנו-מתכתי).
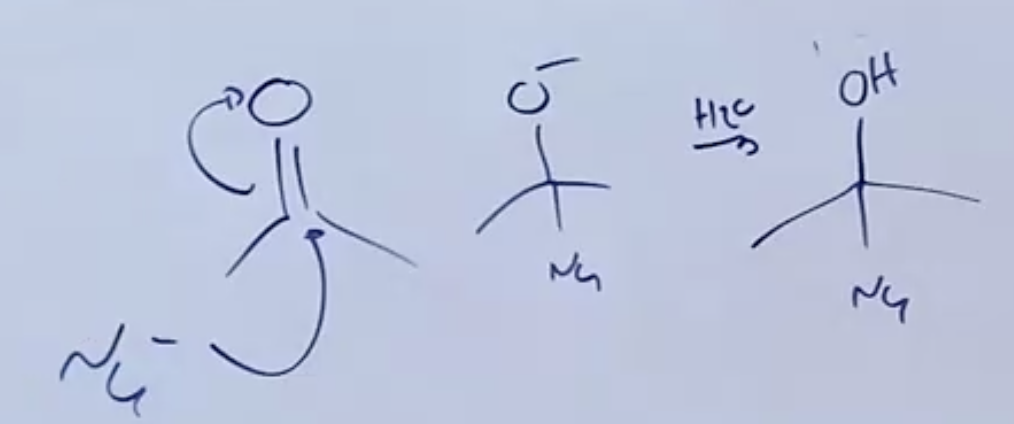
הגריניאר תוקף את הפחמן הקרבונילי ומעלה זוג אלקטרונים לכיוון החמצן. רק לאחר סיום התגובה הראשונה, מוסיפים מים על מנת להחזיר את האלקטרונים לחמצן (לנטרל אותו - פרוטונציה), ולקבל כהל.
 |  |  |
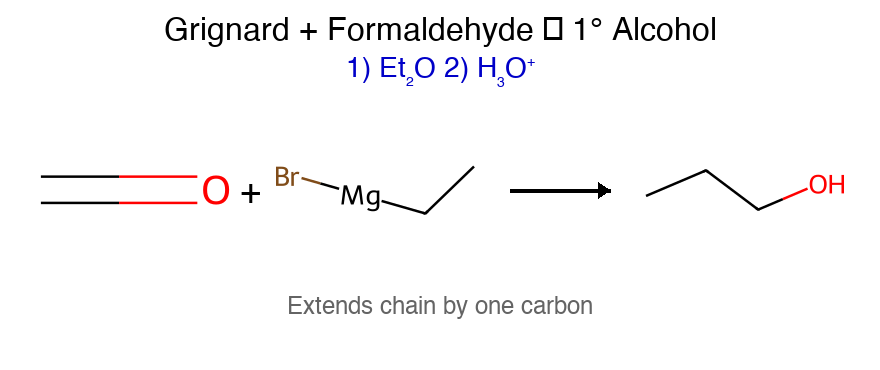
שאלה 9
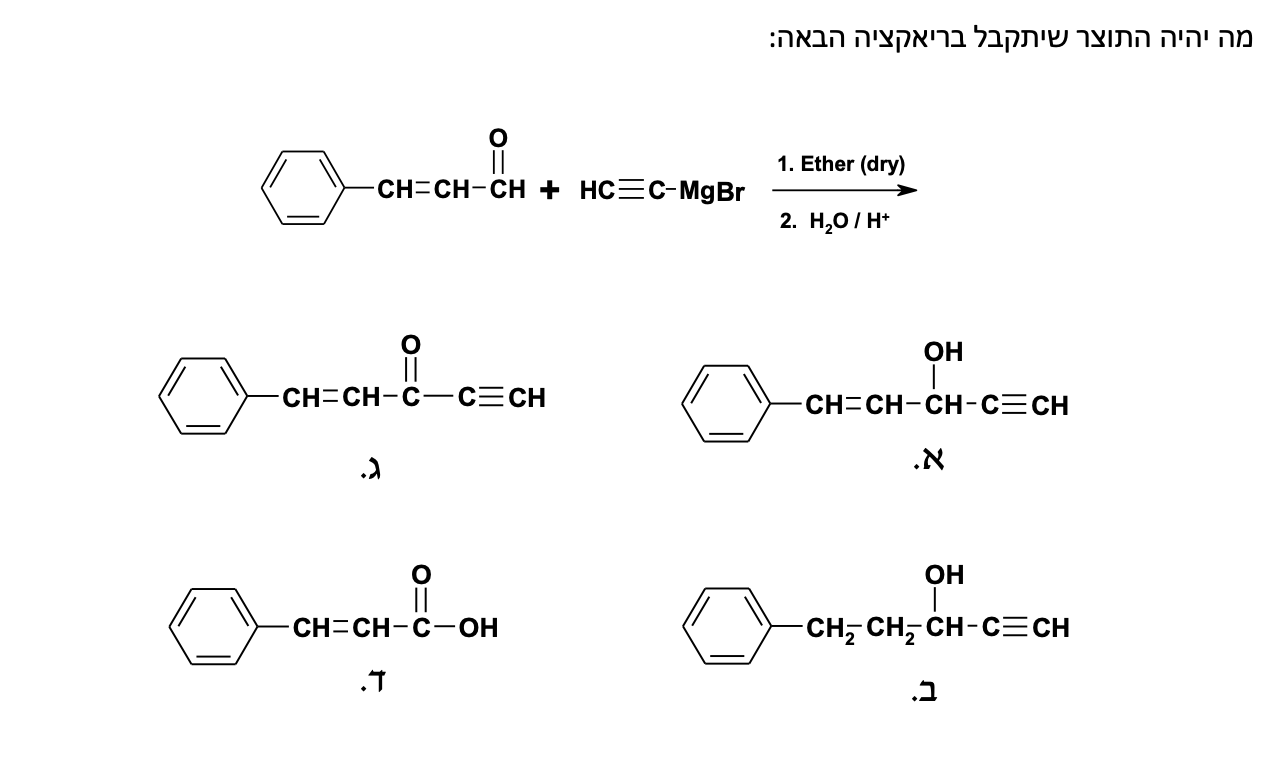
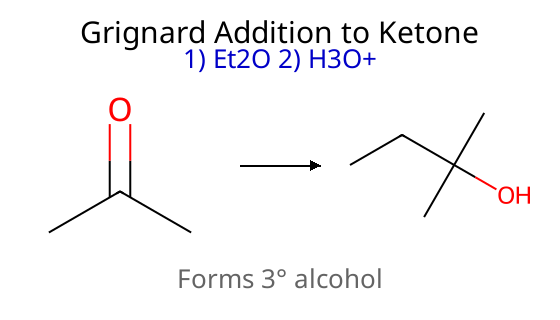
התשובה הנכונה היא (א) - ריאקציית גריניאר שמתחילה עם קטון ובסיום הידרוליזה חומצית. רק בתשובה (א) מתקבל כהל שלישוני, בעוד שבשאר התשובות מתקבלים כוהלים ראשוניים או שניוניים (עם שאר הרכיבים המקוריים כמו שהיו).
החלק שמתווסף:
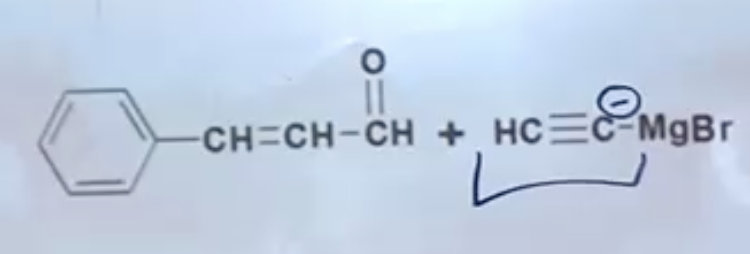
שאלה 10
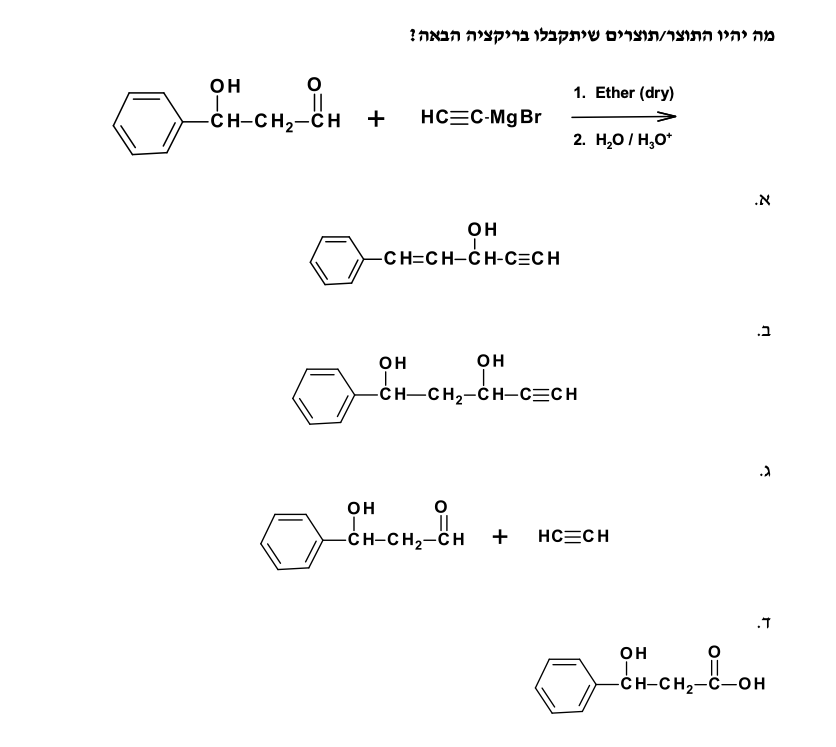
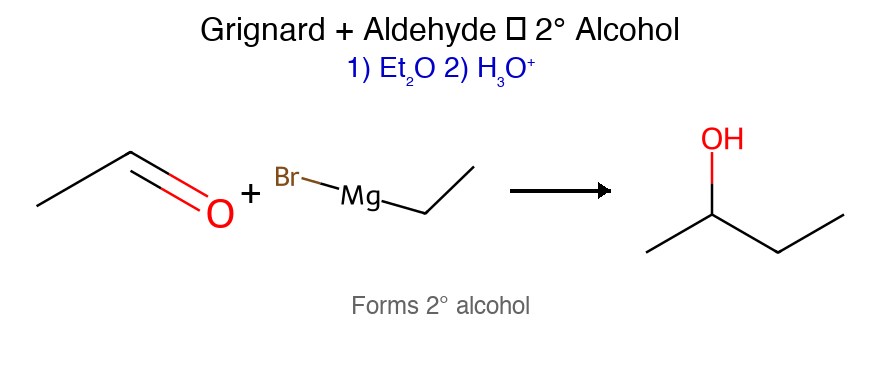
התשובה הנכונה היא (B) - בתרגיל הזה יש לנו ריאקציית גריניאר עם מולקולה שמכילה גם קבוצת אלכוהול וגם קבוצת קרבוניל (קטון).
התגובה מתחילה עם התקפה של גריניאר על הקטון, ולאחר מכן הידרוליזה חומצית. התוצר הסופי הוא כהל שניוני עם קבוצת אלכוהול וקטון.
קבוצת האלכוהול ($\ce{OH}$) לא מגיבה, אבל אם היו מים בשלבים הראשונים — הגריניאר היה מתפרק.
שאלה 11
מה יהיה תוצר העיקר בתגובה הבאה?
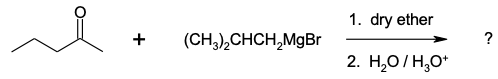
התשובה הנכונה היא (A) - התגובה היא גריניאר
קטון: $\ce{CH3CO(CH2CH2CH3)}$ ← כלומר 2-פנטנון (ketone, 5-carbon chain).
תרכובת גריניאר:
$\ce{(CH3)2CHCH2MgBr}$
איזובוטיל מגנזיום ברומיד (isobutylmagnesium bromide)
הגריניאר תוקף את הפחמן הקרבונילי (נוקלאופיל),
הפחמן הקרבונילי הופך לאלכוהול שניוני.
נבנה שלד פחמני חדש: פחמן הגריניאר מתווסף לפחמן של הקטון.
הרכבת השלד הסופי:
הקטון המקורי הוא:
CH3–CO–CH2CH2CH3
|
C=O ← ההתקפה כאן
הגריניאר:
CH2
|
(CH3)2CH–
לאחר התקפה ופרוטונציה, נוצר:
CH3–CH(OH)–CH2–CH2–CH(CH3)2
↑ ↑
פחמן 4 פחמן 2
זהו 2,4-dimethyl-4-heptanol.
פחמן קרבונילי ← אלכוהול.
חיזור קרבונילים - הוספת מימנים בעזרת הידרידים
הידריד ($\ce{H^-}$) = מוסיף מימנים = מחזר
איך זה עובד:
קרבוניל (C=O) + הידריד (H⁻) → כהל (C-OH)
- $\ce{LiAlH4}$ = מקור להידריד חזק
- $\ce{NaBH4}$ = מקור להידריד מתון
💡 “הידריד = יון מימן עם זוג אלקטרונים = נוקלאופיל שמחזר”
כמו שגריניאר תוקף קרבונילים (מוסיף פחמנים , וכל התקפה על קטון ואלדהיד נותנת כוהל), אותה תגובה ניתן לעשות בעזרת מגיב מיוחד - חיזור - הוספת מימנים.
צריך מימן נוקלאופילי = מימן שטעון במינוס - = הידריד.
חיזור קרבונילים - $\ce{LiAlH4}$ ו$\ce{NaBH4}$
מי שמספקים הידרדים הם או $\ce{LiAlH4}$ (ליתיום אלומיניום הידריד) או $\ce{NaBH4}$ (סודיום בורוהידריד).
חיזור = הוספת מימנים.
 |  |
| ריאגנט | חוזק | מה מחזר | ממס | תוצר |
|---|---|---|---|---|
| $\ce{NaBH4}$ | מתון | רק קטונים ואלדהידים | מתנול/אתנול | כהל |
| $\ce{LiAlH4}$ | חזק מאוד | הכל (קרבונילים, אסטרים, חומצות) | אתר יבש | כהל |
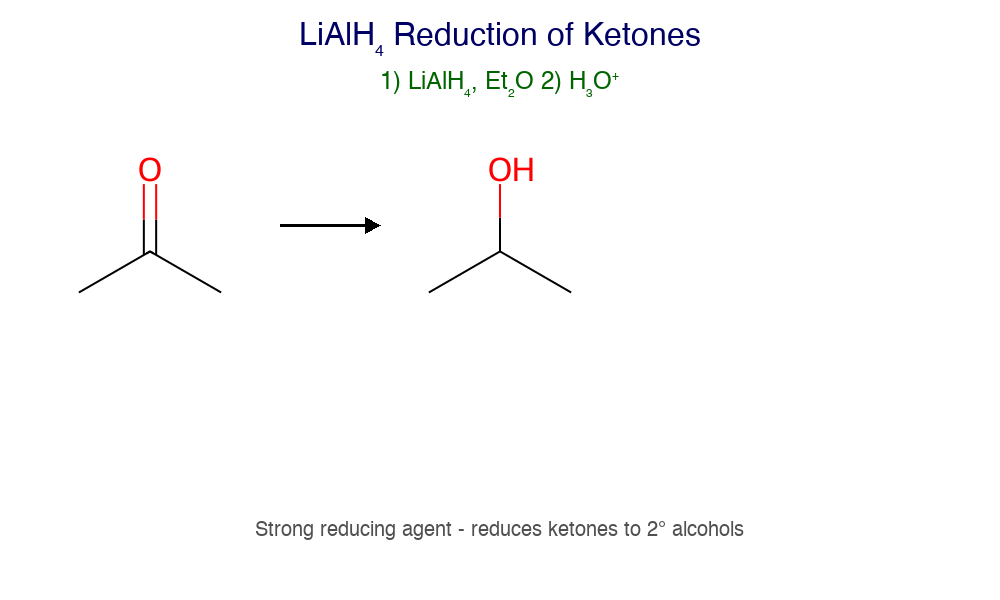
- קטון ← כהל שניוני
- אלדהיד ← כהל ראשוני
- חומצה/אסטר ← כהל ראשוני (רק עם $\ce{LiAlH4}$)
מנגנון:
1. הידריד (H⁻) תוקף קרבוניל → O⁻
2. Work-up עם H₃O⁺ → OH
- ”$\ce{LiAlH4}$ רגיש למים - חייב תנאים יבשים”
- ”$\ce{NaBH4}$ סלקטיבי - לא נוגע באסטרים/חומצות”
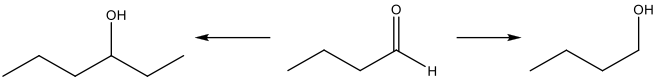
שאלה 12: מי הם הראגנטים לכל תגובה?
 |  |
חיזור עם יון ציאניד $\ce{CN^-}$
תגובה בין קרבוניל לבין $\ce{HCN}$ (ציאניד מימני) יוצרת $\ce{R-C(OH)(CN)-R’}$ - כהל עם קבוצת ציאניד.
דור פסקל