תוכן עניינים:
- חזרה קצרה מהשיעור הקודם
- בקרה על סינתזת חומצות שומן
- הארכה ודה-סטורציה של חומצות שומן
- חומצות שומן חיוניות
- פרוסטגלנדינים ו-COX
- סינתזת טריאצילגליצרולים
- פוספוליפידים לממברנות
- סינתזת כולסטרול
- שינוע שומנים בגוף - ליפופרוטאינים
- טרשת עורקים (Atherosclerosis)
- סיכום נקודות מפתח
- שאלות מומצאות
חזרה קצרה מהשיעור הקודם
בשיעור הקודם דיברנו על יציאת אצטיל-CoA מהמיטוכונדריה. כשיש עודף אנרגיה, ציטראט מצטבר במיטוכונדריה ויוצא לציטופלזמה, שם הוא מתפרק בחזרה לאצטיל-CoA ולאוקסלואצטט. האצטיל-CoA הולך לסינתזת חומצות שומן, והאוקסלואצטט חוזר למיטוכונדריה דרך מלאט ופירובט. בתהליך הזה נוצר $\ce{NADPH}$ מהאנזים Malic Enzyme - וזה מתכתב עם הצורך ב-$\ce{NADPH}$ לסינתזת חומצות שומן.
בקרה על סינתזת חומצות שומן
השלב קובע המהירות (rate limiting step) בסינתזת חומצות שומן הוא הקרבוקסילציה של אצטיל-CoA למלוניל-CoA. האנזים שמבצע את התהליך הוא Acetyl-CoA Carboxylase (ACC) - האנזים עם זרוע הביוטין שזזה מצד לצד.
רגולציה על ידי פוספורילציה
האנזים AMPK (AMP-Activated Protein Kinase) מזרחן את ACC וגורם לו להיות פחות פעיל. כאשר צריך לייצר חומצות שומן, האנזים Protein Phosphatase 2A מסיר את הפוספט והופך את ACC לפעיל.
רגולציה אלוסטרית
-
ציטראט (עודף אנרגיה) מפעיל את ACC - זוהי Forward Activation. עודף ציטראט מסמן שיש לנו הרבה אנרגיה ואנחנו רוצים לכוון את האצטיל-CoA לבניית חומצות שומן.
-
פלמיטאט (התוצר) מעכב את ACC - זהו משוב שלילי. כשיש הרבה פלמיטאט, האנזים מקבל סיגנל להאט.
רגולציה הורמונלית
גלוקגון (הורמון הרעב) מעכב את המסלול של בניית חומצות שומן ומפעיל את האוקסידציה (פירוק) שלהן. הגיוני - במצב של רעב אנחנו צריכים לפרק שומן, לא לבנות אותו.
הארכה ודה-סטורציה של חומצות שומן
נומנקלטורה
כשרואים סימון כמו $18:1\left(\Delta^{9}\right)$, המשמעות היא: חומצת שומן עם 18 פחמנים, קשר כפול אחד, והקשר הכפול נמצא בין פחמן 9 ל-10. המספר מציין את הפחמן שלפני הקשר הכפול.
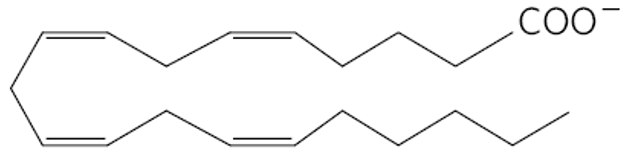
דוגמה נוספת: $20:4 \left(\Delta^{5,8,11,14}\right)$ - זוהי חומצה ארכידונית עם 20 פחמנים ו-4 קשרים כפולים.
מסלולי העיבוד
פלמיטאט (16:0) יכול ללכת לשני כיוונים: דה-סטורציה ליצירת פלמיטאולאט (16:1 Δ9) עם קשר כפול בעמדה 9, או אלונגציה (הארכה) לסטאראט (18:0). הסטאראט יכול להמשיך לאלונגציה או לעבור דה-סטורציה לאולאט (18:1 Δ9).
יצירת קשרים כפולים - Desaturation
יצירת קשר כפול דורשת חמצון - הוצאת מימנים מהשרשרת. התהליך מערב שרשרת מעבר אלקטרונים בציטופלזמה (לא במיטוכונדריה) ודורש חמצן מולקולרי ($\ce{O2}$) ו-$\ce{NADPH}$.
האנזים Fatty Acyl-CoA Desaturase לוקח אלקטרונים מ-$\ce{NADPH}$, מעביר אותם דרך Cytochrome b5 Reductase ו-Cytochrome b5, ובסופו של דבר החמצן מקבל את האלקטרונים ונוצר קשר כפול.
חומצות שומן חיוניות
הבעיה של יונקים
מעמדה 9 והלאה לכיוון קצה המתיל, יונקים לא יכולים לייצר קשרים כפולים. רק צמחים יודעים לסנתז את החומצות הבאות:
-
לינולאט (Linoleate) - 18:2 Δ9,12 - אומגה-6
-
α-לינולנאט (α-Linolenate) - 18:3 Δ9,12,15 - אומגה-3
לכן אנחנו חייבים לאכול את החומצות האלה מהצומח (שמן זית, זרעי פשתן וכו’). הן נקראות חומצות שומן חיוניות (Essential Fatty Acids).
חומצה ארכידונית
חומצה ארכידונית (Arachidonate) - 20:4 - היא חומצת שומן קריטית שמיוצרת מלינולאט. היא נקראת גם Eicosatetraenoate (איקוזו = 20 ביוונית, כמו איקוזהדרון עם 20 פאות). למדנו על מבנים איקוזנואידים בשיעור על וירוסים.
חומצה ארכידונית היא חומר המוצא לפרוסטגלנדינים - הורמונים שאחראים על דלקת, העלאת חום, וקרישת דם (להלן).
פרוסטגלנדינים ו-COX
מהם פרוסטגלנדינים?
פרוסטגלנדינים הם מולקולות הורמונליות שמעוררות דלקת, מעלות חום, ומעורבות בקסקדת קרישת הדם. הם נוצרים מחומצה ארכידונית.
האנזים COX
האנזים Prostaglandin Synthase (בקיצור COX - Cyclooxygenase) הופך חומצה ארכידונית לפרוסטגלנדין $\ce{PGH2}$. לאנזים יש שני אתרים פעילים: אחד עם פעילות Cyclooxygenase ואחד עם פעילות Peroxidase.
התהליך דורש שתי מולקולות $\ce{O2}$ שיוצרות טבעת מיוחדת עם שני חמצנים, ואז הפרוקסיד שנוצר מפורק לפרוסטגלנדין יציב.
אספירין ו-NSAIDs
אספירין היה התרופה הראשונה ממשפחת ה-NSAIDs (Non-Steroidal Anti-Inflammatory Drugs). אספירין נקשר באופן בלתי הפיך לסרין באתר הפעיל של COX וחוסם אותו.
לכן אספירין מוריד דלקת, מוריד חום, ומפחית קרישת דם - ולכן נותנים אותו לאנשים מעל גיל 50 למניעת טרומבוזה.
תרופות מודרניות יותר כמו איבופרופן (Advil) ונפרוקסן עובדות על אותו מנגנון אבל יותר פוטנטיות.
סינתזת טריאצילגליצרולים
מקורות גליצרול-3-פוספט
יש שתי דרכים לייצר גליצרול-3-פוספט (השלד של טריגליצרידים):
-
מגליצרול חופשי: האנזים Glycerol Kinase מוסיף פוספט עם ATP.
-
מגליקוליזה: DHAP (Dihydroxyacetone Phosphate) הופך לגליצרול-3-פוספט על ידי Glycerol-3-phosphate Dehydrogenase - האנזים הזה קשור גם לשאטל שמעביר אלקטרונים לשרשרת הנשימה דרך FAD (פחות יעיל מ-NADH דרך קומפלקס 1).
בניית הטריגליצריד
האנזים Acyl Transferase מעביר חומצות שומן מ-Acyl-CoA לגליצרול-3-פוספט. אחרי שתי העברות מקבלים Phosphatidic Acid - גליצרול עם שתי חומצות שומן וקבוצת פוספט. זהו חומר המוצא גם לטריגליצרידים וגם לפוספוליפידים.
בקרה
אינסולין (הורמון השפע) מעודד את כל המסלול - גם גליקוליזה, גם יצירת אצטיל-CoA, וגם יצירת טריגליצרידים. הגיוני - כשיש שפע, צריך לאגור אנרגיה.
פוספוליפידים לממברנות
למה צריך חומצות שומן בלתי רוויות?
ממברנות צריכות להיות Fluid Mosaic - לא קשיחות מדי. חומצות שומן בלתי רוויות יוצרות “כיפוף” בשרשרת שמונע אריזה צפופה מדי של הפוספוליפידים.
סוגי פוספוליפידים
הפוספוליפידים נבדלים בקבוצת הראש (Head Group) שלהם:
| קבוצת ראש | שם הפוספוליפיד | הערות |
|---|---|---|
| Ethanolamine | Phosphatidylethanolamine | |
| Choline | Phosphatidylcholine | נקרא גם לציטין - נמצא בשוקולד! |
| Serine | Phosphatidylserine | טעון שלילית |
| Glycerol | Phosphatidylglycerol | |
| Inositol-bisphosphate | PIP2 | מולקולת סיגנל, לא בממברנה |
מנגנון הסינתזה
כדי לחבר קבוצת ראש לפוספטידיק אסיד, צריך אקטיבציה. יש שתי אסטרטגיות: או לאקטב את הפוספטידיק אסיד עם CMP (CDP-Diacylglycerol), או לאקטב את קבוצת הראש עם CDP. בשני המקרים, התקפה נוקלאופילית על הפוספט יוצרת את הפוספוליפיד הסופי.
סינתזת כולסטרול
מבנה כולסטרול
כולסטרול הוא מולקולה עם 27 פחמנים וארבע טבעות בתצורה קבועה. כל המולקולה נבנית מיחידות של אצטט (אצטיל-CoA).
השלב המחייב - יצירת מבלונאט
\[\ce{3 Acetyl-CoA -> HMG-CoA ->[HMG-CoA Reductase] Mevalonate}\]למה הבקרה היא על מבלונאט ולא על HMG-CoA?
כי HMG-CoA משותף למספר מסלולים (גופי קטו, מעגל הפנטוזות). אם נשים שם בקרה, נפגע במסלולים אחרים. מבלונאט הולך רק לכולסטרול - לכן זה השלב המחייב.
השלב דורש $\ce{2NADPH}$ ומשחרר CoA.
מאיזופרנים לסקוואלן
ממבלונאט נוצרים איזופרנים מאוקטבים (עם פירופוספט). שני איזופרנים מתחברים לגרניל פירופוספט, ממשיכים לפרנזיל פירופוספט, ושני פרנזילים מתאחדים לסקוואלן - מולקולה לינארית הידרופובית.
גרניל ופרנזיל משמשים גם לעיגון חלבונים לממברנות (Prenylation).
ציקליזציה לכולסטרול
סקוואלן עובר ציקליזציה מורכבת עם $\ce{O2}$ ו-$\ce{NADPH}$ ליצירת מבנה הטבעות של כולסטרול.
גורלות הכולסטרול
- אגירה: כולסטריל אסטר (כולסטרול + חומצת שומן) על ידי האנזים ACAT
- חומצות מרה (Bile Acids): לאמולסיפיקציה של שומנים במעי
- הורמונים סטרואידיים
- אוקסיסטרולים: מולקולות סיגנל
שינוע שומנים בגוף - ליפופרוטאינים
שומנים הם הידרופוביים ולא יכולים לנוע בדם לבד. הם נארזים בחלקיקים שנקראים ליפופרוטאינים - כדורים עם ממברנה חד-שכבתית (מונולייר) וליבה הידרופובית.
סוגי הליפופרוטאינים
| סוג | צפיפות (g/mL) | הרכב עיקרי | מקור |
|---|---|---|---|
| Chylomicrons | < 0.95 | טריגליצרידים (85%) | תאי מעי |
| VLDL | 0.95-1.006 | טריגליצרידים (50%) | כבד |
| LDL | 1.019-1.063 | כולסטרול (45%) | מ-VLDL |
| HDL | 1.063-1.21 | חלבונים (50%) | כבד ורקמות |
המסלול האקסוגני
- אוכלים שומן ← נספג במעי ← נארז בכילומיקרונים
- כילומיקרונים נודדים לרקמות (שומן, שריר, בלוטות)
- ליפאז בקפילרות מפרק טריגליצרידים ← חומצות שומן חופשיות נכנסות לרקמות
- שאריות הכילומיקרונים חוזרות לכבד
המסלול האנדוגני
- כבד מייצר שומנים ואורז אותם ב-VLDL
- VLDL הולך לרקמות, מתפרק ← הופך ל-LDL
- LDL חוזר לכבד דרך LDL Receptor
Reverse Cholesterol Transport
HDL אוסף כולסטרול עודף מהרקמות ומחזיר אותו לכבד. זו הסיבה ש-HDL נחשב “כולסטרול טוב”.
טרשת עורקים (Atherosclerosis)
המנגנון
כאשר יש עודף LDL בדם, הוא חודר לדופן כלי הדם ועובר חמצון. מקרופאגים “אוכלים” את ה-LDL המחומצן והופכים לתאי קצף (Foam Cells). הצטברות תאי קצף יוצרת פלאק שמצר את כלי הדם.
הקשר לבדיקות דם
בבדיקת דם רואים יחס בין LDL ל-HDL:
- HDL גבוה יחסית ל-LDL = מצב טוב (פחות כולסטרול בדם, יותר פינוי)
- LDL גבוה יחסית ל-HDL = סיכון לטרשת עורקים
יש אנשים עם נטייה גנטית ל-LDL גבוה (מוטציה ב-LDL Receptor) - הכולסטרול לא נכנס לכבד ביעילות ונשאר בדם.
סיכום נקודות מפתח
-
רגולציה של סינתזת חומצות שומן: ACC הוא האנזים המרכזי. ציטראט מפעיל, פלמיטאט מעכב, גלוקגון מעכב.
-
חומצות שומן חיוניות: לינולאט ו-α-לינולנאט - חייבים לאכול מהצומח. מהן נוצרת חומצה ארכידונית לפרוסטגלנדינים.
-
NSAIDs: אספירין ואיבופרופן מעכבים COX ולכן מורידים דלקת, חום וקרישת דם.
-
כולסטרול: השלב המחייב הוא HMG-CoA ← מבלונאט (לא HMG-CoA עצמו, כי הוא משותף למסלולים אחרים).
-
ליפופרוטאינים: כילומיקרונים (מהמעי), VLDL←LDL (מהכבד), HDL (פינוי כולסטרול). HDL גבוה = טוב.
שאלות מומצאות
תשומת הלב שהשאלות הבאות לא בהכרח משקפות את הרמה או את התוכן שרלוונטיים למבחן, ובכל מקרה - כמו כל תוכן אחר באתר - אינן בהכרח נכונות.
שאלה 1: רגולציה של סינתזת חומצות שומן
מהו השילוב הנכון של גורמים המשפיעים על האנזים Acetyl-CoA Carboxylase (ACC)?
- ציטראט מעכב את ACC, פלמיטאט מפעיל את ACC, גלוקגון מפעיל את ACC.
- ציטראט מפעיל את ACC, פלמיטאט מעכב את ACC, גלוקגון מעכב את ACC.
- ציטראט מפעיל את ACC, פלמיטאט מפעיל את ACC, אינסולין מעכב את ACC.
- ציטראט מעכב את ACC, פלמיטאט מעכב את ACC, אינסולין מפעיל את ACC.
פתרון
התשובה הנכונה היא (2).
- ציטראט (עודף אנרגיה) מפעיל את ACC - זוהי Forward Activation. עודף ציטראט מסמן שיש הרבה אנרגיה ואנחנו רוצים לכוון את האצטיל-CoA לבניית חומצות שומן.
- פלמיטאט (התוצר) מעכב את ACC - זהו משוב שלילי. כשיש הרבה פלמיטאט, האנזים מקבל סיגנל להאט.
- גלוקגון (הורמון הרעב) מעכב את המסלול של בניית חומצות שומן ומפעיל את האוקסידציה שלהן - במצב של רעב אנחנו צריכים לפרק שומן, לא לבנות אותו.
שאלה 2: חומצות שומן חיוניות ופרוסטגלנדינים
מדוע לינולאט ו-α-לינולנאט נחשבות לחומצות שומן חיוניות, ומהי חשיבותן הקלינית?
- יונקים לא יכולים לייצר קשרים כפולים מעמדה 9 והלאה לכיוון קצה המתיל, ומהן נוצרת חומצה ארכידונית שהיא מקור לפרוסטגלנדינים.
- יונקים לא יכולים לייצר שרשראות שומן ארוכות מ-16 פחמנים, ולכן צריכים לקבל אותן מהמזון.
- החומצות האלה משמשות ישירות כקופקטורים לאנזים COX ללא צורך בעיבוד נוסף.
- יונקים יכולים לסנתז את החומצות האלה אך בקצב איטי מדי, ולכן צריך להשלים מהמזון.
פתרון
התשובה הנכונה היא (1).
מעמדה 9 והלאה לכיוון קצה המתיל, יונקים לא יכולים לייצר קשרים כפולים - רק צמחים יודעים לסנתז את לינולאט (אומגה-6) ו-α-לינולנאט (אומגה-3). לכן אנחנו חייבים לאכול אותן מהצומח.
מלינולאט נוצרת חומצה ארכידונית (20:4), שהיא חומר המוצא לפרוסטגלנדינים - הורמונים שאחראים על דלקת, העלאת חום, וקרישת דם. זו הסיבה שתרופות כמו אספירין ואיבופרופן (מעכבי COX) מורידות דלקת, חום ומפחיתות קרישת דם.
שאלה 3: ליפופרוטאינים וטרשת עורקים
מטופל בן 55 מגיע עם בדיקת דם המראה יחס גבוה של LDL ל-HDL. מהי המשמעות הקלינית של ממצא זה ומהו המנגנון הפתולוגי?
- מצב תקין - LDL גבוה מעיד על ספיגה טובה של שומנים מהמזון.
- סיכון מוגבר לטרשת עורקים - LDL עודף חודר לדופן כלי הדם, עובר חמצון, ונבלע על ידי מקרופאגים שהופכים לתאי קצף היוצרים פלאק.
- סיכון מופחת לטרשת עורקים - LDL גבוה מסייע בפינוי כולסטרול מהרקמות.
- מצב חסר משמעות קלינית - רק רמת הכולסטרול הכללי חשובה לאבחון.
פתרון
התשובה הנכונה היא (2).
כאשר יש עודף LDL בדם, הוא חודר לדופן כלי הדם ועובר חמצון. מקרופאגים “אוכלים” את ה-LDL המחומצן והופכים לתאי קצף (Foam Cells). הצטברות תאי קצף יוצרת פלאק שמצר את כלי הדם - זוהי טרשת עורקים.
לעומת זאת, HDL אוסף כולסטרול עודף מהרקמות ומחזיר אותו לכבד (Reverse Cholesterol Transport). לכן:
- HDL גבוה יחסית ל-LDL = מצב טוב (פחות כולסטרול בדם, יותר פינוי)
- LDL גבוה יחסית ל-HDL = סיכון לטרשת עורקים
יש אנשים עם נטייה גנטית ל-LDL גבוה (מוטציה ב-LDL Receptor) - הכולסטרול לא נכנס לכבד ביעילות ונשאר בדם.