הקדמה
בשיעור זה נלמד על השלכות (projections) וגם נתחיל בתמרות (transformations). נושאים אלו יכללו כמחצית מהשיעור, והנושא הבא יילמד בשבוע הבא אם לא יספיק הזמן.
איזומרים מולקולרים
איזומרים מבניים (Structural Isomers)
מה הם איזומרים? כאשר מדברים על מולקולות, איזומרים מבניים הם מולקולות שבהן החיבור בין האטומים שונה.
איזומרים מרחביים (Stereoisomers)
מה הם איזומרים מרחביים? אלה מולקולות שהחיבור זהה, אבל הסידור במרחב (spatial arrangement) שונה.
החיבור הוא זהה, אטומים זהים, אבל קיימים איזומרים מרחביים שונים. המפורסם ביותר הוא cis-trans, ובשיעור זה נלמד גם על איזומרים אופטיים (enantiomers).
הבדל בין קונפיגורציה (Configuration) לקונפורמציה (Conformation)
קונפיגורציה (Configuration) - הגיאומטריה הקבועה של המולקולה
- אם יש פחמן סגול, ירוק או כחול - זה תמיד יהיה כך ללא תלות באופן ההסתכלות על המולקולה
קונפורמציה (Conformation) - איך המולקולה נראית כרגע בגלל הסיבוב החופשי
- זה תמיד יהיה סגול, ירוק או כחול, אבל ניתן להסתכל על המולקולה מזוויות שונות
- אותו חומר, רק שינוי באופן הצגתו
- כל המצבים השונים נקראים קונפורמרים (conformers)
השלכות ניומן (Newman Projections)
השלכת ניומן היא הדרך היעילה ביותר להציג קונפורמרים.
מה זה השלכת ניומן?
השלכת ניומן היא דרך להציג את המולקולה - זו תמיד אותה מולקולה, אותו חומר, רק מוצג מזוויות שונות.
השלכה קווית (line representation) - הסתכלות על המולקולה מהצד השלכת ניומן - הסתכלות על המולקולה לאורך הקשר בין שני פחמנים
מבנה השלכת ניומן
- פחמן אחד מיוצג כנקודה
- פחמן שני מיוצג כעיגול
- על כל פחמן מציירים את האטומים בזוויות של 60 מעלות
סוגי מצבים
- Staggered (מקופל) - המתמירים לא אחד מאחורי השני
- Eclipsed (מכוסה) - המתמירים אחד מאחורי השני במדויק
אינטראקציות בין אטומים
סוגי אינטראקציות
- Anti - זווית של 180 מעלות בין מתמירים (הכי יציב)
- Gauche - זווית של 60 מעלות בין מתמירים
- Syn - זווית של 0 מעלות בין מתמירים (הכי פחות יציב)
כללים חשובים
- Staggered תמיד מתחלף עם Eclipsed
- בתוך Staggered ובתוך Eclipsed יש רמות יציבות שונות
- כל 60 מעלות יש אינטראקציה של gauche
- Anti הוא הכי יציב, Syn הוא הכי פחות יציב
דוגמא: כלורו-פרופן (Chloro-propane)
הבנת הקונפורמציות השונות של כלורו-פרופן:
מבנה כלורו-פרופן
\[\ce{CH3-CH2-CH2Cl}\]הקונפורמרים השונים

- A - הכי יציב: Staggered עם השדה (chloride) והמתיל (methyl) במצב anti. כלומר, מעט אנרגיה.
- F - הכי פחות יציב: Eclipsed עם השדה והמתיל במצב syn - הכי הרבה אנרגיה.
- מצבים ביניים: שילובים של staggered ו-eclipsed עם רמות יציבות שונות
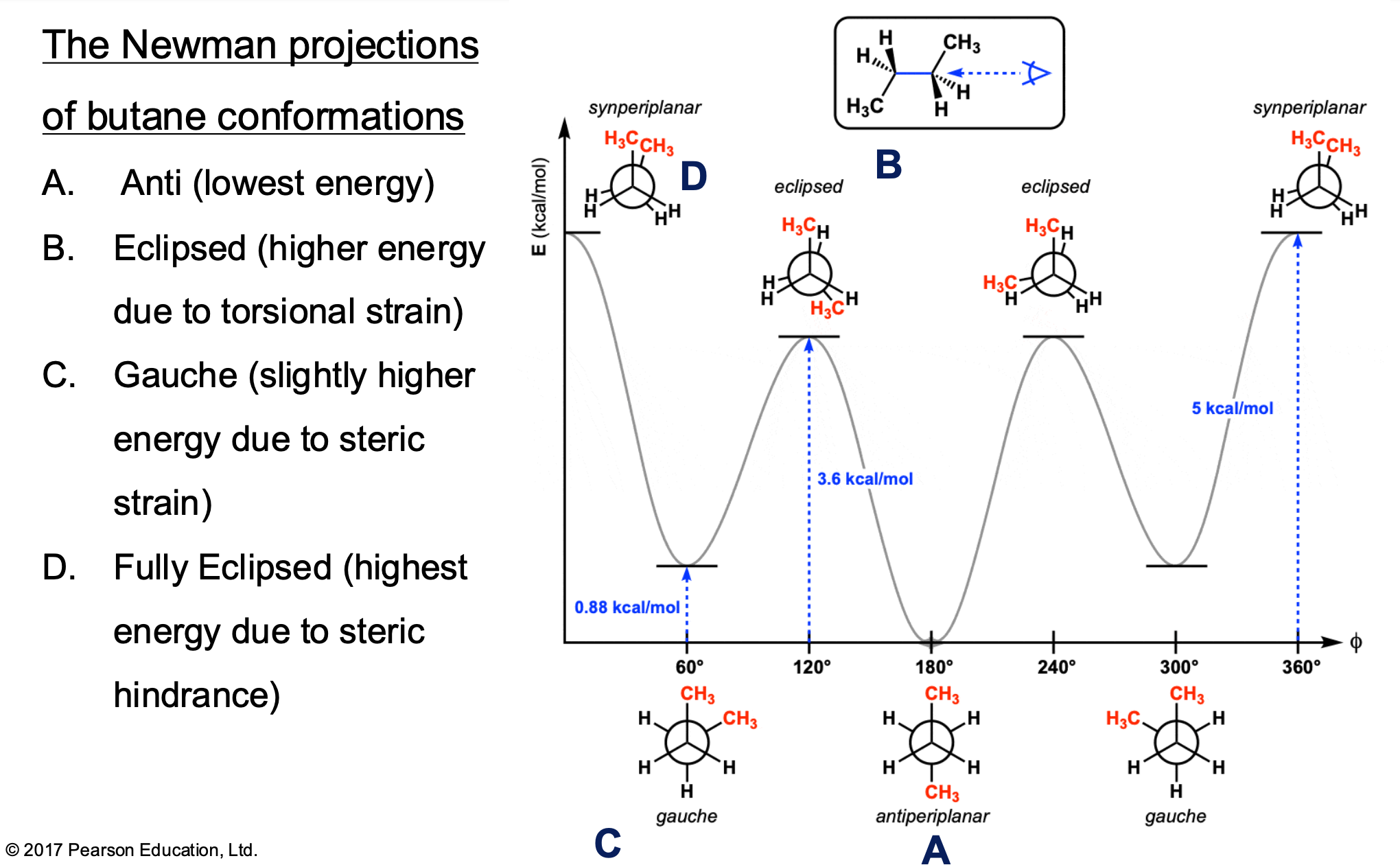
גרף אנרגיה
הגרף מראה כיצד האנרגיה משתנה עם סיבוב של 360 מעלות:
- נקודות נמוכות = Staggered (יציב)
- נקודות גבוהות = Eclipsed (פחות יציב)
- המעבר מתבצע בקפיצות של 60 מעלות
מעבר בין השלכות
מקווית לניומן
- הבטחה שהמצב הוא Staggered
- בחירת מישור (שני מתמירים במצב anti)
- הצבת הפחמן הקדמי כנקודה משמאל
- הצבת הפחמן האחורי כעיגול מימין
- העברת מתמירים לפי הכלל: ימין יוצא, שמאל נכנס
השלכות פישר (Fischer Projections)
מהן השלכות פישר?
השלכות פישר הן דרך נוספת להציג מולקולות, במיוחד כאשר רוצים לייצג מולקולות מורכבות בצורה פשוטה על הנייר.
\[\begin{array}{cccc} & & \text{H} & \\ & & | & \\ \text{COOH} & - & \text{C} & - & \text{CH}_3 \\ & & | & \\ & & \text{OH} & \end{array}\]הכללים להשלכת פישר:
- חצים צידיים יוצאים החוצה - מה שנמצא בצדדים יוצא מהמישור לקראתנו
- למעלה ולמטה נכנסים פנימה - מה שנמצא למעלה ולמטה נכנס פנימה מהמישור
מעבר מהשלכה קווית להשלכת פישר
שלב 1: זיהוי המקומות כשמעבירים מצורה קווית להשלכת פישר, משתמשים בשיטה הבאה:
- בוחרים שתי קבוצות (A ו-B) לשים במישור
- הקבוצה שנמצאת מימין (C) תיצא החוצה
- הקבוצה שנמצאת משמאל (D) תיכנס פנימה
דוגמא: חומצה אמינו
צורה קווית:
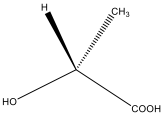
השלכת פישר:
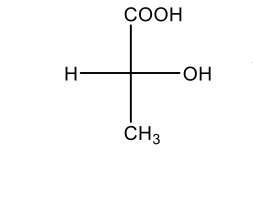
השלבים:
- לקיחת COOH ו-CH₃ למישור
- NH₂ (שהיה מימין) יוצא
- H (שהיה משמאל) נכנס
טיפים למי שאין ראייה מרחבית
אם אין ראייה מרחבית או מודלים, כדאי לזכור:
- תמיד צידים יוצאים, למעלה/למטה נכנסים
- אפשר לבחור כל מישור שרוצים
- A ו-B במישור ← C יוצא, D נכנס
קונפורמציות כיסא (Chair Conformations)
מבוא לקונפורמציות כיסא
ציקלוהקסן יכול להופיע במספר קונפורמציות אפשריות. הקונפורמציה היציבה ביותר היא קונפורמציית כיסא.
מיקומים בכיסא
שני סוגי מיקומים:
- Axial (אקסיאלי) - מאונך למישור הטבעת
- Equatorial (אקווטוריאלי) - כמעט במישור הטבעת
כללים חשובים:
- בכל היפוך כיסא, אקסיאלי הופך לאקווטוריאלי ולהיפך
- מה שלמעלה נשאר למעלה, מה שלמטה נשאר למטה
- קבוצות גדולות מעדיפות להיות במקום אקווטוריאלי
דוגמא: ציקלוהקסן עם מתמירים
מולקולה: 1-איזופרופיל-3-כלור-5-מתיל-ציקלוהקסן
שלב 1: ציור הצורה המישורית
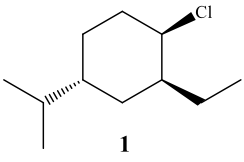
שלב 2: מעבר לקונפורמציית כיסא
- איזופרופיל הוא הקבוצה הגדולה ביותר - חייב להיות אקווטוריאלי
- בחירת מיקום: איזופרופיל למטה-אקווטוריאלי
שאלה: איך נקבע אם זה cis או trans?
- בטבעות, cis/trans נקבע לפי מיקום יחסית למישור
- cis = שניהם למעלה או שניהם למטה
- trans = אחד למעלה, אחד למטה
היפוך כיסא (Chair Flip)
מתי מתרחש היפוך כיסא?
- קבוצה גדולה (כמו tert-butyl) “נועלת” את הכיסא
- אם יש קבוצה גדולה, המולקולה לא תעשה היפוך כיסא
- קבוצות קטנות מאפשרות היפוך כיסא
דוגמא להשוואה:
- קבוצות אקסיאליות: פחות יציב (יותר צפיפות סטרית)
- קבוצות אקווטוריאליות: יותר יציב (פחות צפיפות סטרית)
ציקלוהקסֵן (Cyclohexene)
מאפיינים מיוחדים של ציקלוהקסֵן
- מכיל קשר כפול אחד
- הקשר הכפול קובע שאין סיבוב חופשי
- חשוב לזהות cis/trans בקשר הכפול
דוגמא: 1-איזופרופיל-3-מתיל-ציקלוהקסֵן
צורה מישורית:
…
שאלות חשובות:
- האם זה cis או trans?
- איזו קונפורמציה יותר יציבה?
כללי יציבות ציקלוהקסֵן
- קשר כפול בטבעת יוצר מישור נוקשה
- מתמירים יכולים להיות cis או trans לקשר הכפול
- הצפיפות הסטרית קובעת איזו קונפורמציה יותר יציבה
סיכום מושגי מפתח
השלכות פישר
- צידים יוצאים, למעלה/למטה נכנסים
- שימושי למולקולות מורכבות
- דורש תרגול להבנה מלאה
קונפורמציות כיסא
- אקסיאלי לעומת אקווטוריאלי
- קבוצות גדולות מעדיפות מקום אקווטוריאלי
- היפוך כיסא משנה מיקומים אבל שומר על כיוון
ציקלואקסן
- קשר כפול יוצר מגבלות קונפורמציה
- cis/trans חשוב לקביעת יציבות
- צפיפות סטרית היא שיקול מרכזי
טיפ להצלחה: תרגול עם מודלים מומלץ מאוד! בבחינות בכימיה אורגנית מותר ורצוי להשתמש במודלים להבנה טובה יותר של המולקולות.
קביעת מיקומים במולקולה
האיזופרופיל חייב להיות equatorial כלפי מעלה, לכן זו אינה אופציה טובה. לאחר מכן יש פחמן ומתיל שהוא ב-trans, לכן הוא יהיה כלפי מטה.
שאלה: המתיל יהיה equatorial, כיוון שהוא חייב להיות equatorial.
חשוב לציין שהטבעת אינה מישורית במציאות - היא נראית בצורת כיסא. בכל פחמן יש עמדה equatorial (קרובה למישור הטבעת) ועמדה axial (משיגה מהטבעת).
בדוגמה זו, הפחמן הראשון יהיה תמיד למעלה, equatorial למעלה, או axial למעלה. הפחמן השני, ה-equatorial שלו כלפי מטה, וה-axial כלפי מטה.
הערת זהירות: היפוך הוא מושג אחר. בהיפוך, כאשר הפחמן למטה, הוא הופך למשהו אחר.
Axial הופך להיות equatorial. Equatorial הופך להיות axial.
חשוב לציין: כאשר הסגול היה למעלה, הוא נשאר למעלה. פשוט מ-equatorial הופך להיות axial. הכחול, מ-axial הופך להיות equatorial, אבל נשאר למעלה.
נושא חדש: כיראליות (Chirality)
הכנה והקדמה
נכנסים לנושא חדש - כיראליות. זהו נושא חשוב מאוד בכימיה אורגנית. חשיבות פחמנים כיראליים מודגמת היטב בסיפור הבא.
סיפור התאלידומיד (Thalidomide)
סיפור התאלידומיד הוא מקרה קלאסי בכימיה אורגנית. התרופה הייתה בשימוש בגרמניה בשנות ה-50 וה-60 ונפרסמה כתרופה לבחילות הריון.
הטרגדיה: בתקופה זו בגרמניה נולדו ילדים רבים עם פגיעות בגפיים. ילדים נולדו ללא גפיים, עם גפיים משובטות, או גפיים שלא התפתחו כראוי. מקרה זה היה טרגי ומזעזע.
בארצות הברית נערך מחקר להבנת הסיבה לתופעה, והתגלה שכל האימהות שילדו ילדים עם פגיעות בגפיים לקחו את התרופה הזאת בשליש הראשון של ההריון.
הגילוי: פחמן כיראלי
הממצאים החשובים:
- התרופה מכילה פחמן כיראלי
- פחמן כיראלי יכול להסתדר בשתי קונפיגורציות אפשריות
- קונפיגורציה אחת עזרה נגד בחילות
- הקונפיגורציה השנייה גרמה לנזקים עוברים חמורים
חשיבות כיראליות
כל חומר שמוכנס לגוף, כל חומר שהוא פעיל ביולוגית, מגיע לאתר מטרה. לאתר המטרה יש כיס פעיל שעליו החומר נקשר.
עיקרון החשיבות:
- החומר חייב להיכנס לכיס הפעיל בצורה מושלמת
- אם הוא נכנס בצורה מושלמת - הוא פעיל כמו שצריך
- אם הוא לא נכנס בצורה מושלמת - הוא לא רק לא פעיל, אלא גם עלול לגרום נזק
דוגמאות מחיי היומיום
טעמים טבעיים:
החומר הפעיל שנותן את הטעם בלימון ותפוז הוא אותו חומר בדיוק, אבל בקונפיגורציה שונה!
הבדל מהותי:
- ההבדל בין טעם הלימון לטעם התפוז הוא רק הקונפיגורציה
- החומר הכימי זהה לחלוטין
- רק הסידור המרחבי שונה
הגדרת פחמן כיראלי
מה זה פחמן כיראלי?
פחמן עם ארבעה מתמירים שונים. כאשר פחמן מחובר בארבעה מתמירים שונים, הוא יכול להסתדר בשתי אופציות שונות:
- אפשרות אחת
- אפשרות שנייה
שאלה חשובה: האם זה אותו חומר?
תשובה: לא! מה היחס בין החומרים האלה?
איזומרים (Enantiomers):
- לא משנה איך מסובבים אותם
- לעולם זה לא יהיה אותו חומר
- הם זוג enantiomers
תכונות של Enantiomers
ל-enantiomers יש בדיוק אותן תכונות כימיות ופיזיקליות, חוץ משתיים:
- הפעילות הביולוגית - כי במרחב הם שונים
- סיבוב האור - פחמן כיראלי יודע לסובב את האור
מאפיין מיוחד:
כל enantiomer יסובב את האור פשוט בכיוון הפוך:
- אחד יסובב 30 מעלות ימינה
- השני יסובב 30 מעלות שמאלה
מינוח:
- חומרים כיראליים = חומרים פעילים אופטית = איזומרים אופטיים
- האנלוגיה: כמו כפפות - כפפה ימנית וכפפה שמאלית לא יכולות להתאים זו לזו
קביעת קונפיגורציה: R ו-S
כמו שבקשר כפול נותנים cis ו-trans (או E ו-Z), לפחמנים כיראליים נותנים R ו-S.
השיטה לקביעת קונפיגורציה
שלב 1: מספור המתמירים מספרים את החשיבות של המתמירים לפי המסה המולקולרית - מהגבוה ביותר לנמוך ביותר.
דוגמא:
\[\begin{array}{cccc} & & \text{Br} & \\ & & | & \\ \text{H} & - & \text{C} & - & \text{CH}_3 \\ & & | & \\ & & \text{CH}_2\text{CH}_3 & \end{array}\]מספור לפי שכיחות:
- ברום (הכי כבד)
- CH2CH3 (אתיל)
- CH3 (מתיל)
- H (הכי קל)
הערה חשובה: כאשר יש מימן, הוא תמיד מקום 4 (האחרון).
שלב 2: שמים את הקבוצה הקטנה מאחורה
שיטת העבודה:
- זיהוי הקבוצה הקטנה (מספר 4)
- יש לשים אותה מאחורה (מאחורי המישור)
- אם היא לא מאחורה - מחליפים אותה עם הקבוצה שכן מאחורה
שלב 3: בדיקת כיוון הסיבוב
אחרי שהקבוצה הקטנה מאחורה, בודקים:
- האם הסיבוב הוא עם כיוון השעון או נגד כיוון השעון
- 1 → 2 → 3
- אם עם כיוון השעון: R
- אם נגד כיוון השעון: S
שיטות מיוחדות
המבט האסור
כאשר הקבוצה הקטנה נמצאת קדימה (ולא מאחורה), אפשר לקבוע קונפיגורציה ולקחת את ההפך.
חשוב: זה עובד רק כאשר הקבוצה הקטנה קדימה במדויק, לא במישור.
הערות חשובות
- תמיד לעשות ציור - זה עוזר למנוע טעויות
- הקבוצה הקטנה חייבת להיות מאחורה - אחרת השיטה לא עובדת
- אם הקבוצה הקטנה במישור - השיטה לא עובדת
דוגמאות מעשיות
דוגמא 1: קביעת קונפיגורציה
OH
|
H-C-CH3
|
CH2CH3
פתרון:
- מספור: OH (1), CH2CH3 (2), CH3 (3), H (4)
- H צריך להיות מאחורה
- בודקים סיבוב: 1 → 2 → 3
- אם נגד כיוון השעון: S
דוגמא 2: החלפת קבוצות
Br
|
CH3-C-H
|
CH2CH3
כאן H במישור - צריך להחליף עם הקבוצה מאחורה.
קביעת קונפיגורציה בהשלכות שונות
בהשלכת פישר (Fischer Projection)
פישר מאפשר קביעת קונפיגורציה באופן מאוד נוח:
- אם הקבוצה הקטנה למעלה או למטה → הקונפיגורציה שיוצאת היא הנכונה
- אם הקבוצה הקטנה בצדדים → לוקחים את ההפך
בהשלכת ניומן (Newman Projection)
לא מומלץ! קביעת קונפיגורציה בניומן יכולה להיות מאוד מבלבלת. כדאי להעביר קודם לצורה קווית.
סיכום
כיראליות היא נושא מרכזי בכימיה אורגנית, עם השלכות חשובות:
- בפיתוח תרופות
- בביולוגיה
- בחיי היומיום
הדרך הבטוחה ביותר לקבוע קונפיגורציה:
- מספור המתמירים
- שמים את הקבוצה הקטנה מאחורה
- בודקים כיוון הסיבוב
- קובעים R או S
טיפ: תמיד עבדו עם ציורים ותהיו זהירים בזיהוי מיקום הקבוצה הקטנה.
למידה המשיכית: בתרגול הבא נתעמק יותר בדוגמאות ובשאלות מורכבות יותר.
דור פסקל