תגובות SN1 - יציבות סובסטרטים
שאלה: איזה סובסטרט יהיה הכי אקטיבי במנגנון SN1?
כאשר אנחנו דנים בתגובות SN1, חשוב להבין מה קובע את מהירות התגובה. במנגנון SN1, השלב הראשון (השלב קובע המהירות) הוא יציר הקרבוקטיון.
עקרון יסוד: ככל שהקרבוקטיון יהיה יותר יציב, יהיה קל יותר ליצור אותו, והתגובה תהיה מהירה יותר.
היציבות של קרבוקטיונים תלויה בגורמים הבאים:
- יציבות אינדוקטיבית: פחמן שלישוני > שניוני > ראשוני
- יציבות רזוננטיבית: קרבוקטיונים עליליים או בנזיליים
התשובה: הסובסטרט הכי אקטיבי יהיה זה שיוצר קרבוקטיון שלישוני עלילי, כי הוא נהנה גם מיציבות אינדוקטיבית וגם מיציבות רזוננטיבית.
השפעת ריכוז הנוקלאופיל על קצב התגובה
שאלה: מה תהיה ההשפעה על קצב התגובה של 2-כלורו-2-מתילבוטן עם מתנול אם נכפיל את ריכוז המתנול?
תשובה: קצב התגובה לא ישתנה.
הסבר: בתגובות SN1, קצב התגובה תלוי רק בריכוז הסובסטרט, ולא בריכוז הנוקלאופיל. זאת משום שהשלב קובע המהירות הוא עזיבת הקבוצה העוזבת (יציר הקרבוקטיון), ולא התקפת הנוקלאופיל.
חוק הקצב:
\[\text{Rate} = k[\text{Substrate}]\]תגובות אלימינציה (E2)
מנגנון E2
תגובת E2 היא תגובה המתרחשת בשלב אחד, בדומה ל-SN2. המנגנון כולל:
- בסיס חזק תוקף פרוטון על פחמן β (ליד הפחמן עם הקבוצה העוזבת)
- בו-זמנית: נוצר קשר כפול בין שני הפחמנים
- בו-זמנית: עוזבת הקבוצה העוזבת הטובה
דרישות למנגנון E2
1. בסיס חזק
התגובה דורשת בסיס חזק כי הפרוטון שנקטף אינו פרוטון חומצי במיוחד.
דוגמאות לבסיסים חזקים:
- $\ce{OH^-}$ (הידרוקסיד)
- $\ce{OR^-}$ (אלקוקסידים)
- $\ce{NH2^-}$ (אמיד)
2. דרישת אנטי-פריפלנר
כלל חשוב: הפרוטון שנקטף והקבוצה העוזבת חייבים להיות במצב אנטי-פריפלנר (זווית של 180°).
הסבר: בדומה ל-SN2, גם כאן יש הפרעה אלקטרוסטטית. הבסיס (טעון שלילית) לא יכול להתקרב מאותו הכיוון של הקבוצה העוזבת.
השלכות של דרישת אנטי-פריפלנר
בטבעות כיסא
כאשר יש לנו טבעת כיסא, הקבוצה העוזבת חייבת להיות במצב אקסיאלי כדי שנוכל לראות אנטי-פריפלנר עם הפרוטונים.
- אם הקבוצה נמצאת במצב אקוואטוריאלי, תקרה תחילה היפוך כיסא
- רק לאחר מכן תתרחש האלימינציה
קביעת סטריאוכימיה של הקשר הכפול
המצב האנטי-פריפלנר קובע את הסטריאוכימיה של הקשר הכפול שייווצר:
- אם שתי הקבוצות הגדולות נמצאות באותו כיוון במולקולה המוצא ← תיווצר איזומר E
- אם שתי הקבוצות הגדולות נמצאות בכיוונים מנוגדים ← ייווצר איזומר Z
כלל זייצב מול אלימינציה של הופמן
כלל זייצב
בתנאים רגילים, עם בסיס קטן, התגובה תעדיף ליצור את הקשר הכפול המותמר ביותר (עם הכי הרבה מחליפים).
אלימינציה של הופמן
כאשר משתמשים בבסיס נפחי (כמו t-BuOK), הבסיס לא יכול להגיע פיזית לפרוטון שייתן את התוצר המותמר ביותר בגלל הפרעה מרחבית.
במקרה זה, הבסיס יתקוף את הפרוטון הנגיש ביותר, גם אם זה ייתן קשר כפול פחות מותמר.
דוגמה:
- בסיס קטן ($\ce{OH^-}$) ← תוצר זייצב (קשר כפול מותמר יותר)
- בסיס נפחי ($\ce{(CH3)3COK}$) ← תוצר הופמן (קשר כפול פחות מותמר)
דוגמאות מעשיות
דוגמה 1: השוואת אנטי-פריפלנר
נתונות שתי תגובות דומות עם $\ce{EtO^-}$:
במקרה הראשון:
- רק פחמן אחד יכול לתת אנטי-פריפלנר
- תיווצר רק אפשרות אחת של קשר כפול
במקרה השני:
- שני פחמנים יכולים לתת אנטי-פריפלנר
- תיווצרו שני תוצרים לפי כלל זייצב (התוצר המותמר יותר יהיה עיקרי)
תחרות בין SN2 ל-E2
כאשר יש לנו נוקלאופיל שהוא גם בסיס חזק:
פחמן ראשוני: נוטה יותר ל-SN2 (האלימינציה תיתן קשר כפול לא מותמר)
פחמן שלישוני: לא יכול לעשות SN2, ייתן רק E2
פחמן שניוני: מקרה בעייתי - יכול לתת גם SN2 וגם E2. אם הנוקלאופיל הוא גם בסיס חזק, האלימינציה תהיה מועדפת.
הערות חשובות:
- התגובות אינן מוחלטות - תמיד יהיו אחוזים קטנים של התוצר המשני
- הבסיס הנפחי ייתן בעיקר הופמן, אבל עדיין טיפה זייצב
- בכל מקרה של אי-ודאות, יש להסתכל על הגורמים הקובעים: גודל הבסיס, יציבות הקרבוקטיון, ודרישת אנטי-פריפלנר
קביעת סלקטיביות בתגובות אלימינציה
כלל זייצב מול אלימינציה של הופמן - הבהרה
כפי שראינו קודם, יש להבחין בין שני סוגי סלקטיביות:
כלל זייצב: העדפה ליצירת הקשר הכפול
המותמר ביותר (עם הכי הרבה תחליפים)
בסיס קטן ← זייצב (קשר כפול מותמר יותר)
בסיס גדול/נפחי ← הופמן (קשר כפול פחות מותמר)
הגדרת מותמרות בקשרים כפולים
כדי לקבוע איזה קשר כפול מותמר יותר, סופרים את מספר הפחמנים המחוברים לכל פחמן בקשר הכפול:
- קשר כפול לא מותמר: $\ce{R-CH=CH2}$ (מותמר פעם אחת)
- קשר כפול די-מותמר: $\ce{R-CH=CHR}$ (מותמר פעמיים)
- קשר כפול טרי-מותמר: $\ce{R2C=CHR}$ (מותמר שלוש פעמים)
- קשר כפול טטרה-מותמר: $\ce{R2C=CR2}$ (מותמר ארבע פעמים)
ככל שהקשר הכפול מותמר יותר, הוא יציב יותר.
תחרות בין SN2 ל-E2
עקרונות כלליים
כאשר נוקלאופיל הוא גם בסיס חזק, יכולות להתחרות שתי תגובות:
פחמן ראשוני: נוטה ל-SN2 (האלימינציה תיתן קשר כפול לא מותמר)
פחמן שלישוני: רק E2 אפשרי (SN2 בלתי אפשרי בגלל הפרעה מרחבית)
פחמן שניוני: תחרות אמיתית - אם הנוקלאופיל הוא גם בסיס חזק, אלימינציה תהיה מועדפת
השפעת נפחיות הבסיס
בסיס נפחי (כמו $\ce{(CH3)3CO^-}$):
- לא יכול להגיע לפחמן לביצוע SN2 בגלל הפרעה מרחבית
- רק E2 אפשרי
- ייתן אלימינציה של הופמן
מנגנון E1
מאפייני המנגנון
E1 הוא המקביל של SN1, והוא מתרחש בשני שלבים:
שלב 1 (שלב קובע מהירות): עזיבת הקבוצה העוזבת ← יצירת קרבוקטיון שלב 2 (מהיר): קטיפת פרוטון על ידי בסיס ← סגירת קשר כפול
דרישות לתגובת E1
- קבוצה עוזבת טובה
- קרבוקטיון יציב (שלישוני, עלילי, בנזילי)
- בסיס חלש (מים, אלכוהולים)
- חימום (מעודד אלימינציה על פני התמרה)
חוק קצב
\[\text{Rate} = k[\text{Substrate}]\]הקצב תלוי רק בריכוז הסובסטרט, לא בריכוז הבסיס.
סטריאוכימיה ב-E1
בניגוד ל-E2, ב-E1 אין דרישת אנטי-פריפלנר כי:
- הקרבוקטיון הוא מישורי (SP²)
- הבסיס יכול להגיע מכל כיוון
- התוצר יהיה תערובת של E ו-Z, עם העדפה ל-E (פחות הפרעה מרחבית)
דוגמאות מעשיות
דוגמה 1: תחרות E2 מול סלקטיביות
נתון חומר עם שני מרכזים שיכולים לתת אלימינציה:
עם בסיס קטן ($\ce{EtO^-}$):
- יעדיף זייצב
- ייתן את הקשר הכפול המותמר ביותר
- דורש אנטי-פריפלנר
עם בסיס נפחי ($\ce{t-BuOK}$):
- ייתן הופמן
- ייקח את הפרוטון הנגיש ביותר
- עדיין דורש אנטי-פריפלנר
דוגמה 2: השוואת E1 ל-E2
E2 עם $\ce{EtO^-}$:
- תגובה בשלב אחד
- דורש אנטי-פריפלנר
- ייתן תוצר אחד לפי סטריאוכימיה
E1 עם מתנול + חימום:
- תגובה בשני שלבים
- אין דרישת אנטי-פריפלנר
- ייתן תערובת E/Z עם העדפה ל-E
- יעדיף זייצב (אם הבסיס קטן)
תגובת דהידרציה
מהות התגובה
דהידרציה היא הסרת מולקולת מים מאלכוהול. זוהי תגובת אלימינציה מסוג E1 בתנאים מיוחדים.
הבעיה: $\ce{OH^-}$ כקבוצה עוזבת
$\ce{OH^-}$ היא קבוצה עוזבת גרועה מאוד כי:
- היא בסיס חזק
- לא “אוהבת” להחזיק מטען שלילי
- לעולם לא תעזוב כ-$\ce{OH^-}$
הפתרון: אקטיבציה חומצית
שלב 1: פרוטונציה
\[\ce{R-OH + H^+ -> R-OH2^+}\]האלכוהול פועל כבסיס, תוקף פרוטון עם זוג האלקטרונים החופשיים
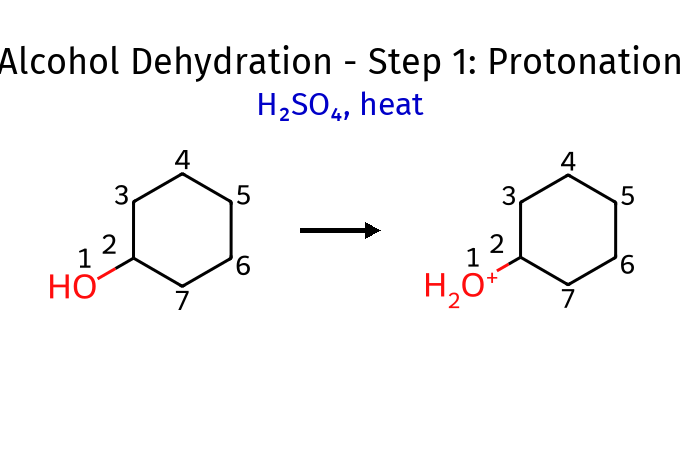
שלב 2: יצירת קבוצה עוזבת טובה
\[\ce{R-OH2^+ -> R^+ + H2O}\]מים ($\ce{H2O}$) הם קבוצה עוזבת מצוינת
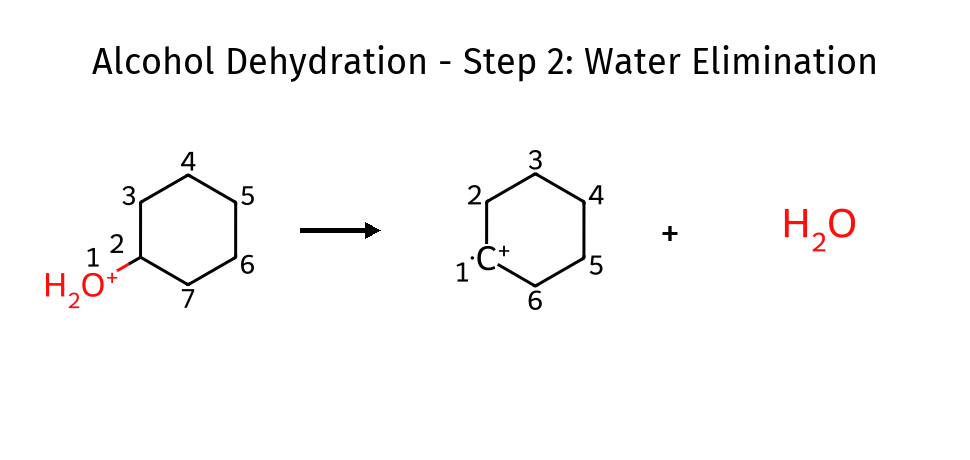
שלב 3: אלימינציה
\[\ce{R^+ + H2O -> \text{alkene} + H3O^+}\]מים (בסיס חלש) קוטפים פרוטון מהקרבוקטיון
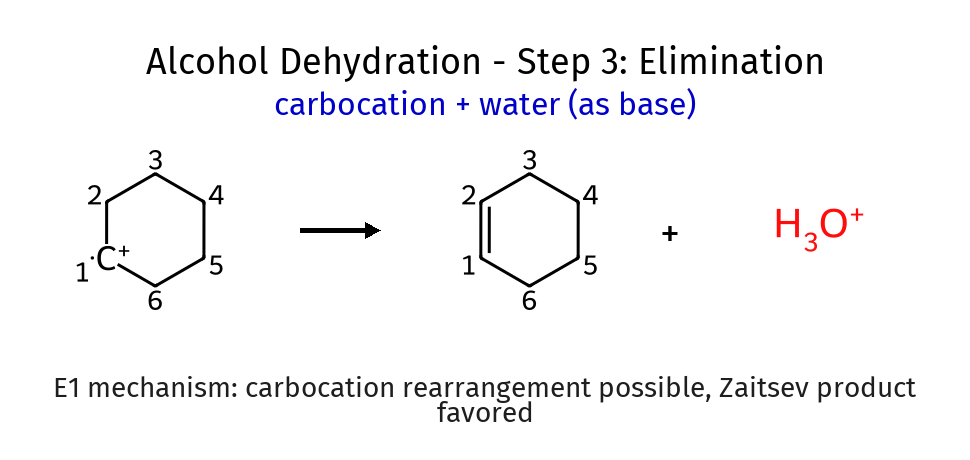
תנאי התגובה
- חומצה חזקה: $\ce{H2SO4}$ או $\ce{H3PO4}$
- חימום (מעודד אלימינציה על פני התמרה)
- תנאים חומציים חזקים
מנגנון E1 במלואו
התגובה עוקבת אחר מנגנון E1 קלסי:
- קבוצה עוזבת טובה (מים)
- יצירת קרבוקטיון יציב
- קטיפת פרוטון על ידי בסיס חלש
- אפשרות לשחלופי קרבוקטיון
סיכון: שחלופי קרבוקטיון
כמו בכל תגובת E1/SN1, יש להיזהר משחלופי קרבוקטיון:
- מעבר מקרבוקטיון ראשוני לשניוני
- מעבר מקרבוקטיון שניוני לשלישוני
- יצירת קרבוקטיונים עליליים או בנזיליים
נקודות מפתח:
- E1 דומה ל-SN1 אבל מחמם מעודד אלימינציה
- דהידרציה = E1 עם אקטיבציה חומצית של OH
- בסיס גדול ייתן הופמן, בסיס קטן ייתן זייצב
- ב-E1 אין דרישת אנטי-פריפלנר, ב-E2 יש
- פחמן שניוני + בסיס חזק ← בעיקר אלימינציה
תרגיל 1: זיהוי תוצרי אלימינציה
ניתוח התגובה
שאלה: בתגובה הבאה מתקבלים שני תוצרים, מה הם?
כאשר אנחנו מסתכלים על תגובה זו, קודם כל צריך לזהות איזה סוג תגובה הולכת לקרות:
זיהוי המנגנון: E2 (אלימינציה בשלב אחד)
- בסיס חזק
- פחמן שניוני
- תנאים מתאימים לאלימינציה
דרישת אנטי-פריפלנר
נקודה חשובה: האם יש כאן עניין של אנטי-פריפלנר?
תשובה: לא, כי שני הפחמנים שיכולים לתת אלימינציה הם זהים מבחינה כימית. בכל אחד מהם יש:
- פרוטונים מעל המישור
- פרוטונים מתחת למישור
זה אומר שדרישת האנטי-פריפלנר מתקיימת בשני המקרים.
השוואת מותמרות הקשרים הכפולים
שאלה: האם יש כאן עניין של זייצב מול אנטי-זייצב?
נבדוק את מותמרות הקשרים הכפולים האפשריים:
- קשר כפול ראשון: מותמר פעמיים ($\ce{R2C=CHR}$)
- קשר כפול שני: מותמר פעמיים ($\ce{R2C=CHR}$)
מסקנה: שני הקשרים הכפולים מותמרים באותה מידה, לכן לא משנה איזה בסיס נשתמש - נקבל את שני החומרים בתערובת.
יחס התוצרים: בערך שווה (1:1), כי זה תלוי רק בגורמים סטטיסטיים.
שאלה צדדית: קונפורמרים מול איזומרים
שאלה מהקהל: מה ההבדל בין קונפורמרים לאיזומרים?
תשובה מהמרצה:
- קונפורמרים: אותה מולקולה בסיבובים שונים סביב קשרים יחידים
- איזומרים: מולקולות שונות עם אותה נוסחה מולקולרית
זה קשור לנושא שלנו כי בעת ביצוע E2, הסיבוב החופשי במולקולה מאפשר לנו להגיע למצב אנטי-פריפלנר הנדרש.
תרגיל 2: בסיס נפחי ואלימינציה של הופמן
ניתוח התגובה
נתון: בסיס חזק ונפחי מול פחמן שניוני
זיהוי המנגנון: E2 (התגובה היחידה האפשרית)
- פחמן שניוני לא יכול לעבור SN2 עם בסיס נפחי
- הבסיס הנפחי מונע גישה לפחמן
יישום כלל הופמן
הבסיס הנפחי: לא יכול להגיע לפרוטונים שנמצאים במיקומים צפופים
אסטרטגיית הבסיס:
- בסיס קטן: היה תוקף את הפרוטון שיתן את הקשר הכפול המותמר ביותר (זייצב)
- בסיס גדול: תוקף את הפרוטון הנגיש ביותר, גם אם זה ייתן קשר כפול פחות מותמר (הופמן)
התוצאה: קשר כפול פחות מותמר, לפי כלל הופמן.
תרגיל 3: פחמן שלישוני ואלימינציה
ניתוח המצב
נתון: פחמן שלישוני עם בסיס חזק
זיהוי המנגנון: E2 בלבד
- פחמן שלישוני לא יכול לעבור SN2
- תגובת האלימינציה היחידה האפשרית
זיהוי התוצאה העיקרית
גורמים לשקול:
- מותמרות הקשר הכפול: נעדיף את הקשר הכפול המותמר ביותר
- דרישת אנטי-פריפלנר: חובה ב-E2
- גודל הבסיס: יקבע את הסלקטיביות
צורך בסיבוב מולקולרי: במקרים מסוימים נצטרך לסובב את המולקולה כדי להשיג מצב אנטי-פריפלנר מתאים.
תרגיל 4: קבוצת טוזיל (OTs) כקבוצה עוזבת
הכרת קבוצת הטוזיל
קבוצת OTs (טוזיל = טולואן-סולפוניל):
\[\ce{-SO2-Ph-CH3}\]מאפיינים:
- קבוצה עוזבת מצוינת
- יציבה מאוד לאחר עזיבה בגלל רזוננטיביות
- נפוצה בסינתזה אורגנית
ניתוח המנגנון
שאלה: איזה מנגנון - E1 או E2?
תשובה: E2, ולא E1
הסבר למה לא E1:
- ברגע שהקבוצה העוזבת עוזבת, נוצר קרבוקטיון שניוני
- הקרבוקטיון הזה נמצא ליד עמדה שלישונית
- יקרה שכלול קרבוקטיון (מעבר משניוני לשלישוני)
- התוצאה תהיה שונה מהרצויה
מסקנה: המנגנון חייב להיות E2 כדי למנוע שחלופים לא רצויים.
יישום עקרונות E2
בסיס נפחי: ייתן אלימינציה של הופמן דרישת אנטי-פריפלנר: חובה גם כאן
תרגיל 5: סטריאוכימיה באלימינציה
ניתוח הסטריאוכימיה
כאשר אנחנו מתמודדים עם מולקולה שיש בה מרכזי כיראליות, חשוב לזכור:
עקרון הסיבוב החופשי:
- במולקולות ליניאריות (לא טבעתיות), אנחנו יכולים לסובב כדי להשיג אנטי-פריפלנר
- לא משנה את הקונפיגורציה של המרכזים הכיראליים שלא משתתפים בתגובה
בדיקת קונפיגורציה
שיטת הבדיקה:
- זיהוי סדר עדיפויות לפני התגובה
- ביצוע הסיבוב הנדרש
- בדיקה שהקונפיגורציה נשמרה
דוגמה מעשית: אם היה לנו R לפני התגובה, והסיבוב נכון - נישאר עם R.
קביעת סטריאוכימיית התוצר
כלל חשוב: האנטי-פריפלנר קובע את הסטריאוכימיה של הקשר הכפול שייווצר
- אם הקבוצות הגדולות באותו כיוון במצב המוצא ← תתקבל Z
- אם הקבוצות הגדולות בכיוונים מנוגדים ← תתקבל E
תרגיל 6: תחרות SN1 מול E1
זיהוי התנאים
נתון: תנאי חימום עם בסיס חלש
ניתוח:
- ללא חימום: היינו מצפים ל-SN1 (התמרה)
- עם חימום: אלימינציה מועדפת ← E1
מאפייני E1
נקודות חשובות:
- אין דרישת אנטי-פריפלנר (שלב ראשון: יצירת קרבוקטיון)
- יכולים להתרחש שחלופי קרבוקטיון
- אם יש מרכזי כיראליות בתוצאה - עלולה להיות רצמיזציה
זיהוי היעדר כיראליות בתוצר
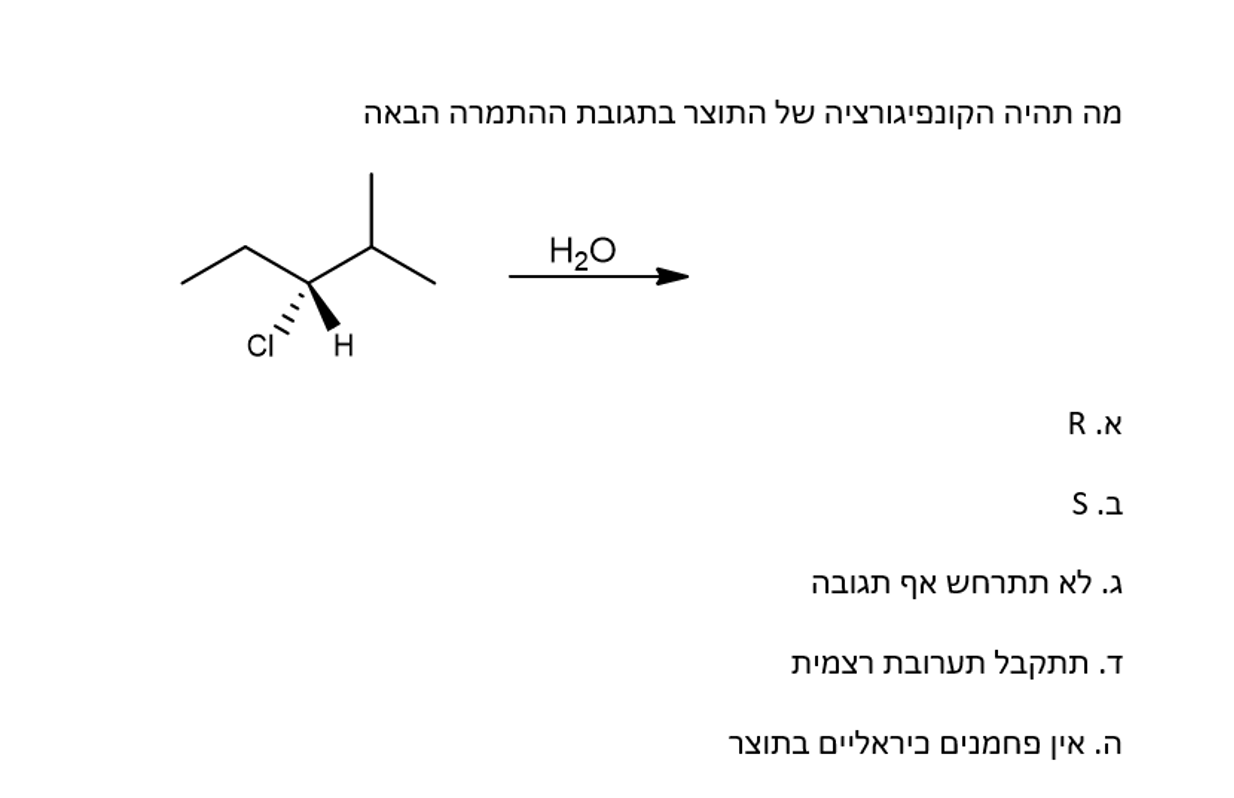
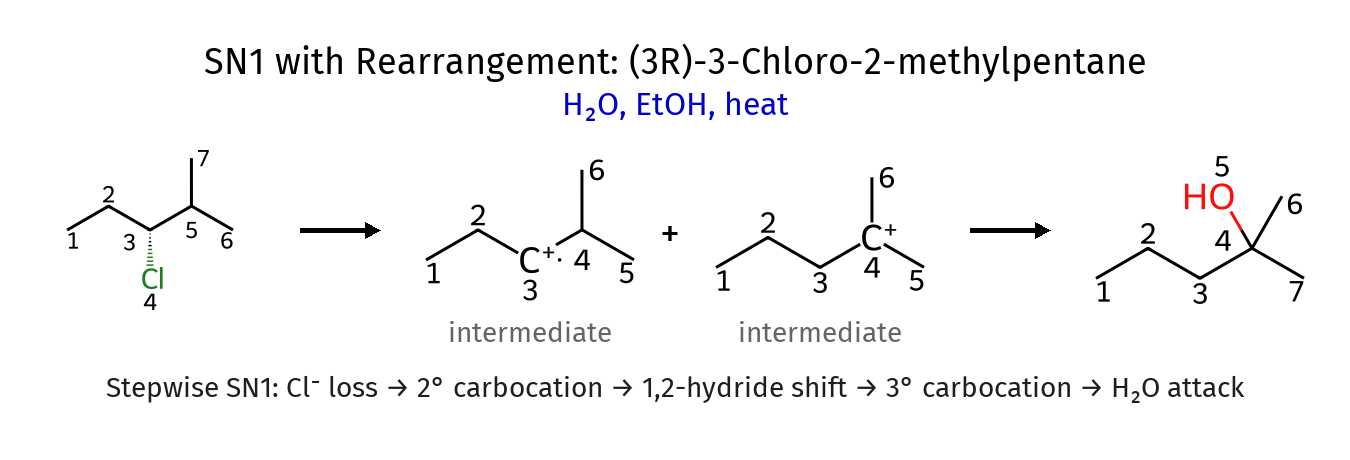
מדוע אין כיראליות בתוצאה?
- שכלול קרבוקטיון: מעבר למבנה סימטרי יותר
- יצירת קשר כפול: הפחמנים הופכים ל-SP² (מישוריים)
- תקיפה מכיוונים שונים: במקרה של התמרה, המולקולה יכולה להיתקף משני צדדים
הערה: הטמפרטורה היא הגורם הקובע בין SN1 (טמפרטורת חדר) ל-E1 (חימום). גם ב-E1 לא הייתה כיראליות במקרה הזה.
זיהוי קונפיגורציית בתגובה
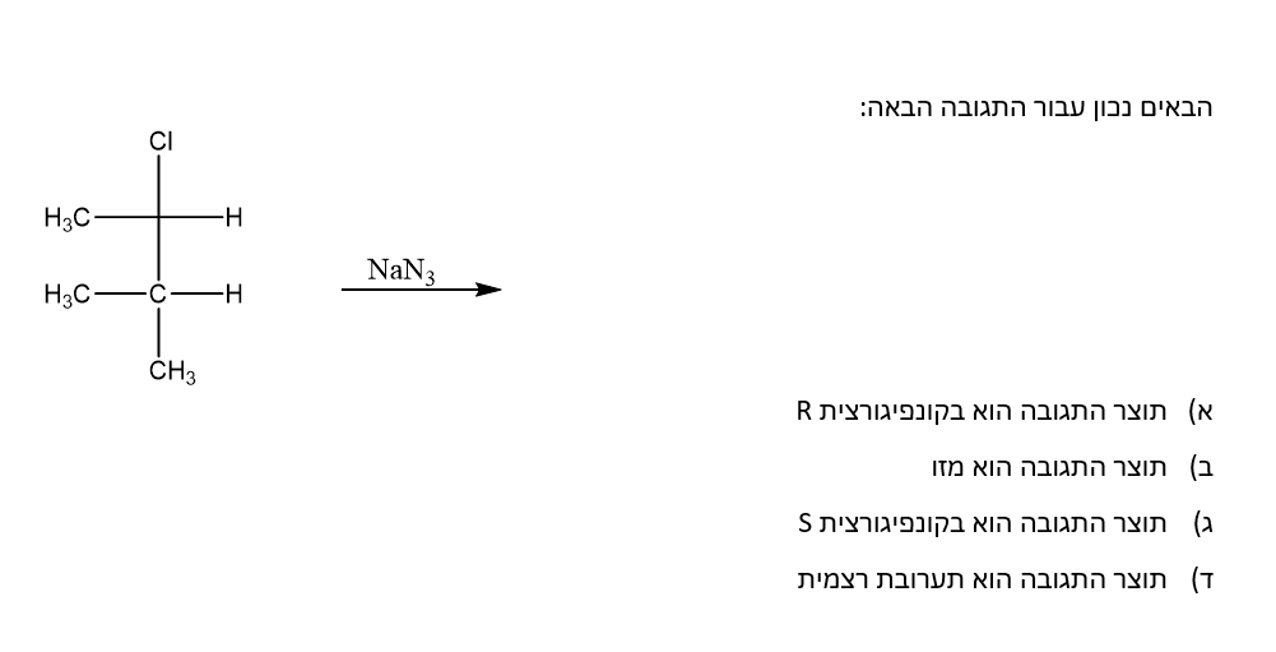
יש פחמן שניוני ונוקלאופיל חזק בסיס חלש -> SN2.
המולקולה בקונפיגורציית R, מכאן שהקבוצה העוזבת לאחר היפוך תהיה בקונפיגורציית S.
שאלת סיכום מאפיינים

| עובדה | SN1 | E1 | SN2 | E2 |
|---|---|---|---|---|
| מצופה שיתרחשו שחלופים | כן | כן | ||
| תוצר הביניים מיוצב ע״י ממס פולרי פרוטי (מים או כוהל) | כן | כן | ||
| דורש יצירה של תוצר ביניים קרבוקטיון | כן | כן | ||
| משוואת קצב התגובה היא $Rate=k[\text{RX}][\text{Nuc/Base}]$ | כן | כן | ||
| מתקבל היפוך קונפיגורציה בתוצר הסופי | כן |
נקודות מפתח לזכירה:
- תמיד לבדוק אנטי-פריפלנר ב-E2
- בסיס נפחי = הופמן, בסיס קטן = זייצב
- חימום מעודד אלימינציה על פני התמרה
- שחלופי קרבוקטיון יכולים לשנות את התוצאה הצפויה
- סיבוב חופשי מאפשר להשיג אנטי-פריפלנר הנדרש