תגובות סיפוח של אַלְקִינים ($\ce{R–C≡C–R’}$)
מבוא לאלקינים ותכונותיהם
אלקינים הם פחמימנים בלתי רוויים המכילים קשר משולש בין שני אטומי פחמן. הקשר המשולש מורכב מקשר סיגמא אחד ($\ce{σ}$) ומשני קשרי פאי ($\ce{π}$), מה שמקנה לאלקינים תכונות כימיות ייחודיות ופעילות גבוהה.
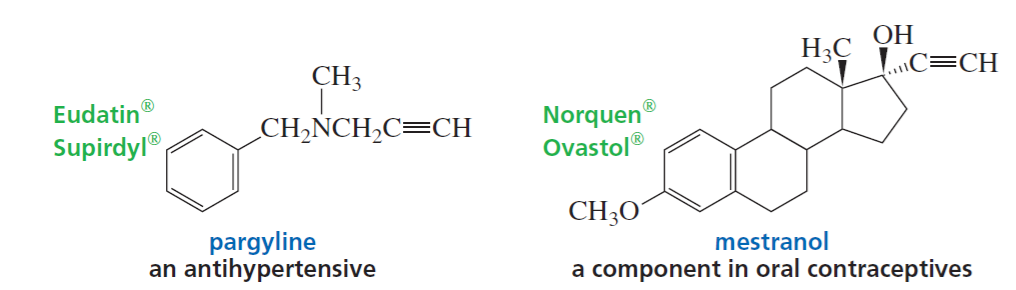
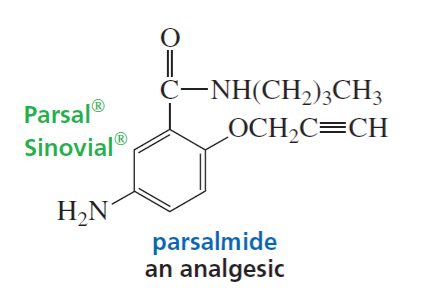
האלקינים ממלאים תפקיד חשוב בעולם הכימיה האורגנית והביולוגית. דוגמאות בולטות לתרופות שמכילות קבוצות אלקיניות כוללות את המסטרנול (Mestranol), הורמון נשי סינתטי המשמש כרכיב בגלולות למניעת הריון, ותרופות אנטי-סרטניות המופקות מחיידקים כמו אנדיאינים (Enediynes), המשמשות לתקיפת תאים סרטניים באופן סלקטיבי.
הכימיה של אלקינים מתמקדת בעיקר בתגובות סיפוח, בדומה לאלקנים, אך עם מספר הבדלים משמעותיים הנובעים מאופי הקשר המשולש וממבנה המולקולה.
תגובת הידרוגנציה של אלקינים
\[\text{Reduction of Alkyne to an Alkane}\]
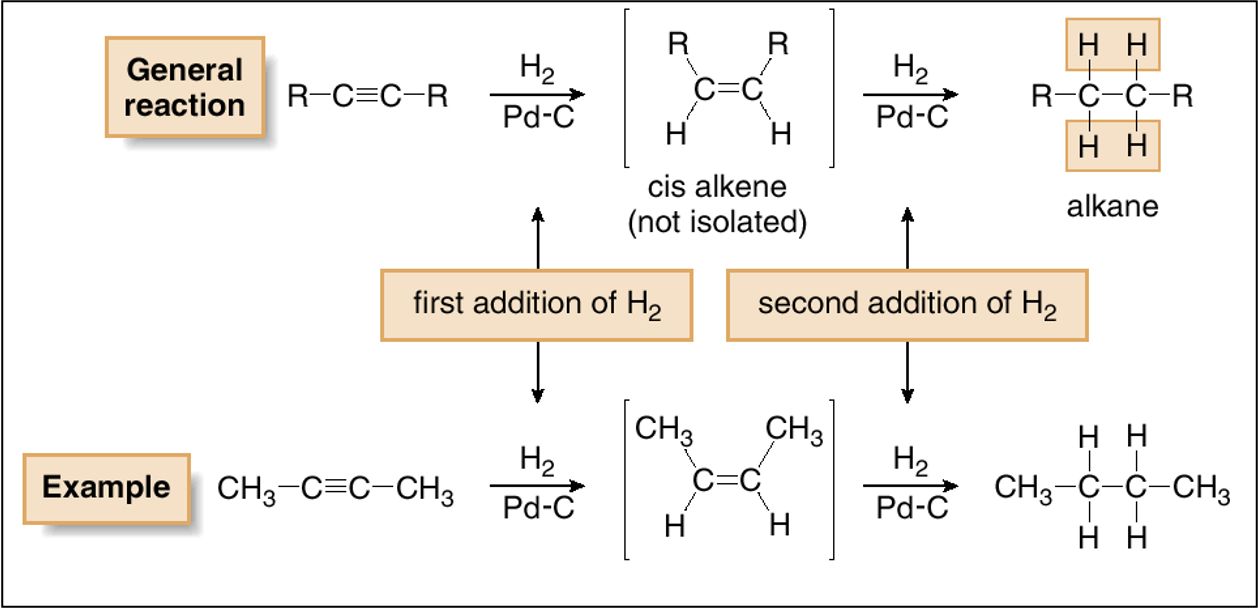
הידרוגנציה היא תגובת סיפוח של $\ce{H2}$ על הקשר המשולש בנוכחות קטליזטור מתכתי. התגובה מתרחשת בשני שלבים עוקבים:
\[\ce{R-C≡C-R' ->[H2/Pd] R-CH=CH-R' ->[H2/Pd] R-CH2-CH2-R'}\]התגובה מתחילה על אלקין:
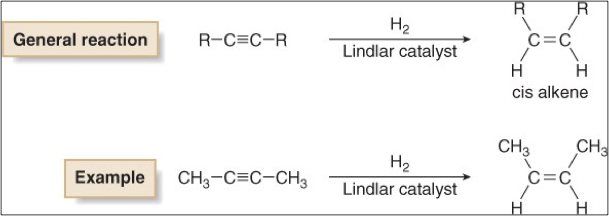
\[\ce{R-C#CH} \quad \text{or} \quad \ce{R-C#C-R'}\]בשלב הראשון, מולקולת $\ce{H2}$ מסתפחת לקשר המשולש ליצירת אַלקֵן עם סטריאוכימיה cis (תוצר Z), שכן שני אטומי המימן נכנסים מאותו צד של המולקולה.
\[\begin{array}{cccccc} & \ce{R} & & & & \ce{R} \\ & & \diagdown & & \diagup & \\ & & & \ce{C=C} & & \\ & & \diagup & & \diagdown & \\ & \ce{\mathbf{H}} & & & & \ce{\mathbf{H}} \\ \end{array}\]בתנאים רגילים עם קטליזטור פלדיום, התגובה ממשיכה באופן ספונטני לשלב השני, בו מסתפחת מולקולת $\ce{H2}$ נוספת לקבלת אלקאן רווי.
\[\begin{array}{cccccc} & & \ce{\mathbf{H}} & & \ce{\mathbf{H}} & \\ & & \vert & & \vert & & \\ \ce{R} & - & \ce{C} & - & \ce{C} & - & \ce{R} \\ & & \vert & & \vert & \\ & & \ce{\mathbf{H}} & & \ce{\mathbf{H}} & \end{array}\]חשוב להבין שבשימוש בקטליזטור פלדיום רגיל, לא ניתן לעצור את התגובה בשלב הביניים של האַלקֵן. התגובה ממשיכה באופן אוטומטי עד לקבלת האלקאן הרווי כתוצר סופי.
הידרוגנציה סלקטיבית עם קטליזטור לינדלר
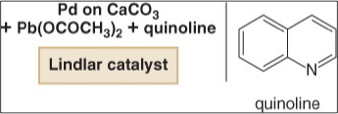
כדי לאפשר עצירה סלקטיבית של ההידרוגנציה בשלב האַלקֵן, פותח קטליזטור מיוחד הנקרא קטליזטור לינדלר (Lindlar catalyst). קטליזטור לינדר מורכב מפלדיום על גבי סידן קרבונט, המורעל חלקית עם עופרת אצטט ותרכובות נוספות. המנגנון המדויק של פעולתו אינו ידוע במלואו, אך השימוש בו מאפשר הידרוגנציה חלקית סלקטיבית:
\[\ce{R-C≡C-R' ->[H2/Lindlar] R-CH=CH-R' \text{ (cis-alkene)}}\] \[\begin{array}{cccccc} & \ce{R} & & & & \ce{R} \\ & & \diagdown & & \diagup & \\ & & & \ce{C=C} & & \\ & & \diagup & & \diagdown & \\ & \ce{\mathbf{H}} & & & & \ce{\mathbf{H}} \\ \end{array}\]התוצר הבלעדי הוא האיזומר cis של האַלקֵן, מה שהופך את השיטה לבעלת ערך סינתטי רב ליצירת אַלקֵנים עם סטריאוכימיה מוגדרת.
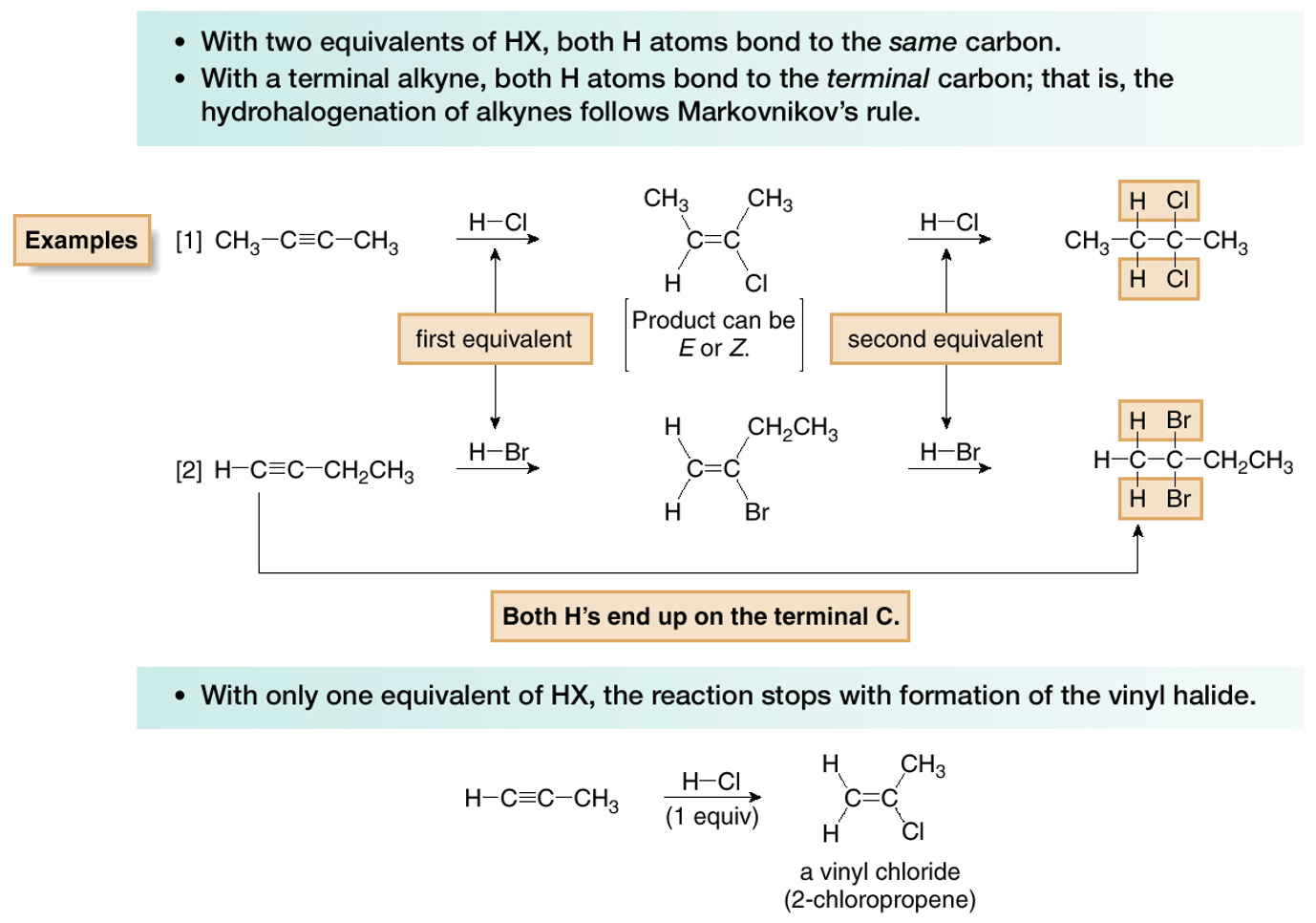
סיפוח הלוגני מימן ($\ce{HX}$) לאלקינים (הידרוהלוגנציה - Hydrohalogenation)
תגובת סיפוח $\ce{HX}$ לאלקינים מתרחשת לפי כלל מרקובניקוב, בדומה לאלקֵנים. המימן מסתפח לפחמן הפחות מותמר, בעוד שההלוגן מסתפח לפחמן היותר מותמר:
\[\ce{R-C≡C-H->[HX][(X=Cl,Br,I)] R-CX=CH2}\]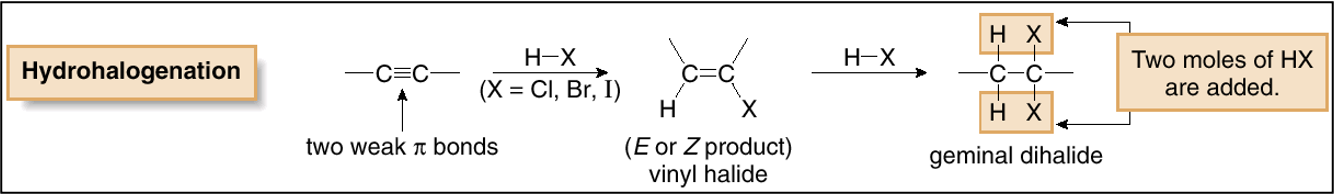
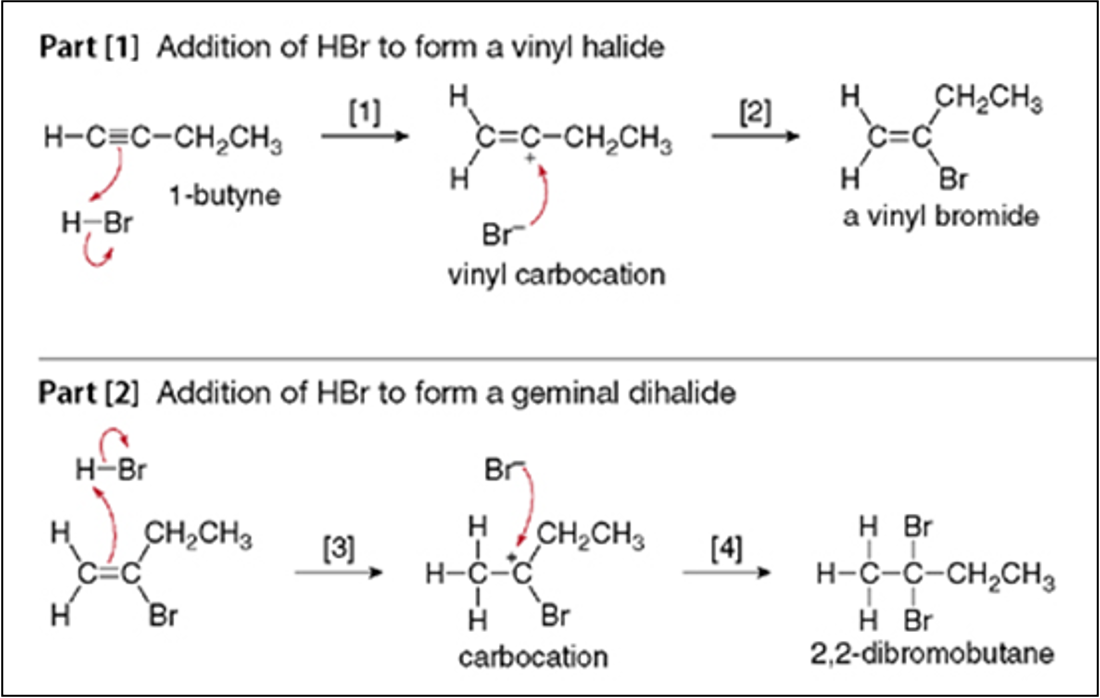
המנגנון כולל התקפה אלקטרופילית של $\ce{H+}$ על הקשר המשולש ליצירת קרבוקטיון ויניל, ולאחר מכן התקפה נוקלאופילית של $\ce{X-}$:
\[\ce{R-C≡C-H ->[H+] R-C^+=CH2 ->[X-] R-CX=CH2}\]הקרבוקטיון הנוצר מיוצב על ידי קבוצות האלקיל הסמוכות, וזו הסיבה שהפרוטון מסתפח לפחמן הפחות מותמר - כדי ליצור את הקרבוקטיון היציב ביותר.
בעודף של $\ce{HX}$, התגובה ממשיכה לשלב שני:
\[\ce{R-CX=CH2 + HX -> R-CX2-CH3}\]שוב, המימן נכנס לפחמן שכבר נושא מימנים, וההלוגן נכנס לפחמן שכבר נושא הלוגנים.
\[\begin{array}{cccccc} & & \ce{X} & & \ce{H} & \\ & & \vert & & \vert & & \\ \ce{R} & - & \ce{C} & - & \ce{C} & - & \ce{R} \\ & & \vert & & \vert & \\ & & \ce{X} & & \ce{H} & \end{array}\]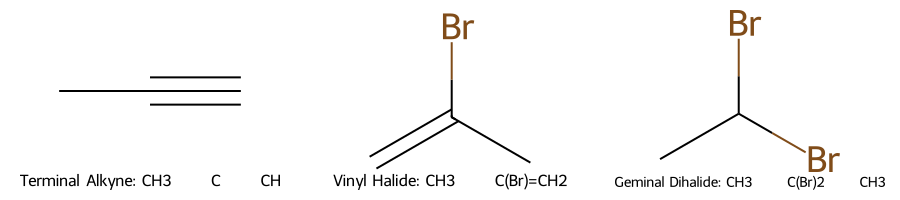
כדי לעצור את התגובה בשלב הראשון ולקבל אלקֵן הלוגני, יש להשתמש בכמות אקוויוולנטית מדויקת (1:1) של $\ce{HX}$.
חשוב לציין שבתגובת ההידרוהלוגנציה אין העדפה סטריאוכימית - התוספים יכולים להיכנס מאותו צד (syn) או מצדדים מנוגדים (anti), ומתקבלת תערובת של איזומרים גאומטריים.
תגובת הלוגנציה של אלקינים (Halogenation) - סיפוח $\ce{X2}$
\[\text{Addition of Halogens to Alkynes}\]
סיפוח הלוגנים ($\ce{X2}$) לאלקינים מתרחש בצורה אנטי-סטריאוספציפית, כלומר שני אטומי ההלוגן נכנסים מצדדים מנוגדים של המולקולה:
\[\ce{R-C≡C-R' ->[X2] R-CX=CX-R' (trans) ->[X2] R-CX2-CX2-R'}\]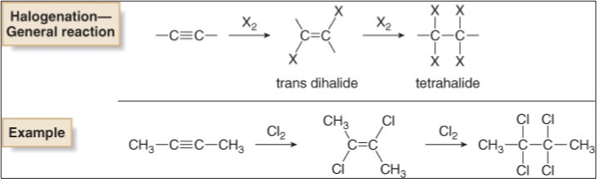
המנגנון כולל יצירת יון הלוניום מחזורי כחומר ביניים, בדומה לתגובה עם אַלקֵנים:
\[\begin{array}{cccccc} & & & \ce{Cl+} & & \\ & & \diagup & & \diagdown & & \\ & & \ce{C} & = & \ce{C} & & \\ & \diagup & & & & \diagdown \\ \ce{CH3} & & & & & & \ce{CH3} \end{array}\]בשלב הראשון, האלקטרונים של קשר $\ce{π}$ תוקפים את מולקולת ההלוגן, גורמים לשבירת הקשר $\ce{X-X}$ ויצירת גשר הלוניום (יון כלורוניום בדוגמה). יון ההלוניום המחזורי חוסם גישה מצד אחד של המולקולה, מה שמכתיב את הכניסה האנטי של ההלוגן השני מהצד הנגדי.
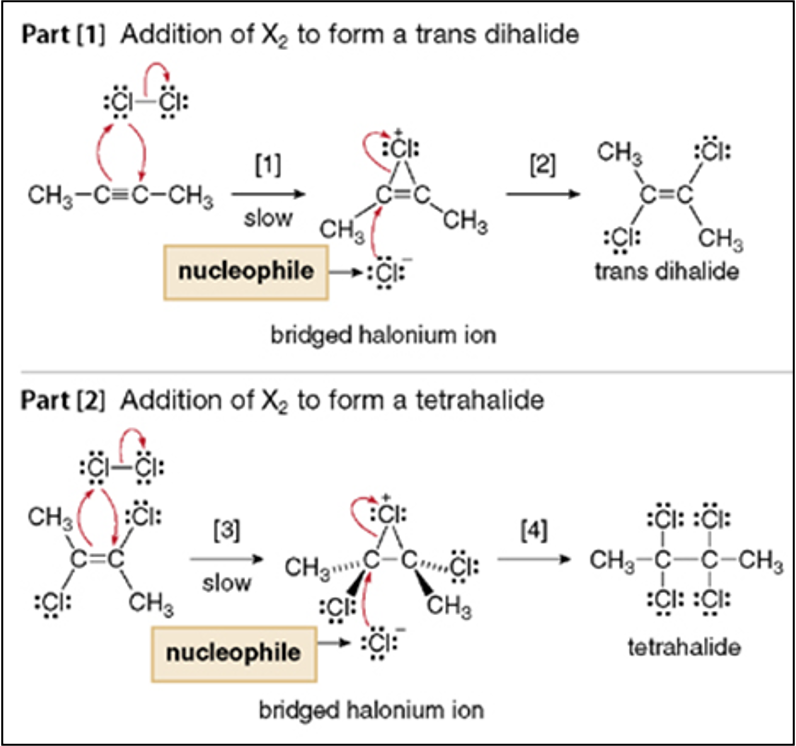
בנוכחות עודף של $\ce{X2}$, התגובה ממשיכה ליצירת תוצר טטרה-הלוגני, בו כל פחמן נושא שני אטומי הלוגן.
\[\begin{array}{cccccc} & & \ce{\mathbf{X}} & & \ce{\mathbf{X}} & \\ & & \vert & & \vert & & \\ \ce{R} & - & \ce{C} & - & \ce{C} & - & \ce{R} \\ & & \vert & & \vert & \\ & & \ce{\mathbf{X}} & & \ce{\mathbf{X}} & \end{array}\]הערה: אין משמעות לצדדים כי בסוף התוצר הוא טטרה-הלוגני, כלומר אין הבדל בין צדדים. ההבדל בשלבי הביניים מובא להבנה.
חומציות של אלקינים טרמינליים (Alkylation of Alkynes)
\[\ce{R-C#C-H ->[B:^-] R-C#C:^- + B-H}\]
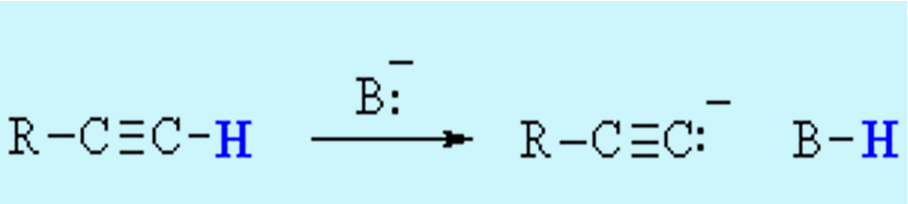
אחת התכונות הייחודיות של אלקינים טרמינליים ($\ce{R-C≡C-H}$) היא החומציות היחסית הגבוהה של אטום המימן הקשור לפחמן $sp$. ערכי ה-pKa האופייניים הם:
- אלקאן ($\ce{C_{sp^3}-H}$): pKa ≈ 50
- אלקן ($\ce{C_{sp^2}-H}$): pKa ≈ 44
- אַלְקִין ($\ce{C_{sp}-H}$): pKa ≈ 25
החומציות המוגברת נובעת מאופי האורביטל ההיברידי $sp$, שמכיל 50% אופי s ולכן קרוב יותר לגרעין ואלקטרושלילי יותר. כתוצאה מכך, הקשר $\ce{C-H}$ מקוטב יותר והפרוטון חומצי יותר.
למרות ש-pKa של 25 אינו מגדיר חומצה חזקה במונחים מוחלטים (לשם השוואה, $\ce{HCl}$ בעל pKa של -7), הוא מספיק חומצי כדי להגיב עם בסיסים חזקים כגון $\ce{NH2-}$ (pKa של $\ce{NH3}$ הוא 38):
\[\ce{R-C≡C-H + NH2- -> R-C≡C^- + NH3}\]יישומים סינתטיים - הארכת שרשרת
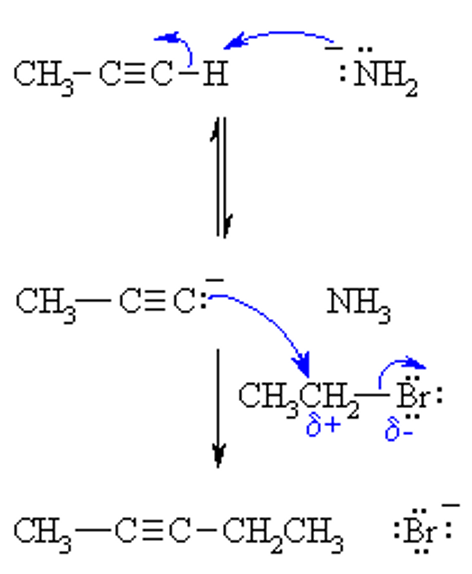
היכולת ליצור אניון אצטיליד ($\ce{R-C≡C^-}$) פותחת אפשרויות סינתטיות חשובות. האניון הוא נוקלאופיל חזק ויכול להגיב בתגובות $\mathrm{S_N2}$ עם אלקיל הלידים:
\[\ce{R-C≡C^- + R'-X -> R-C≡C-R' + X^-}\]שיטה זו מאפשרת הארכת שרשרת פחמנית באופן מבוקר. לדוגמה, ניתן להמיר אַלְקִין בעל שני פחמנים לאַלְקִין בעל ארבעה או יותר פחמנים על ידי תכנון נכון של הנוקלאופיל והאלקטרופיל.
הידרציה של אלקינים ותופעת הטאוטומריזציה
תזכורת: הידרציה - סיפוח מים בתנאים חומציים עם קשר כפול. מימן הולך לפחות מותמר, $\ce{OH}$ הולך ליותר מותמר. נעשה כעת אותו הדבר על קשר משולש.
\[\text{Hydration - Electrophilic Addition of Water}\]
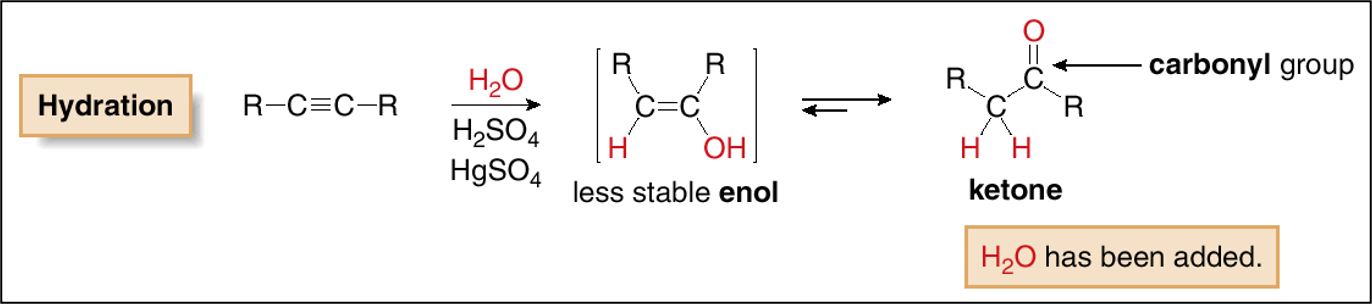
תגובת הידרציה של אלקינים בתנאים חומציים (בנוכחות כספית כקטליזטור) מובילה ליצירת אנול כתוצר ראשוני:
\[\ce{R-C≡C-H ->[H2O/H+/Hg^{2+}] R-C(OH)=CH2}\]התגובה מתרחשת לפי כלל מרקובניקוב - המימן מסתפח לפחמן הפחות מותמר וקבוצת ההידרוקסיל לפחמן היותר מותמר.
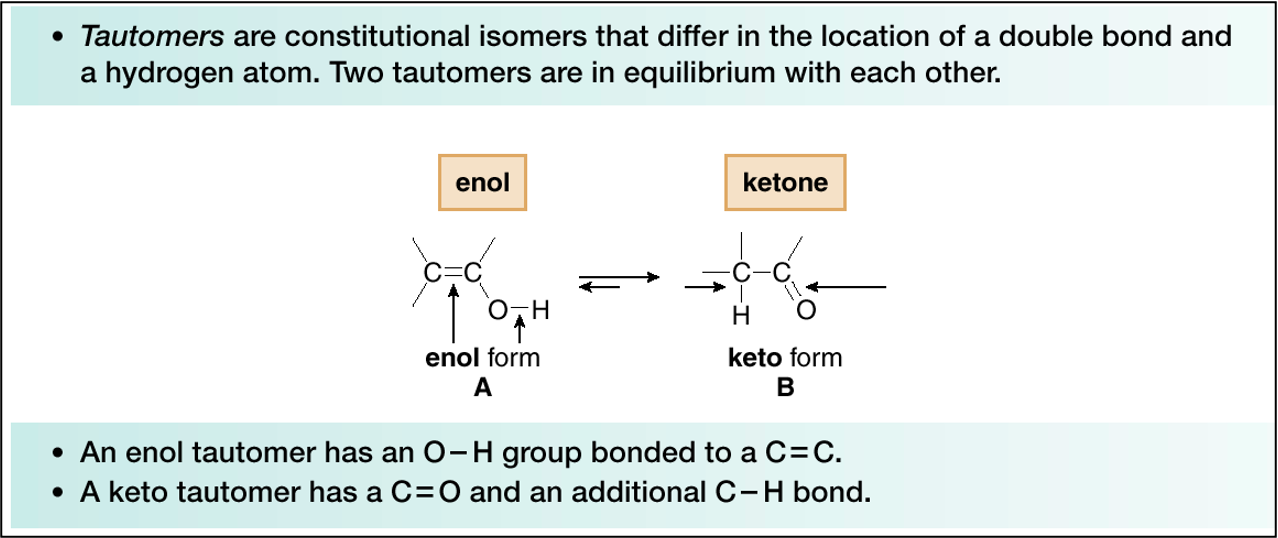
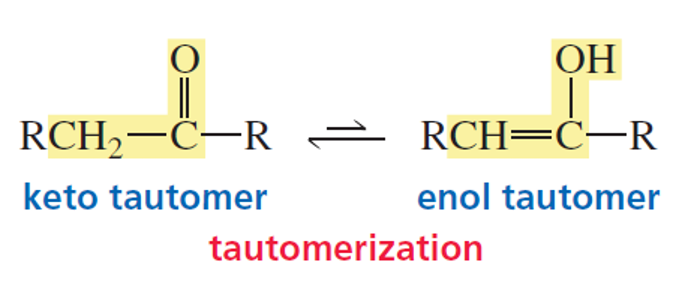
טאוטומריזציה של אנול-קטון
האנול הנוצר אינו יציב ועובר טאוטומריזציה מהירה לקטון המתאים. טאוטומרים הם איזומרים מבניים הנמצאים בשיווי משקל דינמי מהיר:
\[\ce{R-C(OH)=CH2 <=> R-C(=O)-CH3}\]מנגנון הטאוטומריזציה בתנאים חומציים:
- פרוטונציה של החמצן: האלקטרונים הלא קושרים של החמצן תוקפים פרוטון מהתווך החומצי
- העברת פרוטון: הקשר $\ce{π}$ בין הפחמנים נשבר והאלקטרונים עוברים ליצירת קשר $\ce{π}$ בין הפחמן לחמצן
- דה-פרוטונציה: הורדת הפרוטון מהחמצן המפרוטן
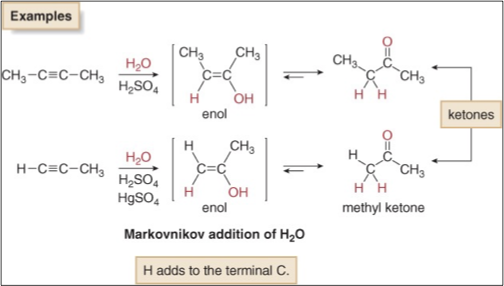
שיווי המשקל נוטה בחוזקה לכיוון הקטון בשל היציבות האנרגטית הגבוהה יותר של קשר $\ce{C=O}$ לעומת קשר $\ce{C=C}$. הקשר הכפול פחמן-חמצן חזק יותר אנרגטית מקשר כפול פחמן-פחמן, מה שמניע את שיווי המשקל לכיוון התוצר הקטוני.
התוצאה הסופית של הידרציה של אלקינים היא אפוא קטון, כאשר קבוצת הקרבוניל נמצאת על הפחמן היותר מותמר של הקשר המשולש המקורי. זוהי שיטה חשובה לסינתזה של קטונים מאלקינים.
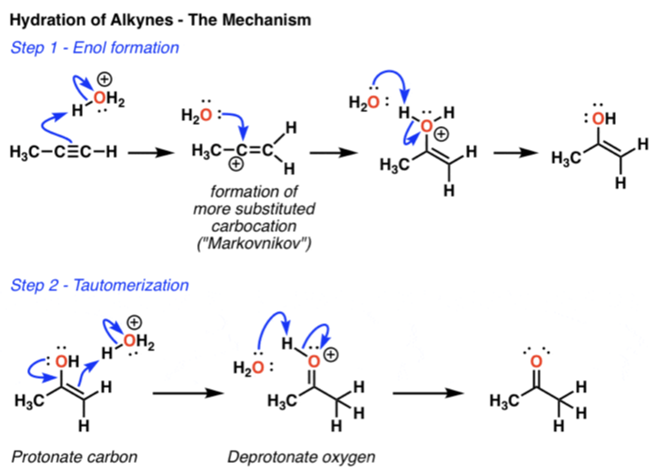
שלב 1:
- המימן נכנס לפחמן הפחות מותמר.
- קבלה של קרבוקטיון.
- המים תוקפים את הקרבוקטיון
- נוקלאופיל $\ce{OH-}$ תוקף את הקרבוקטיון - דה-פרוטונציה של $\ce{OH}$ ליצירת אנול.
שלב 2 (שיווי משקל של אנול וקטון):
- זוג האלקטרונים הלא קושר של החמצן oh נכנס לקשר כפול של החמצן. .. קוטף פרוטון … הקשר הכפול בין הפחמן לחמצן הרבה יותר אנרגטי - מה שמושך לכיוון הקטון.
- קשר פיא נפתח (הרי פחמן לא יכול להיות קשור לחמישה קשרים.
- הורדת הפרוטון מהחמצן וקבלת קטון.
חשוב לזכור: התוצר יהיה על הפחמן היותר מותמר של הקשר המשולש.
סיפוח מים בתנאים חומציים - נקבל
סיפוח מים בתנאים בסיסיים - נקבל
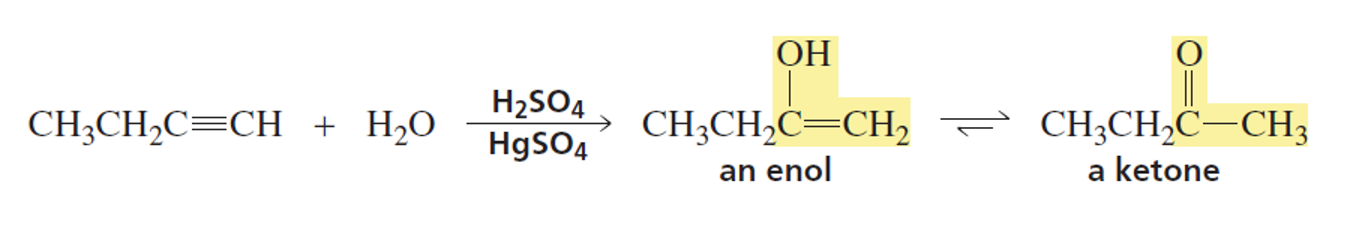
שאלות לדוגמה
שאלה 1 - תגובת הידרוהלוגנציה של אלקין
מה התוצר הסופי העיקרי בתגובה?

התשובה הנכונה היא B. זאת תגובת הידרוהלוגנציה (סיפוח $\ce{HX}$) של אלקין, בה:
- המימנים נכנסים לפחמן הפחות מותמר (מרקובניקוב) - בתמונה זו, לפחמן הימני.
- הברומים נכנסים לפחמן היותר מותמר, וכל הברומים על אותו פחמן.
שאלה 2 - הידרציה (סיפוח מים) של אלקין בתנאים חומציים
מה התוצר הסופי העיקרי בתגובה?

התשובה הנכונה היא שוב B.
התוצר הוא אנול.
סוף הסיפוח הראשון נקבל:
\[\begin{array}{cccccc} & \ce{HO} & & & & \ce{H} \\ & & \diagdown & & \diagup & \\ & & & \ce{C=C} & & \\ & & \diagup & & \diagdown & \\ & \ce{\mathbf{--}} & & & & \ce{\mathbf{H}} \\ \end{array}\]- $\ce{H}$ נכנס לפחמן הפחות מותמר (מרקובניקוב) - בתמונה זו, לפחמן הימני.
- $\ce{OH}$ נכנס לפחמן היותר מותמר (השני מימין), ונותן לנו אנול.
בשלב הבא אפשר להבין איפה יהיה $\ce{CH3}$ ואיפה הכפול.
האנול לא יציב, ולכן הוא עובר טאוטומריזציה לקטון:
\[\begin{array}{cccccc} & \ce{O} & & & & \ce{H} \\ & & \diagdown\diagdown & & \diagup & \\ & & & \ce{C-C} & \ce{-} & \ce{H} \\ & & \diagup & & \diagdown & \\ & \ce{\mathbf{--}} & & & & \ce{\mathbf{H}} \\ \end{array}\]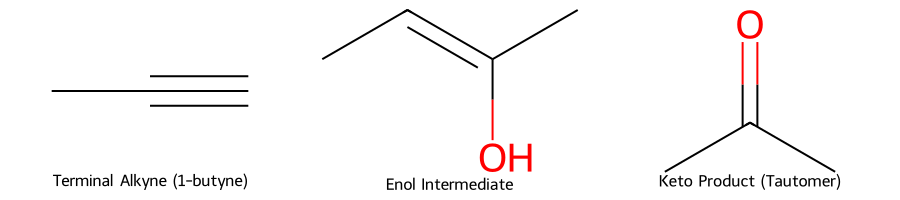
סינתזה והארכת שרשרת באמצעות אלקינים
השימוש באניוני אצטיליד כנוקלאופילים מאפשר הארכת שרשרת פחמנית באופן מבוקר ויעיל. נבחן דוגמה מפורטת להמחשת העיקרון:
בתגובה הראשונה, אלקין טרמינלי מגיב עם בסיס חזק ($\ce{NH2-}$) ליצירת אניון אצטיליד:
\[\ce{R-C≡C-H + NH2- -> R-C≡C^- + NH3}\]האניון הנוצר משמש כנוקלאופיל בתגובת $\mathrm{S_N2}$ עם אלקיל הליד ראשוני. חשוב להדגיש שהתגובה מתרחשת ביעילות רק עם אלקיל הלידים ראשוניים או מתיל הלידים, שכן עם אלקיל הלידים משניים או שלישוניים תתרחש בעיקר תגובת אלימינציה $\mathrm{E2}$ ולא הארכת שרשרת.
דוגמאות מעשיות להארכת שרשרת
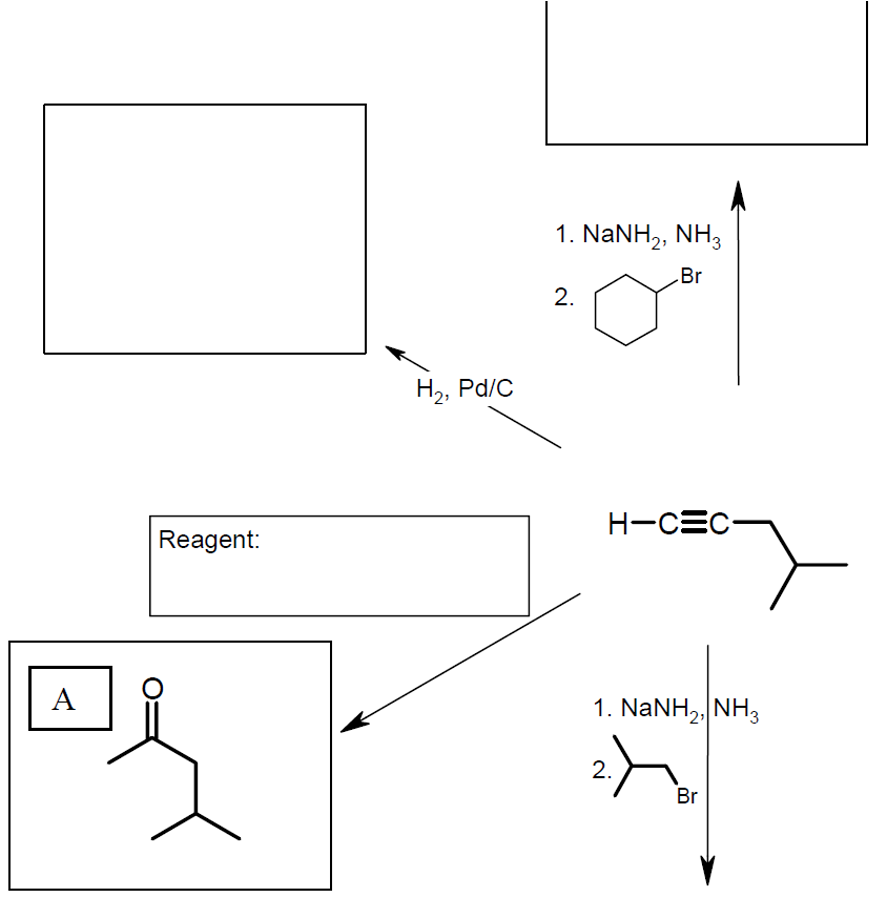
חץ ראשון $\uparrow$
הורדת פרוטון על ידי בסיס חזק $\ce{NaNH2}$, ולאחר מכן התקפה של נוקלאופיל על אלקטרופיל.
-
$\ce{NaNH2}$ בסיס חזק, יקטוף את הפרוטון של הקשר המשולש. יווצר חומר שהוא נוקלאופילי (או בסיסי):
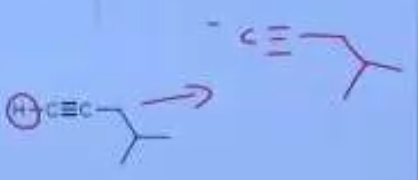
-
החומר הזה הוא בעצם הכנה להארכת השרשרת. הוא יתקוף אלקטרופיל, במקרה הזה את הפחמן שבפינה, ותיווצר קבוצה עוזבת של $\ce{Br-}$ (תגובת $\mathrm{S_N2}$):
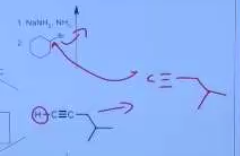
-
נצייר את הארכת השרשרת:
נתחיל עם מה שלא נגענו בו, ונחבר לו את הטבעת.
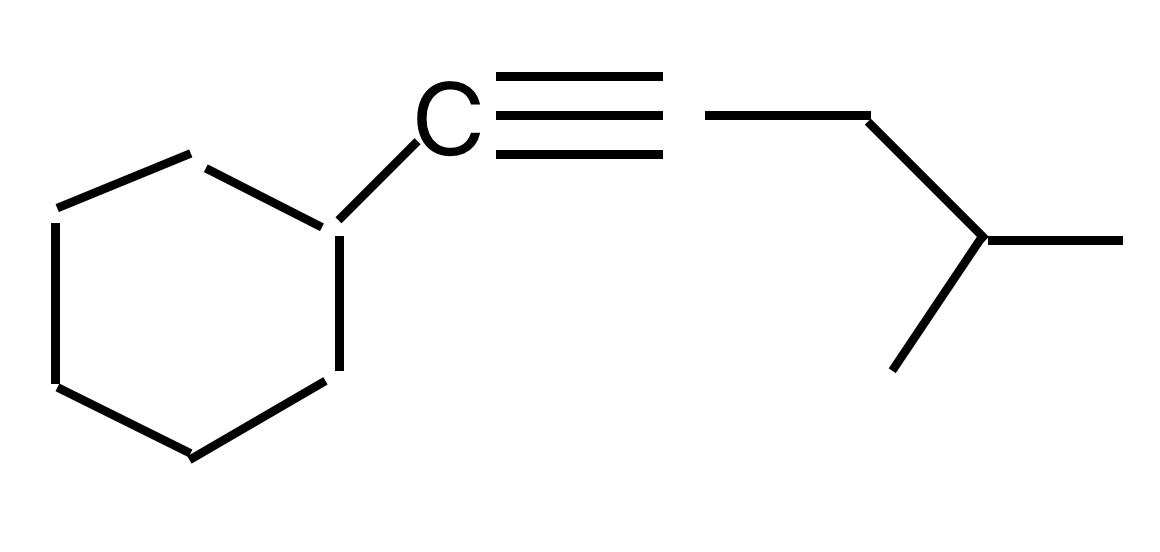
- אין משמעות להיפוך הקונפיגורציה כי הפחמן לא כיראלי.
- אם היינו רוצים לתכנן שעל הפחמן הזה יהיה ציקלו הקסאן…
חץ שני ↖
יש $\ce{H2}$ על פלדיום , מכאן נסיק תגובת הידרוגנציה על אלקין, שמחזרת את האלקין לאלקאן.
נצייר את המולקולה המקורית בלי קשרי ה-$\pi$ (בלי הקשרים המשולשים). נספו כמה פחמנים יש - חמישה, ועל הפחמן הרביעי נוסיף.

כאשר מבצעים הידרוגנציה מלאה ($\ce{H2/Pd}$) על התוצר הסופי, מתקבל אלקאן רווי. תהליך זה ממחיש כיצד ניתן להשתמש באלקינים ככלי סינתטי לבניית שלדי פחמן מורכבים.
חץ שלישי $\downarrow$
דומה לתגובה הראשונה, רק שבמקום הטבעת נחבר למולקולה הנתונה:
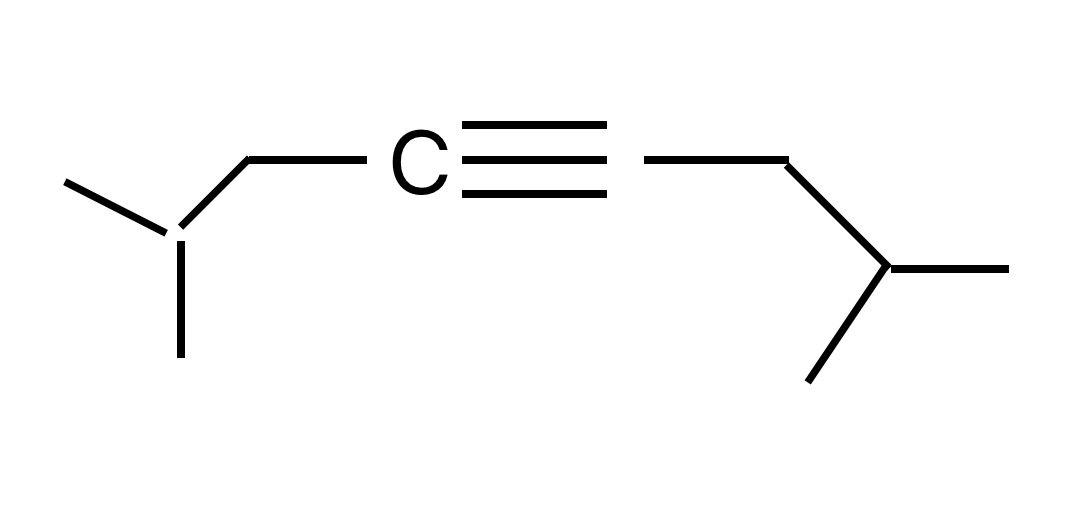
כימיה של אתרים
\[\text{Ethers - Organic Compounds with the General Formula R-O-R'}\]מבוא ותכונות כלליות
אתרים הם תרכובות אורגניות המכילות אטום חמצן הקשור לשני אטומי פחמן ($\ce{R-O-R’}$). אתרים הם מולקולות פולריות בגלל ההבדל באלקטרושליליות בין החמצן לפחמן: החמצן נושא מטען חלקי שלילי ($\delta^-$) והפחמנים נושאים מטען חלקי חיובי ($\delta^+$).
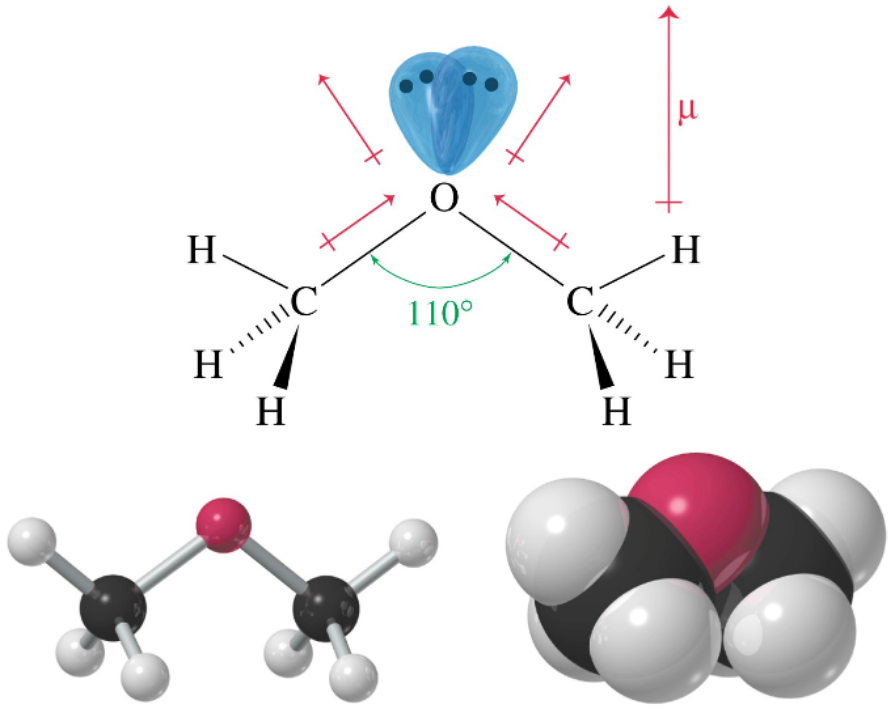
למרות הפולריות, הכוחות הבין-מולקולריים העיקריים באתרים הם כוחות ואן דר ואלס. אתרים אינם יכולים ליצור קשרי מימן בינם לבין עצמם מכיוון שאין להם קשר קוולנטי $\ce{O-H}$. עם זאת, הם כן יכולים לשמש כאקספטורים של קשרי מימן עם מולקולות אחרות כמו מים, מה שמסביר את המסיסות החלקית שלהם במים.
חשיבות היסטורית ושימושים
דיאתיל אתר ($\ce{CH3CH2-O-CH2CH3}$) היה אחד מחומרי ההרדמה הראשונים בהיסטוריה. הוא גורם לאופוריה ולירידה משמעותית ביכולות הקוגניטיביות והמוטוריות עד כדי איבוד הכרה. השימוש בו הופסק בשל סיכוני בטיחות, במיוחד דליקותו הגבוהה.

אתרים נפוצים בתרכובות ביולוגיות ותרופתיות רבות, כולל הרואין (שימש בעבר כמשכך כאבים אך כיום ידוע כסם ממכר), קפסאיצין (החומר החריף בפלפל צ’ילי, משמש כמשכך כאבים לדלקות פרקים), וויטמין E (נוגד חמצון חשוב המגן על ממברנות התא מפני רדיקלים חופשיים).
שיטות להכנת אתרים
1. סינתזת וויליאמסון - תגובת $\mathrm{S_N2}$
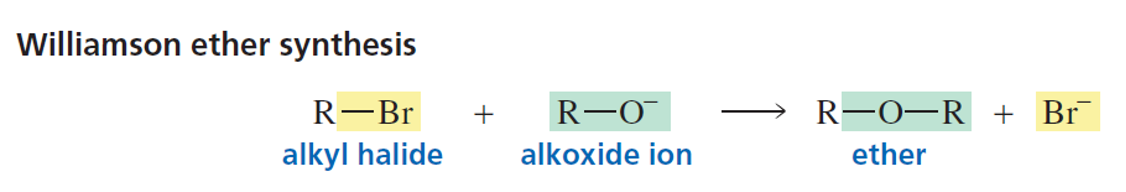
השיטה הקלאסית והנפוצה ביותר להכנת אתרים היא סינתזת וויליאמסון, המבוססת על תגובת $\mathrm{S_N2}$ בין אלקוקסיד $\ce{R-O-}$ (אניון אלכוהולט) לאלקיל הליד:
\[\ce{R-O^- + R'-X -> R-O-R' + X^-}\]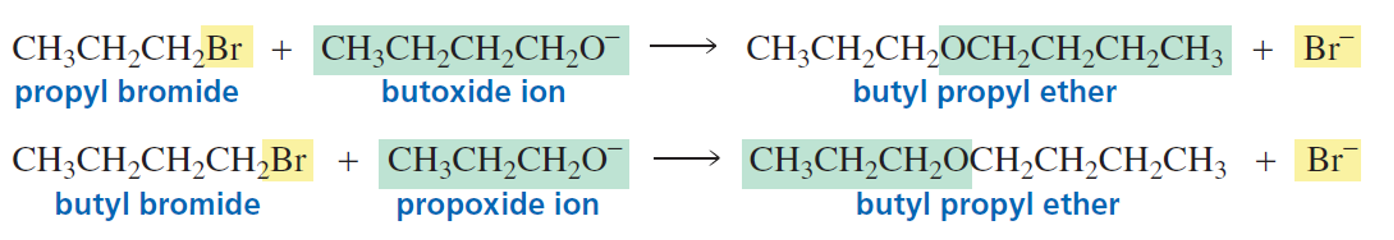
בתכנון רטרוסינתטי של אתר, יש לבחור היכן “לחתוך” את המולקולה. לדוגמה, להכנת tert-butyl ethyl ether יש שתי אפשרויות:
- שימוש ב-tert-butoxide כנוקלאופיל ו-ethyl bromide כאלקטרופיל
- שימוש ב-ethoxide כנוקלאופיל ו-tert-butyl bromide כאלקטרופיל
האפשרות השנייה אינה מעשית מכיוון שאלקיל הליד שלישוני עם בסיס חזק ונוקלאופילי יוביל בעיקר לתגובת $\mathrm{E2}$ ולא ל-$\mathrm{S_N2}$. לכן, יש להשתמש תמיד באלקיל הליד ראשוני (או מתיל) כאלקטרופיל.
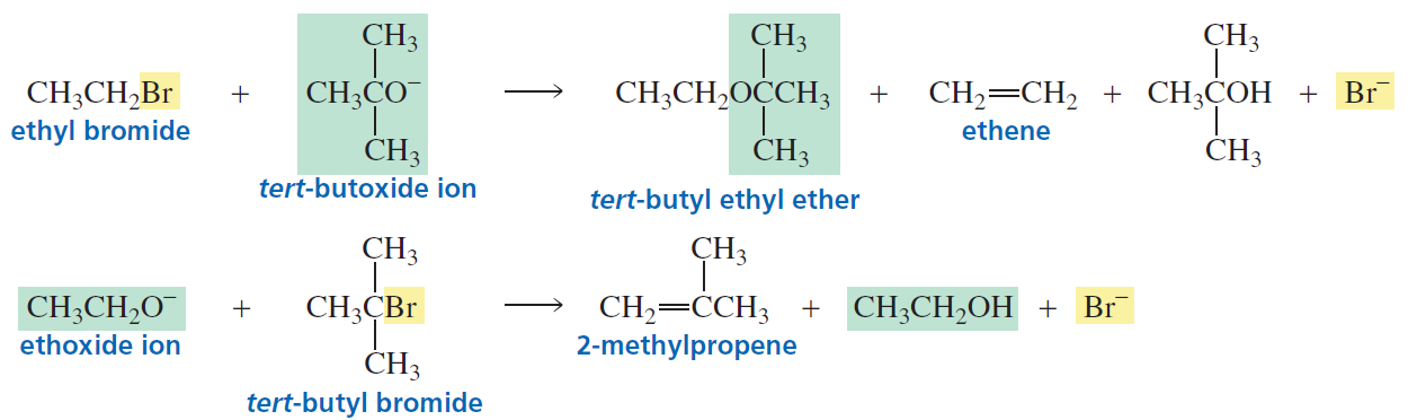
2. סיפוח אלכוהול לאלקֵן
סיפוח כוהל לקשר קפול בתנאים חומציים.
בתנאים חומציים, אלכוהול יכול להסתפח לקשר כפול לפי כלל מרקובניקוב:
\[\ce{R-CH=CH2 ->[H+/ROH] R-CH(OR')-CH3}\]המימן מסתפח לפחמן הפחות מותמר, וקבוצת האלקוקסי לפחמן היותר מותמר.

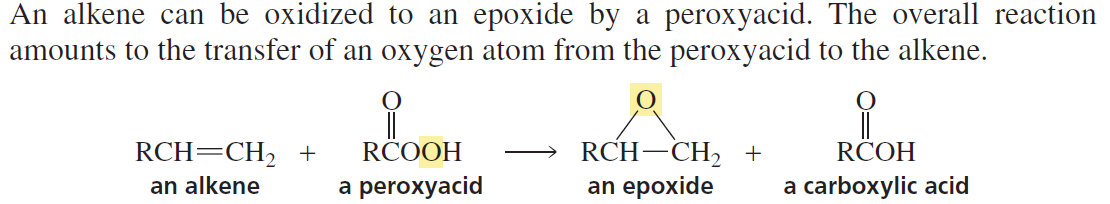
3. יצירת אפוקסידים
אפוקסידים הם אתרים ציקליים תלת-איבריים הנוצרים מתגובת אלקן עם פר-חומצה:
\[\ce{R-CH=CH-R' ->[RCO3H] R-CH-CH-R'}\] \[\ce{\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \backslash O /}\]האפוקסיד מתאפיין במתח טבעתי גבוה הנובע מהזוויות הקטנות (60°) בטבעת התלת-איברית, מה שהופך אותו לריאקטיבי במיוחד.
פתיחת אפוקסידים
הריאקטיביות הגבוהה של אפוקסידים הופכת אותם לאלקטרופילים מצוינים. פתיחת האפוקסיד יכולה להתרחש בשני תנאים:
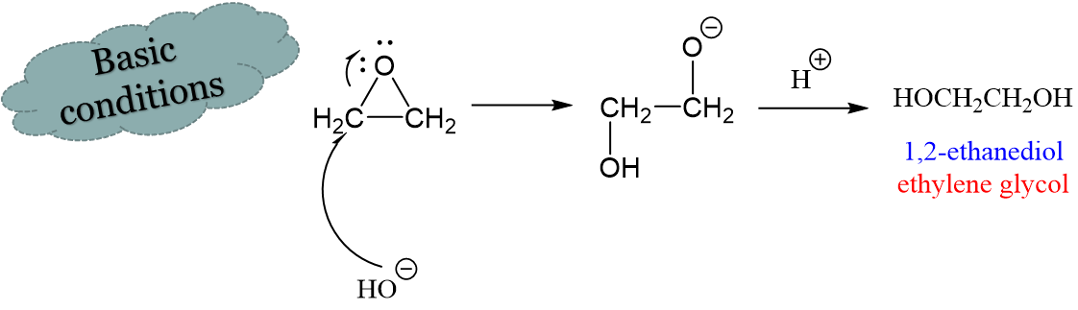
תנאים בסיסיים (מנגנון $\mathrm{S_N2}$)
בתנאים בסיסיים, הנוקלאופיל תוקף את הפחמן הפחות מותמר מהצד ההפוך לגשר האפוקסיד:
\[\ce{Nu^- +_{\ce{R}} \overset{\, \, \, \, \, \, \, \ce{O}}\diagup {\diagdown_{\ce{R}}} ->[acid] Nu-C-C-O^-}\]התקיפה מתרחשת בסטריאוכימיה אנטי, והתוצר הוא דיול trans (או תוצר עם נוקלאופיל ו-OH בתצורת אנטי).
תנאים חומציים (מנגנון דמוי $\mathrm{S_N1}$)
בתנאים חומציים מתרחשת תחילה פרוטונציה של החמצן, ולאחר מכן הנוקלאופיל תוקף את הפחמן היותר מותמר:
\[\ce{H+ + \underset{O}{/\backslash} -> \underset{OH+}{/\backslash} ->[Nu] Nu-C-C-OH}\]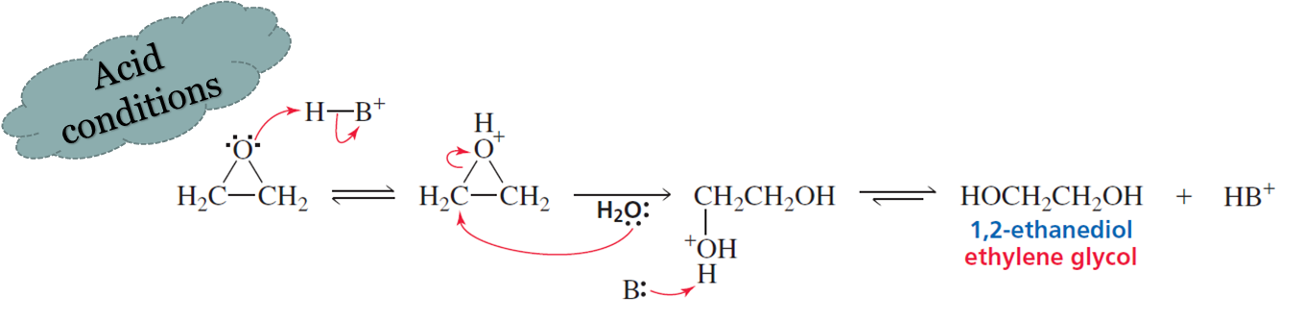
חשוב לזהות נכון את התנאים - נוכחות של חומצה ($\ce{H+}$) מגדירה תנאים חומציים. בהיעדר חומצה, גם אם הנוקלאופיל אינו טעון שלילי, התנאים נחשבים בסיסיים.
בשני המקרים, התוצר הסופי מכיל שני פחמנים סמוכים כאשר על אחד מהם קבוצת $\ce{OH}$ (מהחמצן של האפוקסיד המקורי) ועל השני הנוקלאופיל שתקף.
כימיה של אלכוהולים ($\ce{R-OH}$)
מבוא וסיווג
אלכוהולים הם תרכובות אורגניות המכילות קבוצת הידרוקסיל ($\ce{-OH}$) הקשורה לאטום פחמן. האלכוהול הנפוץ ביותר הוא אתנול ($\ce{CH3CH2OH}$), המצוי במשקאות אלכוהוליים והידוע בהשפעותיו הפיזיולוגיות - גרימת אופוריה וירידה ביכולות הקוגניטיביות והמוטוריות.
אלכוהולים מסווגים לפי מספר אטומי הפחמן הקשורים לפחמן הנושא את קבוצת ההידרוקסיל:
-
אלכוהול ראשוני: הפחמן הנושא את ה-$\ce{OH}$ קשור לפחמן אחד בלבד (או למימנים)
\[\begin{array}{cccccc} & & \ce{OH} & & \\ & & \vert & & \\ \ce{R1} & - & \ce{C} & - & \ce{H} \\ & & \vert & & \\ & & \ce{H} & & \\ \end{array}\] -
אלכוהול משני: הפחמן הנושא את ה-$\ce{OH}$ קשור לשני פחמנים
\[\begin{array}{cccccc} & & \ce{OH} & & \\ & & \vert & & \\ \ce{R1} & - & \ce{C} & - & \ce{R2} \\ & & \vert & & \\ & & \ce{H} & & \\ \end{array}\] -
אלכוהול שלישוני: הפחמן הנושא את ה-$\ce{OH}$ קשור לשלושה פחמנים
\[\begin{array}{cccccc} & & \ce{OH} & & \\ & & \vert & & \\ \ce{R1} & - & \ce{C} & - & \ce{R3} \\ & & \vert & & \\ & & \ce{R2} & & \end{array}\]
סיווג זה חשוב ביותר מכיוון שהוא קובע את הריאקטיביות ואת סוגי התגובות שהאלכוהול יכול לעבור.
סיווג אלכוהולים ודוגמאות חשובות
כפי שצוין, אלכוהול שלישוני הוא כזה שבו הפחמן הנושא את קבוצת ההידרוקסיל קשור לשלושה פחמנים. סיווג זה קריטי להבנת הריאקטיביות השונה של אלכוהולים בתגובות שונות.
אלכוהולים בעלי חשיבות ביולוגית
כולסטרול הוא אחד האלכוהולים החשובים ביותר במערכות ביולוגיות. מולקולה זו משמשת כמולקולת מוצא לביוסינתזה של סטרואידים רבים, כולל הורמונים סטרואידיים. כולסטרול גם ממלא תפקיד חיוני בוויסות ספיגת הסידן בעצמות.
סוכרים כגון גלוקוז מכילים מספר קבוצות הידרוקסיל, מה שהופך אותם לפוליאלכוהולים. המנטול, תרכובת הנותנת את תחושת הקרירות במוצרי מנטה, היא דוגמה נוספת לאלכוהול טבעי חשוב.
חומצות אמינו כמו סרין ותראונין מכילות קבוצות הידרוקסיל ומהוות אבני בניין חיוניות לחלבונים בגוף.
תכונות פיזיקליות וקשרי מימן
אלכוהולים מאופיינים בקשרי מימן בין-מולקולריים חזקים, בשונה מאתרים. קשר המימן נוצר כאשר אטום מימן הקשור קוולנטית לחמצן במולקולה אחת מקיים אינטראקציה אלקטרוסטטית עם זוג אלקטרונים לא קושר של חמצן במולקולה אחרת.
\[\ce{\overset{H}{O-H} \cdots \overset{\delta^-}{O} \cdots \overset{\delta^+}{H}}\]המימן בקשר $\ce{O-H}$ נושא מטען חיובי חלקי משמעותי ($\delta^+$) בשל האלקטרושליליות הגבוהה של החמצן. זה הופך אותו כמעט ל”פרוטון חשוף” המסוגל ליצור קשר חזק עם זוג האלקטרונים של חמצן אחר.
השוואת נקודות הרתיחה ממחישה את החשיבות של קשרי המימן:
- דיאתיל אתר ($\ce{CH3CH2-O-CH2CH3}$): -24°C
- אתנול ($\ce{CH3CH2OH}$): 78°C
למרות שמדובר באיזומרים מבניים עם אותה נוסחה מולקולרית, ההבדל של יותר מ-100°C בנקודת הרתיחה נובע מקשרי המימן החזקים באתנול.
השפעת אורך השרשרת על המסיסות
ככל ששרשרת האלקיל (R) באלכוהול ארוכה יותר, כך יורדת מסיסותו במים. התופעה נובעת מהגדלת החלק ההידרופובי של המולקולה. בעוד שמתנול, אתנול ופרופנול מסיסים היטב במים, אלכוהולים עם שרשראות ארוכות יותר הופכים פחות ופחות מסיסים.
יציבות אניונים ואלקוקסידים וחומציות
סדר היציבות של אניונים שונים הוא:
\[\ce{R-S^- > R-O^- > R-N^-}\]הסדר הזה נובע מהאלקטרושליליות הגוברת בתנועה ימינה בטבלה המחזורית. אטום אלקטרושלילי יותר מייצב טוב יותר מטען שלילי.
מבחינת חומציות, הסדר הוא:
\[\ce{R-SH > R-OH > R-NH2 > R-CH3}\]השפעת המתמר על החומציות
תופעה מעניינת היא שחומציות האלכוהול יורדת עם עליית דרגת המתמר:
-
מים: pKa = 15.7
\[\begin{array}{ccc} & \ce{O} & \\ & \diagup \diagdown &\\ \ce{H} & & \ce{H} \\ \end{array}\] -
מתנול: pKa ≈ 15.5
\[\begin{array}{ccc} & \ce{OH} & \\ & \vert & \\ \ce{H} & \ce{-C-} & \ce{H} \\ & \vert & \\ & \ce{H} & \\ \end{array}\] -
איזופרופנול: pKa ≈ 17
\[\begin{array}{ccc} & \ce{OH} & \\ & \vert &\\ &\diagup \diagdown & \\ \end{array}\] -
tert-בוטנול: pKa ≈ 19
\[\begin{array}{ccc} & \ce{OH} & \\ & \vert & \\ \ce{CH3} & \ce{-C-} & \ce{CH3} \\ & \vert & \\ & \ce{CH3} & \\ \end{array}\]
ההסבר נעוץ באפקט האינדוקטיבי של קבוצות האלקיל: קבוצות אלקיל ($\ce{R}$) הן דוחפות אלקטרונים, וכאשר הן דוחפות צפיפות אלקטרונית לעבר חמצן שכבר נושא מטען שלילי (באלקוקסיד), הן מגבירות את חוסר היציבות שלו. לכן, ככל שיש יותר קבוצות אלקיל (פחמן יותר מותמר), כך הבסיס המצומד פחות יציב והחומצה חלשה יותר.

שיטות סינתטיות להכנת אלכוהולים
1. תגובות התמרה נוקלאופילית
-
תגובת $\mathrm{S_N2}$: אלקיל הליד ראשוני מגיב עם יון הידרוקסיד:
\[\ce{R-X + OH^- -> R-OH + X^-}\]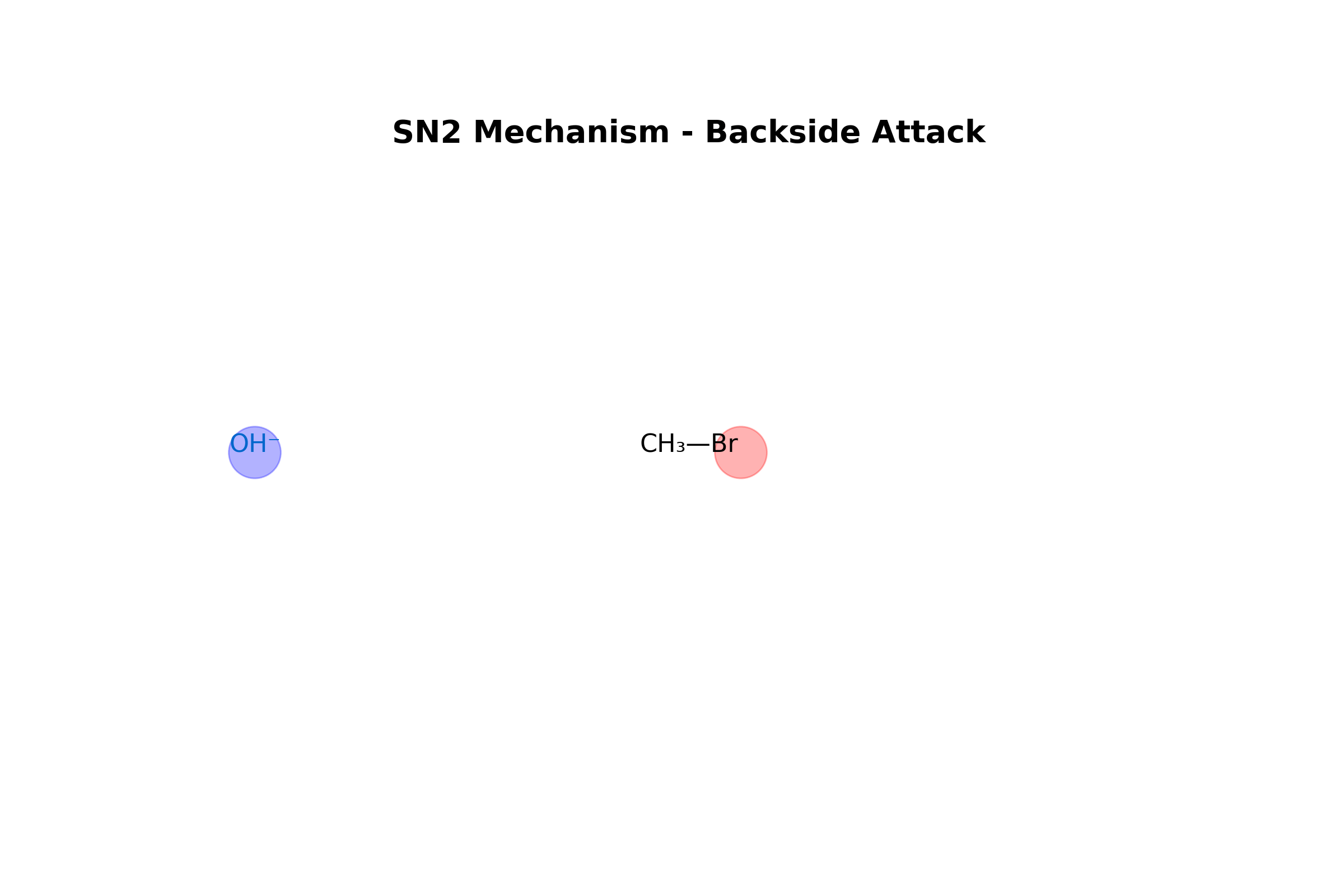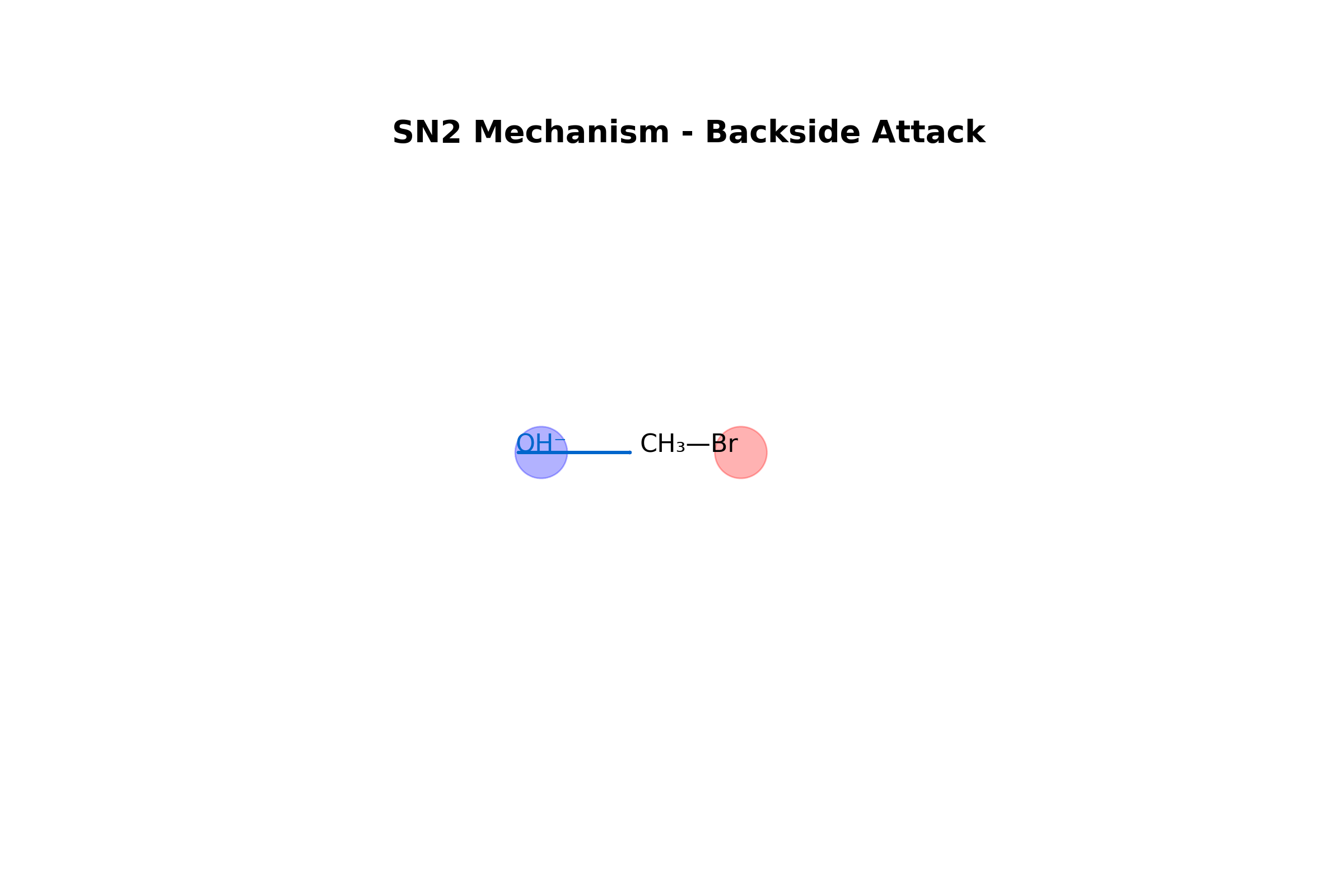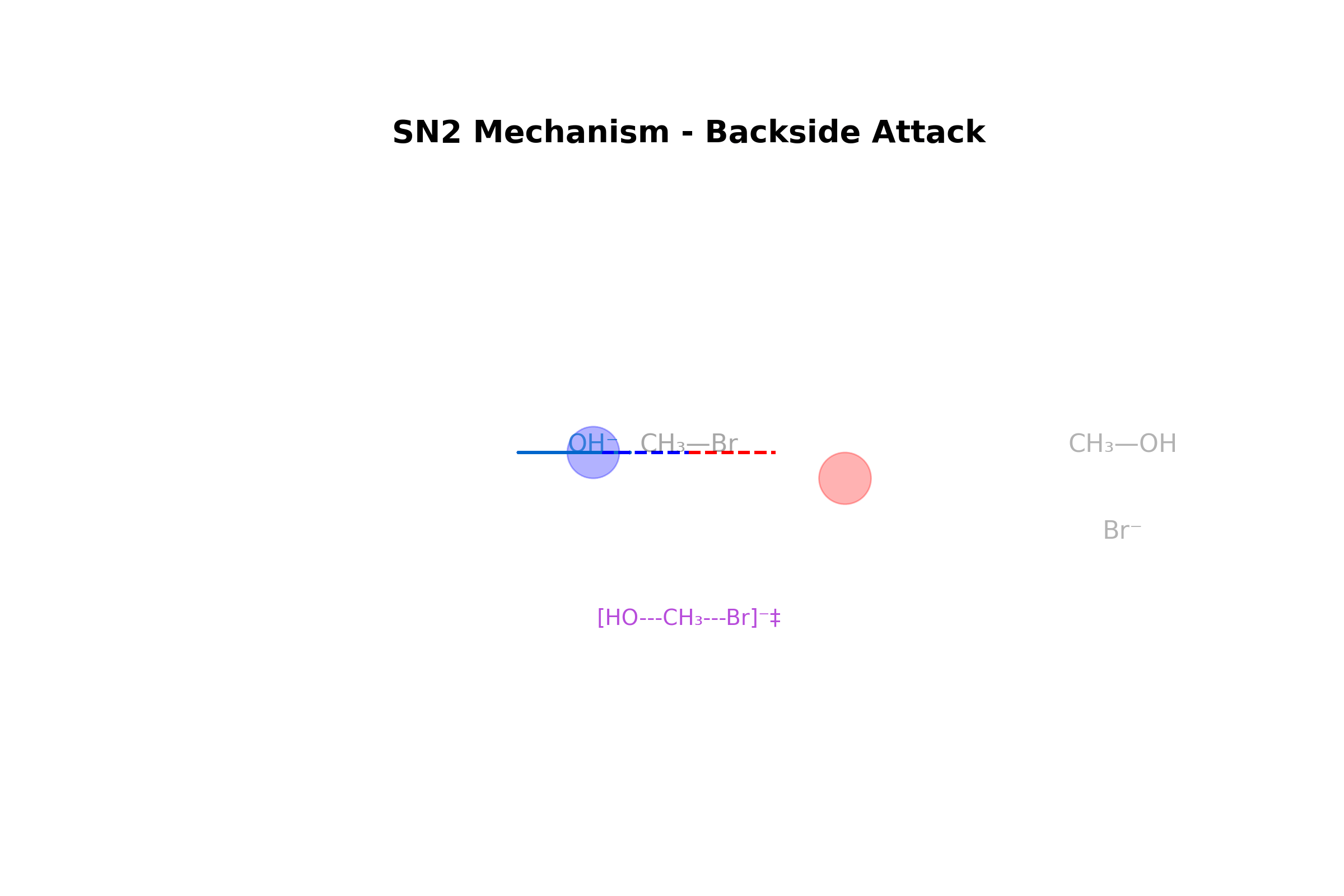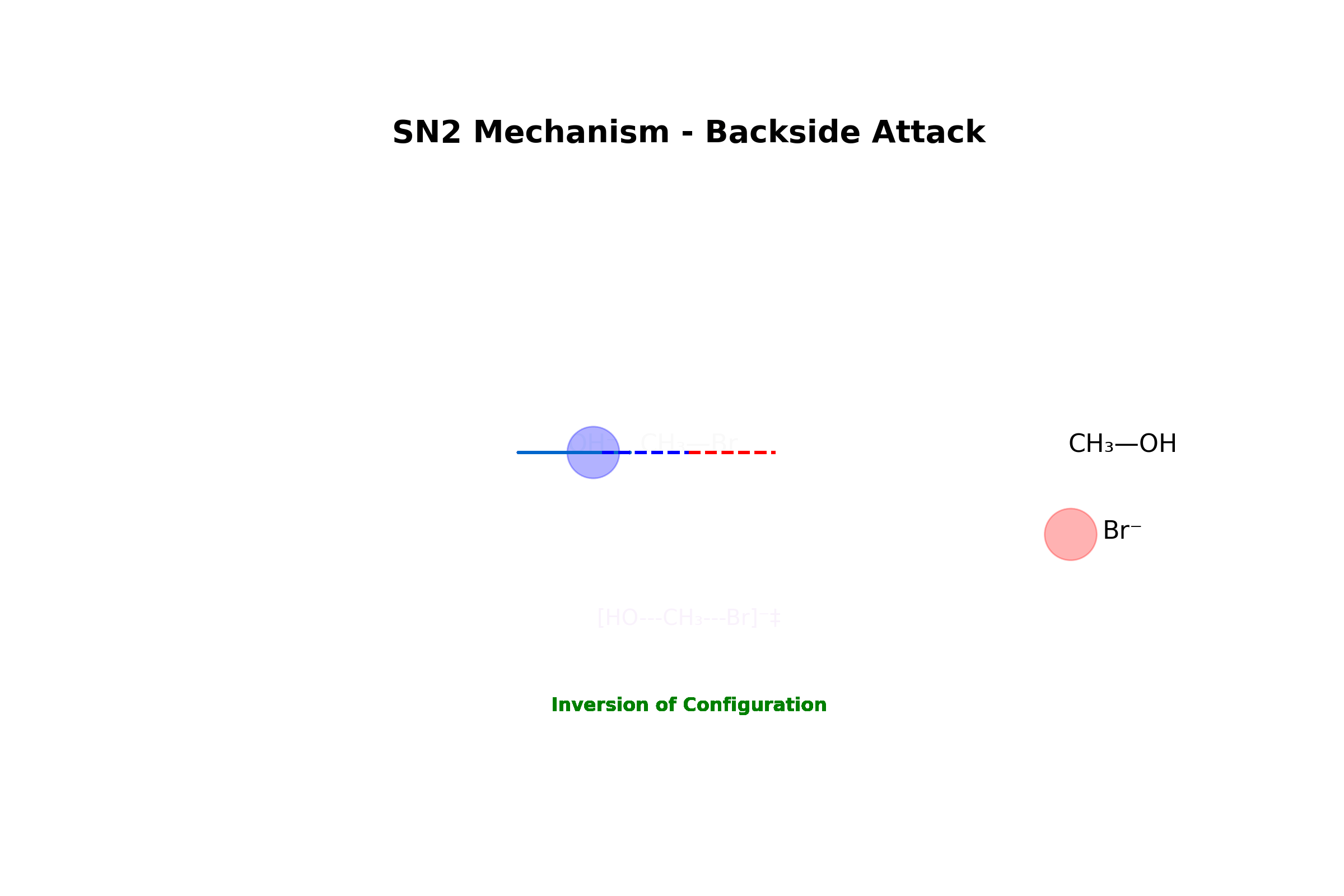
-
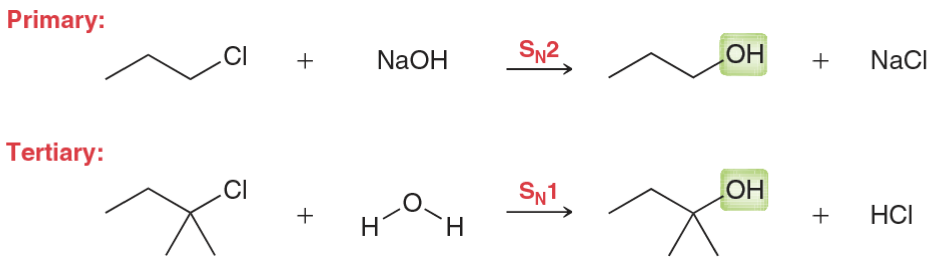
תגובת $\mathrm{S_N1}$: אלקיל הליד שלישוני מגיב עם מים בתנאים חומציים, כאשר ייתכנו שינויי מבנה (rearrangements) של הקרבוקטיון הנוצר.
2. הידרציה של אלקֵנים
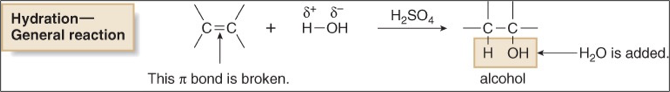
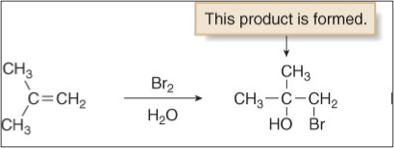
סיפוח מים בתנאים חומציים לקשר כפול מתרחש לפי כלל מרקובניקוב, כאשר המימן מסתפח לפחמן הפחות מותמר.
3. יצירת הלוהידרינים
תגובת אלקֵן עם $\ce{X2}$ בנוכחות מים מובילה ליצירת הלוהידרין, כאשר ההלוגן וקבוצת ההידרוקסיל נמצאים בתצורת anti.
4. חיזור של תרכובות קרבוניליות (carbonyl reduction)
\[\text{Nucleophilic addition of } \ce{H^-}\]
זוהי אחת השיטות החשובות ביותר להכנת אלכוהולים. התהליך מבוסס על הוספת מימן לקשר הכפול $\ce{C=O}$:
\[\ce{R2C=O ->[H^-] R2CH-O^- ->[H+] R2CH-OH}\]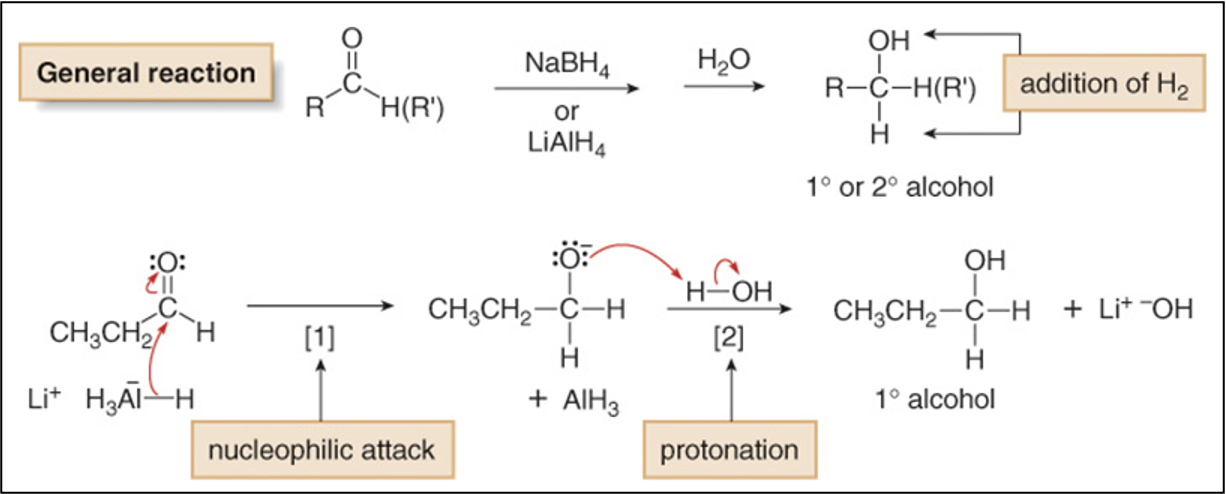
ריאגנטים לחיזור
סודיום בורוהידריד ($\ce{NaBH4}$): ריאגנט מתון וסלקטיבי המחזר רק קטונים ואלדהידים. המנגנון כולל העברת יון הידריד ($\ce{H^-}$) מהבורון לפחמן הקרבונילי:
 \[\ce{BH4^- -> BH3 + H^-}\]
\[\ce{BH4^- -> BH3 + H^-}\] היון הידריד ($\ce{H-}$) תוקף את הפחמן הקרבונילי האלקטרופילי, והאלקטרונים של קשר $\pi$ עוברים לחמצן. לאחר מכן מתבצעת פרוטונציה של האלקוקסיד הנוצר.
ליתיום אלומיניום הידריד ($\ce{LiAlH4}$): ריאגנט חזק ואגרסיבי יותר המחזר את כל נגזרות הקרבוניל, כולל חומצות קרבוקסיליות ואסטרים. הסלקטיביות השונה נובעת מהריאקטיביות הגבוהה יותר של $\ce{AlH4^-}$ לעומת $\ce{BH4^-}$.
הידריד זה מימן עם מטען שלילי: $\ce{H^-}$. הוא נוקלאופיל טוב.
5. ריאגנט גריניאר (Grignard Reagent)
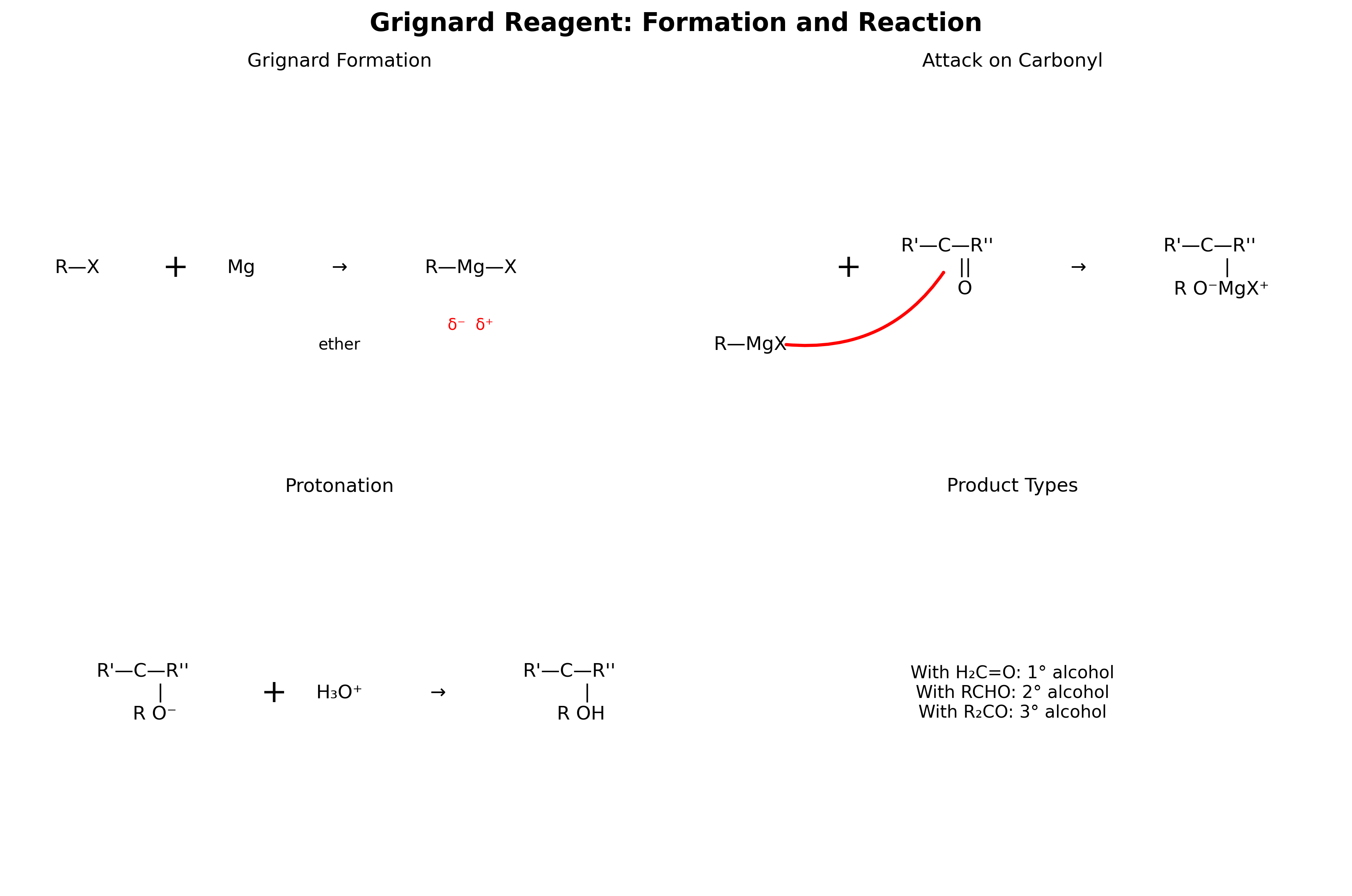
ריאגנט גריניאר הוא כלי סינתטי רב עוצמה המאפשר יצירת קשרים $\ce{C-C}$ חדשים. הכנתו מתבצעת על ידי תגובת אלקיל הליד עם מגנזיום מתכתי:
\[\ce{R-X + Mg ->[ether] R-Mg-X}\]המגנזיום “מחדיר” את עצמו בין הפחמן להלוגן, והופך את הפחמן מאלקטרופילי (באלקיל הליד) לנוקלאופילי. הקשר $\ce{C-Mg}$ הוא קוטבי מאוד, עד כדי כך שניתן לראות את הפחמן כנושא מטען שלילי חלקי גבוה או אפילו כקרבואניון.
שימושי ריאגנט גריניאר
כבסיס: בנוכחות מים או אלכוהולים, ריאגנט גריניאר פועל כבסיס חזק:
\[\ce{R-MgX + H2O -> R-H + Mg(OH)X}\]כנוקלאופיל: התקפה על קרבונילים מאפשרת בניית אלכוהולים עם שלד פחמני מורחב:
- עם פורמלדהיד: יצירת אלכוהול ראשוני
- עם אלדהיד אחר: יצירת אלכוהול משני
- עם קטון: יצירת אלכוהול שלישוני
המנגנון דומה לחיזור עם הידריד, אך במקום $\ce{H^-}$ מועבר $\ce{R^-}$. זה מאפשר בניית מולקולות מורכבות יותר על ידי יצירת קשרי פחמן-פחמן חדשים, מה שהופך את ריאגנט גריניאר לכלי חיוני בסינתזה אורגנית.
תגובות של אלכוהולים - המרה לאלקיל הלידים
שיטות להמרת אלכוהולים לאלקיל הלידים
כפי שנדון, קבוצת ההידרוקסיל ($\ce{R\mathbf{OH}}$) היא קבוצה עוזבת גרועה, ולכן המרת אלכוהולים לתרכובות אחרות דורשת הפיכתה לקבוצה עוזבת טובה. נסקור כעת את השיטות העיקריות להמרת אלכוהולים לאלקיל הלידים.
המרה באמצעות $\ce{HX}$
כבר ראינו שאלכוהולים מגיבים עם חומצות הידרוהליות ($\ce{HCl}$, $\ce{HBr}$, $\ce{HI}$) ליצירת אלקיל הלידים:
- אלכוהולים שלישוניים: עוברים תגובת $\mathrm{S_N1}$ לאחר פרוטונציה של קבוצת ההידרוקסיל
- אלכוהולים ראשוניים: עוברים תגובת $\mathrm{S_N2}$ לאחר פרוטונציה
החומצה ממלאת תפקיד כפול - היא הופכת את ה-$\ce{OH}$ לקבוצה עוזבת טובה ($\ce{OH2+}$) ומספקת את הנוקלאופיל ($\ce{X-}$).
ריאגנטים מיוחדים: $\ce{PBr3}$ ו$\ce{SOCl2}$
שתי שיטות נוספות וחשובות להמרת אלכוהולים לאלקיל הלידים משתמשות בריאגנטים ספציפיים הפועלים במנגנון דמוי-$\mathrm{S_N2}$. שיטות אלו מתאימות רק לאלכוהולים ראשוניים ומשניים.
זרחן טריברומיד (PBr₃)
תגובת אלכוהול עם $\ce{PBr3}$ מתרחשת בשני שלבים עיקריים:
\[\ce{3 R-OH + PBr3 -> 3 R-Br + H3PO3}\]מנגנון התגובה:
שלב 1: החמצן של האלכוהול תוקף את אטום הזרחן, מוציא ברומיד כקבוצה עוזבת:
\[\ce{R-OH + PBr3 -> R-O^+-PBr2 + Br^-}\]בשלב זה נוצר אסטר זרחני ביניים, שבו קבוצת האלכוהול המקורית הפכה לקבוצה עוזבת מצוינת.
שלב 2: יון הברומיד שנוצר בשלב הראשון תוקף את הפחמן במנגנון $\mathrm{S_N2}$:
\[\ce{Br^- + R-O^+-PBr2 -> R-Br + O=PBr2}\]הקשר $\ce{P=O}$ החזק מאוד מהווה כוח מניע לתגובה ומייצב את תוצר הלוואי.
מאחר שמדובר במנגנון $\mathrm{S_N2}$, מתרחש היפוך קונפיגורציה במרכז הכיראלי. אם קבוצת ה-$\ce{OH}$ יצאה מהמישור, הברום ייכנס למישור.
תיוניל כלוריד (SOCl₂)
תגובה עם $\ce{SOCl2}$ בנוכחות בסיס (כגון פירידין או טריאתילאמין) היא שיטה יעילה נוספת:
\[\ce{R-OH + SOCl2 ->[base] R-Cl + SO2 + HCl}\]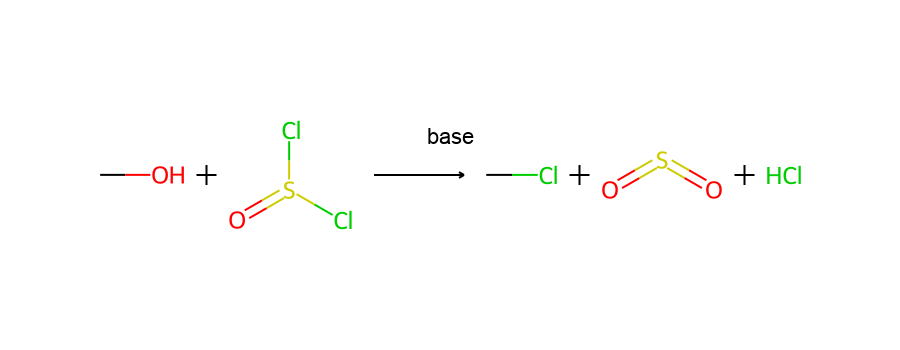
מנגנון התגובה:
שלב 1: החמצן תוקף את אטום הגופרית של $\ce{SOCl2}$:
\[\ce{R-OH + SOCl2 -> R-O-SO-Cl + Cl^-}\]נוצר אסטר סולפיני ביניים (כלורוסולפיט).
שלב 2: סידור מחדש מולקולרי מוביל ליציאת $\ce{SO2}$:
\[\ce{R-O-SO-Cl -> R^+ + SO2 + Cl^-}\]למעשה, מתרחש תהליך מתואם שבו האלקטרונים של הקשר $\ce{S-O}$ חוזרים ליצירת $\ce{S=O}$, תוך כדי יציאת $\ce{Cl^-}$ כקבוצה עוזבת.
שלב 3: יון הכלוריד תוקף במנגנון דמוי-$\mathrm{S_N2}$ עם היפוך קונפיגורציה.
היתרון הגדול של שיטה זו הוא שתוצרי הלוואי ($\ce{SO2}$ ו-$\ce{HCl}$) הם גזיים ומתנדפים מתערובת התגובה, מה שמקל על הבידוד של התוצר.
השוואה בין השיטות
| שיטה | תנאים | מתאים ל- | יתרונות | חסרונות |
|---|---|---|---|---|
| $\ce{HX}$ | חומצי | כל סוגי האלכוהולים | פשוט, זול | אפשרות לשינויי מבנה ב-$\mathrm{S_N1}$ |
| $\ce{PBr3}$ | ניטרלי | ראשוני/משני | סטריאוספציפי, נקי | רק לברומידים |
| $\ce{SOCl2}$ | בסיסי חלש | ראשוני/משני | תוצרי לוואי גזיים | רק לכלורידים |
המשך תגובות אלכוהולים
לאחר שלמדנו כיצד להפוך אלכוהולים לאלקיל הלידים, ניתן להשתמש בתוצרים אלו כחומרי מוצא למגוון רחב של תגובות נוספות. אלקיל הלידים הם אלקטרופילים מצוינים ויכולים לעבור תגובות החלפה ואלימינציה רבות.
הבנת התגובות הללו חיונית משום שהן מאפשרות לנו לבנות “מסלולים סינתטיים” - רצפי תגובות המאפשרים המרה של חומר מוצא פשוט למולקולה מורכבת יותר. למשל, ניתן להמיר אלכוהול לאלקיל הליד, ולאחר מכן להשתמש בו בתגובת $\mathrm{S_N2}$ עם נוקלאופילים שונים ליצירת אתרים, אמינים, ניטרילים ועוד.
כל השיטות שנסקרו כאן מדגימות עיקרון חשוב בכימיה אורגנית: הצורך להפוך קבוצה עוזבת גרועה ($\ce{OH^-}$) לקבוצה עוזבת טובה ($\ce{H2O}$, $\ce{O=PBr2}$, או $\ce{SO2}$) כדי לאפשר תגובות החלפה יעילות.
ריאגנט גריניאר - תכונות ושימושים נוספים
כפל התפקיד של ריאגנט גריניאר
ריאגנט גריניאר ($\ce{R-MgX}$) מתאפיין בדואליות תפקודית חשובה - הוא יכול לפעול הן כנוקלאופיל חזק והן כבסיס חזק. תכונה זו נובעת מאופיו הקרבאניוני של הפחמן, המקנה לו צפיפות אלקטרונית גבוהה.
חשיבות התנאים היבשים
עבודה עם ריאגנט גריניאר דורשת תנאים יבשים לחלוטין (אנהידריים). נוכחות של מים, גם בכמויות זעירות, תגרום לריאגנט לפעול כבסיס במקום כנוקלאופיל:
\[\ce{R-MgX + H2O -> R-H + Mg(OH)X}\]תגובה זו “מבזבזת” את הריאגנט ומונעת את התגובה הרצויה. לכן, כל הממסים והכלים חייבים להיות יבשים לחלוטין, והתגובה מתבצעת תחת אטמוספרה אינרטית.
רעילות אלכוהולים וטיפול רפואי
הרעלת מתנול - מנגנון וטיפול
מתנול ($\ce{CH3OH}$) הוא חומר רעיל ביותר שעלול לגרום לעיוורון ואף למוות. הרעילות אינה נובעת מהמתנול עצמו, אלא מתוצרי החמצון שלו בגוף.
המסלול המטבולי
בגוף, האנזים אלכוהול דהידרוגנאז (ADH) מחמצן אלכוהולים:
\[\ce{CH3OH ->[ADH/NAD+] CH2O + H2O}\]הפורמלדהיד ($\ce{CH2O}$) שנוצר הוא רעיל ביותר לרקמות הגוף, במיוחד לעצב הראייה. הוא ממשיך להתחמצן לחומצה פורמית, שגם היא רעילה.
עקרון הטיפול - תחרות אנזימטית
הטיפול בהרעלת מתנול מבוסס על עקרונות של קינטיקה אנזימטית:
-
זיקה אנזימטית: אתנול ($\ce{CH3CH2OH}$) נקשר לאנזים ADH בזיקה גבוהה פי 25 מזו של מתנול
-
עיכוב תחרותי: מתן אתנול בריכוז גבוה “תופס” את האנזים ומונע חמצון של המתנול
-
הפרשה: המתנול שלא עבר חמצון מופרש מהגוף דרך הכליות והריאות מבלי לגרום נזק
הטיפול כולל מתן אתנול תוך-ורידי או דרך הפה, תוך שמירה על רמה קבועה בדם עד להפרשת המתנול מהגוף.
חמצון אלכוהולים
עקרונות החמצון
חמצון של אלכוהולים הוא תהליך של הסרת מימנים מהפחמן שנושא את קבוצת ההידרוקסיל. היכולת להתחמצן תלויה בנוכחות מימנים על הפחמן הזה:
-
אלכוהול ראשוני ($\ce{RCH2OH}$): יכול להתחמצן לאלדהיד ולאחר מכן לחומצה קרבוקסילית
\[\ce{RCH2OH ->[O] RCHO ->[O] RCOOH}\] -
אלכוהול משני ($\ce{R2CHOH}$): מתחמצן לקטון בלבד
\[\ce{R2CHOH ->[O] R2C=O}\] -
אלכוהול שלישוני ($\ce{R3COH}$): אינו יכול להתחמצן בתנאים רגילים
ריאגנטים לחמצון
חומצה כרומית ($\ce{H2CrO4}$)
חומצה כרומית היא חומר חמצון חזק שנוצר מתגובת כרום טריאוקסיד עם חומצה:
\[\ce{CrO3 + H2O -> H2CrO4}\]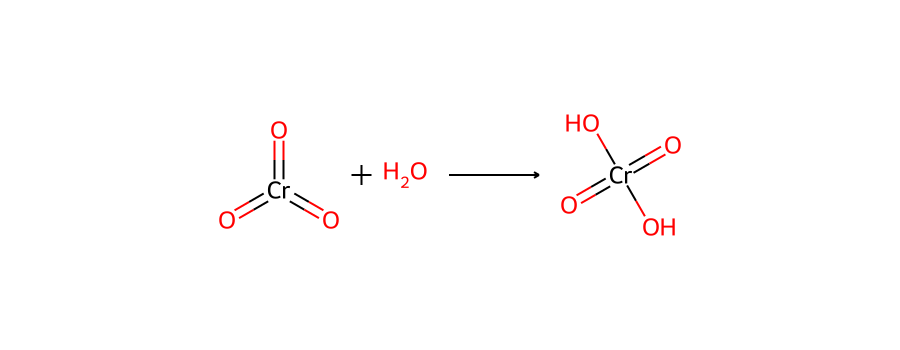
לעתים נרשם גם כ:
\[\ce{Na2Cr2O7 + H2SO4 -> H2CrO4}\]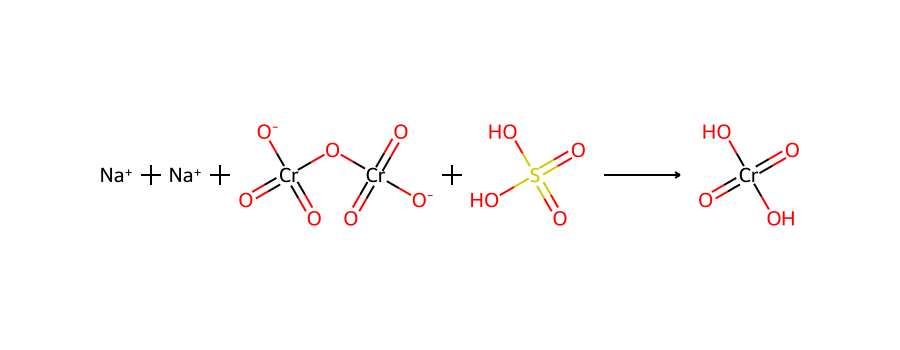

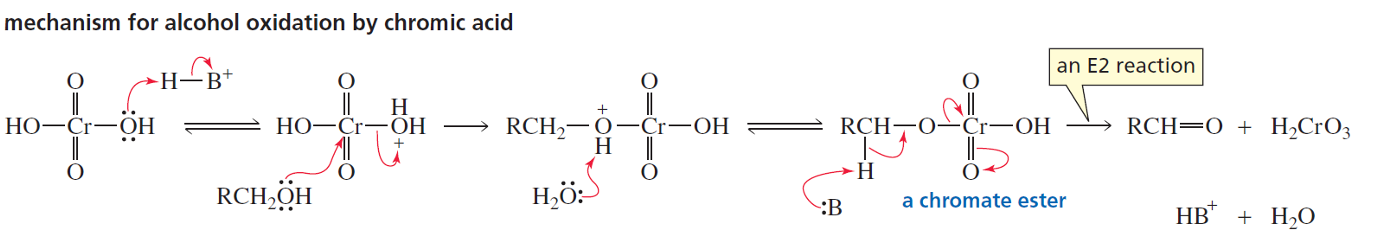
מנגנון החמצון
מנגנון החמצון כולל מספר שלבים:
שלב 1: פרוטונציה של חומצה כרומית ויצירת קבוצה עוזבת טובה:
\[\ce{H2CrO4 + H+ -> H2CrO3OH+}\]שלב 2: התקפת האלכוהול על הכרום ויציאת מים:
\[\ce{R2CHOH + H2CrO3OH+ -> R2CHOCrO2OH + H2O}\]שלב 3: דה-פרוטונציה של האסטר הכרומי:
\[\ce{R2CHOCrO2OH -> R2CHOCrO2O^- + H+}\]שלב 4: השלב הקובע קצב - הסרת מימן $\alpha$ והיווצרות קשר כפול:
\[\ce{R2CHOCrO2O^- -> R2C=O + HCrO3^-}\]השלב האחרון דורש נוכחות של מימן על הפחמן הנושא את קבוצת ההידרוקסיל. זו הסיבה שאלכוהולים שלישוניים אינם מתחמצנים.
בקרת סלקטיביות בחמצון
הבעיה: חמצון יתר של אלדהידים
כאשר אלכוהול ראשוני מתחמצן לאלדהיד בנוכחות מים, נוצר שיווי משקל עם הידרט:
\[\ce{RCHO + H2O <=> RCH(OH)2}\]ההידרט מכיל מימן $\alpha$ ולכן יכול להמשיך ולהתחמצן לחומצה קרבוקסילית:
\[\ce{RCH(OH)2 ->[O] RCOOH}\]הפתרון: PCC (Pyridinium Chlorochromate)
PCC הוא ריאגנט חמצון מתון שפועל בממס אורגני יבש (בדרך כלל דיכלורומתאן). בהיעדר מים, לא נוצר הידרט והחמצון נעצר בשלב האלדהיד:
\[\ce{RCH2OH ->[PCC] RCHO}\]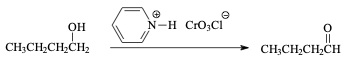
סיכום השוואתי
| סוג אלכוהול | תוצר עם $\ce{H2CrO4}$ | תוצר עם PCC |
|---|---|---|
| ראשוני | חומצה קרבוקסילית | אלדהיד |
| משני | קטון | קטון |
| שלישוני | אין תגובה | אין תגובה |
יישומים סינתטיים
היכולת לשלוט בתוצרי החמצון מאפשרת תכנון סינתטי מדויק. לדוגמה:
- הכנת אלדהידים: שימוש ב-PCC לחמצון סלקטיבי של אלכוהולים ראשוניים
- הכנת קטונים: חמצון של אלכוהולים משניים עם כל חומר חמצון
- הכנת חומצות קרבוקסיליות: חמצון מלא של אלכוהולים ראשוניים עם חומצה כרומית
השליטה בתהליכי החמצון היא כלי חיוני בסינתזה אורגנית, המאפשרת המרה סלקטיבית של קבוצות פונקציונליות ובניית מולקולות מורכבות.
תכנון רטרוסינתטי ושאלות מסכמות
עקרונות הניתוח הרטרוסינתטי
ניתוח רטרוסינתטי הוא גישה לתכנון סינתזה המתחילה מהתוצר הרצוי ו”עובדת אחורה” לחומרי המוצא. השיטה דורשת זיהוי של “חיתוכים” אסטרטגיים במולקולה וחשיבה על תגובות שיכולות ליצור את הקשרים הללו.
דוגמה: סינתזה מורכבת
נניח שאנו רוצים לסנתז אלקאן מסוים. הניתוח הרטרוסינתטי מגלה:
-
זיהוי המבנה: יש לנו שני פחמנים מכל צד של הקשר שנרצה “לחתוך”
-
זיהוי חומר ביניים אפשרי: אנו יודעים שאוזונוליזה יוצרת קרבונילים, לכן נוכל להתחיל מאלקן
-
תכנון השלבים:
- התחלה מקרבוניל
- חיזור לאלכוהול: $\ce{R2C=O ->[NaBH4] R2CHOH}$
- אלימינציה לאלקן: $\ce{R2CHOH ->[H+] R2C=CR2}$
- הידרוגנציה לאלקאן: $\ce{R2C=CR2 ->[H2/Pd] R2CH-CHR2}$
תגובות אלימינציה בסינתזה
E1 - אלימינציה חד-מולקולרית
כאשר יש לנו אלכוהול בתנאים חומציים חזקים, יכולה להתרחש תגובת E1:
\[\ce{R2CHOH ->[H+] R2CH-OH2+ -> R2CH+ -> R2C=CR2}\]השלבים:
- פרוטונציה של האלכוהול
- יציאת מים ויצירת קרבוקטיון
- אלימינציה של פרוטון β ליצירת קשר כפול
תגובה זו שימושית במיוחד כאשר רוצים להמיר קטון לאלקן דרך אלכוהול כחומר ביניים.
שאלות סינתטיות מתקדמות
שילוב מספר תגובות
בעיות סינתטיות מתקדמות דורשות שילוב של מספר תגובות ברצף. לדוגמה:
בעיה: סינתזת מולקולה עם הארכת שרשרת
פתרון:
- שימוש בריאגנט גריניאר עם אפוקסיד
- התקפה נוקלאופילית על האפוקסיד
- פתיחת הטבעת והארכת השרשרת
שימוש בריאגנט גריניאר כבסיס
ריאגנט גריניאר יכול לפעול כבסיס לפני שהוא פועל כנוקלאופיל:
\[\ce{R-MgX + HC≡C-R' -> R-H + XMg-C≡C-R'}\]האניון האצטילידי שנוצר יכול לתקוף אפוקסיד:
\[\ce{^-C≡C-R' + \underset{O}{/\backslash} -> R'-C≡C-CH2-CH2-O^-}\]לאחר עיבוד מימי מתקבל אלכוהול עם שרשרת מוארכת ב-2 פחמנים.
חמצון סלקטיבי ותכנון סינתטי
זיהוי הריאגנט המתאים
כאשר רואים המרה של אלכוהול ראשוני לאלדהיד, יש לזהות שנדרש ריאגנט חמצון מתון:
- PCC: לחמצון סלקטיבי לאלדהיד
- $\ce{H2CrO4}$: לחמצון מלא לחומצה קרבוקסילית
הבחירה בריאגנט קובעת את התוצר הסופי.
עקרונות חשובים בפתרון בעיות סינתטיות
1. חשיבה הפוכה
התחל מהתוצר וחשוב אחורה לחומרי המוצא. שאל את עצמך: “איזו תגובה יכולה ליצור את המבנה הזה?”
2. זיהוי קבוצות פונקציונליות
כל קבוצה פונקציונלית מרמזת על תגובות אפשריות:
- קרבוניל ← חמצון של אלכוהול או אוזונוליזה
- אלכוהול ← חיזור של קרבוניל או הידרציה
- קשר כפול ← אלימינציה או חיזור חלקי
3. שימוש בבנק התגובות
יש לבנות “בנק” של תגובות מוכרות ולהשתמש בו באופן יצירתי:
- תגובות סיפוח (הידרוגנציה, הלוגנציה, הידרציה)
- תגובות אלימינציה ($\mathrm{E1}$, $\mathrm{E2}$)
- תגובות חמצון-חיזור
- תגובות החלפה נוקלאופילית
4. ניתוח רב-שלבי
בעיות מורכבות דורשות לעתים 4-3 שלבים או יותר. יש לתכנן את הרצף כולו לפני הביצוע.
דור פסקל