תוכן עניינים:
- מבט-על: למה בכלל עושים הנדסה גנטית?
- דוגמה מרכזית: Golden Rice
- סוגי חששות סביב GMOs: לא רק “בריא/לא בריא”
- שיטות השבחה ושינוי גנטי: מה “עשינו תמיד” ומה חדש
- המצב בישראל
- ארבעה מושגים/תחומים מרכזיים בהנדסה גנטית
- שיבוט גן: מהלך העבודה הקלאסי
- חיות טרנסגניות (Knockout) למחקר: למה ולמה זה היה איטי
- ריפוי גני: למה זה קשה יותר מאשר בחיידק
- עריכה גנומית ו-CRISPR-Cas9: “הלב” של המהפכה
- CRISPR וסרטן: לאן מכוונים?
- שיבוט אורגניזם: מדולי ועד שאלת האדם
- מה מותר, מה אסור, ומה מתבלבל בכותרות
- דילמות אתיות שהשיעור זרק לכיתה (לא כדי לסגור, כדי לחשוב)
- סיום: הטון של השיעור
מבט-על: למה בכלל עושים הנדסה גנטית?
השיעור חיבר בין שלושה צירים מרכזיים:
- יישומים בחקלאות ובתעשייה
- יישומים רפואיים (ריפוי גני ועריכה גנומית)
- שאלות אתיות-חברתיות שנולדות ברגע שהטכנולוגיה נהיית יעילה וזמינה.
נקודת המוצא הייתה שהנדסה גנטית (GMO) היא לא “קסם” אלא שימוש בעובדה בסיסית: הקוד הגנטי והעקרונות של DNA, שכפול, שעתוק ותרגום הם אוניברסליים כמעט בכל היצורים. לכן אפשר (טכנית) להעביר גן בין מינים שונים - מאדם לחיידק, מחיידק לצמח, וכדומה. אם הקוד היה שונה בין אורגניזמים, זה לא היה עובד.
דוגמה מרכזית: Golden Rice
הדוגמה של “אורז זהוב” (Golden Rice) הוצגה כמקרה בוחן קלאסי שבו הצד הטכנולוגי הצליח, אבל הצד החברתי טרף את הקלפים.
מה עשו בפועל?
המטרה הייתה לגרום לאורז לייצר β-carotene (פרו-ויטמין A) כך שהגרגר יקבל צבע צהבהב וייתן פתרון למחסור תזונתי בחלקים נרחבים של העולם (בעיקר באסיה ובאפריקה), שמחסור בוויטמין A גורם בהם לבעיות בריאותיות.
הגישה הייתה:
- מזהים גנים רלוונטיים (מסלול הקרוטנואידים מצמחים).
- מכניסים אותם לפלסמיד (וקטור DNA מעגלי).
- לא מכניסים לצמח ישירות, אלא דרך Agrobacterium: חיידק שמסוגל “להדביק” צמח (בעיקר סביב פצע/חתך) ולהעביר אליו את הווקטור (Ti vector).
- הצמח שנדבק מתחיל לבטא את הגנים - והצלחת הביטוי נראית כבר בצבע הגרגרים.
אז למה זה נתקע?
לא בגלל שהוכח כמסוכן, אלא בגלל התנגדות חברתית רחבה (“למה במערב לא אוכלים את זה ואתם מנסים עלינו?”). לחץ ציבורי במיוחד באזור הפיליפינים גרם גם לארגונים שתמכו (כמו Greenpeace ואחרים) לסגת, המימון נפגע, והפרויקט לא הפך לפתרון גלובלי כפי שדמיינו.
סוגי חששות סביב GMOs: לא רק “בריא/לא בריא”
השיעור סידר את ההתנגדויות לכמה משפחות חשש, והדגיש: חלק מהחששות “טכנולוגיים” וחלק נוגעים למטרות, לכלכלה ולמי מחליט.
1) חשש בריאותי לטווח ארוך
גם אם בטווח הקצר אין תופעות לוואי, עולה השאלה: מה יתגלה בעוד 20 שנה? הדגש היה שזה לא ייחודי ל-GMO - זה נכון גם לתרופות וטכנולוגיות רפואיות חדשות: תמיד יש אי-ודאות של טווח ארוך.
2) חשש אקולוגי ומגוון גנטי
חקלאות מודרנית נוטה כבר היום לאחידות זנים: אם כולם קונים “זן מוצלח”, המגוון מצטמצם. ואז מזיק או מחלה שמתמחה בזן הזה יכולה ליצור משבר עולמי (ניתנה דוגמה רוחבית כמו “בננות טעימות/גדולות” שמובילות לאחידות, ואז פגיעה רחבה כשהמזיק מגיע). המסר האבולוציוני ברור: מגוון גנטי הוא ביטוח חיים מול שינויי אקלים, מגפות ומזיקים.
3) חשש כלכלי ותזונתי עקיף
אופטימיזציה כלכלית (פרי גדול יותר, חיי מדף ארוכים יותר) עלולה לבוא על חשבון ערכים אחרים שלא נמדדים מיד - למשל איכות תזונתית, או השפעות עקיפות שלא חשבו עליהן.
4) Gene Transfer
כאשר שינוי נעשה דרך מקטע DNA חיצוני (למשל פלסמיד שאינו בהכרח משתלב בגנום), עולה תרחיש תיאורטי של מעבר המקטע ליצורים אחרים בסביבה שלא התכוונו להם.
תמונת נגד: לפעמים GMO יכול להפחית נזק קיים
לדוגמה, הכנסת עמידות למזיקים יכולה להפחית שימוש בחומרי הדברה (שהם רעילים ומזיקים לסביבה). ולכן ההשוואה ההוגנת היא לא “GMO מושלם מול כלום”, אלא מול המצב הקיים.
שיטות השבחה ושינוי גנטי: מה “עשינו תמיד” ומה חדש
השיעור הציב רצף:
- הכלאות (ברירה קלאסית) - היום לעיתים מבוססת על סמנים גנטיים: יודעים לזהות רצפים שמקושרים לתכונות, וכך מכוונים הכלאות בצורה מודעת יותר.
- מוטגנזה אקראית - יוצרים הרבה מוטציות ומחפשים “פגיעה טובה”. הבעיה: חוסר שליטה, ופנוטיפ טוב לא תמיד מספר את כל הסיפור.
- הנדסה גנטית - לכאורה יותר מבוקרת: יודעים איזה גן מכניסים/משבשים ומנסים לוודא שרק הוא מושפע.
המצב בישראל
לפי מה שתואר בשיעור, פורמלית אין בהכרח איסור חוקי גורף על הנדסה גנטית בחקלאות, אבל בפועל כמעט לא עושים שימוש חקלאי בגלל:
- צורך באישורים,
- ובעיקר קונצנזוס/חשש חברתי שמקטין יוזמות והגשות בקשה.
עם זאת, יש שימושים נקודתיים:
- הנדסה גנטית בשמרים / חיידקים לייצור חלבונים (למשל חלבוני “חלב” למוצרים טבעוניים).
- שימוש בהנדסה גנטית כ”מפעל” לייצור רכיבים (אנזימים לתעשיית מזון: גבינות / משקאות / מיצים), ואז מנקים את האנזים ומשתמשים בו בתהליך.
לצרכן: גם אם בישראל לא מגדלים הרבה GMO, יכולים להיכנס מוצרי יבוא (בעיקר תירס / קנולה ורכיבים במזון מעובד), ולא תמיד קיימת חובת סימון ברורה אלא אם היצרן מצהיר “ללא GMO”.
ארבעה מושגים/תחומים מרכזיים בהנדסה גנטית
השיעור מיקד 4 כיוונים:
- שיבוט גן (Gene cloning)
- חיות טרנסגניות / Knockout למחקר
- ריפוי גני ועריכה גנומית (כולל CRISPR-Cas)
- שיבוט אורגניזמים (Organism cloning) - בעיקר כתחום שמעורר שאלות אתיות.
בנוסף הוגדרו שני מושגים בסיסיים:
- Recombinant DNA: כל מקטע DNA שנמצא “לא במקום הטבעי” שלו, או הועבר בין אורגניזמים, גם אם הרצף עצמו לא שונה.
- שיבוט (Cloning) במובן של “יצירת הרבה עותקים” (של גן או חלבון), לא בהכרח שיבוט אורגניזם.
שיבוט גן: מהלך העבודה הקלאסי
הרעיון: לקחת גן/מקטע מטרה (“החדר”) ולהכניס אותו לווקטור (לרוב פלסמיד מעגלי), ואז להכניס לחיידק שיתרבה, ישכפל ויבטא.
למה פלסמיד מעגלי?
DNA לינארי עלול להתפרק מהר ע”י נוקלאזות; פלסמיד מעגלי יציב יותר בתא ולכן “שורד” ומאפשר שכפול / ביטוי.
שלבי הליבה
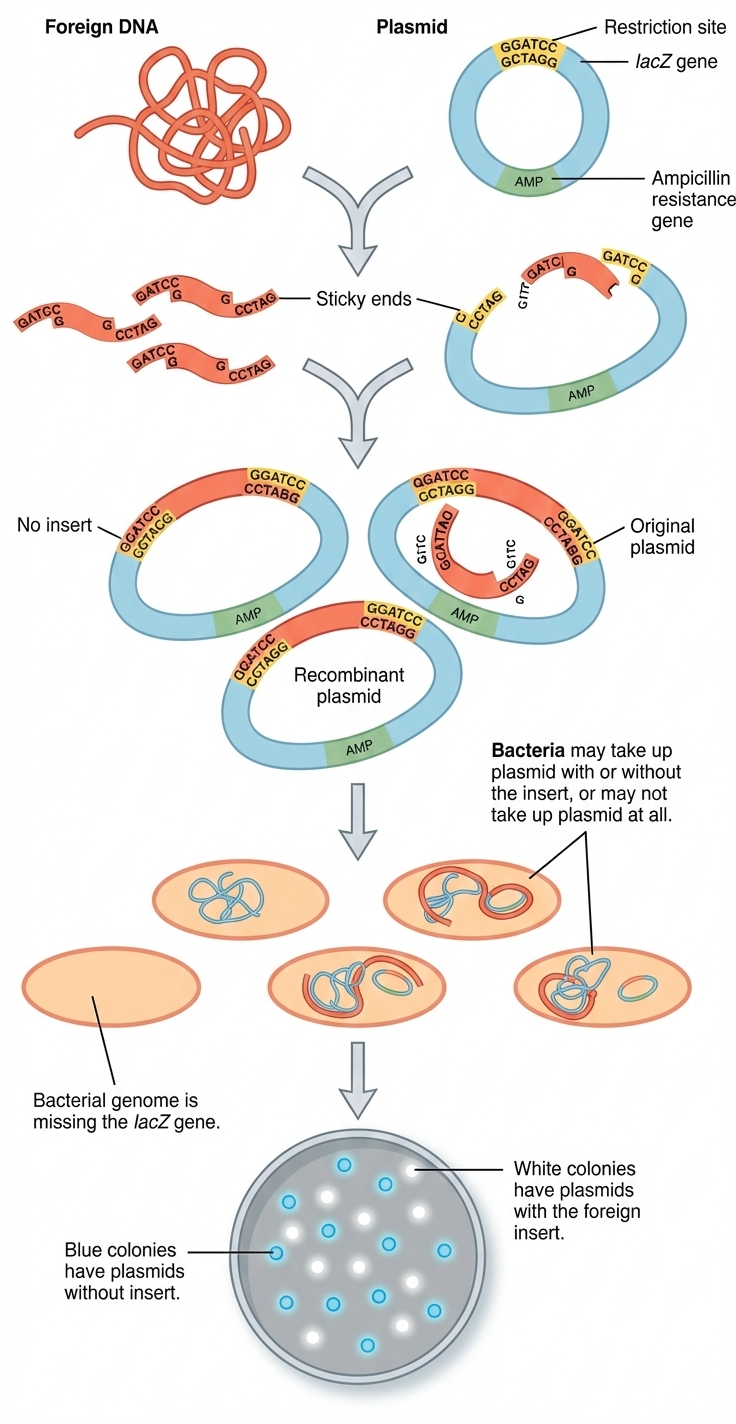
- איתור ובידוד הגן הרצוי והווקטור.
- חיתוך מכוון באמצעות אנזימי רסטריקציה בעלי רצפי הכרה ספציפיים - כדי לא “לחתוך בטעות באמצע הגן” וליצור קצוות תואמים.
- ליגציה - חיבור המקטע לווקטור בעזרת DNA ligase.
- טרנספורמציה - החדרת הפלסמיד לחיידקים (למשל באמצעות חימום או קירור שמערער ממברנה).
- סלקציה - לרוב באמצעות עמידות לאנטיביוטיקה: מגדלים על מצע עם אנטיביוטיקה ורק חיידקים שקיבלו פלסמיד שורדים.
- שכפול וביטוי - בתוך החיידק הפלסמיד צריך לכלול Origin of Replication (ori) כדי להשתכפל עצמאית.
חיות טרנסגניות (Knockout) למחקר: למה ולמה זה היה איטי
איור לא מדויק:
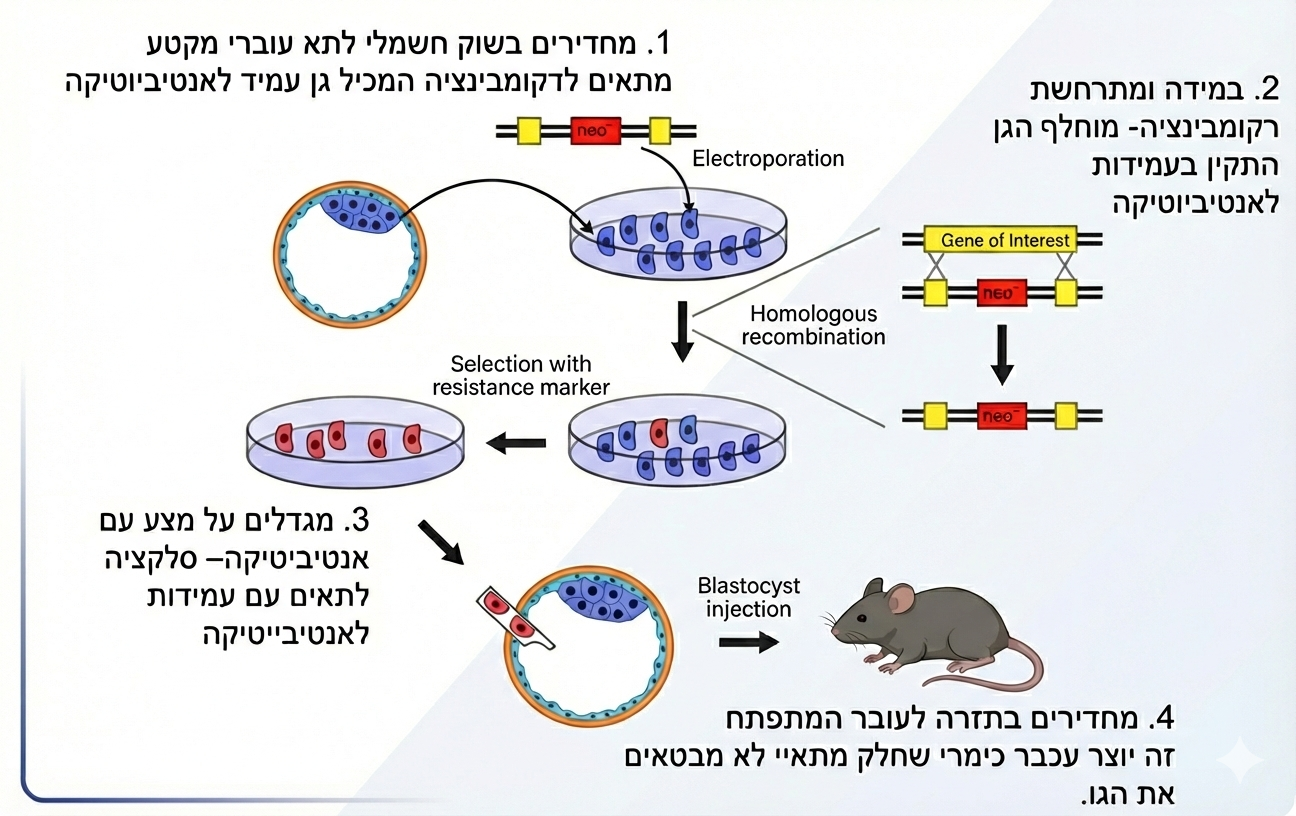
המטרה העיקרית: להוכיח קשר סיבתי בין גן לפנוטיפ (למשל מחלה). בעבר עשו זאת לרוב דרך רקומבינציה הומולוגית:
- מחדירים מקטע DNA עם קצוות מתאימים + סמן (למשל עמידות)
- בוחרים תאים שבהם הייתה רקומבינציה (החלפה מדויקת של הגן המקורי עם המקטע החדש)
- מחזירים לעובר ← מתקבל עובר/עכבר כימרי (חלק מהתאים עם השיבוט וחלק בלי).
- נדרשות הכלאות ודורות כדי להגיע להטרוזיגוט/הומוזיגוט מתאים. זה היה תהליך של חודשים-שנים, עד כדי כך שדוקטורנטים חיכו זמן רב רק כדי ״לקבל את העכבר״.
המסר: CRISPR קיצר דרמטית את המסלול הזה.
ריפוי גני: למה זה קשה יותר מאשר בחיידק
המעבר לאדם מוסיף שכבות:
- הרבה סוגי תאים, לא ״תא אחד שהוא כל האורגניזם״.
- לרוב יש גרעין, צריך להגיע אליו.
- צריך להחליט: תאי גוף (somatic) מול תאי נבט/עובר (germline).
- סומטי: שינוי מקומי, לא עובר לדור הבא.
- עובר/נבט: שינוי בכל תאי הגוף וגם בתורשה - ולכן טעון יותר מבחינה אתית.
שתי אסטרטגיות יישום
- Ex vivo (חוץ-גופית): מוציאים תאים (למשל דם/מח עצם), מהנדסים בצלחת, מחזירים.
- In vivo (תוך-גופית): מחדירים וקטור ישירות לרקמה (למשל לריאות בציסטיק פיברוזיס).
איך מכניסים חומר גנטי לתאים?
הוצגו כמה אפשרויות:
- וירוסים מהונדסים (DNA viruses / RNA viruses כמו רטרו/לנטי) - יתרון: יודעים להיכנס לתא ואף לגרעין. חסרון: שאלות בטיחות, שילוב בגנום, שליטה באתר ההחדרה, סיכון פתוגניות/שינויים.
- ליפוזומים - מעטפת שומנית שמתלכדת עם ממברנה; פחות ״ישות ביולוגית״ ולכן נתפס בטוח יותר, אבל יציבות/משך ביטוי יכולים להיות מוגבלים.
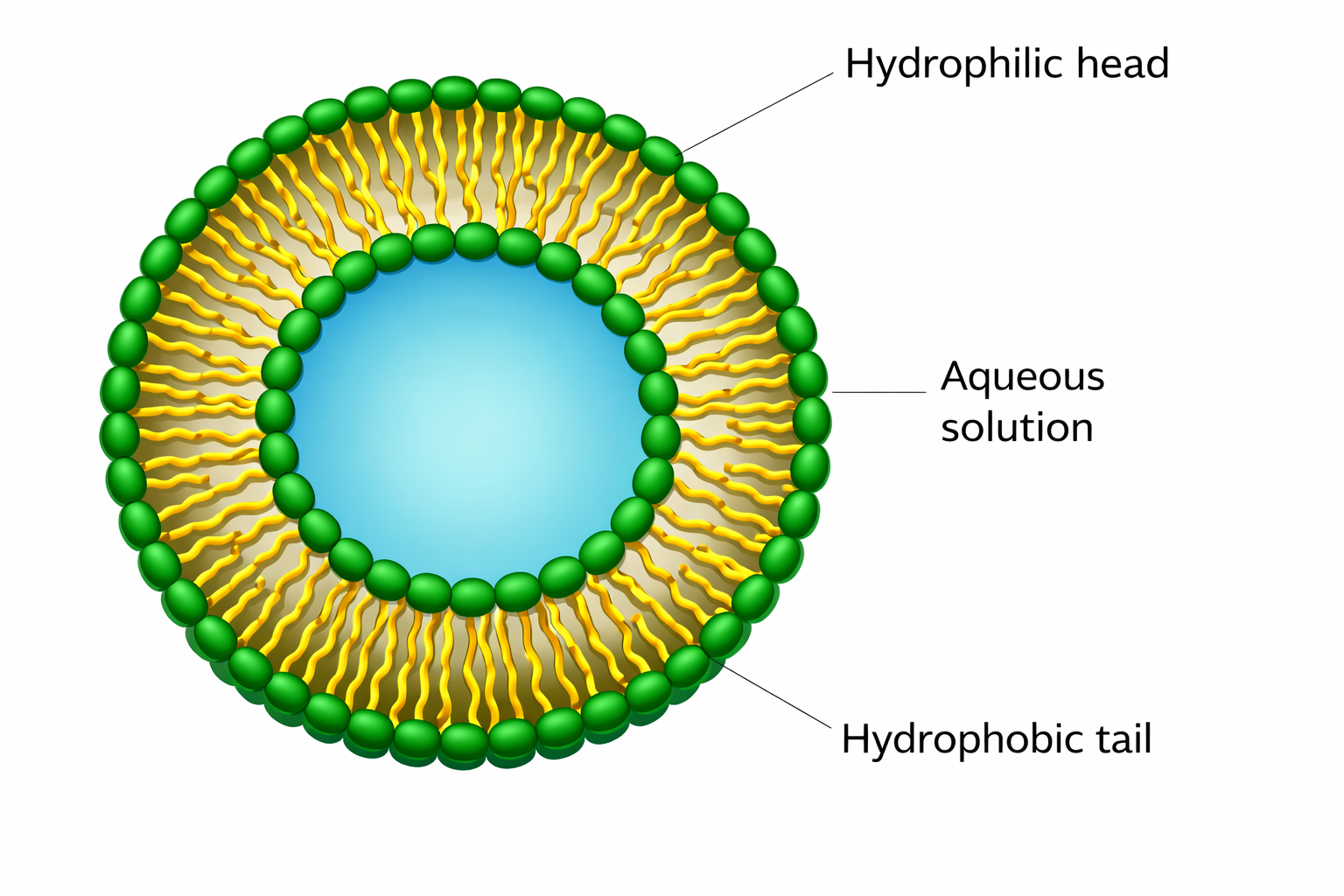
- שוק חשמלי / שיטות פיזיקליות בהתאם לסוג התא.
הבחירה בווירוס תלויה בסוגי התאים (מתחלקים/לא מתחלקים), משך הזמן הרצוי, ושליטה בהחדרה.
דוגמה קלינית: טיפול בתאי T (CAR-T)
הובאה דוגמת אמילי (Emily Whitehead): טיפול שבו לוקחים תאי T, מהנדסים אותם כך שיזהו מטרה סרטנית (למשל CD19 בלוקמיה), מחזירים לגוף, ומקבלים תגובה שיכולה להוביל לרמיסיה. הדוגמה הדגישה גם תופעות לוואי אימוניות אפשריות, הצורך במעקב, ושזה היה ניסוי חלוצי.
עריכה גנומית ו-CRISPR-Cas9: “הלב” של המהפכה
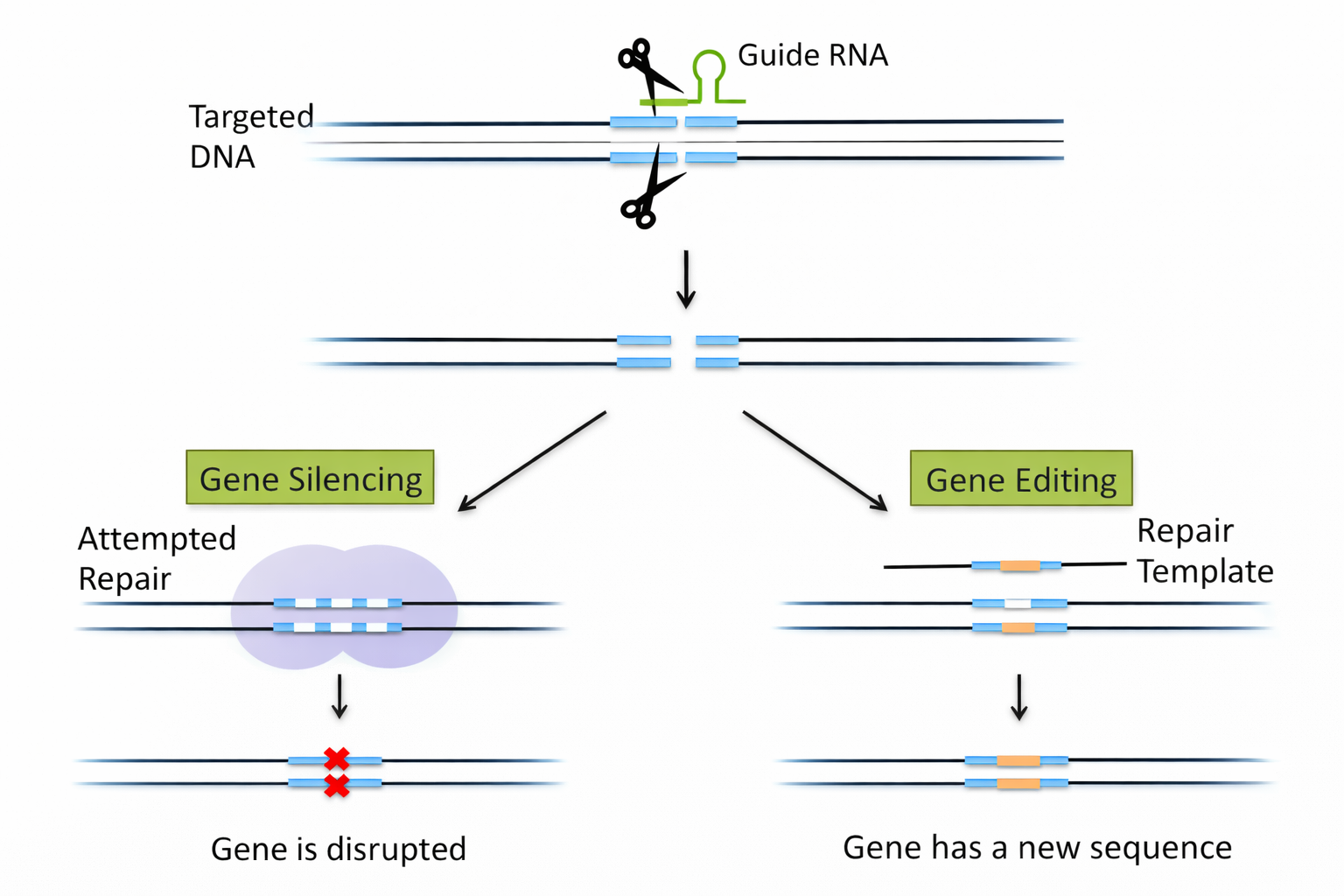
עריכה גנומית הוגדרה כשינוי מכוון ברצף קיים: מחיקה / הכנסה / תיקון של נוקלאוטיד או מקטע.
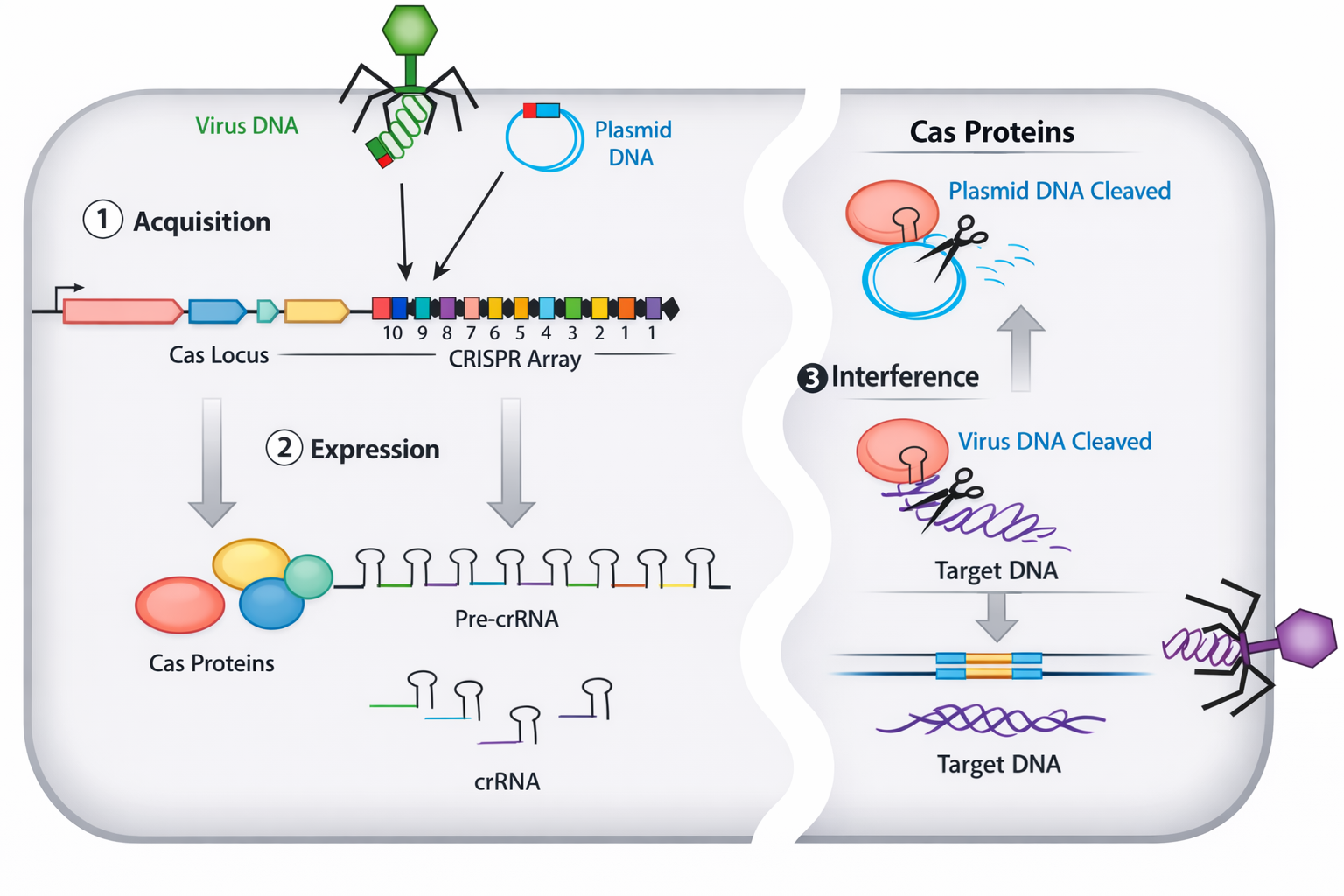
העיקרון
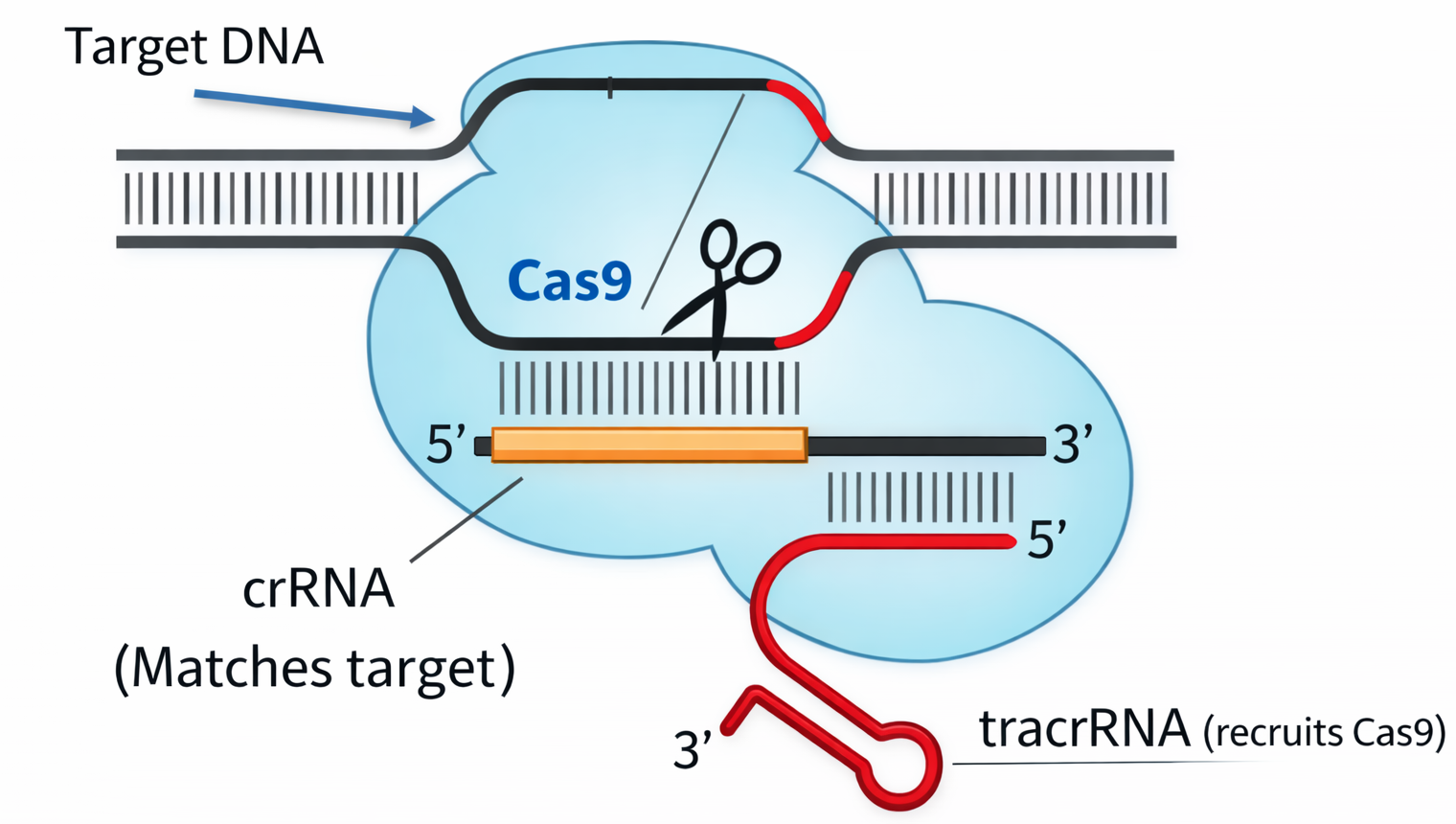
- משתמשים ב-guide RNA שמכוון לרצף ספציפי בגנום.
- החלבון Cas9 מבצע שבר דו-גדילי במקום המכוון.
- מכאן אפשר ללכת לשני כיוונים:
- השבתה/שיבוש גן (Gene silencing) דרך חיתוך ותיקון לא מדויק שמנטרל פונקציה.
- תיקון/החלפה אם מוסיפים תבנית (template) לתיקון, בדומה לרקומבינציה הומולוגית: מתקנים מוטציה ידועה באמצעות רצף תקין.
מאיפה זה הגיע?
CRISPR היא מערכת חיידקית טבעית להגנה מפני DNA זר (למשל בקטריופאג’ים). המנגנון כולל רכיבי RNA וחלבוני חיתוך. ההיסטוריה שהודגשה: ב-2013 הוצג פישוט משמעותי שבו מאחדים את רכיבי ה-RNA ליחידה אחת (“guide”), מה שמאפשר שימוש הנדסי קל יותר.
למה זה שינה את התחום?
כי זה נתפס ככלי:
- מדויק ומכוון יותר,
- מהיר וזול יותר,
- מאפשר להאיץ מחקר (למשל יצירת knockout בעכברים),
- וכבר החל להיכנס לטיפולים קליניים.
CRISPR וסרטן: לאן מכוונים?
השיעור חיבר לגנטיקה של סרטן:
- Tumor suppressors: ״הבלמים״ של מחזור התא. בסרטן לעיתים יש אובדן פעילות שלהם ← הרעיון הטיפולי יכול להיות להחזיר/להגביר פעילות (אם אפשר).
- Proto-oncogenes / oncogenes: ״הגז״ שמקדם חלוקה. בסרטן יש פעילות יתר ← הרעיון יכול להיות להחליש/לנטרל בתאים סרטניים.
אבל הוצג קושי: הגידול הטרוגני וצובר מוטציות; לכן לעיתים ריאלי יותר לתקוף לא את כל תאי הגידול ישירות אלא להעצים את מערכת החיסון.
דוגמה שניתנה:
- עריכה בתאי T: חיתוך PD-1 (מעכב תגובה חיסונית) כדי להגביר פעילות.
- CAR-T: הוספת יכולת זיהוי אנטיגן (כמו CD19) כך שתאי T יכוונו ספציפית לתאים סרטניים.
בנוסף הוזכר שכיום CRISPR משמש גם לא רק ״לחתוך״, אלא גם לדיוק בבקרת ביטוי (רגולציה עדינה), ואפילו רעיונות של השפעה זמנית בסגנון RNAi.
שיבוט אורגניזם: מדולי ועד שאלת האדם
כאן השיעור עבר מהנדסה ״של גן״ לשיבוט ״של יצור״.
העיקרון הביולוגי
כדי לקבל אורגניזם חדש זהה גנטית למקור, לא צריך זרע וביצית; צריך:
- מטען DNA דיפלואידי (גרעין מתא סומטי),
- וסביבה של תא ביצית שמפעילה את תוכנית החלוקות וההתפתחות.
ההליך:
- מוציאים גרעין מביצית (enucleation).
- מכניסים גרעין מתא סומטי דיפלואידי.
- נותנים פולס חשמלי ← לפעמים מתחיל תהליך חלוקה והתפתחות.
- אחוזי הצלחה נמוכים; נדרשת גם “איפוס” אפיגנטי (כמו מחיקת מתילציה בשלבים מוקדמים).
דולי (1996): למה השתמשו בשלוש כבשים?
כדי להראות מקור השפעות:
- כבשה שתרמה ביצית (ציטופלזמה/מיטוכונדריה ו-mRNA מוקדם),
- כבשה שתרמה גרעין (DNA גרעיני עיקרי),
- כבשה פונדקאית שנשאה את ההיריון.
דולי הייתה דומה גנטית לתורמת הגרעין (למעט תרומות מיטוכונדריאליות אפשריות). לאחר מכן שוכפלו גם מינים נוספים. דולי מתה צעירה יחסית, וזה הצית דיונים על טלומרים/בקרת ביטוי גנים/איכות התהליך, וגם על כך שרוב הניסיונות “נכשלים” ולכן עולות שאלות מה קורה בעוברים שלא מתפתחים.
מה מותר, מה אסור, ומה מתבלבל בכותרות
השיעור הציג שהתחום מוצף לעיתים בהצהרות לא מבוססות, לצד מקרים אמיתיים מעוררי סערה. הודגש שכיום, במיוחד לגבי שיבוט אדם ועריכה גנומית בעוברים, רוב המדינות מחמירות מאוד, ובישראל (כפי שנאמר בשיעור) אסור שיבוט אדם ועריכת גנים בעוברים למטרות רבייה. עם זאת, למחקר יש לעיתים מסגרות שונות ומוגבלות במדינות שונות.
נוסף גם ההבדל בין:
- Reproductive cloning (יצירת אדם/יצור חדש) לבין
- Therapeutic cloning (שיבוט לצורך הפקת תאים/רקמות להשתלה בלי יצירת אורגניזם שלם).
דילמות אתיות שהשיעור זרק לכיתה (לא כדי לסגור, כדי לחשוב)
המסר החוזר: אין “כן/לא” פשוט. כל טכנולוגיה פותחת שאלות של אחריות, רגולציה וזהות.
- הנדסה גנטית להצלת יבול חקלאי מול חשש לפגיעה אקולוגית/מגוון/השפעות ארוכות טווח.
- שיבוט אדם חכם במיוחד לשימור “תרומה לאנושות” מול זכויות היצור החדש, ואי-ודאות חברתית.
- עיצוב תכונות בצאצאים (IVF/PGD/עריכה): איפה הגבול בין מניעת מחלה לבין “שדרוג” (מראה, IQ וכו’)? זה מתחבר לחשש מאאוגניקה, מצמצום שונות גנטית, ומפערים חברתיים (מי שיכול להרשות לעצמו).
וכן השאלה העקרונית: מי מחליט - הפרט? המדינה? הקהילה הבינלאומית? ואיך מייצרים רגולציה כשהטכנולוגיה נהיית “קיט ביתי”?
סיום: הטון של השיעור
הקו המסכם היה מפוכח: הנדסה גנטית היא קפיצת מדרגה ביכולת שלנו להבין ולשנות מנגנונים ביולוגיים, ולכן הפוטנציאל שלה עצום - לטוב ולרע. הערך הלימודי המרכזי הוא לא רק לדעת “איך זה עובד”, אלא להבין שהידע הזה מיד מתרגם לשאלות של חברה, מוסר, מדיניות וסיכון, ושכדי להתקדם בצורה אחראית חייבים לשלב מדע עם דיון ציבורי ורגולטורי.
תודה למודל ChatGPT 5.2 (Thinking) של OpenAI על הסיוע בעריכת הסיכום.
דור פסקל