לשנן
המרת כהלים להלוגנים
| ריאגנט | מנגנון | כהל ראשוני | כהל שניוני | כהל שלישוני | הערות |
|---|---|---|---|---|---|
| $\ce{HBr}$/$\ce{HCl}$ | SN1 דרך קרבוקטיון | לא עובד | עובד + שחלופים | הדרך היחידה | ניצולות נמוכות מאוד על ראשוני |
| $\ce{PBr3}$ | SN2 | אידיאלי | היפוך קונפיגורציה | אין SN2 על שלישוני | קשר זרחן-חמצן בין הקשרים החזקים בטבע |
| $\ce{SOCl2}$ | SN2 | אידיאלי | היפוך קונפיגורציה | לא עובד | פירידין = הבסיס במערכת |
כלל מפתח:
- כהל שלישוני ← הלוגן: רק $\ce{HX}$
- כהל ראשוני ← הלוגן: רק $\ce{PBr3}$/$\ce{SOCl2}$
חמצון כהלים - יצירת קטונים ואלדהידים (קרבונילים)
בחמצון: תמיד מימן ו-$\ce{OH}$ הולכים, נסגר קשר כפול $\ce{C=O}$
- כהל ראשוני:
- $\ce{PCC}$ ← אלדהיד
- $\ce{KMnO4}$/$\ce{Cr2O7}$ ← חומצה קרבוקסילית
- כהל שניוני: כל מחמצן ← קטון
- כהל שלישוני: לעולם לא מתחמצן
יצירת אלדהיד מכוהל - $\ce{PCC}$ על כוהל ראשוני בלבד!
חיזור קרבונילים - יצירת כהלים
| ריאגנט | מה הוא עושה | תוצר | הערות |
|---|---|---|---|
| $\ce{NaBH4}$ | נותן $\ce{H-}$ | כהל | מתון, עובד רק על קרבונילים |
| $\ce{LiAlH4}$ | נותן $\ce{H-}$ | כהל | חזק, מחזר גם חומצות/אסטרים |
| $\ce{H2}$/$\ce{Pt}$ | הוספת $\ce{H2}$ | כהל | קטליטי |
$\ce{H-}$ = נוקלאופיל חזק ← תמיד נותן כהל
סולם אלקטרופיליות קרבונילים
| חומר | אלקטרופיליות | סיבה |
|---|---|---|
| $\ce{H-CHO}$ (פורמלדהיד) | הכי גבוהה | אין דחיפת $\ce{e-}$, אין הפרעה סטרית |
| $\ce{R-CHO}$ (אלדהיד) | גבוהה | רק R אחד דוחף $\ce{e-}$ |
| $\ce{R2C=O}$ (קטון) | נמוכה יותר | שני R דוחפים $\ce{e-}$ |
ככל שיותר פחמנים על הקרבוניל ← פחות אלקטרופילי
התקפה על קרבונילים - מנגנונים
סביבה בסיסית vs חומצית
| סביבה בסיסית | סביבה חומצית | |
|---|---|---|
| נוקלאופילים | חזקים: $\ce{RMgBr}$, $\ce{H-}$, $\ce{OH-}$, $\ce{RO-}$ | חלשים: $\ce{ROH}$, $\ce{H2O}$, $\ce{RNH2}$ |
| מנגנון | התקפה ישירה ← $\ce{O-}$ ← פרוטונציה | פרוטונציה ← קרבוקטיון ← התקפה |
| תוצר | תמיד כהל | תלוי בנוקלאופיל |
כל התקפה על קטון/אלדהיד = התוצר כהל
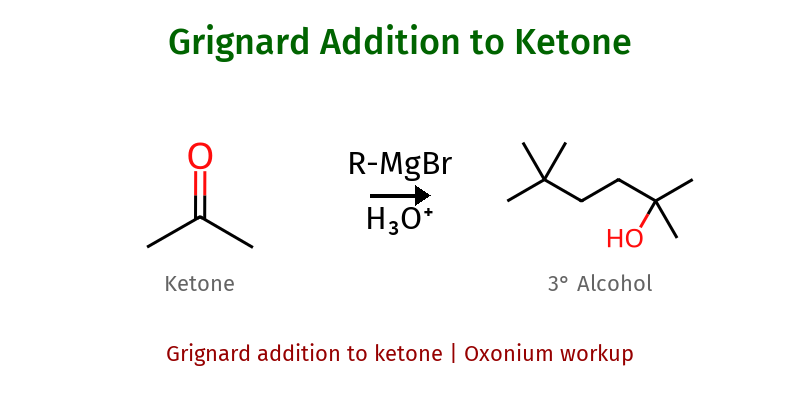
גריניאר
$\ce{RMgBr}$/$\ce{RLi}$ + קרבוניל ← כהל (אחרי $\ce{H3O+}$ work-up)
| מה תוקפים | תוצר |
|---|---|
| פורמלדהיד | כהל ראשוני |
| אלדהיד אחר | כהל שניוני |
| קטון | כהל שלישוני |
חשוב: גריניאר תמיד שני שלבים!
- $\ce{RMgBr}$ + $\ce{C=O}$
- $\ce{H3O+}$ (work-up)
אצטלים
זיהוי ויצירה
| שם ומבנה | יציבות | הערות |
|---|---|---|
| \(\begin{array}{ccc} & \text{Hydrate} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{OH}}} \quad \underset{\diagup \quad}{\textcolor{red}{\ce{OH}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\) | מתפרק מיד | מים + קרבוניל = לא מעניין |
| \(\begin{array}{ccc} & \text{Hemiacetal} & \\[6pt] & \underset{ \vert}{\textcolor{black}{\ce{R}}} \quad \quad \quad \underset{ }{\textcolor{black}{\ce{}}} & \\[-6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{O}}} \quad \underset{\diagup \quad}{\textcolor{red}{\ce{OH}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\) | לא יציב | ממשיך להגיב לאצטל |
| \(\begin{array}{ccc} & \text{Acetal} & \\[6pt] & \underset{ \vert}{\textcolor{black}{\ce{R}}} \quad \quad \underset{ \vert}{\textcolor{black}{\ce{R}}} & \\[-6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{O}}} \quad \underset{\diagup \quad}{\textcolor{red}{\ce{O}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\) | יציב מאוד | קבוצת הגנה |
תגובת יצירה
קטון/אלדהיד + $\ce{2ROH}$ ⇌ אצטל + $\ce{H2O}$ (עם $\ce{H+}$)
עקרונות חשובים
- משיכת מים החוצה ← דוחף לאצטל (Le Chatelier)
- הוספת מים ← חזרה לקרבוניל
- אתילן גליקול ← טבעת 5 (יעיל יותר)
- אצטל יציב לכל מלבד $\ce{H3O+}$
אימִינים ואֵנָמִינים
| אמין מגיב | תוצר | מבנה | זיהוי |
|---|---|---|---|
| $\ce{NH3}$ \(\begin{array}{ccc} & \text{or} \, 1^\circ \text{Amine:} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{cyan}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt] & \textcolor{blue}{\ce{NH2}} & \\ \end{array}\) | \(\begin{array}{ccc} & \text{Emine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{cyan}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt] & \textcolor{blue}{\ce{N}} & \\[-6pt] & \vert \vert \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt] \end{array}\) | $\ce{R2C=NR’}$ | $\ce{C=N}$ |
| \(\begin{array}{ccc} & 2^\circ \text{Amine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{cyan}{\ce{R}}} \quad \underset{ \diagup \quad }{\textcolor{cyan}{\ce{R}}} & \\[-6pt] & \textcolor{blue}{\ce{NH}} & \\ \end{array}\) | \(\begin{array}{ccc}& \text{Enamine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{cyan}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt]& \textcolor{blue}{\ce{N}} & \\[-6pt]& \vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup \hspace{-0.3em} \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\) | $\ce{R2C=CR-NR’2}$ | $\ce{C=C-N}$ |
| שלישוני | לא מגיב | - | לא נוקלאופילי |
כלל הזיהוי: הפחמן בקשר כפול לחנקן = היה קרבונילי
חיזור אימינים ואנאמינים:
- הוספת $\ce{H3O+}$ מחזירה לקרבוניל (הופכת את התגובה המקורית)
- $\ce{->[H2/Pd]}$ מחזר לאמין (פירוק הקשרים הקפולים)
תגובות מיוחדות וקבוצות הגנה
| תגובה | ריאגנטים | תוצר | שימוש |
|---|---|---|---|
| יצירת טיואצטל | $\ce{RSH}$ + $\ce{H+}$ | $\ce{R2C(SR’)2}$ | הכנה לחיזור מלא |
| חיזור מלא | טיואצטל + Raney Ni | אלקאן | העלמת קרבוניל |
| הגנה | קרבוניל ← אצטל | אצטל | מונע תגובה לא רצויה |
טיפים לפתרון שאלות
זיהוי מהיר
- $\ce{CHO}$ = אלדהיד (לא $\ce{COH}$!)
- $\ce{C(OR)2}$ = היה קרבוניל
- טבעת באצטל = אתילן גליקול
- המי-אצטל טבעתי = יציב (חריג!)
פירוק אצטל - מתכון
- מצא את הפחמן עם $\ce{(OR)2}$
- זה היה הקרבוניל
- כל $\ce{OR}$ הופך ל-$\ce{ROH}$
- הפחמן חוזר להיות קרבוניל-$\ce{C=O}$
חוקי ברזל
- ברגע שיש קרבוקטיון ← בדוק שחלוף
- התקפה תוך-מולקולרית > בין-מולקולרית
- $\ce{NaOH}$ לא תוקף קרבוניל (יוצר הידראט שמתפרק)
- אם יש קשר כפול במולקולה - אל תשתמש ב-$\ce{KMnO4}$ לחמצון
- גריניאר צריך work-up עם $\ce{H3O+}$ (תמיד שני שלבים)
- E1 תמיד נותן זייצב (גם עם בסיס קטן)
דגשים
- “כהל שלישוני זה הדרך היחידה” - להפיכה להלוגן עם $\ce{HX}$
- “המנגנון הזה מסתמך על מנגנון אחד” - כל פרק הקרבונילים
- “תזכרו את זה בפעם הבאה” - $\ce{NaOH}$ לא תוקף קרבוניל
תגובות המרה של אלכוהולים לתרכובות הלוגניות ולקרבונילים, ויציג את היסודות הבסיסיים של כימיה קרבונילית - תחום מרכזי בכימיה אורגנית המניח את הבסיס להבנת מנגנונים מורכבים יותר.
חלק א׳: המרת אלכוהולים לתרכובות הלוגניות
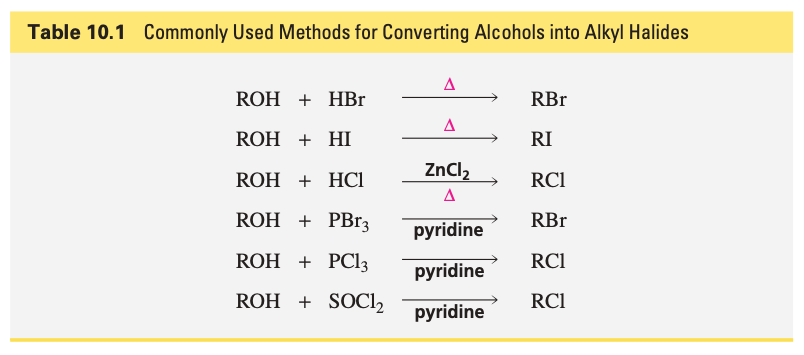
עקרונות תיאורטיים ואתגרים מכניסטיים
הבעיה המהותית בהמרת אלכוהולים
האתגר העיקרי בהמרת אלכוהולים לתרכובות הלוגניות נובע מהעובדה שקבוצת ההידרוקסיל ($\ce{OH^-}$) מהווה קבוצה עוזבת גרועה מאוד.
באמצעות ניתוח של החומציות היחסית, אפשר להבין ש-$\ce{H2O}$ הוא חומצה חלשה משמעותית ($\mathrm{p}K_a \approx7$), מה שאומר ש-$\ce{OH^-}$ הוא בסיס חזק, ולכן קבוצה עוזבת גרועה.
לעומת זאת, הלוגנידים כמו $\ce{Br^-}$ ו-$\ce{Cl^-}$ הם בסיסים חלשים הרבה יותר ולכן קבוצות עוזבות טובות.
הפתרון טמון בהפיכת קבוצת ההידרוקסיל לקבוצה עוזבת טובה יותר, דרך פרוטונציה או דרך יצירת קשר עם אטומים אלקטרופיליים.
שיטות קלאסיות: תגובה עם חומצות הלוגניות
המנגנון הבסיסי
התגובה הפשוטה ביותר להמרת אלכוהולים לתרכובות הלוגניות כוללת שימוש בחומצה הלוגנית חזקה כמו $\ce{HBr}$ או $\ce{HCl}$.
המנגנון מתחיל בפרוטונציה של האלכוהול (נניח ש-$\ce{HX}$ הוא $\ce{HCl}$):
\[\ce{R-OH ->[HCl] R-\mathbf{OH_2^+} + Cl^-}\]הפרוטונציה הופכת את המים ($\ce{H2O}$ שהחליפו את קבוצת ההידרוקסיל) לקבוצה עוזבת טובה יותר. לאחר מכן, המשך המנגנון תלוי בסוג האלכוהול.
תלות בסוג האלכוהול והיציבות היחסית
-
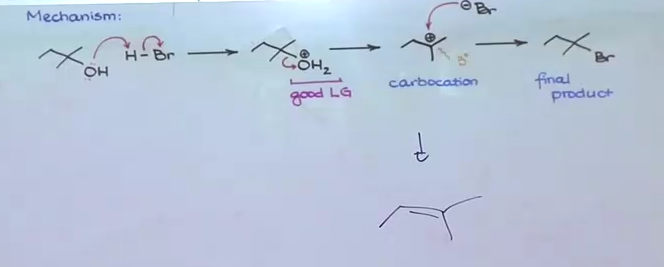
אלכוהולים שלישוניים: התגובה מתרחשת בקלות רבה דרך מנגנון $\mathrm{S_N1}$. הקרבוקטיון השלישוני מיוצב על ידי שלוש קבוצות אלקיל דוחפות אלקטרונים באמצעות השפעה אינדוקטיבית ואפקט ההיפרקונג׳וגציה.
עבור אלכוהולים שלישוניים, המים עוזבים ויוצרים קרבוקטיון יציב:
\[\ce{R3C-OH2^+ -> R3C^+ + H2O}\]בסיום, יון ההלוגן תוקף את הקרבוקטיון:
\[\ce{R3C^+ + X^- -> R3C-X}\](אם היינו משתמשים ב-$\ce{H2SO4}$ התוצר היה דווקא הידרציה - יצירת קשר כפול כמו בחץ למטה).
-
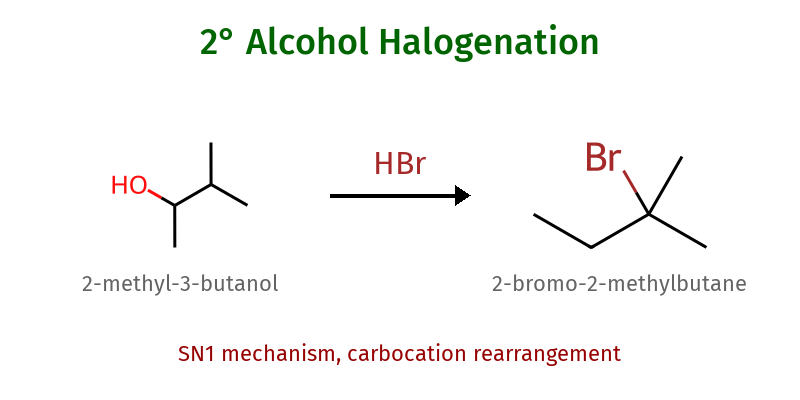
אלכוהולים שניוניים: התגובה מתרחשת, אך בקצב איטי יותר. קיים סיכון לשחלופי קרבוקטיון (1,2-שחלוף הידריד או אלקיל), אשר עלול להוביל לתערובת של תוצרים עם שינוי בשלד הפחמני.
-
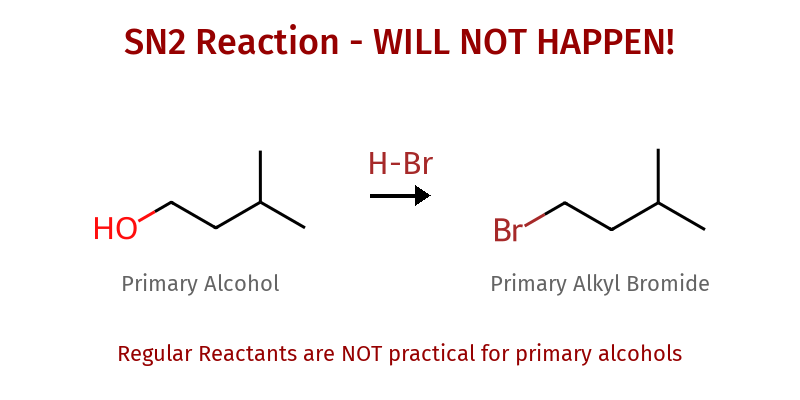
אלכוהולים ראשוניים: הקרבוקטיון הראשוני אינו יציב, המים לא עוזבים בקלות ולכן התגובה איטית מאוד ולא יעילה. תיאורטית, המנגנון אמור להיות $\mathrm{S_N2}$, אך מכשולים קינטיים הופכים את התגובה לבלתי מעשית.
הגדרות בסיסיות - תוקף vs נתקף
חשוב להבהיר את המינוח:
- תוקף (נוקלאופיל): בעל זוג אלקטרונים חופשי או מטען שלילי, יוצר קשר חדש
- נתקף (אלקטרופיל): מקבל אלקטרונים, נוצר אליו קשר חדש
בתגובות חומצה-בסיס: הבסיס - אלכוהול - “קוטף” פרוטון מהחומצה.
שיטות מתקדמות: רגנטים אורגנו-פוספור ואורגנו-גופרית
זרחן טריברומיד ($\ce{PBr3}$)
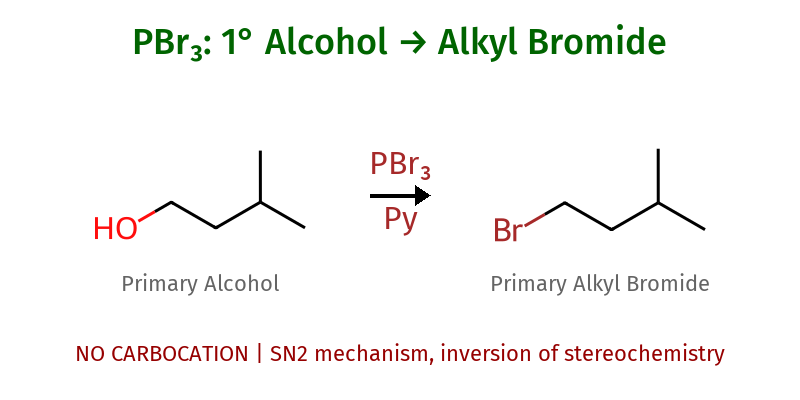
זרחן טריברומיד מהווה פתרון אלגנטי לבעיית האלכוהולים הראשוניים והשניוניים.
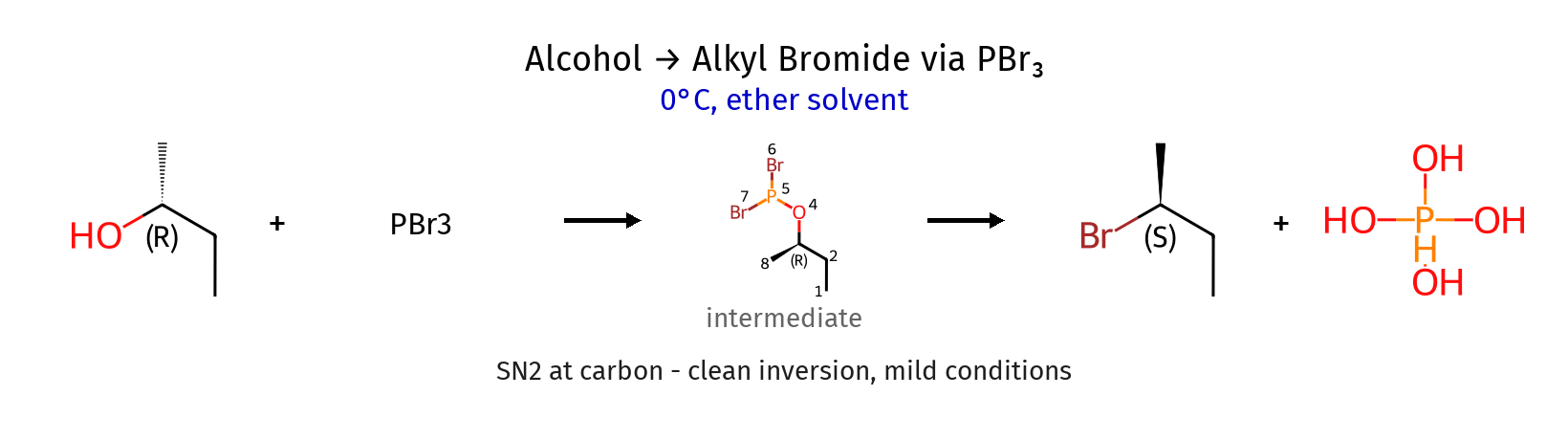
המנגנון כולל שני שלבים מובחנים:
-
שלב א׳: התקפה נוקלאופילית על הזרחן
\[\ce{3 R-OH + PBr3 -> 3 R-OPBr2 + 3 Br^-}\]בשלב זה, החמצן של האלכוהול תוקף את הזרחן (אטום מרכזי אלקטרופילי) תוך יציאת ברומיד. התוצר הוא אסטר פוספונט.
-
שלב ב׳: התקפה נוקלאופילית על הפחמן
\[\ce{R-OPBr2 + Br^- -> R-Br + [OPBr2]^-}\]בשלב זה, יון הברומיד תוקף את הפחמן במנגנון $\mathrm{S_N2}$ מובהק, תוך הסרת קבוצת הזרחן.
יתרונות מכניסטיים:
- הקשר P-O הוא מהחזקים בטבע (כ-540 קג׳יי/מול), מה שהופך את קבוצת הזרחן לקבוצה עוזבת מצוינת
- המנגנון $\mathrm{S_N2}$ מבטיח הפיכת קונפיגורציה במרכזים כיראליים
- התגובה יעילה גם לאלכוהולים ראשוניים
תיוניל כלוריד ($\ce{SOCl2}$)
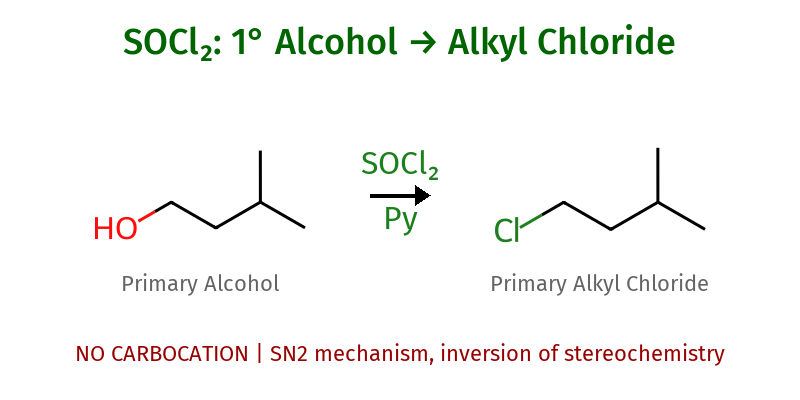
באופן דומה, תיוניל כלוריד משמש להכנת כלורידים:
\[\ce{R-OH ->[SOCl2][pyridine] R-OSCl + HCl}\] \[\ce{R-OSCl + Cl^- -> R-Cl + SO2 + Cl^-}\]היתרון של תיוניל כלוריד הוא שתוצרי הלוואי ($\ce{SO2}$ ו-$\ce{HCl}$) הם גזים הנפלטים מהתערובת, מה שמקל על טיהור התוצר.
דהידרציה של אלכוהולים: יצירת אלקנים
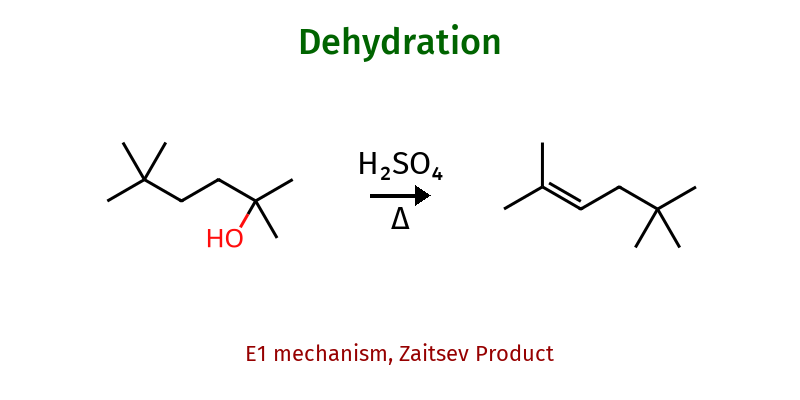
חזרה - דהידרציה של אלכוהולים
אם ניקח כהל בחומצה חזקה וחימום נקבל תקובת דהידרציה:
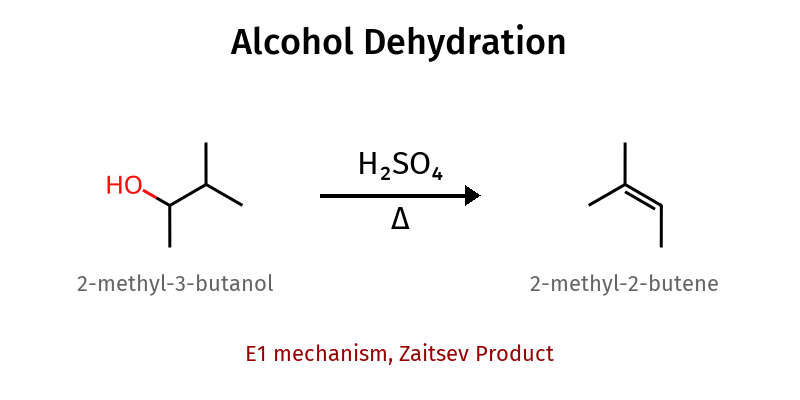
המנגנון והגורמים הקובעים
תגובת דהידרציה של אלכוהולים בנוכחות חומצה חזקה וחימום מובילה ליצירת אלקנים דרך מנגנון $\ce{E1}$:
\[\ce{R-CH2-CH(OH)-R' ->[H2SO4, \Delta] R-CH=CH-R' + H2O}\]המנגנון כולל:
- פרוטונציה של ההידרוקסיל
- יציאת מים ויצירת קרבוקטיון
- קטיפת פרוטון $\beta$ על ידי בסיס (בדרך כלל מולקולת מים או $\ce{HSO4-}$)
כלל זייצב וסלקטיביות התוצר
בשל המעבר דרך קרבוקטיון, האלקן שנוצר הוא לרוב המותמר ביותר — בהתאם לכלל זייצב. הקרבוקטיון נוצר במיקום היציב ביותר (שלישוני > שניוני > ראשוני), ולעיתים עובר סידורים מחדש (rearrangements) לקבלת קרבוקטיון יציב יותר. הדה-פרוטונציה מתרחשת באופן שיוצר את האלקן היציב ביותר תרמודינמית, כלומר האלקן המותמר ביותר.
דוגמה: דהידרציה של 2-בוטנול מניבה בעיקר 2-בוטן (יותר מותמר) ורק מעט 1-בוטן (פחות מותמר).
שאלה 1 - מציאת ריאגנטים
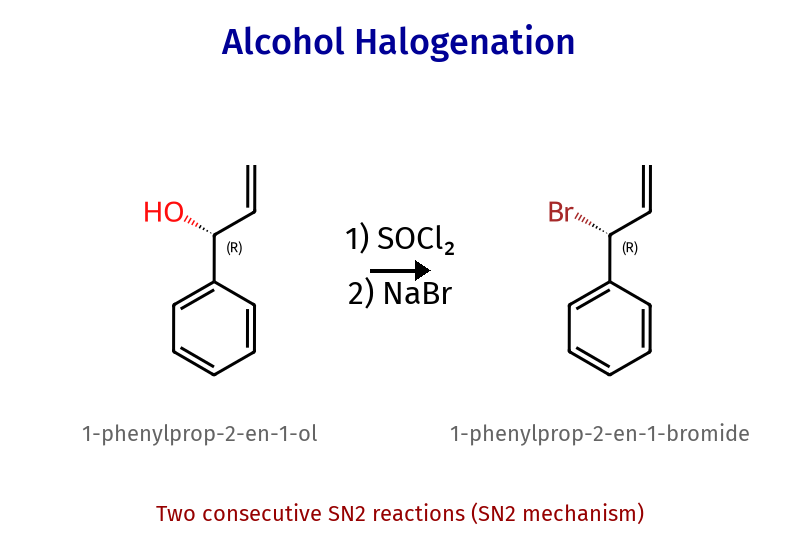
שאלה 2 - השלימו את הריאגנטים
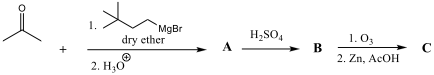
 |  |
בשלב האחרון יש אוזונוליזה בתנאים מחזרים - הקשר הכפול ישבר ונקבל שני תוצרים: קטיונים ואלדהידים (לפחמנים שהיה מחובר להם מימן).
שאלה 3: מה התוצר הסופי העיקרי בתגובה הבאה?
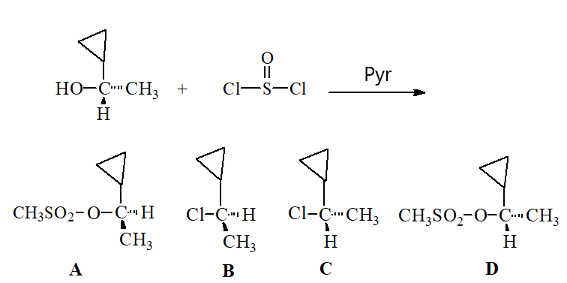
התשובה היא B - במקום אלכוהול נכנס $\ce{Cl}$ ויש היפוך קונפיגורציה (כי הפחמן כיראלי).
חלק ב׳: חמצון אלכוהולים לקרבונילים
עקרונות תרמודינמיים וקינטיים בחמצון אלכוהולים
ההגדרה הפורמלית של חמצון באורגנית
בכימיה אורגנית, חמצון מוגדר כהסרת אלקטרונים או הוספת חמצן או הסרת מימן. בהקשר של אלכוהולים, החמצון כולל הסרת שני אטומי מימן: אחד מקבוצת ההידרוקסיל ואחד מהפחמן הסמוך, תוך יצירת קשר כפול $\ce{C=O}$.
הדרישה המבנית לחמצון
התנאי ההכרחי לחמצון אלכוהול הוא נוכחות מימן על הפחמן שנושא את קבוצת ההידרוקסיל:
-
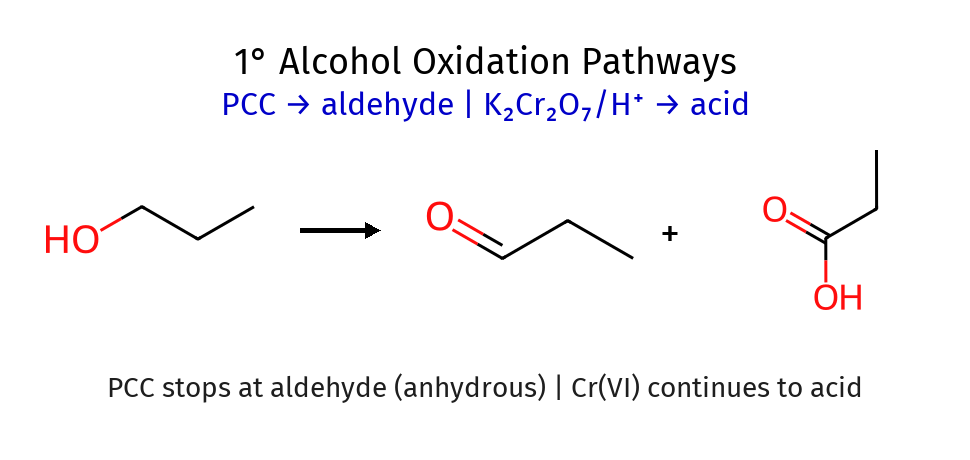
אלכוהול ראשוני (יש שני $\ce{H}$ ים ← ניתן לחמצון לאלדהיד ואז לחומצה קרבוקסילית)
\[\begin{array}{c} \textcolor{cyan}{\ce{H}} \\ | \\ \ce{R - C - OH} \\ | \\ \textcolor{cyan}{\ce{H}} \\ \end{array}\]- הפחמן המרכזי קשור ל־OH, ל־R ולשני מימנים ← ניתן לחמצון.
-
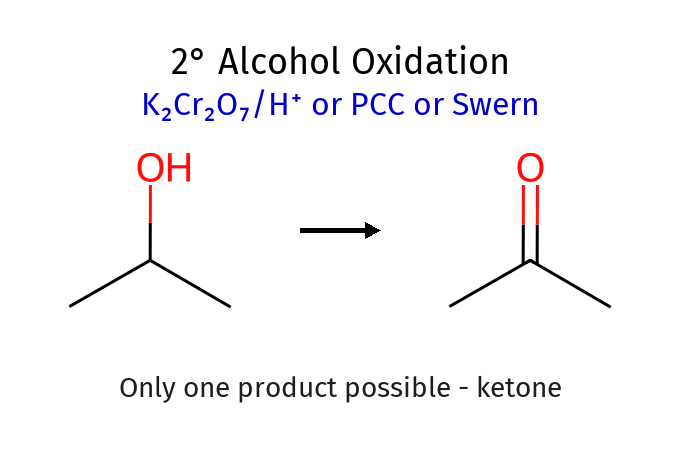
אלכוהול שניוני (יש $\ce{H}$ אחד ← ניתן לחמצון לקטון)
\[\begin{array}{c} \ce{R'} \\ | \\ \ce{R - C - OH} \\ | \\ \textcolor{cyan}{\ce{H}} \end{array}\]- יש H אחד על הפחמן של ה־OH ← גם הוא ניתן לחמצון.
-
אלכוהול שלישוני (אין $\ce{H}$ על הפחמן ← לא ניתן לחמצון רגיל)
\[\begin{array}{c} \ce{R'} \\ | \\ \ce{R - C - OH} \\ | \\ \ce{R''} \end{array}\]- כל הקשרים הם ל־R, אין מימן על הפחמן ← לא ניתן לחמצון רגיל.
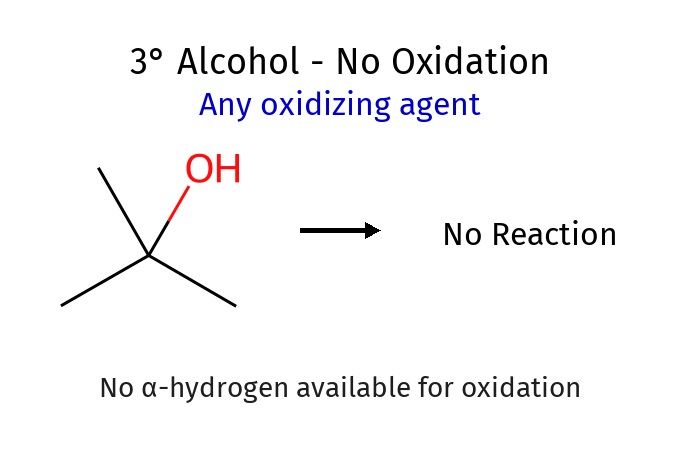
מכאן נובע שאלכוהולים שלישוניים ($\ce{R3C-OH}$) אינם יכולים לעבור חמצון בתנאים רגילים, שכן אין להם מימן זמין על הפחמן הקרבונילי העתידי.
סלקטיביות בחמצון: תלות בסוג האלכוהול
אלכוהולים ראשוניים: דרגות חמצון מרובות
אלכוהולים ראשוניים יכולים לעבור שתי דרגות חמצון:
דרגה ראשונה: חמצון לאלדהיד
\[\ce{R-CH2OH ->[O] R-CHO + H2O}\]דרגה שנייה: חמצון לחומצה קרבוקסילית
\[\ce{R-CHO ->[O] R-COOH}\]הבחירה בין שתי הדרגות תלויה בחומר המחמצן:
PCC (פירידיניום כלורוכרומט): מחמצן עדין שעוצר בשלב האלדהיד
\[\ce{R-CH2OH ->[PCC] R-CHO}\]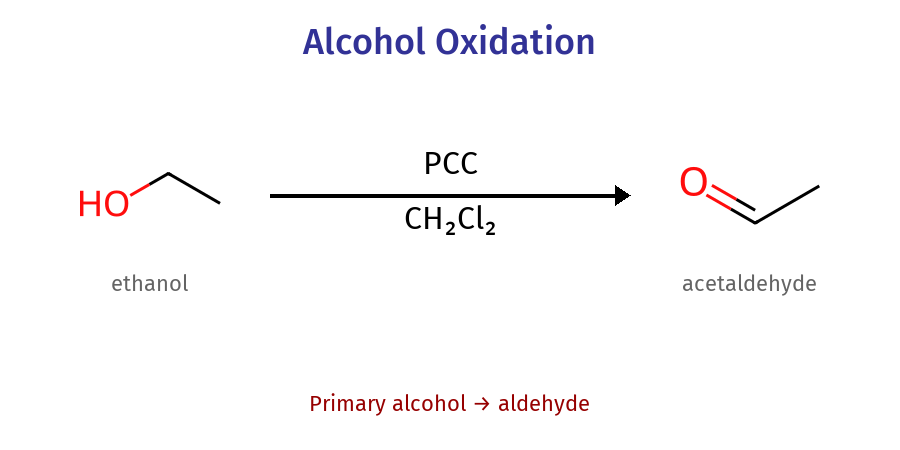
מחמצנים חזקים ($\ce{KMnO4}$, $\ce{K2Cr2O7}$): מובילים ישירות לחומצה קרבוקסילית
\[\ce{R-CH2OH ->[KMnO4] R-COOH}\]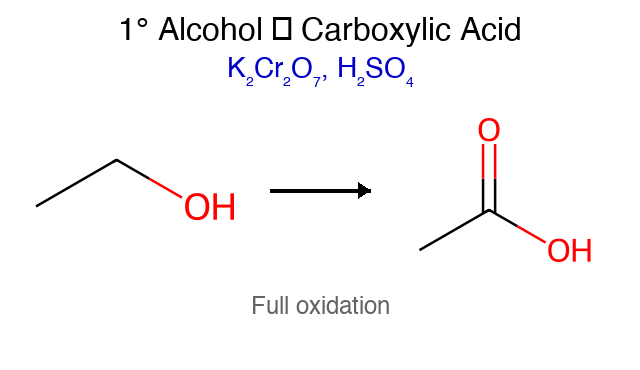
אלכוהולים שניוניים: חמצון חד-שלבי
אלכוהולים שניוניים מתחמצנים תמיד וללא יוצא מן הכלל לקטונים:
\[\ce{R-CH(OH)-R' ->[O] R-CO-R'}\]קטונים מהווים את צורת החמצון המקסימלית של אלכוהולים שניוניים, ואינם יכולים להתחמצן עוד מבלי לשבור קשרים C-C.
מחמצנים ספציפיים ומגבלותיהם
איגרוני התאמה: מחמצן חזק מול מחמצן עדין
בחירת המחמצן חייבת להתחשב בנוכחות קבוצות פונקציונליות נוספות במולקולה:
- אלקנים: רגישים לחמצון על ידי $\ce{KMnO4}$, לכן יש להשתמש במחמצנים חלופיים
- קבוצות ארומטיות: עמידות בפני מרבית המחמצנים הרגילים
- קבוצות רגישות אחרות: דורשות בחירה קפדנית של תנאי התגובה
מחמצנים כרומטיים
מחמצני כרום פועלים דרך מנגנון הכולל יצירת אסטר כרומט כתוצר ביניים:
\[\ce{R2CHOH + HCrO4^- -> R2CH-OCrO3H + H2O}\]לאחר מכן מתרחשת קטיפת $\beta$-הידריד פנימולקולרית היוצרת את הקרבוניל ומפחיתה את הכרום.
שאלות תרגול
שאלה 4: מה יהיה התוצר העיקרי בתהליך הבא
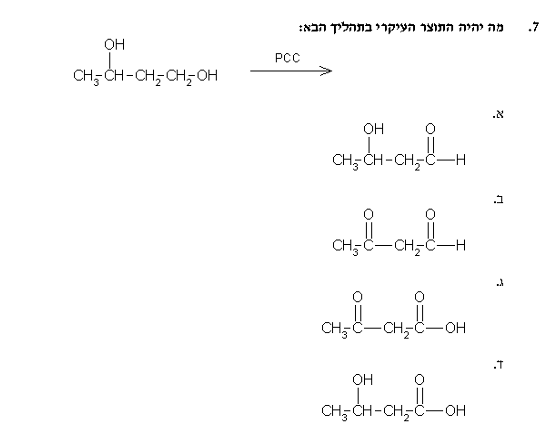
התשובה היא ב.
יש שני כהלים:
- כוהל ראשוני (מצד ימין) - יתחמצן לאלדהיד
- אלכוהול שניוני (על הפחמן השני משמאל) - יתחמצן לקטון
שאלה 5: מה התוצר הסופי העיקרי בתגובה הבאה?
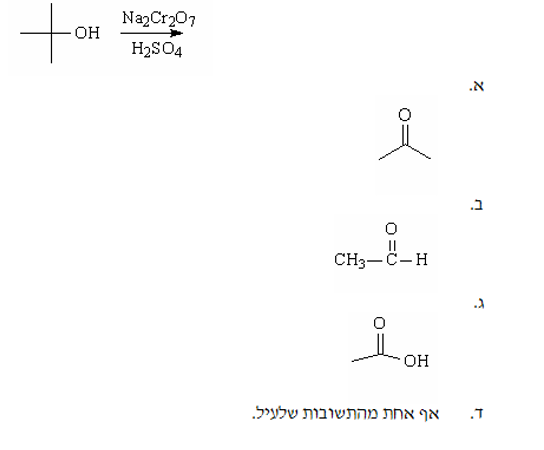
התשובה היא ד - אין תוצר - כוהל שלישוני לא מתחמצן.
שאלה 6: מי מבין הכהלים הבאים יעבור דהידרציה הכי מהר?
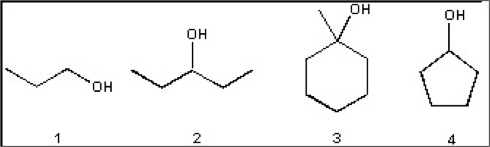
התשובה היא $\mathrm{3}$ - אלכוהול שלישוני.
השאלה למעשה שואלת למי יהיה את הקרבוקטיון הכי יציב - במקרה הזה לכוהל השלישוני.
שאלה 7: הפיכת כהל לאלקיל הליד
באיזה ריאגנט לא ניתן להשתמש בכדי להפוך כהל לאלקיל הליד?
- $\ce{SOCl2}$ (thionyl chloride)
- $\ce{PBr3}$ (phosphorus tribromide)
- $\ce{NaCl}$ (sodium chloride)
- $\ce{HBr}$ (hydrobromic acid)
התשובה היא $\mathrm{3}$ - נתרן כלוריד.
- $\ce{SOCl2}$ מאקטב $\ce{OH}$ להיות כלור - מנגנון $\mathrm{S_N2}$
- $\ce{PBr3}$ מאקטב $\ce{OH}$ להיות ברום - מנגנון $\mathrm{S_N2}$
- $\ce{HBr}$ מאקטב $\ce{OH}$ להיות ברום דרך החומצה ההלוגנית (יצירת קרבוקטיון [הכוהל קוטף פרוטון הופך מים קרבוקטון] והברום תוקף - מנגנון $\mathrm{S_N1}$).
שאלה 8: מה התוצר העיקרי של התגובה הבאה?
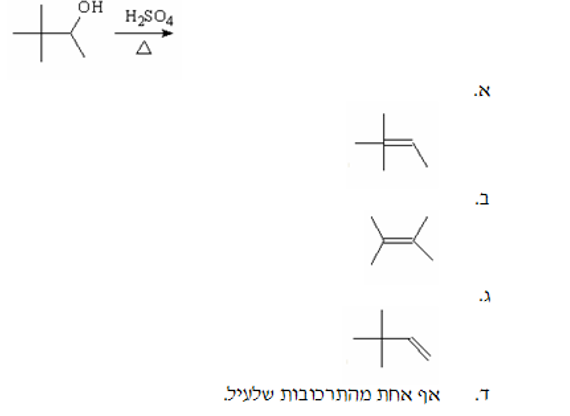
התשובה היא ב.
$\ce{->[H2SO4, \Delta]}$ על כוהל שניוני.
נוצר מים , כוהל עוזב, קרבוקטיון - שחלוף - מעבר מתיל - ליציב יותר - וסגירת הקשר הכפול. מנגנון $\mathrm{E1}$ רגיל.
שאלה 9: ריאגנטים
סמנו את התשובה שבה מופיעים הריאגנטים הנחוצים לסינתזה הבאה בסדר הנכון:
\[\ce{CH2=CH-CH2OH -> CH2=CH-CH2-C#C-CH3}\]
התשובה היא $\mathrm{4}$ - יש לי כוהל ראשוני.
תזכורת: גריניאר תוקף רק קרבונילים ואפוקסידים (לא עושה תגובות $\mathrm{S_N2}$ עם אלקטרופילים אחרים).
אלקין תרמינלי - נוקלאופיל חביב נוסף - קשר משולש שבקצה - $\ce{C#C}$ עם בסיס חזק שיוצר פחמן נוקלאופילי. ייצוב היברידיזציה של יונים.
המטרה היא להוסיף $\ce{c#C-CH3}$ לקצה של הכוהל.
זה $\mathrm{S_N2}$ רגיל - אבל הבעיה שיש $\ce{OH}$ - קבוצה עוזבת גרועה.
גריניאר לא עוזר כי אין כאן קרבוניל.
נתחיל עם $\ce{PBr3}$ או $\ce{SOCl2}$ כדי להפוך את הכוהל לאלקיל הליד, ואז נחבר עם האלקין הטרמינלי. רק בתשובה 4 (עם ה-$\ce{PBr3}$) יש את הריאגנט הנכון גם בלשב השני.
חלק ג׳: יסודות כימיה קרבונילית
מבנה אלקטרוני ותכונות של קבוצת הקרבוניל
היברידיזציה וגיאומטריה מולקולרית
הפחמן הקרבונילי מאופיין בהיברידיזציה $sp^2$, המעניקה לו גיאומטריה מישורית טריגונלית עם זוויות קשר של כ-120°. הקשר C=O מורכב מקשר $\sigma$ (חפיפת אורביטלים $sp^2$) וקשר $\pi$ (חפיפת אורביטלים $p$).
פולריזציה ורזוננס אלקטרוני
הפרש האלקטרו-שליליות הניכר בין פחמן (2.5) לחמצן (3.5) יוצר דיפול משמעותי:
\[\ce{\delta^+ C=O^{\delta^-}}\]מבנה זה יכול להיות מתואר באמצעות שני מבני רזוננס עיקריים:
\[\ce{R2C=O \leftrightarrow R2C^+-O^-}\]המבנה הרזונטיבי השני מדגיש את האופי הקרבוקטיוני של הפחמן הקרבונילי ומסביר את התגובתיות הגבוהה שלו כלפי נוקלאופילים.
גורמים שמשפיעים על תגובתיות קרבונילית
השפעות אלקטרוניות
השפעה אינדוקטיבית: קבוצות דוחפות אלקטרונים (כגון אלקיל) מפחיתות את המטען החיובי החלקי על הפחמן ובכך מפחיתות את האלקטרופיליות. קבוצות מושכות אלקטרונים (כגון הלוגנים) מגבירות את האלקטרופיליות.
השפעה מזומרית (רזוננס): קבוצות עם זוגות אלקטרונים חופשיים (כגון $\ce{OR}$, $\ce{NR2}$) יכולות לתרום צפיפות אלקטרונית לקרבוניל דרך רזוננס, ובכך לפחות את התגובתיות.
השפעות סטריות
הפרעה סטרית: קבוצות גדולות סביב הפחמן הקרבונילי מקשות על גישת נוקלאופילים. זו הסיבה העיקרית לכך שאלדהידים תגובתיים יותר מקטונים.
זווית התקפה: נוקלאופילים תוקפים את הפחמן הקרבונילי בזווית של כ-107° למישור הקרבוניל (זווית בורגי-דונץ), מה שמגדיל את החשיבות של הפרעות סטריות.
השוואה מפורטת: אלדהידים מול קטונים
הבדלי תגובתיות
אלדהידים ($\ce{R-CHO}$) תגובתיים יותר מקטונים ($\ce{R-CO-R’}$) מכמה סיבות:
- הפרעה סטרית מופחתת: המימן באלדהיד הוא הקבוצה הקטנה ביותר האפשרית
- השפעה אלקטרונית: באלדהידים יש רק קבוצה אחת דוחפת אלקטרונים, בעוד שבקטונים יש שתיים
- יציבות התוצר: תוצרי ההתקפה על אלדהידים פחות עמוסים סטרית
השלכות סינתטיות
הבדלי התגובתיות מאפשרים תגובות סלקטיביות. למשל, בנוכחות גם אלדהיד וגם קטון באותה מולקולה, נוקלאופילים יתקפו עדיפית את האלדהיד.
שאלה 1: תגובות של קטונים ואלדהידים
עם איזה ריאגנטים נבצע את התגובה הבאה?
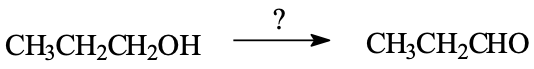
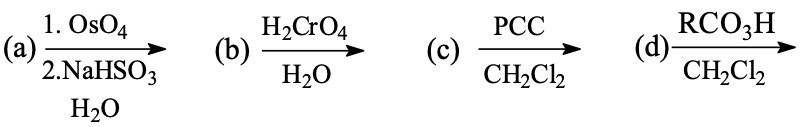
התשובה היא $\mathrm{C}$ - כוהל ראשוני שהפך לאלדהיד חייב להיות $\ce{PCC}$.
חלק ד’: מנגנונים בסיסיים של התקפה נוקלאופילית
התקפה נוקלאופילית בסביבה בסיסית
המנגנון הכללי
בסביבה בסיסית, נוקלאופילים חזקים (בעלי מטען שלילי או זוגות אלקטרונים זמינים) תוקפים ישירות את הפחמן הקרבונילי:
שלב 1: התקפה נוקלאופילית
\[\ce{Nu^- + R2C=O -> R2C(Nu)-O^-}\]האלקטרונים מהקשר $\pi$ עוברים לחמצן, ויוצרים אלקוקסיד יציב.
שלב 2: פרוטונציה
\[\ce{R2C(Nu)-O^- ->[H^+] R2C(Nu)-OH}\]הפרוטונציה מתרחשת בדרך כלל במהלך “עבודת התגובה” (work-up) עם מים או עם חומצה חלשה.
נוקלאופילים חזקים נפוצים
ראגנט גריניאר ($\ce{R-MgX}$): נוקלאופילים פחמניים חזקים המאפשרים הארכת שלד הפחמן
הידרידים ($\ce{H^-}$ מ-$\ce{NaBH4}$ או $\ce{LiAlH4}$): מובילים להפחתה לאלכוהולים
אלקינים טרמינליים (לאחר דה-פרוטונציה): מאפשרים יצירת אלכוהולים פרופרגיליים
התקפה נוקלאופילית בסביבה חומצית
הצורך בהפעלה חומצית
בסביבה חומצית, הקרבוניל עובר תחילה פרוטונציה על החמצן, מה שמגביר באופן דרמטי את האלקטרופיליות של הפחמן:
\[\ce{R2C=O + H^+ -> R2C=OH^+}\]הפרוטונציה יוצרת מטען חיובי פורמלי על החמצן, והמבנה הרזונטיבי מציג מטען חיובי מלא על הפחמן:
\[\ce{R2C=OH^+ \leftrightarrow R2C^+-OH}\]נוקלאופילים חלשים
הפעלה חומצית מאפשרת לנוקלאופילים חלשים (ניטרליים) לתקוף ביעילות:
- מים: מובילים להידראטים (לא יציבים)
- אלכוהולים: מובילים לקבוצות אצטל (Acetal)
- אָמינים: מובילים לאימינים ואֵנָמִינים
שאלה 1
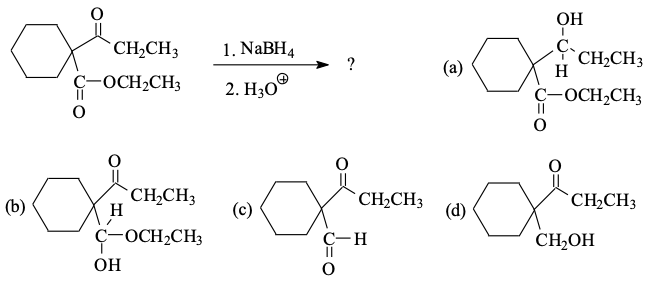
התשובה היא $\mathrm{A}$ - $\ce{NaBH4}$ לא תוקף אסתרים (הקבוצה התחתונה), במקרה הזה רק קבוצת הקרבוניל העליונה תהפוך לאלכוהול (חיזור).
שאלה 2
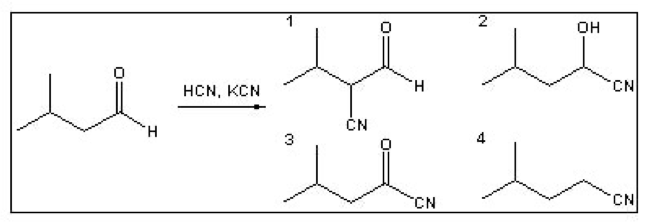
התשובה היא $\mathrm{2}$ - $\ce{HCN}$ מחזר את האלדהיד לאלכוהול עם ציאניד.
שאלה 3
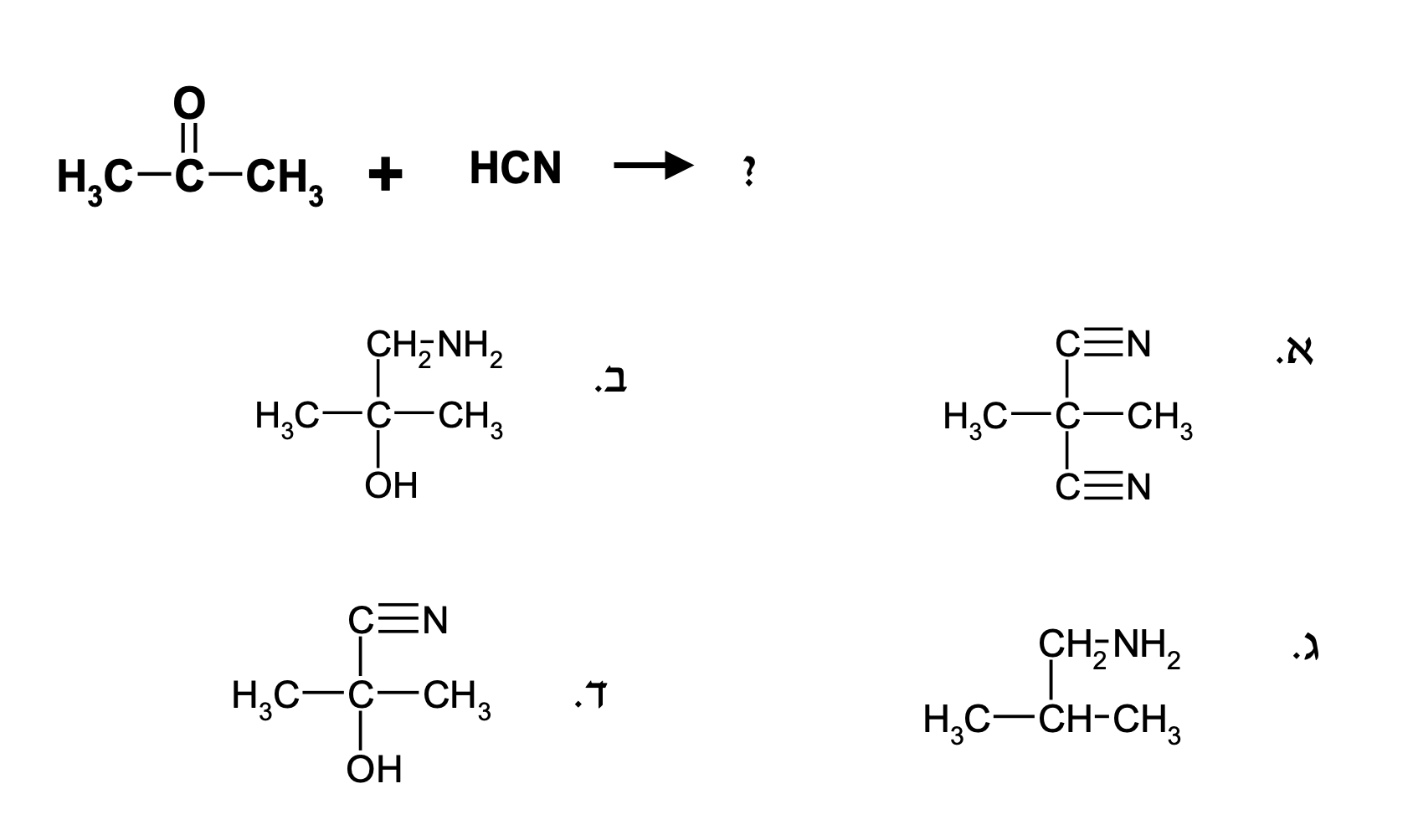
התשובה היא $\mathrm{4}$ - אותו עקרון.
תגובות עם מים: היווצרות הידראטים
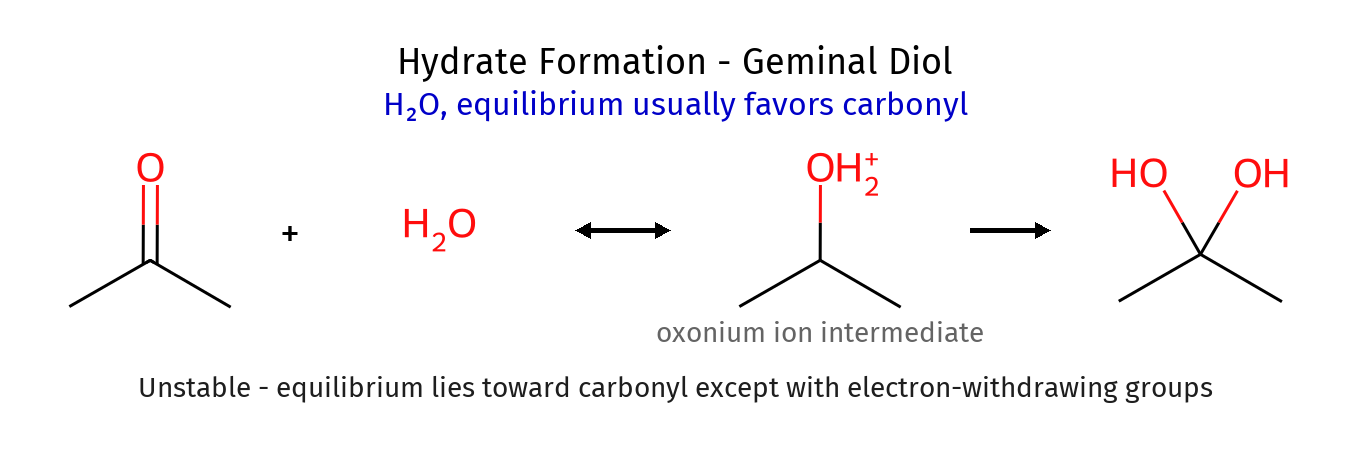
המנגנון והיציבות
מים יכולים לתקוף קרבונילים ליצירת הידראטים (דיאולים ג׳מינליים):
\[\ce{R2C=O + H2O \rightleftharpoons R2C(OH)2}\]ברוב המקרים, שיווי משקל נוח בכבדות לכיוון הקרבוניל החופשי, בשל:
- האנטרופיה החיובית של פירוק (מולקולה אחת הופכת לשתיים)
- עדיפות אנרגטית של הקשר $\pi$ החזק בקרבוניל
יוצאי דופן: הידראטים יציבים
מקרים נדירים בהם הידראטים יציבים כוללים:
- פורמלדהיד בתמיסה מימית: שיווי המשקל נוח להידראט
- קרבונילים עם קבוצות מושכות אלקטרונים חזקות: מייצבות את ההידראט
חלק ה’: כימיה מתקדמת של אצטלים
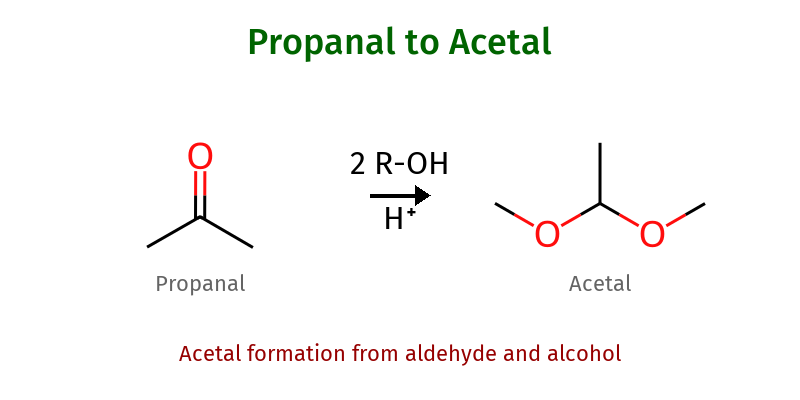
יצירת אצטלים: מנגנון מפורט
השלבים המכניסטיים
יצירת אצטלים היא תהליך רב-שלבי המתרחש בקטליזה חומצית:
שלב 1: הפעלה חומצית של הקרבוניל
\[\ce{R2C=O + H^+ \rightleftharpoons R2C=OH^+}\]שלב 2: התקפה נוקלאופילית של האלכוהול הראשון
\[\ce{R2C=OH^+ + R'OH \rightleftharpoons R2C(OR')-OH2^+}\]שלב 3: דה-פרוטונציה ליצירת המי-אצטל
\[\ce{R2C(OR')-OH2^+ \rightleftharpoons R2C(OR')-OH + H^+}\]המי-אצטל הוא תוצר ביניים לא יציב הממשיך להגיב:
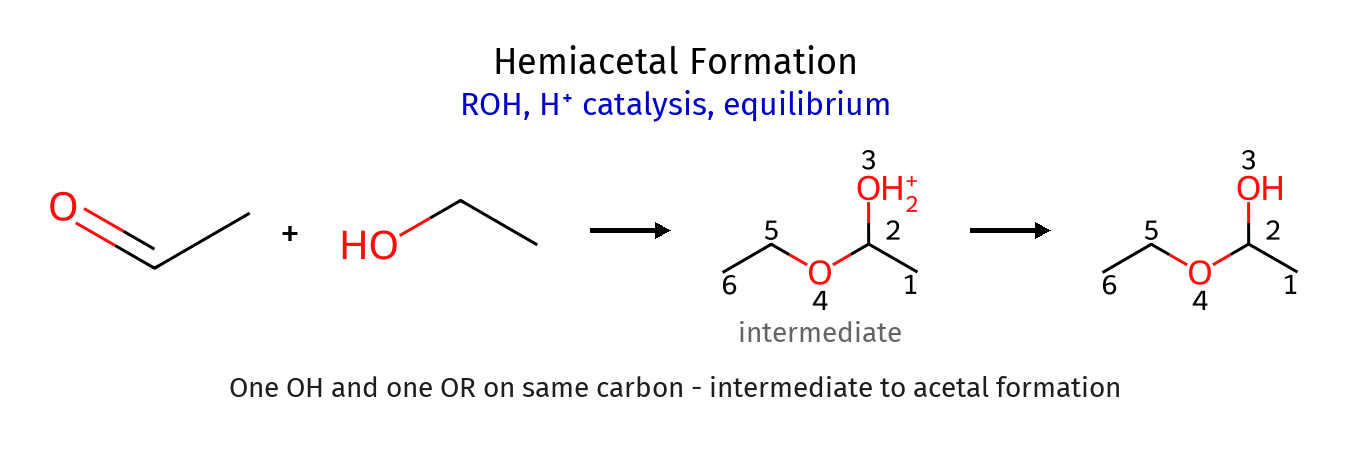
שלב 4: הפעלה של קבוצת ההידרוקסיל
\[\ce{R2C(OR')-OH + H^+ \rightleftharpoons R2C(OR')-OH2^+}\]שלב 5: יציאת מים ויצירת קרבוקטיון מיוצב
\[\ce{R2C(OR')-OH2^+ \rightleftharpoons R2C^+(OR') + H2O}\]הקרבוקטיון מיוצב על ידי תרומת צפיפות אלקטרונית מהחמצן (רזוננס).
שלב 6: התקפה של מולקולת אלכוהול שנייה
\[\ce{R2C^+(OR') + R'OH \rightleftharpoons R2C(OR')2H^+}\]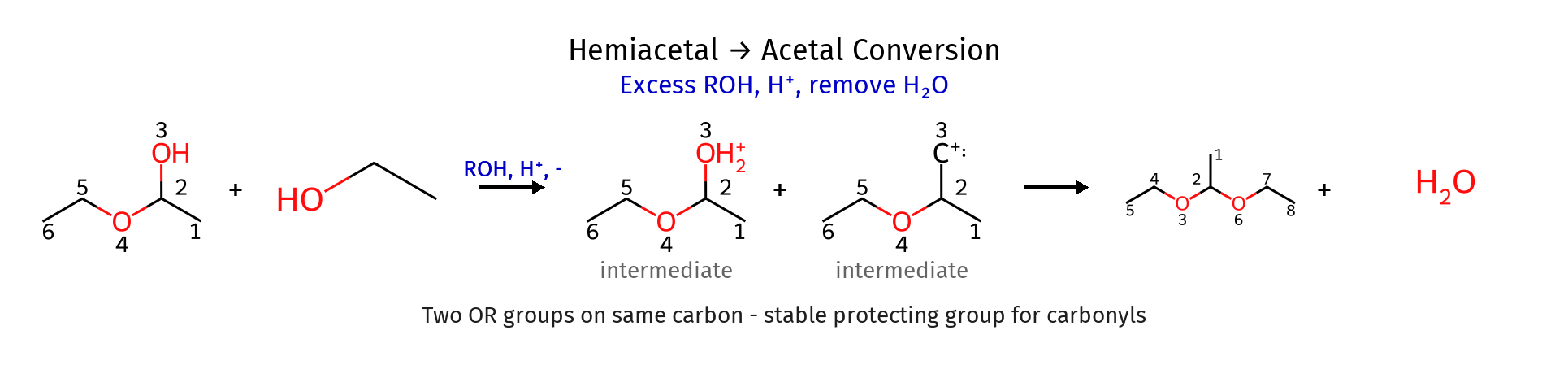
שלב 7: דה-פרוטונציה ליצירת האצטל
\[\ce{R2C(OR')2H^+ \rightleftharpoons R2C(OR')2 + H^+}\]גורמים תרמודינמיים וקינטיים
עקרון לה-שאטלייה: מכיוון שהתגובה מייצרת מים, הסרתם (באמצעות חומר מייבש או זיקוק אזאוטרופי) דוחפת את שיווי המשקל לכיוון היווצרות האצטל.
עודף אלכוהול: שימוש בעודף גדול של האלכוהול מגביר את הריכוז האפקטיבי ודוחף את התגובה קדימה.
אצטלים ציקליים: יתרונות קינטיים ותרמודינמיים
אתילן גליקול כרגנט מועדף
שימוש באתילן גליקול ($\ce{HOCH2CH2OH}$) במקום שני מולקולות אלכוהול נפרדות מוביל ליתרונות משמעותיים:
\[\ce{R2C=O + HOCH2CH2OH ->[H^+] R2C<[O-CH2][O-CH2]> + H2O}\]יתרונות:
- קינטיים: ההתקפה השנייה היא תוך-מולקולרית, לכן מהירה יותר משמעותית
- תרמודינמיים: מיוצב על ידי עלויות אנטרופיה נמוכות יותר
- סינתטיים: קל יותר לטיהור ובידוד
אצטלים ציקליים כקבוצות הגנה מתקדמות
אצטלים ציקליים מהווים קבוצות הגנה מצוינות לקרבונילים בשל:
- יציבות גבוהה בפני בסיסים חזקים
- יציבות בפני נוקלאופילים
- יציבות בפני חומרי חימצון והפחתה
- הסרה סלקטיבית בתנאים חומציים מימיים
היישומים הסינתטיים של כימיית אצטלים
הגנה סלקטיבית בסינתזה מרובת שלבים
דוגמה לשימוש בקבוצת הגנה:
- הפיכת קטון לאצטל (הגנה)
- ביצוע תגובה רגישה על חלק אחר במולקולה
- הסרת ההגנה והחזרה לקטון המקורי
אצטלים מרכיבים אחרים
תיואצטלים: שימוש בדי-תיולים במקום דיאולים מוביל לתיואצטלים ($\ce{R2C(=S)R’}$, שרגישים להסרה על ידי מתכות כבדות או חומרי חימצון עדינים.
חלק ו’: כימיה של נגזרי חנקן
תגובות עם אָמינים: יצירת אימינים (Imine)
מנגנון יצירת אימינים
תגובה בין קרבונילים לאָמינים ראשוניים או אמוניה מוביל ליצירת אימינים:
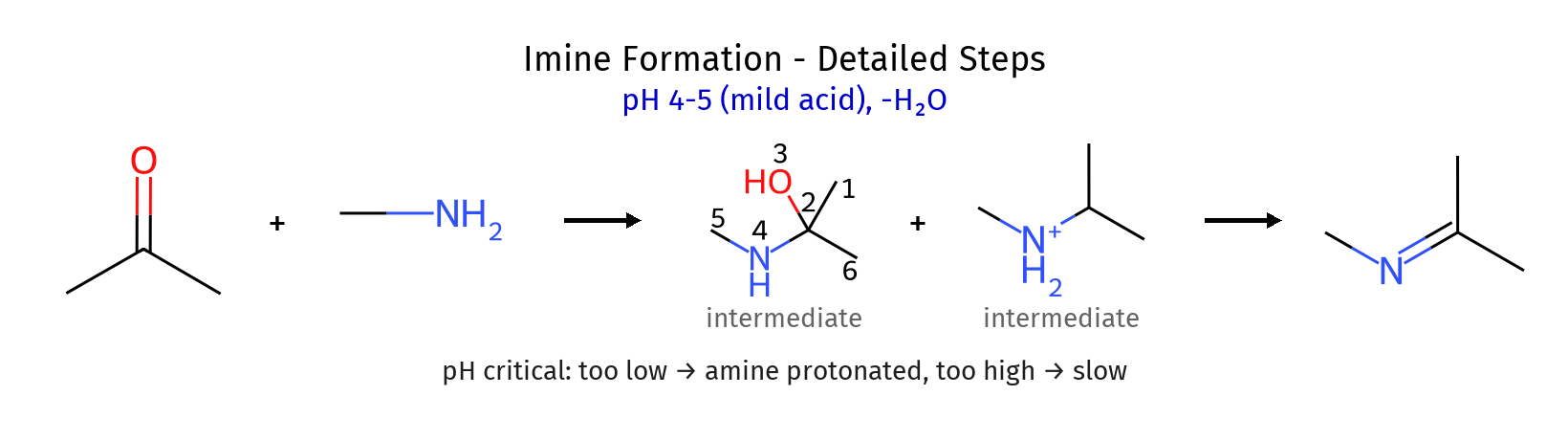
שלבים 3-1: התקפה ויצירת קרבינולאמין
\[\ce{R2C=O ->[H^+] R2C=OH^+}\] \[\ce{R2C=OH^+ + R'NH2 \rightleftharpoons R2C(NHR')-OH2^+}\] \[\ce{R2C(NHR')-OH2^+ \rightleftharpoons R2C(NHR')-OH + H^+}\]הקרבינולאמין הוא תוצר ביניים לא יציב.
שלבים 6-4: הסרת מים ויצירת אימין
\[\ce{R2C(NHR')-OH ->[H^+] R2C(NHR')-OH2^+}\] \[\ce{R2C(NHR')-OH2^+ \rightleftharpoons R2C^+(NHR') + H2O}\]הקרבוקטיון מיוצב על ידי תרומת צפיפות אלקטרונית מהחנקן.
\[\ce{R2C^+(NHR') ->[- H^+] R2C=NR'}\]התוצר הסופי: אימין עם קשר כפול $\ce{C=N}$.
אימינים: תכונות ושימושים
- יציבות: אימינים יציבים יחסית אך רגישים להידרוליזה חומצית
- תגובתיות: הפחמן הקשור לחנקן בקשר כפול הוא אלקטרופילי
- שימושים סינתטיים: אימינים יכולים לעבור הפחתה לאָמינים (למשל בעזרת $\ce{H2/Pd}$), או לשמש כנוקלאופילים לאחר דה-פרוטונציה
אֵנָמִינים: מנגנון וחשיבות סינתטית (Enamine)
מנגנון יצירת אֵנָמִינים
כאשר אמין שניוני מגיב עם קרבוניל, התהליך דומה בתחילתו ליצירת אימין, אך בהיעדר מימן על החנקן לקטיפה, המנגנון ממשיך בדרך שונה:
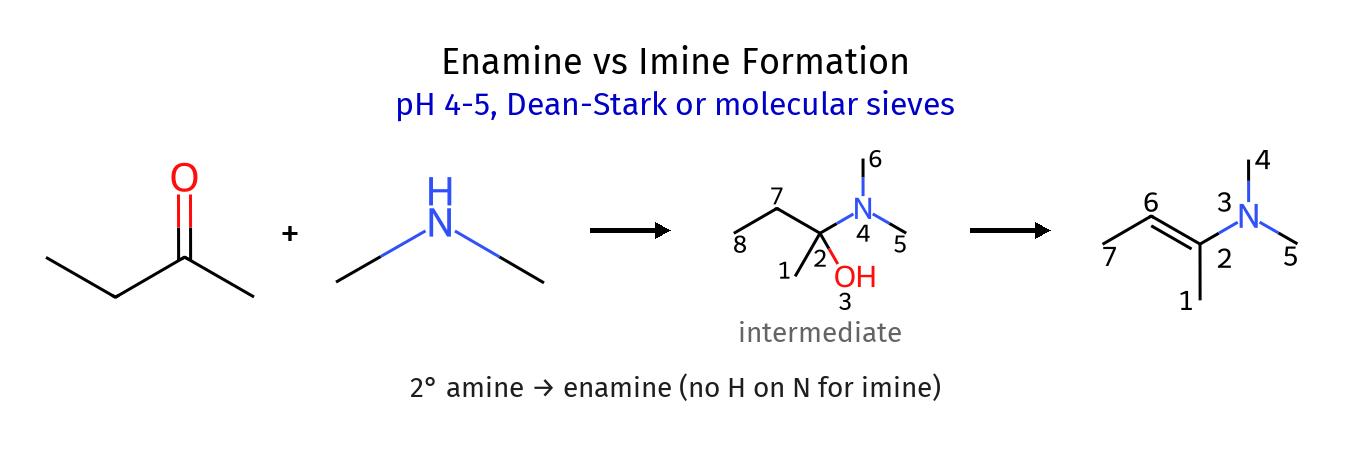
לאחר יצירת הקרבוקטיון המיוצב על ידי החנקן:
\[\ce{R2C^+(NR'2) ->[- H^+] R2C=CHR'' + NR'2}\]במקום קטיפת מימן מהחנקן, מתרחשת קטיפת פרוטון מפחמן $\alpha$ (ליד החנקן המקורי), ויצירת קשר כפול $\ce{C=C}$.
תכונות ושימושים של אֵנָמִינים
- מבנה: אֵנָמִין מאופיין בקשר כפול $\ce{C=C}$ עם קבוצת אמין מחוברת
- תגובתיות: הפחמן $\beta$ לחנקן הוא נוקלאופילי בשל התרומה האלקטרונית מהחנקן
- שימושים: אֵנָמִינים משמשים כנוקלאופילים במגוון תגובות היווצרות קשר C-C
גורמים המשפיעים על יצירת אימינים ואֵנָמִינים
השפעת pH
- pH נמוך מדי: האמין נמצא בצורה פרוטונטת ואינו נוקלאופילי
- pH גבוה מדי: הקרבוניל אינו מופעל מספיק להתקפה
- pH אופטימלי: בדרך כלל סביב 5-4, המאפשר איזון בין הפעלת הקרבוניל לבין נוקלאופיליות האמין
השפעות סטריות ואלקטרוניות
- קבוצות גדולות על החנקן: מקשות על ההתקפה הראשונית
- קבוצות מושכות אלקטרונים על החנקן: מפחיתות נוקלאופיליות
- קבוצות דוחפות אלקטרונים על החנקן: מגבירות נוקלאופיליות אך עלולות לייצב יתר על המידה את תוצרי הביניים
שאלות תרגול - אימינים ואֵנָמִינים
שאלה 1: מה התוצר העיקרי של התגובה הבאה?
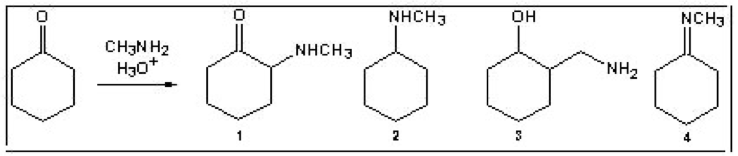
התשובה היא $\mathrm{4}$: אמין ראשוני על קרבוניל נותן אימין (קשר כפול C=N).
שאלה 2: הצע מנגנון לתגובה הבאה
קודם נוסיף אלכוהול
אחר כך נשים אמין ראשוני.
שאלה 3: מה התוצר הסופי של התגובה הבאה?
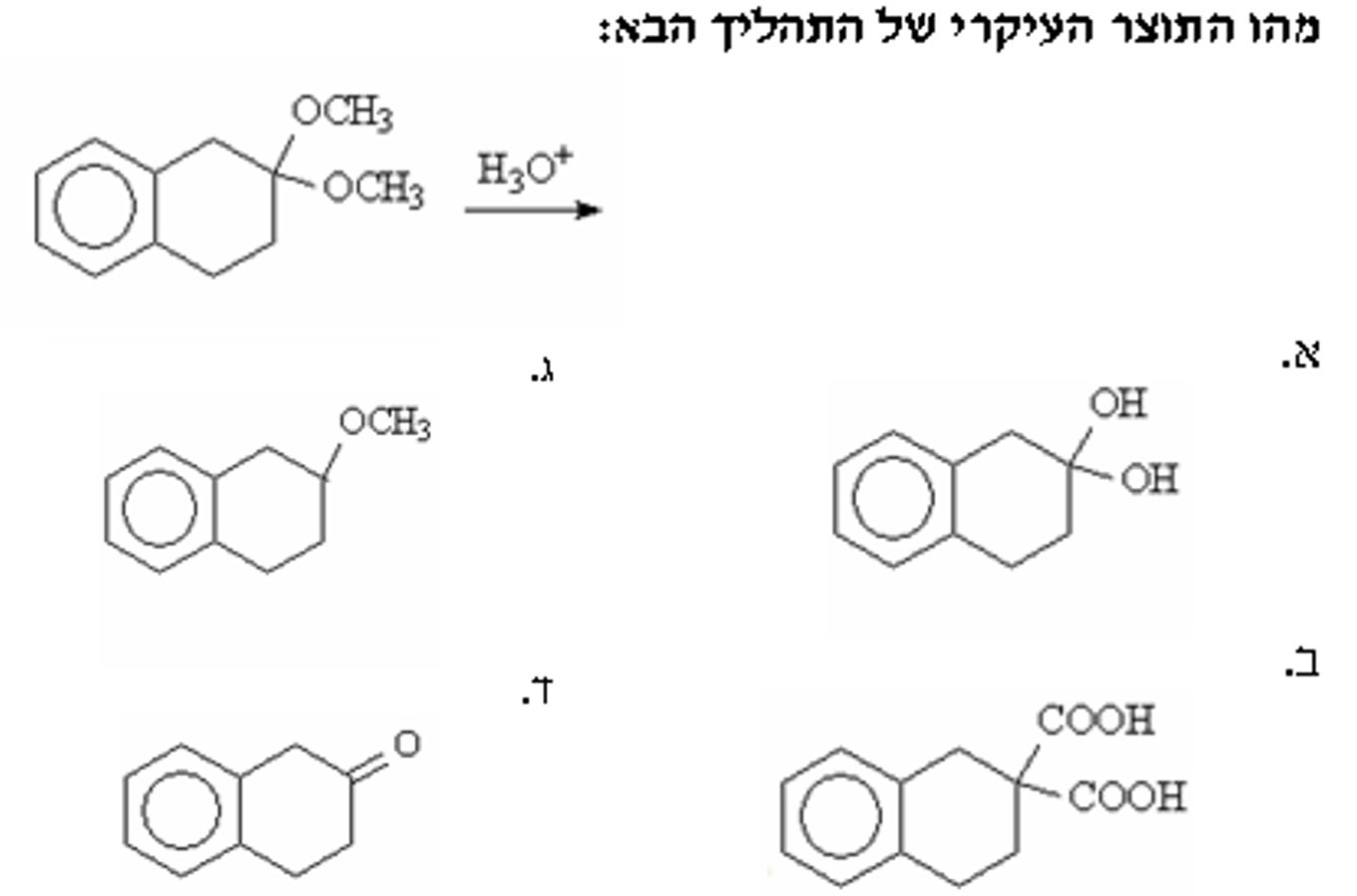
אצטל בקטליזה חומצית ($\ce{H3O^+}$) מתפרק בחזרה לאלדהיד ואלכוהול.
הפחמן שהיה הפחמן הקבונילי הוא זה שמחוברות אליו קבוצות ה-$\ce{OR}$.
התשובה היא $\mathrm{4}$.
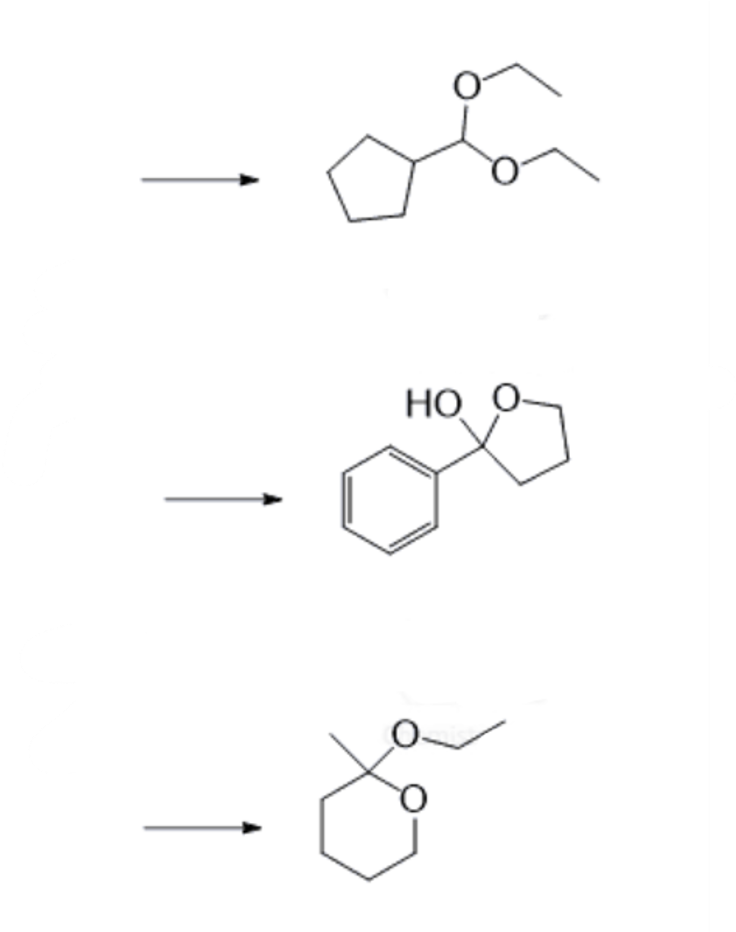
שאלה 4: מה המגיבים שנתנו כל אחד מהחומרים הבאים?
שאלה 5: הצע סינתזה לתגובה הבאה?
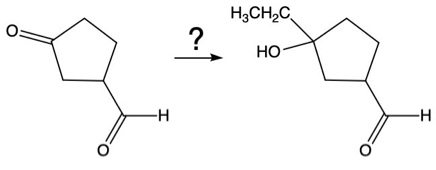
שאלה 6: מה התוצרים של התגובה הבאה?
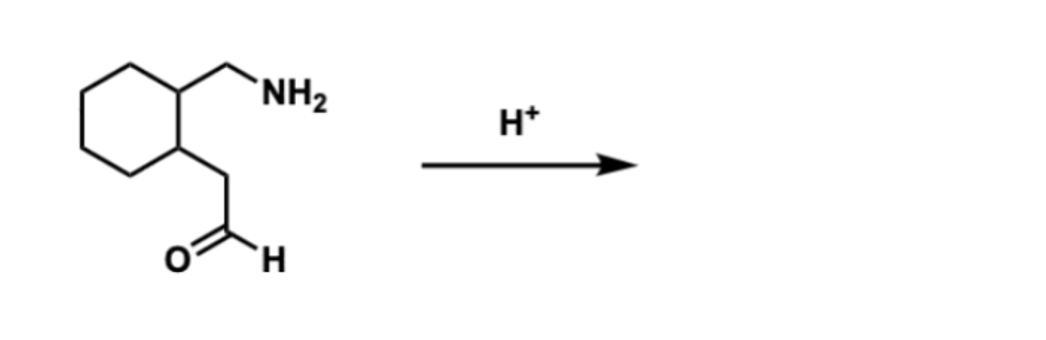
שאלה 7: מה התוצרים של התגובה הבאה?
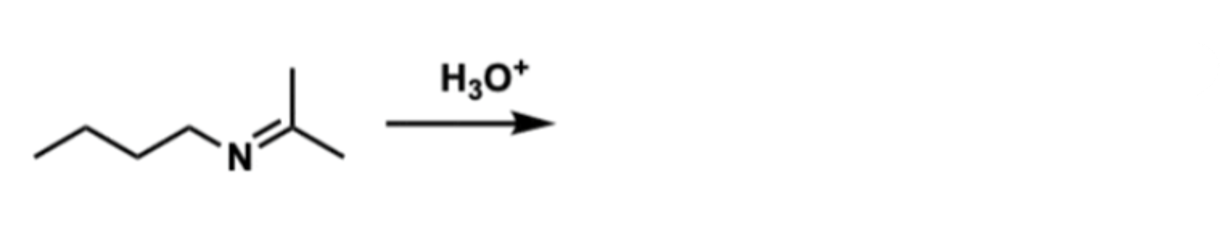
שאלה 8: מה התוצרים של התגובה הבאה?
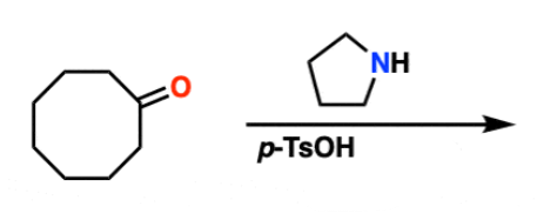
שאלה 9: הצע סינתזה לתגובה הבאה
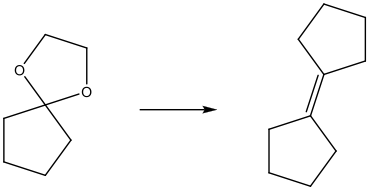
שאלה 10: הצע סינתזה לתגובה הבאה

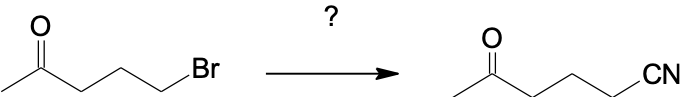
שאלה 11: הצע סינתזה לתגובה הבאה
 \[\begin{array}{ccc} & \text{Hydrate} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{OH}}} \quad \underset{\diagup \quad}{\textcolor{red}{\ce{OH}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\]
\[\begin{array}{ccc} & \text{Hydrate} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{OH}}} \quad \underset{\diagup \quad}{\textcolor{red}{\ce{OH}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\] \[\begin{array}{ccc} & \text{Hemiacetal} & \\[6pt] & \underset{ \vert}{\textcolor{black}{\ce{R}}} \quad \quad \quad \underset{ }{\textcolor{black}{\ce{}}} & \\[-6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{O}}} \quad \underset{\diagup \quad}{\textcolor{red}{\ce{OH}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\]
\[\begin{array}{ccc} & \text{Acetal} & \\[6pt] & \underset{ \vert}{\textcolor{black}{\ce{R}}} \quad \quad \quad \underset{ \vert}{\textcolor{black}{\ce{R}}} & \\[-6pt] & \underset{\quad \diagdown}{\textcolor{red}{\ce{O}}} \quad \quad \underset{\diagup \quad}{\textcolor{red}{\ce{O}}} & \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R}} \quad \quad \overset{\diagdown \quad}{\ce{R}} & \\[-6pt] \end{array}\]
לא יצא לי הכי מדויק:
\[\begin{array}{ccc} & \text{Enamine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{black}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt] & \textcolor{blue}{\ce{N}} & \\[-6pt] & \vert \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup \hspace{-0.1em} \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt] \end{array}\] \[\begin{array}{ccc}& \text{Enamine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{cyan}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt]& \textcolor{blue}{\ce{N}} & \\[-6pt]& \vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup \hspace{-0.3em} \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\]\[\begin{array}{ccc} & \text{Emine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{cyan}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt] & \textcolor{blue}{\ce{N}} & \\[-6pt] & \vert \vert \\[-6pt] & \ce{C} & \\[-6pt] & \overset{\quad \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt] \end{array}\]
\[\begin{array}{ccc} & 1^\circ \text{Amine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{black}{\ce{R}}} \quad \underset{ \quad}{\textcolor{red}{\ce{}}} & \\[-6pt] & \textcolor{blue}{\ce{NH2}} & \\ \end{array}\]
\[\begin{array}{ccc} & 2^\circ \text{Amine} & \\[6pt] & \underset{\quad \diagdown}{\textcolor{black}{\ce{R}}} \quad \underset{ \diagup \quad }{\textcolor{black}{\ce{R}}} & \\[-6pt] & \textcolor{blue}{\ce{NH}} & \\ \end{array}\] דור פסקל