למי מהמולקולות הבאות הגיאומטריה המולקולרית אינה לינארית?
- $\text{BeH}_2$
- $\text{SO}_2$
- $\text{CS}_2$
- $\text{C}_2\text{H}_2$
התשובה היא 2 - כי זה מבנה משולש.
מבני לואיס:
\[\boxed{\text{H} - \text{Be} - \text{H}}\]נבנה בשלבים את של $\text{SO}_2$:
יש לנו 16 אלקטרוני ערכיות. $\text{O}$ במרכז כי יותר אלקטרונגטיבי. נבנה שלד וקשרים קוולנטיים יחידים:
\[\text{O} - \text{S} - \text{O}\]נותרו לנו $18-4=14$ אלקרטרונים למקם. נתחיל מהשלמת אוקטטים לקצוות:
\[\text{:O} - \text{S} - \text{O:}\]נותרו עוד 10. נמשיך:
\[:\underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}} - \text{S} - \underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}}:\]נותרו עוד 2. נוסיף לאטום המרכזי:
\[:\underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}} - \overset{\cdot\cdot}{\text{S}} - \underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}}:\]האטום המרכזי נותר ללא אוקטט, נשתמש באלקטרונים הבלתי קושרים של החמצן ליצירת קשרים כפולים:
\[\boxed{\underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}} = \overset{\cdot\cdot}{\text{S}} - \underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}}:}\]תשומת הלב שזו מולקולת רזוננס - אפשרות אחרת תהיה:
\[\boxed{:\underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}} - \overset{\cdot\cdot}{\text{S}} = \underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{O}}}}\]נמשיך לתרגול עם $\text{CS}_2$: יש לי $4+6\times 2 = 16$ אלקרטרונים למלא. אתום הפחמן יהיה במרכז.
\[\text{S} - \text{C} - \text{S}\]כעת נפזר עוד 12 אלקטרונים:
\[:\underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{S}}} - \text{C} - \underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{S}}}:\]האטום המרכזי נותר ללא אוקטט, ניצור קשרים כפולים:
\[\boxed{\underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{S}}} = \text{C} = \underset{\cdot\cdot}{\overset{\cdot\cdot}{\text{S}}}}\]במולקולה $\text{C}_2\text{H}_2$ יש 10 אלקרטוני ערכיות. הפחמנים יהיו במרכז והמימנים בקצוות. נקבל בתור שלד ראשוני:
\[\text{H} - \text{C} - \text{C} - \text{H}\]נפז עוד 4 אלקטרונים. הליום מסתפק ב-2 ולא באוקטט, לכן נוכל לשים אותם במרכזי באופן שישלים אוקטט:
\[\boxed{\text{H} - \text{C} \equiv \text{C} - \text{H}}\]מהן ההכלאות של האטומים המסומנים במולקולה הנתונה?
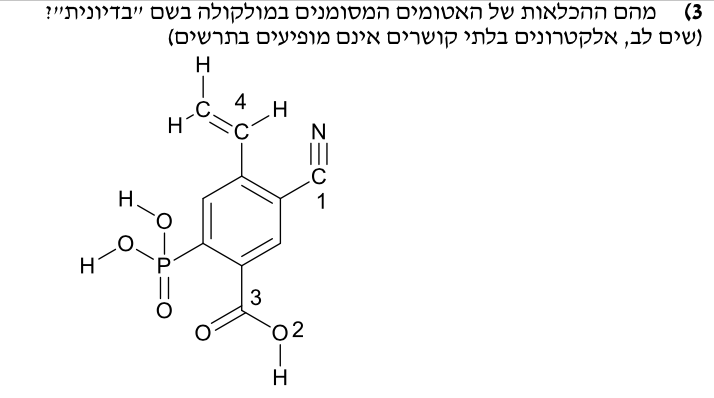 \[-\text{C}\equiv \text{N}\]
\[-\text{C}\equiv \text{N}\] הנוטציה לפי $VSEPR$ היא $\text{AX}_2$, ולכן ההיברידיזציה חייבת להיות מסוג $\boxed{sp}$.
\[-\text{O} - \text{H}\]אפשר לראות שיש שני זוגות של אלקטרונים בלתי קושרים. זה בעצם כמו מים. הנוטציה תהיה $\text{AX}_2\text{E}_2$, ולכן ההיברידיזציה תהיה מסוג $\boxed{sp^3}$
\[-\underset{\text{|}}{\text{C}} = O \\\]אין לי אלקטרונים בלתי קושרים, והאטום המרכזי מחובר לשלושה אלקטרונים. מכאן שמדובר ב $\text{AX}_3$, ולכן ההיברידיזציה תהיה מסוג $\boxed{sp^2}$.
המקרה הרביעי אותו הדבר, סך הכל נקבל:
\[sp, \, sp^3, \, sp^2, \, sp^2\]מה תפקיד הקטליזטור בריאקציה כימית?
להוריד את אנרגיית האקטיבציה של התגובה.
נתון היון $\text{NO}_2^{-1}$ מה ההיברידיזציה על האטום המרכזי חנקן?
נתחיל ממבנה לואיס.
סך הכל אלקטרונים חופשיים - 18
מבנה לואיס יראה כך:
\[\begin{array}{c} \overset{\cdot\cdot}{\underset{\cdot\cdot}{\text{:O}}}^{-} - \overset{\cdot\cdot}{\text{N}} = \overset{\cdot\cdot}{\text{O:}} \quad \leftrightarrow \quad \overset{\cdot\cdot}{\text{:O}} = \overset{\cdot\cdot}{\text{N}} - \overset{\cdot\cdot}{\underset{\cdot\cdot}{\text{O:}}}^{-} \end{array}\]הנוטרציה של המולקולה לפי מודל $\text{VSEPR}$ היא $\text{AX}_2\text{E}_1$ ולכן ההיברידיזציה מסוג $\boxed{sp^2}$
תלמיד רפואה נדרש להכין תמיסת $NaCl$ בריכוז של $1\text{M}$, אך הוא טעה והכין תמיסה בריכוז של 1m (מולל) האם טעות התלמיד סיכנה את חיי החולה?
1 ליטר של מים זה 1000 קילוגרם.
אותו דבר
8. נתונה התגובה הבאה בשיווי משקל
\[2 \text{ICl}_{\text(s)} \rightarrow \text{I}_{\text(s)} + \text{Cl}_{\text(g)}\]איזה מהשינויים הבאים יגדיל את הכמות הכוללת של גז הכלור Cl2 שניתן להפיק?
- הוספה של $\text{I}_{\text{2(s)}}$ מכלי התגובה
- הקטנת נפח הכלי שבו מתרחשת התגובה
- הרחקה של הגז $\text{Cl}_{\text{2(g)}}$ מכלי התגובה
- הרחקה של $\text{ICl}_{\text{(s)}}$ מכלי התגובה
9. דוגמה של גז תופסת נפח של 2.5 ליטר בטמפרטורה של $25^{\circ}C$ אם מגדילים את הטמפרטורה של הכלי ל50 מעלות צלזיוס תוך שמירה על לחץ קבוע בכלי, מה הנפח החדש של הכלי?
- $2.7 \text{L}$
- $5 \text{L}$
- $3 \text{L}$
- $7.5 \text{L}$
החוק הרלוונטי זה חוק צ׳ארלס:
\[\frac{V_1}{T_1} = \frac{V_2}{T_2}\]נציב ונקבל $2.7 \text{L}$. אפשר גם בעזרת $\text{PV} = \text{nRT}$.
בואו נפתור את זה שלב אחר שלב באמצעות חוק שארל (Charles’s Law):
1) חוק שארל קובע שבלחץ קבוע, היחס בין הנפח לטמפרטורה המוחלטת (בקלווין) הוא קבוע: $\frac{V_1}{T_1} = \frac{V_2}{T_2}$
2) נמיר את הטמפרטורות לקלווין:
- $T_1 = 25°C + 273 = 298K$
- $T_2 = 50°C + 273 = 323K$
3) נציב בנוסחה:
- $\frac{2.5L}{298K} = \frac{V_2}{323K}$
4) נחלץ את $V_2$:
- $V_2 = \frac{2.5L \times 323K}{298K}$
- $V_2 = 2.71L$
5) בדיקת התשובות:
- התשובה הקרובה ביותר היא $2.7L$
התשובה הנכונה היא 1: $2.7L$
לא לשכוח לעבור ליחידות של קלווין.
10. לאיזה מהתהליכים הבאים אנתרופיה מקסימלית?
- המסה של גוש קרח למים בחלל בריכה של $27 \text{m}^3$
- יצירת גביש מלח בתמיסת מים בחלל בריכה בנפח $27 \text{m}^3$
- התפשטות של מול אחד של גז בלחץ גובה לחלל החדר בנפח $27 \text{m}^3$
- התפשטות של שני מול של גז בלחץ גובה לחלל חדר בנפח של $27 \text{m}^3$
התשובה היא ד.
שאלות פתוחות
הוראות
בחרו 3 מתוך 5 שאלות פתוחות לפתרון. כל שאלה שווה 20 נקודות.
שאלה 2 - תהליך שריפה
הערה - שאלה זו נמצאת במאגר השאלות למבחן.
תרכובת מכילה את היסודות $\text{C, H, Cl, O}$ בלבד. בכדי לגלות את הרכבה בוצעו מספר מדידות. בניסוי הראשון שרפו 40.10 גרם של התרכובת והתקבלו 58.57 גרם $\text{CO}_2$ ו 14.98 גרם $\text{H}_2\text{O}$. דוגמא אחרת של התרכובת במשקל של 75.00 גרם נבדקה ונמצאה שהיא מכילה 22.06 גרם של היסוד $\text{Cl}$. בניסוי נוסף 7.20 גרם של התרכובת הוכנסו לכלי בנפח 1.5 ליטר בטמפרטורה של $0^{\circ}\text{C}$ והלחץ הנמדד בכלי היה $0.298 \text{ atm}$ - יש להניח שכל הדוגמא עברה לפאזה הגזית.
- חשבו את הנוסחה המולקולרית של התרכובת
פתרון שאלה 2
בשלב הראשון של תהליך השרפה נמצא את $x$ ו$y$:
\[\underbrace{\text{C}_x\text{H}_y\text{Cl}_z\text{O}_w}_{40.1 \text{g}} + \text{O}_2 \rightarrow \underbrace{\text{H}_2\text{O}}_{14.98 \text{g}} + \underbrace{\text{CO}_2}_{58.57 \text{g}}\]מספר המולים של מים שהתקבל הוא:
\[\begin{aligned} \frac{14.98 \text{ gr}}{18 \text{gr/mol}} &= \boxed{0.832 \text{ mol H}_2\text{O}} \\ &\Rightarrow 0.832 \times 2 = \boxed{1.66 \text{ mol H}} \\ &\Rightarrow \boxed{ 1.6 \text{ gr H}} \end{aligned}\]נמצא באופן דומה את המולים של הפחמן הדו חמצני:
\[\begin{aligned} \frac{58.57 \text{ gr}}{44 \text{gr/mol}} &= \boxed{1.33 \text{ mol}} \\ &\Rightarrow \boxed{1.33 \text{ mol C}} \\ &\Rightarrow 1.33 \times 12 \approx \boxed{ 16 \text{ gr C}} \end{aligned}\]אנחנו לא יכולים להשמיט את הכלור - נשתמש בנתון על הדוגמא האחרת ונמיר אותו למשקל שיש לנו:
\[\begin{aligned} 75.00 &\rightarrow 22.06 \\ 40.10 &\rightarrow \boxed{11.8 \text{ gr Cl}} \\ &\Rightarrow \frac{11.8}{35.45} = \boxed{0.333 \text{ mol Cl}} \end{aligned}\]בשלב האחרון נחסיר את המשקלים שמצאנו כדי לזהות את משקל החמצן בדגימה הראשונה:
\[\begin{aligned} \text{O}_{\text{gr}} + 16 + 16 + 11.8 &= 40.1 \\ \text{O}_{\text{gr}} &= \boxed{10.7 \text{ gr O}} \\ &\Rightarrow \frac{10.7}{16} = \boxed{0.669 \text{ mol O}} \end{aligned}\]סך הכל קיבלנו את המולים הבאים:
\[\begin{aligned} \text{H} &= 1.66 \text{ mol} \\ \text{C} &= 1.33 \text{ mol} \\ \text{Cl} &= 0.333 \text{ mol} \\ \text{O} &= 0.669 \text{ mol} \end{aligned}\]נחלק במקדם הקטן ביותר ונקבל:
\[\begin{aligned} \text{H} &= 5 \text{ mol} \\ \text{C} &= 4 \text{ mol} \\ \text{Cl} &= 1 \text{ mol} \\ \text{O} &= 2 \text{ mol} \end{aligned}\]וסך הכל מצאנו שהנוסחה האימפירית של החומר היא:
\[\boxed{\text{H}_5\text{C}_4\text{Cl}\text{O}_2}\]אבל שאלו אותנו על הנוסחה המולקולרית, כדי לקבל אותה אנחנו צריכים לדעת את המשקל המולקולרי של החומר. בשביל זה נוכל להיעזר בנתון על הלחץ והמצב הגזי.
\[\begin{aligned} \text{PV} &= \text{nRT} \\ \text{n} &= \frac{\text{PV}}{\text{RT}} = \frac{0.298 \text{ atm }\times 1.5 \text{ L}}{0.08206 \times 273 \text{ K}} \\ &= \frac{0.447}{22.4} \approx 0.02 \end{aligned}\]כעת אנחנו יודעים מה המשקל של 0.02 מולים של החומר, נמצא את המשקל של מול אחד שלו:
\[\begin{aligned} 0.02 &\rightarrow 7.20 \text{ gr} \\ 1.00 &\rightarrow \frac{7.2}{0.02} = \boxed{360 \text{ gr}} \end{aligned}\]נבדוק את המשקל המולקולרי של הנוסחה האמפירית ונתאים אותה לנוסחה המולקולרית:
\[\begin{aligned} \text{H}_5\text{C}_4\text{Cl}\text{O}_2 &\rightarrow 5 + 12 \times 4 + 35.45 + 16 \times 2 \approx 120 \text{ gr} \\ &\Rightarrow \text{H}_{15}\text{C}_{12}\text{Cl}_3\text{O}_6 \approx \boxed{360 \text{ gr}} \end{aligned}\]הערה - החישוב כאן רגיש לעיגול המספרים. בחישובים אחרים יצא לי דווקא שהנוסחה המולקולרית ביחס של $1:2$ לאימפירית, כלומר:
\[\boxed{\text{H}_{10}\text{C}_{8}\text{Cl}_2\text{O}_4}\]שאלה 3 - שיווי משקל ולחצים חלקיים
הערה - שאלה מתוך מאגר השאלות למבחן.
חומר גזי מתפרק לפי המשוואה:
\[\text{AB}_{3\text{ (g)}} \rightarrow 1/2 \text{ A}_{2\text{ (g)}} + 3/2 \text{ B}_{2\text{ (g)}}\]השינוי בלחץ בחלקי של החומר $\text{AB}_3$ נתון בטבלה בטמפ, של $200^{\circ} \text{C}$ כפונקציה של הזמן בשעות.
| זמן (בשעות) | לחץ $\text{AB}_3$ (מ״מ כספית) |
|---|---|
| 0 | 660 |
| 5 | 330 |
| 15 | 165 |
| 35 | 82,5 |
- מצאו את סדר התגובה
- חשבו את קבוע המהירות של התגובה
- מה הלחץ הכללי בכלי אחרי 15 שעות
פתרון שאלה 3
צריך להיזהר לא להסיק מסקנות - זמן מחצית החיים לא זהה, התגובה אינה מסדר ראשון. נפתור באופן מתודי. תחילה נשים לב שניתן להשתמש בלחצים בחלקיים במקום הריכוזים בגלל שהם פרופורציונאליים:
\[P\left(\text{AB}_3\right) \propto \left[\text{AB}_3\right]\]מכאן נוכל להגדיר את משוואת הקצב:
\[\text{r} = k\left[\text{AB}_3\right]^m = k\times P\left(\text{AB}_3\right)^m\]כעת נחשב ערכים של קצב ממוצע $r_i=\frac{\Delta P_i}{\Delta t_i}$ בנקודות מסוימות, ונמצא איזה ערך של $m$ מתאים לנתונים:
\[\begin{aligned} r_1 &= \frac{330-660}{5-0} = -\frac{330}{5} = -66 \\ &\Rightarrow \boxed{r_1 = 66 = k\left(660\right)^m} \\ \\ r_2 &= \frac{165-330}{15-5} = -\frac{165}{10} = - 16.5 \\ &\Rightarrow \boxed{r_2 = 16.5 = k\left(330\right)^m} \\ \end{aligned}\]נחלק את המשוואות כדי לקבל את $m$:
\[\begin{aligned} \frac{66}{16.5} &= \frac{k\left(660\right)^m}{k\left(330\right)^m} \\ 4 &= 2^m \\ &\Rightarrow \boxed{m=2} \end{aligned}\]מכאן שהריאקציה מסדר שני.
סעיף ב׳ - נחשב את קבוע המהירות של התגובה. נציב את הנתונים מהסעים הקודם עבור $r_1, t=5$:
\[\begin{aligned} r_1 &= 66 = k\left(660\right)^2 \\ k &= \frac{66}{660^2} \approx \boxed{1.52 \times 10^{-4}} \end{aligned}\]סעיף ג׳ - נחשב את הלחץ הכללי בכלי לאחר 15 שעות:
לאחר 15 שעות הלחץ של $\text{AB}_3$ ירד ב:
\[660-165 = \boxed{495}\]כלומר, שנוצרו שאר הגזים בלחץ זה. ניעזר ביחסים הסטיוכומטריים למציאת הלחץ שנוצר מהם:
\[\begin{aligned} P\left(\text{A}_2\right) &= 1/2 495 = \boxed{247.5} \\ P\left(\text{B}_2\right) &= 3/2 495 = \boxed{742.5} \\ &\Rightarrow P_{\text{tot}} = 165 + 247.5 + 742.5 = \boxed{1155 \text{ mmHg}} \end{aligned}\]שאלה 4
עבור התהליך הבא:
\[\text{SO}_2\text{Cl}_2(\text{g}) \leftrightarrow \text{SO}_2(\text{g}) + \text{Cl}_2(\text{g})\] \[K_p = 2.4 \text{ atm at } 375^{\circ}\text{C}\]מכניסים 6.7 גרם של $\text{SO}_2\text{Cl}_2$ לכלי שנפחו 1 ליטר ומחממים את הכלי מ-$298^{\circ}\text{C}$ ל$375^{\circ}\text{C}$.
- מה הלחץ בכלי לפני בחימום ב$298^{\circ}\text{C}$? הניחו שהחומר אינו מתפרק ללא חימום
- לאחר החימום המערכת הגיעה לשיווי משקל מה הלחצים החלקיים של כל הגזים בשיווי משקל?
- כיצד ישפיעו כל אחד מהשיוניים הללו על הערך המדד כל השפעה הופעלה בנפרד על המערכת המצויה בשיווי משקל (נמקו)
- הקטנת הנפח על $K_p$
- הגדלת הנפח על כמות $\text{SO}_2\text{Cl}_2(\text{g})$
- הגדלת הלחץ על כמות $\text{SO}_2\text{Cl}_2(\text{g})$ - יגדל, כמו התוצר תעלה
- הוספת $\text{SO}_2$ על כמות $\text{Cl}(\text{g})$
שאלה 5
הערה- שאלה שמתחילה אותו הדבר עם סעיפים נוספים הופיעה במאגר השאלות למבחן . להלן השאלה המלאה עם הצעת הפתרון שלי:
חומצה לקטית (חומצת חלב) $\text{HC}_3\text{H}_5\text{O}_3$ מאוד חשובה בתהליכים ביולוגים. משוואת הפירוק שלה במים היא:
\[\text{HC}_3\text{H}_5\text{O}_3 (\text{aq}) + \text{H}_2\text{O} \rightarrow \text{H}^+ (\text{aq}) + \text{C}_3\text{H}_5\text{O}_3^- (\text{aq})\]ידוע כי בטמפרטורה של $298 \text{K}$ קבוע הפירוק של החומצה הוא $K_a = 1.38 \times 10^{-4}$.
- א. חשבו את ערך ה$\text{pH}$ של תמיסת חומצה לקטית בריכוז $0.5 \text{ M}$
- ב. לתמיסה בנפח $250 \text{ ml}$ של חומצה לקטית בריכוז $0.5 \text{ M}$ מוסיפים $0.045$ מול של המלח של החומצה $\text{NaC}_3\text{H}_5\text{O}_3$. מה יהיה ה$\text{pH}$ של התמיסה?
- ג. לתמיסה שהוכנה בסעיף ב׳ מוסיפים $100 \text{ ml}$ של תמיסת $\text{NaOH}$ בריכוז $0.01 \text{ M}$. מה יהיה ה$\text{pH}$ לאחר ההוספה?
- ד. חשבו מה הנפח של תמיסת $\text{HCl}$ בריכוז $0.1 \text{ M}$ שיש להוסיף לתמיסה בסעיף ג בכדי לחזור ל$\text{pH}$ המקורי של התמיסה שהוכנה בסעיף ב׳.
פתרון סעיף א - ערך $\text{pH}$ של חומצה לקטית
נתון לנו קבוע פירוק, מכאן שמדובר בחומצה חלשה.
ניעזר בקבוע הפירוק.
נסמן את כמות החומצה שהתפרקה ב-$x$, ובגלל היחסים זהו גם ריכוז $\left[\text{H}_3\text{O}^+\right]=x$. נחשב:
\[\begin{aligned} \frac{x^2}{0.5} &\approx 1.38 \times 10^{-4} \\ x &= \sqrt{6.90 \times 10^{-5}} = \boxed{8.31\times 10^{-3}} \end{aligned}\]לא לשכוח - כדי לקבל את ערך $\text{pH}$ נציב:
\[\begin{aligned} \text{pH} &= - \log \left(8.31\times 10^{-3}\right) \\ &= \boxed{2.08} \end{aligned}\]פתרון סעיף ב - לאחר הוספת המלח
המלח $\text{NaC}_3\text{H}_5\text{O}_3$ יתפרק וייתן את הבסיס המצומד לחומצה הלקטית כך שיתקבל יון משותף:
\[\text{NaC}_3\text{H}_5\text{O}_3 \rightarrow \text{Na}^+ + \text{C}_3\text{H}_5\text{O}_3^-\]ניעזר במשוואת הנדרסון האסלבך, תחילה נדרש למצוא את ריכוז המלח המצומד.
\[\begin{aligned} \left[\text{HC}_3\text{H}_5\text{O}_3\right]_{\text{weak acid}} &= \boxed{0.5} \end{aligned}\]נתנו לנו את מספר המולים, נקבל את הריכוז בעזרת חלוקה בנפח - בשונה מהמקרה בו נתון לנו הריכוז.
\[\begin{aligned} \left[{\text{C}_3\text{H}_5\text{O}_3^-}\right]_{\text{conjugate base}} &= \frac{0.045}{0.250 \text { L}} = \boxed{0.180} \end{aligned}\] \[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(1.38 \times 10^{-4}\right) + \log \frac{0.180}{0.5} \\ &= 3.86 - 0.444 = \boxed{3.42} \end{aligned}\]פתרון סעיף ג - הוספת בסיס לתמיסת בופר?
התמיסה שנוצרה היא תמיסת בופר, להבנתי, הוספת הבסיס תביא לתגובה עם החומצה החלשה ומים:
\[\text{HC}_3\text{H}_5\text{O}_3 + \text{OH}^- \rightarrow \text{H}_2\text{O} + \text{C}_3\text{H}_5\text{O}_3^-\]נחשב כמה מולים של בסיס נוספו:
\[0.01 \times 0.100 \text{ L} = \boxed{0.001 \text{ mol}}\]נחשב את הריכוזים החדשים - השינוי השפיע גם על נפח התמיסה, ומכאן שצריך לחשב את הריכוזים מחדש ולא רק לחסר מהקודמים:
\[\begin{aligned} \left[\text{HC}_3\text{H}_5\text{O}_3\right] &= \frac{0.5 \text{ M} \times 0.250 \text{ L} - 0.001}{0.350 \text{ L}} \\ &= \frac{0.124 \text{ mol}}{0.350 \text{ L}} = \boxed{0.354} \end{aligned}\] \[\begin{aligned} \left[{\text{C}_3\text{H}_5\text{O}_3^-}\right] &= \frac{0.045 + 0.001}{0.350 \text{ L}} \\ &= \frac{0.046 \text{ mol}}{0.350 \text{ L}} = \boxed{0.131} \end{aligned}\]נציב את הריכוזים במשוואת הנדרסון האסלבאך ונקבל:
\[\begin{aligned} \text{pH} &= \text{p}K_a + \log \frac{[\text{conjugate base}]}{[\text{acid}]} \\ &= -\log \left(1.38 \times 10^{-4}\right) + \log \frac{0.131}{0.354} \\ &= 3.86 - 0.432 = \boxed{3.43} \end{aligned}\]עליה קלה בערף $\text{pH}$ אכן מתאימה למקרה של הוספת בסיס חזק לבופר.
סעיף ד - ערך של חומצה חזקה שנדרש כדי לחזור
נמצא את הנפח הדרוש. הוספת החומצה תוביל לתגובה הבאה:
\[\text{C}_3\text{H}_5\text{O}_3^- + \text{H}_3\text{O}^+ \rightarrow \text{H}_2\text{O} + \text{HC}_3\text{H}_5\text{O}_3\] \[\begin{aligned} 3.42 &= 3.86 + \log \frac{0.131 - x}{0.354 + x} \\ -0.44 &= \log \frac{0.131 - x}{0.354 + x} \\ 10^{-0.44} &= \frac{0.131 - x}{0.354 + x} \\ 0.363 x + 0.129 &= 0.131 - x \\ 1.363 x &= 0.002 \\ x &= \boxed{0.00147} \end{aligned}\]מצאנו את מספר המולס הדרוש, נעבור לנפח:
\[\begin{aligned} x \text { L} \times 0.1 \text{ M} &= 0.00147 \text{ mol} \\ x &= \frac{0.00147}{0.1} = \boxed{0.0147 \text{ L}} \end{aligned}\]שאלה 6
נתונים הערכים הבאים עבור $\Delta \text{H}^{\circ}_f, \Delta \text{G}^{\circ}_f, \text{S}^{\circ}$:
| $\text{S}^{\circ}$ | $\Delta \text{G}^{\circ}_f$ | $\Delta \text{H}^{\circ}_f$ | תרכובת |
|---|---|---|---|
| $47.1$ | $32.8$ | $-26.4$ | $\text{CO(g)}$ |
| $51.1$ | $-94.0$ | $-94.0$ | $\text{CO}_2(\text{g})$ |
| ? | $-56.5$ | $-57.8$ | $\text{C(graphite)}$ |