תוכן עניינים:
- חלק א’: חזרה על פרויקט הגנום האנושי ושיטות מחקר
- חלק ב’: גישות מחקר בגנטיקה - Forward vs. Reverse Genetics
- חלק ג’: גנומיקה השוואתית (Comparative Genomics)
- חלק ד’: תכונות מורכבות (Complex Traits)
- חלק ה’: גנטיקה של אוכלוסיות (Population Genetics)
- חלק ו’: מבוא להנדסה גנטית (Genetic Engineering)
- סיכום כללי
חלק א’: חזרה על פרויקט הגנום האנושי ושיטות מחקר
שיטות ריצוף הגנום האנושי
שיטת הליכת כרומוזום (Chromosome Walking)
שיטה זו התבססה על שימוש בסמנים גנטיים (Genetic Markers) שזוהו לאורך הגנום עוד לפני השלמת הריצוף. התהליך כלל:
- שיבוט (Cloning) של מקטעי DNA שונים לתוך וקטורים
- ריצוף כל מקטע בנפרד
- איתור סמן ידוע במקטע המרוצף
- חיפוש מקטע נוסף בספריית הגנום המכיל את אותו הסמן
- חיבור המקטעים וחיפוש הסמן הבא
- בנייה הדרגתית של הגנום השלם
חסרונות השיטה: תהליך איטי ביותר שארך שנים רבות ודרש מאמץ בינלאומי משותף של מדינות רבות.
שיטת הירייה (Shotgun Sequencing)
חברת Celera הציגה גישה חדשנית ויעילה יותר:
- פירגמנטציה - שבירת הגנום לחתיכות קטנות באמצעות סוניקציה (Sonication) - גלי קול, ללא ידיעה מוקדמת על תוכן החתיכות
- הוספת אדפטורים (Adapters) - רצפים ידועים מראש המשמשים לעיגון פריימרים
- ריצוף מקבילי - ריצוף כל המקטעים בו-זמנית באמצעות הפריימרים
- הרכבה ממוחשבת - שימוש באלגוריתמים לזיהוי חפיפות (Overlaps) ובניית הגנום השלם
יתרונות: מהירות, יעילות, פחות תלות בכוח אדם, שימוש מרבי בכוח מחשוב.
בסופו של דבר, שתי השיטות שולבו - כל אחת השלימה פערים של השנייה, ויחד אפשרו את פענוח הגנום האנושי.
פרויקט אלף הגנומים (1000 Genomes Project)
כהרחבה לפרויקט הגנום האנושי, פרויקט זה ריצף 1,092 גנומים של אנשים ממוצאים שונים. הממצאים העיקריים:
- שונות בין-אישית: לכל אדם 100-50 וריאנטים ייחודיים
- חישוב שיעור המוטציה: הנתונים אפשרו הערכה מדויקת יותר של קצב המוטציות בגנום האנושי
חלק ב’: גישות מחקר בגנטיקה - Forward vs. Reverse Genetics
Forward Genetics - מפנוטיפ לגנוטיפ
גישה מחקרית המתחילה מתצפית על פנוטיפ (מחלה, תכונה פיזית, התנהגות) ושואלת: אילו רצפים גנטיים אחראים לפנוטיפ זה?
שיטה 1: מחקרי GWAS (Genome-Wide Association Studies)
עיקרון השיטה:
- גיוס קבוצת מקרה (Case) - אנשים עם הפנוטיפ הנחקר (למשל: חולי סוכרת, אנשים גבוהים)
- גיוס קבוצת ביקורת (Control) - אנשים ללא הפנוטיפ
- השוואת הגנומים וחיפוש אתרים גנטיים המשותפים לקבוצת המקרה
נקודות חשובות:
- ככל שהמדגם גדול יותר (Sample Size), המידע מדויק ואיכותי יותר מבחינה סטטיסטית
- ממצאי GWAS מצביעים על קורלציה (Correlation) ולא בהכרח על קשר סיבתי (Causation)
- האתר שנמצא עשוי להיות קשור לפנוטיפ באופן עקיף - למשל דרך אפיסטזיס (Epistasis) - אינטראקציה בין גנים שבה גן אחד מווסת פעילות של גן אחר
שיטה 2: מוטגנזה אקראית (Random Mutagenesis) וסריקה (Screening)
עיקרון השיטה:
- יצירת מוטציות אקראיות באורגניזם מודל (חיידקים, זבובי פירות, עכברים)
- שיטות ליצירת מוטציות: קרינת UV, חומרים מוטגניים
- הערה חשובה: ניתן להשבית את מנגנון ה-Photolyase כדי שהמוטציות לא יתוקנו
- סריקת הפנוטיפים - זיהוי פרטים עם פנוטיפ שונה/חריג
- חזרה לזיהוי המקטע הגנטי שנפגע
יתרון: יעילות גבוהה - במקום לבדוק גן-גן, מזהים ישירות את הגן שגרם לפנוטיפ.
דוגמה מזבובי פירות (Drosophila): הכנסת טרנספוזונים עם גן GFP, איתור אתרי ביטוי שונים בלרוות (זחלים) ובזבובים בוגרים.
Reverse Genetics - מגנוטיפ לפנוטיפ
גישה מחקרית המתחילה מגן ידוע ושואלת: מהו תפקידו של גן זה?
שיטה 1: ביטוי אקטופי (Ectopic Expression)
ביטוי גן במקום, בזמן או בכמות שאינם הרגילים לו.
אפשרות א’ - הגברת ביטוי:
- הכנסת הגן תחת פרומוטור (Promoter) חזק יותר
- תוצאה: ייצור מוגבר של mRNA וחלבון
- מאפשר זיהוי פנוטיפ שלא נראה בביטוי הרגיל (הנמוך)
אפשרות ב’ - ביטוי ברקמה שונה:
- הכנסת גן לרקמה/אורגניזם שבו הוא לא מתבטא באופן טבעי
דוגמה קלאסית - GFP (Green Fluorescent Protein):
- מקור: מדוזות - זקוקות למנגנון זוהר לחיים במעמקי הים
- שימוש: הכנסת הגן לחיידקים באמצעות הנדסה גנטית
- תוצאה: חיידקים זוהרים בירוק
- יישום: אם לא היינו יודעים את תפקיד הגן, הכנסתו לחיידק והצפייה בפנוטיפ הייתה מלמדת אותנו
שיטה 2: מוטגנזה מכוונת (Targeted Mutagenesis)
פגיעה מכוונת בגן ספציפי ליצירת מצב של Loss of Function.
שימוש ברקומבינציה הומולוגית (Homologous Recombination):
- מנגנון שהכרנו בתיקון DNA ובמיוזה (תהליך השחלוף/Crossing Over)
- החלפת הגן המקורי בסמן סלקציה או ברצף ריק
- יצירת עכבר Knockout - עכבר נעדר ביטוי של הגן הספציפי
דוגמה: פגיעה בגן מסוים בעכבר גרמה להיעדר פרווה בחזה ← מסקנה: הגן אחראי לצמיחת פרווה.
הערה היסטורית: בעבר תהליך זה היה ארוך ומסורבל. כיום, שיטות כמו CRISPR (יילמד בשיעור הבא) מקצרות משמעותית את התהליך.
שיטה 3: שימוש בטרנספוזונים (Transposons)
- אלמנטים גנטיים ניידים (שנלמדו בשיעור קודם) היכולים להשתלב בגנום
- אם טרנספוזון נכנס לתוך גן - הוא משבש את פעילותו
- יתרון: ניתן לעקוב אחר מיקום הכניסה באמצעות רצף הטרנספוזון הידוע כסמן
שילוב הגישות: מקורלציה לקשר סיבתי
שאלה שנשאלה בשיעור: לאחר שמחקר GWAS מצא קשר בין אתר בכרומוזום 15 לסיכון מוגבר למחלת לב - איך מוכיחים קשר סיבתי ישיר?
תשובה: שילוב גישות:
- GWAS מזהה קורלציה (Forward Genetics)
- Reverse Genetics - פגיעה מכוונת בגן החשוד ובדיקת ההשפעה על הפנוטיפ
- מחקרים בתאים, במודלים של עכברים ובמערכות נוספות
חלק ג’: גנומיקה השוואתית (Comparative Genomics)
מה לומדים מהשוואת גנומים?
השוואת גנומים של אורגניזמים שונים (אדם, שימפנזה, עכבר, זבוב, עגבנייה) מאפשרת:
- זיהוי שינויים אבולוציוניים - מוטציות שהתקבעו לאורך הזמן
- זיהוי רצפים שמורים (Conserved Sequences) - רצף המופיע בכל האורגניזמים הנבדקים מעיד על חיוניות ולחץ סלקטיבי לשמרו
- זיהוי גנים שאיבדו תפקוד - היו פעילים באבות קדמונים ואינם מתפקדים כיום
- גילוי פתוגנים חדשים וניבוי התפתחותם האבולוציונית
סוגי שינויים גנטיים (Genetic Variations)
| סוג השינוי | תיאור | הערות |
|---|---|---|
| Point Mutations / SNPs | שינוי, הוספה או מחיקה של נוקלאוטיד בודד | השכיחות ביותר; רובן מתוקנות או ניטרליות |
| Duplications | הכפלה של מקטע DNA | לא תמיד מגבירה ביטוי - לפעמים יוצרת בקרה שלילית וחוסר תפקוד |
| Deletions | מחיקה/חסר של מקטע DNA | |
| Inversions | היפוך של מקטע DNA | נוצר משבר דו-גדילי (DSB) בשני אתרים, היפוך והדבקה |
מנגנון יצירת Inversions
שאלה שנשאלה: איזה מנגנון תיקון עשוי ליצור Inversion?
תשובה: NHEJ (Non-Homologous End Joining) - מנגנון “לא חכם” שמדביק קצוות DNA שבורים ללא התייחסות לרצף ההומולוגי. אם ההדבקה מתרחשת לאחר שהמקטע התהפך, נוצרת Inversion.
הבהרה: Homologous Recombination פחות תיצור Inversion כי היא משתמשת בכרומוזום ההומולוג כתבנית לתיקון.
שאלה נוספת: האם ב-Inversion נשמרת כיווניות 5’-3’?
תשובה: כן, הכיווניות הכימית נשמרת, אך סדר הגנים מתהפך, מה שעלול לשנות את הביטוי הגנטי.
שימושים בגנומיקה השוואתית
בניית עצים פילוגנטיים (Phylogenetic Trees)
השוואת גנומים מאפשרת מיפוי קרבה גנטית בין מינים.
דוגמה: השוואת גנומים של פרה, כבש וחזיר מראה דמיון גנטי גדול יותר בין פרה לכבש מאשר לחזיר.
שאלה שנשאלה: איך יכול להיות שלמינים קרובים יש מספר שונה של כרומוזומים?
תשובה: תהליכים אבולוציוניים כוללים:
- הכפלת כרומוזומים שלמים
- דופליקציות של גנים הנכנסים לאתרים חדשים
- טרנספוזונים המכניסים מקטעים לאזורים חדשים
- מוטציות כולל Insertions הגורמות לשינויים מבניים
הסבר: ההנחה היא שבמהלך האבולוציה, כרומוזום הכפיל את עצמו, ואז כל אחד משני העותקים עבר מוטציות שונות עד שהפכו לכרומוזומים נפרדים עם תכונות שונות.
יישומים נוספים
- מיפוי גיאוגרפי-אבולוציוני: הבנת תהליכי נדידה והתפתחות
- השוואת טמפרטורות גידול: זיהוי גנים הקשורים להסתגלות לסביבות שונות
- זיהוי זנים חדשים: למשל, זנים חדשים של וירוסים והתאמת חיסונים
- חיזוי שפעת עונתית: ניבוי זנים חדשים על בסיס מגמות אבולוציוניות
דמיון גנטי בין בני אדם
בני אדם דומים מאוד גנטית זה לזה, וגם לשימפנזים. מסקנה חשובה: רוב השונות בין בני אדם נובעת לא רק מרצפי DNA אלא מ:
- בקרת ביטוי גנים - אילו גנים מתבטאים, מתי ובאיזו כמות
- אפיגנטיקה - תוספות כימיות על בסיסי DNA והיסטונים המשפיעות על ביטוי
חלק ד’: תכונות מורכבות (Complex Traits)
הגדרה
תכונות מורכבות הן:
- תכונות פוליגניות (Polygenic) - מעורבים בהן שלושה גנים או יותר (בניגוד לשני גנים שנלמדו בהקשר של אינטראקציות גנים)
- או תכונות עם השפעה משמעותית של גורמים סביבתיים
- לרוב - שילוב של שניהם
הבדלים מתכונות מונוגניות
| מאפיין | תכונה מונוגנית | תכונה מורכבת |
|---|---|---|
| מספר גנים | גן אחד | שלושה ומעלה |
| פנוטיפים | שניים (או ארבעה בשני גנים) | ספקטרום רציף |
| התפלגות | דיסקרטית | התפלגות פעמון (Normal Distribution) |
| ניבוי | קל יחסית | מורכב מאוד |
| דוגמה | אנמיה חרמשית, קבוצת דם | גובה, משקל, דיכאון |
Nature vs. Nurture - גנטיקה מול סביבה
שאלה שנשאלה: תנו דוגמאות לתכונות גנטיות לחלוטין ולתכונות סביבתיות לחלוטין.
תכונות גנטיות (כמעט) לחלוטין:
- קבוצת דם ABO
- מחלות מונוגניות כמו אנמיה חרמשית
תכונות סביבתיות (כמעט) לחלוטין:
- מחלות זיהומיות ויראליות (אם מישהו לא היה באזור - לא נדבק)
- חשיפה לרעלים
אולם - גם כאן יש ניואנסים:
- דוגמת הקורונה: אנשים רבים נחשפו לנגיף, אך לא כולם חלו באותה חומרה ← יש רכיב גנטי המשפיע על מערכת החיסון
- לחץ דם, IQ, נטייה לסטרס - כולן תכונות מורכבות עם גם וגם
מסקנה: רוב התכונות והמחלות נמצאות “באמצע” - שילוב של גנטיקה וסביבה.
מדד תורשתיות - Heritability (H²)
מדד המבטא את החלק היחסי של השונות בתכונה המוסבר על ידי גורמים גנטיים.
- H² = 1 ← התכונה נקבעת גנטית בלבד
- H² = 0 ← התכונה נקבעת סביבתית בלבד
- ערכים ביניים ← שילוב
| תכונה | H² | פרשנות |
|---|---|---|
| סוג דם | 1.0 | גנטי לחלוטין |
| אוטיזם | 0.90 | גנטי ברובו |
| גובה | 0.88 | גנטי ברובו |
| צבע שיער | 0.89 | גנטי ברובו |
| IQ | 0.69 | גנטי חלקית, סביבתי משמעותית |
הערה חשובה: H² מבטא קורלציה, לא סיבתיות. IQ גבוה לא “נגרם” ישירות מגנים - ייתכן שהגנים משפיעים על יכולת למידה, שבתורה מושפעת מסביבה.
שיטת המחקר: השוואת תאומים (Twin Studies)
עיקרון:
- תאומים זהים (Monozygotic): 100% DNA משותף
- תאומים לא זהים (Dizygotic): ~50% DNA משותף (כמו אחים רגילים)
- שתי הקבוצות חולקות סביבה דומה (באותה משפחה)
לוגיקה: אם תכונה גנטית לחלוטין - נצפה ל-100% התאמה בתאומים זהים. אם סביבתית לחלוטין - לא נצפה להבדל בין סוגי התאומים.
דוגמה - סוג דם:
- תאומים זהים: 100% התאמה
- תאומים לא זהים: התאמה לפי חוקי מנדל
דוגמה - צבע שיער:
- תאומים זהים: 89% התאמה (לא 100%!)
- תאומים לא זהים: התאמה נמוכה משמעותית
- מסקנה: רכיב גנטי חזק, אך לא בלעדי
שאלה שנשאלה: האם היו ניסויים על תאומים שגדלו בנפרד?
תשובה: כן, היו מחקרים (חלקם בעייתיים אתית) על תאומים זהים שהופרדו בלידה וגדלו בסביבות שונות. הממצאים תמכו בהשפעה גנטית משמעותית על תכונות רבות, אך גם הראו השפעות סביבתיות.
דוגמה מורחבת: דיכאון קליני (Major Depressive Disorder)
האם דיכאון גנטי או סביבתי?
תשובה: גם וגם - תכונה מורכבת קלאסית.
גנים מעורבים
זוהו למעלה מ-80 גנים הקשורים לדיכאון, במסלולים מגוונים:
| מסלול | הסבר |
|---|---|
| סרוטונין ונוירוטרנסמיטורים | מסלול הטריפטופן, ייצור סרוטונין |
| ציר HPA (Hypothalamic-Pituitary-Adrenal) | תגובה לסטרס |
| מחזור יום-לילה (Circadian Rhythm) | דיכאון חורף, רגישות לשעות אור |
| מערכת החיסון | קשר הדדי בין דלקת למצב רוח |
| פעילות מיטוכונדריאלית | ייצור אנרגיה תאית משפיע על תפקוד כללי |
מחקר אינטראקציה גן-סביבה
מחקר קלאסי בחן גן ספציפי עם שני אללים: אלל קצר (כחול בגרף) ואלל ארוך (ירוק בגרף).
ממצאים:
- ללא אירועים טראומטיים: אין הבדל משמעותי בשכיחות דיכאון בין נשאי האללים
- אירוע טראומטי אחד או שניים: עדיין אין הבדל משמעותי
- שלושה-ארבעה אירועים טראומטיים: הבדל דרמטי - נשאי האלל הקצר בסיכון גבוה משמעותית
מסקנה: האלל עצמו אינו “גורם” לדיכאון, אך הוא מגביר את הרגישות לגורמי סטרס סביבתיים. זו דוגמה מובהקת ל-Gene-Environment Interaction.
שאלה שנשאלה: האם אפשר לעשות בדיקה גנטית לדיכאון?
תשובה: מורכב מאוד. גם אם נבדוק את כל 80+ הגנים:
- לא ברור כיצד לשקלל את התוצאות
- ייתכן שאדם נושא אללי סיכון בחלק מהגנים ואללי הגנה באחרים
- הגורמים הסביבתיים אינם ניתנים לניבוי
שאלה נוספת: האם הגנים האלה ספציפיים לדיכאון?
תשובה: לא בהכרח. גנים רבים משפיעים על מסלולים מרובים - שינוי בהם עשוי להשפיע על תפקודים נוספים מעבר לדיכאון.
דוגמה מורחבת: צבע עור ולבקנות (Albinism)
צבע עור - תכונה מורכבת
מלנין (Melanin): פיגמנט המיוצר בתאים ייעודיים - מלנוציטים (Melanocytes).
תפקידי המלנין:
- הגנה מפני נזקי קרינת UV
- שימור וספיגת ויטמין B9 (פולאט)
- מעורבות ביצירת ויטמין D
שאלה שנשאלה: איך מלנין קשור ליצירת ויטמין D?
תשובה: המלנין מגן מפני UV אך גם “חוסם” חלק מהקרינה הדרושה לסינתזת ויטמין D בעור. לכן:
- באזורים עם קרינה חזקה ← יתרון למלנין רב (הגנה מסרטן עור)
- באזורים עם קרינה חלשה ← יתרון למלנין מועט (ייצור ויטמין D)
מפת צבע העור העולמית: התפלגות צבע העור משקפת התאמה אבולוציונית לעוצמת הקרינה - עור כהה יותר באזורים קרובים לקו המשווה.
לבקנות (Albinism)
הגדרה: פגיעה בייצור מלנין הגורמת לצבע עור, שיער ועיניים בהיר מאוד.
שכיחות: 1:17,000
תסמינים:
- צבע עור ושיער בהיר מאוד
- צבע עיניים בהיר (לפעמים אדמדם)
- רגישות גבוהה לשמש (שריפות ללא שיזוף)
- לעיתים - פגיעה בראייה
גנים מעורבים:
| גן | תפקיד |
|---|---|
| TYR (Tyrosinase) | אנזים במסלול ייצור המלנין - ממיר טירוזין למלנין |
| OCA2 | בקרה על כמות ייצור המלנין |
שאלה שנשאלה: מה הקשר למחלת PKU?
תשובה: במסלול המטבולי, ההמרה של פנילאלנין לטירוזין (הפגועה ב-PKU) נמצאת מעל מסלול ייצור המלנין. אולם יש מסלולים חלופיים, ולכן חולי PKU אינם בהכרח לבקנים.
האם לבקנות היא תכונה מורכבת?
שאלה שנשאלה בשיעור: אם לבקנות יכולה לנבוע מפגיעה בגנים שונים, האם היא תכונה מורכבת?
תשובה: לא. לבקנות היא דוגמה ל-Genetic Heterogeneity (הטרוגניות גנטית) - אותו פנוטיפ יכול לנבוע מפגיעה בגנים שונים, אך מספיקה פגיעה בגן אחד כדי לגרום למצב. זה שונה מתכונה מורכבת/פוליגנית שבה נדרשת תרומה של מספר גנים יחד.
הערה חברתית-תרבותית
במדינות מסוימות באפריקה (כולל אוגנדה), לבקנים נרדפו היסטורית מתוך אמונות תפלות שייחסו להם כוחות מיסטיים או מזיקים. זוהי תזכורת שלגנטיקה יש השלכות חברתיות רחבות.
דוגמה נוספת: Retinitis Pigmentosa (RP)
הגדרה: מחלה גנטית הגורמת לאובדן ראייה פרוגרסיבי עקב פגיעה ברשתית.
גנים מעורבים: למעלה מ-70 גנים שונים - הטרוגניות גנטית נרחבת.
סוגי מוטציות שנמצאו:
- Missense (החלפת חומצה אמינית)
- Frameshift (הזזת מסגרת הקריאה)
- Nonsense (קודון עצירה מוקדם)
- Splicing mutations (פגיעה בעיבוד RNA)
- מוטציות באינטרונים הפוגעות ברגולציה
המלצת צפייה: הסרט “Blink” בנטפליקס - על משפחה שבה מספר ילדים חולים ב-RP ומחליטים לטייל בעולם כדי לחשוף אותם לחוויות ויזואליות לפני אובדן הראייה.
טיפוח סלקטיבי (Selective Breeding)
עיקרון: בחירת פרטים מקצוות ההתפלגות של תכונה רצויה להכלאה, במטרה להסיט את הממוצע בדורות הבאים.
דוגמה מהשיעור: שחקן הכדורסל הגבוה ביותר בהיסטוריה (מנוט בול, 2.31 מ’) לצד שחקן גולף נמוך יחסית - הפרשי גובה ניכרים כתוצאה מתורשה.
יישום בחקלאות:
- זיהוי התפלגות תכונה (למשל: גודל עגבנייה, תכולת פרו-ויטמין A בתירס)
- בחירת פרטים מהקצה הרצוי להכלאה
- לאורך דורות - הסטת הממוצע לכיוון הרצוי
- כך פותחו זנים שונים של עגבניות: שרי קטנות או עגבניות ענק
הבהרה חשובה: טיפוח סלקטיבי אינו הנדסה גנטית - לא מכניסים או מוציאים רצפי DNA, רק בוחרים אילו פרטים יתרבו.
חלק ה’: גנטיקה של אוכלוסיות (Population Genetics)
מעבר מפרט לאוכלוסייה
עד כה עסקנו בגנטיקה ברמת:
- הפרט (אללים, גנוטיפ, פנוטיפ)
- המשפחה (עצי משפחה, חישובי הסתברות)
כעת נעבור לשאלות ברמת האוכלוסייה:
- מה השכיחות של אלל מסוים באוכלוסייה?
- מה הסיכון לחלות במחלה גנטית באוכלוסייה מסוימת?
- האם הסיכון שווה בכל האוכלוסיות בעולם?
התשובה: לא - יש שונות משמעותית בין אוכלוסיות.
תהליכים המשפיעים על הרכב גנטי של אוכלוסיות
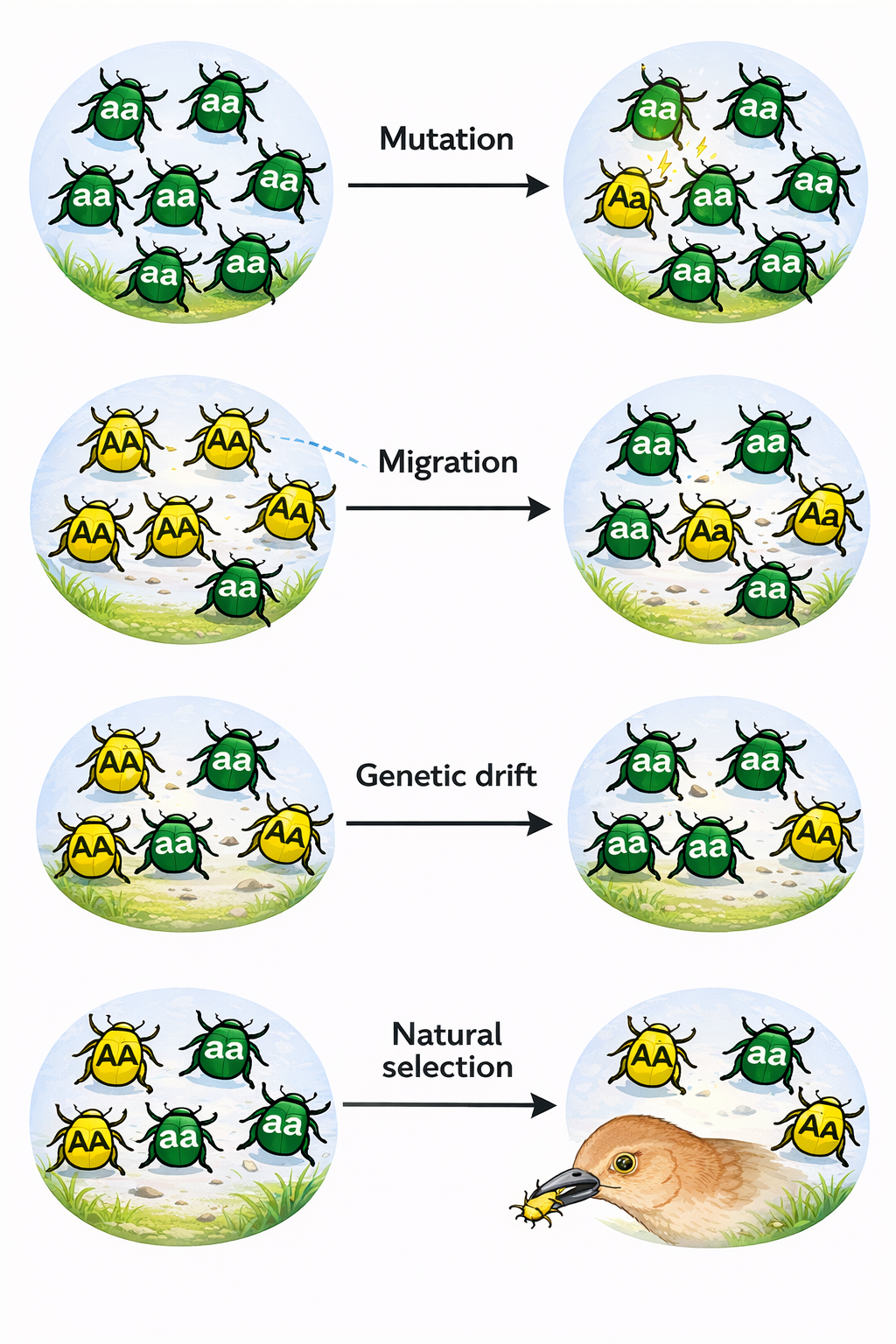
1. מוטציות (Mutations)
שינויים אקראיים ב-DNA. רובן ניטרליות או מתוקנות; חלקן גורמות ל-Loss of Function, ולעיתים נדירות - Gain of Function.
2. הגירה (Migration / Gene Flow)
תנועת אנשים בין אוכלוסיות משנה את ההרכב הגנטי.
3. ברירה טבעית (Natural Selection)
תכונות המעניקות יתרון הישרדותי ורבייתי יתפשטו באוכלוסייה; תכונות מזיקות יפחתו.
4. סחיפה גנטית (Genetic Drift)
שינויים אקראיים בשכיחות אללים, משמעותיים במיוחד באוכלוסיות קטנות.
משוואות הארדי-ויינברג (Hardy-Weinberg Equilibrium)
שני חוקרים - Hardy ו-Weinberg - פיתחו באופן עצמאי את העקרונות המתמטיים המתארים הרכב גנטי באוכלוסיות יציבות.
משוואה ראשונה: שכיחות אללים
\[p + q = 1\]כאשר:
- p = שכיחות האלל הדומיננטי (A)
- q = שכיחות האלל הרצסיבי (a)
משוואה שנייה: שכיחות גנוטיפים
\[p^2 + 2pq + q^2 = 1\]כאשר:
- p² = שכיחות הומוזיגוט דומיננטי (AA)
- 2pq = שכיחות הטרוזיגוט (Aa) - מכפילים ב-2 כי יש שתי דרכים לקבל הטרוזיגוט (A מאמא ו-a מאבא, או להפך)
- q² = שכיחות הומוזיגוט רצסיבי (aa)
הקשר בין המשוואות:
\[(p + q)^2 = p^2 + 2pq + q^2 = 1\]דוגמה: חצי-דומיננטיות בפרחים
רקע: בחצי-דומיננטיות (Incomplete Dominance), להטרוזיגוט יש פנוטיפ ביניים ייחודי.
| גנוטיפ | פנוטיפ |
|---|---|
| A₁A₁ | סגול |
| A₁A₂ | ורוד |
| A₂A₂ | לבן |
נתונים משדה: מתוך 200 פרחים שנדגמו:
- 98 סגולים (A₁A₁)
- 84 ורודים (A₁A₂)
- 18 לבנים (A₂A₂)
חישוב שכיחות אללים:
| אלל | חישוב | תוצאה |
|---|---|---|
| A₁ | (98×2 + 84) / 400 | 280/400 = 0.70 (70%) |
| A₂ | (18×2 + 84) / 400 | 120/400 = 0.30 (30%) |
אימות: p + q = 0.70 + 0.30 = 1 ✓
חישוב שכיחות גנוטיפים (צפויה):
| גנוטיפ | חישוב | תוצאה |
|---|---|---|
| A₁A₁ | p² = 0.70² | 49% |
| A₁A₂ | 2pq = 2×0.70×0.30 | 42% |
| A₂A₂ | q² = 0.30² | 9% |
אימות: 49% + 42% + 9% = 100% ✓
דוגמה קלינית: מחלת טיי-זקס (Tay-Sachs Disease)
רקע: מחלה מונוגנית רצסיבית קשה, גורמת לנזק נוירולוגי פרוגרסיבי ומוות בגיל צעיר.
שכיחות:
| אוכלוסייה | שכיחות חולים |
|---|---|
| יהודים אשכנזים | 1:3,500 |
| קנדים צרפתים | 1:35,000 |
| ממוצע עולמי | 1:320,000 |
חישוב עבור האוכלוסייה האשכנזית:
נתון: q² = 1/3,500 (שכיחות הומוזיגוט רצסיבי = חולים)
שלב 1 - חישוב q: \(q = \sqrt{1/3500} = 0.017\)
שלב 2 - חישוב p: \(p = 1 - q = 1 - 0.017 = 0.983\)
שלב 3 - חישוב שכיחות נשאים (2pq): \(2pq = 2 \times 0.017 \times 0.983 = 0.033 \approx 3.3\%\)
מסקנה: כ-3% מהאוכלוסייה היהודית האשכנזית הם נשאים למחלת טיי-זקס.
יישום קליני
שאלה שנשאלה: למה הנתון הזה חשוב?
תשובות:
- החלטות על בדיקות סקר: כדי להצדיק בדיקת סקר אוכלוסייתית, המחלה צריכה להיות:
- חמורה מספיק (טיי-זקס - בהחלט)
- שכיחה מספיק (3% נשאים - מצדיק השקעה)
- ייעוץ גנטי: אם אדם מהאוכלוסייה האשכנזית מתחתן עם בן/בת זוג מאותה אוכלוסייה, הסיכוי ששניהם נשאים הוא 3% × 3% = 0.09%, והסיכוי לילד חולה הוא 0.09% × 25% ≈ 0.02%.
תנאים לשיווי משקל הארדי-ויינברג
המשוואות תקפות רק כאשר מתקיימים כל התנאים הבאים:
| תנאי | הסבר | למה זה חשוב |
|---|---|---|
| אוכלוסייה גדולה | מספיק פרטים למדגם מייצג | באוכלוסייה קטנה - סחיפה גנטית אקראית |
| זיווגים אקראיים | ללא העדפה לפי מצב גנטי | אם חולים מתחתנים עם חולים - משתנה השכיחות |
| אין הגירה משמעותית | לא נכנסות/יוצאות קבוצות גדולות | הגירה משנה את ההרכב הגנטי |
| אין מוטציות חדשות משמעותיות | קצב מוטציה נמוך | מוטציות חדשות מוסיפות אללים |
| אין ברירה טבעית | אין יתרון/חיסרון לאלל מסוים | סלקציה משנה שכיחויות |
שאלה שנשאלה: אם האוכלוסייה האשכנזית סגורה יחסית, למה לא צפויות יותר מוטציות?
תשובה: אוכלוסייה סגורה לא מגבירה את קצב המוטציות, אלא מגבירה את הסיכוי שמוטציה קיימת תופיע במצב הומוזיגוטי (כי שני ההורים עלולים לרשת את אותו אלל מאב קדמון משותף).
מסקנה מעשית: במציאות, אף אוכלוסייה לא נמצאת בשיווי משקל מושלם. המשוואות נותנות אומדן - טוב יותר מ”הסיכוי קטן”, אך לא מדויק לחלוטין.
סחיפה גנטית (Genetic Drift)
שינויים אקראיים בשכיחות אללים, משמעותיים במיוחד באוכלוסיות קטנות.
אפקט מייסד (Founder Effect)
הגדרה: כשקבוצה קטנה מאוכלוסייה גדולה נודדת ומקימה אוכלוסייה חדשה, ההרכב הגנטי שלה עשוי להיות שונה מהאוכלוסייה המקורית.
מנגנון: מיעוט באוכלוסייה המקורית הופך לרוב באוכלוסייה החדשה.
דוגמה - איי טריסטן דה קוניה:
- קבוצת איים מרוחקת בדרום האוקיינוס האטלנטי
- 2,800 ק”מ מדרום אפריקה, 3,300 ק”מ מדרום אמריקה
- אוכלוסייה נוכחית: 238 תושבים (נכון ל-2024)
- רוב התושבים צאצאים של משפחה סקוטית אחת שהגיעה ב-1817
- פיתחו ניב שפה ייחודי
- שכיחות גבוהה של מחלות מורכבות: גלאוקומה ואסתמה
אפקט צוואר בקבוק (Bottleneck Effect)
הגדרה: כשאוכלוסייה מצטמצמת דרמטית (מגפה, אסון טבע, רדיפות), ההרכב הגנטי של השורדים עשוי להיות שונה מהאוכלוסייה המקורית.
מנגנון: מיעוט באוכלוסייה המקורית הופך לרוב בקרב השורדים.
נישואי קרובים (Consanguinity) וסיכון גנטי
הבעיה הגנטית
בנישואי קרובים, שני ההורים עלולים לרשת את אותו אלל נדיר מאב קדמון משותף. לכן:
- עולה הסיכוי למצב הומוזיגוטי רצסיבי (שני עותקים של האלל הפגום / מוטנטי) אצל הילדים
- מחלות גנטיות נדירות הופכות שכיחות יותר
שכיחות עולמית
נישואי קרובים נפוצים באזורים שונים בעולם:
- מדינות המזרח התיכון
- מדינות באפריקה
- קהילות מבודדות מסיבות דתיות או גיאוגרפיות
נתון: קיים קשר סטטיסטי ברור בין שיעור נישואי קרובים לשיעור מומים מולדים.
פתרון: תוכנית “דור ישרים”
הרקע: באוכלוסייה החרדית הייתה התנגדות ראשונית לבדיקות סקר גנטיות - חשש מ”תיוג” של נשאים ופגיעה בסיכויי שידוך.
הפתרון:
- בדיקות גנטיות לכל המעוניינים
- התוצאות נשמרות במאגר ללא חשיפה לנבדק
- כשבני זוג פוטנציאליים פונים למאגר, הם מקבלים תשובה בינארית:
- “התאמה” - אינם נשאים לאותה מחלה
- “אי-התאמה” - שניהם נשאים (לא מפרטים לאיזו מחלה)
יתרונות:
- מניעת לידת ילדים חולים
- ללא תיוג של יחידים כ”נשאים”
- התאמה תרבותית לאוכלוסייה
יתרון ההטרוזיגוט (Heterozygote Advantage)
לפעמים נשאות באלל מחלה מקנה יתרון אבולוציוני, מה שמפר את שיווי המשקל.
דוגמה קלאסית: חסר ב-G6PD
| מצב | תיאור |
|---|---|
| הומוזיגוט תקין | רגיש למלאריה |
| הטרוזיגוט (נשא) | עמיד יחסית למלאריה + סיכון נמוך לאנמיה |
| הומוזיגוט פגוע | עמיד למלאריה אך סיכון גבוה לאנמיה המוליטית |
תוצאה: באזורים אנדמיים למלאריה (כמו אגן הים התיכון), שכיחות המוטציה גבוהה יותר מהצפוי - כי ההטרוזיגוטים שרדו בשיעור גבוה יותר.
משמעות להארדי-ויינברג: במצב כזה, לא ניתן להניח “אין ברירה טבעית” - האלל “הפגום” דווקא מועדף בסביבה מסוימת.
חלק ו’: מבוא להנדסה גנטית (Genetic Engineering)
הגדרה
הנדסה גנטית: שינוי מכוון בחומר הגנטי ביד אדם, באופן מלאכותי.
כוללת:
- העברת DNA בין אורגניזמים שונים
- שינוי ברצף גן קיים
- יצירת שילובים חדשים של רצפים גנטיים
אינה כוללת:
- השבחה קלאסית / טיפוח סלקטיבי (בחירת פרטים להכלאה)
- בחירת עוברים (PGD) - בדיקה ובחירה, לא שינוי
שלושת סוגי השינויים העיקריים
| סוג | תיאור | דוגמה |
|---|---|---|
| הפעלת גן | ביטוי גן שלא היה פעיל/קיים | הכנסת GFP ממדוזות לחיידקים |
| השתקת גן | מניעת ביטוי גן פעיל | השתקת גן סרטני |
| שינוי רמת ביטוי | הגברה או הפחתה של ביטוי | הגברת ייצור חלבון תרופתי |
יישומים בתחומים שונים
חקלאות
מטרות (זהות להשבחה קלאסית, אך בשיטות שונות):
- הארכת חיי מדף
- הגדלת יבול
- העשרת ערך תזונתי
- עמידות למזיקים ולתנאי סביבה
דוגמאות תיאורטיות/מעשיות:
| יבול | בעיה | פתרון מוצע |
|---|---|---|
| עגבניות | רגישות לקור | הכנסת גנים מדגי קוטב לעמידות לקפיאה |
| תירס | נזקי מזיקים (60%+ מהיבול בארה”ב) | הכנסת גנים מחיידקים לעמידות למזיקים |
| אורז | ערך תזונתי נמוך | אורז מוזהב (Golden Rice) - הכנסת גנים לייצור בטא-קרוטן (פרו-ויטמין A) |
הבהרה חשובה:
- בישראל אין גידולים מהונדסים גנטית בחקלאות (יש מחקר, אין שימוש מסחרי)
- התנגדות ציבורית להנדסה גנטית קיימת, אך חלק מהטענות מבלבלות בין הנדסה גנטית להשבחה קלאסית
- המטרות זהות - השיטות שונות
רפואה
ריפוי גני (Gene Therapy):
- זיהוי מוטציה ספציפית בעובר או בחולה
- תיקון המוטציה או הכנסת עותק תקין של הגן
- פוטנציאל לריפוי מחלות מונוגניות
נטרול גנים מזיקים:
- השתקת גנים סרטניים (אונקוגנים)
- שיבוש ביטוי של גנים הגורמים למחלה
ייצור חלבונים תרופתיים:
| חלבון | שימוש | שיטה ישנה | שיטה חדשה |
|---|---|---|---|
| אינסולין | טיפול בסוכרת | הפקה מלבלב חזירים | ייצור בחיידקים מהונדסים |
יתרונות הייצור בחיידקים:
- זול פי 600
- נקי יותר (ללא סיכון להעברת פתוגנים מחזירים)
- אספקה בלתי מוגבלת
שאלה שנשאלה: האם אפשר לבחור מאפיינים של תינוק (צבע עיניים, גובה)?
תשובה:
- טכנית - מתחיל להיות אפשרי במקומות מסוימים בעולם
- לא בישראל - אסור חוקית
- יש להבחין: בחירת עוברים (PGD) ≠ הנדסה גנטית
- PGD = בדיקה ובחירה של עובר קיים, לא שינוי הגנום
מחקר
- הבנת תפקודי גנים (Forward & Reverse Genetics)
- יצירת מודלים למחלות (עכברי Knockout)
- פיתוח טכנולוגיות חדשות
תעשייה
תעשיית מזון:
- ייצור אנזימים להכנת גבינות
- אנזימים לריכוך בשר
- אנזימים להצללת מיצים
תעשיות אחרות:
- אורגניזמים עם תכונות ייחודיות (למשל: צמחים זוהרים לנוי)
- ייצור חומרים ביולוגיים
שאלות אתיות (לדיון בשיעורים הבאים)
- מהם הסיכונים של שחרור אורגניזמים מהונדסים לסביבה?
- האם יש גבול למה שמותר לשנות בגנום האדם?
- מי מחליט אילו שינויים “לגיטימיים”?
- מהן ההשלכות החברתיות של היכולת “לעצב” צאצאים?
סיכום כללי
השיעור עסק במעבר משלושה מישורים:
-
מפרט לאוכלוסייה: הבנה שגנטיקה פועלת לא רק ברמת הפרט והמשפחה, אלא גם ברמת אוכלוסיות שלמות, עם דינמיקות ייחודיות.
-
מתכונות פשוטות למורכבות: רוב התכונות והמחלות אינן מונוגניות אלא משלבות השפעות של גנים רבים וגורמים סביבתיים.
-
מטבע למלאכותי: הידע הגנטי שנצבר מאפשר כיום התערבות מכוונת בגנום - הנדסה גנטית - עם יישומים בחקלאות, רפואה, מחקר ותעשייה.
נקודות מפתח:
- משוואות הארדי-ויינברג מאפשרות חישוב שכיחויות גנטיות, אך תקפות רק בתנאים מסוימים
- תכונות מורכבות דורשות גישות מחקר משולבות ומקשות על ניבוי
- הנדסה גנטית היא כלי, לא מטרה - המטרות (יבול, בריאות) זהות לשיטות קלאסיות
- לכל התערבות גנטית יש השלכות אתיות הדורשות דיון ציבורי
בשיעור הבא: טכנולוגיית CRISPR ויישומיה.
דור פסקל