מבוא לקורס
הקורס יכלול מספר הרצאות, עם הפוגות לשמירה על סדר נושאים קוהרנטי. כל מרצה מתמקד בתחום התמחותו.
הערה חשובה: לאורך ההרצאות, ייתכנו חזרות על נושאים שכבר נלמדו או שיילמדו בהמשך. החזרתיות מכוונת ומטרתה לחזק מושגים ולהציגם מכמה זוויות. הקורס מתמקד בעקרונות ובדוגמאות מרכזיות, מבלי להיכנס לעומק רב מדי בכל נושא.
מהו יצור חי?
[בשקופית מוצגים ארבעה פריטים ונשאלת השאלה מה יוצא דופן]
מה יוצא דופן בשקופית?
האבן היא היוצאת דופן כי היא אינה חיה.
הפעולה הזו, של זיהוי חיים, היא מורכבת. ביולוגים ופילוסופים יכולים לעסוק במשך שנים בשאלה: איך מגדירים מהו יצור חי ומה אינו חי? אין הגדרה מדויקת, כי לכל הגדרה יש יוצאים מן הכלל.
מהי ההגדרה של יצור חי?
“משהו שמתרבה” – זו תשובה נפוצה, אך יש יצורים חיים שאינם מתרבים. פרד, למשל, אינו יכול להתרבות, וברור שהוא חי. גם בני אדם לאחר גיל הפוריות הם עדיין יצורים חיים.
לכל הגדרה שתוצע – בין אם זו העברת מידע, מטבוליזם, או כל דבר אחר – תמיד ניתן למצוא יוצא מן הכלל שמראה שההגדרה אינה מספקת.
הבעיה בזיהוי חיים מחוץ לכדור הארץ היא הציפייה למצוא חיים כפי שהם מוכרים לנו. ייתכן שצורות חיים אחרות פועלות בצורה שונה לחלוטין. תיאוריה הנקראת “Assembly Theory” גורסת כי מה שמגדיר חיים הוא מורכבות – כאשר עוברים מספר מסוים של תגובות, ההסבר הסביר ביותר הוא קיום חיים, ולא תהליך אקראי.
חשיבות הממברנות
למרות הקושי להגדיר חיים באופן מדויק, יש דבר אחד משותף לכל היצורים החיים: כל אורגניזם וכל יצור חי, התאים שלו מוקפים בממברנה. מאפיין זה נפוץ ושמור בכל ממלכת החיים. הממברנות נראות דומות ופועלות בצורה דומה בכל היצורים החיים, מה שמרמז על התפתחות החיים מאב קדמון משותף.
מדוע ממברנות חיוניות לחיים?
התפקיד החשוב ביותר של הממברנה הוא הפרדה בין חוץ לפנים.
לא ניתן ליצור חיים ללא הפרדה זו. אם ניקח בריכה ענקית ונשפוך לתוכה DNA, DNA פולימראז וכל מה שדרוש לתא כדי לפעול – לא יקרה דבר, כי הבריכה גדולה מדי והחומרים לא ייפגשו זה את זה.
ההפרדה הזאת חיונית גם בתוך התאים. לדוגמה:
- ה-DNA נמצא בתוך הגרעין, מוקף בממברנה.
- מערכת החיסון מזהה DNA חופשי כסימן לפולש (כמו וירוס), ולכן חשוב שה-DNA יהיה מוקף ומוגן.
- המיטוכונדריה פועלת על מפל ריכוזים שנשמר הודות לממברנה.
- סינפסות עצביות משחררות וזיקולות (בועיות מוקפות ממברנה) עם נוירוטרנסמיטורים.
כל אלה מדגישים את חשיבות הממברנות לקיום החיים.
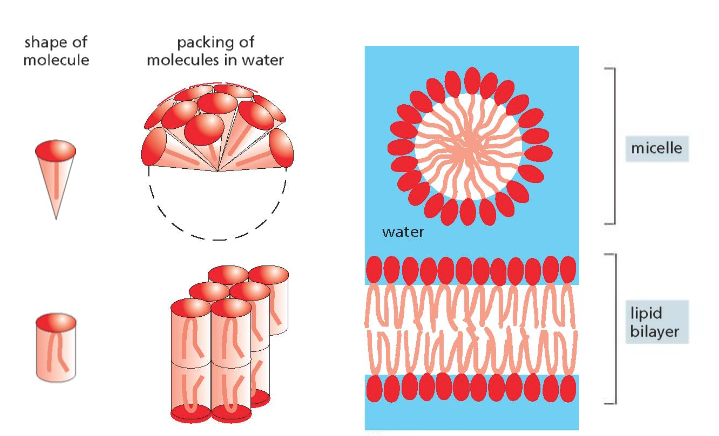
ליפיד ביילר (lipid bilayer) - המבנה הבסיסי של ממברנות
כעת נדון במאפייני הממברנות ולאחר מכן בחלבונים המשולבים בהן.
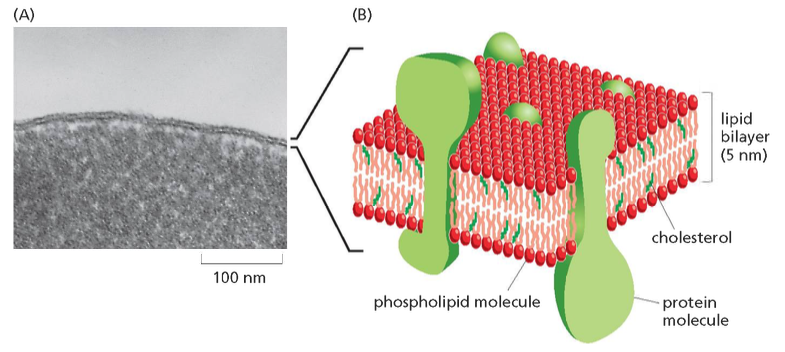
מבנה הליפיד ביילר
למרות שיש סוגים שונים של ממברנות עם תפקידים שונים, כולן נראות דומות למדי. המבנה הבסיסי הוא ליפיד ביילר (שכבה כפולה של ליפידים).
מה הרעיון כאן? רוב הגוף נמצא בסביבה מימית. הליפיד ביילר מורכב משתי שכבות:
- החלק החיצוני - פונה אל הסביבה המימית, הן מחוץ לתא והן בתוכו.
- החלק הפנימי - מורכב מהשומנים עצמם.
השומנים הם הידרופוביים (דוחים מים) ולכן אינם רוצים להיות בסביבה מימית. הם מעדיפים להיות בסביבה של שומנים אחרים. מבנה זה מסתדר בצורה ספונטנית: השומנים מתחברים זה לזה, והקבוצות הפולריות פונות לסביבה המימית.
כך זה נראה במיקרוסקופ אלקטרונים – ניתן לראות שתי שכבות כהות (אלקטרון-דנס) שהן שתי השכבות של הממברנה.
בגלל שהחלק הפנימי הוא שומני ודוחה מים, הממברנה אינה מאפשרת מעבר חופשי של מים ומולקולות מסיסות במים. זה מאפשר לממברנה לבצע את תפקידה העיקרי – הפרדה בין חוץ לפנים.
חלבוני ממברנה
הממברנות בתאים אינן מורכבות רק משומנים, אלא גם מחלבונים רבים שתקועים בתוכן. לחלבונים האלה יש מגוון גדול של תפקידים, והם חיוניים לתפקוד התא. התא זקוק לחלבוני הממברנה כדי לתקשר עם תאים אחרים, לשמור על מיקומו, ולבצע פעולות רבות אחרות.
פוספוליפידים - אבני הבניין של הממברנה
הליפיד ביילר מורכב בעיקר ממולקולות הנקראות פוספוליפידים. הן נקראות כך כי:
- יש להן אזור של קבוצת פוספט (בצבע צהוב בשקופית)
- יש להן אזור של ליפיד (שומן)
מהו בדיוק הליפיד? זוהי שרשרת של פחמימנים שהיא מאוד הידרופובית (דוחה מים). לעומת זאת, הראש של קבוצת הפוספט הוא פולרי, מרגיש בנוח בסביבה מימית, ואינו רוצה להיצמד לאזורים הידרופוביים.
פוספוליפידים - ראש פולרי (הידרופילי) וזנבות הידרופוביים
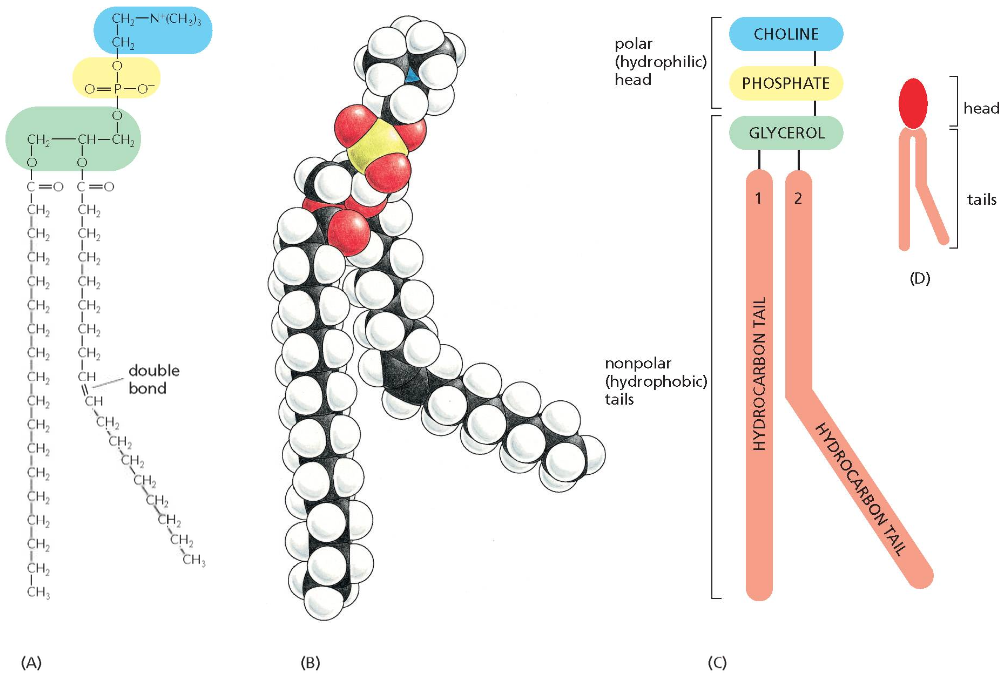
סוגי שרשראות שומן
הזנבות של הפוספוליפידים יכולים להיות משני סוגים עיקריים:
- שרשרת רוויה - אין בה קשרים כפולים והיא ישרה לחלוטין (שומן רווי במזון)
- שרשרת בלתי רוויה - יש בה קשרים כפולים והיא מעוקלת
ההבדל חשוב מאוד: כאשר השרשראות ישרות (רוויות), הן יכולות להיות מסודרות בצורה צפופה. זה יוצר ממברנה צמיגית, קשיחה ופחות גמישה.
\[\begin{array}{ccc} \vert & \hline & \\ \ce{CH2} & \ce{CH2} & \ce{CH2} \\ \vert & \hline & \\ \ce{CH2} & \ce{CH2} & \ce{CH2} \\ \end{array}\]לעומת זאת, כאשר השרשראות מעוקלות (בלתי רוויות), הן אינן יכולות להיות צפופות כל כך, מה שהופך את הממברנה לגמישה ולפלואידית יותר.
\[\begin{array}{ccc} & \ce{CH2} & \\ & \vert & \\ & \ce{CH2} & \\ & \vert & \\ & \ce{CH2} & \\ \end{array}\]יש לכך השלכות בריאותיות: צריכה של הרבה שומן רווי גורמת לכך שהתאים מכניסים לממברנה שומנים רוויים, ועל כן מאבדים מהגמישות שלהם. זה יכול לגרום לבעיות במעבר דם בעורקים, התקפי לב, שבץ ובעיות דומות.
כולסטרול בממברנה
בין הפוספוליפידים משתלבות גם מולקולות שומניות אחרות. הדוגמה הקלאסית היא כולסטרול.
הכולסטרול מורכב מחלק הידרופילי קטן וחלק שומני גדול. כאשר הכולסטרול נתקע בין הפוספוליפידים, הוא מוסיף להם חוזק. מדוע? כי השרשראות השומניות באופן טבעי נמצאות בתנועה מתמדת, והכולסטרול – שהוא קשיח יחסית – מונע מהן לזוז.
זו סיבה נוספת לכך שצריכת כולסטרול מופרזת או רמות גבוהות של כולסטרול בגוף עלולות להיות מסוכנות: הממברנות מאבדות מהפלואידיות שלהן, מה שמקשה על כדוריות הדם לעבור בנימי הדם הקטנים.
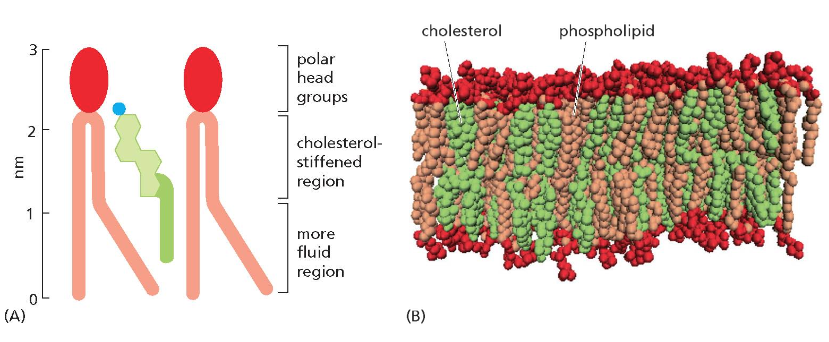
הכולסטרול מייצב את הממברנה
כולסטרול “טוב” וכולסטרול “רע”
חשוב להבין: ההבחנה בין כולסטרול “טוב” (HDL) וכולסטרול “רע” (LDL) נוגעת לאופן שבו הכולסטרול מועבר בזרם הדם, לא לכולסטרול עצמו.
הכולסטרול אף פעם לא מסתובב לבד בדם, אלא תמיד עם חלבונים. החלבונים הללו יכולים להופיע בצפיפות גבוהה (HDL) או בצפיפות נמוכה (LDL). ההבחנה בין טוב לרע מגיעה מקורלציה – אנשים בריאים בדרך כלל היו עם HDL גבוה, ואנשים חולים עם LDL גבוה.
HDL (High-Density Lipoprotein)
LDL (Low-Density Lipoprotein)
מערכת הכולסטרול בגוף מורכבת ומתוחכמת. היא התגלתה על ידי מייקל בראון וג׳וזף גולדשטיין בשנות ה-70 (זכו על כך בפרס נובל). הגוף מייצר כולסטרול וגם צורך אותו מהמזון. לפי כמות הכולסטרול בדם, התאים יודעים כמה כולסטרול לייצר או לפרק. כשיש יותר מדי כולסטרול, התא מאחסן אותו בבועיות שומן (ליפיד דרופלטס).
התארגנות עצמית של ממברנות
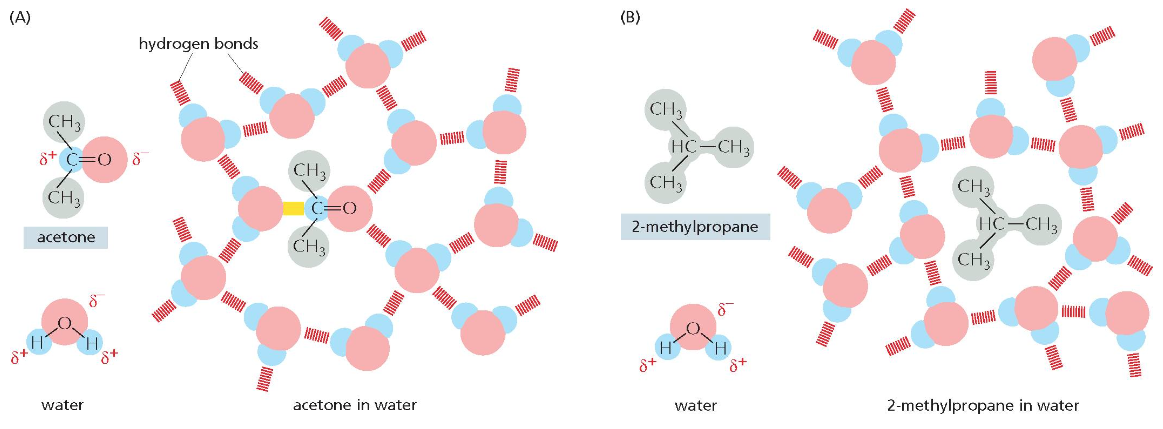
תכונה מדהימה של ממברנות, שמובילה חוקרים לחשוב שאולי חיים התחילו מממברנות ולא מ-DNA או RNA, היא שממברנות יכולות להיווצר באופן ספונטני.
כאשר יש מולקולה פולרית כמו אצטון, החמצן שבה מרגיש בנוח עם החמצן והמימנים של המים, ולכן אצטון מתערבב היטב במים. לעומת זאת, מולקולה הידרופובית כמו מתיל-פרופן לא תיצור אינטראקציה עם מים.
כלומר, כשיש מולקולות הידרופוביות בתוך מים, הן ינסו להתרחק ככל האפשר מהמים ולהתקרב זו לזו. זה קורה ללא השקעת אנרגיה – תהליך ספונטני.
בטבע, אורגניזמים תמיד שואפים להיות יעילים מבחינה אנרגטית. היעילות במערכת של ממברנות היא שלא צריך להשקיע אנרגיה כדי שהממברנות ייסגרו – הן פשוט מסתדרות מעצמן.
ניתן לראות זאת גם במערכות מלאכותיות כמו מיצלות (להלן), שבהן יש פוספוליפיד עם זנב אחד במקום שניים. כשמכניסים הרבה מולקולות כאלה למים, הן מסתדרות בצורת כדור שהצד הפנימי שלו הידרופובי והצד החיצוני פולרי. התהליך קורה מעצמו.
תכונה זו חשובה גם לתעשיית התרופות, שבה משתמשים בעקרון זה ליצירת מערכות להובלת תרופות.
מערכות שומניות מלאכותיות ושימושיהן
ליפוזומים ויישומים רפואיים
בתעשיית התרופות קיים אתגר משמעותי: לא ניתן לתת לבני אדם חומר שאינו מסיס במים. אם תרופה אינה מסיסה במים, יש שתי אפשרויות:
- להמיס אותה בשמן (פתרון בעייתי).
- למצוא דרך אחרת להעביר את התרופה.
אחד הפתרונות המוצלחים הוא שימוש במיצלות (micelles) – מבנים כדוריים המורכבים מפוספוליפידים עם זנב אחד. כאשר מכניסים תרופה הידרופובית למיצלה, היא נכנסת לחלק השומני הפנימי וכך ניתן להעביר אותה בגוף.
המיצלות נוצרות בתהליך של “מניפולציה” – לוקחים מולקולות פוספוליפידיות עם זנב אחד, ובתהליכים של חימום, קירור וניעור, המולקולות מוצאות זו את זו ומסתדרות באופן ספונטני למבנה כדורי.
לעומת זאת, כאשר משתמשים בפוספוליפידים עם שני זנבות, נוצר הליפיד ביילר (שכבה כפולה של שומנים) כמו שיש בממברנת התאים שלנו.
ליפוזומים
ליפוזום הוא מבנה מלאכותי לחלוטין המשמש בתעשיית התרופות. בניגוד למיצלה, שבה המרכז הוא הידרופובי (שומני), בליפוזום המרכז מכיל מים. הליפוזום מורכב משכבה כפולה של פוספוליפידים (ליפיד ביילר), בדומה לממברנה תאית, אך ללא חלבונים.
הליפוזומים שימושיים במיוחד כאשר רוצים להכניס לגוף חומרים הידרופיליים (מסיסים במים) שלא רוצים שיתפרקו בדרך. לדוגמה, בחיסון הקורונה, ה-mRNA מוכנס לתוך ליפוזומים כדי למנוע את פירוקו על ידי אנזימי RNase הנמצאים בזרם הדם. הליפוזומים מגנים על ה-mRNA עד שהם מתמזגים עם ממברנת התא ומשחררים את תוכנם לתוך התא.
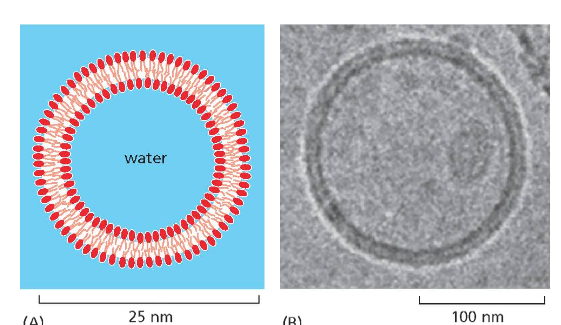
הליפוזומים שימשו גם למחקר בסיסי על ממברנות. בניגוד לתאים חיים, שהם מורכבים ודורשים תנאים מיוחדים, ליפוזומים הם מערכת פשוטה ומלאכותית שקל לחקור.
| מיצלה | ליפוזום |
|---|---|
| בנויה מפוספוליפידים עם זנב אחד | בנוי מפוספוליפידים עם שני זנבות |
| מרכז הידרופובי (שומני) | מרכז הידרופילי (מימי) |
מאפיינים פיזיקליים של ממברנות
פלואידיות של ממברנות
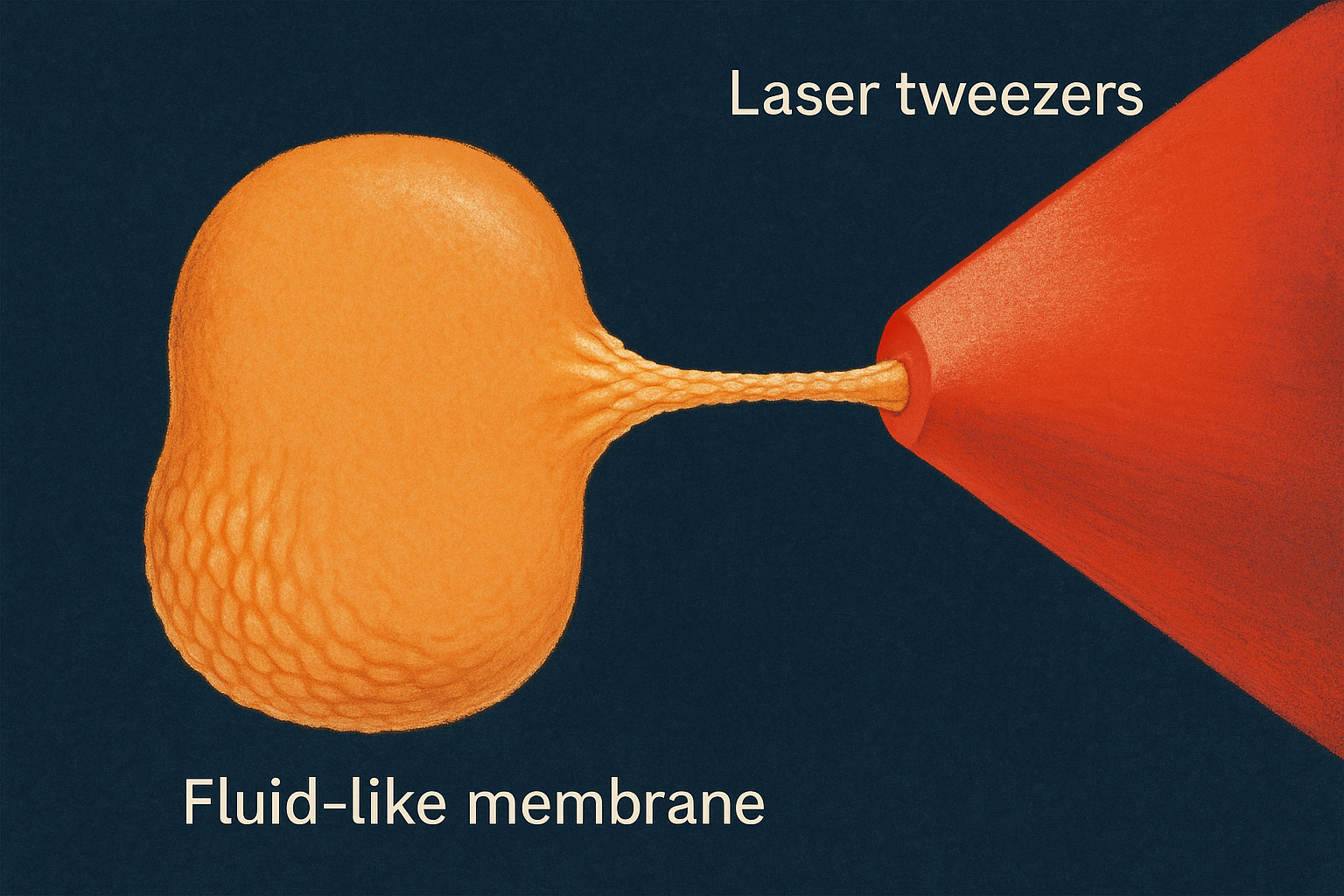
ממברנות מתנהגות כמו נוזל צמיג (fluid-like). זה נראה בניסוי עם “פינצטת לייזר” (Laser tweezers) – שיטה שזכתה בפרס נובל, המאפשרת לתפוס חלקיקים בסקאלה ננומטרית באמצעות קרן לייזר.
כאשר תופסים חלק מממברנה עם פינצטת לייזר ומושכים אותה, הממברנה נמתחת ואינה נשברת. זה מעיד על תכונות נוזליות של הממברנה – המולקולות בממברנה יכולות לנוע זו ביחס לזו. אם הממברנה הייתה מוצק, היא הייתה נשברת כשמושכים אותה.
הפלואידיות של הממברנה חשובה להבנת התנהגות החלבונים והמולקולות שנמצאות בה - הם אינם קבועים במקום, אלא יכולים לנוע בתוכה.
תנועת פוספוליפידים בממברנה
הדמיות מחשב מראות שפוספוליפידים בממברנה נמצאים בתנועה מתמדת. הם יכולים:
- לנוע אופקית בתוך אותו מישור של הממברנה.
- להסתובב במקומם.
- לעבור בין המישור החיצוני והפנימי של הממברנה (אם כי זה נדיר).
בנוסף, הממברנה אינה מישורית לגמרי – יש בה בליטות וכיפופים, והיא דינמית ונמצאת בתנועה מתמדת.
למה תאים לא מתמזגים באופן ספונטני?
אם פוספוליפידים נמשכים זה לזה, והממברנות נוטות להיסגר באופן ספונטני, מדוע תאים אינם מתמזגים ספונטנית זה עם זה?
הסיבה: כאשר תא מייצר פוספוליפידים, החלק הפולרי שלהם מיד נעטף במולקולות מים. כדי להזיז את מולקולות המים האלה, נדרשת השקעת אנרגיה. לכן, אם נביא שתי ממברנות קרובות זו לזו, לא יקרה דבר – שכבת המים תמיד מפרידה בין הראשים הפולאריים.
מיזוג ממברנות בתאים דורש תהליך אקטיבי, עם חלבונים מיוחדים והשקעת אנרגיה. טוב שכך, כי מיזוג ספונטני של ממברנות היה קטסטרופלי לחיים.
התאמת הממברנה לתפקיד ולסביבה
גודל התא וקביעתו
אחת השאלות המעניינות בביולוגיה היא: איך תא “יודע” באיזה גודל עליו להיות?
אין תשובה חד-משמעית לשאלה זו. הגודל הוא תוצאה של שילוב גורמים:
- יציבות אנרגטית
- הפעולה שהתא צריך לבצע
- סביבת התא
לדוגמה, בגוף האדם, התא הגדול ביותר הוא הביצית והקטן ביותר הוא תא דם אדום – שניהם תאים בודדים, אך בגדלים שונים מאוד. הגודל נקבע על ידי שיווי משקל בין המגבלות הפיזיקליות, הסביבה, והתפקיד שהתא צריך למלא.
התאמת הממברנה לטמפרטורה
יונקים משקיעים אנרגיה רבה כדי לשמור על טמפרטורה יציבה (כ-37 מעלות צלזיוס). לעומת זאת, צמחים, חיידקים ופטריות חשופים לשינויי טמפרטורה קיצוניים – מקפיאה בלילה ועד 40 מעלות ביום.
יצורים אלה צריכים להתאים את הרכב השומנים בממברנה שלהם בהתאם לסביבה:
- ארכאונים שחיים בתנאים קיצוניים (כמו בגייזרים של ילוסטון) בעלי שרשראות שומן ארוכות ורוויות, המעניקות לממברנה חוזק ועמידות לטמפרטורות גבוהות.
- יצורים שחיים מתחת לקרח באנטארקטיקה בעלי יותר חומצות שומן בלתי רוויות, המונעות מהממברנה לקפוא.
זאת דוגמה יפה להתאמה אבולוציונית של מבנה מולקולרי לסביבה.
הדמיית מחשב של ממברנות
הדמיות מחשב של ממברנות הן משימה מורכבת מאוד מבחינה חישובית. המערכת כוללת מספר עצום של מולקולות, וכל מולקולה יכולה להתנהג במספר דרכים. יצירת מודל מדויק דורשת כוח מחשוב אדיר.
ההדמיות מראות כי:
- חומצות שומן יכולות לנוע בחופשיות יחסית.
- מולקולות מים בדרך כלל אינן חודרות דרך הממברנה, אך לפי ההדמיה, מולקולה בודדת עשויה לעבור מדי פעם – אך הקצב איטי מאוד.
- ממברנות המכילות כולסטרול הן יציבות יותר, כיוון שמולקולות הכולסטרול מגבילות את תנועת השרשראות השומניות.
חשוב להבין שהסימולציות האלה מדמות רק כמה ננו-שניות של פעילות בזמן אמיתי. הדמיית שנייה אחת של פעילות ממברנה דורשת כוח מחשוב עצום!
הרכב הממברנה בסוגי תאים שונים
הטבלה שהוצגה מראה את הרכב הליפידים בממברנות של תאים שונים בגוף ומשווה אותם לחיידק האי-קולי (E. coli).
תאים שונים משלבים שומנים שונים בממברנה בהתאם לתפקידם ולסביבתם:
- תא פלזמה בכבד
- תא דם אדום
- מיאלין (העוטף נוירונים)
- מיטוכונדריה
- הרשתית האנדופלסמטית (ER)
- חיידק אי-קולי (E. coli)
נקודה מעניינת: באי-קולי אין כולסטרול כלל! זה אומר שהחיידק צריך למצוא דרכים אחרות להתמודד עם הצורך לייצב את הממברנה ולבודד אותה ממים.
מחקר על ספציפיות של חלבונים אנטי-מיקרוביאליים
דוגמה למחקר שבוצע על חלבונים אנטי-מיקרוביאליים שהגוף מייצר כדי להרוג חיידקים. השאלה הייתה: איך החלבונים האלה יודעים לפגוע דווקא בחיידקים ולא בתאי הגוף?
בניסוי ייצרו ליפוזומים מלאכותיים עם הרכבי שומנים שונים:
- ליפוזומים עם מטען חיובי (דומים לממברנות חיידקים)
- ליפוזומים עם מטען שלילי (דומים לממברנות של תאי הגוף)
בתוך הליפוזומים הוכנס חומר פלואורסצנטי שניתן למדידה. כאשר הוסיפו את החלבון האנטי-מיקרוביאלי (REG3α), רק הליפוזומים עם המטען החיובי נפגעו ושחררו את החומר הפלואורסצנטי. זה מסביר את הספציפיות של החלבון – הוא מזהה ממברנות עם מטען חיובי (כמו של חיידקים) ולא פוגע בממברנות עם מטען שלילי (כמו של תאי האדם).
סידור עצמי של פוספוליפידים
למרות שנאמר שפוספוליפידים אינם קשורים זה לזה ויכולים לנוע בחופשיות, יש תופעה מעניינת שמראה שהם יכולים ליצור סדר מסוים.
בניסוי לקחו שלושה סוגים שונים של פוספוליפידים וצבעו רק סוג אחד בצבע אדום. כאשר יצרו ליפוזום מסוג אחד בלבד, הצביעה האדומה הייתה אחידה בכל מקום.
אם פוספוליפידים נעים באופן רנדומלי לחלוטין, כשמוסיפים עוד שני סוגים לא צבועים, היינו מצפים לראות את אותו פיזור, רק בעוצמת צבע נמוכה יותר. אך במקום זאת, הליפידים הסתדרו במעין נקודות מרוכזות.
זה מעיד שפוספוליפידים יכולים ליצור סידור עצמי בצורה מסוימת. עדיין אין הסבר מלא לתופעה זו.
אחסון שומנים בתאים - אגלי שומן (Lipid Droplets)
תאים משתמשים בשומן למספר מטרות:
- כמקור אנרגיה
- ליצירת ממברנות
- כמולקולות להעברת אותות
כאשר יש בתאים יותר מדי שומן ואין להם מה לעשות איתו, הם אינם יכולים להשאיר אותו חופשי בציטופלזמה – הוא ייצור בעיות בגלל ההידרופוביות שלו. הפתרון: התא מכניס את השומן לתוך מבנים מיוחדים הנקראים “אגלי שומן” (Lipid Droplets).
אגלי שומן דומים למיצלות – יש להם שכבה חיצונית של פוספוליפידים עם זנבות הפונים פנימה, והחלק הפנימי מלא בשומן. זו דרך יעילה לאחסן שומן בתא.
הכבד, שמקבל את כל השומן מהמזון דרך וריד השער (Portal Vein), הוא האיבר העיקרי שמאחסן שומן. כאשר צופים בכבד במיקרוסקופ, אפשר לראות נקודות של שומן בתאים.

אסימטריה של ממברנות
עד כה דובר על ליפיד ביילר (שכבה כפולה של שומנים) מבלי להדגיש מספיק את ההבדלים בין החלק החיצוני לחלק הפנימי של הממברנה.
למעשה, שני צדי הממברנה אינם זהים – יש להם תכונות שונות. הסיבה לכך ברורה: הם חשופים לסביבות שונות לחלוטין.
- בתוך התא (הציטוזול): תנאים קבועים יחסית של pH וריכוז חומרים.
- מחוץ לתא (הנוזל הבין-תאי): סביבה שיכולה להשתנות מאוד ממקום למקום בגוף (מוח, לב, שריר וכו’).
התא מתמודד עם השוני בין הסביבות באמצעות מודיפיקציות שונות של הפוספוליפידים בכל צד של הממברנה.
גליקוליפידים ותפקידם במערכת החיסון
מבנה ותפקיד הגליקוליפידים
דוגמה קלאסית לשימוש בגליקוליפידים (ליפידים עם סוכרים) היא במערכת החיסון. כאמור, יש פוספוליפידים שיש להם סוכרים במקום קבוצות מסוימות.
מדוע הסוכרים האלה חשובים? המערכת החיסונית יודעת לזהות את הסוכרים האלה, והם משמשים כ”תעודת זהות” עבור המקרופאגים. הסוכרים מסמנים למקרופאגים “אל תאכל אותי” – כלומר, הם מסמנים את התאים כתאים של הגוף עצמו ולא כפולשים.
מנגנון “פליפ-פלופ” במוות תאי מתוכנן
כאשר תא עובר מוות תאי מתוכנן (אפופטוזיס) כי הוא מבין שעליו להתאבד כדי להציל את האורגניזם כולו, הממברנה מבצעת תהליך נקרא “פליפ-פלופ”: החלק החיצוני שלה הופך להיות פנימי, והחלק הפנימי הופך להיות חיצוני. כתוצאה מכך, הסוכרים נעלמים מהצד החיצוני של התא.
כאשר מקרופאג רואה ממברנה ללא סוכרים, הוא מיד מזהה זאת כסימן שעליו לבלוע את התא הזה ולפרק אותו. זוהי התנהגות אלטרואיסטית של התא – הוא מתאבד כדי להגן על האורגניזם כולו.
הגנה מפני וירוסים
נניח שתא נדבק בווירוס. וירוס מחוץ לתא לא יכול לעשות דבר; הוא אינו מתרבה או מבצע מטבוליזם לבד, וזו אחת הסיבות שווירוסים אינם נחשבים ליצורים חיים. הסכנה מתחילה כשהווירוס חודר לתא ומשתמש במערכות התא כדי לשכפל את עצמו.
כאשר וירוס נכנס לתא, קיימות מערכות שמזהות DNA ו-RNA זר בציטופלזמה. זיהוי כזה מפעיל שרשרת העברת אותות שגורמת לתא לבצע “פליפ-פלופ” בממברנה, להתאבד, ולאפשר למקרופאג לבלוע אותו ולחסל את הווירוס.
גם אם לפעמים נדבקים בווירוסים ונעשים חולים, זה לא אומר שהמערכת לא עובדת. למעשה, התחושות של מחלה (חום, עייפות וכו’) מעידות על כך שהמערכת החיסונית כן עובדת. העובדה שרוב האנשים מחלימים מהדבקות ויראליות מעידה על כך שהמערכת פועלת היטב.
יש לציין שאין הרבה תרופות נגד וירוסים, ואלה שיש (כמו תרופות ל-HIV) לא הורגות וירוסים אלא רק מעכבות את התרבותם. בדרך כלל ההחלמה מתרחשת הודות למערכת החיסון.
סוכרים על פני הממברנה
מיקום הגליקוליפידים
גליקוליפידים נמצאים רק בחלק החיצוני של הממברנה. זוהי תכונה נפוצה בכל היצורים האאוקריוטיים, אך אינה קיימת בחיידקים.
ישנם סוגים שונים של גליקוליפידים. לחלקם יש ראש מורכב עם הרבה סוכרים, ולאחרים יש רק סוכר אחד. הסוכרים יכולים להיות מסוגים שונים, כמו גלקטוז או חומצה סיאלית. תחום שלם בביולוגיה, הנקרא “גליקומיקס”, עוסק בחקר הסוכרים שנמצאים על תאים. תחום הגליקומיקס נמצא יחסית בחיתוליו, אך הבנה טובה יותר של הסוכרים הללו עשויה לשפוך אור על מחלות רבות.
מדוע הגליקוליפידים נמצאים רק בצד החיצוני?
הגליקוזילציה (הוספת סוכרים) נעשית רק בחלק הפנימי של הגולג׳י, אברון שבו מתבצעות מודיפיקציות לחלבונים ולשומנים לפני שהם נשלחים מחוץ לתא. בגלל האופן שבו בועיות מהגולג׳י מתמזגות עם ממברנת התא, הסוכרים תמיד מופנים כלפי חוץ. אין אפשרות שהם יופנו כלפי פנים.
דוגמה מהמעי
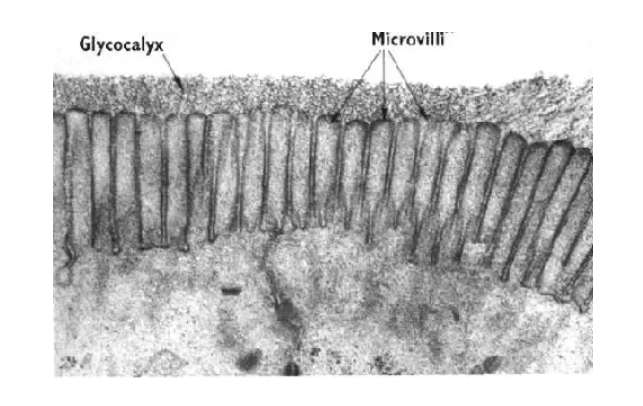
דוגמה מעניינת היא ממברנת תאי האפיתל במעי. תאי האפיתל של המעי מכוסים במיקרו-וילי, מבנים דמויי אצבע המגדילים את שטח הפנים כדי לספוג יותר נוטריינטים מהמזון.
על גבי הממברנה של תאי האפיתל יש סוכרים רבים (נראים בצבע מגורען בתמונות מיקרוסקופיות). הסוכרים האלה חשובים מאוד כי במעי יש טריליוני חיידקים, וירוסים ופטריות, ובכל זאת רוב האנשים אינם סובלים מדלקות כרוניות במעי. הסוכרים על הממברנה של תאי האפיתל יוצרים מעין מחסום, שמונע מחיידקים להגיע קרוב מספיק לממברנה כדי לפרוץ אותה.
חלבוני ממברנה - מבוא
תפקיד החלבונים בממברנה
הממברנה עצמה היא בעיקר חיץ, מחסום בין פנים התא לסביבתו החיצונית. היא אינה מבצעת פעולות אנזימטיות או קטליטיות בעצמה. כדי לבצע פעולות אקטיביות, התא זקוק לחלבונים שמשולבים בממברנה.
ישנן סיבות רבות מדוע התא זקוק לחלבוני ממברנה:
- כדי שהתאים יישארו במקומם הנכון ולא ינדדו באופן אקראי (חלבוני עיגון)
- כדי לחוש ולהגיב לשינויים בסביבה (רצפטורים)
- כדי להעביר חומרים דרך הממברנה (תעלות וטרנספורטרים)
מבנה חלבוני ממברנה
חלבונים טרנס-ממברנליים הם חלבונים שחודרים דרך הממברנה מצד אחד לצד השני. לכל החלבונים הטרנס-ממברנליים יש אזור שנקרא “דומיין טרנס-ממברנלי” שנמצא בתוך הממברנה (״תחום טרנס-ממברנלי״).
כפי שלמדנו, יש חומצות אמינו הידרופיליות וחומצות אמינו הידרופוביות. כאשר חלבון צריך להיות טרנס-ממברנלי, האזורים שיוצרים מבנים הידרופוביים יהיו תקועים בין הליפידים בממברנה, ואילו האזורים שיוצרים מבנים הידרופיליים יהיו בצד התוך-תאי או החוץ-תאי.
חלבוני ממברנה יכולים להיות בצורת אלפא-הליקס או בטא-ברל (״חבית״ בטא - β barrel). הצורה תלויה בתפקוד החלבון. כאשר יש מספר אזורים הידרופוביים והידרופיליים לסירוגין, זה בדרך כלל מצביע על חלבון שיוצר תעלה דרך הממברנה.
ישנם גם חלבונים שאינם חלבוני טרנס-ממברנליים, אך הם עדיין נחשבים לחלבוני ממברנה כי הם מקושרים אליה. למשל, חלבונים שמקושרים לממברנה על ידי סוכרים, או חלבונים שמקושרים לחלבונים אחרים שנמצאים בממברנה.
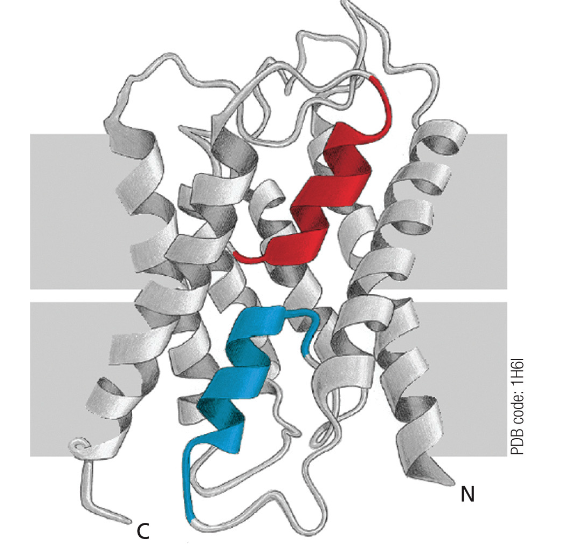
סוגים שונים של חלבוני ממברנה
ישנם חלבונים שעוברים את הממברנה פעם אחת, ויש כאלה שעוברים אותה מספר פעמים. מדען יכול לנבא מהרצף של החלבון האם הוא טרנס-ממברנלי וכמה פעמים הוא יעבור את הממברנה.
הניבוי נעשה באמצעות “אינדקס הידרופובי” – סולם שמודד את מידת ההידרופוביות של חומצות האמינו. כל מה שנמצא מעל הערך 0 הוא הידרופובי (צריך אנרגיה כדי להיות במים), וכל מה שנמצא מתחת ל-0 הוא הידרופילי.
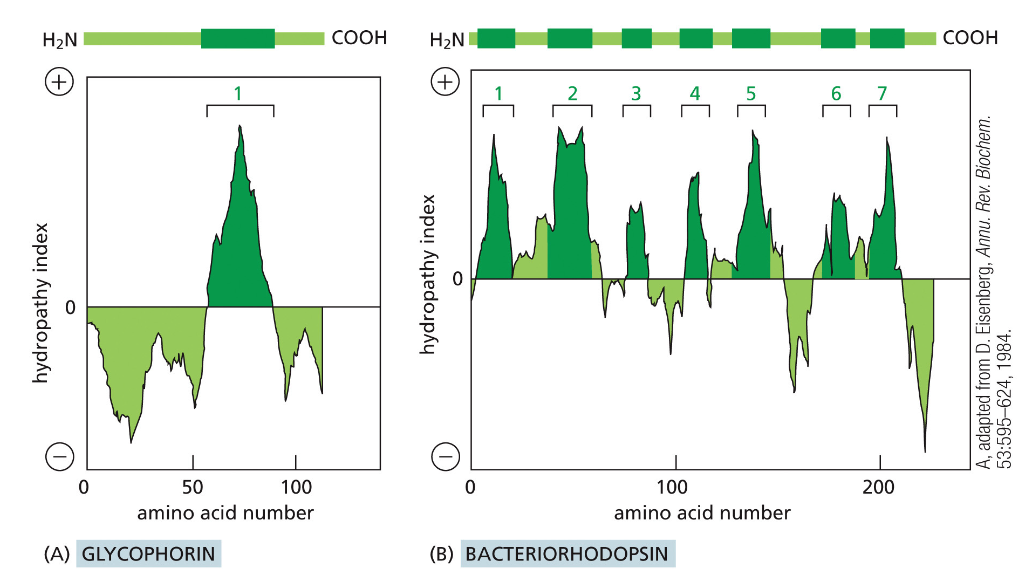
כך, למשל, חלבונים עם אזור הידרופובי אחד יעברו את הממברנה פעם אחת, ואילו חלבונים עם מספר אזורים הידרופוביים יעברו את הממברנה מספר פעמים.
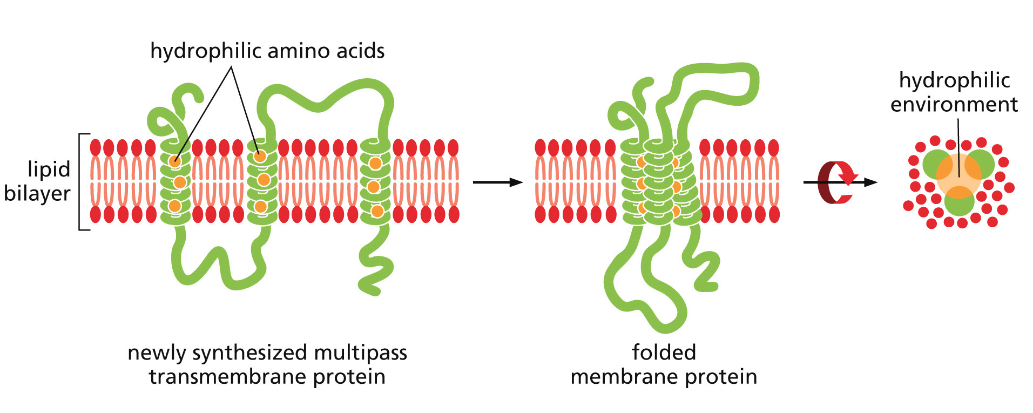
תעלות מים (אקוואפורינים)
למרות שהממברנה הידרופובית, מים בכל זאת עוברים דרכה. איך זה קורה?
התשובה היא תעלות חלבון מיוחדות שנקראות אקוואפורינים. בתעלות אלה יש חומצות אמינו פולריות שנמצאות במקום מסוים בתעלה.
כאשר מסתכלים על חתך של אקוואפורין, רואים שלושה סלילים (אלפא-הליקסים) ובכל סליל יש כמה שיירים (צדדים של חומצות אמינו) שכולם פונים לאותו כיוון. כאשר החלבון מתקפל בתוך הממברנה, האזורים ההידרופוביים נמצאים בחוץ (באינטראקציה עם הליפידים), והשיירים ההידרופיליים נמצאים בפנים, בתוך התעלה. כך נוצר מסלול בטוח למעבר מים.
רודופסין - חלבון ממברנה שמגיב לאור
רודופסין הוא חלבון שנמצא בחיידקים ומגיב לאור. הוא עובר את הממברנה מספר פעמים, ובמרכזו יש שייר שנקרא רטינל.
כאשר פוטון של אור פוגע ברטינל, אחת מחומצות האמינו של הרטינל עוברת שינוי מבני, וכתוצאה מכך משתנה צורת המולקולה כולה. השינוי של הרטינל גורם לשינויים קונפורמציוניים בצורת החלבון.
בשינוי צורה זה, החלבון משחרר פרוטון (יון מימן) לצד אחד של הממברנה ואז יכול לקלוט פרוטון אחר מהצד השני.
רודופסין משמש גם בטכניקה מחקרית שנקראת אופטוגנטיקה. בשיטה זו, מייצרים למשל עכבר טרנסגני שנוירונים מסוימים שלו מבטאים את הרודופסין. כאשר מאירים על האזור הזה באור באורך גל מסוים, התעלה נפתחת והנוירון יורה. כך אפשר לבדוק האם הנוירונים האלה אחראים על התנהגות מסוימת, כמו רצון לאכול, התמכרות או דיכאון.
איך חלבוני ממברנה מגיעים לממברנה?
חלבונים ממברנליים לא נוצרים בציטופלזמה ואז מגיעים לממברנה. הם עוברים סינתזה ישירות בממברנה של הרשתית האנדופלסמטית (ER), ומשם הם עוברים על גבי וזיקולות דרך הגולג׳י ומגיעים לממברנת התא כשהם כבר תקועים בתוך הממברנה של הבועית.
גליקוזילציה של חלבונים וסוגי דם
סוכרים על חלבונים וזיהוי עצמי
כפי שנאמר שעל פוספוליפידים יכולים להיות סוכרים, גם על חלבונים יכולים להיות סוכרים. כאשר סוכרים אלה פונים החוצה, הם עוזרים לגוף לזהות האם מדובר בתא שלו או לא.
דוגמה קלאסית לכך היא סוגי הדם במערכת ABO. מה זה בעצם ABO? אלו סוכרים שונים שנמצאים על גבי חלבונים בממברנת תאי הדם האדומים, ומאפשרים למערכת החיסונית לזהות האם התא הזה הוא של הגוף או לא.
מערכת הדם ABO היא דוגמה טובה לכך שהסוכרים עוזרים להבחין בין תאים של הגוף לתאים זרים. הבעיה היא שזה מקשה כאשר רוצים לעשות תרומת דם, כי אם נקבל דם מסוג שונה משלנו, המערכת החיסונית תזהה אותו כזר ותתקוף אותו.
ניידות חלבונים בממברנה
ניסויי פיוז’ן (מיזוג תאים)
כפי שנאמר, הפוספוליפידים יכולים לנוע בצורה יחסית חופשית בממברנה, אך לפעמים הם גם יוצרים צברים (אגרגטים). באופן דומה, גם חלבוני ממברנה יכולים לנוע בצורה חופשית בממברנה – אם כי לא כולם.
כדי להוכיח זאת, נערך ניסוי שבו לקחו תא אנושי ותא עכבר וביצעו מיזוג (פיוז’ן) ביניהם. את חלבוני הממברנה של התא האנושי צבעו באדום, ואת אלו של העכבר בירוק.
מיד לאחר המיזוג, ניתן היה לראות בבירור את החלק של התא שהגיע מהאדם ואת החלק שהגיע מהעכבר, כל אחד בצבע אחר. אך לאחר כמה שניות, הצבע האדום והירוק התפשטו בכל היקף התא הממוזג. זה מעיד על כך שהחלבונים יכולים לנוע בצורה חופשית בממברנה, ולאחר המיזוג הם התפזרו בכל שטח הממברנה.
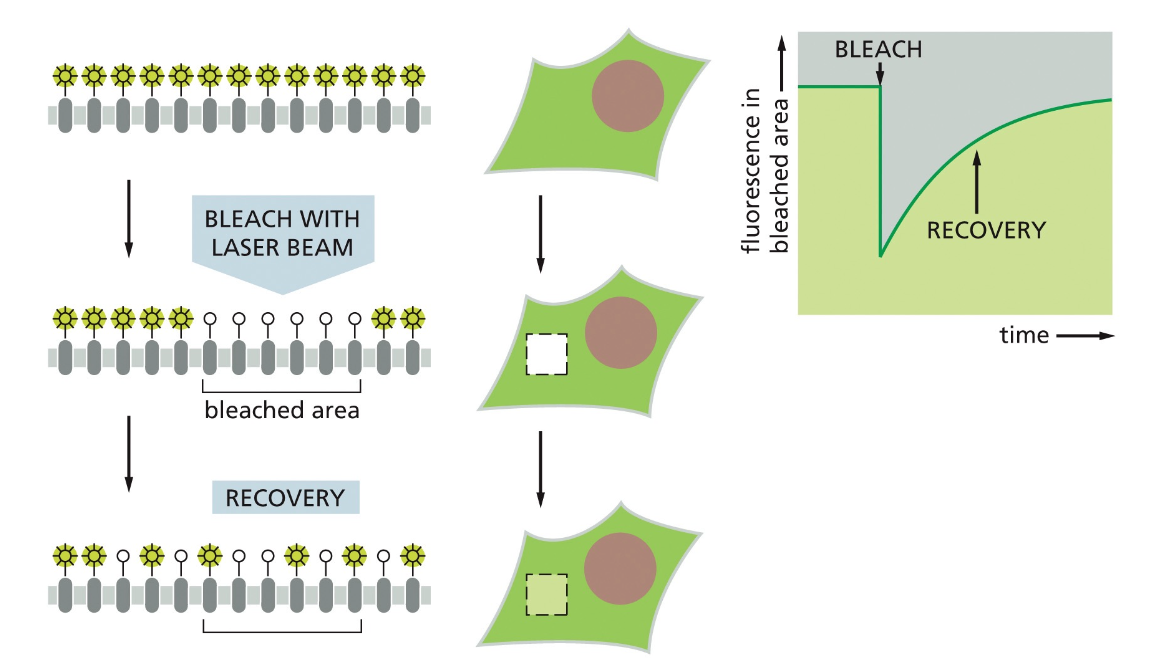
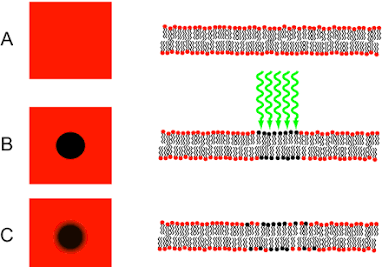
ניסויי FRAP
טכניקה נוספת להדגמת ניידות חלבונים בממברנה היא FRAP (Fluorescence Recovery After Photobleaching).
בשיטה זו מייצרים חלבונים ממברנליים שמחוברים למולקולה פלואורסצנטית (מפיקה אור). באמצעות קרן לייזר מדויקת, מבצעים “הלבנה” (photobleaching) – שריפה של היכולת של החלבונים באזור מסוים לפלוט אור.
אם החלבונים יכולים לנוע בחופשיות בממברנה, יתרחש תהליך של “התאוששות” (recovery) – חלבונים פלואורסצנטיים מאזורים אחרים בממברנה ינועו לאזור ה”הלבנה” וימלאו את ה”חור” שנוצר.
בסרטון שהוצג, ניתן לראות תא לפני ההלבנה, אחרי ההלבנה (כשנוצר אזור חשוך), ואז אחרי כמה שניות רואים שחלבונים מאזורים אחרים הגיעו וסגרו את החור.
חשוב להבהיר: הלייזר לא פגע בכל החלבונים בממברנה, רק באלו שבאזור ממוקד. החלבונים שעברו הלבנה עדיין מתפקדים, הם רק איבדו את היכולת לפלוט אור. מה שרואים בהתאוששות הוא חלבונים אחרים, שלא עברו הלבנה, שהגיעו לאזור בגלל תנועה חופשית (דיפוזיה).
מדידת קצב ההתאוששות מאפשרת לחוקרים לחשב את מקדם הדיפוזיה של החלבון, כלומר כמה מהר הוא יכול לנוע בממברנה.
 דור פסקל
דור פסקל