תוכן עניינים:
- חזרה: מבנה הגנום
- שונות גנטית בין בני אדם
- סוגי פולימורפיזם
- מוטציות
- סוגי מוטציות
- השפעת מוטציות על תפקוד
- מוטציות לא תמיד רעות
- מנגנוני תיקון DNA
- מנגנוני תיקון לנזק חד-גדילי
- מנגנוני תיקון לשבר דו-גדילי
- טרנסלוקציות כרומוזומליות
- התפתחות סרטנית
- סיכום - נקודות מפתח
- שאלות מג׳ונרטות
חזרה: מבנה הגנום
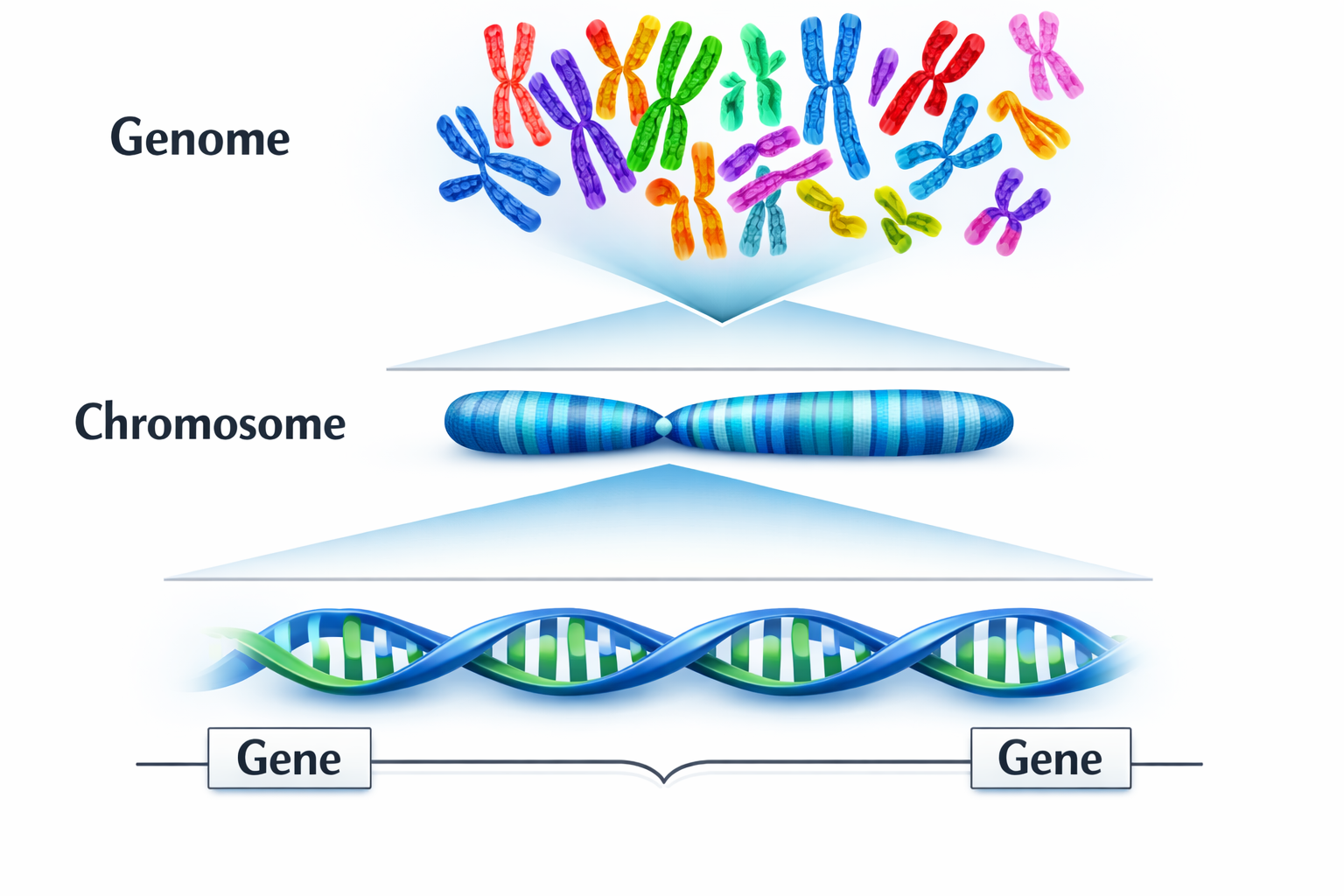
היררכיית המידע הגנטי
Genome → Chromosomes (23 pairs = 46) → Genes → Nucleotides
 |  |
הגדרת גן
גן = מקטע DNA עם:
- פרומוטור - נקודת התחלה (אזור בקרה)
- רצף מקודד - המידע עצמו
- סטופ קודון - נקודת סיום
חשוב: רוב הגנים מקודדים לחלבונים, אבל יש גנים שמקודדים ל-RNA שלא הופך לחלבון (tRNA, rRNA, microRNA).
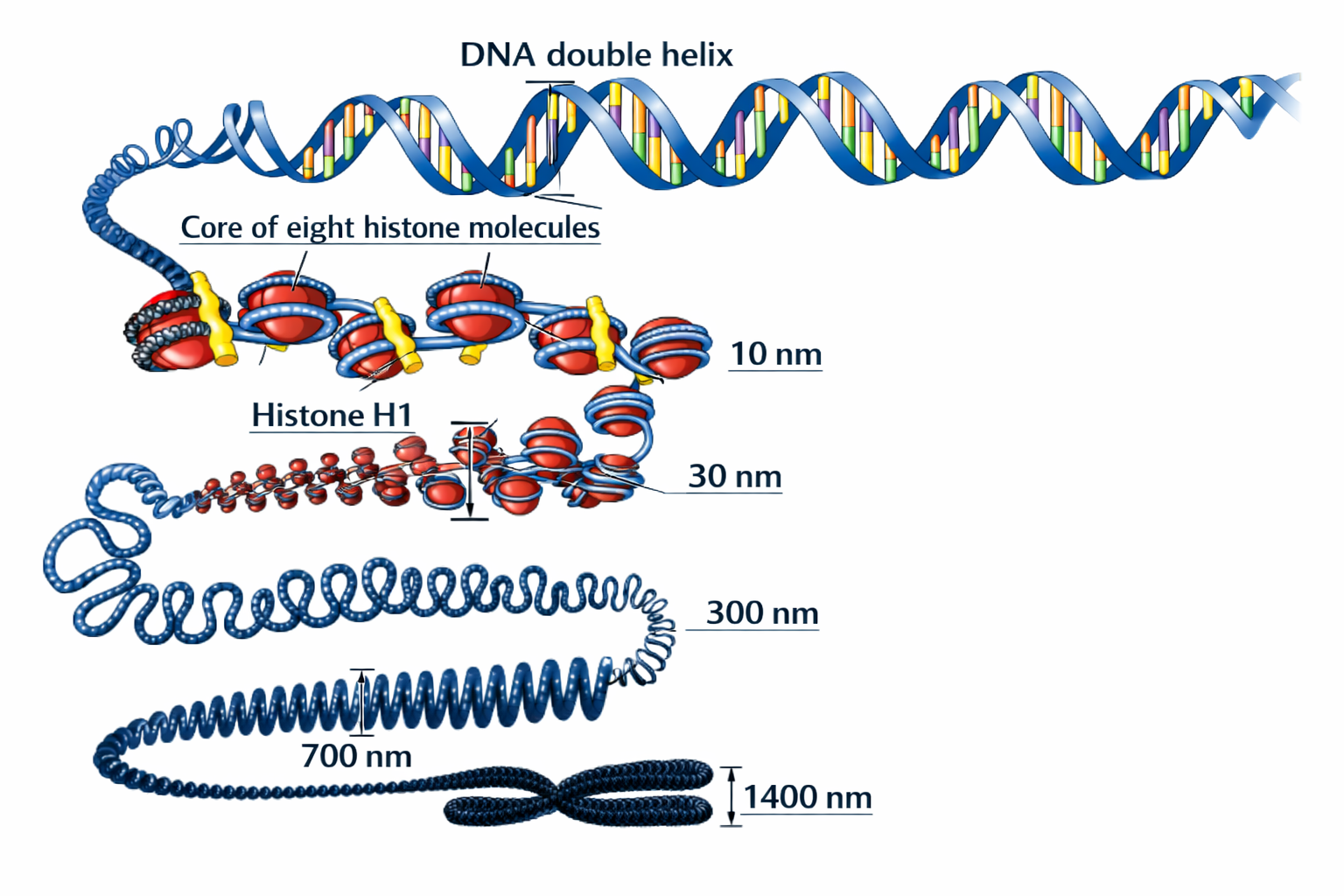
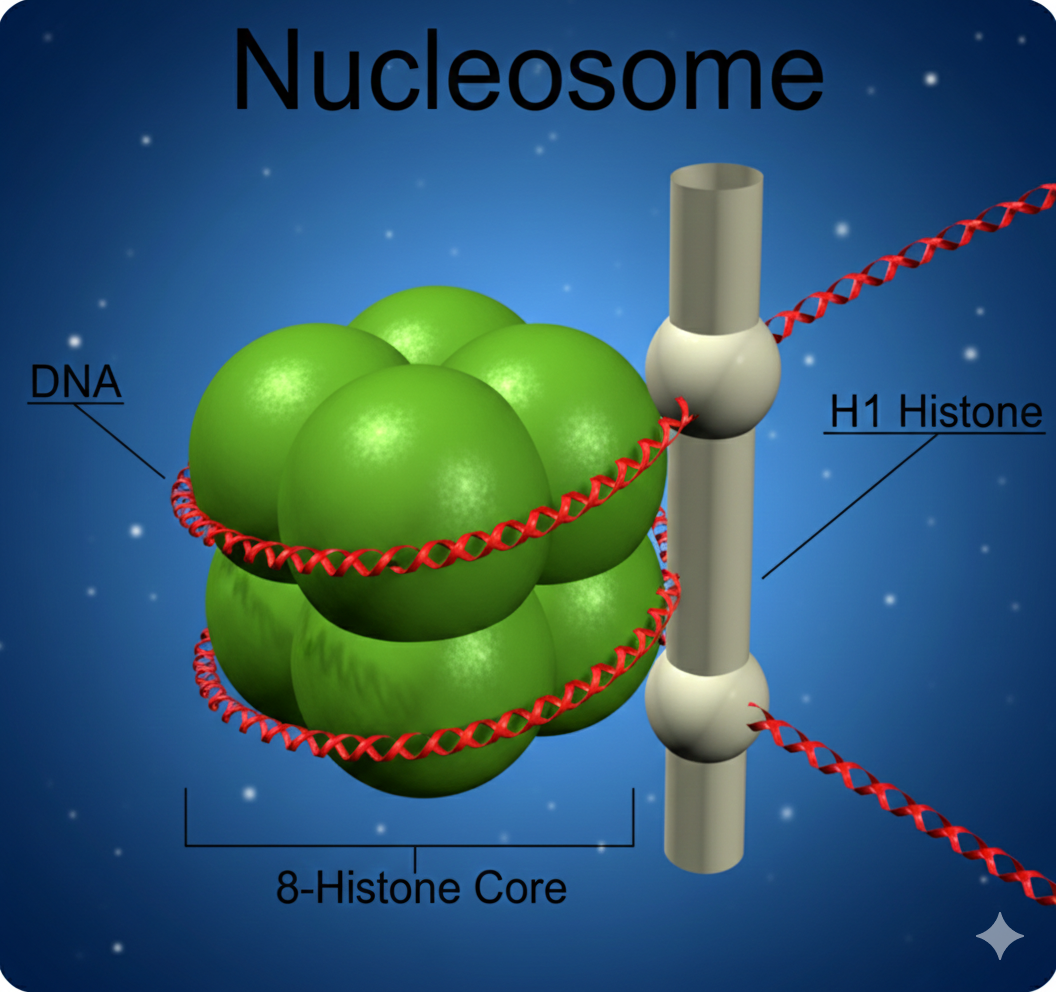
אריזת ה-DNA
- DNA נכרך סביב היסטונים (8 היסטונים = נוקלאוזום)
- כרומטין צפוף (Heterochromatin) ← DNA לא נגיש לשעתוק
- כרומטין פרוס (Euchromatin) ← DNA נגיש לשעתוק
- מודיפיקציות אפיגנטיות (מתילציה, אצטילציה) משפיעות על הצפיפות
שונות גנטית בין בני אדם
כמה אנחנו דומים?
| מדד | ערך |
|---|---|
| דמיון גנטי בין בני אדם | 99.9% |
| שונות גנטית | 0.1% |
| תדירות השוני | בסיס אחד שונה לכל 1,500~ בסיסים |
סוגי השונות הגנטית
1. אללים (Alleles)
- גרסאות שונות של אותו גן
- מקודדים לחלבונים שונים מעט
- דוגמה: אללים A ו-B בסוג דם
2. פולימורפיזם (Polymorphism)
- הבדלים ברצף ה-DNA שלא בהכרח מתבטאים בפנוטיפ
- רוב השינויים באזורים לא מקודדים
- פעם קראו לאזורים האלה “Junk DNA” - היום יודעים שיש להם תפקידים
הערה: בפרק של פודקאסט מומלץ ששמעתי (גיקונומי), המרואיין סיפר שמי שבחר את השם במכוון בחר “Junk” ולא “Garbage”, כי “Garbage” זה משהו שאין לו שום תפקיד, בעוד ש”Junk” זה משהו שאולי יהיה לו תפקיד כלשהו אבל אנחנו בעיקר שומרים במחסן. כלומר, הוא לא בהכרח בחר את השם מתוך מחשבה שהמקטעים האלה חסרי ערך, ממה שהבנתי.
3. מוטציות (Mutations)
- שינויים ברצף ה-DNA כתוצאה מגורם חיצוני או פנימי
- עשויים לגרום לפגיעה בתפקוד
- יכולים להיות גם שליליים וגם חיוביים (התאמה לסביבה)
סוגי פולימורפיזם
SNP - Single Nucleotide Polymorphism
הגדרה: שינוי של נוקלאוטיד בודד בין אנשים שונים באוכלוסייה.
מאפיינים:
- כ-18 מיליון אתרי SNP בגנום האנושי
- יכול להיות באזור מקודד או לא מקודד
- לרוב אין פנוטיפ בולט
דוגמה:
person A: ...ATCGATCG...
person B: ...ATCAATCG...
↑
SNP
VNTR - Variable Number of Tandem Repeats
הגדרה: מספר משתנה של רצפים חזרתיים באוכלוסייה.
מאפיינים:
- מעל 40% מהגנום מכיל רצפים חזרתיים
Microsatellites(STR) - פחות מ-10 בסיסיםMinisatellites- 60-10 בסיסים- השוני הוא במספר החזרות, לא ברצף עצמו
דוגמה:
person A: ...(CAG)₇... ← 7 repetitions
person B: ...(CAG)₁₃... ← 13 repetitions
person C: ...(CAG)₁₆... ← 16 repetitions
הערה: כאשר VNTR מופיע באזור מקודד או באזור בקרה חשוב, זה יכול לגרום למחלה (למשל: תסמונת X השביר).
מוטציות
גורמים למוטציות
גורמים חיצוניים
| גורם | סוג הנזק |
|---|---|
| קרינת UV | דימרים של T |
| קרינת רנטגן | שברים בגדיל |
| חומרים כימיים (קרצינוגנים) | שינויים בבסיסים |
| וירוסים | הכנסת רצפים זרים |
גורמים פנימיים
| גורם | הסבר |
|---|---|
| טעויות בשכפול | הגורם מספר 1! |
| רדיקלים חופשיים | נזק חמצוני |
| דלקות כרוניות | שינויים בסביבה התאית |
חשוב: לא ניתן להימנע לחלוטין ממוטציות. טעויות בשכפול הן הגורם העיקרי (כ-10¹⁸ מוטציות ביום לאדם!).
למה חשיפת עוברים לקרינה מסוכנת במיוחד?
- תאים בחלוקה מהירה
- מוטציה בתא אחד ← כל התאים שיתפתחו ממנו יהיו עם הנזק
- פחות זמן לתיקון
סוגי מוטציות
לפי סוג השינוי
| סוג | תיאור |
|---|---|
| Substitution | החלפת בסיס אחד באחר |
| Insertion | הוספת בסיס/ים |
| Deletion | חסר של בסיס/ים |
| T-Dimer | קשר לא תקין בין שני T על אותו גדיל |
מוטציות נקודתיות - ההשלכות
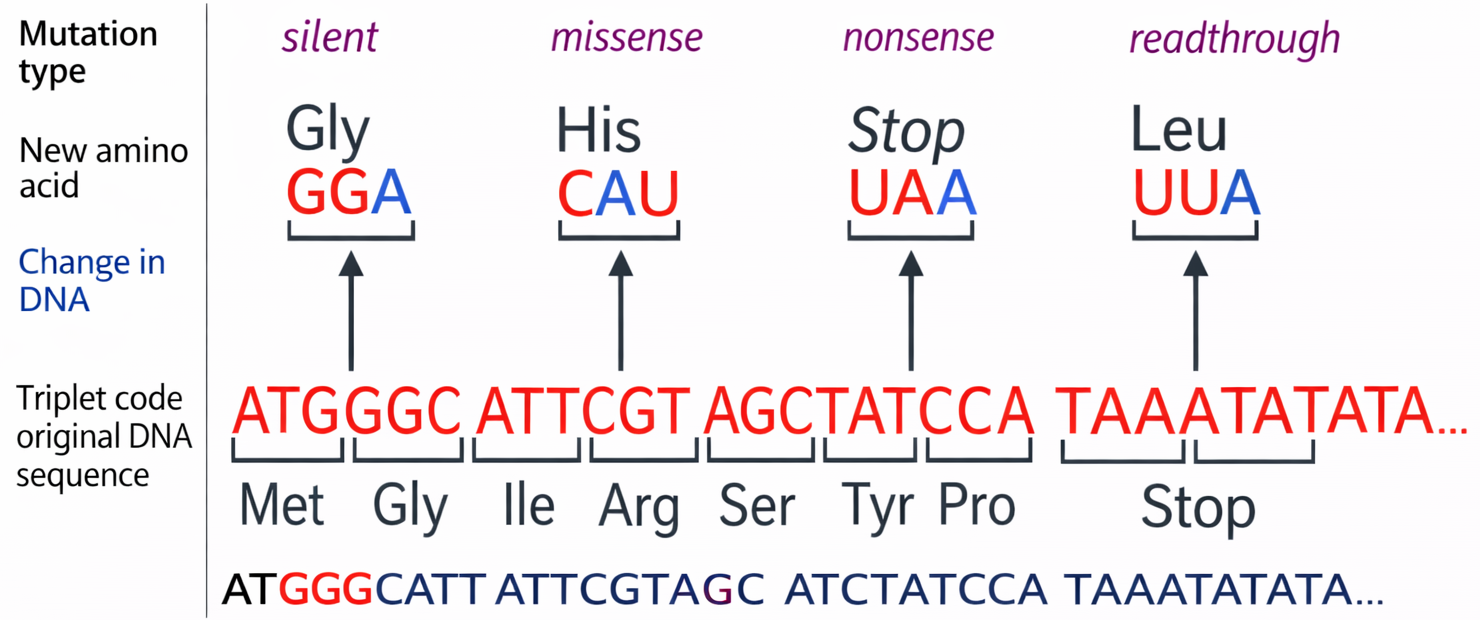
1. Silent Mutation (מוטציה שקטה)
\[\ce{UGC (Cys) -> UGU (Cys)}\]שתיהן מקודדות ל-Cysteine ← אין שינוי בחלבון.
2. Missense Mutation (מוטציה חסרת הגיון)
\[\ce{UGC (Cys) -> UCG (Ser)}\]שינוי בחומצה אמינית אחת ← עשוי לפגוע בתפקוד החלבון.
3. Nonsense Mutation (מוטציה ללא הגיון)
\[\ce{UGC (Cys) -> UGA (STOP)}\]יצירת סטופ קודון מוקדם ← חלבון קצר/לא מתפקד.
4. Readthrough Mutation (מוטציית פריצת דרך)
\[\ce{UGA (STOP) -> UGC (Cys)}\]סטופ קודון הופך לחומצה אמינית ← חלבון ארוך מדי.
Frameshift Mutation (הזזת מסגרת קריאה)
כאשר יש הוספה או חסר של בסיס/ים (לא כפולה של 3):
original: AUG-GCA-UGC-UAA
adding A: AUG-AGC-AUG-CUA-A...
↑
כל הקודונים השתנו!
הנזק הכי חמור: כל הרצף מנקודת המוטציה משתבש.
השפעת מוטציות על תפקוד
Loss of Function (אובדן פעילות)
- החלבון לא מתפקד או לא נוצר
- בדרך כלל רצסיבי - צריך ששני האללים יהיו פגומים
- דוגמה: מוטציה שמשבשת אתר פעיל של אנזים
Gain of Function (עודף פעילות)
- החלבון פעיל יתר על המידה
- בדרך כלל דומיננטי - מספיק אלל אחד פגום
- דוגמה: מוטציה באזור בקרה שמונעת קישור רפרסור
| סוג | דומיננטיות | דרישה |
|---|---|---|
| Loss of Function | רצסיבי | שני אללים פגומים |
| Gain of Function | דומיננטי | אלל אחד פגום |
מוטציות לא תמיד רעות
יתרון אבולוציוני
מוטציות הן הבסיס לאבולוציה ולהתאמה לסביבה.
דוגמה מחיידקים: חשיפה למוטגנים ← מוטציות ← חלקן מקנות עמידות לאנטיביוטיקה.
דוגמה: אנמיה חרמשית (Sickle Cell Anemia)
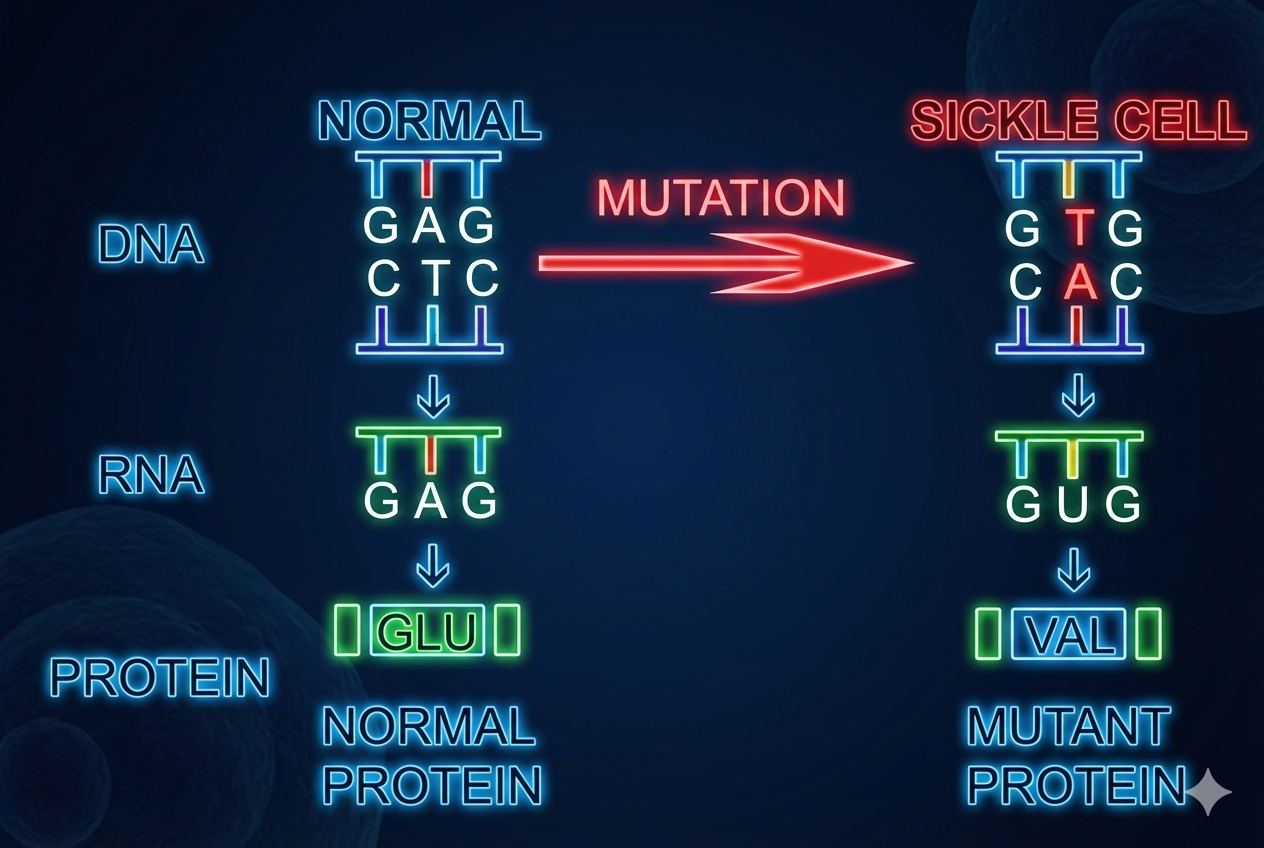
המוטציה:
- שינוי נקודתי בגן ההמוגלובין
- במקום Glutamic Acid, בגלל המוטציה, נכנס Valine
- משנה את צורת כדוריות הדם האדומות לצורה של חרמש
החיסרון:
- כדוריות דם לא תקינות
- סיכון לחסימות בכלי דם
- אנמיה
היתרון:
- עמידות למלריה!
- טפיל המלריה לא יכול להתפתח בתאים עם המוטציה
- שכיחות גבוהה באזורים עם מלריה אנדמית
עסקת חבילה: יתרון אבולוציוני אחד יכול לבוא עם חיסרון אחר.
מנגנוני תיקון DNA
עקרונות כלליים
כל מנגנון תיקון כולל שלושה שלבים:
- זיהוי ועצירה - זיהוי הנזק ועצירת מחזור התא
- תיקון - תיקון הנזק בהתאם לסוג
- אפופטוזיס - אם התיקון נכשל ← מוות תאי מתוכנת
נקודות בקרה במחזור התא
| נקודה | שלב | מה נבדק? |
|---|---|---|
| G1 Checkpoint | לפני S | האם התא גדול מספיק? יש נוטריאנטים? |
| G2 Checkpoint | אחרי S | האם ה-DNA החדש תקין? |
| M Checkpoint | מיטוזה | האם הכרומוזומים מחוברים לציר? |
P53 - “שומר הגנום”
חלבון P53 יושב על הצומת של שלושת המנגנונים:
- זיהוי נזק ועצירת מחזור התא
- גיוס מנגנוני תיקון
- הפעלת אפופטוזיס אם התיקון נכשל
מנגנוני תיקון לנזק חד-גדילי
1. BER - Base Excision Repair
מתי: נזק לבסיס בודד (קרינת רנטגן, רדיקלים חופשיים)
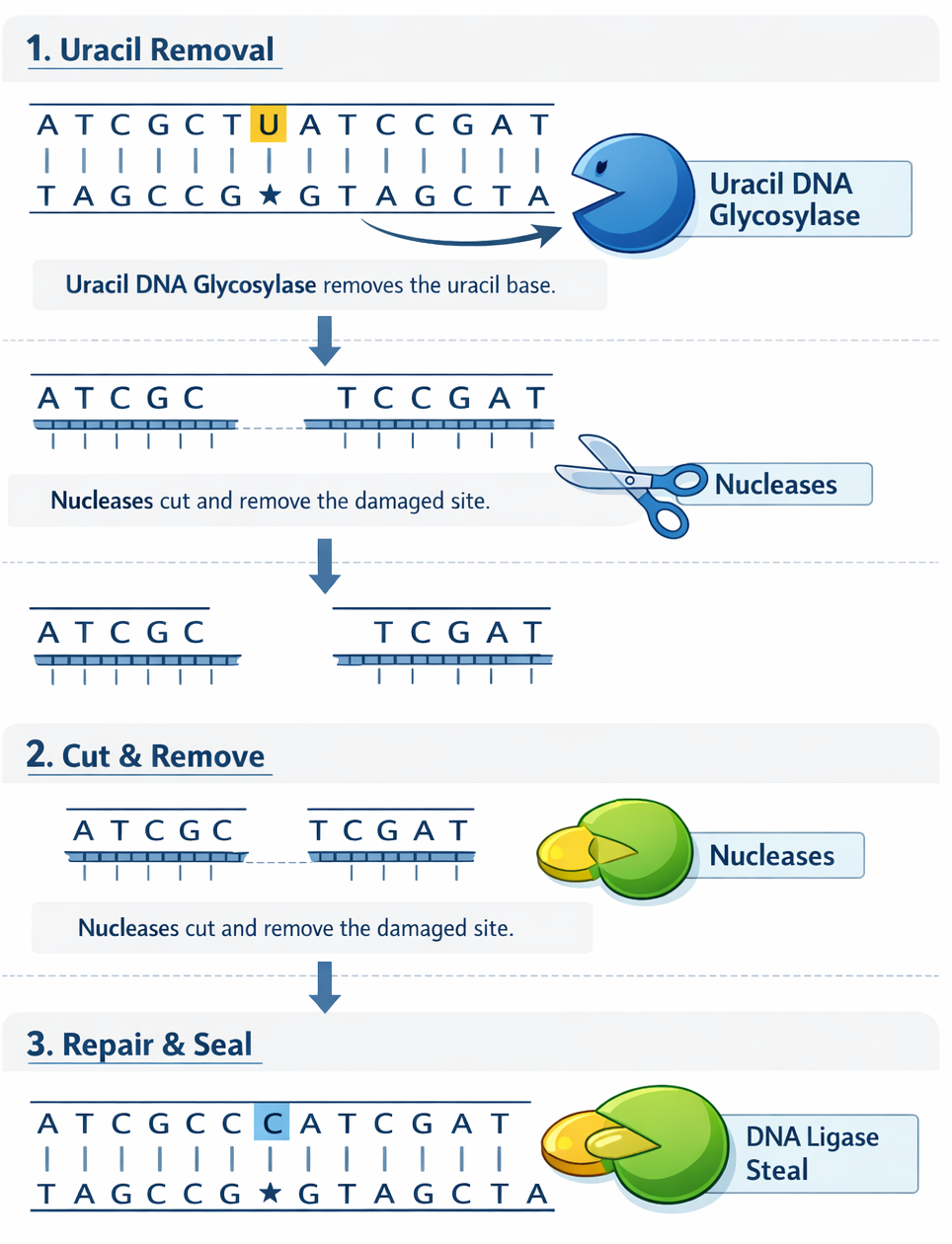
שלבים:
- DNA Glycosylase - מזהה ומוציא את הבסיס השגוי
- Nuclease - מפרק עוד כמה בסיסים משני הצדדים
- DNA Polymerase - מסנתז רצף חדש
- Ligase - מדביק את הרצף החדש
נזק ← זיהוי ← הוצאת בסיס ← פירוק נוסף ← סינתזה ← הדבקה
2. NER - Nucleotide Excision Repair
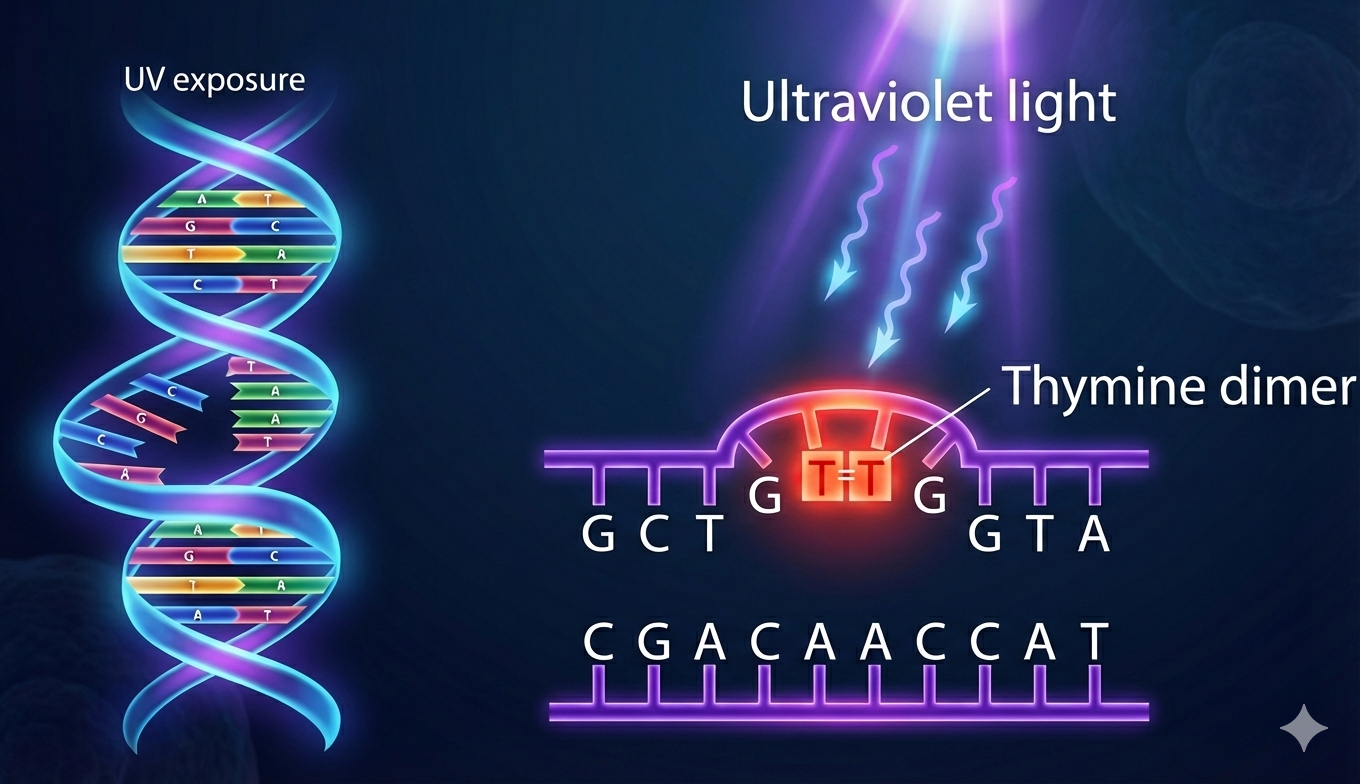
מתי: דימרים של T (קרינת UV), עיוותים מבניים
מאפיינים:
- מתקן קטעים של 32-24 בסיסים
- בעיקר באאוקריוטים
- יכול לפעול גם על גנים בזמן שעתוק
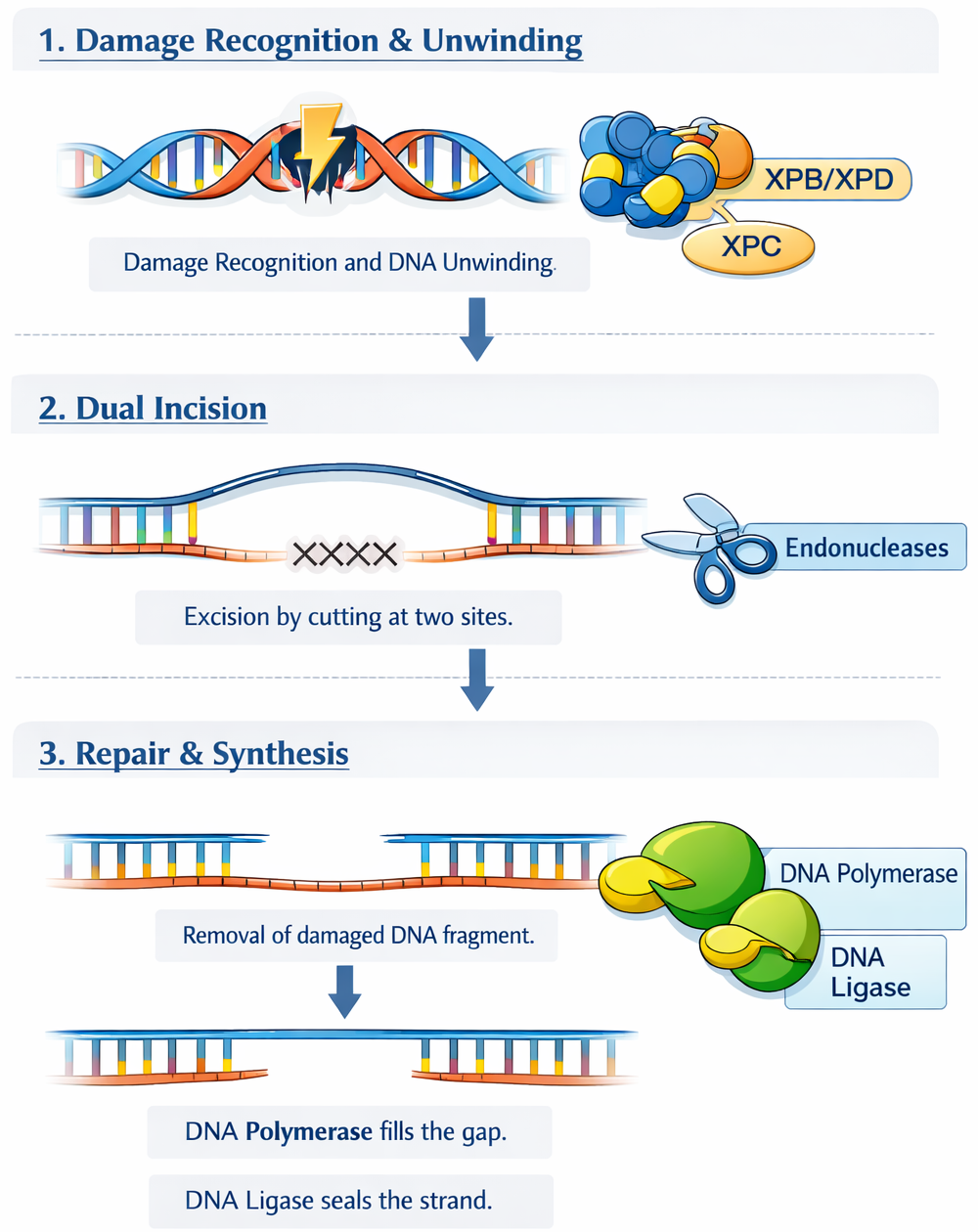
שלבים:
- זיהוי העיוות המבני
- פתיחת הקשרים בין הגדילים
- חיתוך האזור הפגום על ידי Endonuclease
- סינתזה על ידי DNA Polymerase
- הדבקה על ידי Ligase
בחיידקים: UvrA, UvrB, UvrC
בבני אדם: XPA, RPA, XPG, TF2H ועוד
מחלה: Xeroderma Pigmentosum (XP)
- מוטציה בגנים של מסלול
NER- רגישות יתר לקרינת UV
- סיכון פי 2,000 לסרטן עור
- אוטוזומלית רצסיבית
3. MMR - Mismatch Repair
מתי: טעויות אי-התאמה לאחר שכפול (שלא תוקנו ב-Proofreading)
האתגר: איך יודעים איזה גדיל לתקן?
הפתרון - מתילציה:
- הגדיל הישן ממותל (יש עליו מתילציה)
- הגדיל החדש לא ממותל (עדיין לא הספיק)
- התיקון מתרחש לפני שהדגם האפיגנטי מועבר לגדיל החדש
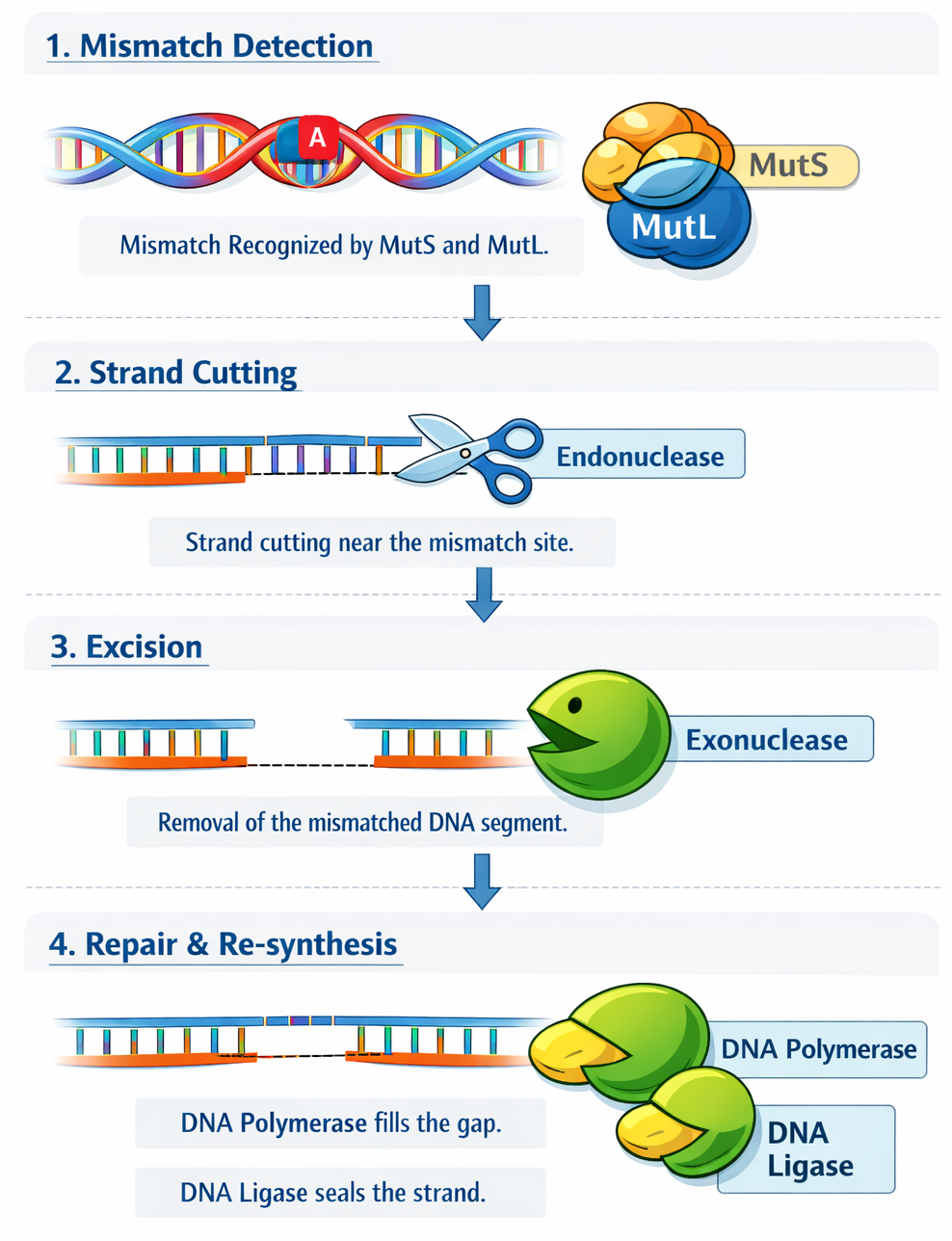
שלבים:
MutS- מזהה את אי-ההתאמהMutL- נקשר ל-MutSMutH- מזהה רצףGATCממותל בגדיל הישן- Endonuclease - חותך את הגדיל החדש
- Exonuclease - מפרק את האזור הפגום
- DNA Polymerase III - מסנתז רצף חדש
- Ligase - מדביק
מחלה: HNPCC (סרטן מעי תורשתי)
- מוטציה ב-
MSH2,MLH1(ההומולוגים האנושיים של MutS, MutL)- סיכון מוגבר לסרטן מעי
- המעי מתחלק מהר + חשוף לחומרים רבים ← הרבה טעויות
מנגנוני תיקון לשבר דו-גדילי
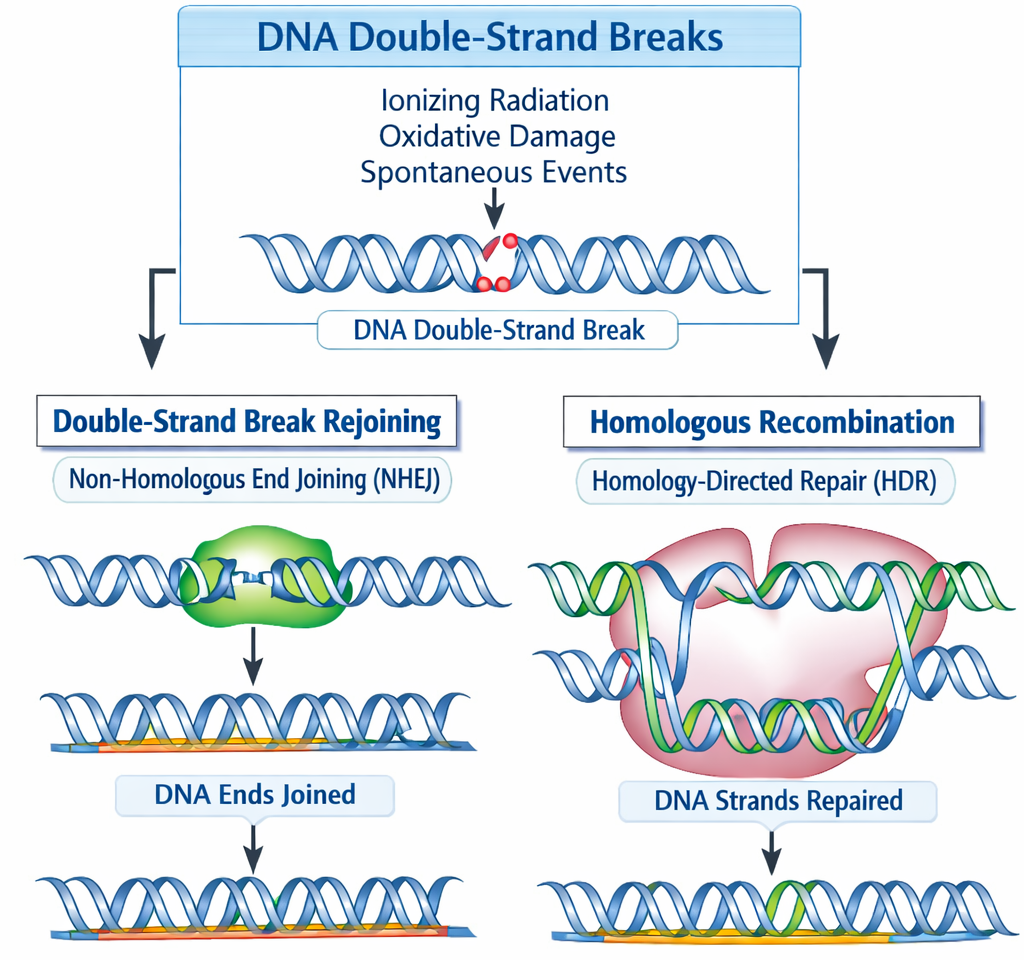
שבר דו-גדילי הוא הנזק הכי חמור - שני הגדילים נשברים!
1. HR - Homologous Recombination
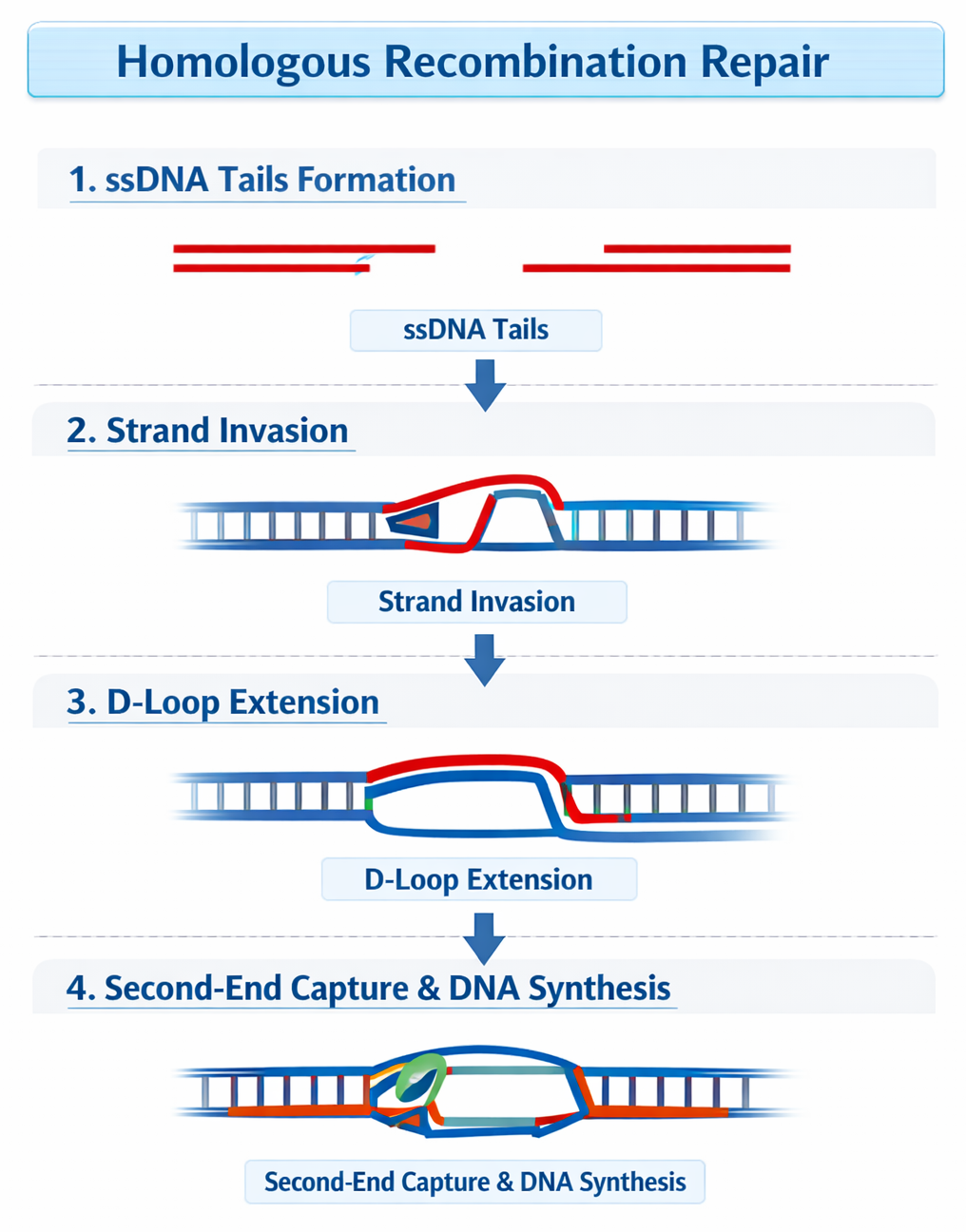
מתי: רק כשיש כרומוזום הומולוגי זמין (אחרי שכפול, בחלוקה)
עיקרון: שימוש בכרומוזום ההומולוגי (או הכרומטידה האחות) כתבנית לתיקון
יתרון: תיקון מדויק - יש תבנית להשוואה
מגבלה: רק בשלבי S ו-G2 של מחזור התא
הערה: אותו מנגנון משמש גם ל-Crossing Over במיוזה!
2. NHEJ - Non-Homologous End Joining
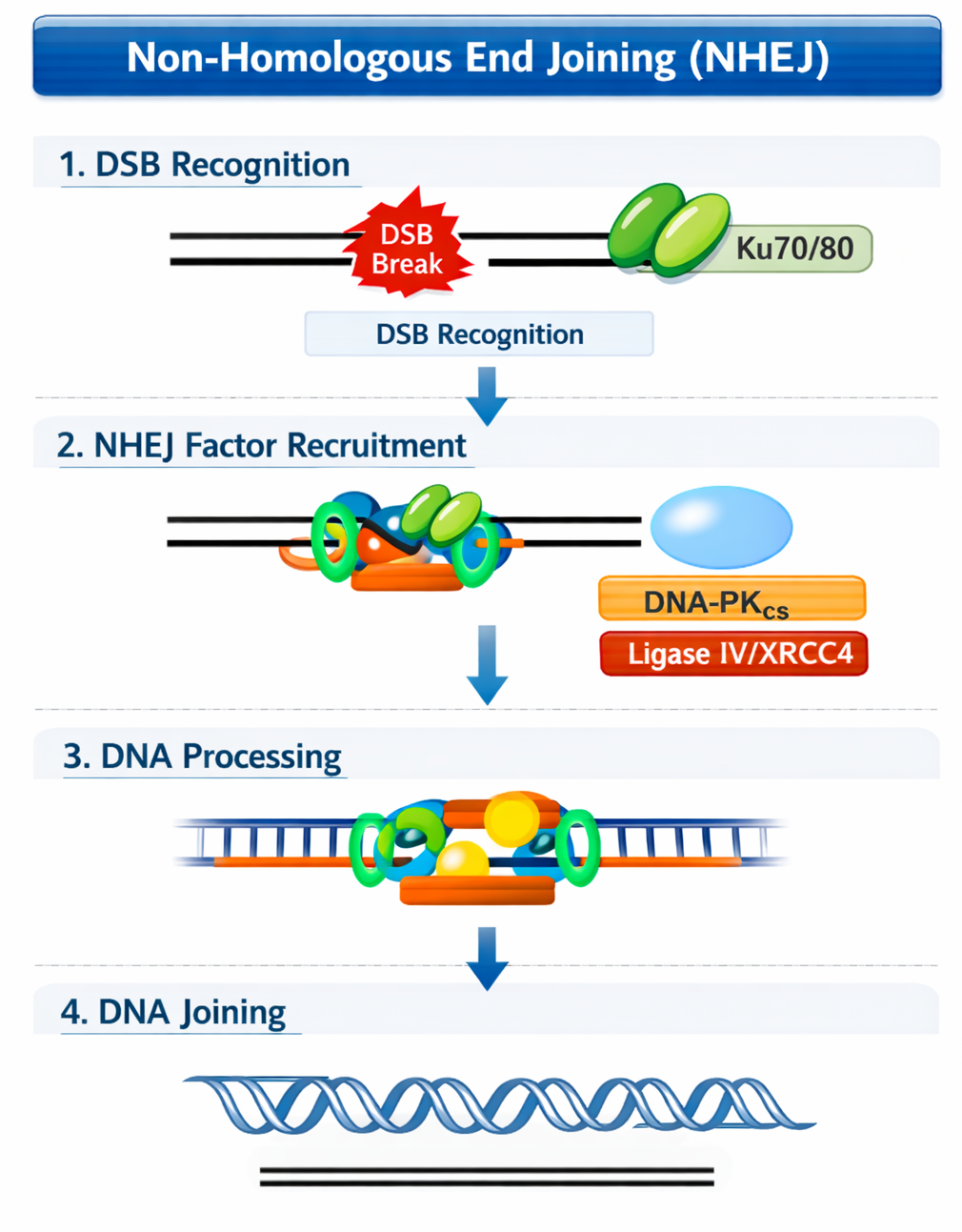
מתי: כשאין כרומוזום הומולוגי (תא לא בחלוקה)
עיקרון: זיהוי קצוות חשופים והדבקה שלהם ישירות
שלבים:
- חלבון
Ku70/Ku80- מזהים קצוות חשופים - יצירת קומפלקס שמקרב את הקצוות
- Ligase - הדבקה
חסרונות:
- יכול לחבר קצוות לא נכונים
- יכולים להיות חסרים בסיסים
- כיווניות עלולה להיות שגויה
BRCA1 ו-BRCA2
תפקיד:
- BRCA1 - פעיל ב-
HRוב-NHEJ - BRCA2 - פעיל בעיקר ב-
NHEJ
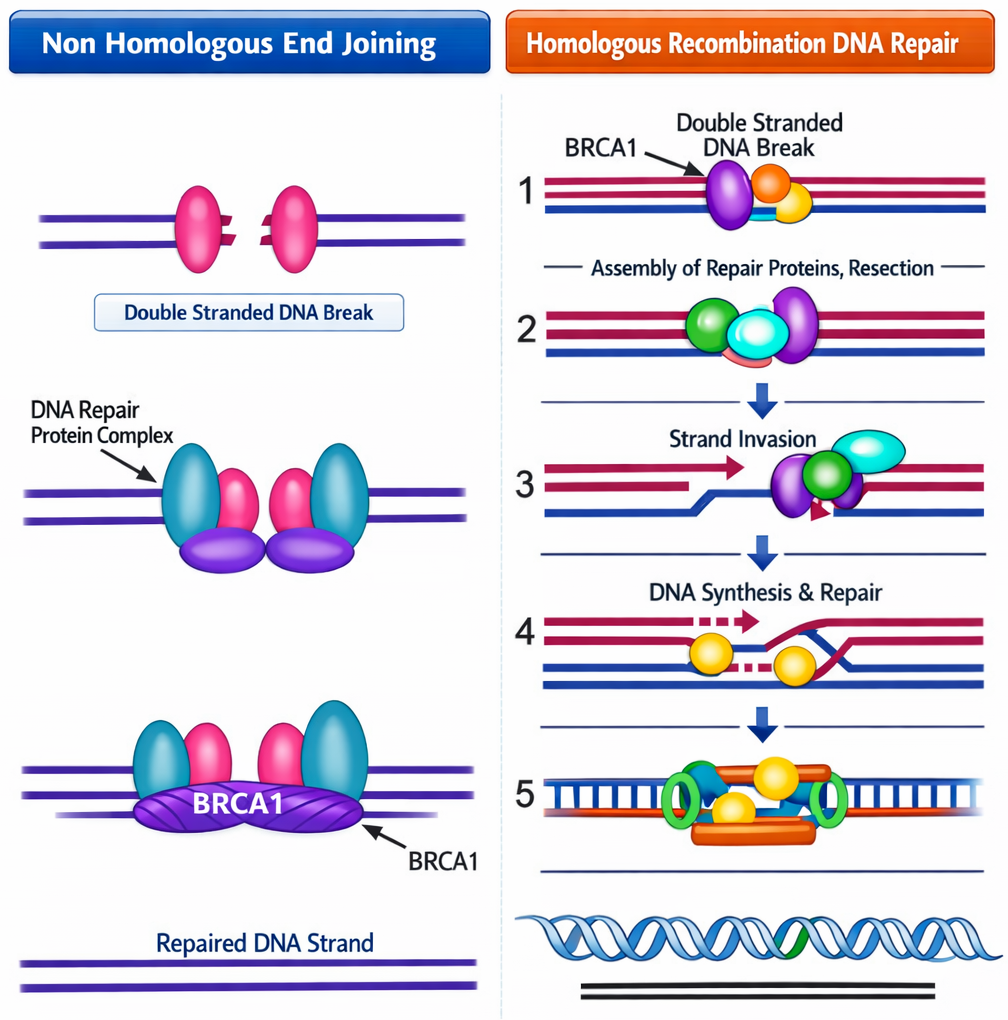
מוטציה:
- סיכון מוגבר לסרטן שד ושחלות
- שברים דו-גדיליים לא מתוקנים
- הנזק מצטבר ויכול להוביל להתפתחות סרטנית
טרנסלוקציות כרומוזומליות
כאשר NHEJ מחבר קצוות של כרומוזומים שונים.
דוגמה: כרומוזום פילדלפיה
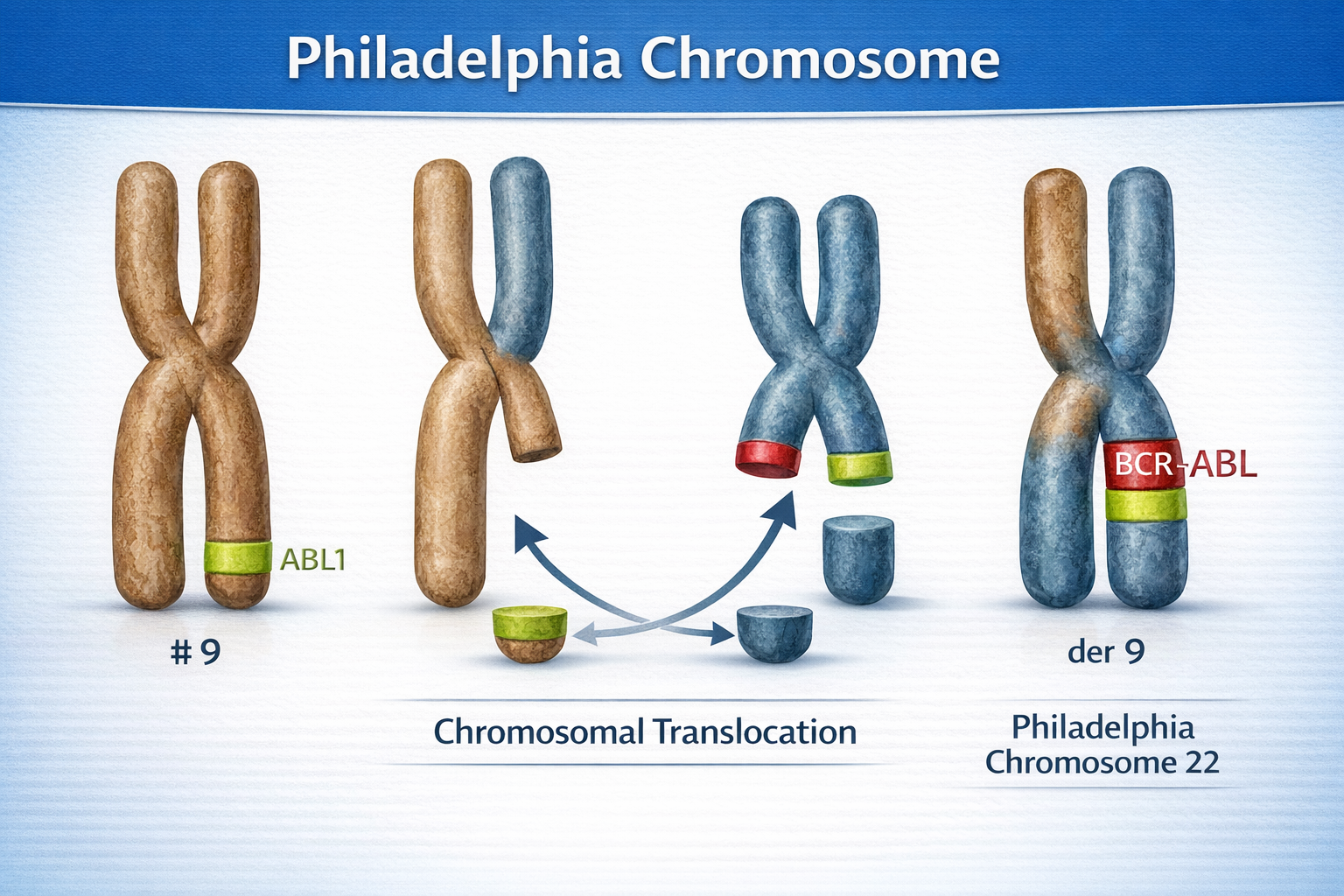
מה קורה:
- קטע מכרומוזום 9 (גן ABL) מתחבר לכרומוזום 22 (גן BCR)
- נוצר כרומוזום לא תקין - “כרומוזום פילדלפיה”
- גן היתוך BCR-ABL פעיל יתר על המידה
- מעודד חלוקה לא מבוקרת
תוצאה: CML - Chronic Myeloid Leukemia
טרנסלוקציות נוספות
| טרנסלוקציה | מחלה |
|---|---|
| t(9;22) | CML |
| t(14;21) | Burkitt Lymphoma |
| אחרות | סוגי לוקמיה שונים |
התפתחות סרטנית
סרטן = תהליך רב-שלבי
לא מספיקה מוטציה אחת! נדרשת צבירת מוטציות במספר מערכות:
שלבי ההתפתחות
תא נורמלי
↓ מוטציה בגני חלוקה
תא עם חלוקה לא מבוקרת
↓ מוטציה במנגנוני תיקון DNA
תא עם נזק מצטבר
↓ מוטציה במנגנון אפופטוזיס
תא שלא מת
↓ מוטציה בהתחמקות ממערכת החיסון
תא שלא מזוהה
↓ מוטציה ביכולת אנגיוגנזה
גידול עם אספקת דם
↓ מוטציה ביכולת תנועה
גרורות
למה סרטן לוקח זמן?
כל שלב דורש:
- מוטציה ספציפית
- שהמוטציה תהיה בתא שיתחלק
- שהתא ישרוד את מנגנוני הבקרה
כדור שלג: ככל שיש יותר מוטציות, יש יותר חלוקה, יש יותר סיכוי למוטציות נוספות.
דרגות סרטן (Staging)
| דרגה | מצב |
|---|---|
| Adenoma קטנה | גידול התחלתי |
| Adenoma גדולה | יותר מוטציות |
| Carcinoma | גידול סרטני |
| Metastasis | גרורות |
האם סרטן תורשתי?
התשובה המורכבת:
- 90% מהמקרים - לא תורשתי (מקרים חדשים)
- 10% מהמקרים - יש רקע משפחתי
מה כן עובר בתורשה:
- מוטציות בגנים של בקרה (כמו
BRCA1/BRCA2) - לא סרטן עצמו, אלא סיכון מוגבר
תנאי לתורשה:
- המוטציה חייבת להיות בתא נבט (ביצית/זרע)
- מוטציה בתא סומטי לא עוברת לדור הבא
ארבעת מנגנוני ההגנה
- עצירת חלוקה - נקודות בקרה במחזור התא
- תיקון DNA - מנגנוני
BER,NER,MMR,HR,NHEJ - אפופטוזיס - מוות תאי מתוכנת
- מערכת החיסון - זיהוי והרס תאים חריגים
סיכום - נקודות מפתח
שונות גנטית
- 99.9% דמיון בין בני אדם
- SNP = שינוי נקודתי
- VNTR = מספר חזרות משתנה
מוטציות - סוגים והשפעות
- גורם מספר 1: טעויות בשכפול
- סוגים: Silent, Missense, Nonsense, Frameshift
- Loss/Gain of Function ← רצסיבי/דומיננטי
מנגנוני תיקון
| מנגנון | סוג נזק | מאפיין |
|---|---|---|
BER | בסיס בודד | תיקון נקודתי |
NER | דימרים, עיוותים | 32-24 בסיסים |
MMR | טעויות שכפול | מבוסס מתילציה |
HR | שבר דו-גדילי | צריך הומולוג |
NHEJ | שבר דו-גדילי | ללא הומולוג |
סרטן
- תהליך רב-שלבי של צבירת מוטציות
- רוב המקרים לא תורשתיים
- מה שעובר בתורשה = סיכון מוגבר, לא המחלה עצמה
שאלות מג׳ונרטות
שאלה 123: Nonsense לעומת Readthrough
קודון UAA עבר מוטציה והפך ל-UAC. מהו סוג המוטציה?
- Silent - אין שינוי בחלבון הסופי
- Missense - החלפת חומצת אמינו אחת באחרת
- Nonsense - יצירת Stop חדש במקום חומצת אמינו
- Readthrough - המשך תרגום מעבר לנקודת הסיום
פתרון
התשובה הנכונה היא (4).
Readthrough: Stop Codon קיים הופך לקודון שמקודד לחומצת אמינו. דוגמה: UAA (Stop) ← UAC (Tyr) ← החלבון ממשיך להתארך מעבר לנקודה הרגילה.
Nonsense הוא ההפך: קודון שמקודד לחומצת אמינו הופך ל-Stop. דוגמה: UAC (Tyr) ← UAA (Stop) ← חלבון מקוצר.
שתיהן מוטציות חמורות: Nonsense נותנת חלבון קטוע, Readthrough נותנת חלבון ארוך מדי.
מקור: תרגיל 7 שקפים 4, 7
שאלה 124: Frameshift Mutation
ברצף mRNA: AUG-CAU-GCA-UGC, נמחק בסיס U מהקודון השני. מה התוצאה?
- החלבון יתארך ויכלול חומצות אמינו נוספות בסופו
- חומצת האמינו השנייה תשתנה, השאר יישארו זהים
- כל הקודונים מנקודת המחיקה ישתנו (Frameshift)
- המוטציה תהיה שקטה כי מדובר בבסיס אחד בלבד
פתרון
התשובה הנכונה היא (3).
מחיקה (Deletion) של בסיס בודד גורמת ל-Frameshift - כל הקודונים מנקודת המחיקה ועד הסוף משתנים.
דוגמה מהמצגת:
- מקורי: AUG-CAU-GCA-UGC
- אחרי מחיקת
U: AUG-CAG-CAU-GC…
כל חומצות האמינו משתנות, ולרוב נוצר Stop Codon מוקדם ← חלבון קצר ולא-פונקציונלי.
חשוב: הוספה/מחיקה של 3 בסיסים (כפולה של 3) לא תגרום ל-Frameshift.
מקור: תרגיל 7 שקף 5
שאלה 125: Loss of Function לעומת Gain of Function
מוטציית Gain of Function בגן תיצור בדרך כלל:
- אלל רצסיבי, כי העותק השני מפצה על הפגם
- אלל דומיננטי, כי נוצרת פעילות חדשה או מוגברת
- אלל קו-דומיננטי, כי שני האללים מתבטאים בשווה
- אלל רצסיבי, כי GOF תמיד דורש הומוזיגוטיות
פתרון
התשובה הנכונה היא (2).
| סוג מוטציה | אלל שנוצר | הסבר |
|---|---|---|
| Loss of Function (LOF) | רצסיבי | העותק השני מפצה |
| Gain of Function (GOF) | דומיננטי | פעילות חדשה/מוגברת |
ב-GOF: החלבון המוטנטי עושה משהו חדש או מוגזם, ואלל אחד מספיק ← דומיננטי. GOF הרבה יותר נדיר מ-LOF.
ב-LOF: הגן הפגום לא מתבטא, אך אלל תקין אחד מספיק לרוב ← רצסיבי.
חריג: Haploinsufficiency הוא LOF שמתנהג כדומיננטי כי עותק אחד לא מספיק.
מקור: תרגיל 7 שקפים 6, 8
שאלה 126: מוטציה סומטית לעומת מוטציה בתאי נבט
מה נכון לגבי מוטציה שמתרחשת בתא סומטי?
- היא עוברת לתאי הצאצא בדור הבא
- היא משפיעה על התא ועל תאים שנגזרים ממנו בלבד
- היא תמיד גורמת להתפתחות סרטנית
- היא חמורה יותר ממוטציה ב-Germline
פתרון
התשובה הנכונה היא (2).
| מאפיין | סומטית | תא נבט (Germline) |
|---|---|---|
| עוברת לצאצאים? | לא | כן |
| היכן הנזק? | תא + תאים שנגזרו ממנו | כל תאי הצאצא |
| קשר לסרטן | עלול לגרום לגידול מקומי | מעלה סיכון תורשתי |
מוטציה סומטית: נזק נקודתי, לא עובר לדור הבא. מוטציה ב-Germline: נמצאת בביצית/זרעון ← כל תאי הצאצא נושאים אותה.
מקור: תרגיל 7 שקף 8
שאלה 127: סיווג מנגנוני תיקון DNA
כמה קטגוריות עיקריות של מנגנוני תיקון DNA קיימות?
- שתיים: חד-גדילי ודו-גדילי
- ארבע: BER, NER, MMR ו-NHEJ
- שלוש: הופכי מיידי, חד-גדילי, דו-גדילי
- אחת: Excision Repair בלבד
פתרון
התשובה הנכונה היא (3).
1. תיקון הופכי מיידי (Direct Reversal)
- חד-שלבי, פשוט ביותר
- דוגמה: Photolyase (לא בבני אדם)
2. תיקון נזק חד-גדילי:
- BER (Base Excision Repair)
- NER (Nucleotide Excision Repair)
- MMR (Mismatch Repair)
3. תיקון שבר דו-גדילי:
- NHEJ (Non-Homologous End Joining)
- רקומבינציה הומולוגית (Homologous Recombination)
מקור: תרגיל 7 שקף 10
שאלה 128: Photolyase ותיקון הופכי מיידי
מהו אנזים Photolyase?
- אנזים שמתקן דימרים של T באור; לא קיים בבני אדם
- אנזים שמתקן שברים דו-גדיליים באמצעות רקומבינציה הומולוגית
- אנזים שמזהה אי-התאמות בסיסים במנגנון MMR בבני אדם
- אנזים שחותך בסיסים פגומים כשלב ראשון של תיקון BER
פתרון
התשובה הנכונה היא (1).
Photolyase הוא אנזים שמבצע תיקון הופכי מיידי (Direct Reversal):
- פועל באור נראה (Photoreactivation)
- פותח דימרים של Thymine שנוצרו ע”י קרינת UV
- תהליך חד-שלבי - פשוט ומהיר
- לא קיים בבני אדם ← אצלנו דימרים מתוקנים ע”י NER
בבני אדם, היעדר Photolyase מחייב הסתמכות על NER. פגם ב-NER גורם ל-XP.
מקור: תרגיל 7 שקפים 12-13
שאלה 129: Base Excision Repair - שלב ראשון
מהו האנזים שמתחיל את תהליך ה-BER?
- DNA Ligase - מחבר קצוות של גדילי DNA
- Endonuclease - חותך בתוך שלד הסוכר-פוספט
- DNA Polymerase - מסנתז רצף חדש על פי תבנית
- DNA Glycosylase - מזהה ומוציא בסיס פגום
פתרון
התשובה הנכונה היא (4).
שלבי BER (Base Excision Repair):
- DNA Glycosylase ← מזהה ומוציא בסיס פגום בודד (חותך קשר בסיס-סוכר)
- Nuclease (AP Endonuclease / Apex1) ← חותך שלד הסוכר-פוספט
- DNA Polymerase ← מסנתז בסיס חדש תקין
- DNA Ligase ← מחבר את הגדיל
BER מטפל בנזקים קטנים: בסיס בודד פגום, חמצון, דה-אמינציה (למשל Uracil שנוצר ב-DNA).
מקור: תרגיל 7 שקף 16
שאלה 130: NER - מאפיינים
כמה בסיסים בערך מוסר מנגנון NER באאוקריוטים?
- בסיס אחד
- 32-24 בסיסים
- 5-3 בסיסים
- מאות עד אלפי בסיסים
פתרון
התשובה הנכונה היא (2).
השוואה בין BER ל-NER:
| מאפיין | BER | NER |
|---|---|---|
| גודל הנזק | בסיס בודד | 32-24 בסיסים |
| מורכבות | פשוט יחסית | מורכב, יותר אנזימים |
| סוג נזק | בסיס פגום/שגוי | עיוות מבני (דימרים, adducts) |
| אנזים מפתח | DNA Glycosylase | XPA, XPB, XPC (באאוקריוטים) |
ב-E. coli: NER מסיר ~12 נוקלאוטידים (ע”י UvrA, UvrB, UvrC).
מקור: תרגיל 7 שקפים 17-19
שאלה 131: Xeroderma Pigmentosum
מהי צורת התורשה של Xeroderma Pigmentosum?
- אוטוזומלית דומיננטית עם חדירות מלאה
- X-linked רצסיבית, שכיחה יותר בגברים
- אוטוזומלית רצסיבית עם פגם ב-NER
- מיטוכונדריאלית, עוברת רק מהאם
פתרון
התשובה הנכונה היא (3).
Xeroderma Pigmentosum (XP):
- תורשה אוטוזומלית רצסיבית
- פגם בגנים של מנגנון NER (XPA-XPG)
- לא מסוגלים לתקן דימרים של Thymine מקרינת UV
- רגישות קיצונית לאור שמש
- סיכון מוגבר פי ~2000 לסרטן עור
- דורשים הגנה מלאה מ-UV
מקור: תרגיל 7 שקפים 24, 31
שאלה 132: MMR - הבחנה בין גדילים
כיצד מנגנון MMR מבחין בין הגדיל החדש לגדיל המקורי ב-E. coli?
- הגדיל החדש ארוך יותר כי טרם עבר קיצוץ
- הגדיל המקורי ממותל והחדש עדיין לא
- הגדיל החדש מכיל Uracil במקום Thymine
- הגדיל המקורי מסומן בקבוצות אצטיל
פתרון
התשובה הנכונה היא (2).
ב-E. coli: רצפי GATC בגדיל המקורי ממותלים (קבוצת מתיל על Adenine). הגדיל החדש טרם עבר מתילציה ← המערכת מתקנת את הגדיל הלא-ממותל (החדש).
שלבי MMR:
- MutS מזהה את אי-ההתאמה
- MutL מגויס ומתחבר
- MutH חותך את הגדיל הלא-ממותל ליד רצף GATC
- Exonuclease מסירה את הקטע הפגום
- DNA Pol III מסנתז מחדש
- Ligase מחבר
מתילציה של הגדיל החדש מתרחשת רק לאחר התיקון.
מקור: תרגיל 7 שקפים 22-20
שאלה 133: Lynch Syndrome (HNPCC)
Lynch Syndrome נגרמת מפגם ב:
- NER - תיקון נוקלאוטידים באכסיזיה
- NHEJ - חיבור קצוות לא הומולוגי
- MMR - תיקון אי-התאמה
- BER - תיקון בסיסים באכסיזיה
פתרון
התשובה הנכונה היא (3).
Lynch Syndrome (= HNPCC = Hereditary Non-Polyposis Colorectal Cancer):
- פגם ב-Mismatch Repair (MMR)
- גנים מעורבים: MLH1 (~50%), MSH2 (~40%), MSH6, PMS2
- תורשה אוטוזומלית דומיננטית
- סיכון מוגבר לסרטן מעי גס וסוגי סרטן נוספים
למה דווקא המעי? תאי המעי מתחלקים במהירות גבוהה ← שכפול רב ← יותר טעויות.
מקור: תרגיל 7 שקפים 36-33
שאלה 134: תיקון שבר דו-גדילי
מהן שתי הדרכים העיקריות לתיקון שבר דו-גדילי?
- BER ו-NER
- MMR ו-Direct Reversal
- NHEJ ורקומבינציה הומולוגית
- Photolyase ו-Glycosylase
פתרון
התשובה הנכונה היא (3).
| מנגנון | NHEJ | רקומבינציה הומולוגית |
|---|---|---|
| מתי? | התא לא בחלוקה | התא בחלוקה |
| דיוק | פחות מדויק | מדויק מאוד |
| חלבון מפתח | Ku70/80 | RecA / RAD51, BRCA1/2 |
| תבנית | אין - חיבור ישיר | כרומטידה אחות |
BER, NER, MMR הם מנגנונים לתיקון חד-גדילי בלבד.
מקור: תרגיל 7 שקפים 29-26
שאלה 135: NHEJ - חלבון מרכזי
מהו החלבון המרכזי במנגנון NHEJ?
- MutS - מזהה אי-התאמות בשכפול
- Ku70/80 - נקשר לקצוות שבורים
- XPA - מזהה עיוותים מבניים ב-DNA
- RecA - מבצע חיפוש רצף הומולוגי
פתרון
התשובה הנכונה היא (2).
Ku70/80 (הטרודימר) הוא החלבון המרכזי ב-NHEJ:
- נקשר לקצוות השבורים של ה-DNA
- מגייס DNA-PKcs ו-Ligase IV/XRCC4
- מחבר את הקצוות ישירות ללא צורך בתבנית
חסרון: NHEJ עלול לגרום לאובדן של מספר בסיסים באתר השבר ← מוטציות קטנות. אבל עדיף משבר דו-גדילי לא מתוקן.
מקור: תרגיל 7 שקפים 29-30
שאלה 136: רקומבינציה הומולוגית - מתי?
מתי מתרחשת רקומבינציה הומולוגית לתיקון שבר דו-גדילי?
- רק כשהנזק נגרם מקרינת UV
- כשהתא בחלוקה וכרומטידה אחות זמינה
- כשהתא במצב G0 ולא מתחלק כלל
- רק כשהנזק הוא בסיס בודד פגום
פתרון
התשובה הנכונה היא (2).
רקומבינציה הומולוגית דורשת תבנית הומולוגית - בדרך כלל הכרומטידה האחות. לכן היא מתרחשת כאשר:
- התא עבר שלב S (שכפול DNA)
- קיימת כרומטידה אחות זהה כתבנית
התהליך: Strand Invasion ← D-loop ← סינתזה ← חיבור מחדש. זהו תיקון מדויק ללא אובדן מידע.
כשאין כרומטידה אחות (התא לא בחלוקה) ← NHEJ.
מקור: תרגיל 7 שקפים 27-28
שאלה 137: PARP Inhibitors
מדוע מעכבי PARP הורגים תאי סרטן עם מוטציית BRCA אך לא תאים בריאים?
- התרופה מגיעה רק לתאים סרטניים דרך קולטנים ייחודיים
- תאים בריאים כלל לא משתמשים ב-PARP לתיקון DNA
- תאים בריאים מתקנים שברים דו-גדיליים ב-HR; תאי הגידול לא יכולים
- תאים סרטניים רגישים יותר לכל סוגי התרופות בגלל חלוקה מהירה
פתרון
התשובה הנכונה היא (3).
מנגנון Synthetic Lethality:
- PARP מתקן שברים חד-גדיליים (BER pathway)
- מעכב PARP ← שברים חד-גדיליים לא מתוקנים
- בשכפול, שברים חד-גדיליים הופכים לדו-גדיליים
- תאים בריאים: BRCA1/2 תקין ← HR מתקן ← שורדים
- תאי גידול: BRCA פגום ← לא יכולים לתקן ← מתים
זו דוגמה לרפואה מותאמת אישית המנצלת חולשה גנטית ייחודית של הגידול.
מקור: תרגיל 7 שקפים 41-38
שאלה 138: תיקון דימרים של Thymine בבני אדם
באיזה מנגנון מתוקנים דימרים של Thymine בבני אדם?
- Direct Reversal ע”י Photolyase
- NER - Nucleotide Excision Repair
- MMR - Mismatch Repair
- NHEJ - חיבור קצוות לא הומולוגי
שאלה 121: גורמי מוטציות
מהו הגורם השכיח ביותר למוטציות בתאים נורמליים?
- חשיפה לקרינת UV
- חשיפה לחומרים כימיים מסרטנים
- טעויות אקראיות בשכפול DNA בעת חלוקת תא
- קרינה מייננת מהסביבה
פתרון
התשובה הנכונה היא (3).
מוטציות מתרחשות בתאים נורמליים כל העת. הגורם השכיח ביותר הוא טעויות אקראיות בשכפול ה-DNA. למרות ש-DNA Polymerase מדויק מאוד (שגיאה אחת לכל ~10⁹ בסיסים לאחר Proofreading), עדיין מצטברות מוטציות לאורך החיים.
גורמים נוספים (פחות שכיחים אך משמעותיים): קרינת UV (דימרים של T), קרינה מייננת (שברים), חומרים כימיים.
מקור: תרגיל 7 שקף 3
שאלה 122: סוגי מוטציות נקודתיות - Silent
מוטציה שמשנה קודון אך לא משנה את חומצת האמינו נקראת:
- Missense
- Nonsense
- Silent
- Readthrough
פתרון
התשובה הנכונה היא (3).
| סוג מוטציה | מה קורה | דוגמה (mRNA) |
|---|---|---|
| Silent | אותה חומצת אמינו | CAU→CAC (שניהם His) |
| Missense | חומצת אמינו שונה | CAU→CAA (His→Gln) |
| Nonsense | Stop Codon נוצר | UAC→UAA (Tyr→Stop) |
| Readthrough | Stop Codon נהרס | UAA→UUA (Stop→Leu) |
מוטציה שקטה אפשרית בגלל ניוון הקוד הגנטי (Degeneracy) - מספר קודונים מקודדים לאותה חומצת אמינו, בעיקר בשינוי בבסיס השלישי (Wobble Position).
מקור: תרגיל 7 שקפים 4, 7
שאלה 123: Nonsense לעומת Readthrough (גרסה 2)
מה ההבדל בין מוטציית Nonsense למוטציית Readthrough?
- Nonsense יוצרת Stop מוקדם; Readthrough הורסת Stop קיים
- Nonsense משנה חומצת אמינו; Readthrough מוחקת בסיס
- שתיהן יוצרות Stop מוקדם, אך במיקומים שונים
- Nonsense קורית רק באקסונים; Readthrough רק באינטרונים
פתרון
התשובה הנכונה היא (1).
Nonsense: קודון שמקודד לחומצת אמינו הופך ל-Stop Codon. דוגמה: UAC (Tyr) ← UAA (Stop) ← חלבון מקוצר.
Readthrough: Stop Codon קיים הופך לקודון שמקודד לחומצת אמינו. דוגמה: UAA (Stop) ← UUA (Leu) ← החלבון ממשיך להתארך מעבר לנקודה הרגילה.
שתיהן מוטציות חמורות: Nonsense נותנת חלבון קטוע, Readthrough נותנת חלבון ארוך מדי עם זנב לא-פונקציונלי.
מקור: תרגיל 7 שקפים 4, 7
שאלה 124: Frameshift Mutation (גרסה 2)
מחיקת בסיס בודד מרצף מקודד תגרום ל:
- מוטציה שקטה - אין שינוי בחלבון
- שינוי בחומצת אמינו אחת בלבד
- הזזת מסגרת הקריאה מנקודת המחיקה והלאה
- הכפלה של החלבון המקודד
פתרון
התשובה הנכונה היא (3).
מחיקה (Deletion) של בסיס בודד גורמת ל-Frameshift - כל הקודונים מנקודת המחיקה ועד הסוף משתנים.
דוגמה מהמצגת:
- מקורי: AUG-CAU-GCA-UGC
- אחרי מחיקת U: AUG-CAG-CAU-GC…
כל חומצות האמינו משתנות, ולרוב נוצר Stop Codon מוקדם ← חלבון קצר ולא-פונקציונלי.
חשוב: הוספה או מחיקה של 3 בסיסים (או כפולה של 3) לא תגרום ל-Frameshift - רק להוספה/חוסר של חומצת אמינו אחת.
מקור: תרגיל 7 שקף 5
שאלה 125: Loss of Function לעומת Gain of Function (גרסה 2)
מוטציית Loss of Function בגן יוצרת בדרך כלל אלל:
- דומיננטי - כי החלבון הפגום מפריע לתקין
- רצסיבי - כי העותק השני עדיין מייצר חלבון תקין
- קו-דומיננטי - כי שני האללים מתבטאים
- לתלי ב-X - כי LOF קורה רק בכרומוזום X
פתרון
התשובה הנכונה היא (2).
| סוג מוטציה | אלל שנוצר | הסבר |
|---|---|---|
| Loss of Function (LOF) | רצסיבי | העותק השני מפצה |
| Gain of Function (GOF) | דומיננטי | פעילות חדשה/מוגברת |
ב-LOF: הגן הפגום לא מתבטא תקין, אך אלל אחד תקין מספיק לרוב לייצר מספיק חלבון ← צריך שני אללים פגומים למחלה ← רצסיבי.
ב-GOF: החלבון המוטנטי עושה משהו חדש או מוגזם, ואלל אחד מספיק ← דומיננטי. GOF הרבה יותר נדיר.
חריג: Haploinsufficiency הוא LOF שמתנהג כדומיננטי כי עותק אחד לא מספיק.
מקור: תרגיל 7 שקפים 6, 8
שאלה 126: מוטציה סומטית לעומת מוטציה בתאי נבט (גרסה 2)
מוטציה שמתרחשת בתא נבט (Germline) לעומת תא סומטי:
- פוגעת רק ברקמה אחת ולא עוברת לצאצאים
- אינה עוברת לצאצאים אך משפיעה על כל הגוף
- עוברת לצאצאים ונמצאת בכל תאי הצאצא
- תמיד גורמת לסרטן בניגוד לסומטית
פתרון
התשובה הנכונה היא (3).
| מאפיין | סומטית | תא נבט (Germline) |
|---|---|---|
| עוברת לצאצאים? | לא | כן |
| היכן הנזק? | תא + תאים שנגזרו ממנו | כל תאי הצאצא |
| קשר לסרטן | עלול לגרום לגידול מקומי | מעלה סיכון תורשתי |
מוטציה סומטית: נזק נקודתי, לא עובר לדור הבא. מוטציה ב-Germline: נמצאת בביצית/זרעון ← כל תאי הצאצא נושאים אותה.
מקור: תרגיל 7 שקף 8
שאלה 127: סיווג מנגנוני תיקון DNA (גרסה 2)
כמה קטגוריות עיקריות של מנגנוני תיקון DNA קיימות?
- שתיים: תיקון חד-גדילי ודו-גדילי
- שלוש: תיקון הופכי מיידי, תיקון חד-גדילי, ותיקון דו-גדילי
- ארבע: BER, NER, MMR, NHEJ
- אחת: Excision Repair בלבד
פתרון
התשובה הנכונה היא (2).
1. תיקון הופכי מיידי (Direct Reversal)
- חד-שלבי, פשוט ביותר
- דוגמה: Photolyase (לא בבני אדם)
2. תיקון נזק חד-גדילי:
- BER (Base Excision Repair)
- NER (Nucleotide Excision Repair)
- MMR (Mismatch Repair)
3. תיקון שבר דו-גדילי:
- NHEJ (Non-Homologous End Joining)
- רקומבינציה הומולוגית (Homologous Recombination)
מקור: תרגיל 7 שקף 10
שאלה 128: Photolyase ותיקון הופכי מיידי (גרסה 2)
מה נכון לגבי Photolyase?
- קיים בבני אדם ומתקן דימרים של Thymine
- אינו קיים בבני אדם אך מתקן דימרים של Thymine ביצורים אחרים
- קיים בבני אדם ומתקן שברים דו-גדיליים
- אינו קיים בבני אדם ומתקן אי-התאמות בסיסים
פתרון
התשובה הנכונה היא (2).
Photolyase הוא אנזים שמבצע תיקון הופכי מיידי (Direct Reversal):
- פועל באור נראה (Photoreactivation)
- פותח דימרים של Thymine שנוצרו ע”י קרינת UV
- תהליך חד-שלבי - פשוט ומהיר
- לא קיים בבני אדם ← אצלנו דימרים מתוקנים ע”י NER
בבני אדם, היעדר Photolyase מחייב הסתמכות על NER לתיקון נזקי UV. פגם ב-NER גורם ל-Xeroderma Pigmentosum.
מקור: תרגיל 7 שקפים 13-12
שאלה 129: Base Excision Repair - שלב ראשון (גרסה 2)
מהו האנזים שמתחיל את תהליך ה-BER?
- DNA Ligase
- DNA Glycosylase
- DNA Polymerase
- Endonuclease
פתרון
התשובה הנכונה היא (2).
שלבי BER (Base Excision Repair):
- DNA Glycosylase ← מזהה ומוציא בסיס פגום בודד (חותך את הקשר בין הבסיס לסוכר)
- Nuclease (AP Endonuclease / Apex1) ← חותך את שלד הסוכר-פוספט
- DNA Polymerase ← מסנתז בסיס חדש תקין
- DNA Ligase ← מחבר את הגדיל
BER מטפל בנזקים קטנים: בסיס בודד פגום, חמצון, דה-אמינציה. לדוגמה: Uracil שנוצר בטעות ב-DNA (מ-Deamination של Cytosine).
מקור: תרגיל 7 שקף 16
שאלה 130: NER - מאפיינים (גרסה 2)
כמה בסיסים בערך מוסר מנגנון NER באאוקריוטים?
- בסיס בודד
- 5-3 בסיסים
- 32-24 בסיסים
- מאות בסיסים
פתרון
התשובה הנכונה היא (3).
השוואה בין BER ל-NER:
| מאפיין | BER | NER |
|---|---|---|
| גודל הנזק | בסיס בודד | 32-24 בסיסים |
| מורכבות | פשוט יחסית | מורכב, יותר אנזימים |
| סוג נזק | בסיס פגום/שגוי | עיוות מבני (דימרים, adducts) |
| אנזים מפתח | DNA Glycosylase | XPA, XPB, XPC (באאוקריוטים) |
- ב-E. coli: NER מסיר ~12 נוקלאוטידים (ע”י UvrA, UvrB, UvrC).
- באאוקריוטים: NER מסיר ~32-24 נוקלאוטידים (ע”י חלבוני XP).
מקור: תרגיל 7 שקפים 19-17
שאלה 131: Xeroderma Pigmentosum (גרסה 2)
מהי צורת התורשה של Xeroderma Pigmentosum ובאיזה מנגנון תיקון הפגם?
- אוטוזומלית דומיננטית, פגם ב-MMR
- אוטוזומלית רצסיבית, פגם ב-NER
- X-linked רצסיבית, פגם ב-BER
- אוטוזומלית רצסיבית, פגם ב-NHEJ
פתרון
התשובה הנכונה היא (2).
Xeroderma Pigmentosum (XP):
- תורשה אוטוזומלית רצסיבית
- פגם בגנים של מנגנון NER (XPA-XPG)
- לא מסוגלים לתקן דימרים של Thymine מקרינת UV
- רגישות קיצונית לאור שמש
- סיכון מוגבר פי ~2000 לסרטן עור
- דורשים הגנה מלאה מ-UV (בגדים, קרם, כובע)
מקור: תרגיל 7 שקפים 24, 31
שאלה 132: MMR - הבחנה בין גדילים (גרסה 2)
כיצד מנגנון MMR מבחין בין הגדיל החדש (שמכיל את הטעות) לגדיל המקורי?
- הגדיל החדש ארוך יותר מהמקורי
- הגדיל המקורי ממותל (Methylated) והחדש עדיין לא
- הגדיל החדש נושא סימון פלואורסצנטי
- הגדיל המקורי מכיל Uracil במקום Thymine
פתרון
התשובה הנכונה היא (2).
ב-E. coli: רצפי GATC בגדיל המקורי ממותלים (קבוצת מתיל על Adenine). הגדיל החדש טרם עבר מתילציה ← המערכת יודעת לתקן את הגדיל הלא-ממותל (החדש).
שלבי MMR:
- MutS מזהה את אי-ההתאמה
- MutL מגויס ומתחבר
- MutH חותך את הגדיל הלא-ממותל ליד רצף GATC
- Exonuclease מסירה את הקטע הפגום
- DNA Pol III מסנתז מחדש
- Ligase מחבר
מתילציה של הגדיל החדש מתרחשת רק לאחר התיקון.
מקור: תרגיל 7 שקפים 22-20
שאלה 133: Lynch Syndrome (HNPCC)
Lynch Syndrome נגרמת מפגם באיזה מנגנון תיקון?
- NER - Nucleotide Excision Repair
- BER - Base Excision Repair
- MMR - Mismatch Repair
- Direct Reversal
פתרון
התשובה הנכונה היא (3).
Lynch Syndrome (= HNPCC = Hereditary Non-Polyposis Colorectal Cancer):
- פגם ב-Mismatch Repair (MMR)
- גנים מעורבים: MLH1 (~50%), MSH2 (~40%), MSH6, PMS2
- תורשה אוטוזומלית דומיננטית
- סיכון מוגבר לסרטן מעי גס וסוגי סרטן נוספים
למה דווקא המעי? תאי המעי מתחלקים במהירות גבוהה ← שכפול רב ← יותר טעויות ← ללא MMR תקין הטעויות מצטברות.
- MSH2 = ההומולוג האנושי של MutS בחיידקים.
- MLH1 = ההומולוג האנושי של MutL בחיידקים.
מקור: תרגיל 7 שקפים 36-33
שאלה 134: תיקון שבר דו-גדילי - שתי דרכים (גרסה 2)
מהן שתי הדרכים העיקריות לתיקון שבר דו-גדילי ב-DNA?
- BER ו-NER
- MMR ו-BER
- NHEJ ורקומבינציה הומולוגית
- Direct Reversal ו-MMR
פתרון
התשובה הנכונה היא (3).
| מנגנון | NHEJ | רקומבינציה הומולוגית |
|---|---|---|
| שם מלא | Non-Homologous End Joining | Homologous Recombination |
| מתי? | התא לא בחלוקה | התא בחלוקה (כרומטידה אחות זמינה) |
| דיוק | פחות מדויק (עלול לאבד בסיסים) | מדויק מאוד |
| חלבון מפתח | Ku70/80 | RecA (ובבני אדם: RAD51, BRCA1/2) |
| תבנית | אין - חיבור ישיר | כרומטידה אחות/הומולוג |
מקור: תרגיל 7 שקפים 29-26
שאלה 135: NHEJ - חלבון מרכזי (גרסה 2)
מהו החלבון המרכזי במנגנון NHEJ?
- MutS
- XPA
- Ku70/80
- DNA Glycosylase
פתרון
התשובה הנכונה היא (3).
Ku70/80 (הטרודימר) הוא החלבון המרכזי ב-NHEJ:
- נקשר לקצוות השבורים של ה-DNA
- מגייס DNA-PKcs ו-Ligase IV/XRCC4
- מחבר את הקצוות ישירות ללא צורך בתבנית
חסרונות NHEJ: עלול לגרום לאובדן של מספר בסיסים באתר השבר ← מוטציות קטנות. אבל עדיף מאשר שבר דו-גדילי לא מתוקן (שעלול לגרום לטרנסלוקציות כרומוזומליות).
מקור: תרגיל 7 שקפים 30-29
שאלה 136: רקומבינציה הומולוגית - מתי? (גרסה 2)
רקומבינציה הומולוגית לתיקון שבר דו-גדילי מתרחשת בעיקר כאשר:
- התא במצב G0 ואינו מתחלק
- התא בשלב חלוקה וכרומטידה אחות זמינה
- הנזק הוא בסיס בודד פגום
- הנזק נגרם מקרינת UV בלבד
פתרון
התשובה הנכונה היא (2).
רקומבינציה הומולוגית דורשת תבנית הומולוגית - בדרך כלל הכרומטידה האחות. לכן היא מתרחשת כאשר:
- התא עבר שלב S (שכפול DNA)
- קיימת כרומטידה אחות זהה לשימוש כתבנית
התהליך: Strand Invasion ← D-loop ← סינתזה ← חיבור מחדש. זהו תיקון מדויק ללא אובדן מידע.
כשאין כרומטידה אחות (התא לא בחלוקה) ← NHEJ.
חלבונים מעורבים: RecA (בחיידקים), RAD51, BRCA1, BRCA2 (באדם).
מקור: תרגיל 7 שקפים 27-28
שאלה 137: PARP Inhibitors - מנגנון פעולה
מעכבי PARP משמשים לטיפול בסרטן שד עם מוטציית BRCA. מדוע התאים הסרטניים מתים אך התאים הבריאים שורדים?
- התרופה מגיעה רק לתאים סרטניים ולא לבריאים
- תאים בריאים לא צריכים PARP בכלל
- תאים בריאים מתקנים שברים דו-גדיליים ע”י HR; תאי הגידול עם BRCA פגום לא יכולים
- תאים סרטניים רגישים יותר לכימותרפיה באופן כללי
פתרון
התשובה הנכונה היא (3).
מנגנון Synthetic Lethality:
- PARP מתקן שברים חד-גדיליים (BER pathway)
- מעכב PARP ← שברים חד-גדיליים לא מתוקנים
- בשכפול, שברים חד-גדיליים הופכים לדו-גדיליים
- תאים בריאים: BRCA1/2 תקין ← HR מתקן שברים דו-גדיליים ← שורדים
- תאי גידול: BRCA פגום ← לא יכולים לתקן דו-גדיליים ← מתים
זו דוגמה לרפואה מותאמת אישית: הטיפול מנצל חולשה גנטית ייחודית של הגידול.
מקור: תרגיל 7 שקפים 41-38
שאלה 138: Thymine Dimers
קרינת UV גורמת ליצירת דימרים של Thymine. באיזה מנגנון מתוקן נזק זה בבני אדם?
- Direct Reversal ע”י Photolyase
- NER - Nucleotide Excision Repair
- MMR - Mismatch Repair
- NHEJ - Non-Homologous End Joining
פתרון
התשובה הנכונה היא (2).
דימרים של Thymine = קשר קוולנטי בין שני בסיסי T סמוכים על אותו גדיל. זה גורם לעיוות מבני ב-DNA.
בבני אדם: Photolyase לא קיים ← נזקי UV מתוקנים ע”י NER.
שלבי NER באאוקריוטים:
- זיהוי העיוות המבני ע”י XPC/XPE
- פתיחת הגדילים ע”י XPB/XPD (הליקאזות)
- חיתוך משני צידי הנזק ע”י XPF ו-XPG
- סינתזה ע”י DNA Polymerase
- חיבור ע”י Ligase
פגם ב-NER ← Xeroderma Pigmentosum (XP).
מקור: תרגיל 7 שקפים 11-13, 17, 31
שאלה 139: BER לעומת NER - השוואה
מה ההבדל העיקרי בין BER ל-NER?
- BER מתקן בסיס בודד; NER מסיר קטע של עשרות בסיסים
- BER פועל רק בפרוקריוטים; NER רק באאוקריוטים
- BER מתקן שברים דו-גדיליים; NER מתקן חד-גדיליים
- BER דורש יותר אנזימים מ-NER
פתרון
התשובה הנכונה היא (1).
| מאפיין | BER | NER |
|---|---|---|
| גודל | בסיס בודד | 32-24 בסיסים |
| סוג נזק | בסיס פגום/מחומצן | עיוות מבני (דימרים, adducts) |
| אנזים ראשון | DNA Glycosylase | XPC/XPE (זיהוי) |
| מורכבות | פשוט יחסית | מורכב יותר |
| קיום | פרוקריוטים + אאוקריוטים | בעיקר אאוקריוטים |
| מחלה | סיכון מוגבר לסרטן | XP, Trichothiodystrophy |
שניהם מנגנוני תיקון חד-גדילי - משתמשים בגדיל המשלים כתבנית. שניהם כוללים הסרה, סינתזה, וחיבור ע”י Ligase.
מקור: תרגיל 7 שקפים 16-19
שאלה 140: MLH1 ו-MSH2 - תפקיד ב-MMR
מהו ההומולוג האנושי של MutS בחיידקים?
- MLH1
- MSH2
- Ku70
- XPA
פתרון
התשובה הנכונה היא (2).
| חיידקים (E. coli) | אדם (הומולוג) | תפקיד |
|---|---|---|
| MutS | MSH2 (+ MSH6) | זיהוי אי-התאמת בסיסים |
| MutL | MLH1 (+ PMS2) | תיאום ועיבוד התיקון |
| MutH | אין הומולוג ישיר | חיתוך הגדיל הלא-ממותל |
ב-HNPCC (Lynch Syndrome):
- MLH1 אחראי ל-~50% מהמקרים
- MSH2 אחראי ל-~40% מהמקרים
- MSH6 ו-PMS2 אחראים לשאר
מקור: תרגיל 7 שקפים 24-23, 35