תגובות אלפא לקרבוניל - הקרבוניל כנוקלאופיל
\[\alpha \, \text{ to } \, \ce{CO}\]
הקדמה: מעבר מאלקטרופיליות לנוקלאופיליות בקרבונילים
בפרקים הקודמים התמקדנו בתגובות שבהן הפחמן הקרבונילי משמש כאלקטרופיל, כאשר המטען החלקי החיובי ($\delta^+$) על הפחמן נובע ממשיכת האלקטרונים על ידי החמצן האלקטרושלילי. בפרק זה נבחן תכונה ייחודית של קרבונילים - היכולת של הפחמן באלפא לקרבוניל לשמש כנוקלאופיל.
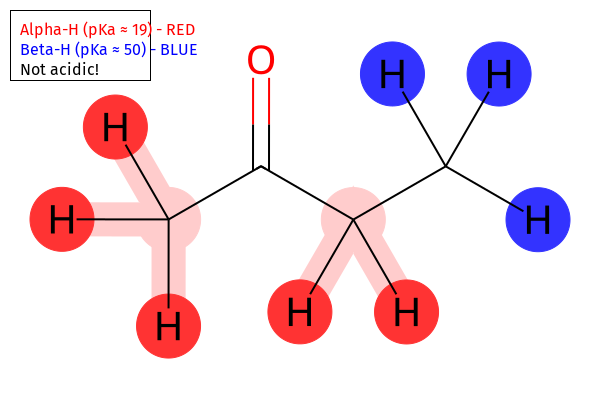
החומציות של פחמן אלפא לקרבוניל
נבחן את ערכי ה-pKa של מימנים במיקומים שונים ביחס לקרבוניל:
- פחמן אלדהידי: pKa ≈ 50
- פחמן אלפא לקרבוניל: pKa ≈ 17-19
- פחמן בטא לקרבוניל: pKa ≈ 50
ההבדל המשמעותי בחומציות נובע מהיציבות של הבסיס המצומד.
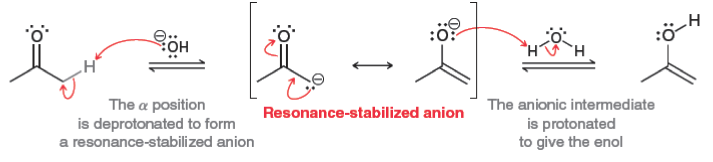
כאשר נתלש פרוטון מפחמן אלפא, נוצר אניון המיוצב ברזוננס:

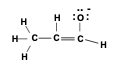 \[\ce{R-CO-CH2-R' + B^- <=> R-CO-CH^--R' + BH}\]
\[\ce{R-CO-CH2-R' + B^- <=> R-CO-CH^--R' + BH}\] האניון הנוצר, הנקרא אנולאט (enolate), מיוצב ברזוננס עם החמצן הקרבונילי:
\[\ce{R-CO-CH^--R' <=> R-C(O^-)=CH-R'}\]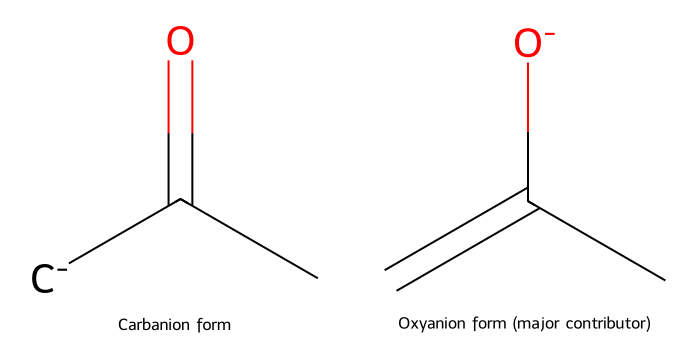
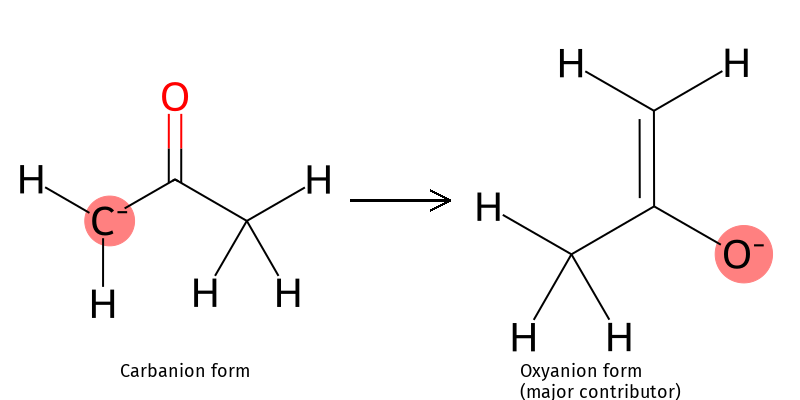
נוצר פחמן טעון שלילית (נוקלאופיל) שיכול לתקוף אלקטרופילים.
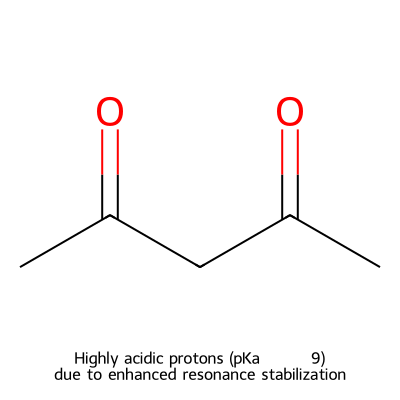
די-קטונים: חומציות מוגברת
במערכות די-קטון (1,3-דיקרבוניל), החומציות עולה משמעותית (pKa ≈ 9). זאת משתי סיבות עיקריות:
- ייצוב רזוננס מוגבר: האניון מיוצב על ידי שני קרבונילים
- אפקט אינדוקטיבי: שתי קבוצות קרבוניל מושכות אלקטרונים מייצבות את המטען השלילי
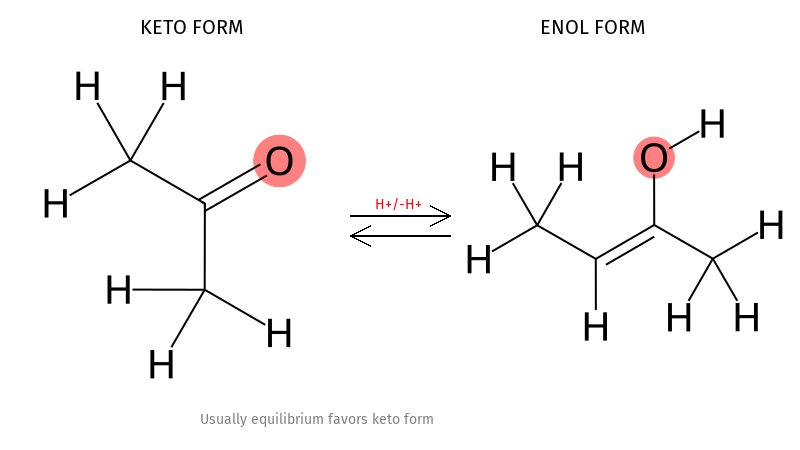
שיווי משקל אנול - קטון
| \(\begin{array}{ccc}& \text{keton} & \\[6pt]& \textcolor{red}{\ce{O}} & \\[-6pt]& \vert\vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup }{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\) | \(\begin{array}{ccc}& \text{Enol} & \\[6pt]& \textcolor{red}{\ce{OH}} & \\[-6pt]& \vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup \hspace{-0.3em} \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\) |
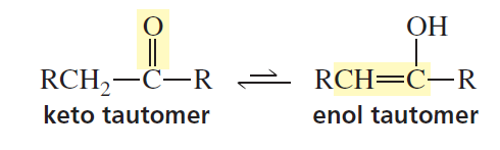
ככלל שיווי המשקל נוטה לכיוון הקטון, אך ישנם מקרים שבהם האנול יציב יותר.
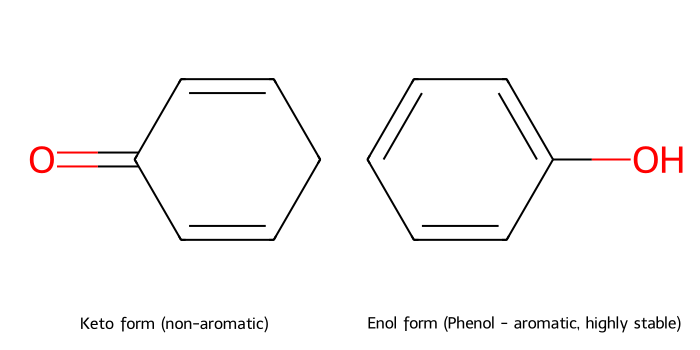
למשל בדי-קטונים, כאשר האנול יוצר קשרי מימן תוך-מולקולריים, או כאשר האנול יוצר מערכת ארומטית (למשל בנזן).
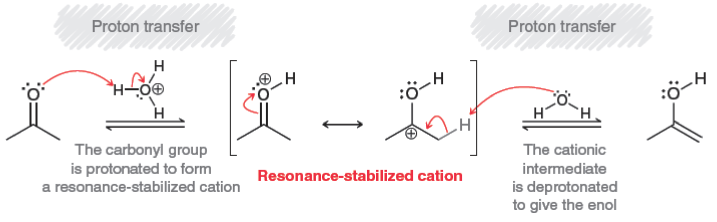
המנגנון בקטליזה חומצית ($\ce{CH3COOH}$)
בנוכחות חומצה, הקרבוניל עובר טאוטומריזציה לאנול:
-
פרוטונציה של החמצן הקרבונילי:
\[\ce{R-CO-CH2-R' + H^+ -> R-C(OH^+)-CH2-R'}\] -
דה-פרוטונציה באלפא:
\[\ce{R-C(OH^+)-CH2-R' + H2O -> R-C(OH)=CH-R' + H3O^+}\]
המנגנון בקטליזה בסיסית ($\ce{NaOH}$)
בקטליזה בסיסית, התגובה מתבצעת דרך יצירת אנולאט:
-
דה-פרוטונציה באלפא:
\[\ce{R-CO-CH2-R' + OH^- -> R-CO-CH^--R' + H2O}\] -
פרוטונציה של החמצן:
\[\ce{R-CO-CH^--R' + H2O -> R-C(OH)=CH-R' + OH^-}\]
יציבות האנול
בדרך כלל שיווי המשקל נוטה לכיוון הקטון, אך במקרים מסוימים האנול יציב יותר:
- די-קטונים: קשרי מימן תוך-מולקולריים יוצרים מבנה טבעתי יציב
- יצירת מערכת ארומטית: כאשר האנול יוצר טבעת בנזן
תגובת הלוגנציה באלפא ($\alpha \, \text{halogenation}$)
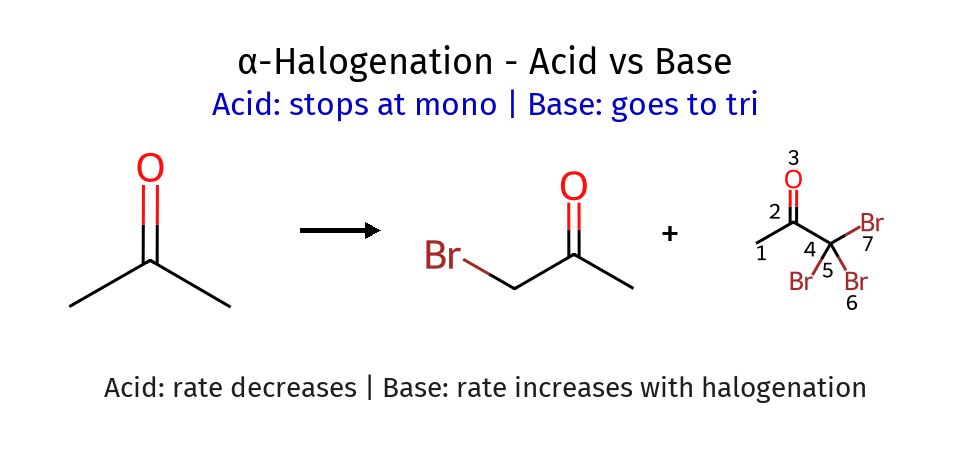
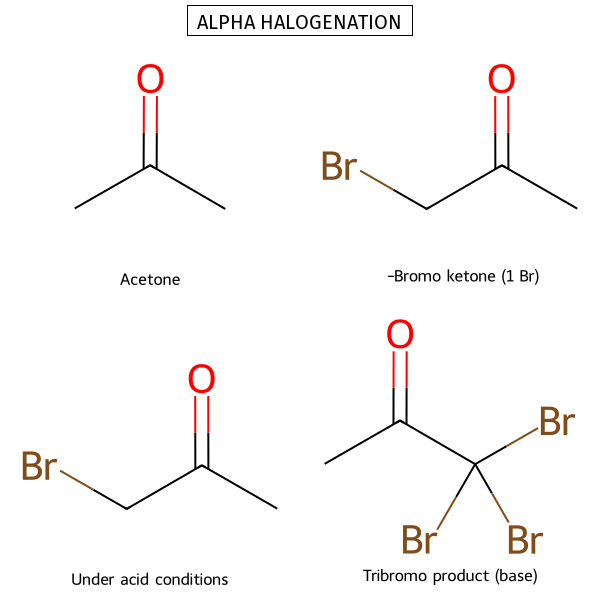
המנגנון בקטליזה חומצית - רק מימן אחד מוחלף
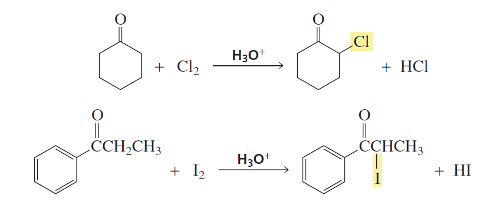
תגובת הלוגנציה באלפא מתרחשת דרך האנול כחומר ביניים:
\[\begin{array}{ccc}& \text{Enol} & \\[6pt]& \textcolor{red}{\ce{OH}} & \\[-6pt]& \vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup \hspace{-0.3em} \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\]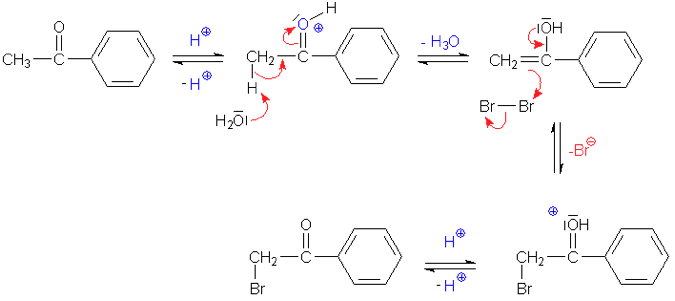
-
יצירת האנול (כמתואר לעיל - השורה הראשונה)
-
התקפת האנול על ההלוגן:
\[\ce{R-C(OH)=CH-R' + Br2 -> R-C(OH^+)-CHBr-R' + Br^-}\] -
דה-פרוטונציה:
\[\ce{R-C(OH^+)-CHBr-R' + H2O -> R-CO-CHBr-R' + H3O^+}\]
מגבלה חשובה: בקטליזה חומצית, רק מימן אחד מוחלף. הברום המוכנס מושך אלקטרונים ומקשה על פרוטונציה נוספת.
המנגנון בקטליזה בסיסית - כל המימנים באלפא יכולים להיות מוחלפים
בנוכחות בסיסיות, התגובה מתבצעת דרך יצירת אנולאט:
\[\begin{array}{ccc}& \text{enolate} & \\[6pt]& \textcolor{red}{\ce{O^{\ominus}}} & \\[-6pt]& \vert \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup \hspace{-0.3em} \diagup}{\ce{R1}} \quad \overset{\diagdown \quad}{\ce{R2}} & \\[-6pt]\end{array}\]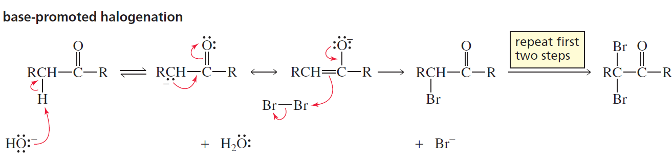
-
יצירת אנולאט:
\[\ce{R-CO-CH2-R' + OH^- -> R-CO-CH^--R' + H2O}\] -
התקפה על הלוגן:
\[\ce{R-CO-CH^--R' + Br2 -> R-CO-CHBr-R' + Br^-}\]
הבדל מהותי: בקטליזה בסיסית, כל המימנים באלפא יכולים להיות מוחלפים. הברום המוכנס מגביר את החומציות של המימנים הנותרים.
שאלה 1
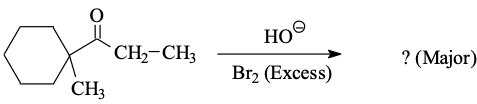
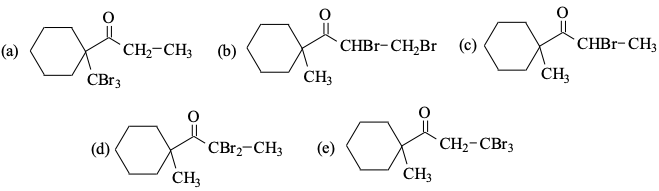
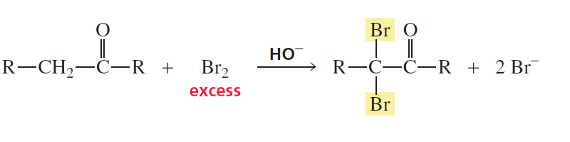
מגיבים בקטליזה בסיסית ברום 2 בעודף. התוצר הוא D.
בקטליזה חומצית התשובה הייתה דווקא C - רק מימן אחד מוחלף בברום.
חשוב: מדברים רק על המימנים של הפחמן באלפא לקרבוניל! (המימנים החומציים)
שאלה 2 (מהתרגול) - סינתזה
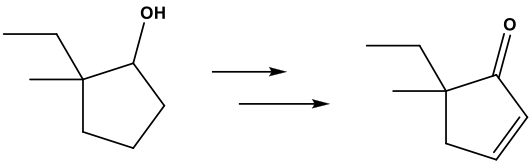
בשלב ראשון נחמצמן את הכוהל השניוני לקרבוניל (קטון) עם $\ce{PCC}$.
בשלב השני, נבצע הלוגנציה באלפא לקרבוניל עם $\ce{Br2}$ בקטליזה חומצית, ככה שרק ברום אחד מוחלף על הפחמן באלפא לקרבוניל.
בשלב השלישי נשתמש בבסיס חזק ($\ce{NaOH}$) בשביל תגובת אלימינציה, שתסגור קשר כפול במקום הבאום.
$\ce{NaOH}$ לא משפיע על הקרבוניל.
האלימינציה היא לפי כלל זייצב, אבל אין מימנים פנויים על הפחמן המותמר יותר ($\mathrm{E2}$).
התנהגות אנולט כנוקלאופיל ($\mathrm{S_N2}$)
האנולט יכול לשמש כנוקלאופיל, עם אלקיל הליד ראשוני, בתגובה עם אלקטרופיל.
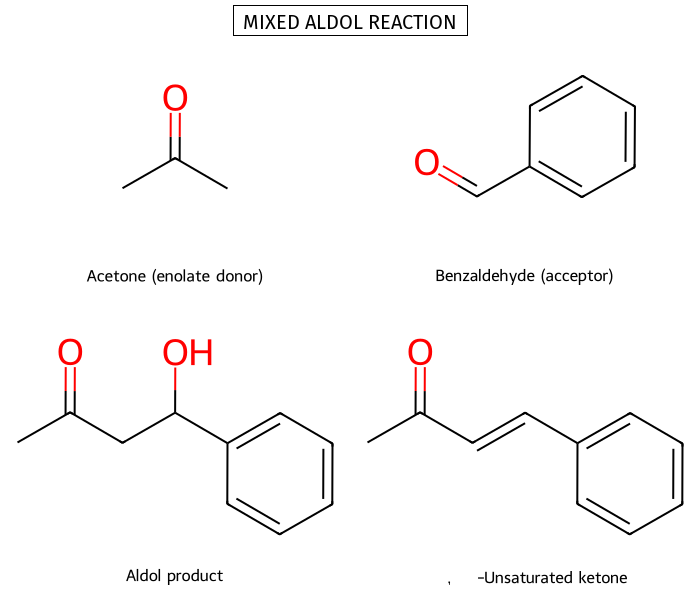
תגובת אלדול - דחיסה של קרבונילים
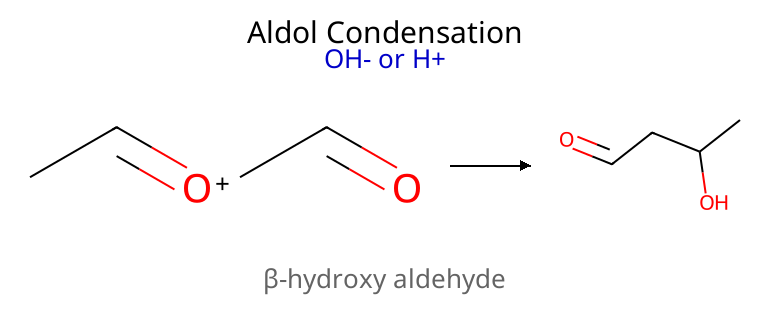
תגובת אלדול היא אחת התגובות החשובות ביותר ליצירת קשרי פחמן-פחמן בכימיה אורגנית. בתגובה זו, פחמן אלפא של קרבוניל אחד (הנוקלאופיל) תוקף פחמן קרבונילי של מולקולה אחרת (האלקטרופיל).
התוצר הסופי זהה הן בסביבה חומצין והן בסביבה בסיסית, אך המנגנון שונה.
עם נגיב עם בסיס ($\ce{OH^-}$), תוצר ביניים עם כוהל. לאחר חימום (דהידרציה), התוצר הסופי הוא אלפא,בטא-בלתי רווי.
באופן דומה בקטליזה חומצית, התוצר הסופי הוא אלפא,בטא-בלתי רווי, אך התגובה מתבצעת דרך יצירת אנול.
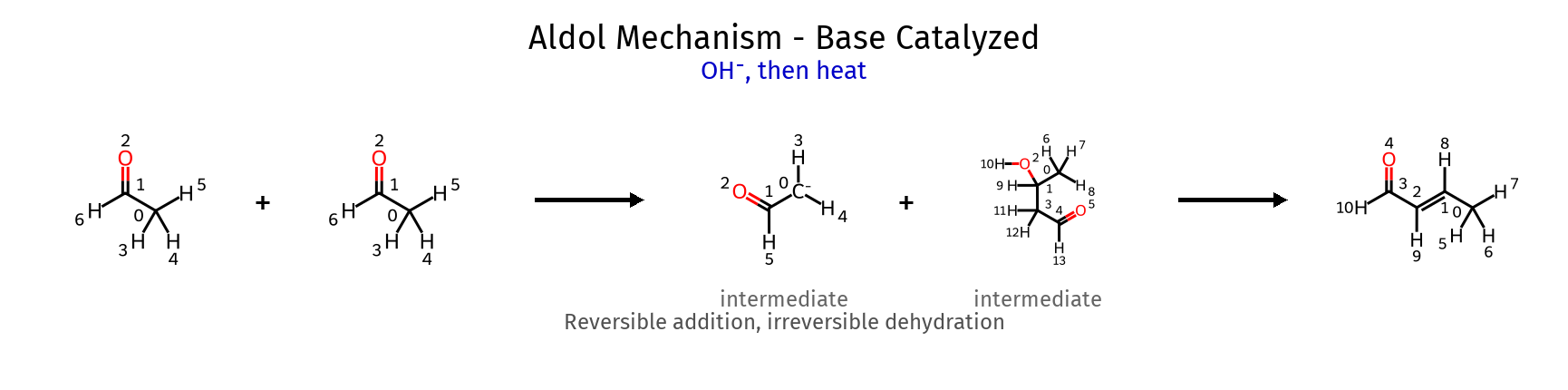
מנגנון תגובת אלדול בקטליזה בסיסית

-
יצירת אנולאט: (הנוקלאופיל)
\[\ce{CH3-CHO + OH^- -> CH2^--CHO + H2O}\] -
התקפה נוקלאופילית:
\[\ce{CH2^--CHO + CH3-CHO -> CH3-CH(O^-)-CH2-CHO}\] -
פרוטונציה:
\[\ce{CH3-CH(O^-)-CH2-CHO + H2O -> CH3-CH(OH)-CH2-CHO + OH^-}\]
התוצר הוא אלפא,בטא-הידרוקסי-קרבוניל.
המנגנון תגובת אלדול בקטליזה חומצית

בקטליזה חומצית, שני הקרבונילים דורשים הכנה:
- הנוקלאופיל הופך לאנול
- האלקטרופיל עובר פרוטונציה להגברת האלקטרופיליות
- יצירת אנול (מהקרבוניל הנוקלאופילי)
- פרוטונציה של הקרבוניל האלקטרופילי
- התקפת האנול על הקרבוניל המופרטן
- דה-פרוטונציה ליצירת התוצר
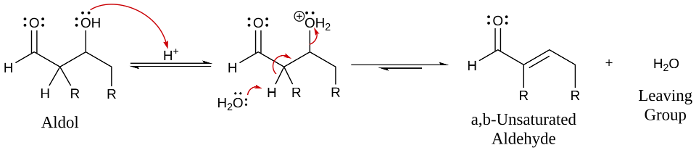
דהידרציה לתוצר אלפא,בטא-בלתי רווי
בחימום, תוצר האלדול עובר אלימינציה:
\[\ce{R-CH(OH)-CH2-CO-R' ->[\Delta] R-CH=CH-CO-R' + H2O}\]
הבסיס החזק קוטף פרוטון, נסגר קשר כפול, ויש יציאה של קבוצה עוזבת $\ce{OH^-}$.
$\ce{OH^-}$ היא קבוצה עוזבת גרועה. זה בכל זאת קורה כי התוצר מאוד יציב.
התוצר הוא אלפא,בטא-קרבוניל בלתי רווי - מערכת מצומדת יציבה במיוחד: קשר כפול צמוד לקרבוניל.
\[\begin{array}{ccc}& \alpha -\beta & \\[6pt]& \textcolor{red}{\ce{O}} & \\[-6pt]& \parallel \\[-6pt]& \ce{C} & \\[-6pt]& \overset{\quad \diagup }{\ce{H}} \quad \quad \overset{ \hspace{-2em}\diagdown }{ \hspace{-0.5em}\ce{C}} & \\[-6pt] & \overset{\quad \quad \quad \parallel}{\quad \quad \quad \ce{C}} \\[-6pt] &\quad \quad \quad \quad \quad \overset{\diagdown \quad}{\ce{R2}} \\[-6pt]\end{array}\]תגובת אלדול מעורבת
כאשר מגיבים קרבונילים שונים, יש לקחת בחשבון:
- רק קרבוניל עם מימני אלפא יכול להיות נוקלאופיל
- אלדהידים אלקטרופיליים יותר מקטונים
- בתגובה בין קטון לאלדהיד: הקטון משמש כנוקלאופיל, האלדהיד כאלקטרופיל (מי שנתקף הוא תמיד האלקטרופיל - כאן האלדהיד).
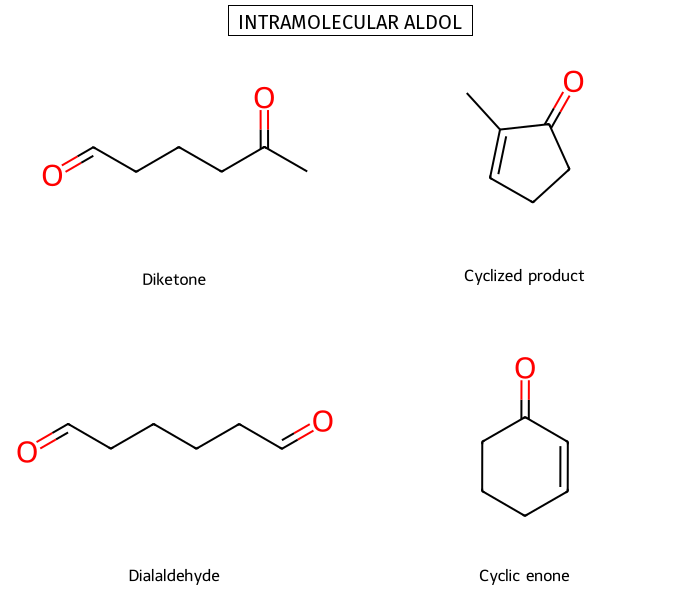
תגובת אלדול תוך-מולקולרית
בתגובות ציקליזציה, גודל הטבעת הנוצרת קובע את אתר התגובה. טבעות של 5 ו-6 איברים עדיפות תרמודינמית.
שאלה 2 - תגובת אלדול
דוגמה 1: תגובת אלדול בין קטון לאלדהיד
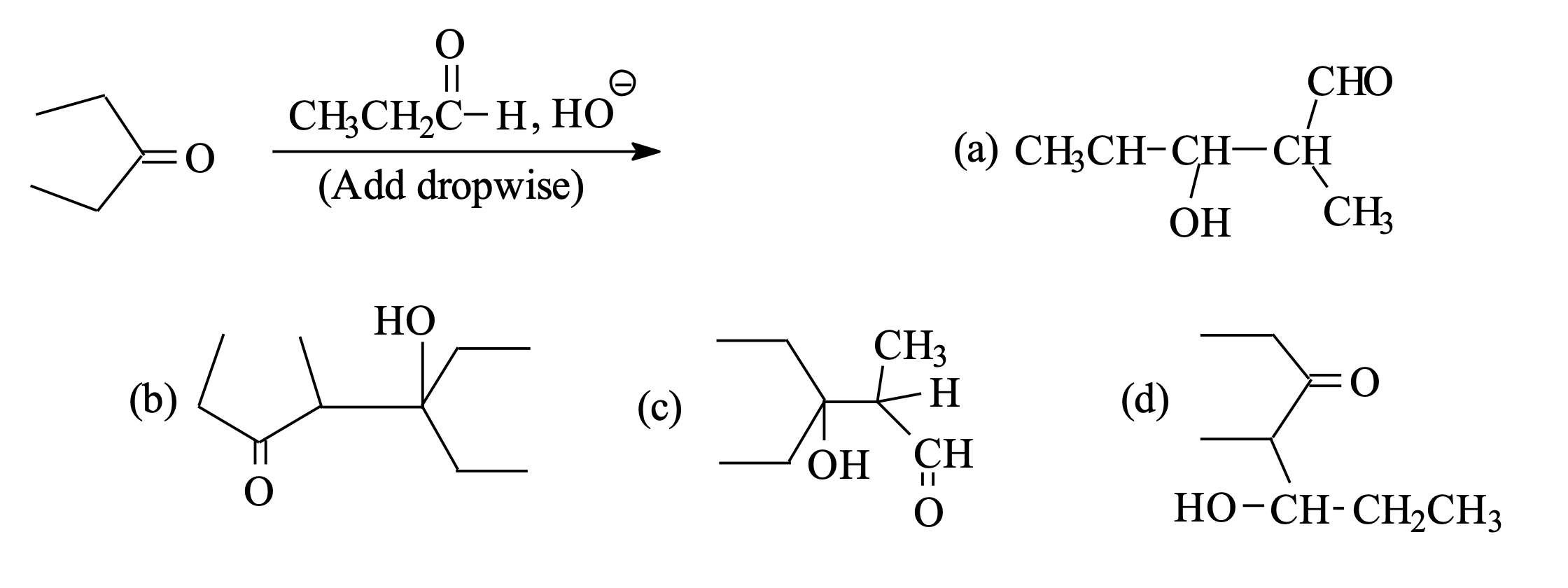
נתונים: קטון + אלדהיד + $\ce{OH^-}$ ← תוצר
ניתוח השאלה:
בתגובה בין קטון לאלדהיד, הקטון תמיד ישמש כנוקלאופיל (בשל האלקטרופיליות הנמוכה יותר שלו) והאלדהיד כאלקטרופיל (נתקף).
מנגנון התגובה:
-
יצירת אנולאט מהקטון:
\[\ce{R2CH-CO-R' + OH^- -> R2C^--CO-R' + H2O}\] -
התקפה נוקלאופילית על האלדהיד:
\[\ce{R2C^--CO-R' + R''-CHO -> R2C(CHO-R'')-CO-R'}\] -
פרוטונציה של האוקסיאניון:
\[\ce{R2C(CHO^--R'')-CO-R' + H2O -> R2C(CHOH-R'')-CO-R' + OH^-}\]
התוצר הסופי הוא אלפא,בטא-הידרוקסי-קטון. ללא חימום, התגובה עוצרת בשלב זה (תשובה D).
עקרון חשוב: בהיעדר חימום, לא מתרחשת אלימינציה לתוצר אלפא,בטא-בלתי רווי.
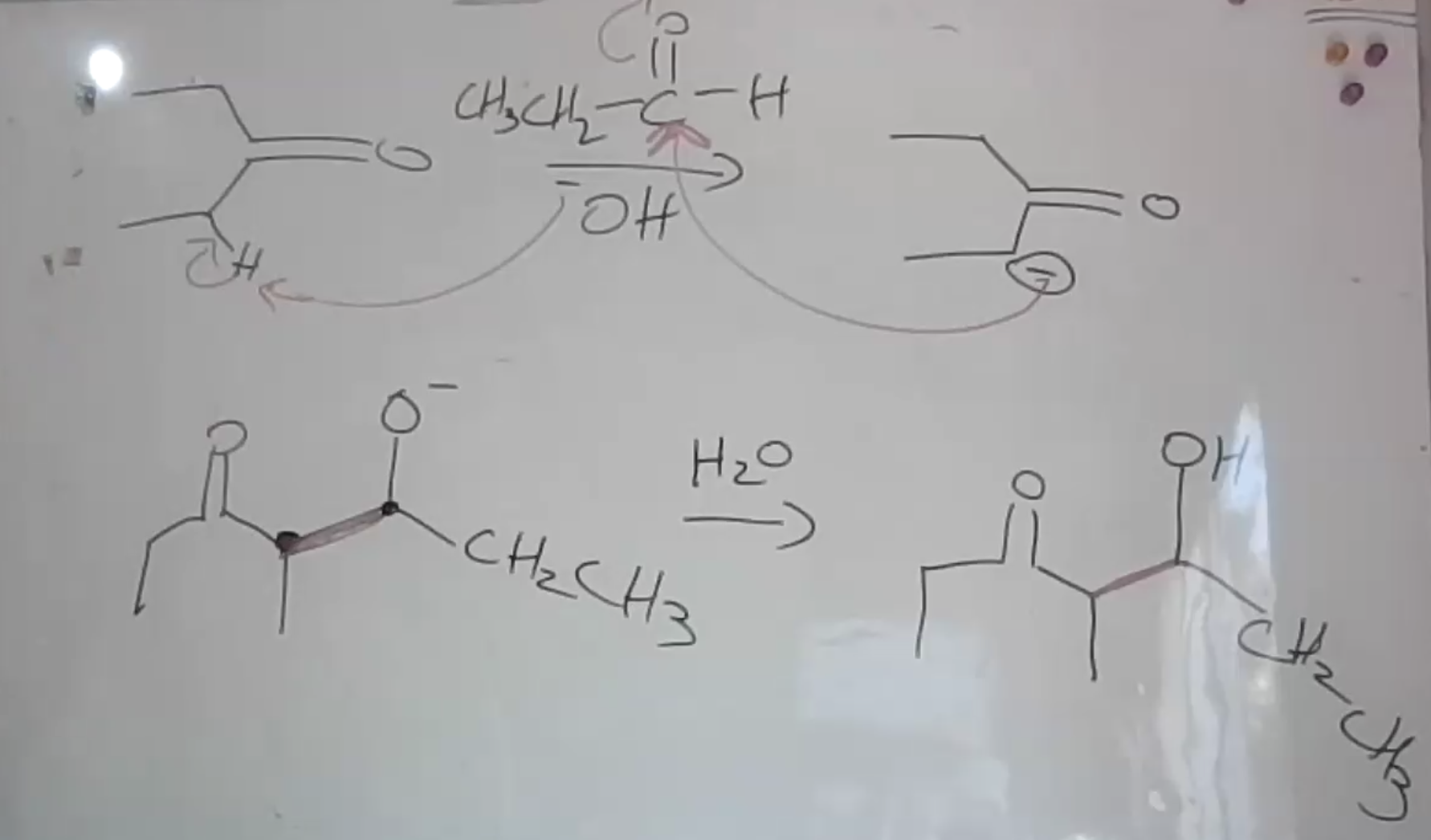
שאלה 4: אלדול תוך
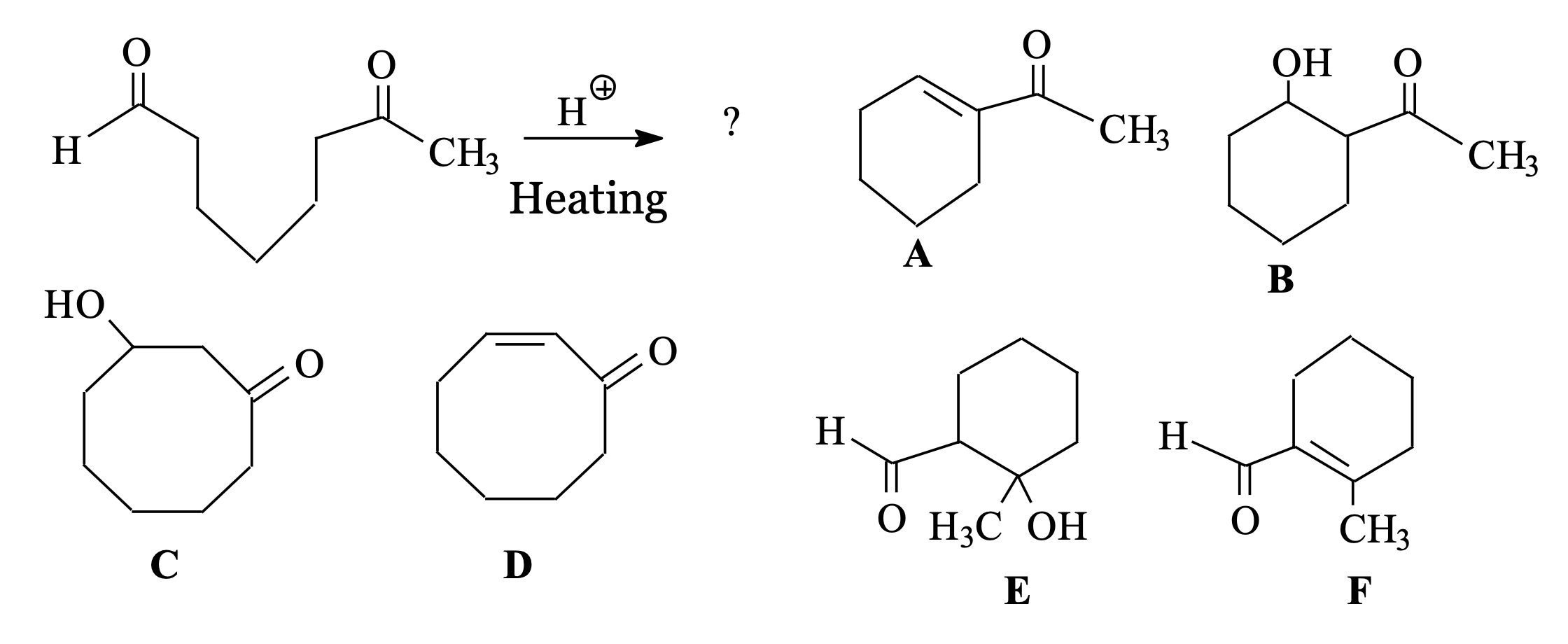
התשובה היא $\mathrm{A}$.
תגובת קלייזן - דחיסת אסטרים
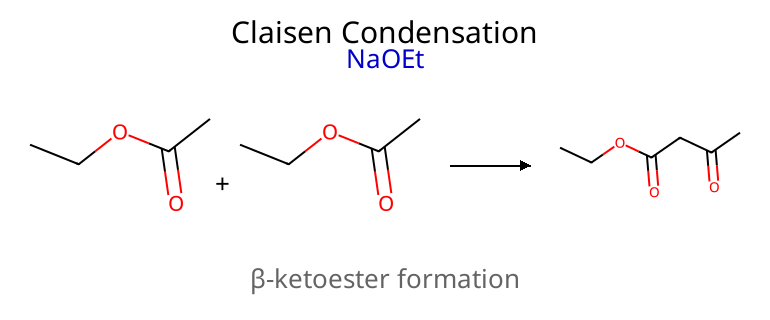
המנגנון המלא
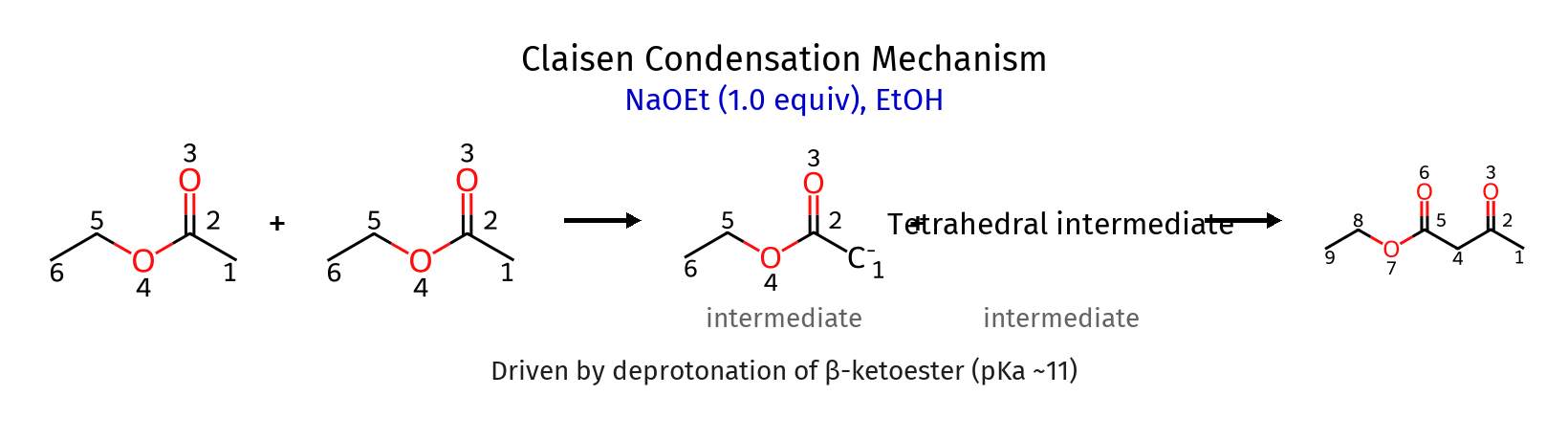
תגובת קלייזן מתרחשת בין שני אסטרים ליצירת β-קטו-אסטר:
-
יצירת אנולאט מאסטר:
\[\ce{CH3-CO2Et + EtO^- -> CH2^--CO2Et + EtOH}\] -
התקפה על אסטר שני:
\[\ce{CH2^--CO2Et + CH3-CO2Et -> CH3-C(O^-)(CH2-CO2Et)-OEt}\] -
אלימינציה של אלקוקסיד:
\[\ce{CH3-C(O^-)(CH2-CO2Et)-OEt -> CH3-CO-CH2-CO2Et + EtO^-}\] -
חומצה לנטרול:
\[\ce{CH3-CO-CH2-CO2Et + H3O^+ -> CH3-CO-CH2-CO2Et + H2O}\]
הבדל מהותי מאלדול: בקלייזן יש יציאת קבוצה עוזבת (אלקוקסיד) במקום פרוטונציה של אוקסיאניון.
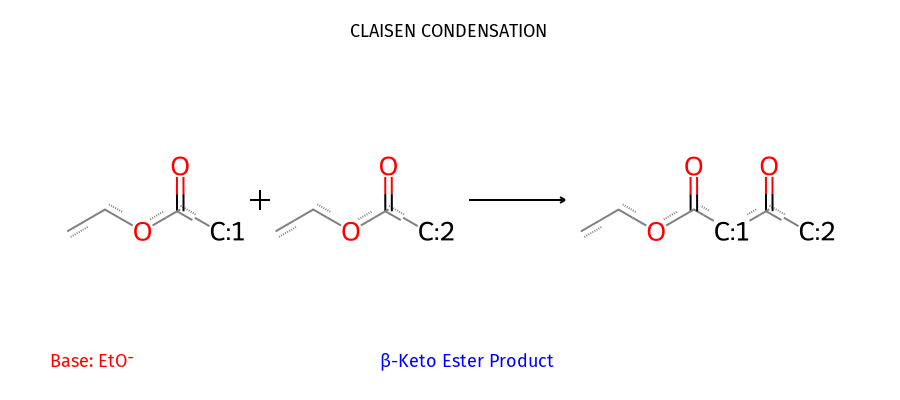
תגובת קלייזן תוך-מולקולרית (ציקליזציית דיקמן)
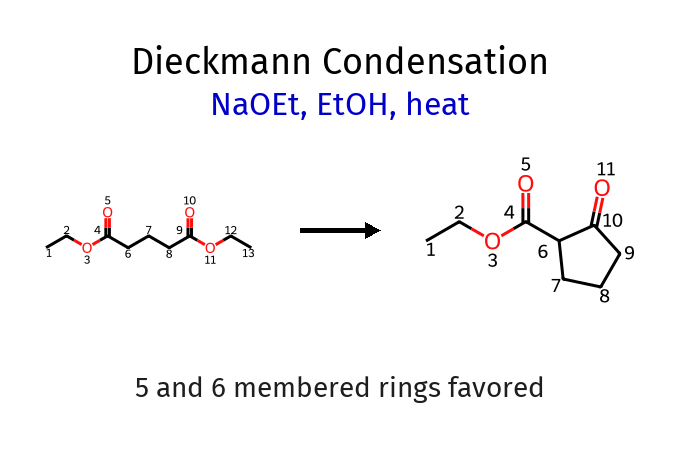
כאשר שני האסטרים נמצאים באותה מולקולה, נוצרות טבעות. העדיפות היא לטבעות של 5 או 6 איברים:
\[\ce{EtO2C-(CH2)4-CO2Et ->[EtO^-][\Delta] \text{cyclic β-keto ester}}\]דקרבוקסילציה של β-קטו-חומצות
התנאי המבני הקריטי
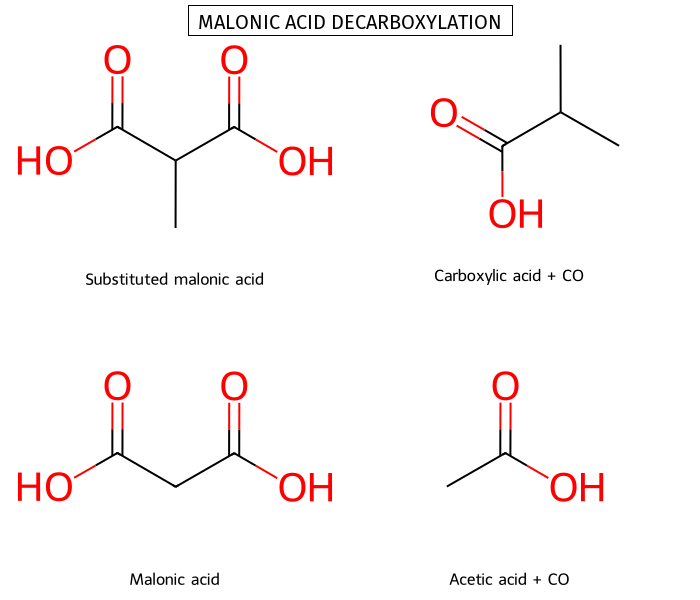
דקרבוקסילציה ספונטנית מתרחשת רק כאשר חומצה קרבוקסילית נמצאת בעמדה β לקרבוניל:
\[\ce{R-CO-CH2-COOH ->[\Delta] R-CO-CH3 + CO2}\]מנגנון תגבות דקרבוקסילציה - מעבר ציקלי
- מעבר ציקלי דרך מצב מעבר בן 6 איברים:
- הפרוטון של החומצה עובר לחמצן הקרבונילי
- הקשר C-C נשבר
- נוצר קשר כפול C=C
-
יציאת CO₂ ויצירת אנול:
\[\ce{R-CO-CH2-COOH -> R-C(OH)=CH2 + CO2}\] -
טאוטומריזציה לקטון:
\[\ce{R-C(OH)=CH2 -> R-CO-CH3}\]
זיהוי במולקולות מורכבות: יש לחפש קרבוניל וחומצה המופרדים על ידי פחמן אחד בדיוק.
יישומים ביולוגיים
תגובת אלדול בהזדקנות - Cross-linking של קולגן
הקולגן, החלבון הנפוץ ביותר בגוף, עובר תגובות אלדול ספונטניות עם הגיל:
- חמצון אנזימטי: האנזים ליזיל אוקסידאז מחמצן קבוצות אמינו של ליזין לאלדהידים
- דחיסת אלדול: שני אלדהידים מגיבים ליצירת cross-links
- אלימינציה: יצירת קשרים צולבים בלתי רוויים
השלכות: הקשרים הצולבים מפחיתים את גמישות הרקמות, תורמים להזדקנות העור והרקמות.
שאלה 3
מה יהיה התוצר העיקרי בתגובה הבאה?
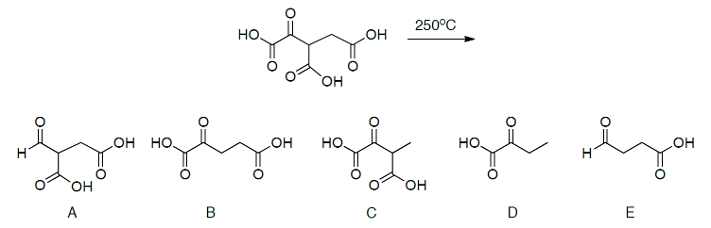
B זאת התשובה הנכונה.
יש חימום של מולקולה עם קרבונילים - תגובת דקרבוקסילציה
חייב להיות פחמן אחד הפרש בין שני הפחמנים הקרבונילים של החומצה.
במקרה הזה האלקטרונים נכנסים פנימה.
הקשר הכפול מתפרק, עולים למעלה וכו׳.
הפירוק פה:
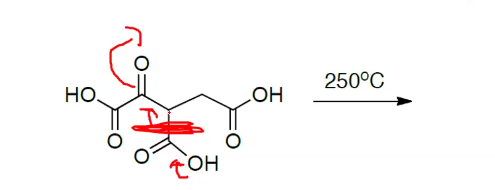
רק שם יש הפרש של פחמן אחד.
שאלה 4 - תגובת אלדול תוך-מולקולרית מורכבת
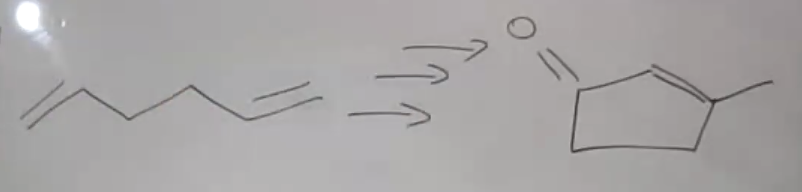
כאשר מתבקשים לסנתז מולקולה ציקלית המכילה קשר כפול צמוד לקרבוניל, יש לעבוד אחורנית:
ניתוח רטרוסינתטי:
-
זיהוי התוצר: אלפא,בטא-קרבוניל בלתי רווי מעיד על תוצר אלדול שעבר אלימינציה
-
שלב אחורה ראשון: לפני האלימינציה היה אלפא,בטא-הידרוקסי-קרבוניל:
\[\ce{R-CH=CH-CO-R' <- R-CH(OH)-CH2-CO-R'}\] - שלב אחורה שני: זיהוי הקרבונילים המקוריים:
- הקשר שנוצר הוא בין פחמן אלפא של קרבוניל אחד לפחמן קרבונילי של השני
- יש לזהות היכן היו שני הקרבונילים לפני התחיסה
- תכנון הסינתזה:
- הכנת הקרבונילים הדרושים (למשל על ידי הידרציה של אלקינים)
- ביצוע תגובת אלדול תוך-מולקולרית
- חימום לאלימינציה
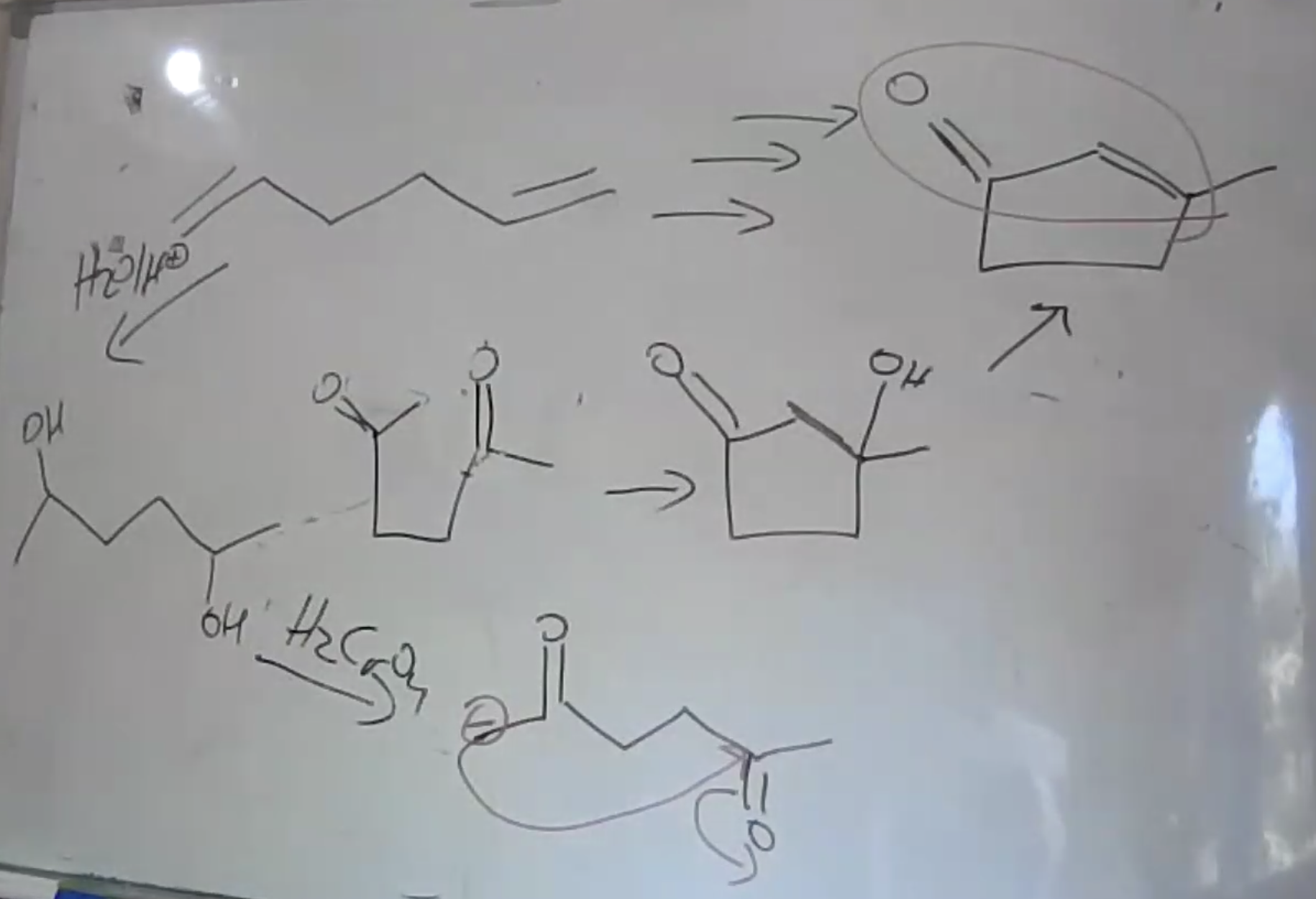
אמינים - מבנה ותכונות
סיווג אמינים
- אמין ראשוני: $\ce{R-NH2}$
- אמין שניוני: $\ce{R2NH}$
- אמין שלישוני: $\ce{R3N}$
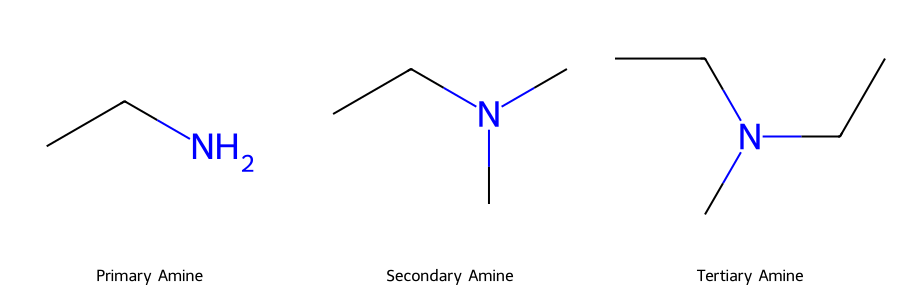
בסיסיות של אמינים
סדר הבסיסיות: אמין שניוני > אמין ראשוני > אמין שלישוני > אמוניה
הסיבות:
- אפקט אינדוקטיבי: קבוצות אלקיל דוחפות אלקטרונים
- הפרעה סטרית: באמין שלישוני מפריעה לקליטת פרוטון
גורמים המשפיעים על בסיסיות
-
רזוננס: אנילין פחות בסיסי מציקלוהקסילאמין בגלל דה-לוקליזציה של הזוג הבודד
-
אפקט אינדוקטיבי: קבוצות מושכות אלקטרונים מפחיתות בסיסיות
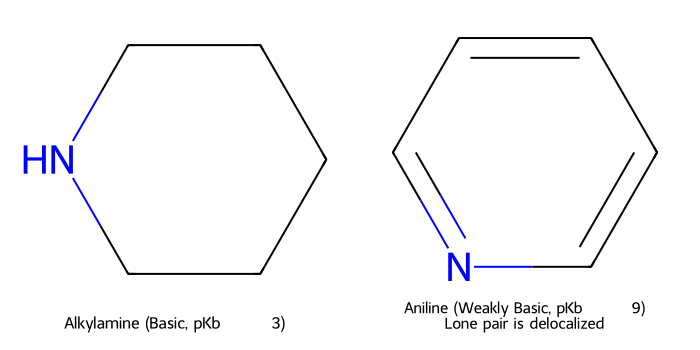
תגובות של אמינים
-
אלקילציה ($\mathrm{S_N2}$):
\[\ce{RNH2 + R'X -> RR'NH + HX}\] -
יצירת אימין (תגובת שיף):
\[\ce{RNH2 + R'2C=O -> R'2C=NR + H2O}\]
-
חיזור אימינים לאמינים:
\[\ce{R2C=NR' ->[H2/Pd] R2CH-NHR'}\]
סיכום
תגובות הלוגנציה באלפא
| תנאי התגובה | מנגנון | חומר ביניים | מגבלות | תוצר |
|---|---|---|---|---|
| קטליזה חומצית | דרך אנול | $\ce{R-C(OH)=CH-R’}$ | רק מימן אחד מוחלף | $\ce{R-CO-CHX-R’}$ |
| קטליזה בסיסית | דרך אנולאט | $\ce{R-CO-CH^–R’}$ | כל המימנים יכולים להיות מוחלפים | $\ce{R-CO-CX3-R’}$ |
תגובות אלדול
מנגנון לפי סוג קטליזה
| קטליזה | חומר ביניים | מנגנון מלא | תוצר ראשוני |
|---|---|---|---|
| בסיסית | אנולאט | יצירת אנולאט ← התקפה על קרבוניל ← פרוטונציה | אלפא,בטא-הידרוקסי-קרבוניל |
| חומצית | אנול | יצירת אנול ← פרוטונציה של קרבוניל אלקטרופילי ← התקפה | אלפא,בטא-הידרוקסי-קרבוניל |
סוגי תגובות אלדול
| סוג התגובה | תנאים | תוצר סופי | הערות |
|---|---|---|---|
| אלדול פשוט | ללא חימום | $\ce{R-CH(OH)-CH2-CO-R’}$ | עצירה בשלב ההידרוקסי |
| אלדול + דהידרציה | עם חימום ($\Delta$) | $\ce{R-CH=CH-CO-R’}$ | מצומד - יציב במיוחד |
| אלדול מעורב | קטון + אלדהיד | קטון = נוקלאופיל אלדהיד = אלקטרופיל | רק קרבונילים עם H באלפא יכולים להיות נוקלאופיל |
| אלדול תוך-מולקולרי | מולקולה עם 2 קרבונילים | טבעות 5-6 איברים | עדיפות תרמודינמית |
תגובת קלייזן (דחיסת אסטרים)
| שלב | מנגנון | תוצר ביניים | הערה מרכזית |
|---|---|---|---|
| 1 | יצירת אנולאט | $\ce{CH2^–CO2Et}$ | אלקוקסיד כבסיס |
| 2 | התקפה על אסטר שני | $\ce{CH3-C(O^-)(CH2-CO2Et)-OEt}$ | יצירת קשר C-C |
| 3 | אלימינציה | $\ce{CH3-CO-CH2-CO2Et}$ | שונה מאלדול - יציאת OR במקום פרוטונציה |
תוצר סופי: β-קטו-אסטר
דקרבוקסילציה
| תנאי מבני | מנגנון | תוצר | דרישה קריטית |
|---|---|---|---|
| β-קטו-חומצה | מעבר ציקלי 6-איברים | $\ce{R-CO-CH3 + CO2}$ | בדיוק פחמן אחד בין הקרבונילים |
בסיסיות אמינים
| סוג אמין | סדר בסיסיות | pKa טיפוסי | גורמים משפיעים |
|---|---|---|---|
| שניוני | הכי בסיסי | ~11 | אפקט אינדוקטיביי + הפרעה מינימלית |
| ראשוני | בסיסיות גבוהה | ~10.7 | אפקט אינדוקטיבי |
| שלישוני | בסיסיות נמוכה יחסית | ~10.8 | הפרעה סטרית |
| אמוניה | הכי פחות בסיסי | 9.25 | אין אפקט אינדוקטיבי |
גורמים מיוחדים המשפיעים על בסיסיות
| מקרה | השפעה | סיבה |
|---|---|---|
| אנילין | בסיסיות נמוכה מאוד | רזוננס עם הטבעת הארומטית |
| קבוצות מושכות אלקטרונים | הפחתת בסיסיות | אפקט אינדוקטיבי שלילי |
תגובות אמינים
| תגובה | ריאגנטים | תוצר | מנגנון |
|---|---|---|---|
| אלקילציה | $\ce{RX}$ (אלקיל הליד) | אמין מותמר יותר | $\mathrm{S_N2}$ |
| יצירת אימין | קרבוניל ($\ce{C=O}$) | $\ce{R2C=NR’}$ | תגובת שיף + אלימינציית מים |
| חיזור אימין | $\ce{H2/Pd}$ | אמין שניוני | הידרוגנציה של קשר C=N |
נקודות מפתח
- הלוגנציה: בסיסית = כל ה-H, חומצית = H אחד בלבד
- אלדול: בחימום ← אלימינציה לתוצר מצומד יציב
- קלייזן: אלימינציה של OR (שונה מאלדול!)
- דקרבוקסילציה: רק β-קטו-חומצות, בדיוק פחמן אחד הפרש
- בסיסיות אמינים: שניוני > ראשוני > שלישוני > אמוניה
pKa חשובים:
- פחמן אלפא לקרבוניל: ~17-19
- די-קטון: ~9
- פחמן רגיל: ~50