חזרה - מעגל האוריאה
בשיעור הקודם דיברנו על מעגל האוריאה (Urea Cycle), המסלול המרכזי שבו הגוף מסלק עודפי חנקן על-ידי המרת אמוניה ($\ce{NH3}$) / אמוניום ($\ce{NH4+}$) (רעילה) ל-אוריאה ($\ce{(NH2)2CO}$) (פחות רעילה ומסיסה), המופרשת בשתן.
מקורות עיקריים ליצירת אמוניה בגוף:
- פירוק חומצות אמינו מהתזונה לאחר עיכול וספיגה.
- פירוק חלבונים אנדוגני (Turnover טבעי של חלבונים בתא).
- הובלת חנקן מרקמות פריפריאליות באמצעות גלוטמין (מסלול הגלוטמין).
- הובלת חנקן מהשריר באמצעות אלנין (מסלול האלנין; Glucose-Alanine cycle).
ארבע חומצות אמינו “צומתיות” בניהול החנקן:
אלנין- נשא מרכזי של חנקן מהשריר לכבד.גלוטמט- “מרכז טרנסאמינציה”; אוסף קבוצות אמינו מחומצות אמינו רבות.גלוטמין- נשא לא-רעיל של אמוניה מרקמות פריפריאליות.אספרטט- תורם את אטום החנקן השני שנכנס למעגל האוריאה (בשלב יצירת ארגינינוסוקצינאט).
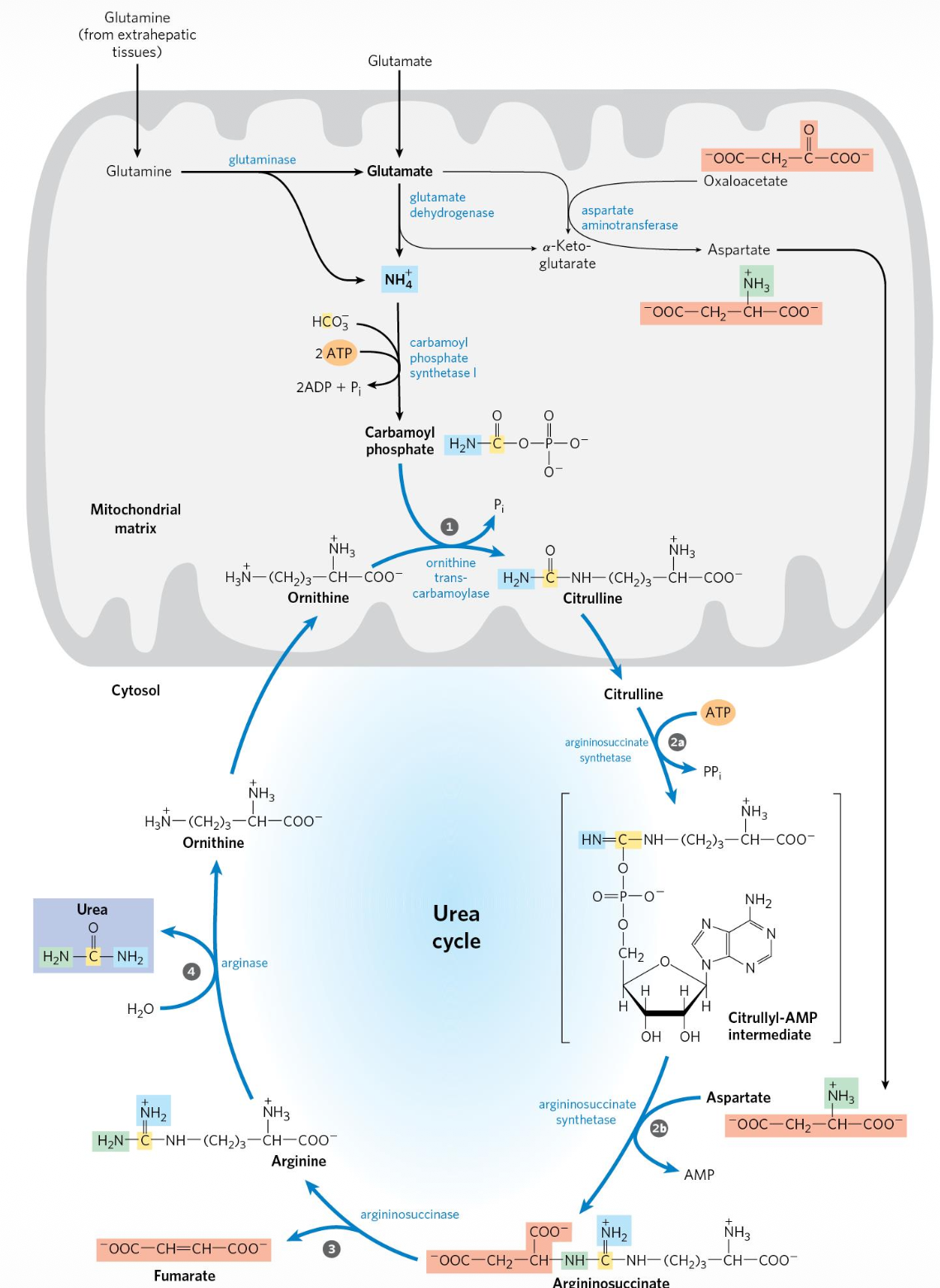
נקודה חשובה: מעגל האוריאה מתרחש בשני מדורים תאיים:
- במיטוכונדריה: שני השלבים הראשונים (CPS1, OTC).
- בציטוזול: שלושת השלבים הבאים (ASS1, ASL, Arginase).
כלומר, מעגל האוריאה הוא מסלול של חמישה שלבים אנזימטיים, ולא “ארבעה שלבים”.
הקשר בין מעגל קרבס למעגל האוריאה
קיים חיבור מטבולי הדוק בין מעגל האוריאה למעגל קרבס, דרך מעקף אספרטט-ארגינינוסוקצינאט (Aspartate-Argininosuccinate Shunt).
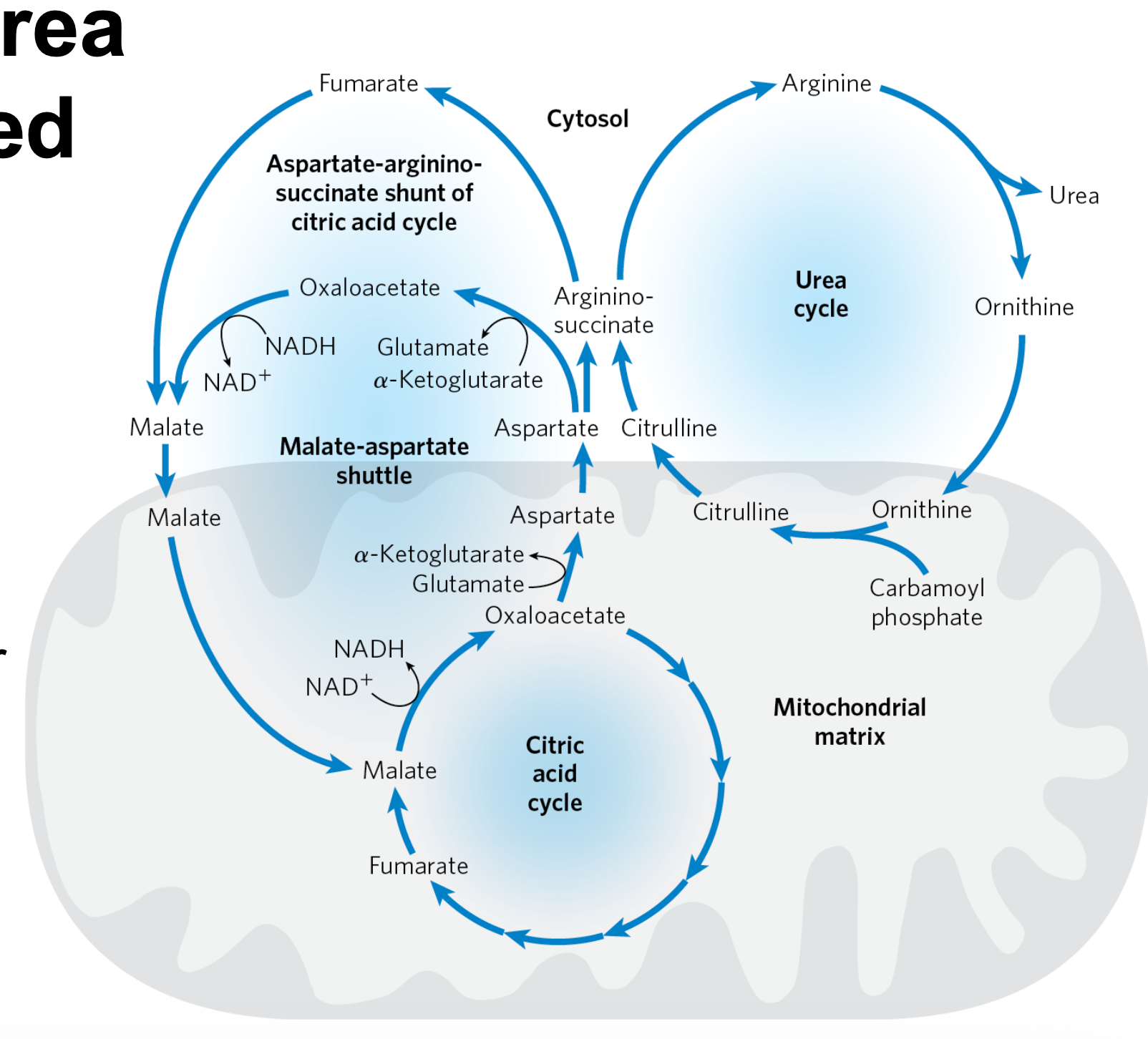
מנגנון הקישור
- במיטוכונדריה נוצר ציטרולין (Citrulline), והוא מועבר לציטוזול.
- בציטוזול האנזים Argininosuccinate Synthetase (ASS1) מחבר ציטרולין עם אספרטט (בצריכת $\ce{ATP}$) ליצירת Argininosuccinate.
- האנזים Argininosuccinate Lyase (ASL) מפרק ארגינינוסוקצינאט ל-ארגינין ול-פומראט (Fumarate).
- ה-פומראט יכול להפוך ל-מלאט ואז ל-אוקסלואצטט (OAA), וכך “נכנס” למעגל קרבס.
- מאוקסלואצטט ניתן לייצר שוב אספרטט (באמצעות טרנסאמינציה) שמוזן חזרה למעגל האוריאה.
המשמעות הפיזיולוגית
חשוב: המעקף יוצר זרימה דו-כיוונית של תוצרי ביניים בין המעגלים:
- מעגל האוריאה משתלב במטבוליזם האנרגטי (TCA), ולא פועל כנתיב “מנותק”.
- נוצרת שמירה על מאזן תוצרי-הביניים: פומראט שמיוצר באוריאה יכול לתמוך במעגל קרבס, ואספרטט שמגיע מה-TCA מספק את החנקן השני לאוריאה.
בקרה על מעגל האוריאה
בקרת מעגל האוריאה מתבצעת בשתי רמות עיקריות:
1) בקרה ברמת ביטוי אנזימים (Gene Expression)
בעת עומס חנקני (למשל, לאחר ארוחה עתירת חלבון או במצבי קטבוליזם), הכבד מעלה את הביטוי של:
- אנזימי מעגל האוריאה עצמם
- ובעיקר של האנזים הקובע-קצב בתחילת המסלול: CPS1 (Carbamoyl Phosphate Synthetase I)
2) בקרה אלוסטרית על CPS1 באמצעות N-Acetylglutamate (NAG)
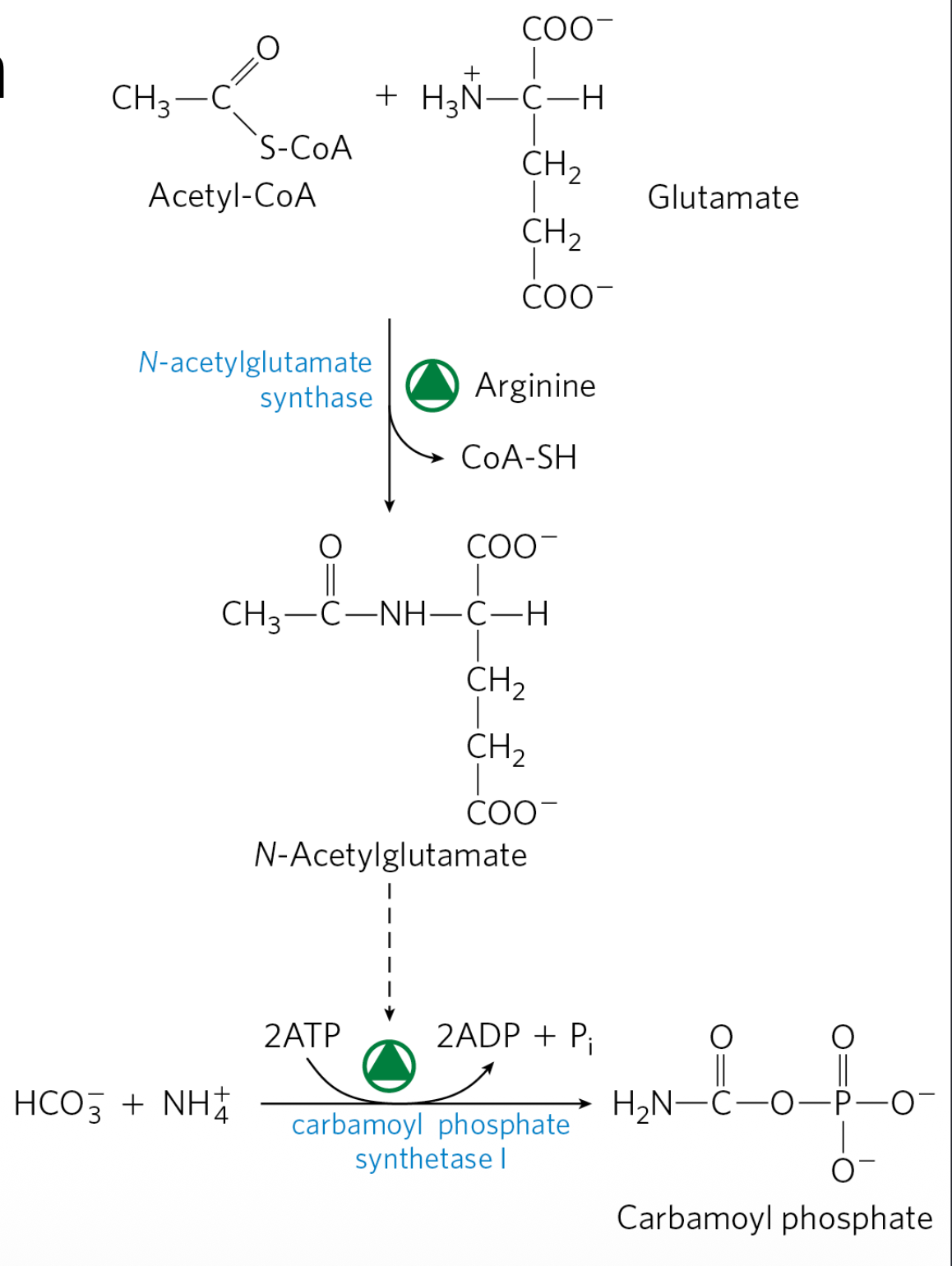
המולקולה N-Acetylglutamate (NAG) היא מפעיל אלוסטרי חיוני של CPS1:
- ללא NAG ← CPS1 כמעט ואינו פעיל.
- בנוכחות NAG ← CPS1 מופעל, והמסלול “נפתח” לזרימת חנקן.
יצירת N-Acetylglutamate
\[\ce{Acetyl-CoA + Glutamate ->[N-Acetylglutamate Synthase] N-Acetylglutamate + CoA}\]האנזים N-Acetylglutamate Synthase (NAGS) מוגבר פעילות בנוכחות ארגינין.
הלוגיקה המטבולית (למה זה הגיוני)
| מולקולה | מה היא “מסמנת” |
|---|---|
| גלוטמט | עומס קבוצות אמינו (טרנסאמינציות) ← נטייה ליצירת אמוניה |
| $\ce{Acetyl-CoA}$ | מצב קטבולי/זרימת פירוק גבוהה |
| ארגינין | תוצר במסלול עצמו; מצביע על פעילות/זרימה במעגל |
מסקנה: אנחנו לא מנסים כאן “לעצור” מסלול, אלא להאיץ סילוק רעל.
כשעולה פירוק חלבונים ← עולה ייצור אמוניה ← צריך להפעיל מהר את מעגל האוריאה.
מוטציות במעגל האוריאה (Urea Cycle Disorders)
פגיעה באחד מאנזימי המסלול עלולה להוביל ל-היפראמונמיה (Hyperammonemia) - מצב מסכן חיים.
עקרונות טיפול כלליים (ברמה קלינית):
- הפחתת עומס חנקן באמצעות התאמת תזונה (לרוב הפחתת חלבון תחת פיקוח).
- במצבים חריפים משתמשים גם באמצעים להפחתת אמוניה במהירות (תלוי חומרה והנחיות רפואיות).
פירוק חומצות אמינו - סיכום מארגן
לכל חומצת אמינו נתיב פירוק ייחודי, אך בסופו של דבר רוב הנתיבים “מתכנסים” לתוצרים שנכנסים למטבוליזם המרכזי (TCA/$\ce{Acetyl-CoA}$/קטונים).
נהוג לסווג חומצות אמינו ל:
| קטגוריה | משמעות |
|---|---|
| קטוגניות (Ketogenic) | מתפרקות ל-$\ce{Acetyl-CoA}$ או לגופי קטו ← אינן יכולות להפוך נטו לגלוקוז |
| גלוקוגניות (Glucogenic) | מתפרקות לתוצרים שיכולים להזין גלוקונאוגנזה (למשל דרך OAA, α-KG, $\ce{Succ-CoA}$ וכד’) |
הערה: יש חומצות אמינו שהן גם קטוגניות וגם גלוקוגניות.
אחרי שסגרנו איך הגוף מפנה חנקן (אוריאה) ואיפה שלדי הפחמן נכנסים למטבוליזם, עוברים עכשיו לשלב שבו מפיקים את רוב ה־ATP: נשימה תאית (ETC/OxPhos).
נשימה תאית (Cellular Respiration)
כעת עוברים לשלב הסופי של הפקת אנרגיה: שרשרת הובלת אלקטרונים (Electron Transport Chain, ETC) ו-זרחון חמצוני (Oxidative Phosphorylation).
מבט-על מטבולי
גליקוליזה / חמצון חומצות שומן / פירוק חומצות אמינו
↓
Acetyl-CoA
↓
מעגל קרבס
↓
נשאי אלקטרונים (NADH, FADH₂)
↓
שרשרת הובלת אלקטרונים
↓
ATP Synthase
↓
ATP
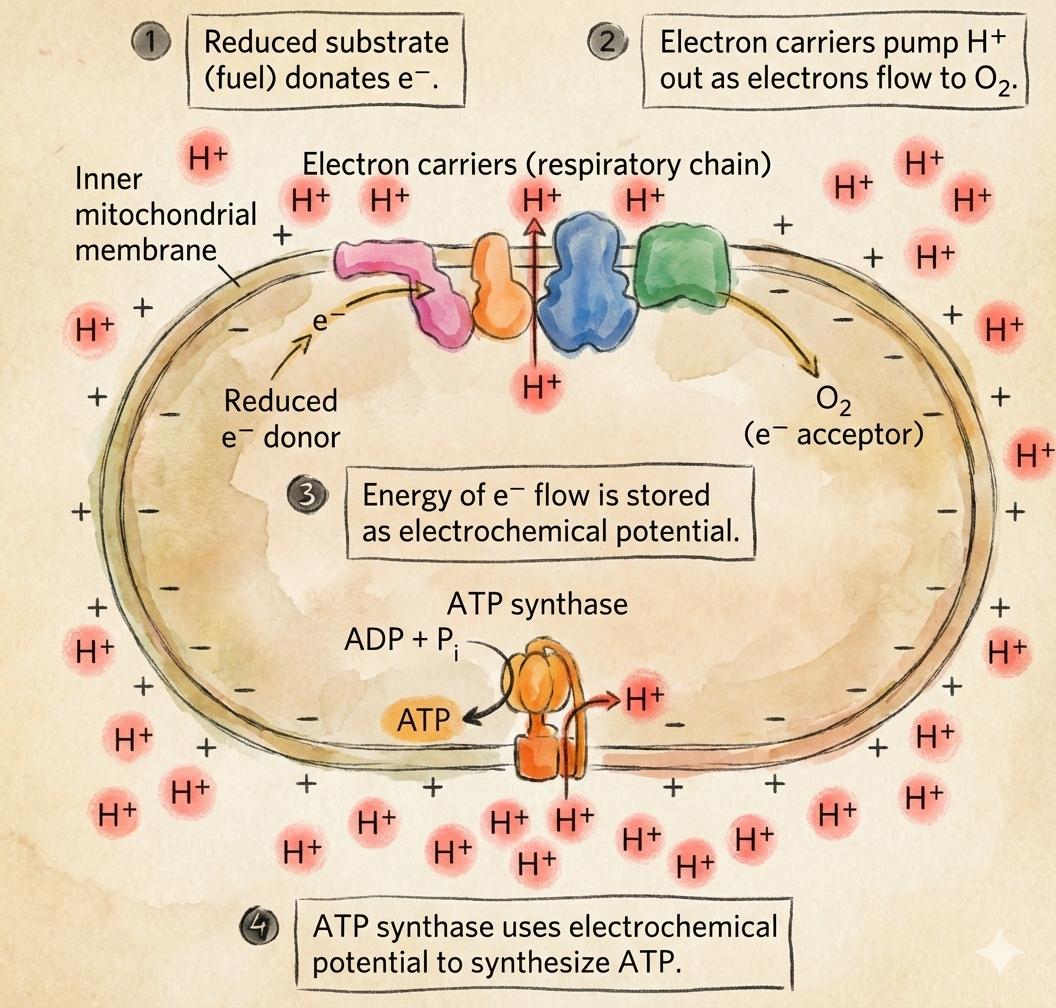
המטרה היא לנצל את האנרגיה האצורה ב-NADH ו-FADH2 כדי:
- להעביר אלקטרונים דרך קומפלקסים בממברנה הפנימית,
- לשאוב פרוטונים וליצור מפל פרוטונים,
- ולהשתמש במפל הזה כדי להניע את
ATP SynthaseליצירתATP, תוך חיזור חמצן למים.
התיאוריה הכימואוסמוטית (The Chemiosmotic Theory)
רקע היסטורי קצר
עד תחילת שנות ה-60:
- זיהו את הקומפלקסים ואת מעבר האלקטרונים,
- אך המנגנון שמחבר זאת ליצירת
ATPלא היה ברור.
התובנה המרכזית (Peter Mitchell)
פיטר מיטשל הציע שהכוח המניע ליצירת ATP הוא הפרש פוטנציאל אלקטרוכימי של פרוטונים בין שני צידי הממברנה הפנימית (Proton Motive Force).
- הרעיון היה שנוי במחלוקת בתחילה,
- והוא זכה על כך בפרס נובל בשנת 1978.
מבנה המיטוכונדריה
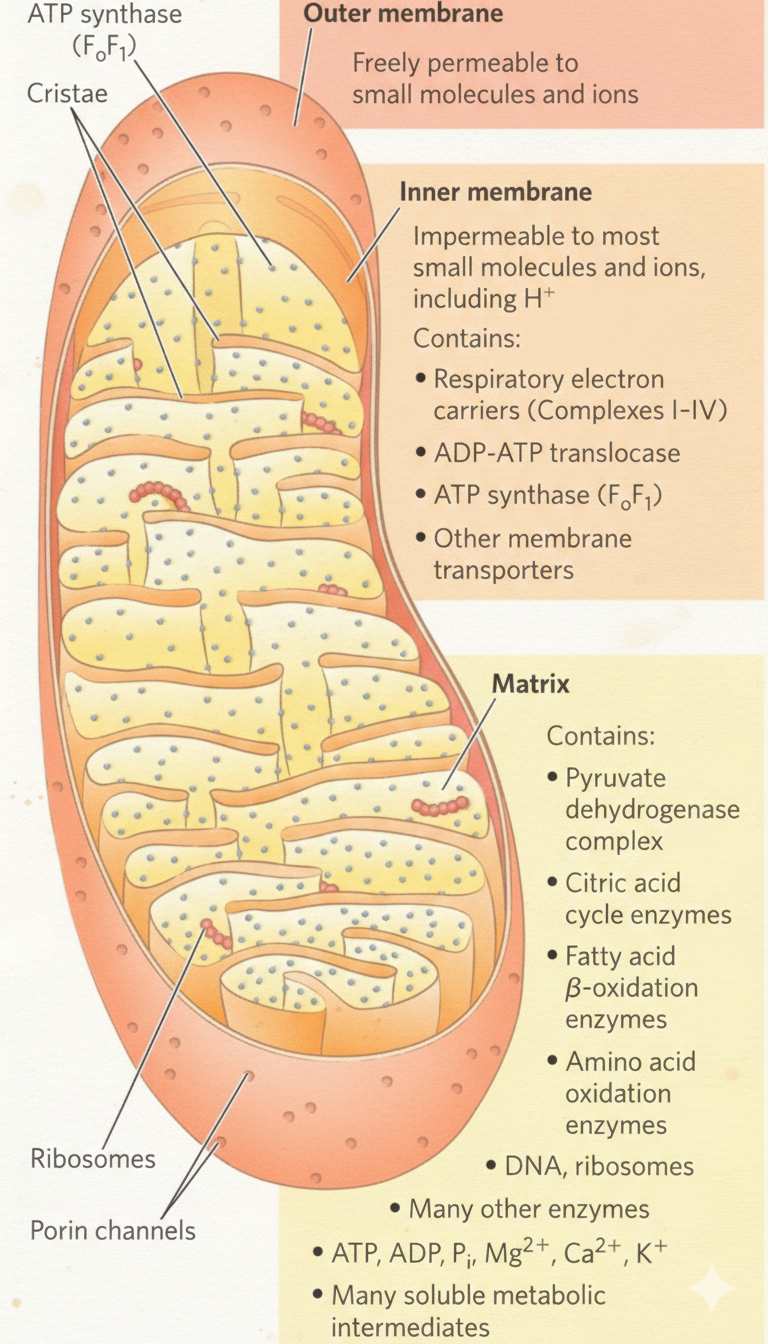
שתי ממברנות
| ממברנה | תכונות עיקריות | מה נמצא עליה/בה |
|---|---|---|
| חיצונית | חדירה יחסית (Porins/VDAC מאפשרים מעבר מולקולות קטנות עד $\sim 5 \, \mathrm{kDa}$) | - |
| פנימית | כמעט לא חדירה; מעבר מתווך טרנספורטרים | קומפלקסי ה-ETC, ATP Synthase, נשאים (Translocases) |
מדורים עיקריים
- Intermembrane Space (P-side) - מצטברים בו פרוטונים.
- Matrix (N-side) - בו מתקיימים TCA, β-Oxidation, PDH ועוד.
- Cristae - קיפולי הממברנה הפנימית שמגדילים שטח פנים לקומפלקסים.
דינמיות המיטוכונדריה
המיטוכונדריה עוברת Fusion/Fission בהתאם לצרכים ולמצבי עקה, וברקמות עתירות אנרגיה (לב/שריר/מוח) יש לרוב צפיפות מיטוכונדריות גבוהה ותכולת קומפלקסים רבה.
נשאי אלקטרונים ב-ETC
סוגי נשאים מרכזיים
| נשא | תיאור | מספר אלקטרונים |
|---|---|---|
| $\ce{NAD+}$/$\ce{NADH}$ | נגזרת ניקוטינאמיד | 2 (כהידריד) |
| Flavoproteins (FMN/FAD) | נגזרות ויטמין B₂ | 1 או 2 |
| Ubiquinone ($\ce{CoQ}$) | ליפופילי, נייד בממברנה | 1 או 2 |
| Cytochromes (a, b, c) | Heme עם $\ce{Fe}$ | 1 |
| Iron-Sulfur Centers | אשכולות $\ce{Fe-S}$ | 1 |
הבהרות קצרות:
- $\ce{NADH}$ מוסר הידריד (שני אלקטרונים) ל-FMN בקומפלקס I.
- FAD/FMN יכולים לעבוד במעבר של אלקטרון אחד (Radical/ Semiquinone) או שניים.
- $\ce{CoQ}$ נע חופשי בממברנה בין קומפלקסים ($\ce{Q <=> QH2}$).
- Cytochrome c הוא נשא מסיס במרווח הבין-ממברנלי ונושא אלקטרון אחד בכל פעם.
פוטנציאל חיזור (Reduction Potential)
פוטנציאל חיזור משקף את הנטייה לקבל אלקטרונים:
- אלקטרונים נעים מערכים נמוכים לערכים גבוהים.
- זה יוצר מעבר אלקטרונים ספונטני לאורך השרשרת.
NADH (≈ -0.32V) → Complex I → Q → Complex III → Cyt c → Complex IV → O₂ (≈ +0.82V)
הערכים המוצגים הם ערכים סטנדרטיים; בתא הערכים תלויים גם בריכוזים ובמצב הפיזיולוגי.
ארבעת הקומפלקסים של שרשרת הובלת האלקטרונים
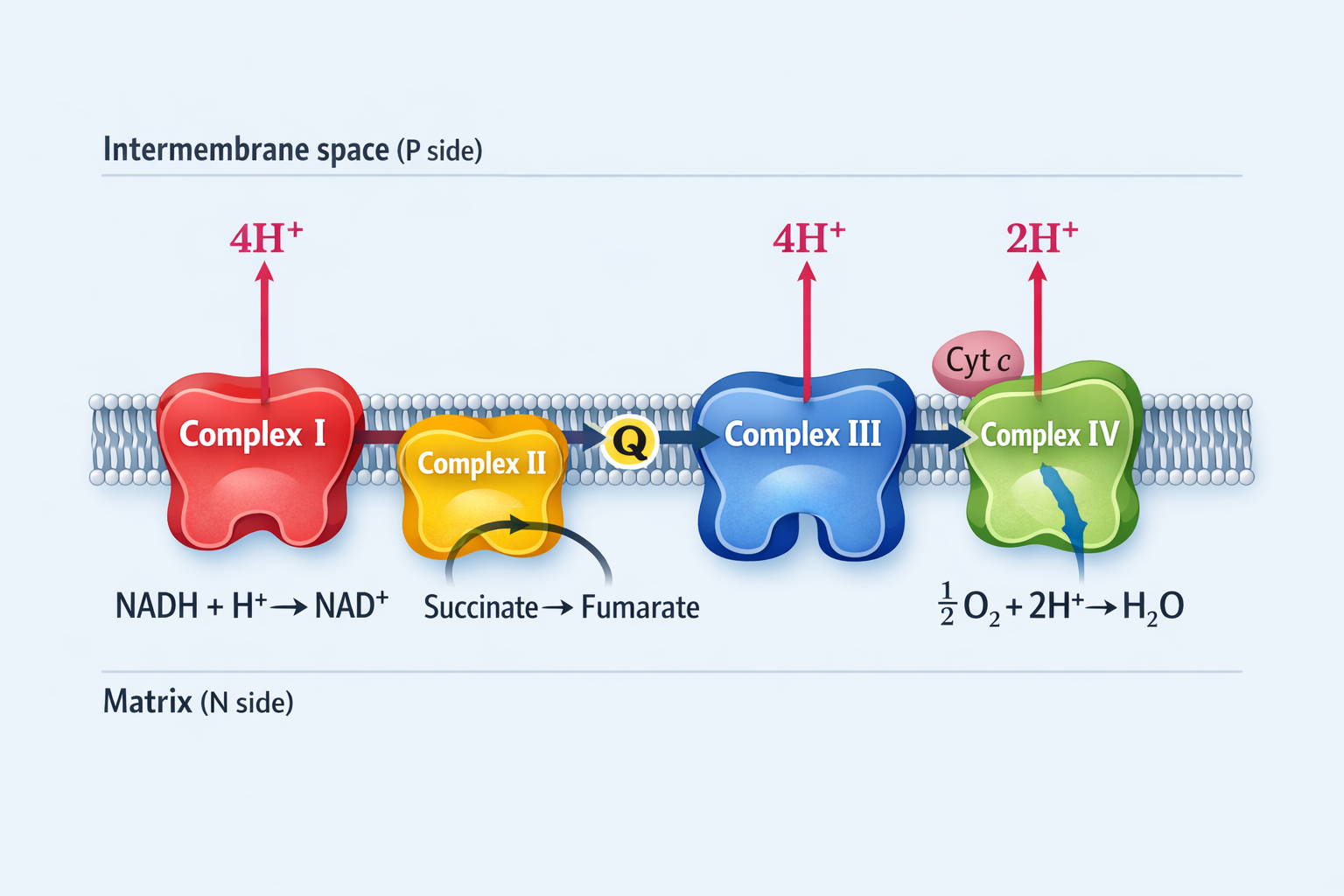
הערה חשובה על ספירת פרוטונים:
לעיתים מציגים נתונים “לשני אלקטרונים” (כלומר פר $\ce{NADH}$ אחד), ולעיתים “לארבעה אלקטרונים” (חיזור מלא של $\ce{O2}$). כאן נציג בצורה עקבית את הספירה המקובלת ל-$\ce{NADH}$ אחד (שני אלקטרונים).
| קומפלקס | שם | מעבר אלקטרונים | פרוטונים נשאבים (ל-$\ce{2e-}$) |
|---|---|---|---|
| I | NADH Dehydrogenase | $\ce{NADH -> Q}$ | $\ce{4H+}$ |
| II | Succinate Dehydrogenase | $\ce{Succinate -> Q}$ | 0 |
| III | Cytochrome bc₁ | $\ce{QH2 -> Cyt c}$ | $\ce{4H+}$ |
| IV | Cytochrome c Oxidase | $\ce{Cyt c -> O2}$ | $\ce{2H+}$ (ונצרכים גם פרוטונים ליצירת מים) |
Complex I: NADH Dehydrogenase
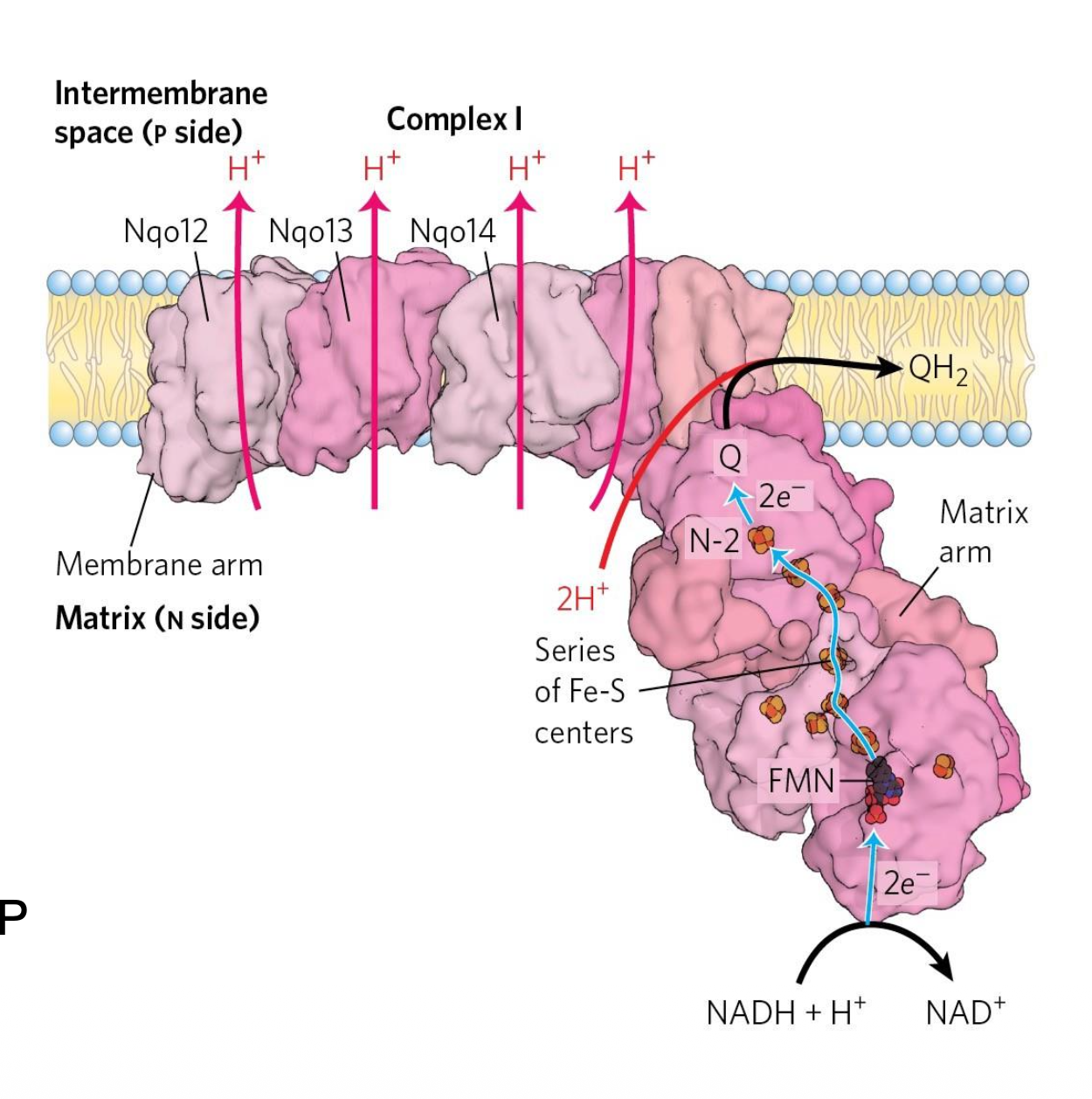
מאפייני Complex I
- מבנה בצורת L
- קומפלקס גדול מאוד ($\sim 1,000 \, \mathrm{kDa}$), עם עשרות תת-יחידות
- מכיל
FMNואשכולות ברזל-גופרית
מהלך עקרוני
- $\ce{NADH}$ מוסר הידריד ל-
FMN. - האלקטרונים עוברים דרך אשכולות $\ce{Fe-S}$.
- $\ce{Q}$ (Ubiquinone) מחוזר ל-$\ce{QH2}$ (Ubiquinol), המקבל שני אלקטרונים ו-2 פרוטונים מהמטריקס.
- במקביל נשאבים $\ce{4H+}$ מהמטריקס למרווח הבין-ממברנלי.
משוואה כללית
\[\ce{NADH + H+ + Q + 4H+_{N} -> NAD+ + QH2 + 4H+_{P}} \tag{Complex I}\]מעכבים עיקריים של Complex I
| מעכב | השפעה |
|---|---|
| Rotenone | חסימת העברת אלקטרונים ל-$\ce{Q}$ |
| Amytal | חסימה דומה |
| Piericidin A | חסימה דומה |
תיקון דיוק: Myxothiazol הוא מעכב של Complex III (אתר Qₒ), לא של Complex I.
Complex II: Succinate Dehydrogenase
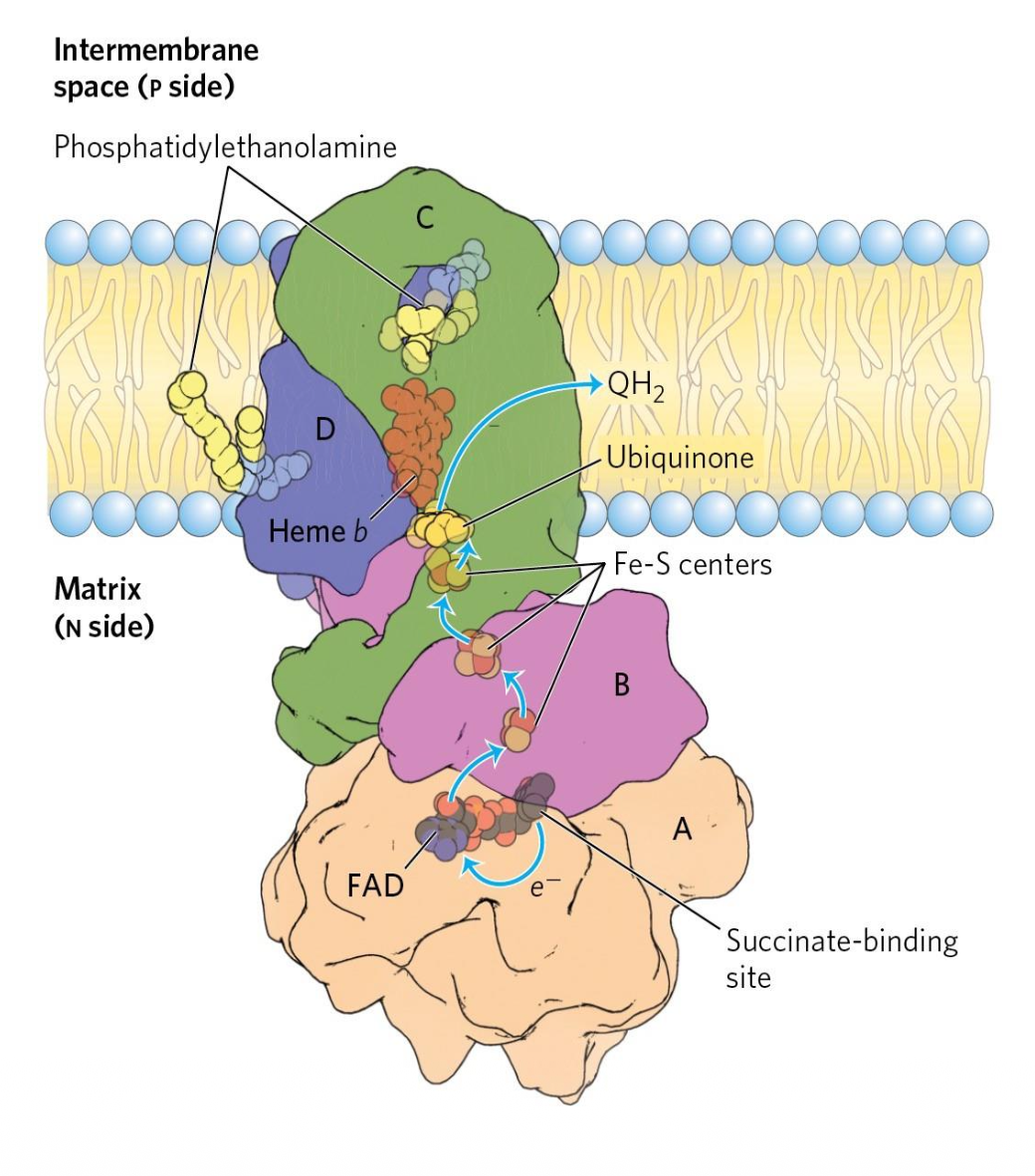
מאפייני Complex II
- אנזים “כפול תפקיד”: חלק ממעגל קרבס וגם חלק מה-ETC
- מכיל
FADואשכולות $\ce{Fe-S}$ - לא שואב פרוטונים
מהלך עקרוני - קומפלקס II
- $\ce{Succinate}$ מחומצן ל-$\ce{Fumarate}$ (ב-TCA - שלב 6 של מעגל קרבס).
- $\ce{FAD}$ מחוזר ל-$\ce{FADH2}$.
- האלקטרונים מועברים ל-$\ce{Q}$ (Ubiquinone) ליצירת $\ce{QH2}$ (Ubiquinol).
משוואה
\[\ce{Succinate + Q \small{(Ubiquinone)} -> Fumarate + QH2 \small{(Ubiquinol)}\tag{Complex II}}\]משמעות אנרגטית: בגלל שאין שאיבת פרוטונים ב-Complex II, אלקטרונים שמקורם ב-$\ce{FADH2}$ תורמים פחות ליצירת מפל פרוטונים לעומת $\ce{NADH}$.
מעגל Q (The Q Cycle)
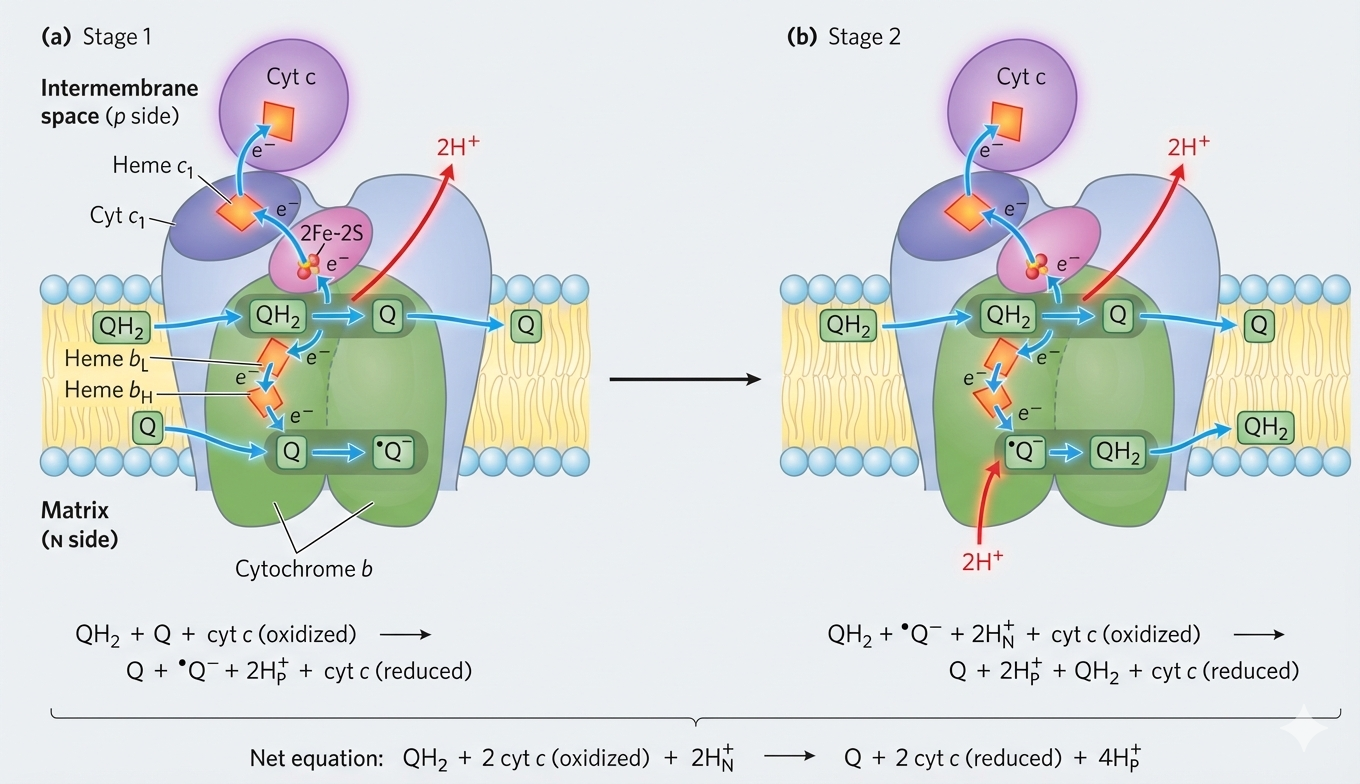
מעגל Q הוא המנגנון שבו Complex III מעביר אלקטרונים מ-$\ce{QH2}$ ל-Cytochrome c תוך התאמה בין:
- $\ce{QH2}$ שמעביר שני אלקטרונים
- לבין $\ce{Cyt c}$ שמקבל אלקטרון אחד בלבד
שני אתרי קישור ב-Complex III
| אתר | נקשר אליו | תפקיד |
|---|---|---|
| Qₒ (חיצוני) | $\ce{QH2}$ | חמצון $\ce{QH2}$ ושחרור פרוטונים לצד P |
| Qᵢ (פנימי) | $\ce{Q}$ | חיזור הדרגתי דרך semiquinone |
תוצאה כוללת (עבור 2 אלקטרונים שמועברים לשני $\ce{Cyt c}$)
- משתחררים $\ce{4H+}$ למרווח הבין-ממברנלי
- ונלקחים $\ce{2H+}$ מהמטריקס ליצירת $\ce{QH2}$ מחדש באתר Qᵢ
Complex III: Cytochrome bc₁
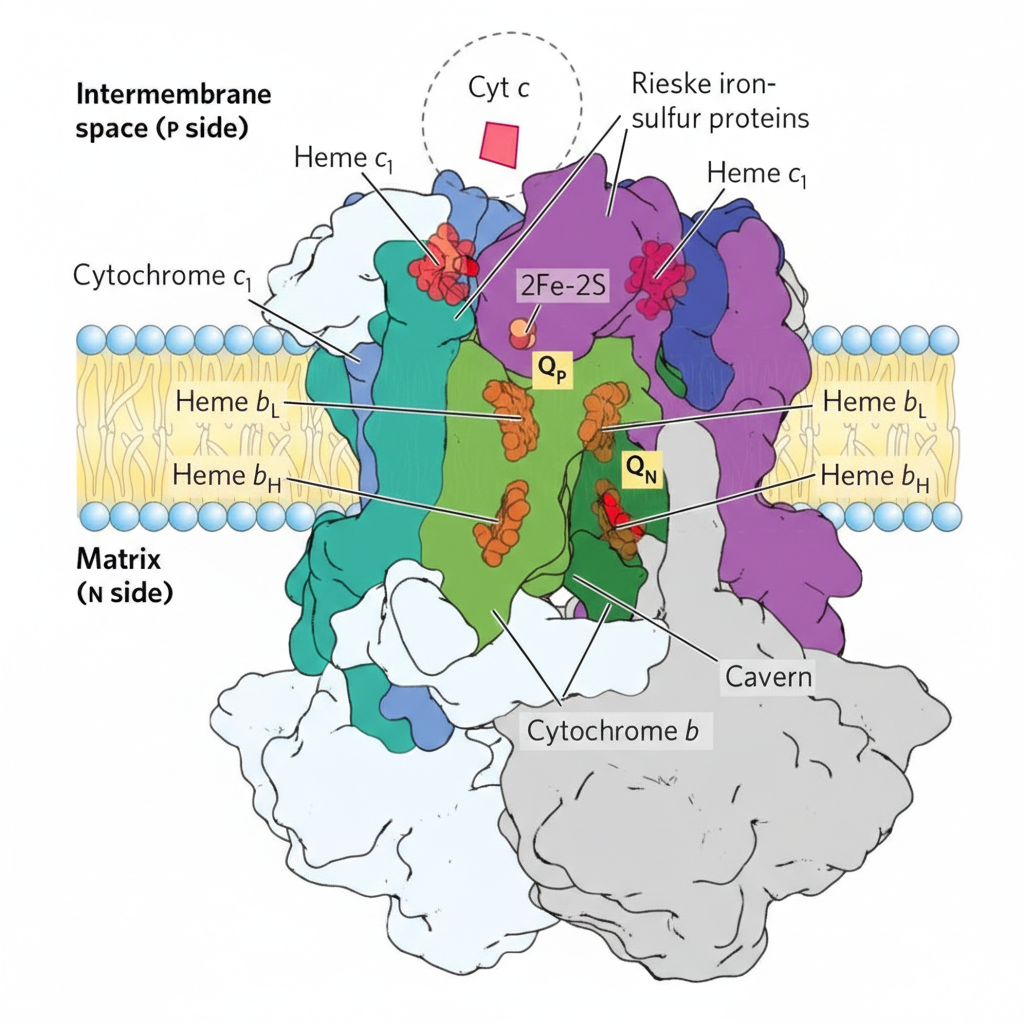
מאפייני Complex III
- דימר (שתי יחידות)
- כולל: Cytochrome b (bL, bH), Cytochrome c₁, וחלבון Rieske ($\ce{Fe-S}$)
משוואה כללית - חיזור $\ce{Cyt c}$ על ידי $\ce{QH2}$
\[\ce{QH2 + 2Cyt c_{ox} + 2H+_{N} -> Q + 2Cyt c_{red} + 4H+_{P}} \tag{Complex III}\]Complex IV: Cytochrome c Oxidase
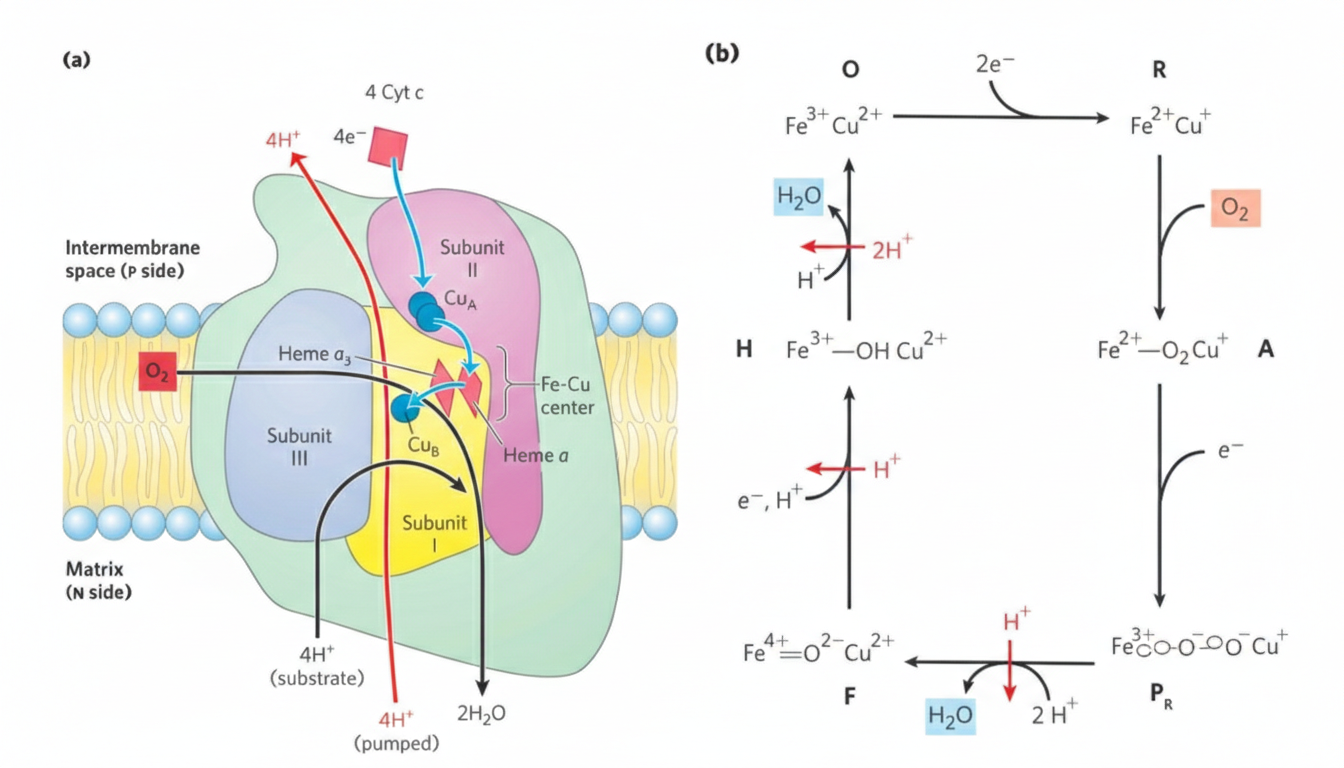
מאפייני Complex IV
- כולל מרכזים מתכתיים: $\ce{Cu_A}$, $\ce{Cu_B}$ וציטוכרומים a, a₃
- בו מתבצע חיזור החמצן למים
משוואה (לחיזור מלא של $\ce{O2}$; ארבעה אלקטרונים)
\[\ce{4Cyt c_{red} + 8H+_{N} + O2 -> 4Cyt c_{ox} + 2H2O + 4H+_{P}}\]פירוש פיזיולוגי:
- $\ce{4H+}$ נשאבים החוצה (ל-P-side) עבור 4 אלקטרונים.
- $\ce{4H+}$ נוספים נצרכים במטריקס ליצירת 2 מולקולות מים.
- לכן, “ל-$\ce{NADH}$ אחד” (2 אלקטרונים) מקובל לדבר על $\ce{2H+}$ נשאבים (וגם צריכת פרוטונים ליצירת מים ביחס מתאים).
מעכבים עיקריים של Complex IV
| מעכב | מנגנון |
|---|---|
| $\ce{CN-}$ (Cyanide) | קישור למרכז ההמי וחסימת חיזור $\ce{O2}$ |
| $\ce{CO}$ (Carbon Monoxide) | קישור למרכז ההמי בתצורתו המחוזרת וחסימה |
סיכום
המטרה
לבנות מפל פרוטונים (Proton Gradient) בין המטריקס למרווח הבין-ממברנלי, שישמש “מקור אנרגיה” ל-ATP Synthase.
תפוקת שאיבת פרוטונים (ל-$\ce{NADH}$ אחד; שני אלקטרונים)
| קומפלקס | $\ce{H+}$ נשאבים |
|---|---|
| Complex I | 4 |
| Complex III | 4 |
| Complex IV | 2 |
| סה״כ | 10 $\ce{H+}$ |
תפוקת שאיבת פרוטונים (ל-$\ce{FADH2}$ אחד; שני אלקטרונים דרך Complex II)
| קומפלקס | $\ce{H+}$ נשאבים |
|---|---|
| Complex II | 0 |
| Complex III | 4 |
| Complex IV | 2 |
| סה״כ | 6 $\ce{H+}$ |
בשיעור הבא: נשתמש במפל הפרוטונים כדי להבין איך ATP Synthase ממיר אותו ל-$\ce{ATP}$ (זרחון חמצוני בפועל).
שאלות מהתרגול:
שאלות מהתרגול
שאלה 1: עלות אנרגטית של מעגל האוריאה
מה ההשקעה האנרגטית, נטו, שנדרשת בשביל להפוך מולקולה אחת של אמוניום ($\ce{NH4+}$) לאוריאה?
- 0.5 מולקולה של ATP.
- מולקולה אחת של ATP.
- 2 מולקולות של ATP.
- 3 מולקולות של ATP.
- 4 מולקולות של ATP.
פתרון
התשובה הנכונה היא (1) - 0.5 מולקולה של ATP (נטו).
עקרונית נדרשים 3 מולקולות ATP למעגל האוריאה: שתיים לשלב המקדים (יצירת Carbamoyl Phosphate) ועוד אחת בתהליך עצמו (יצירת Argininosuccinate).
אבל - העלות האנרגטית מתקזזת הודות לקשרים בין המסלולים המטבוליים (Aspartate-Argininosuccinate Shunt):
- פומראט הנוצר במעגל האוריאה מומר למלאט
- המלאט מועבר למיטוכונדריה
- בתוך המטריקס, Malate Dehydrogenase יוצר NADH
- כל מולקולת NADH יכולה להניב עד 2.5 מולקולות ATP בנשימה המיטוכונדריאלית
לכן העלות נטו נמוכה משמעותית מ-3 ATP.
שאלה 2: שרשרת מעבר האלקטרונים
איזה משפט נכון?
- קומפלקס מספר III שואב 4 פרוטונים מהמטריקס אל החלל הבין-ממברנאלי.
- פתיחת תעלת אשלגן בממברנה הפנימית אינה משפיעה על קצב יצירת ה-ATP.
- קומפלקס מספר IV שואב שני פרוטונים מהמטריקס.
- מתהליך הגליקוליזה (ללא מעגל קרבס) מקבלים שתי מולקולות של מים.
פתרון
התשובה הנכונה היא (4).
למה התשובות האחרות לא נכונות:
-
תשובה 1 - לא נכון: אמנם קומפלקס III מעביר 4 פרוטונים לחלל הבין-ממברנלי, אבל רק 2 מהם מגיעים מהמטריקס - השניים האחרים מגיעים מ-$\ce{QH2}$ (מעגל Q).
-
תשובה 2 - לא נכון: פתיחת תעלת אשלגן תפריע למפל הריכוזים ולפוטנציאל החשמלי (יונים חיוביים יעברו), מה שיפגע ב-Proton Motive Force ויוריד את קצב יצירת ה-ATP.
-
תשובה 3 - לא נכון: קומפלקס IV שואב 4 פרוטונים מהמטריקס (לא 2), ומשתמש ב-4 פרוטונים נוספים ליצירת מים.
-
תשובה 4 - נכון: בגליקוליזה, בשלב יצירת Fructose-1,6-bisphosphate ובשלבים נוספים, נוצרות שתי מולקולות מים נטו.
שאלה 3: ההבדל בין קומפלקס I לקומפלקס II
מה ההבדל העיקרי בין קומפלקס I וקומפלקס II בשרשרת מעבר האלקטרונים?
- קומפלקס I מעביר פרוטונים לחלל הבין-ממברנלי, בעוד קומפלקס II אינו עושה זאת.
- קומפלקס I מקבל אלקטרונים מ-$\ce{FADH2}$, בעוד קומפלקס II מקבל אלקטרונים מ-$\ce{NADH}$.
- קומפלקס I פועל במיטוכונדריה, בעוד קומפלקס II פועל בציטופלסמה.
- קומפלקס I קשור לסינתזת ATP, בעוד קומפלקס II אינו קשור לכך.
פתרון
התשובה הנכונה היא (1).
קומפלקס I (NADH Dehydrogenase):
- מקבל אלקטרונים מ-$\ce{NADH}$
- מעביר 4 פרוטונים לחלל הבין-ממברנלי
- תורם ל-Proton Motive Force
קומפלקס II (Succinate Dehydrogenase):
- מקבל אלקטרונים מ-$\ce{FADH2}$ (חלק ממעגל קרבס - הופך Succinate ל-Fumarate)
- מעביר אלקטרונים ל-Ubiquinone
- אינו שואב פרוטונים כלל!
לכן, אלקטרונים שנכנסים דרך קומפלקס II מייצרים פחות ATP מאלקטרונים שנכנסים דרך קומפלקס I.
למה האחרות לא נכונות:
- תשובה 2 הפוכה (I מקבל NADH, II מקבל FADH2)
- תשובה 3 שגויה - שניהם במיטוכונדריה
- תשובה 4 לא מדויקת - שניהם תורמים ל-ATP בעקיפין
שאלה 4: גורמים המשפיעים על ריכוז פרוטונים
איזה מהגורמים הבאים משפיע, באופן ישיר, על ריכוז הפרוטונים בחלל הבין-ממברנלי?
- ריכוז הגלוקוז בתא.
- ריכוז ה-ATP בתא.
- קצב זרימת האלקטרונים בשרשרת מעבר האלקטרונים.
- ריכוז ה-CoQ10.
פתרון
התשובה הנכונה היא (3).
קצב זרימת האלקטרונים בשרשרת מעבר האלקטרונים הוא הגורם שמשפיע באופן ישיר על ריכוז הפרוטונים בחלל הבין-ממברנלי.
ככל שקצב זרימת האלקטרונים גבוה יותר:
- קומפלקסים I, III ו-IV עובדים מהר יותר
- יותר פרוטונים נשאבים לחלל הבין-ממברנלי
- מפל הריכוזים (Proton Motive Force) גדל
למה האחרות לא נכונות:
- ריכוז גלוקוז - משפיע בעקיפין דרך גליקוליזה ומעגל קרבס
- ריכוז ATP - משפיע על הצימוד, אבל לא ישירות על שאיבת הפרוטונים
- ריכוז CoQ10 - הוא נשא אלקטרונים, אבל הריכוז שלו לא קובע ישירות את קצב השאיבה
שאלה 5: משאבות פרוטונים
איזה מהקומפלקסים בשרשרת מעבר האלקטרונים משמש כמשאבת פרוטונים?
- קומפלקס I, II, III ו-IV.
- קומפלקס I, III ו-IV.
- קומפלקס II ו-IV.
- קומפלקס I ו-II.
פתרון
התשובה הנכונה היא (2) - קומפלקס I, III ו-IV.
| קומפלקס | שואב פרוטונים? | כמה פרוטונים? |
|---|---|---|
| I (NADH Dehydrogenase) | ✓ כן | 4 |
| II (Succinate Dehydrogenase) | ✗ לא | 0 |
| III (Cytochrome bc₁) | ✓ כן | 4 (2 מהמטריקס + 2 מ-QH2) |
| IV (Cytochrome c Oxidase) | ✓ כן | 4 |
קומפלקס II הוא היוצא מן הכלל - הוא מעביר אלקטרונים מ-Succinate ל-Ubiquinone אבל אינו שואב פרוטונים. לכן אלקטרונים שנכנסים דרכו (מ-$\ce{FADH2}$) מייצרים פחות ATP מאלקטרונים שנכנסים דרך קומפלקס I.
שאלה 6: תפקיד ציטוכרום C
איזה מהבאים הוא התפקיד המרכזי של ציטוכרום C בשרשרת מעבר האלקטרונים?
- העברת פרוטונים.
- העברת אלקטרונים בין קומפלקס III לקומפלקס IV.
- העברת אלקטרונים בין $\ce{NADH}$ ל-$\ce{FADH2}$.
- קיבוע חמצן למים.
פתרון
התשובה הנכונה היא (2).
ציטוכרום C הוא חלבון קטן שנמצא בחלל הבין-ממברנלי (לא בתוך הממברנה עצמה) ותפקידו להעביר אלקטרונים בין קומפלקס III לקומפלקס IV.
מאפיינים חשובים:
- מעביר אלקטרון אחד בכל פעם (לכן נדרשים 4 ציטוכרום C להעברת 4 אלקטרונים לחיזור חמצן למים)
- נע בדיפוזיה בין הקומפלקסים
- אינו חלק מה-Respirasomes (סופר-קומפלקסים)
למה האחרות לא נכונות:
- תשובה 1: ציטוכרום C מעביר אלקטרונים, לא פרוטונים
- תשובה 3: אין העברה ישירה בין NADH ל-FADH2
- תשובה 4: קיבוע חמצן למים נעשה על ידי קומפלקס IV, לא ציטוכרום C
שאלה 7: מוטציה ביחידת γ של ATP Synthase
אם מתרחשת מוטציה בתת-היחידה γ, כיצד זה ישפיע על הפעילות של ATP Synthase?
- המוטציה לא תשפיע על הפעילות של ATP Synthase.
- קצב יצירת ה-ATP יעלה.
- הפעילות של ATP Synthase תופסק.
- אי אפשר לדעת.
פתרון
התשובה הנכונה היא (4) - אי אפשר לדעת.
יחידת γ (גמא) היא הציר המרכזי של ATP Synthase - היא מסתובבת בתוך טבעת יחידות α ו-β וגורמת לשינויים הקונפורמציוניים שמאפשרים סינתזה ושחרור של ATP.
למה אי אפשר לדעת?
ההשפעה של מוטציה תלויה בסוג המוטציה ובמיקומה:
- מוטציה שקטה (Silent) - לא תשפיע כלל
- מוטציה שמשנה חומצת אמינו לא קריטית - השפעה מינימלית
- מוטציה באזור האינטראקציה עם יחידות β - עלולה לפגוע בשינויים הקונפורמציוניים ולהאט או לעצור את הסינתזה
- מוטציה שפוגעת במבנה הכללי - עלולה לעצור לחלוטין את הפעילות
ללא מידע ספציפי על סוג המוטציה ומיקומה, לא ניתן לחזות את ההשפעה.