מבוא
בשיעור זה נעמיק בנושא מבנה חומצות אמינו, הקשר הפפטידי ותכונותיו המיוחדות, זוויות הקונפורמציה φ ו-ψ, גרף Ramachandran, וכן נדון בחשיבות של שמירה אבולוציונית ו-sequence alignment.
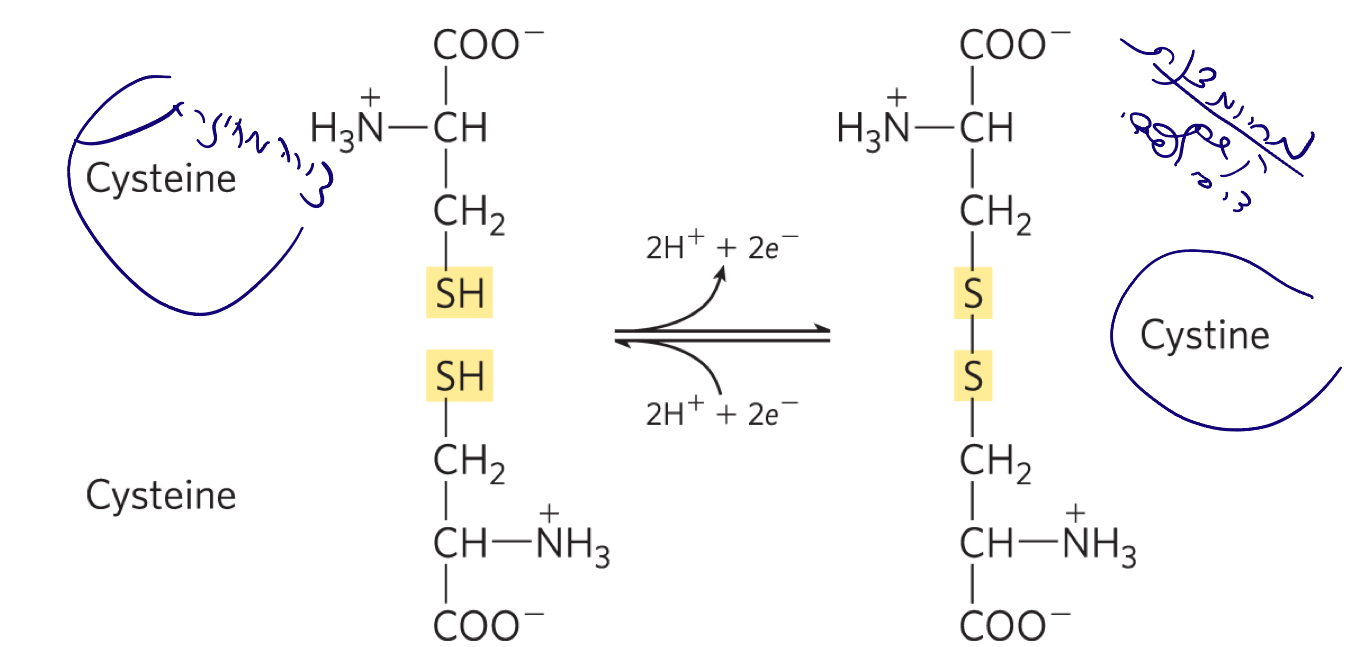
ציסטאין (Cysteine) וציסטין (Cystine)
הבחנה בין שתי הצורות
- ציסטאין (Cys, C): חומצת אמינו במצב המחוזר שלה, עם קבוצת $\ce{-SH}$ (thiol) בשרשרת הצד (R).
- ציסטין (Cystine): שתי חומצות ציסטאין במצב מחומצן, המחוברות באמצעות קשר דיסולפידי ($\ce{S-S}$).
ניתן לרכוש את שתי הצורות בנפרד (למשל מחברת Sigma).
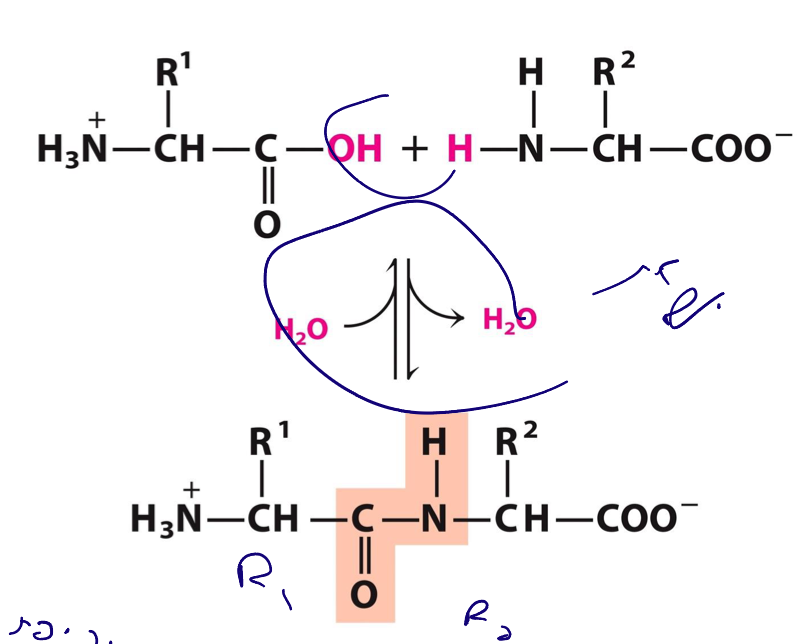
הקשר הפפטידי (Peptide Bond)
מאפייני הקשר
הקשר הפפטידי הוא קשר כיווני וייחודי המחבר שתי חומצות אמינו:
- כיוון: תמיד מ-N-terminus (קצה אמיני) ל-C-terminus (קצה קרבוקסילי).
- היווצרות: דרך תקיפת הקצה הקרבוקסילי ($\ce{-COOH}$) את הקצה האמיני ($\ce{-NH2}$) של חומצת האמינו הבאה.
- תהליך קונדנסציה: יוצרת מולקולת $\ce{H2O}$ (מים).
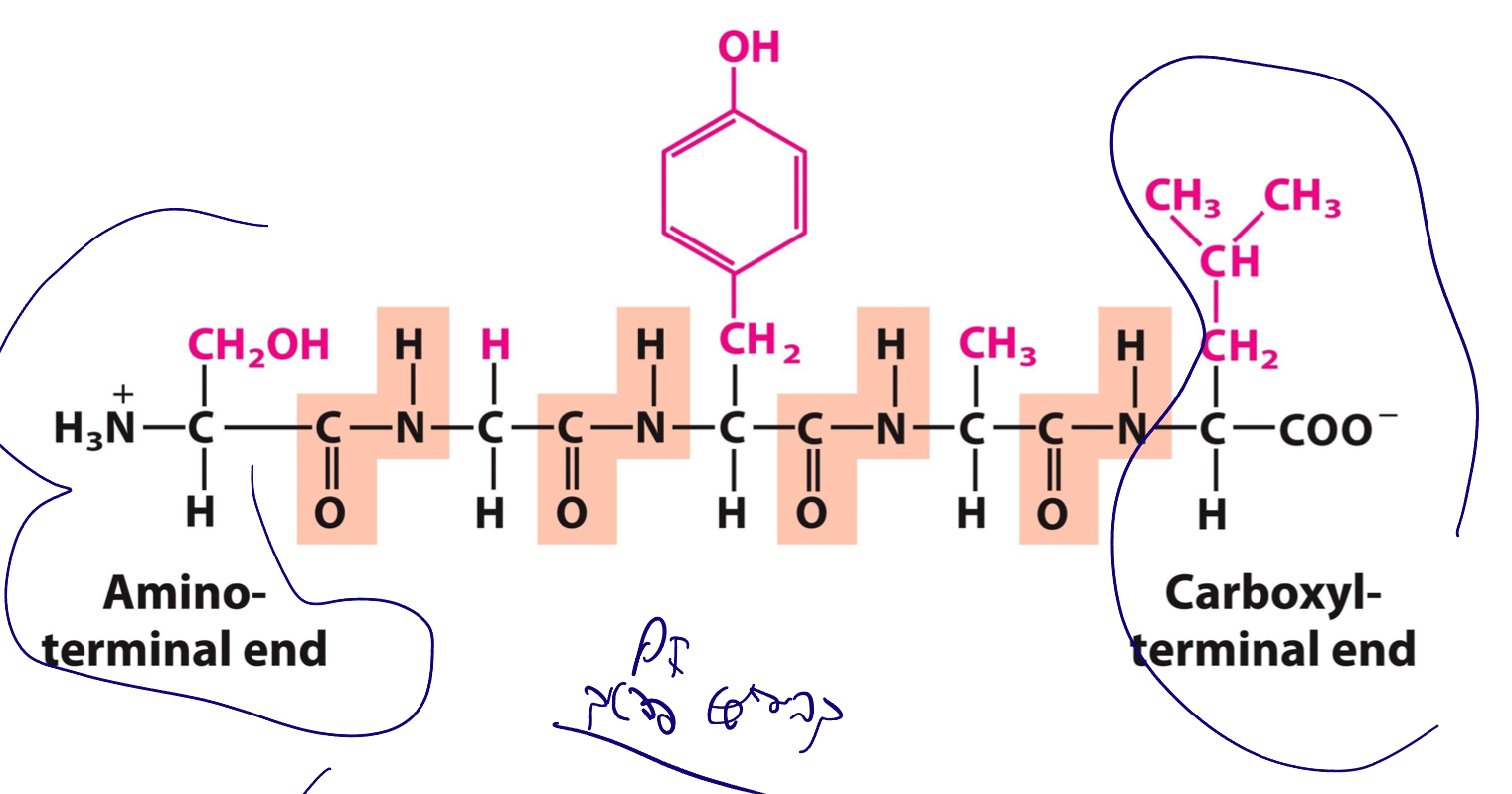
מבנה הפפטיד
בפפטיד יש רק:
- קצה אמיני אחד (N-terminus)
- קצה קרבוקסילי אחד (C-terminus)
חומצות האמינו הפנימיות אינן תורמות לפעילות חומצה/בסיס מהקצוות האמיני והקרבוקסילי שלהן, מכיוון שהם קשורים בקשר פפטידי.
בניגוד לאמור בתרגול, בעת חישוב pI כן יש להתחשב בשיירים שיכולים להיות טעונים לארוך השרשרת הפפטידית (למשל: Asp, Glu, Lys, Arg, His).
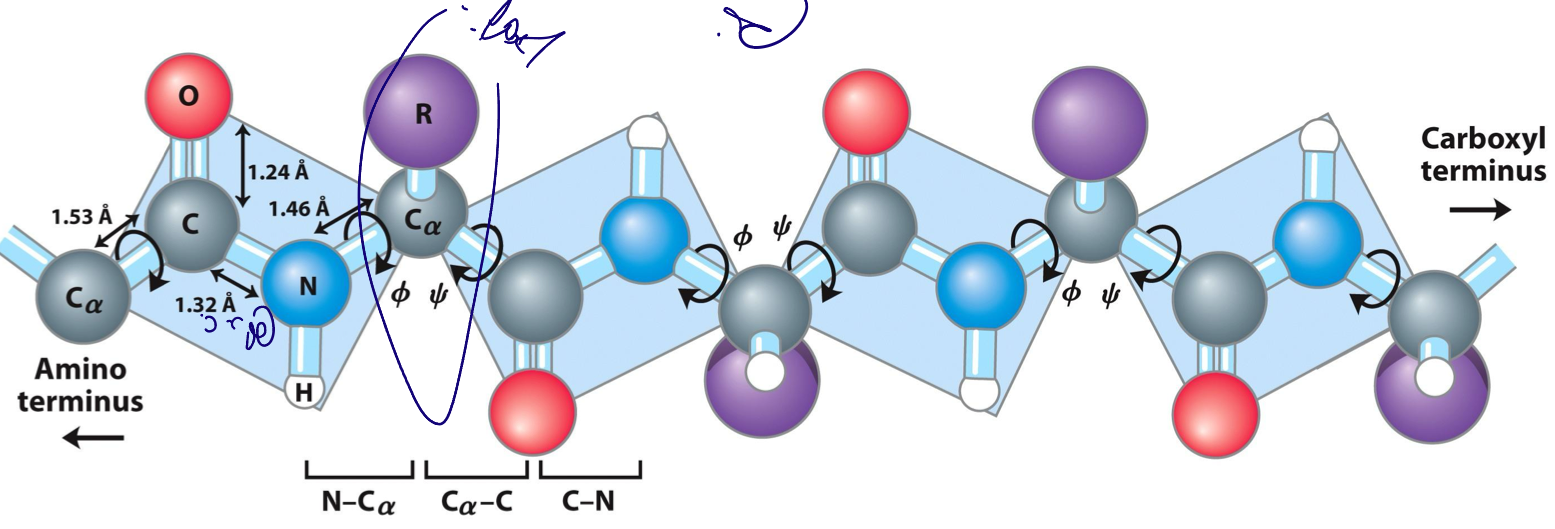
שלד פוליפפטידי (Polypeptide Backbone)
הסדר הקבוע של האטומים בשלד:
\[\ce{N-terminus} \rightarrow \ce{C_\alpha} \rightarrow \ce{C} (carbonyl) \rightarrow \ce{N} \rightarrow \ce{C_\alpha} \rightarrow \dots\]כאשר:
- $\ce{C_\alpha}$ = פחמן אלפא (כיראלי, עליו מחוברת קבוצת R)
- $\ce{C}$ (carbonyl) = פחמן קרבונילי
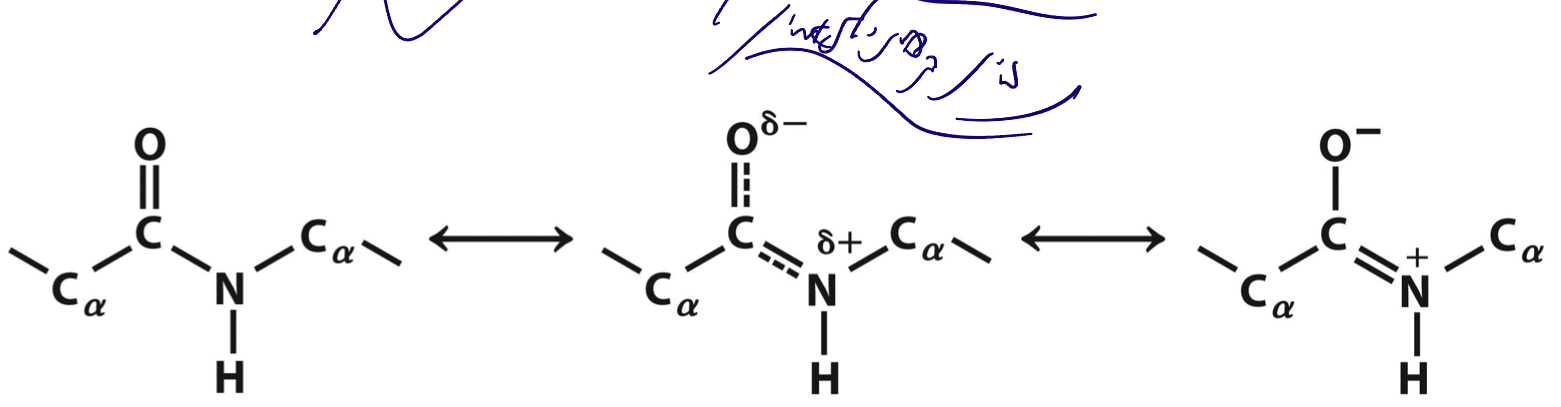
רזוננס בקשר הפפטידי
תכונות מיוחדות
הקשר הפפטידי אינו קשר בודד רגיל – יש לו תכונות של קשר כפול חלקי בגלל רזוננס:
- הקרבוניל ($\ce{C=O}$) והחנקן ($\ce{N-H}$) יוצרים מצב רזוננס.
- ענן האלקטרונים (אלקטרוני π) זז בין הקרבוניל לאמין.
- התוצאה: הקשר הפפטידי הוא מישורי (planar) ואינו יכול להסתובב סביב ציר עצמו.
אורך הקשר
- קשר כפול $\ce{C=N}$: ~1.27 Å
- קשר בודד $\ce{C-N}$: ~1.45 Å
- קשר פפטידי: ~1.32 Å (בין השניים)
- קשר בודד בין פחמנים ($\ce{C-C}$): ~1.53 Å
ייצוג גרפי
הקשר הפפטידי מיוצג כמלבן/פלטה שפינותיו הן:
- החמצן הקרבונילי ($\ce{O}$) של חומצה אחת
- המימן ($\ce{H}$) של קבוצת האמין של חומצה שנייה 3-4. שני פחמני ה-α של שתי החומצות האמינו
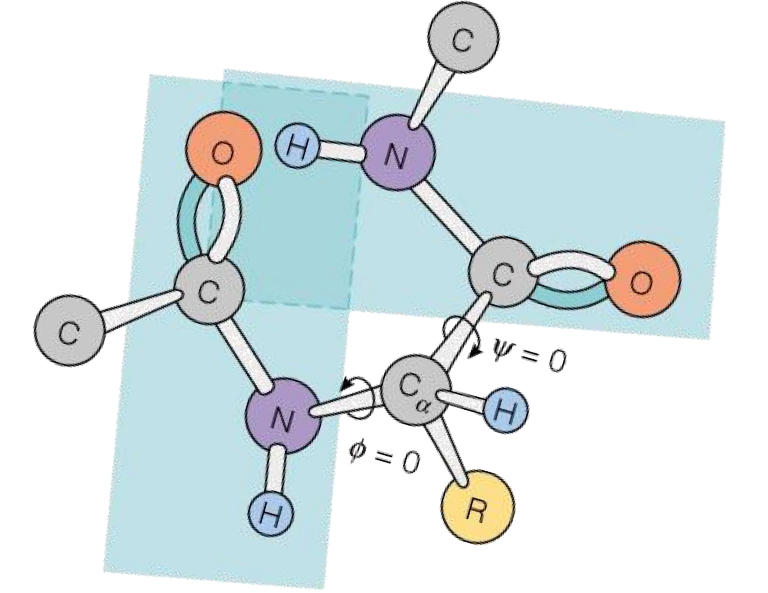
זוויות קונפורמציה: φ (Phi) ו-ψ (Psi)
הגדרות
מכיוון שהקשר הפפטידי מישורי, הגמישות של שרשרת הפפטיד תלויה בסיבובים סביב:
- זווית φ (Phi): זווית הסיבוב סביב הקשר $\ce{N - C_\alpha}$
- זווית ψ (Psi): זווית הסיבוב סביב הקשר $\ce{C_\alpha - C}$ (carbonyl)
נקודת האפס
- φ = 0°, ψ = 0°: מצב תיאורטי שבו שני מישורי קשר פפטידי חופפים (לא מתקיים בפועל).
- הגבלות סטריות: שרשראות הצד (R) יכולות ליצור הפרעות סטריות, ולכן לא כל הזוויות אפשריות.
גרף Ramachandran
מהו?
גרף Ramachandran הוא מפה דו-ממדית המציגה את הזוויות φ ו-ψ האפשריות עבור חומצות אמינו בחלבונים.
- ציר X: זווית φ
- ציר Y: זווית ψ
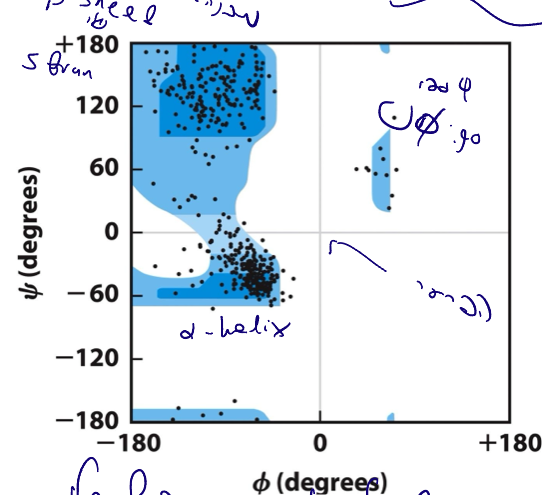
תוצאות
- רוב חומצות האמינו מתרכזות באזורים ספציפיים על הגרף.
- אזורים אלה מתאימים למבנים שניוניים מסוימים:
- α-helix (סליל אלפא)
- β-sheet / β-strand (יריעה בטא)
חומצות אמינו מיוחדות
- גליצין (Gly, G): בעלת גמישות מרבית (R = H), יכולה לקבל כמעט כל זווית.
- פרולין (Pro, P): קשיחה מאוד (R סגור על ה-N-terminus), מוגבלת בזוויות אך יכולה להתקיים בקונפורמציות cis וגם trans (50-50).
שמירה אבולוציונית (Conservation) ו-Sequence Alignment
חשיבות הרצף
- מבנה ראשוני (Primary Structure): רצף חומצות האמינו קובע את המבנה והפונקציה של החלבון.
- חלבונים בעלי פונקציה דומה: יהיו בעלי רצף דומה (הומולוגיה).
- חלבונים פונדמנטליים: רצפים שמורים מאוד לאורך האבולוציה (לעיתים >80% זהות).
סוגי החלפות ברצף
-
החלפה קונסרבטיבית (Conservative substitution): החלפת חומצה אמינו בחומצה בעלת תכונות דומות (למשל: Leu ↔ Ile, שתיהן הידרופוביות).
-
החלפה לא-קונסרבטיבית (Non-conservative substitution): החלפה שמשנה את תכונות החומצה (למשל: חומצה הידרופובית ↔ חומצה טעונה).
Sequence Alignment
- מטרה: להשוות רצפים ממינים שונים ולזהות אזורים שמורים.
- Gaps: מוכנסים כדי למקסם התאמה, אך כרוכים ב-penalty score.
- אזורים שמורים נמצאים בדרך כלל ב:
- אתרים פעילים (active sites) של אנזימים
- אתרי קישור לליגנדים
- אתרי אינטראקציה עם חלבונים אחרים
- חומצות אמינו ממוטבות פוסט-טרנסלציוניות (phosphorylation, glycosylation, methylation, acetylation)
Signature Sequences
- רצפים ייחודיים לקבוצות אורגניזמים ספציפיות (למשל: חיידקים, ארכיאה, יוקריוטים).
- שימושיים לזיהוי מקור ביולוגי של רצף לא ידוע.
היררכיה מבנית של חלבונים
רמות המבנה
- מבנה ראשוני (Primary Structure): רצף חומצות האמינו.
- מבנה שניוני (Secondary Structure): דפוסים מבניים חוזרים (α-helix, β-sheet).
- מבנה שלישוני (Tertiary Structure): המבנה התלת-ממדי הכולל של שרשרת פוליפפטידית אחת, כולל כל הקשרים בין שרשראות הצד.
- מבנה רביעוני (Quaternary Structure): קומפלקס של מספר שרשראות פוליפפטידיות (למשל: המוגלובין – 2α + 2β).
קשרים במבנה שלישוני
- קשרי מימן
- אינטראקציות הידרופוביות
- קשרי דיסולפיד ($\ce{S-S}$)
- גשרי מלח (אלקטרוסטטיים)
- כוחות ואן-דר-ואלס
סיכום
- הקשר הפפטידי הוא מישורי עקב רזוננס ובעל תכונות של קשר כפול חלקי.
- זוויות φ ו-ψ מוגבלות על ידי הפרעות סטריות, כפי שמתואר בגרף Ramachandran.
- רצף חומצות האמינו (מבנה ראשוני) קובע את המבנה והפונקציה של החלבון.
- שמירה אבולוציונית ו-sequence alignment הם כלים חשובים להבנת פונקציה, זיהוי אתרים פעילים, ומעקב אחר התפתחות אבולוציונית.
- המידע הרצפי מאפשר תכנון ניסויים (למשל: מוטגנזה ממוקדת) ושימוש במודלים אורגניזמיים פשוטים יותר (שמרים, חיידקים).