הקדמה
ניתן לחלק את המחלות הגנטיות לפי חמישה מנגנונים עיקריים:
- מחלות מנדליות - הנגרמות על ידי מוטציות בגן יחיד (כגון סיסטיק פיברוזיס, טיי זקס, המופיליה)
- מחלות כרומוזומליות - הנגרמות על ידי שינויים במספר או במבנה הכרומוזומים (כגון תסמונת דאון, טריזומיה 18)
- מחלות מולטיפקטוריאליות - הנגרמות משילוב של גורמים גנטיים וסביבתיים (כגון סוכרת, לחץ דם גבוה)
- מחלות גנטיות סומטיות - הנגרמות על ידי מוטציות בגנים סומטיים (כגון סרטן)
- מחלות מיטוכונדריאליות - הנגרמות על ידי מוטציות ב-DNA המיטוכונדריאלי (כגון LHON, MELAS)
השיעור שלהלן עוסק בסוג השני.
מבוא לציטוגנטיקה ומשמעותה הרפואית
ציטוגנטיקה (Cytogenetics) היא תחום מדעי המתמקד בחקר הכרומוזומים - מבנם, מספרם, דרכי ההורשה ומצבי בריאות וחולי. תחום זה משלב בין ביולוגיה תאית לגנטיקה, ומאפשר הבנה מעמיקה של השינויים הכרומוזומליים והשלכותיהם הקליניות.
חשיבות השינויים הכרומוזומליים
שינויים כרומוזומליים מהווים את ההפרעות הגנטיות השכיחות ביותר בבני אדם, ועולים בשכיחותם על כל המחלות המנדליות (מחלות הנגרמות על ידי גן בודד). השינויים הכרומוזומליים נמצאים בכאחוז אחד מהילודים החיים, בכשני אחוזים מההריונות של נשים מעל גיל 35, ובכ-50% מההפלות הספונטניות בטרימסטר הראשון.
כאשר לעובר יש בעיה כרומוזומלית שאינה תואמת חיים (incompatible with life), הטבע מסיים את ההיריון מכיוון שאין סיכוי לילד לחיות. חשוב לזכור שהבעיות הכרומוזומליות נפוצות יותר מכל המחלות המנדליאניות שנגרמות בגלל גן יחיד.
החשיבות ברפואה המודרנית באה לידי ביטוי במספר תחומים. כאשר מזהים מומים מולדים תוך-רחמיים, חשוב לקבוע האם מדובר במום לב בר-תיקון שהילד יוכל לחיות איתו לאחר ניתוח, או האם המום הוא חלק מתסמונת הטומנת בחובה פיגור שכלי קשה, מומים נוספים במערכת העיכול, ספקטרום רחב של בעיות עם שיעור תמותה ותחלואה גבוהים. כאשר משהו לא תקין ברמת הכרומוזום, אי אפשר לתקן זאת - מחלות אלה חסרות מרפא ועדיין אין דרך לתקן אותן.
אינדיקציות לבדיקה ציטוגנטית
הבדיקות הציטוגנטיות מהוות כלי אבחון מרכזי במצבים קליניים מגוונים:
במהלך ההריון:
- גיל אימהי מתקדם - נשים מעל גיל 35 נמצאות בסיכון מוגבר לאנאופלואידיות (מספר כרומוזומים לא תקין)
- ממצאים אולטרסאונדיים לא תקינים - זיהוי מומים מבניים בעובר
- היסטוריה של הפלות חוזרות - ייתכן ושינוי כרומוזומלי הוריתי גורם להפלות חוזרות
- בעיות פוריות - אינפרטיליות גברית או נשית עלולות לנבוע משינויים כרומוזומליים
לאחר הלידה:
- מומים מולדים - מומים מבניים מרובים או תסמונות דיסמורפיות
- עיכוב התפתחותי או פיגור שכלי
- אמביגואוס ג’ניטלי (Ambiguous Genitalia) - אי בהירות לגבי מין התינוק. כפי שציינה הרופאה: “המיילדת מסתכלת והיא לא יודעת להגיד אם זה בן או בת… זו סיטואציה מאוד מאוד מלחיצה, ואחת המלחיצות ביותר לרופא ילדים”
- תמותת עוברים או תינוקות
באונקולוגיה:
- אבחון ומעקב אחר גידולים ממאירים - שינויים כרומוזומליים ספציפיים משמשים כסמנים ביולוגיים (biomarkers)
- הערכת פרוגנוזה - חלק מהשינויים מעידים על חומרת המחלה
- מעקב אחר הצלחת טיפול - לדוגמה, לאחר השתלת מח עצם
מבנה הכרומוזום האנושי
ארגון מולקולרי היררכי
הכרומוזומים בנויים מ-DNA המתלפף סביב היסטונים. הכרומוזום האנושי מייצג רמת ארגון גבוהה ביותר של ה-DNA, המאפשרת דחיסה של מולקולות ענקיות לתוך גרעין התא.
רמות הדחיסה:
- DNA כפול-סלילי - המבנה הבסיסי של Watson ו-Crick
- נוקלאוזום (Nucleosome) - היחידה הבסיסית של דחיסת הכרומטין:
- מורכב מ-8 חלבוני היסטון (octamer)
- כל אוקטמר מכיל שני עותקים של ארבעה סוגי היסטונים: H2A, H2B, H3, ו-H4
- מולקולת ה-DNA מתלפפת 1.65 פעמים סביב אוקטמר ההיסטון
- בין נוקלאוזום לנוקלאוזום קיימים אזורי “לינקר DNA” שבהם נקשר היסטון H1
-
סולנואיד - דחיסה נוספת של שרשרת הנוקלאוזומים לסליל בעל קוטר של כ-30 ננומטר
-
לולאות כרומטין - הסולנואיד מאורגן ללולאות המעוגנות בפיגום גרעיני
- כרומוזום מטאפאזי - הצורה הדחוסה ביותר, הנראית במיקרוסקופ אור רק במהלך חלוקת התא
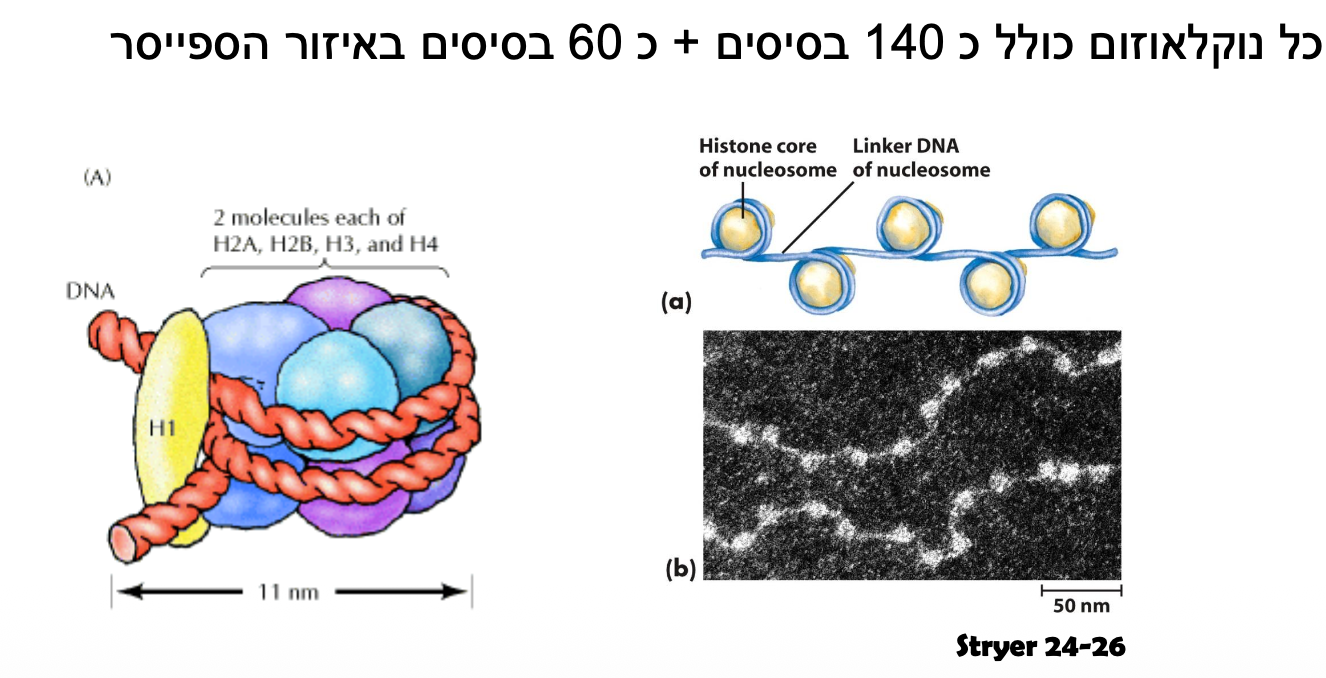
כל המבנה נדחס, ואנחנו יכולים לראות כרומוזומים כיחידות נפרדות רק בשלב המטאפאזה של חלוקת התא, כאשר הם בשיא הדחיסה שלהם. באינטרפאזה, לעומת זאת, הכרומוזומים נמצאים כמין “מרק” בתוך הגרעין ולא ניתן להבדיל ביניהם.
מרכיבים מבניים קריטיים
הכרומוזומים התגלו באדם רק לפני כ-70 שנה, ב-1956, כאשר טכנאי מעבדה שם בטעות משהו בתרבית התאים שגרם לתאים להתפוצץ בזמן המטאפאזה. התאים התפוצצו ופתאום היה אפשר לראות את הכרומוזומים הבודדים, לספור אותם ולראות שחלק ארוכים יותר וחלק קצרים יותר, לחלק יש צנטרומר באמצע ולחלק בקצה.
כל כרומוזום מורכב מ:
- צנטרומר (Centromere) - חיוני ביותר לחלוקת התא, דרכו סיבי הכישור נקשרים ומושכים כל כרומוזום לקוטב השני. הצנטרומר מהווה את נקודת החיבור בין שתי כרומטידות אחיות ואת האזור שאליו נקשרים סיבי הציר במהלך חלוקת התא
- זרוע קצרה (p) וזרוע ארוכה (q) - שם נמצאים הגנים
- טלומרים - בקצוות הכרומוזום, חיוניים ליציבות כדי שלא ייעלם ולא ילך לאיבוד בחלוקת התאים
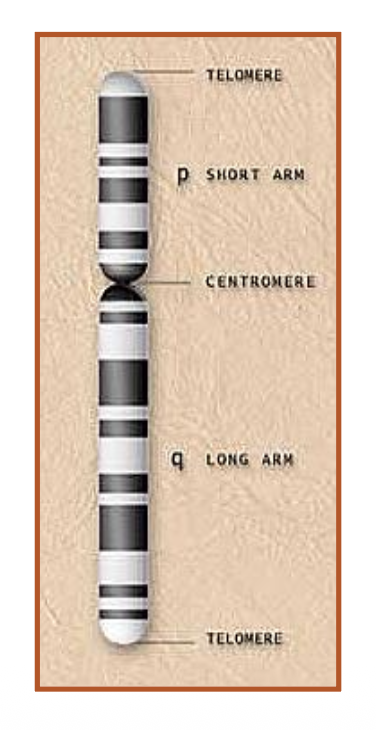
טלומרים (Telomeres): ללא טלומרים אי אפשר לחיות - הכרומוזום חייב טלומרים בשני הצדדים כדי להיות יציב בחלוקת התאים. אם כרומוזום איבד את הקצה שלו, הוא יידבק למשהו אחר כדי להיות יציב.
הטלומרים הם מבני DNA חוזני הממוקמים בקצות הכרומוזומים, המורכבים מרצפי TTAGGG חוזרות. תפקידם המרכזי הוא:
- הגנה מפני פירוק אנזימטי - מונעים זיהוי קצות הכרומוזום כשבר DNA
- מניעת איחוי בין-כרומוזומלי - ללא טלומרים, כרומוזומים עלולים להתמזג זה עם זה
- שעון מולקולרי - התקצרות הטלומרים בכל חלוקת תא משמשת מנגנון לספירת חלוקות והזדקנות תאית
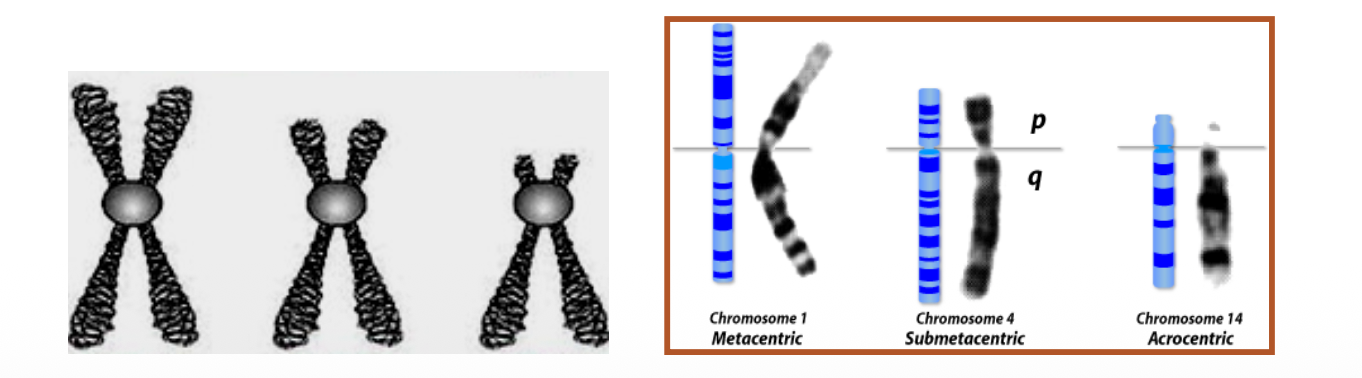
סיווג הכרומוזומים לפי מיקום הצנטרומר
הצנטרומר מהווה את נקודת החיבור בין שתי כרומטידות אחיות ואת האזור שאליו נקשרים סיבי הציר במהלך חלוקת התא. מיקומו על הכרומוזום קובע את סיווגו:
- מטאצנטרי (Metacentric) - הצנטרומר ממוקם כמעט במרכז הכרומוזום, וכתוצאה מכך הזרועות כמעט שוות באורכן
- סאב-מטאצנטרי (Submetacentric) - הצנטרומר מוסט מהמרכז, יוצר זרוע קצרה (p) וזרוע ארוכה (q) במידות שונות
- אקרוצנטרי (Acrocentric) - הצנטרומר ממוקם כמעט בקצה הכרומוזום, והזרוע הקצרה זעירה או כמעט לא קיימת
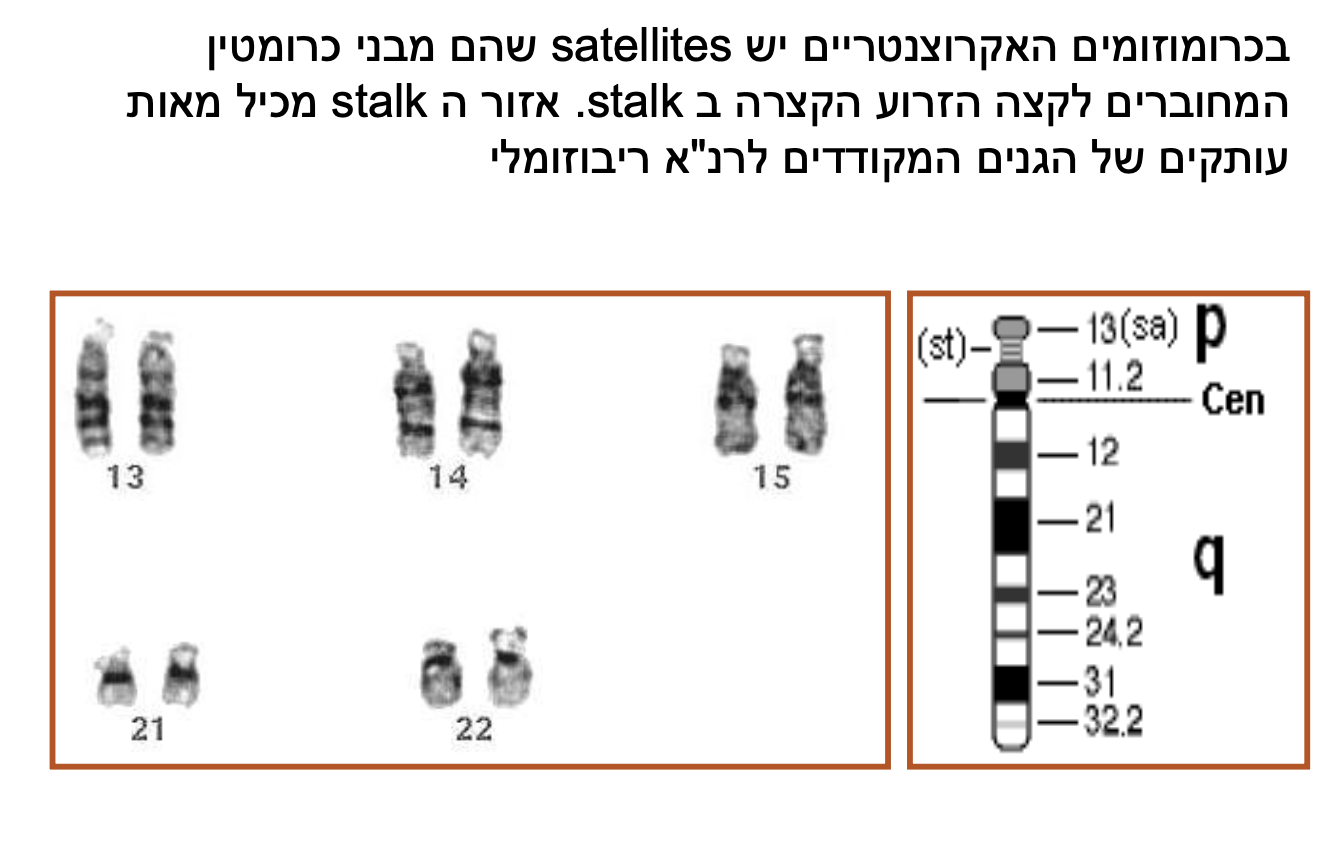
באדם יש חמישה כרומוזומים אקרוצנטריים: 13, 14, 15, 21, 22. חשוב לזכור אותם כי הם “עושים הרבה צרות”. הזרוע הקצרה שלהם חסרת משמעות גנטית - אין שם גנים גרעיניים, רק גנים המקודדים ל-RNA ריבוזומלי. מכיוון שזה קיים בכולם, אם אקרוצנטרי אחד איבד את הזרוע הקצרה שלו, לא קורה כלום. הם נוטים להידבק ולכן מקבלים הרבה שינויים מבניים הנקראים טרנסלוקציות.
מספר והגודל הכרומוזומלי
לכל אורגניזם יש מספר כרומוזומים קבוע. לבני אדם יש 46 כרומוזומים - שני סטים של 23 (דיפלואיד), סט אחד מהאם וסט אחד מהאב. מעניין לציין שאין קורלציה ישירה בין גודל היצור למספר הכרומוזומים - לצפרדע אחת יש 20 כרומוזומים ולאחרת 36, לתולעים יש 4, לאורז 24, לשימפנזה 48, ולכלב 78.
מספר קבוע למין: כל אורגניזם מאופיין במספר כרומוזומים קבוע וייחודי. בבני אדם:
- 46 כרומוזומים בכל תא סומטי (2n = 46)
- 23 זוגות הומולוגיים
- 22 זוגות אוטוזומים + זוג כרומוזומי מין (XX בנקבות, XY בזכרים)
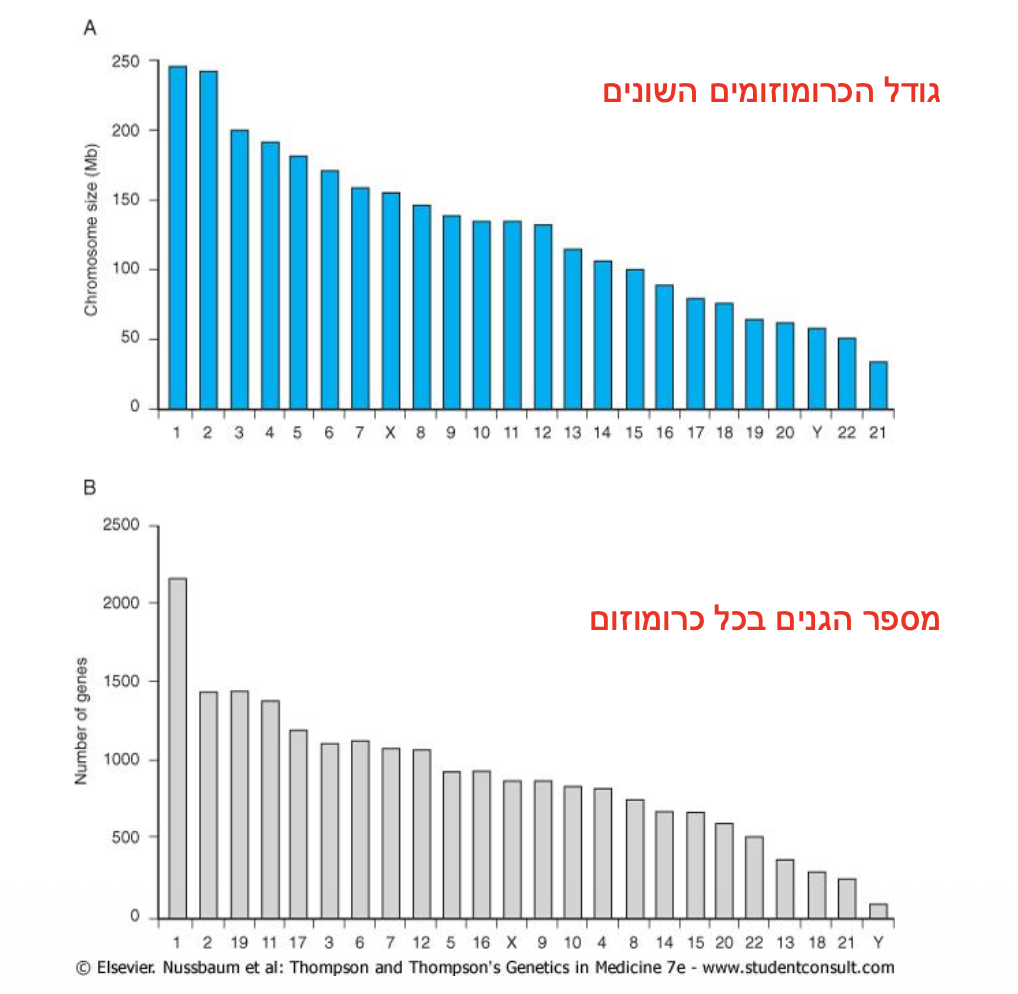
שונות בגדלים: הכרומוזומים האנושיים מגוונים מאוד בגודלם:
- הכרומוזום הגדול ביותר - כרומוזום 1 (כ-249 מיליון זוגות בסיסים, כ-2000 גנים)
- הכרומוזום הקטן ביותר - כרומוזום 21 (כ-47 מיליון זוגות בסיסים, כ-300-200 גנים)
חשוב להדגיש: אין קורלציה ישירה בין גודל הכרומוזום למספר הגנים. לדוגמה, כרומוזום 19 קטן יחסית אך עשיר מאוד בגנים (צפיפות גנים גבוהה), בעוד שכרומוזום 2 גדול משמעותית אך מכיל אזורים נרחבים של DNA לא מקודד (למשל בגן-2 יותר כרומטין או AT-rich)
שיטות קלאסיות לזיהוי וניתוח כרומוזומים
צביעות קונבנציונליות
משנות השבעים התחילו לצבוע כרומוזומים ולזהות אותם, כאשר פשוט נתנו להם מספרים מ-1 עד 22, בתוספת כרומוזומי המין X ו-Y. יצור עם שני X הוא נקבה, ו-XY הוא זכר.
| Type | Stain | Area Stained | Effect |
|---|---|---|---|
| Q-banding | Quinacrine | Chromosome arms; mostly repetitive AT-rich DNA | Under UV light, distinct fluorescent banded pattern for each chromosome. |
| G-banding | Giemsa | Chromosome arms; mostly repetitive AT-rich DNA | Distinct banded pattern for each chromosome; same as Q-banding pattern except single additional band near centromere of chromosomes 1 and 16. |
| R-banding | Variety of techniques | Chromosome arms; mostly unique GC-rich DNA | Reverse banding pattern of that observed with Q- or G-banding. |
| C-banding | Variety of techniques | Centromere region of each chromosome and distal portion of Y chromosome; highly repetitive, mostly AT-rich DNA | Largest bands usually on chromosomes 1, 9, 16, and Y; chromosomes 7, 10, and 15 have medium-sized bands; size of C-bands highly variable from person to person. |
סוגי הצביעות העיקריות:
-
G-banding (Giemsa) - הצביעה השכיחה ביותר והסטנדרטית ביותר.
עקרונות ומנגנון:
- טיפול קל בטריפסין ולאחר מכן צביעה בגימזה
- צובעת אזורים עשירים ב-AT (אדנין וטימין) בצבע כהה
- אזורים עשירים ב-GC (גואנין וציטוזין) נשארים בהירים
- יוצר דפוס פסים אופייני ייחודי לכל כרומוזום
-
C-banding - צובעת צנטרומרים.
מטרה וטכניקה:
- צביעה ספציפית של אזור הצנטרומר
- מבוססת על צביעה של הטרוכרומטין מרוכז
- מאפשרת זיהוי מהיר של מספר הצנטרומרים בכל כרומוזום
שימושים קליניים:
- חשובה לזיהוי כרומוזומים עם שני צנטרומרים או שלושה (לא תקין)
- זיהוי כרומוזומים אצנטריים (ללא צנטרומר - לא יציבים)
- הערכת כרומוזומים מרקר (marker chromosomes)
-
R-banding (Reverse) - צביעה הפוכה מ-G-banding.
עקרונות:
- דפוס צביעה הפוך מ-G-banding
- צובעת אזורים עשירים ב-GC
- אזורים עשירים ב-A-T נשארים בהירים
יתרונות:
- עוזרת לראות גבולות של פסים
- מדגישה את האזורים הטלומריים (עשירים ב-GC)
- מסייעת בזיהוי גבולות פסים לא ברורים
- משלימה את המידע מ-G-banding
-
Q-banding - פחות בשימוש.
מאפיינים:
- צביעה פלואורסצנטית באמצעות Quinacrine
- גם צובעת אזורים עשירים ב-AT כמו G-banding
- דומה ל-G-banding בדפוס
- דורש מיקרוסקופ פלואורסצנטי
- פחות נפוץ בשימוש שגרתי
 |  |
הכנת קריוטיפ (Karyotype)
קריוטיפ: תמונה של כל הכרומוזומים בתא מסודרים בזוגות לפי גודל ומורפולוגיה. זוהי תצוגה מסודרת של כל הכרומוזומים בתא, המאורגנים לפי גודל, מיקום הצנטרומר, ודפוס הפסים הייחודי.
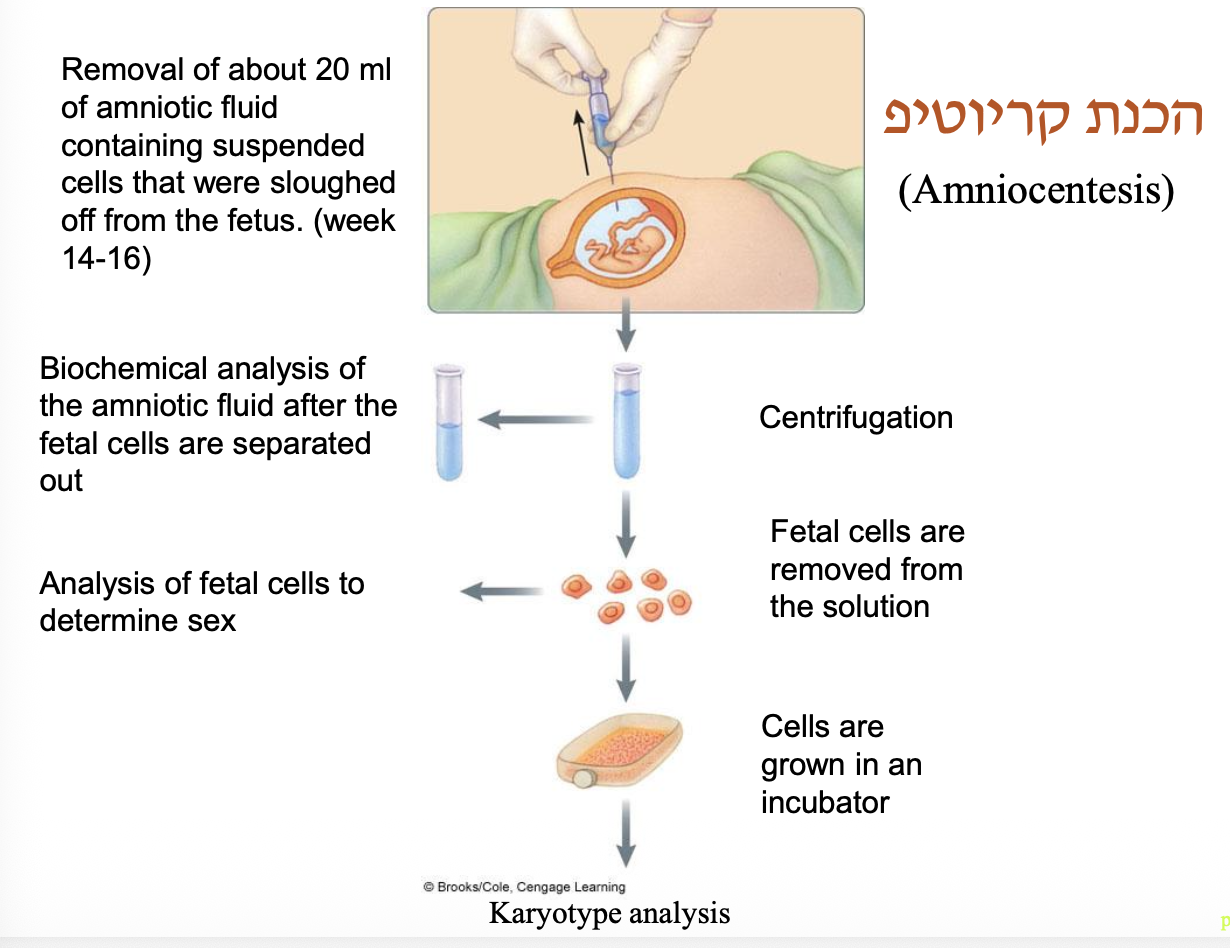
שלבי ההכנה:
- תרבית תאים:
- הזרקת תאים חיים (לימפוציטים מדם, אמניוציטים ממי שפיר, פיברובלסטים מעור) לתווך תרבית
- הוספת מיטוגנים (כגון PHA - Phytohemagglutinin) לעידוד התחלקות תאית
- גידול בתנאים אופטימליים (37°C, 5% CO₂) למשך 72-48 שעות
אפשר להכין קריוטיפ מכל דגימה של רקמה שיש בה תאים מתחלקים (תאי דם לבנים (בעיקר לימפוציטים מסוג T), מח עצם, דגימות מגידולים סרטניים, מי שפיר, סיסי שילייה)
הרציונאל: אנחנו רואים אותם רק בשלבים של חלוקת התא, בעיקר במטאפאזה. לכן, צריך לגרום לתאים להתחלק.
- סינכרוניזציה למטאפאזה:
- הוספת קולכיצין (Colchicine) או קולצמיד (Colcemid) - תרופות המעכבות פילמור מיקרו-טובולים
- עצירת חלוקת התא בשלב המטאפאזה (במיטוזה), כאשר הכרומוזומים בשיא דחיסתם
- טיפול היפוטוני:
- הוספת תמיסה היפוטונית (KCl 0.075M) גורמת לכניסת מים לתוך התאים
- התאים מתנפחים ובסופו של דבר מתפוצצים, ופזור הכרומוזומים על השקופית
- קיבוע וצביעה:
- קיבוע בתערובת מתנול:חומצה אצטית (3:1) לשימור המבנה
- צביעה בשיטות שונות
- ניתוח ותיעוד:
- צילום תחת מיקרוסכופ
- סידור הכרומוזומים לפי סדר סטנדרטי
- ניתוח והערכה
בעבר היו גוזרים ומדביקים ידנית את התמונות. היום מחשבים עוזרים אבל עדיין לא מחליפים לגמרי את העין האנושית. הזיהוי נעשה לפי: אורך, מיקום הצנטרומר, ודגם הפסים (כמו ברקוד בסופר).

רזולוציה ומספר פסים
מספר הפסים הנראים תלוי בשלב החלוקה:
- מטאפאזה - כ-450-400 פסים בכלל הגנום (הכי דחוס)
- פרומטאפאזה - כ-650-550 פסים (כרומוזומים פחות דחוסים)
- פרופאזה - עד 850 פסים (הכי ארוך ופתוח)
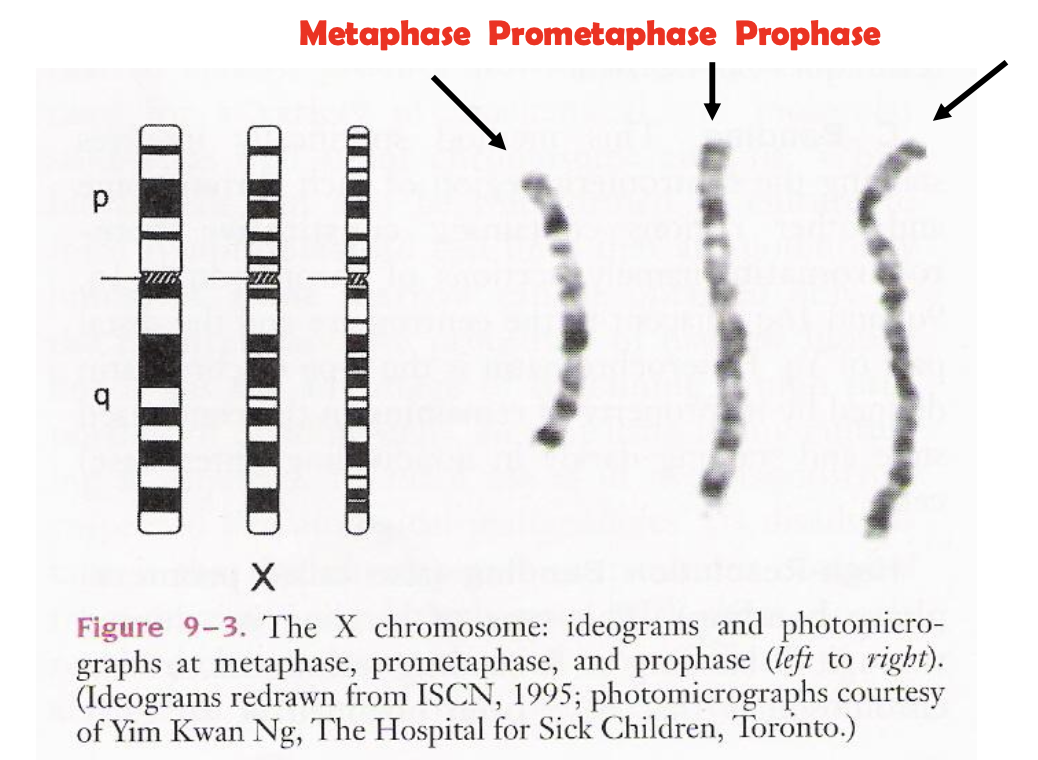
ככל שהכרומוזום יותר ארוך ופחות דחוס, ניתן לראות יותר פסים ולזהות שינויים קטנים יותר. למשל, פס שנראה אחיד במטאפאזה יכול להתגלות כשלושה פסים נפרדים בפרופאזה. נרצה שהכרומוזום יהיה כמה שיותר ארוך (High Resolution Karyotype) כדי לראות שינויים קטנים.
בתמונה למעלה כרומוזום X.
צריך לבקש במפורש כרומוזומים ארוכים ככל האפשר בשביל לגלות דברים עדינים
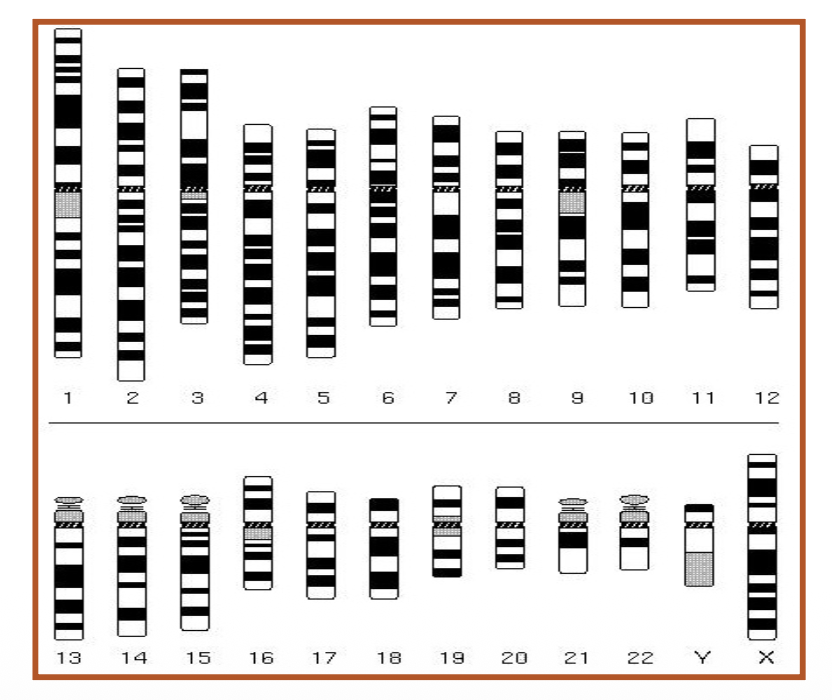
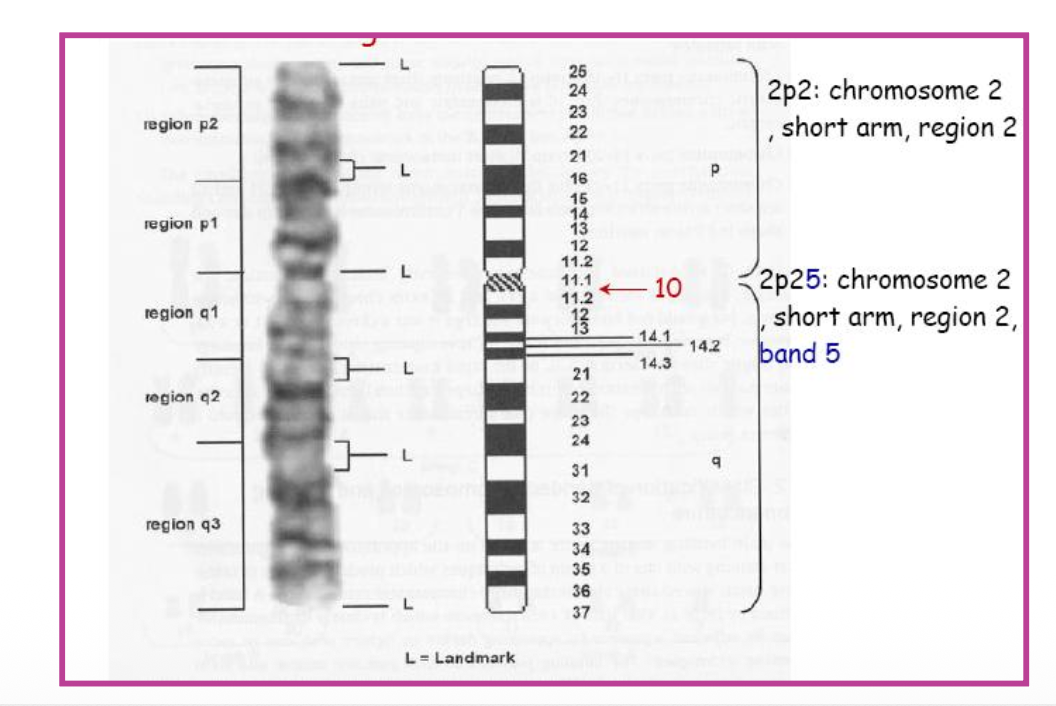
המינוח הבינלאומי (ISCN)

International System for Human Cytogenomic Nomenclature (ISCN)
כל כרומוזום ממוספר, והפסים נספרים מהצנטרומר כלפי חוץ. זוהי טרמינולוגיה בינלאומית - השמות, הצביעות והפסים אחידים בכל העולם.
הצנטרומר הוא נקודת האפס.
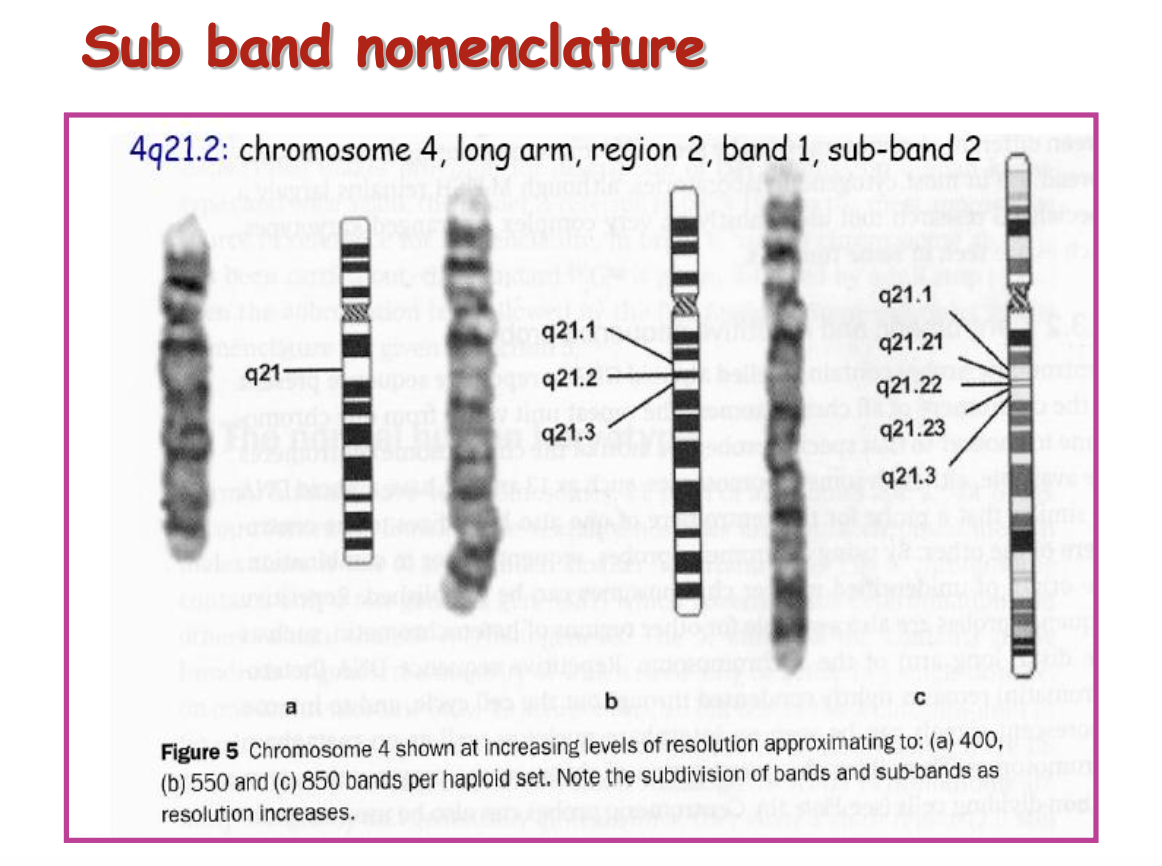
מערכת מספור פסים: כל כרומוזום מחולק לאזורים (regions), פסים (bands), ותת-פסים (sub-bands):
- הצנטרומר הוא נקודת האפס והייחוס
- הזרוע הקצרה מסומנת ב-p (מ-“petite” בצרפתית)
- הזרוע הארוכה מסומנת ב-q (האות הבאה אחרי p באלפבית)
דוגמאות למינוח:
- 2p25 - כרומוזום 2, זרוע קצרה (p), אזור 2, פס 5
- 4q21.3 - כרומוזום 4, זרוע ארוכה (q), אזור 2, פס 1, תת-פס 3
 |  |
דוגמאות לכתיבת קריוטיפ:
- 46,XX - נקבה תקינה
- 46,XY - זכר תקין
- 47,XX,+21 - נקבה עם טריזומיה 21 (תסמונת דאון)
- 46,XX,del(4)(p16) - נקבה עם דלישן (מחיקה) של פס 16 בזרוע הקצרה של כרומוזום 4
טכנולוגיות מולקולריות מתקדמות
FISH (Fluorescence In Situ Hybridization)
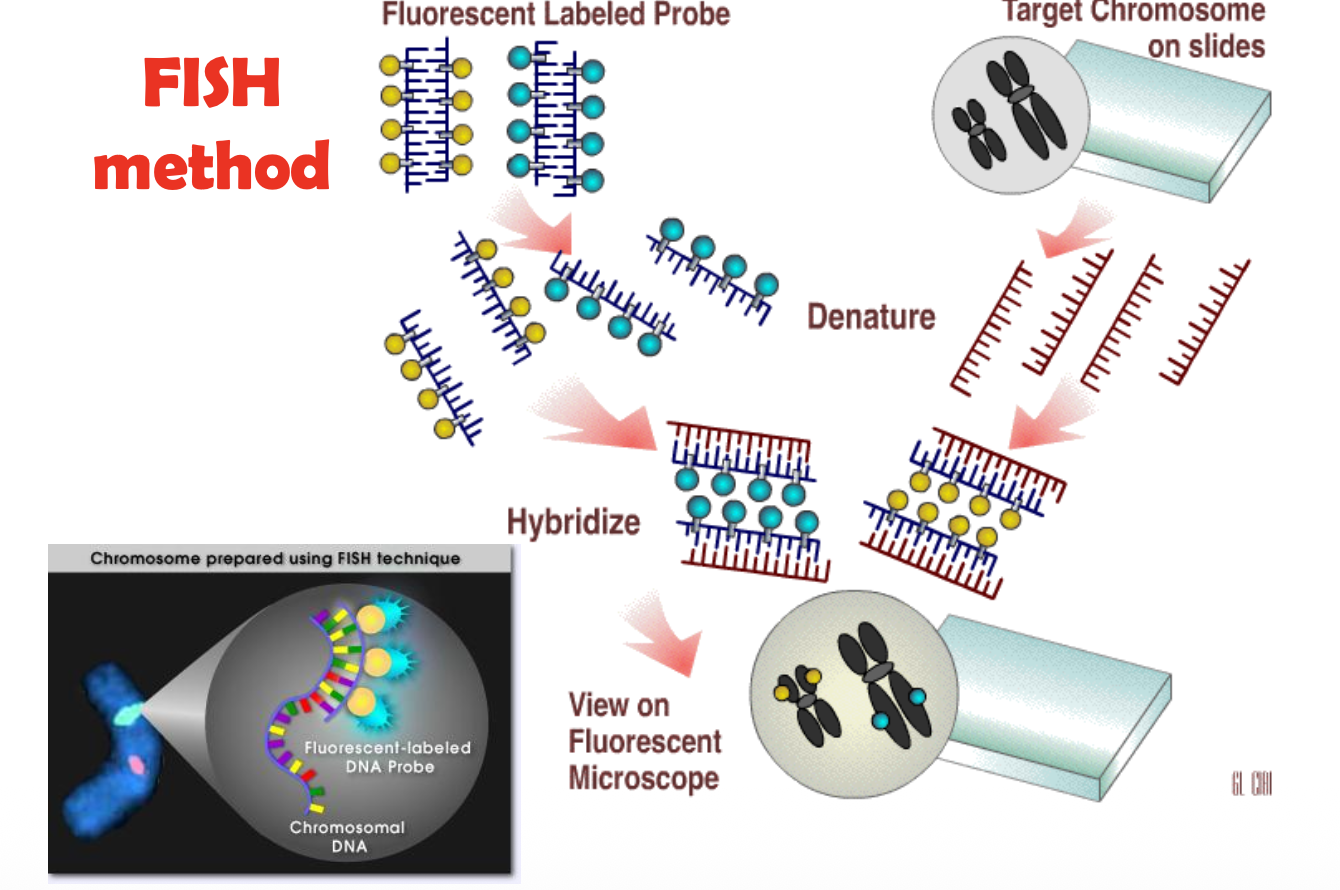
טכניקת FISH הייתה מהפכה בציטוגנטיקה, ומשלבת בין ציטוגנטיקה קלאסית לביולוגיה מולקולרית. רמה של DNA ולא רק מבנה הכרומוזום.
עקרונות מולקולריים:
הכנת הפרוב (Probe):
- בחירת רצף DNA - סינתזה של גלאי DNA (500-200 זוגות בסיסים או יותר) מאזור ספציפי
- סימון פלואורסצנטי - סימון הגלאי בצבע פלואורסצנטי (כגון FITC - ירוק, Rhodamine - אדום, DAPI - כחול). במקור היו עושים שימוש בסימון רדיואקטיבי שהיה פחות מדויק מהצביעה הפלואורסצנטית המודרנית
- דנטורציה - הפרדת הפרוב לחוטים בודדים על ידי חימום
תהליך ההיברידיזציה:
- הכנת הדגימה:
- קיבוע תאים או כרומוזומים על שקופית
- חימום הכרומוזומים וה-DNA להפרדת הסיבים (דנטורציה) - דנטורציה של ה-DNA הגנומי בחימום (75-70°C)
- הוספת הפרוב:
- הפרוב המסומן מתווסף לדגימה
- הגלאי מחפש ונקשר למקום ההומולוגי על הכרומוזום
- ההיברידיזציה מתרחשת בטמפרטורה מבוקרת (42-37°C)
- הפרוב מחפש את הרצף ההומולוגי שלו ונקשר אליו
- שטיפה והדמיה:
- הסרת פרובים שלא נקשרו
- הדמיה במיקרוסקופ פלואורסצנטי
- ספירת אותות פלואורסצנטיים
סוגי פרובים:
- Locus-Specific Probes:
- פרובים לאזור ספציפי בגנום
- שימוש: זיהוי דלישן, דופליקציה, או טרנסלוקציה של אזור מוגדר
- דוגמה: פרוב ל-STS (Steroid Sulfatase) על כרומוזום X

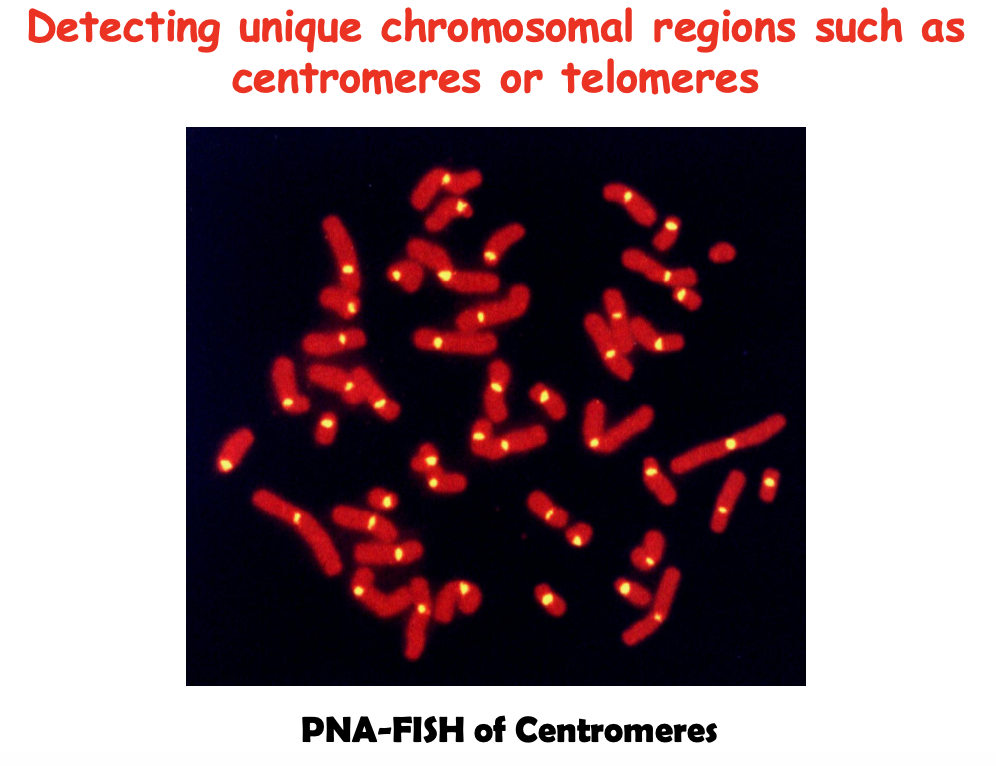
- Centromeric Probes:
- פרובים הנקשרים לחזרות הצנטרומריות
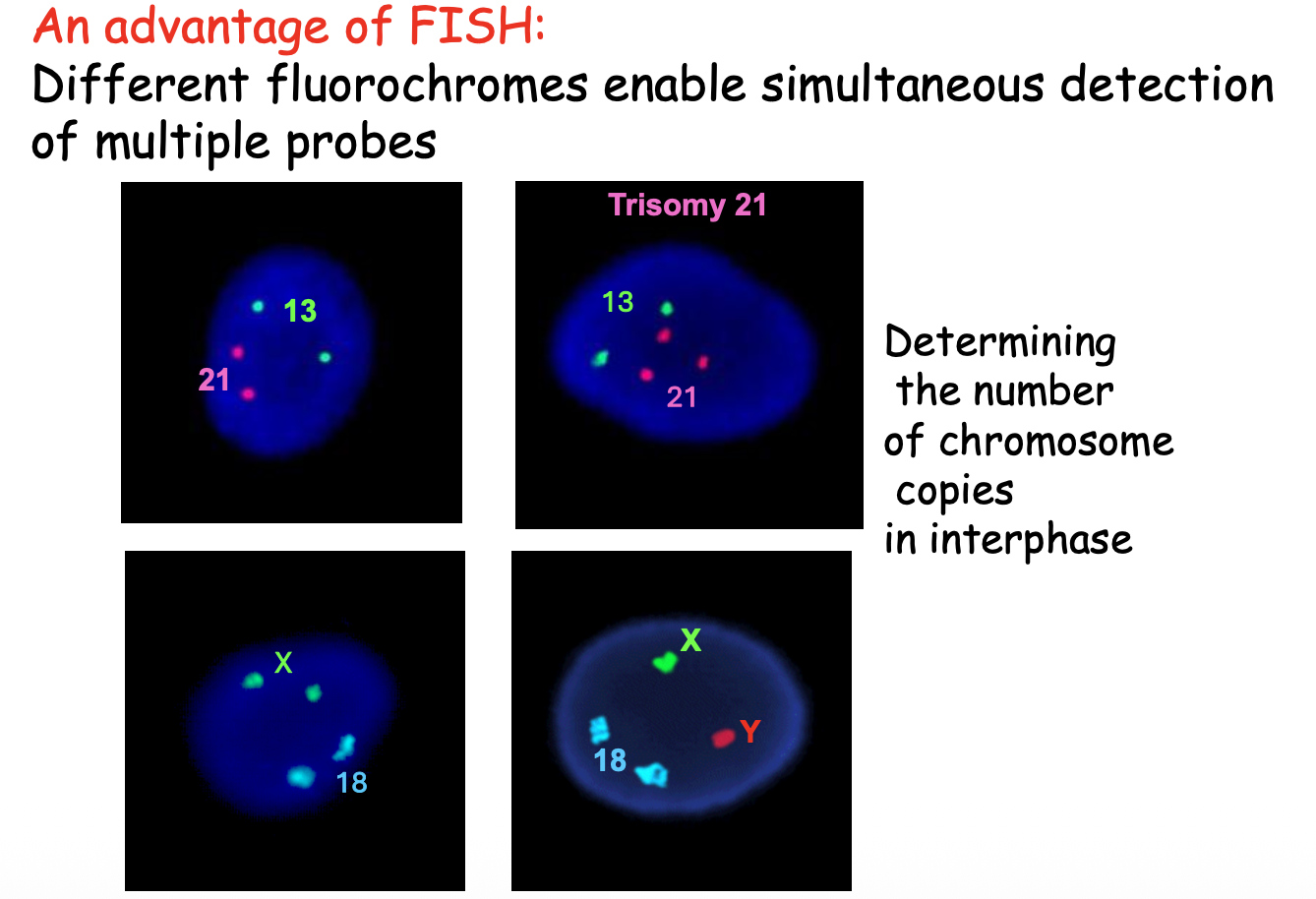
- שימוש: ספירה מהירה של מספר עותקי כרומוזום (אנאופלואידיה)
- יתרון: ניתן לבצע גם בתאי אינטרפאזה
- Whole Chromosome Probes (Chromosome Painting):
- פרובים המכסים כרומוזום שלם
- שימוש: זיהוי טרנסלוקציות מורכבות
- כל כרומוזום נצבע בצבע שונה
- Telomeric Probes:
- פרובים לרצפי הטלומר $\ce{(TTAGGG)ₙ}$
- שימוש: זיהוי אובדן או חוסר של טלומרים
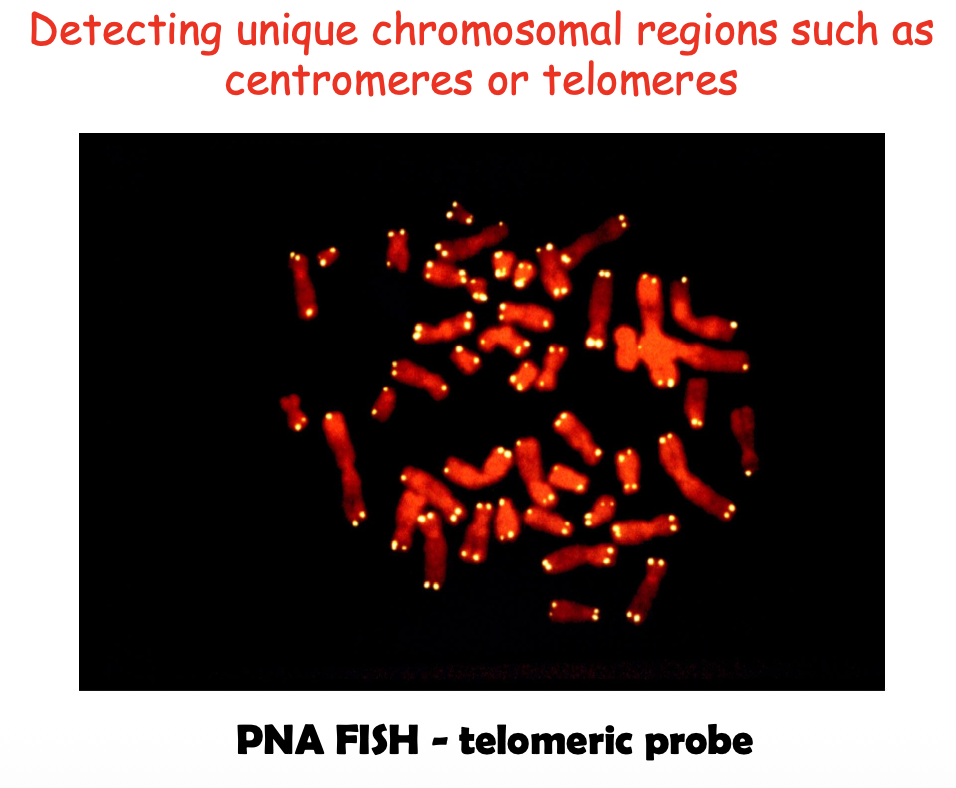
יתרונות:
- אינטרפאזה FISH - עובד גם באינטרפאזה (לא צריך תאים מתחלקים)
- תוצאות תוך 48-24 שעות במקום שבועיים
- רזולוציה גבוהה - יכול לזהות שינויים קטנים מאוד שלא נראים במיקרוסקופ, זיהוי שינויים של עשרות אלפי זוגות בסיסים
- ספציפיות גבוהה
חסרונות ומגבלות:
- דורש השערה קלינית - צריך לדעת מה מחפשים. כפי שהרופאה הדגישה: “בשביל להשתמש בפיש אני צריכה לראות את התינוק ולחשוב שיש לו ארבע פי מינוס ולהגיד למעבדה בבקשה תעשו לי צביעת פיש לארבע פי מינוס… אין לי הסתכלות מלאה על כל הכרומוזומים בבת אחת”
- אם החשד שגוי, הבדיקה תהיה תקינה למרות שיש בעיה אחרת
- לא מאפשר סקירה גנומית מלאה
- עלות גבוהה יחסית עבור מספר פרובים
- דורש מומחיות טכנית
יישומים קליניים:
- אבחון פרה-לידתי:
- זיהוי מהיר של אנאופלואידיות (13, 18, 21, X, Y)
- תוצאות תוך 48-24 שעות (לעומת 14-7 יום בקריוטיפ)
- תסמונות מיקרודלישן:
- תסמונת
4p-(Wolf-Hirschhorn) - תסמונת דיג’ורג’ (
del 22q11.2) - תסמונת פרדר-וילי/אנג’למן (
del 15q11-q13)
- תסמונת
- אונקולוגיה:
- זיהוי טרנסלוקציות אופייניות (כגון
BCR-ABLבלוקמיה מיאלואידית כרונית) - מעקב אחר שאריות מחלה לאחר טיפול
- זיהוי טרנסלוקציות אופייניות (כגון
M-FISH ו-SKY - Spectral Karyotyping
כל כרומוזום נצבע בצבע שונה, מה שמקל על זיהוי טרנסלוקציות. למשל, אם על כרומוזום שאמור להיות ירוק יש חתיכה סגולה, ניתן לזהות מיד שיש טרנסלוקציה.

מולטי-קולור FISH (M-FISH) ו-Spectral Karyotyping (SKY):
עקרון הטכנולוגיה:
- צביעה של כל 24 סוגי הכרומוזומים (22 אוטוזומים + X + Y) בצבעים שונים
- שימוש בקומבינציות של 6-5 צבעים פלואורסצנטיים שונים
- כל כרומוזום מקבל “חתימה ספקטרלית” ייחודית
יישומים עיקריים:
- טרנסלוקציות מורכבות - זיהוי חומר כרומוזומלי ממקור לא ידוע
- כרומוזומים מרקר - זיהוי מקור החומר הכרומוזומלי
- ציטוגנטיקה של סרטן - ניתוח קריוטיפים מורכבים בגידולים ממאירים
CGH/CMA (Comparative Genomic Hybridization/Chromosomal Microarray)
השיטה המתקדמת ביותר, המכונה גם CGH (Comparative Genomic Hybridization) או SNP Array, מייצגת את הדור הבא של אבחון ציטוגנטי.
במקום FISH בודד צובעים את כל הגנום בבת אחת ומקבלים תמונה מלאה של כל השינויים בכרומוזומים.
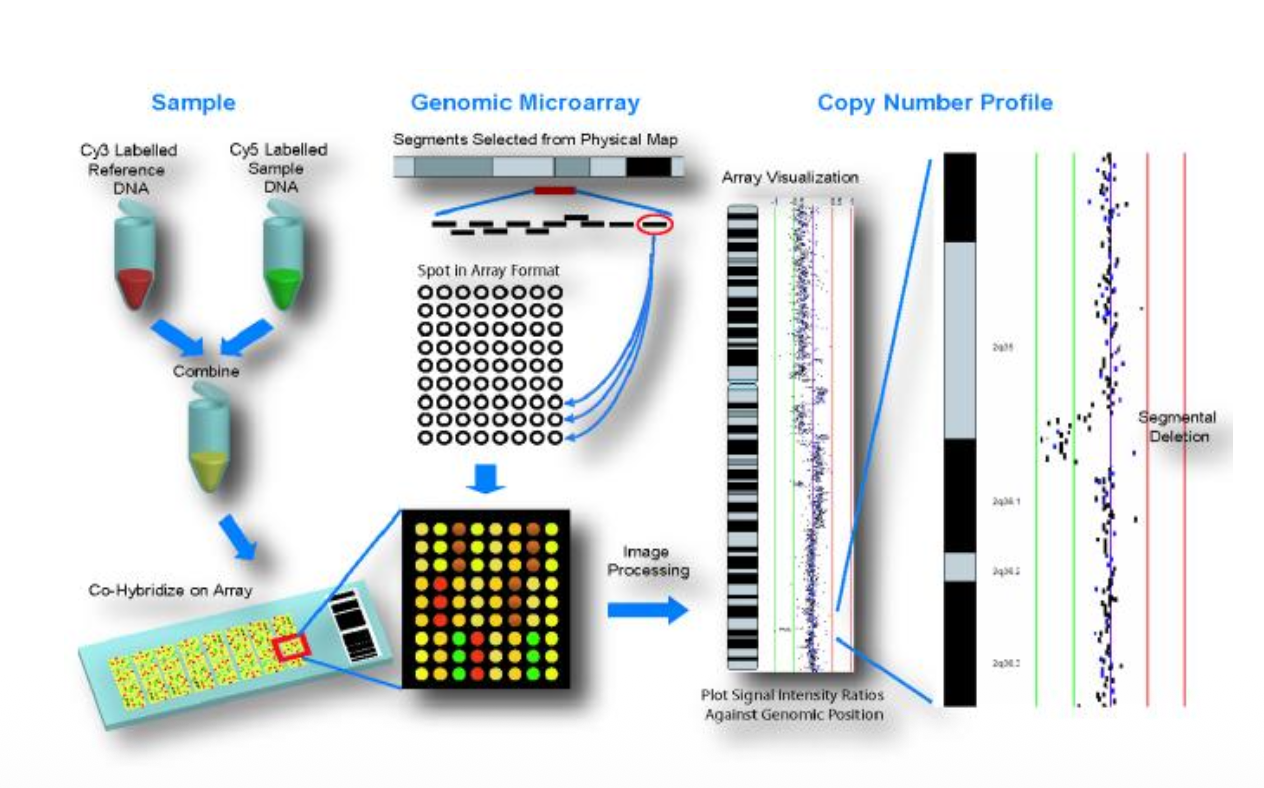
עקרון הטכנולוגיה:
הכנת הדגימות:
- DNA רפרנס (בקרה):
- לוקחים DNA רפרנס (בריא) מאדם בריא
- צובעים באדום - סימון בצבע פלואורסצנטי אחד (למשל, ירוק)
- DNA נבדק (מטופל):
- DNA של החולה מהמטופל הנבדק
- צובעים בירוק - סימון בצבע פלואורסצנטי שונה (למשל, אדום)
- ערבוב והיברידיזציה:
- מערבבים ושופכים על צ’יפ עם חתיכות DNA מכל הגנום
- DNA הרפרנס וה-DNA הנבדק מעורבבים ביחס 1:1
- דנטורציה של שני סוגי ה-DNA
- הוספה ל-microarray
מבנה ה-Microarray:
- פלטפורמת סיליקון דומה לשבבי מחשב
- אלפי עד מיליוני פרובים המפוזרים על השבב
- כל פרוב מייצג אזור ספציפי בגנום
- מיפוי מלא של כל הגנום האנושי
תהליך ההיברידיזציה והניתוח:
- הפרובים על השבב מתחרים על קשירה של DNA רפרנס מול DNA נבדק
- במקום עם כמות שווה - צבע צהוב (יחס 1:1 בין אדום לירוק)
- עודף אדום - חסר בחולה (דלציה) - עודף של DNA רפרנס ← צבע ירוק דומיננטי
- עודף ירוק - עודף בחולה (דופליקציה) - עודף של DNA נבדק ← צבע אדום דומיננטי
קריאה וניתוח:
- סריקת השבב במכשיר פלואורסצנטי מיוחד
- יצירת גרף Log₂ Ratio:
- ציר ה-X: מיקום לאורך הכרומוזומים
- ציר ה-Y: יחס בין אותות (log₂ של test/reference)
- Log₂ ratio = 0: שני עותקים (תקין)
- Log₂ ratio = -1: עותק אחד (דלישן)
-
Log₂ ratio = +0.58: שלושה עותקים (דופליקציה)
היתרון הגדול: בשנייה, תוך שלושה-ארבעה ימים, ניתן לראות בדיוק מה הבעיה כשסורקים בעצם את כל הגנום.
רזולוציה והספציפיות:
רזולוציה גבוהה ביותר:
- קריוטיפ קלאסי: 10-5 מגהבסיס
- FISH: 100-50 קילובסיס
- CMA: 50-10 קילובסיס ואף פחות
זיהוי CNV (Copy Number Variations):
- דלישן סגמנטלי - אובדן של חלק מכרומוזום
- דופליקציה סגמנטלית - עותקים נוספים של חלק מכרומוזום
- מוזאיקיות - שינוי הקיים רק בחלק מהתאים
יתרונות משמעותיים:
- סריקה גנומית מלאה - אין צורך בהשערה קלינית מוקדמת
- רזולוציה גבוהה ביותר - זיהוי שינויים קריפטיים (לא נראים במיקרוסקופ)
- זיהוי CNVs פתוגניים - שינויים בגודל קטן המשפיעים על גנים חשובים
- אין צורך בתאים חיים - ניתן לבצע גם על DNA מקובע
- תוצאות מהירות - תוך 5-3 ימים
מגבלות:
- אינו מזהה שינויים מאוזנים - טרנסלוקציות מאוזנות ואינברסיות
- פוליפלואידיה - לא מזהה טריפלואידיה (69 כרומוזומים)
- מוזאיקיות ברמה נמוכה - קושי בזיהוי מוזאיקיות מתחת ל-20%
- פרשנות מורכבת - CNVs עשויים להיות ווריאנטים בנינים או פתוגניים
יישומים קליניים:
- אבחון פוסט-נטלי:
- ילדים עם עיכוב התפתחותי לא מוסבר
- מומים מולדים מרובים
- אוטיזם וספקטרום אוטיסטי
- פיגור שכלי
- אבחון פרה-נטלי:
- ממצאים אולטרסאונדיים לא תקינים
- סיכון מוגבר בבדיקות סקר
- היסטוריה משפחתית
דוגמאות קליניות
מקרה 1: חסר בכרומוזום 11
תינוק נולד עם בעיות וחשבו לבעיה בכרומוזום 11. בקריוטיפ רגיל נראה תקין, אבל ב-CMA נמצא חסר של 9 מגה-בייס שלא נראה במיקרוסקופ. כדי לקבוע אם זה קשור לממצאים הקליניים, צריך לבדוק איזה גנים נמצאים באזור החסר.

דוגמה קלינית - מחיקה קריפטית בכרומוזום 11:
במקרה שהוצג, תינוק עם מומים מולדים ועיכוב התפתחותי הציג קריוטיפ תקין לכאורה. בדיקת CMA גילתה:
- דלישן של 9 מגהבסיס באזור 11q22.3-q23.3
- הדלישן כלל מספר גנים חשובים להתפתחות
- האבחנה אפשרה ייעוץ גנטי מדויק להורים והערכת סיכון הישנות

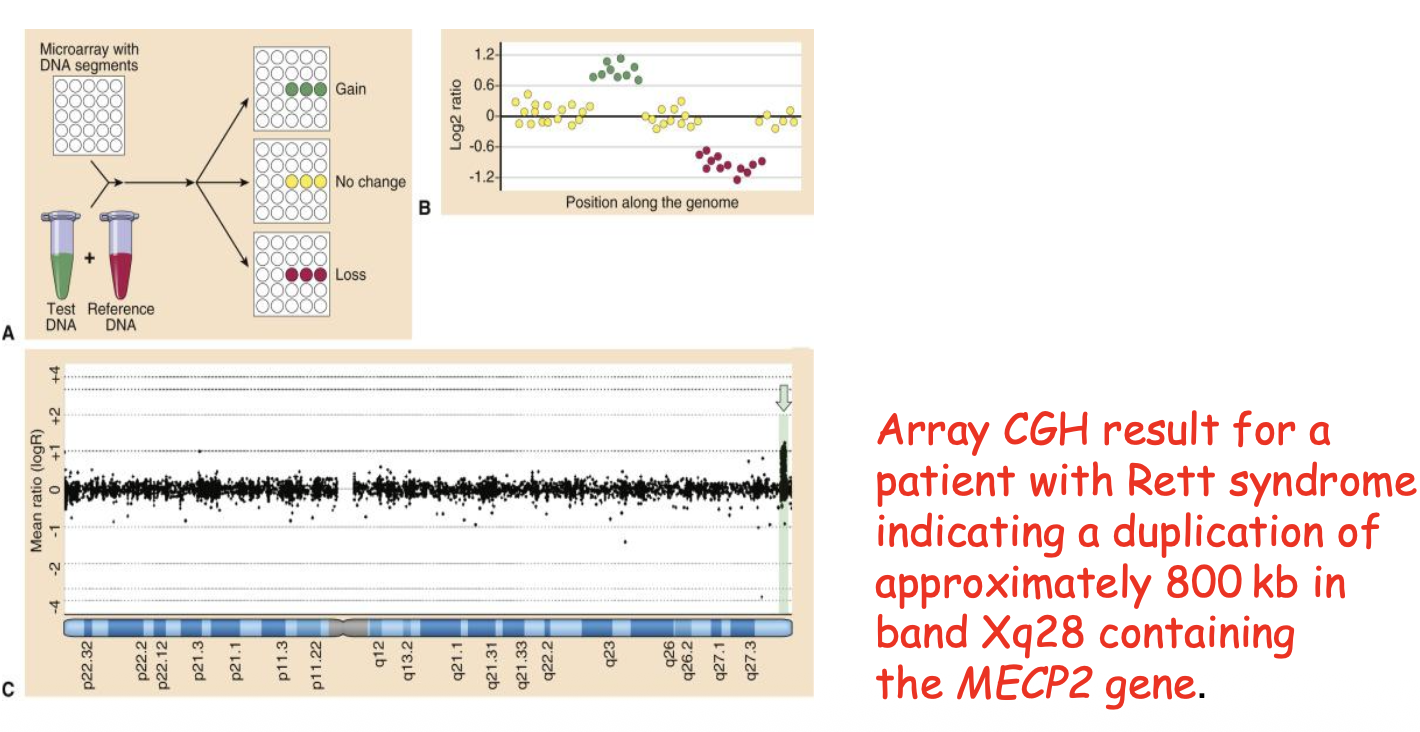
מקרה 2: תסמונת Rett
נמצאה תוספת של 800 קילו-בייס הכוללת את הגן MECP2. תסמונת Rett מופיעה בבנות (X-דומיננטי, בנים זה לטאלי), עם פיגור קשה, ראש גדול מאוד ותנועות אופייניות של “רחיצת ידיים” מתמדת.
מקרה 3: טריזומיה 21
ניתן לזהות בשלוש שיטות:
- קריוטיפ - רואים שלושה כרומוזומי 21
- FISH - שלושה סיגנלים
- CMA - עלייה בקו הגרף באזור כרומוזום 21
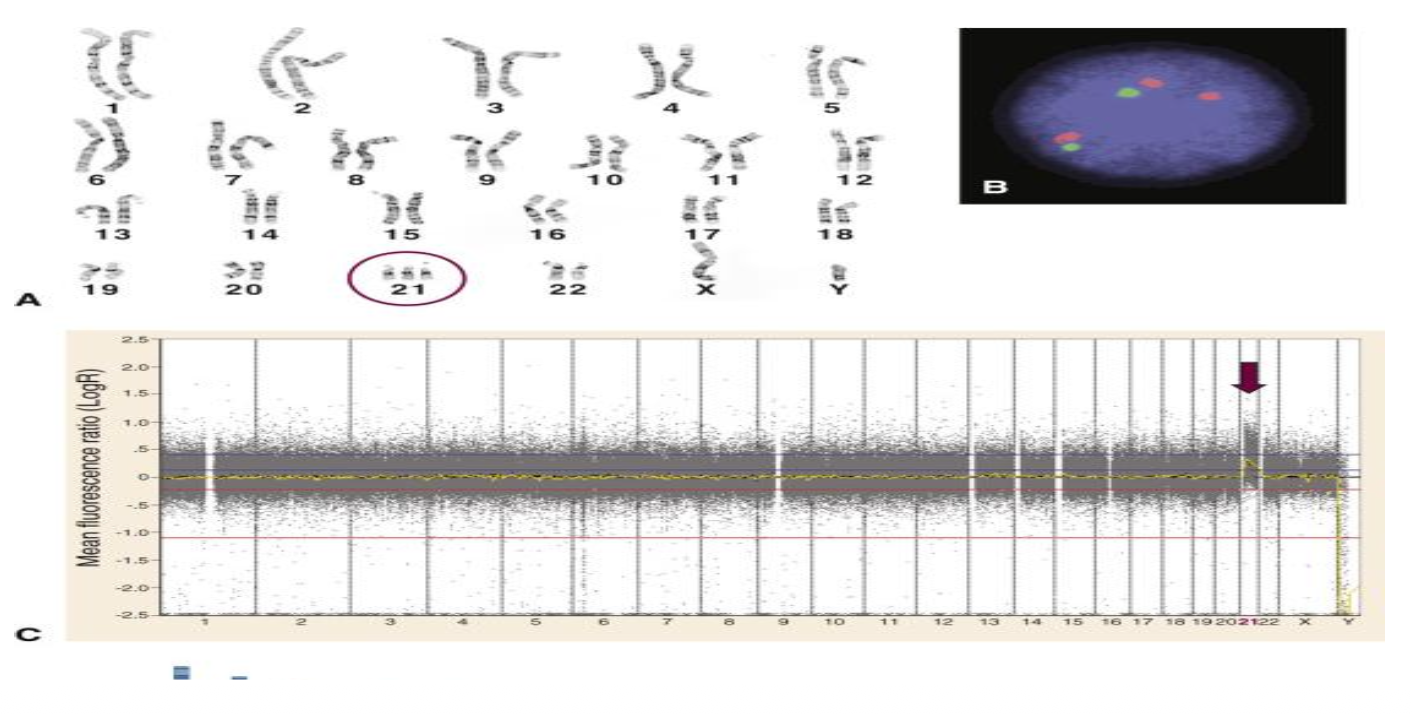
השוואה בין השיטות וסיכום
הרופאה הדגישה את ההבדל העקרוני: בקריוטיפ רואים את כל הכרומוזומים, ב-FISH צריך השערה ספציפית. “אתם כרופאים צריכים לדעת מה לבקש כדי שייתן לכם את שיעור הדיוק המתאים”.
לסיכום, כפי שציינה הרופאה: “כל אחד ישתמש במה שנוח לו, במה שיותר זמין לו. אבל אתם כרופאים צריכים לדעת מה לבקש”.
הציטוגנטיקה המודרנית משלבת טכניקות קלאסיות וממולקולריות מתקדמות, המאפשרות אבחון מדויק של הפרעות כרומוזומליות. מהקריוטיפ המסורתי דרך FISH וכלה ב-CMA, כל שיטה מציעה יתרונות ייחודיים ורזולוציה שונה. הבנה מעמיקה של שיטות אלו חיונית לרופא המודרני לצורך אבחון, ייעוץ גנטי, וניהול קליני מיטבי של מטופלים עם הפרעות כרומוזומליות.
לקסיקון מקצועי ומונחי מפתח
-
קריוטיפ (Karyotype): תצוגה מסודרת של כל הכרומוזומים בתא, מאורגנים לפי גודל, מיקום צנטרומר, ודפוס פסים.
-
אידיוגרם (Ideogram): ייצוג סכמטי וסטנדרטי של כרומוזום, המראה את דפוס הפסים האופייני שלו.
-
לוקוס (Locus): המיקום הפיזי הספציפי של גן או רצף DNA על כרומוזום.
-
הפלואידי (Haploid): סט אחד של כרומוזומים (n = 23 בבני אדם), כפי שנמצא בתאי הזקאות.
-
דיפלואידי (Diploid): שני סטים של כרומוזומים (2n = 46 בבני אדם), כפי שנמצא בתאים סומטיים.
-
הומולוגים (Homologous Chromosomes): זוג כרומוזומים דומים - אחד ממקור אימהי ואחד ממקור אבי, הנושאים גנים באותם לוקוסים.
-
אנאופלואידיה (Aneuploidy): מצב שבו מספר הכרומוזומים אינו כפולה שלמה של המספר ההפלואידי (למשל, 45 או 47).
-
מוזאיקיות (Mosaicism): נוכחות של שתי אוכלוסיות תאיות או יותר עם הרכב כרומוזומלי שונה באותו פרט.
-
CNV (Copy Number Variation): שונות במספר עותקי DNA - דלישן או דופליקציה של קטעי DNA.