חזרה: תרמודינמיקה של ריאקציות
$\Delta G$ ו-$\Delta G°’$
\[\Delta G = \Delta G°' + RT \ln Q\]- $R$ = קבוע הגזים
- $T$ = טמפרטורה בקלווין
- $Q$ = מנת הריאקציה (יחס תוצרים/מגיבים)
משמעות הסימן
| $\Delta G$ | כיוון הריאקציה |
|---|---|
| שלילי | לכיוון התוצרים (ספונטני) |
| חיובי | לכיוון המגיבים |
בעיה: שלבים עם $\Delta G$ חיובי
לשלב ארבע בגליקוליזה (אלדולאז) יש $\Delta G°’ = +23 \, \mathrm{kJ/mol}$ (חיובי!).
פתרון: צימוד ריאקציות
\[\begin{aligned} &\ce{Glucose + P_i -> G6P} \quad &\Delta G°' = +10 \\ &\ce{ATP -> ADP + P_i} \quad &\Delta G°' = -30 \\ &\ce{Glucose + ATP -> G6P + ADP} \quad &\Delta G°' = -20 \end{aligned}\]כל ה-$\Delta G$ של הגליקוליזה שלילי ← התהליך הולך לכיוון התוצרים.
סקירה: גליקוליזה
מסלולי הגלוקוז בתא
גלוקוז שנכנס לתא יכול ללכת ל:
- גליקוגן - אחסון (בשרירים ובכבד)
- מטריקס חוץ-תאי - בניית פוליסכרידים
- מעגל הפנטוזות - ייצור NADPH וריבוז
- גליקוליזה - פירוק לפירובט
שלבי הגליקוליזה
פאזת ההכנה (שלבים 5-1):
- השקעה של שני $\text{ATP}$
- שלב 1 ו-3: פוספורילציה
פאזת הרווח (שלבים 10-6): ייצור של:
- ארבעה $\text{ATP}$ (נטו: שני $\text{ATP}$)
- שני $\text{NADH}$
- שני פירובט
רווח אנרגטי כולל
| מקור | כמות ATP |
|---|---|
| גליקוליזה ישירה | $2 \, \text{ATP}$ |
| NADH (דרך שרשרת הובלת אלקטרונים) | $\sim 5 \, \text{ATP}$ |
| סה”כ | $\sim 7 \, \text{ATP}$ |
רגולציה של Hexokinase
שני איזואנזימים עיקריים
| מאפיין | Hexokinase 1-3 | Hexokinase 4 (Glucokinase) |
|---|---|---|
| מיקום | שריר | כבד |
| $K_M$ | נמוך (~0.1 mM) | גבוה (~10 mM) |
| משמעות | פעיל בריכוזי גלוקוז נמוכים | פעיל רק בריכוזי גלוקוז גבוהים |
| עיכוב על ידי תוצר | כן (G-6-P) | לא |
הגדרת $K_M$
$K_M$ = ריכוז הסובסטרט בו האנזים מגיע ל-$\frac{1}{2}V_{max}$
חשוב: $K_M$ נמוך לא בהכרח אומר אפיניות גבוהה! זה נכון רק במצב ספציפי (מודל מיכאליס-מנטן פשוט).
רגולציה של Hexokinase 1-3 (שריר)
עיכוב אלוסטרי על ידי התוצר:
\[\ce{Glucose ->[Hexokinase] G-6-P}\]כשיש הרבה G-6-P ← האנזים מעוכב ← “עשינו מספיק, אפשר לעצור”
רגולציה של Hexokinase 4 (כבד)
מנגנון מיוחד - הפרדה פיזית:
- ריכוז גלוקוז גבוה בדם ← גלוקוז נכנס לתאי הכבד
- גלוקוז משחרר את Hexokinase 4 מחלבון רגולטורי (GKRP)
- Hexokinase 4 יוצא מהגרעין לציטוזול
- מתחיל להפוך גלוקוז ל-G-6-P
גלוקוז נמוך / F-6-P גבוה:
- F-6-P (תוצר ביניים) קושר לחלבון הרגולטורי
- החלבון מושך את Hexokinase 4 בחזרה לגרעין
- האנזים לא פעיל (אין גישה לסובסטרט)
למה זה הגיוני?
- כשיש הרבה F-6-P ← הכבד עושה גְלוּקוֹנֵאוֹגֶנְזַה (יוצר גלוקוז)
- לא רוצים ש-Hexokinase 4 יהפוך את הגלוקוז החדש בחזרה ל-G-6-P!
רגולציה ברמת השעתוק
אינסולין מפעיל מסלול:
\[\ce{Insulin -> Receptor -> Dimerization -> IRS -> Grb2 -> SOS -> Ras-GTP -> Raf -> MEK -> ERK}\]ERK נכנס לגרעין ומעלה את הביטוי של אנזימי הגליקוליזה.
רגולציה של PFK-1 - השלב המחייב
למה זה השלב המחייב?
אחרי ש-PFK-1 הופך F-6-P ל-F-1,6-BP, המולקולה חייבת להגיע עד פירובט.
שלב מחייב = נקודת אל-חזור
מעכבים ומעודדים
מעכבים (מצביעים על אנרגיה גבוהה):
| מעכב | משמעות |
|---|---|
| ATP (ריכוז גבוה) | יש מספיק אנרגיה |
| ציטראט | מעגל קרבס פעיל |
מעודדים (מצביעים על מחסור באנרגיה):
| מעודד | משמעות |
|---|---|
| AMP | רמת ATP נמוכה |
| ADP | רמת ATP נמוכה |
| F-2,6-BP | המעודד החזק ביותר! |
מנגנון העיכוב על ידי ATP
ל-PFK-1 יש שני אתרי קישור ל-ATP:
- אתר פעיל - ATP כסובסטרט
- אתר אלוסטרי - ATP כמעכב
כש-ATP נקשר לאתר האלוסטרי ← שינוי מבני ← ירידה בפעילות
עיכוב אלוסטרי - הגדרה
עיכוב אלוסטרי = מולקולה נקשרת למקום אחר באנזים (לא באתר הפעיל) וגורמת לשינוי מבני שמפחית את הפעילות.
Fructose-2,6-bisphosphate - הרגולטור המרכזי
מה ההבדל מ-F-1,6-BP?
| מולקולה | תפקיד | מיקום הפוספט |
|---|---|---|
| F-1,6-BP | תוצר ביניים בגליקוליזה | עמדות 1 ו-6 |
| F-2,6-BP | רגולטור בלבד | עמדות 2 ו-6 |
פעולה כפולה
F-2,6-BP:
- מעודד PFK-1 (גליקוליזה)
- מעכב FBPase-1 (גְלוּקוֹנֵאוֹגֶנְזַה)
F-2,6-BP הוא המעודד החזק ביותר של PFK-1 - יכול להפעיל אותו גם בנוכחות ATP גבוה!
האנזים הדו-תפקודי
PFK-2 / FBPase-2 - אנזים אחד עם שני ראשים:
| ראש | פעילות | תוצאה |
|---|---|---|
| PFK-2 (קינאז) | $\ce{F-6-P + ATP -> F-2,6-BP}$ | מעודד גליקוליזה |
| FBPase-2 (פוספטאז) | $\ce{F-2,6-BP -> F-6-P + P_i}$ | מעודד גלוקונאוגנזה |
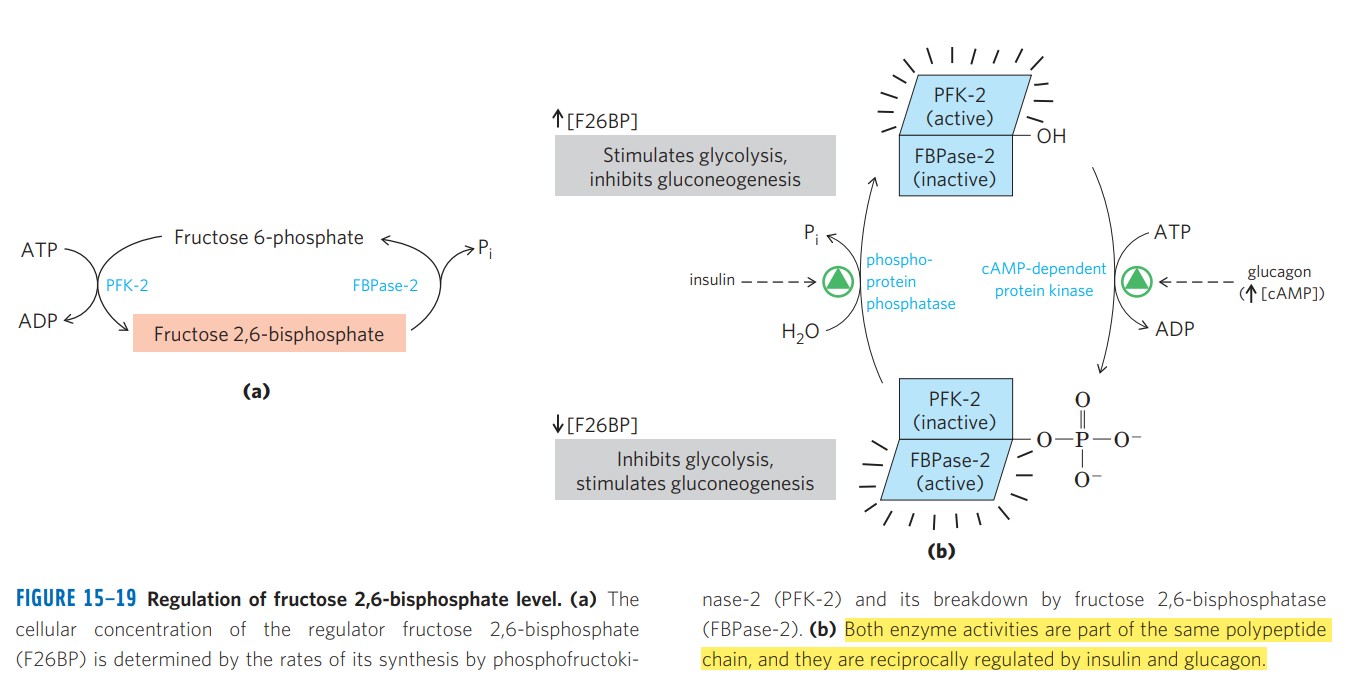
רגולציה הורמונלית
גלוקגון (רעב - גלוקוז נמוך):
\[\ce{Glucagon -> GPCR -> cAMP\uparrow -> PKA}\]PKA מזרחן את האנזים הדו-תפקודי:
- FBPase-2 פעיל ← F-2,6-BP יורד
- PFK-1 לא מעודד ← גליקוליזה מעוכבת
- FBPase-1 פעיל ← גלוקונאוגנזה
אינסולין (שובע - גלוקוז גבוה):
אינסולין מפעיל פוספטאז שמסיר את הפוספט:
- PFK-2 פעיל ← F-2,6-BP עולה
- PFK-1 מעודד ← גליקוליזה
גרף הפעילות
PFK-1 activity
^
| with F-2,6-BP
| /----------
| /
| / without F-2,6-BP
| / /----------
|/__/
+----------------> [F-6-P]
עם F-2,6-BP: פעילות גבוהה יותר, $K_M$ נמוך יותר.
רגולציה של Pyruvate Kinase
שני איזואנזימים
| איזואנזים | מיקום | רגולציה |
|---|---|---|
| Pyruvate Kinase M | כל התאים | אלוסטרית בלבד |
| Pyruvate Kinase L | כבד | אלוסטרית + הורמונלית |
רגולציה אלוסטרית (כל ה-PK)
מעכבים:
| מעכב | משמעות |
|---|---|
| ATP | יש מספיק אנרגיה |
| ציטראט | מעגל קרבס פעיל |
| Acetyl-CoA | יש מספיק דלק |
| אלנין | רמת פירובט גבוהה* |
| חומצות שומן | מקור אנרגיה חלופי |
*אלנין נוצר מפירובט על ידי טרנסאמינציה: $\ce{Pyruvate + NH3 <=> Alanine}$
מעודד:
- F-1,6-BP (תוצר PFK-1) - דוחף את התהליך קדימה
רגולציה הורמונלית (PK-L בכבד בלבד)
גלוקגון:
\[\ce{Glucagon -> cAMP -> PKA ->[phosphorylation] PK-L_{inactive}}\]הכבד מפסיק לפרק גלוקוז ומתחיל לייצר אותו (גלוקונאוגנזה).
מצב רגיל: פוספטאז מסיר את הפוספט ← PK-L פעיל.
שים לב: זרחון לא תמיד מפעיל! כאן זרחון מעכב את PK-L.
גְלוּקוֹנֵאוֹגֶנְזַה
עלות אנרגטית
לייצור מולקולת גלוקוז אחת:
| מרכיב | כמות |
|---|---|
| פירובט | 2 |
| ATP | 4 |
| GTP | 2 |
| NADH | 2 |
תהליך יקר מאוד - קורה רק כשיש מספיק אנרגיה!
מעכבים של גלוקונאוגנזה
| מעכב | משמעות |
|---|---|
| ADP | מחסור באנרגיה |
| AMP | מחסור באנרגיה |
הגיוני: צריך הרבה אנרגיה לגלוקונאוגנזה. אם אין אנרגיה (AMP/ADP גבוה) - לא עושים!
האנזים האחרון: Glucose-6-phosphatase
\[\ce{G-6-P + H2O ->[G6Pase] Glucose + P_i}\]מיקום: לומן של ה-ER בתאי כבד
מנגנון:
- טרנספורטר מכניס G-6-P ללומן
- האנזים מפרק ל-Glucose + Pi
- טרנספורטר מוציא גלוקוז לציטוזול
- טרנספורטר מוציא Pi לציטוזול
- GLUT2 מוציא גלוקוז לדם
מסלול הלקטט
בתנאים של נשימה אנאירובית (חוסר חמצן):
\[\ce{Pyruvate + NADH <=>[LDH] Lactate + NAD+}\]- יצירת לקטט מורידה את רמת ה-pH בתאים
- גורם לכאבי שרירים בפעילות גופנית אינטנסיבית
מעגל הפנטוזות (Pentose Phosphate Pathway)
תוצרים עיקריים
- NADPH - כוח מחזר
- Ribose-5-phosphate - לסינתזת נוקלאוטידים
האנזים הראשון: G6PD
\[\ce{G-6-P + NADP+ ->[G6PD] 6-phosphoglucono-\delta-lactone + NADPH}\]רגולציה
NADPH מעכב את G6PD (עיכוב על ידי תוצר)
מחסור ב-G6PD (Favism)
הבעיה:
- אין מספיק NADPH
- לא ניתן לשמור על סביבה מחזרת
- הצטברות נזק חמצוני
- המוליזה (פירוק תאי דם אדומים)
פאביזם:
- רגישות לפול (Fava beans)
- הפול מכיל Vicine שיוצר רדיקלים
- אנשים עם מחסור ב-G6PD לא יכולים לנטרל את הנזק החמצוני של הרדיקלים
יתרון אבולוציוני:
- עמידות למלריה!
- הפרזיט לא שורד בנזק החמצוני
תאים שצריכים הרבה NADPH
| תא | סיבה |
|---|---|
| תאי שומן | סינתזת חומצות שומן |
| תאים מתחלקים | סינתזת נוקלאוטידים |
| תאי דם אדומים | נשיאת חמצן ← נזק חמצוני ← צריך לנטרל |
| כבד | סינתזת חומצות שומן, ניקוי רעלים |
סיכום - נקודות מפתח
עקרונות כלליים
- תוצרים מעכבים - ATP, ציטראט, NADPH
- מגיבים מעודדים - AMP, ADP, F-1,6-BP
- זרחון לא תמיד מפעיל - תלוי באנזים הספציפי
שלושת האנזימים המרכזיים בגליקוליזה
| אנזים | שלב | מעכבים | מעודדים |
|---|---|---|---|
| Hexokinase | 1 | G-6-P (1-3), F-6-P (4) | גלוקוז |
| PFK-1 | 3 | ATP, ציטראט | AMP, ADP, F-2,6-BP |
| Pyruvate Kinase | 10 | ATP, ציטראט, אלנין | F-1,6-BP |
רגולציה הורמונלית - כבד
| הורמון | מצב | השפעה על גליקוליזה | השפעה על גְלוּקוֹנֵאוֹגֶנְזַה |
|---|---|---|---|
| אינסולין | שובע | ↑ | ↓ |
| גלוקגון | רעב | ↓ | ↑ |
F-2,6-BP - המפתח
- נוצר על ידי PFK-2
- מפורק על ידי FBPase-2
- שניהם על אותו חלבון!
- גלוקגון ← זרחון ← FBPase-2 פעיל
- אינסולין ← דה-זרחון ← PFK-2 פעיל
מיקום האנזימים
| אנזים | מיקום |
|---|---|
| רוב אנזימי הגליקוליזה | ציטוזול |
| Pyruvate Carboxylase | מיטוכונדריה |
| G6Pase | לומן ה-ER |
| G6PD | ציטוזול |