מבוא וחזרה כללית
הקורס מתחיל בהנחה שהסטודנטים כבר למדו כימיה כללית עם המרצה מסתאי, ולכן מכירים את מבנה האטום ומבינים קצת על קשרים. נעשתה חזרה כללית בהקשר של כימיה אורגנית כדי לבסס את הידע לקראת הנושאים המתקדמים יותר.
סוגי קשרים עיקריים
בכימיה אורגנית עוסקים בשלושה סוגי קשרים עיקריים:
- קשר קובלנטי - שיתוף אלקטרונים בין אטומים
- קשר יוני - העברת אלקטרונים בין אטומים
- קשרים חלשים יותר:
- קשרי לונדון (כוחות ון דר ואלס) - הכי חלשים, קיימים בכל מולקולה
- קשרי דיפול-דיפול - חזקים יותר מלונדון, קיימים במולקולות לא סימטריות לגמרי
- קשרי מימן - מקרה ספציפי של קשרי דיפול-דיפול, קיימים כאשר יש מימן וגם $\ce{N, O}$ או $\ce{F}$ (נוף)
כימיה אורגנית לעומת אי-אורגנית
ההבדל הבסיסי בין כימיה אורגנית לאי-אורגנית הוא הימצאות הפחמן. ברגע שיש פחמן במולקולה, היא שייכת לכימיה אורגנית. זהו כלל אצבע המתקיים ברוב המקרים, אם כי ישנם מקרים יוצאי דופן.
מטען פורמלי (Formal Charge)
המושג מטען פורמלי מתייחס למטען החשמלי המיוחס לאטום ספציפי במולקולה. חישוב המטען הפורמלי נלמד הן ברמת האטומים הבודדים והן ברמת המולקולות.
חישוב מטען פורמלי
ניתן לחשב את המטען הפורמלי באמצעות הנוסחה הבאה:
מטען פורמלי = מספר אלקטרוני הערכיות - (מספר האלקטרונים הלא-קושרים + 1/2 מספר האלקטרונים הקושרים)
מבנה מולקולות
מבנה לואיס
מבנה לואיס הוא דרך לייצג את האלקטרונים בקשרים כימיים במולקולה. כדי לשרטט מבנה לואיס:
- חישוב מספר האלקטרונים הכולל במולקולה
- קביעת מספר הקשרים שכל אטום יוצר (הכלל הבסיסי):
- פחמן: 4 קשרים
- חנקן: 3 קשרים
- חמצן: 2 קשרים
חשוב לזכור: יש כללים ברורים לגבי כמות הקשרים שכל אטום יכול ליצור. חנקן לעולם לא יהיה עם חמישה קשרים, פחמן מעולם לא יהיה עם חמישה קשרים, וחמצן נדיר שיהיה עם שלושה קשרים.
דוגמה שהוצגה בהרצאה כללה את מולקולת $\ce{NLO3}$, שבה החנקן במצב לא טבעי עם ארבעה קשרים במקום שלושה, מה שמוביל למטען חיובי על החנקן.
היברידיזציה, אורביטלות מולקולריות וקשרים כימיים
טבלה מפורטת של סוגי היברידיזציה
| היברידיזציה | אורביטלות אטומיות | אורביטלות מהוברדות | אורביטלות לא מהוברדות | קשרים | מבנה מרחבי | זווית קשר |
|---|---|---|---|---|---|---|
| $\mathbf{sp^3}$ | \(2s + 2p_x + 2p_y + 2p_z\) | $4$ אורביטלות $sp^3$ זהות | אין | $4$ קשרי $\sigma$ | טטראדר | $109.5^{\circ}$ |
| $\mathbf{sp^2}$ | \(2s + 2p_x + 2p_y\) | $3$ אורביטלות $sp^2$ זהות | $2p_z$ | $3$ קשרי $\sigma$ $+1$ קשר $\pi$ | משולש מישורי | $120^{\circ}$ |
| $\mathbf{sp}$ | \(2s + 2p_z\) | $2$ אורביטלות $sp$ זהות | $2p_x, 2p_y$ | $2$ קשרי $\sigma$ $+2$ קשרי $\pi$ | ליניארי | $180^{\circ}$ |
הסברים מפורטים
$\mathbf{sp^3}$ היברידיזציה (מתאן, $\mathbf{CH_4}$)
- אורביטלות מעורבות: אורביטל $2s$ אחת מתערבבת עם שלוש אורביטלות $2p$ ($2p_x$, $2p_y$, $2p_z$)
- תוצאה: נוצרות $4$ אורביטלות מהוברדות $sp^3$ זהות
- קשרים: כל אורביטל $sp^3$ יוצרת קשר $\sigma$ עם אורביטל $1s$ של אטום מימן
- סה”כ: $4$ קשרי $\sigma$ (מסוג $sp^3$-$1s$), ללא קשרי $\pi$
$\mathbf{sp^2}$ היברידיזציה (אתן, $\mathbf{C_2H_4}$)
- אורביטלות מעורבות: אורביטל $2s$ אחת מתערבבת עם שתי אורביטלות $2p$ ($2p_x$, $2p_y$)
- תוצאה: נוצרות $3$ אורביטלות מהוברדות $sp^2$ זהות + אורביטל $2p_z$ לא מהוברדת
- קשרי $\sigma$:
- קשר $\sigma$ אחד בין שני אטומי הפחמן ($sp^2$-$sp^2$)
- שני קשרי $\sigma$ עם אטומי מימן ($sp^2$-$1s$)
- קשר $\pi$: נוצר מחפיפה צדדית בין שתי אורביטלות $2p_z$ הלא מהוברדות של שני אטומי הפחמן
- סה”כ: $3$ קשרי $\sigma$ + קשר $\pi$ אחד (לכל פחמן)
$\mathbf{sp}$ היברידיזציה (אתין, $\mathbf{C_2H_2}$)
- אורביטלות מעורבות: אורביטל $2s$ אחת מתערבבת עם אורביטל $2p$ אחת ($2p_z$)
- תוצאה: נוצרות $2$ אורביטלות מהוברדות $sp$ זהות + $2$ אורביטלות $p$ לא מהוברדות ($2p_x$, $2p_y$)
- קשרי $\sigma$:
- קשר $\sigma$ אחד בין שני אטומי הפחמן ($sp$-$sp$)
- קשר $\sigma$ אחד עם אטום מימן ($sp$-$1s$)
- קשרי $\pi$: נוצרים מחפיפה צדדית בין זוגות אורביטלות $2p_x$ ו-$2p_y$ הלא מהוברדות של שני אטומי הפחמן
- סה”כ: $2$ קשרי $\sigma$ + $2$ קשרי $\pi$ (לכל פחמן)
חשוב לציין: בכל מקרה, אלקטרוני $1s$ של הפחמן אינם משתתפים בהיברידיזציה או בקשרים כי הם נמצאים ברמת אנרגיה נמוכה יותר.
חישוב היברידיזציה
לקביעת היברידיזציה של אטום יש לחשב:
- מספר אלקטרוני הערכיות (ואלנס) המשתתפים בהיברידיזציה
- מספר קשרי סיגמה שהאטום יוצר
- מספר זוגות האלקטרונים הלא-קושרים
נוסחה לחישוב היברידיזציה: סך הכל = מספר קשרי סיגמה + מספר זוגות אלקטרונים לא-קושרים.
לדוגמה, עבור פחמן ב-$\ce{CH4}$:
- 4 קשרי סיגמה
- 0 זוגות אלקטרונים לא-קושרים
- סך הכל: 4
- היברידיזציה: $4-1=3 \Rightarrow \text{sp}^3$
השפעה על זוויות קשר
זוויות הקשר בטטראדר הן 109.5°, אולם אם קיימים זוגות אלקטרונים לא-קושרים, הזווית תשתנה. הדחייה של זוג אלקטרונים לא-קושר חזקה יותר מדחיית מימנים, ולכן זווית הקשר בין המימנים תהיה קטנה יותר מ-109.5° (בערך 107°).
חומצות ובסיסים בכימיה אורגנית
בשיעור השני נכנסנו לנושא של חומצות ובסיסים בהקשר של כימיה אורגנית, בניגוד לכימיה כללית שנלמדה קודם.
עקרונות יסוד
חומר יכול להיות חומצה או בסיס בהתאם לחומר השני שהוא מגיב איתו. החומר היותר חומצי יהיה החומצה בריאקציה. דוגמה קלאסית היא מים ($\ce{H2O}$): אם המים מגיבים עם חומצה, הם מתנהגים כמו בסיס, ואם הם מגיבים עם בסיס, הם מתנהגים כמו חומצה.
חומר לא בהכרח רק חומצה או רק בסיס - הכל יחסי ותלוי בריאקציה הספציפית.
סוגי חומצות
חומצת ברונסטד–לאורי
חומצת ברונסטד יודעת לתת פרוטון ($\ce{H+}$), וזה בדרך כלל ההגדרה שמשתמשים בה בכימיה אורגנית. כשמדברים בכימיה אורגנית, בניגוד לכימיה כללית, חומר הוא חומצה ברגע שהוא נותן פרוטון.
חומצת לואיס
חומצת לואיס זה חומר שיודע לקבל אלקטרונים.
חשוב להבין את היחס בין שני סוגי החומצות: כל חומר שהוא חומצת ברונסטד בהגדרה גם יהיה חומצת לואיס, אבל לא ההפך. לא כל חומר שמקבל אלקטרונים בהכרח גם יש לו פרוטון לתת.
קביעת חומציות
גורמים המשפיעים על חומציות:
-
אלקטרונגטיביות - לאורך שורה בטבלה המחזורית: ככל שהחומר יותר אלקטרונגטיבי הוא יהיה יותר חומצי. פלואור ($\ce{F}$) זה החומר הכי אלקטרונגטיבי בטבלה המחזורית. [המדד שלו] 3.98.
-
גודל האטום - לאורך טור בטבלה המחזורית: ככל שהחומר יותר גדול הוא יהיה יותר חומצי.
העיקרון המנחה בקביעת חומציות: כמה החומר יכול להתמודד עם המטען השלילי עליו. ככל שחומר יותר גדול הוא יתמודד יותר טוב עם המטען השלילי עליו. ככל שחומר יותר אלקטרונגטיבי הוא יתמודד יותר טוב עם המטען השלילי עליו.
חומצה חזקה זו חומצה שמוותרת יחסית בקלות על הפרוטון. ויתור על הפרוטון אומר שהחומר יודע להסתדר עם המטען שנשאר איתו.
אפקט אינדוקטיבי
אפקט אינדוקטיבי מתרחש כאשר ייצוב המטען השלילי אינו על האטום עצמו אלא ממרחק. כאשר הייצוב הוא ממרחק, אפקט אלקטרונגטיבי הוא יותר חזק מאפקט של גודל האטום, ולכן כשיש פלואור מקבלים אפקט יותר חזק מאשר אפקט של ברום.
עיקרון נוסף הוא מרחק האטום ממקום הפרוטון: ככל שהאטום שיכול לשאת עליו את המטען השלילי יהיה יותר קרוב למקום שבו צריך לעשות החלוקת מטען, החומר יהיה יותר חומצי.
חומצות ובסיסים מצומדים
לכל חומצה יש בסיס מצומד ולכל בסיס יש חומצה מצומדת.
דוגמה: הבסיס המצומד של מתנול ($\ce{CH3OH}$) הוא $\ce{CH3O-}$, שנוצר לאחר הסרת הפרוטון מקבוצת ההידרוקסיל.
נומנקלטורה - שמות למולקולות אורגניות
בשיעור השלישי נכנסנו למשפחות של מולקולות בכימיה אורגנית ולשיטות הנומנקלטורה (מתן שמות). הוזכרו מספר משפחות חשובות:
- אלכוהול: עם קבוצת הידרוקסיל (OH)
- אתרים: עם קבוצת R-O-R (אלכוהול יכול להיחשב כמקרה פרטי של אתר שבו אחד ה-R הוא H)
שלבים במתן שם למולקולה
- זיהוי השרשרת הכי ארוכה:
- סופרים את מספר אטומי הפחמן וקובעים את השם הבסיסי
- למשל: 8 פחמנים = אוקטן
- מספור השרשרת:
- מתחילים למספר מהצד שיביא למספור הנמוך ביותר למתמירים
- שמות מתמירים:
- מציינים את מיקום ושם המתמירים
סוגי שמות סטנדרטיים
יש ארבעה שמות שצריך לזכור אם יש מולקולה:
-
שרשרת ישרה: נגמרת ב”יל” לדוגמה: שרשרת של ארבעה פחמנים נקראת “בוטיל”.
-
פחמן שלישוני (טרס): כאשר לפחמן יש שלושה מתמירים, מדברים על מולקולה עם פחמן תרס, תרסי או טריטי.
-
פחמן עם הסתעפות (ברנצ’): כאשר המולקולה לא בשרשרת ישרה אלא מסתעפת מהשרשרת ישרה ויש לה מתמיר נוסף.
במקרה מיוחד, כאשר ההסתעפות היא על הפחמן האחד לפני האחרון, מסתכלים על קצה השרשרת מבחינת המבנה הישר של הפחמנים והפחמן האחד לפני אחרון יש סיעוף.
-
פחמן משני (סק): פחמן שמחובר לשני פחמנים אחרים.
דוגמה למתן שם
בדוגמה שנדונה, רואים מולקולה עם חמישה פחמנים והידרוקסיל:
CH3
|
H3C-C-CH2-CH2-OH
|
CH3
ניתן להשתמש בשתי גישות:
- גישה ראשונה: להתייחס לשרשרת הישרה (4 פחמנים) עם מתמיר - “טרש-בוטנול”
- גישה שנייה: להשתמש בקידומת “איזו” - “איזו-פנטנול”
הגישה הראשונה מועדפת בגלל בהירות גדולה יותר במולקולות מורכבות.
דוגמה נוספת - אוקטן עם מתמיר
בדוגמה נוספת, זוהתה שרשרת של 8 פחמנים (אוקטן) עם מתמיר איזו-פרופיל על פחמן מספר 4. התשובה הנכונה היא: 4-איזו-פרופיל אוקטן
כוחות בין-מולקולריים
בכימיה אורגנית, מדברים על שלושה סוגי כוחות בין-מולקולריים (מהחלש לחזק):
-
קשרי לונדון: קשרי לונדון יהיו בכל מולקולה, והם קשרים מאוד חלשים.
-
קשרי דיפול-דיפול: קשרי דיפול-דיפול יהיו בהרבה מולקולות, כל מולקולות שאינן לגמרי סימטריות לרוב יציגו קשרי דיפול-דיפול, והן יותר חזקים מלונדון.
-
קשרי מימן: קשרי מימן הם מקרה ספציפי של קשרי דיפול-דיפול, כאשר יש מולקולה שיש לה גם מימן וגם נוף (ניטרוג׳ן, אוקסג׳ן ופלואור).
מדדים לחוזק הקשרים
בכימיה אורגנית משתמשים בשני מדדים:
-
נקודת רתיחה - ככל שנקודת הרתיחה גבוהה יותר, הקשרים בין המולקולות חזקים יותר
-
מסיסות - ככל שהמסיסות יורדת, הקשרים בין המולקולות חזקים יותר
חשוב לציין גורמים שמשפיעים על נקודת רתיחה: ככל שיש שרשרת יותר ארוכה של פחמנים, נקודת הרתיחה עולה בגלל קשרי לונדון. קשרי לונדון יותר משמעותיים ככל שהמולקולה יותר ארוכה, וככל שהאטום יותר גדול הוא יותר פולרי ולכן נקודת הרתיחה עולה.
היטלי ניומן (Newman Projections)
היטלי ניומן הם דרך לייצג את המבנה המרחבי של מולקולות, במיוחד סביב קשרי סיגמה.
עקרונות בסיסיים
כאשר מציירים היטלי ניומן:
- הפחמן הקדמי מיוצג כנקודה
- הפחמן האחורי מיוצג כעיגול
- המתמירים מסודרים סביב הפחמנים
דוגמה: אתאן (CH₃-CH₃)
בהיטלי ניומן של אתאן, ניתן לייצג את המולקולה בשתי קונפורמציות עיקריות:
-
סטאגרד (Staggered) - המימנים רחוקים זה מזה המצב יותר יציב כי המימנים רחוקים אחד מהשני, ולכן פחות דחייה ויותר יציבות.
-
אקליפסט (Eclipsed) - המימנים אחד מול השני מצב פחות יציב כי המימנים דוחים אחד את השני.
חשוב להבין שהמולקולה בתנועה מתמדת סביב הקשר. יש סיבוב חופשי סביב קשר סיגמה וכל הזמן יש את הסיבוב והאטומים יכולים להיות בכל נקודה.
דוגמה: בוטאן (CH₃-CH₂-CH₂-CH₃)
כאשר בוחנים את הקשר בין פחמן 2 לפחמן 3 בבוטאן:
CH₃-CH₂-CH₂-CH₃
1 2 3 4
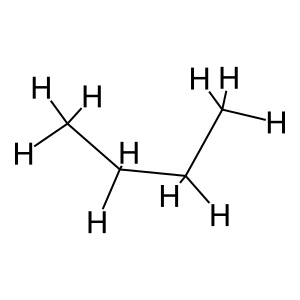
יש מספר קונפורמציות אפשריות:
-
פול אקליפסט (Full Eclipsed) - קבוצות CH₃ אחת מול השנייה (הכי פחות יציב) ברגע ששתי הקבוצות הנפחיות הן באקליפסט קוראים לזה פול אקליפסט, אקליפסט מלא.
-
אקליפסט (Eclipsed) - CH₃ מול H ברגע ששתי הקבוצות הנפחיות הן באקליפסט אבל לא אחת מול השנייה קוראים לזה אקליפסט.
-
גוש (Gauche) - CH₃ במצב סטאגרד אך לא הכי רחוק ברגע שהן רחוקות אחת מהשנייה אבל לא הכי רחוקות אחת מהשנייה קוראים לזה גוש.
-
אנטי (Anti) - קבוצות CH₃ במצב סטאגרד והכי רחוקות (הכי יציב) כשהקבוצות הנפחיות הן במצב שהן הכי רחוקות אחת מהשנייה קוראים לזה אנטי, וזו הקונפורמציה שתהיה הכי יציבה מבחינה אנרגטית.
כללים להערכת יציבות: המצב הכי יציב מבחינה אנרגטית הוא כאשר שתי הקבוצות הכי נפחיות או הכי טעונות יהיו הכי רחוקות אחת מהשנייה.
מולקולות ציקליות
בהמשך עברנו למולקולות ציקליות, במיוחד ציקלוהקסאן. מולקולות ציקליות יכולות להיות מורכבות משלושה פחמנים, ארבעה, חמישה, שישה ויותר. מולקולות בעלות חמישה ושישה פחמנים הן יחסית יותר יציבות.
ציקלוהקסאן
ציקלוהקסאן הוא מולקולה ציקלית עם שישה פחמנים. היא יכולה להופיע בשתי קונפורמציות עיקריות:
-
כיסא (Chair) - היציבה יותר
-
סירה (Boat) - פחות יציבה בסירה המתמירים יכולים להוות דחייה ולכן זה יהיה פחות יציב.
עמדות במבנה כיסא
במבנה כיסא יש שני סוגי עמדות למתמירים:
-
עמדה אקסיאלית (Axial): עמדה אקסיאלית פירושה שהמתמירים ניצבים למישור המולקולה פחות או יותר. המולקולה אינה פלנארית לגמרי אז זה לא ממש ניצבים אבל יחסית ניצבים למישור המולקולה.
-
עמדה אקווטוריאלית (Equatorial): אקווטוריאלי בא מלשון קו המשווה, המתמירים בהמשך ישרים.
בהשוואה בין השתיים: אקווטוריאלי יהיה יותר יציב. ככל שהמתמיר יהיה יותר גדול תהיה העדפה לאקווטוריאלי.
חשוב לציין שככל שהמתמיר גדול יותר, כך ההעדפה לעמדה אקווטוריאלית משמעותית יותר. אם מדובר במימנים אז העדפה לאקווטוריאלי לא תהיה מאוד דרמטית. אבל אם יש קבוצה הלוגנית מאוד גדולה כמו ברום, כלור או יוד, אז העדפה לאקווטוריאלי תהיה הרבה יותר גדולה.
הפיכת כיסא (Chair Flip)
מולקולת ציקלוהקסאן יכולה לעבור מקונפורמציית כיסא אחת לשנייה. כאשר יש מתמירים על המולקולה, הפיכת הכיסא משנה את העמדה שלהם. אם מתמיר היה בעמדה אקווטוריאלית, לאחר הסיבוב הוא הופך לאקסיאלית.
זה גורם לשינוי ביציבות המולקולה: כאשר יש מתמירים, המתמירים יכולים לגרום לדחייה מסוימת ולכן תהיה העדפה לצורה אקסיאלית או אקווטוריאלית.
דחייה בעמדה אקסיאלית
במצב אקסיאלי, יש פוטנציאל לדחייה בין מתמירים. כאשר מתמיר נמצא בעמדה אקסיאלית, תהיה לו דחייה עם המימנים שיושבים במיקומים 1, 3 ו-5. אם במקום מימנים יש מתמירים גדולים, הדחייה משמעותית יותר.
טבלת העדפות קונפורמציוניות
המרצה הציג טבלה המראה את היחס בין העדפת עמדה אקווטוריאלית לעמדה אקסיאלית:
| מתמיר | יחס אקווטוריאלי:אקסיאלי |
|---|---|
| מימן (H) | 1:1 (אין העדפה) |
| מתיל (CH₃) | 20:1 |
| טרץ-בוטיל | ~5000:1 |
ככל שהקבוצה יותר נפחית, ככל שהקבוצה יותר גדולה תהיה עדיפות לעבור לעמדה אקווטוריאלית.
ציס וטראנס - מאפיינים ותכונות
המקרה הקלאסי: קשר כפול
במקרה הקלאסי של ציס וטראנס מדובר במולקולות עם קשר כפול. בקשר כפול אין סיבוב חופשי סביב הקשר.
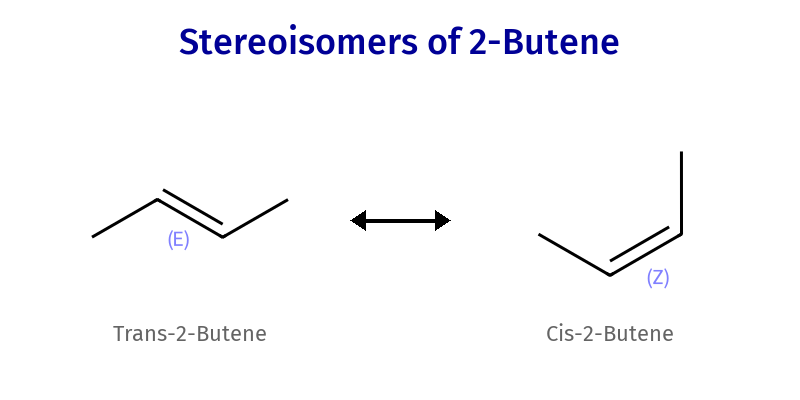
-
ציס: שתי קבוצות נפחיות באותו צד של הקשר הכפול שני המתמירים הנפחיים (כגון כלור ויוד) נמצאים באותו צד של הקשר הכפול.
-
טראנס: שתי קבוצות נפחיות בצדדים מנוגדים של הקשר הכפול המתמירים נמצאים בצדדים מנוגדים של הקשר הכפול.
מבין השניים, טראנס יותר יציב. טראנס קרוי כך כי כשרוקדים טראנס מתפזרים עם כל הגוף, כלומר רחוק אחד מהשני, וטראנס תמיד יהיה יותר יציב.
השוואת תכונות ציס וטראנס
נעשתה השוואה בין איזומרים ציס וטראנס של בוטן-2:
1. נקודת רתיחה
- ציס: ~4°C
- טראנס: ~1°C
נקודת הרתיחה הניסיונית של הציס היא בערך ארבע מעלות לעומת הטראנס שהיא בערך מעלה אחת.
2. מומנט דיפול
-
טראנס: מומנט דיפול = 0 (המומנטים מבטלים זה את זה) כאשר יש טראנס, המומנט דיפול של סך הכל המולקולה יהיה אפס כי יש שתי קבוצות נפחיות שלמרות שלכל אחת מהן יש מומנט דיפול יחסית למולקולה, הן מבטלות אחת את השנייה.
-
ציס: יש מומנט דיפול במולקולת ציס, שני המומנטים פועלים מאותו כיוון ולכן יהיה מומנט דיפול לכיוון הנפחי של המולקולה.
3. כוחות בין-מולקולריים
תכונות אלו משפיעות על האינטראקציות בין המולקולות:
- בשתי המולקולות יש קשרי לונדון
- בציס יש גם קשרי דיפול-דיפול בגלל המומנט הדיפולי
- בטראנס אין קשרי דיפול-דיפול בגלל המומנט הדיפולי האפסי
חשוב להבין שמדובר בכוחות בין מולקולות ולא בתוך המולקולה. כשמדברים על תכונות כמו נקודת רתיחה או מסיסות, מדובר על אינטראקציות בין מולקולות ולא בתוך המולקולה.
E/Z כהרחבה של ציס/טראנס
הקריטריון העיקרי למולקולה להציג איזומריזם E/Z הוא הימצאות קשר כפול פחמן-פחמן עם שתי קבוצות שונות על כל פחמן.
כאשר יש ארבעה מתמירים שונים סביב קשר כפול, משתמשים במערכת E/Z במקום ציס/טראנס. ציס וטראנס הם בעצם מקרה ספציפי של E ו-Z.
קביעת E/Z
-
יש לדרג את המתמירים לפי סדר עדיפות (על פי המספר האטומי).
-
בדיקת סידור המתמירים בעלי העדיפות הגבוהה:
- אם שני המתמירים בעדיפות גבוהה הם באותו צד, זה יהיה Z.
- אם שני המתמירים בעדיפות גבוהה הם בצדדים מנוגדים, זה יהיה E.
E ו-Z באים מגרמנית:
- Z = Zusammen (יחד)
- E = Entgegen (מנוגד)
דוגמה שהוצגה כללה:
- ברום (Br) = 35 (מספר אטומי)
- כלור (Cl) = 17
- CH₃ = 6 (מספר אטומי של פחמן)
- H = 1
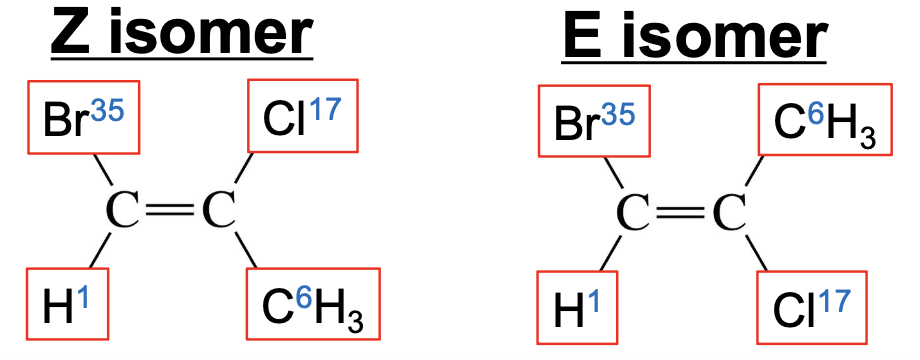
ציס וטראנס במולקולות ציקליות
גם במולקולות ציקליות ניתן להבחין בין ציס וטראנס. הרעיון הוא להבין אם המתמירים קרובים אחד לשני או רחוקים אחד מהשני.
בבחינת מולקולות ציקליות יש לבדוק באיזו עמדה נמצאים המתמירים (אקסיאלית או אקווטוריאלית). מתמירים בעמדה אקווטוריאלית ואקווטוריאלית יהיו יותר יציבים מאשר מתמירים בעמדה אקסיאלית ואקווטוריאלית.
בתוך קבוצת טראנס, המצב היציב יותר הוא כאשר המתמירים יכולים להיות אקווטוריאלי רחוק אחד מהשני או אקסיאלי רחוק אחד מהשני. בטראנס, המצב האקווטוריאלי יהיה יותר יציב.
איזומריה
איזומרים הם מולקולות שיש להן את אותו מבנה כימי מבחינת הרכב האטומים, אך לא בהכרח אותו מבנה מרחבי.
מהם איזומרים?
כשמדברים על מולקולות שיש להן את אותו מבנה כימי, הכוונה למולקולות שיש להן את אותו מספר פחמנים, אותו מספר מימנים ואותו מספר חמצנים, חנקנים וכן הלאה - בדיוק אותו הרכב כימי, קוראים להן איזומרים.
סוגי איזומרים
1. איזומרים מבניים (Structural Isomers)
הדוגמה הכי קלה להבנה היא איזומרים מבניים. מדובר במולקולות שיש להן את אותו מספר פחמנים, מימנים וכן הלאה אבל הם לא מחוברים באותה דרך.
דוגמה:
- אתנול (CH₃CH₂OH)
- אתר דימתילי (CH₃OCH₃)
בשתי מולקולות אלה יש שישה מימנים, שני פחמנים וחמצן אחד, אך אלו אינן אותן מולקולות והן בעלות תכונות שונות לגמרי, הן פיזיקליות והן כימיות.
2. סטריאואיזומרים (Stereoisomers)
סטריאואיזומרים הם חומרים שהמתמירים או האטומים מחוברים באותה דרך. החיבור והקשר בין האטומים הוא אותו קשר.
סטריאואיזומרים נחלקים לשני סוגים עיקריים:
א. סטריאואיזומרים קונפורמציוניים
סטריאואיזומרים קונפורמציוניים הם חומרים שהמבנה שלהם לא בדיוק אותו דבר. האטומים מחוברים באותו אופן, אבל המבנה המרחבי שלהם שונה. ניתן לעבור ממבנה אחד למבנה שני בלי לשבור אף קשר.
דוגמה קלאסית היא כיסא וסירה בציקלוהקסאן. הם בעלי יציבות שונה - כיסא יותר יציב, אך המעבר ביניהם אינו כרוך בשבירת קשר.
ב. סטריאואיזומרים קונפיגורציוניים
הדוגמה הבולטת היא ציס וטראנס. במקרה זה המעבר בין האיזומרים דורש שבירת קשר. כדי לעבור ביניהם נדרשת רוטציה סביב הקשר הכפול, אבל לא ניתן לבצע רוטציה כזו בלי לשבור קשר.
כללים לסיבוב סביב קשרים
-
קשר יחיד: יש סיבוב חופשי
-
קשר כפול: אין סיבוב חופשי
חריג: במולקולות ציקליות אין סיבוב חופשי גם סביב קשר יחיד. במולקולות ציקליות יש אילוץ על המולקולה ולכן אין סיבוב חופשי סביב קשר יחיד, אך זה המקרה היחיד.
כיראליות
הגדרת כיראליות
כיראליות מתייחסת למולקולות שאינן זהות לתמונת המראה שלהן, כמו ידיים ימין ושמאל. כמעט תמיד כשמדברים על כיראליות מדברים על פחמן, ובפרט על פחמן שיש לו ארבעה מתמירים שונים.
מרכז כיראלי (פחמן אסימטרי)
פחמן כיראלי (פחמן אסימטרי) הוא פחמן המחובר לארבעה מתמירים שונים. לדוגמה, אם יש פחמן עם שני מימנים, אין לו ארבעה מתמירים שונים ולכן הוא לא יהיה כיראלי. אם יש פחמן עם CH₃, ברום, יוד ו-CH₂CH₃, יש לו ארבעה מתמירים שונים ולכן הוא יהיה כיראלי.
פחמן כיראלי מסומן בכוכבית - זה הסימן המוסכם לסמן פחמן כיראלי.
אננטיומרים
אננטיומרים הם סטריאואיזומרים שהם תמונות מראה זה של זה. הם בעלי אותו מבנה כימי אך תכונות פיזיקליות שונות, במיוחד בשבירת אור. יש מכשיר מיוחד, היום מתוחכם מאוד, שמאפשר להבחין ביניהם לפי האופן שבו הם שוברים אור - ימינה או שמאלה.
חשיבות ההבדל בין אננטיומרים: החומרים האלה שונים ברמה הפיזיקלית, הם שוברים אור בדרך שונה. דוגמה מוכרת היא התרופה תלידומיד - שני האננטיומרים הם תמונות מראה זה של זה, בעלי אותו הרכב מולקולרי, אך הם מגיבים שונה ופועלים שונה בגוף.
דוגמה ביולוגית משמעותית: תלידומיד
תלידומיד היא דוגמה קלאסית לחשיבות הכיראליות בתרופות. התרופה פותחה בשנות הארבעים של המאה ה-20 (סביב 1928) ושווקה בסביבות 1935-1940. היא יועדה לטיפול בבחילות, בעיקר לנשים בהיריון. לתרופה זו יש פחמן כיראלי.
התוצאות הטרגיות של אי-הבחנה בין אננטיומרים: רבות מהנשים בהיריון שנטלו את התרופה נגד בחילות והקאות ילדו תינוקות עם פגמים בגפיים, בידיים וברגליים. עשרות אלפי תינוקות נולדו עם מומים.
ההבנה המאוחרת: מבין שני האננטיומרים של המולקולה, שאינם זהים אלא תמונות מראה זה של זה, אחד אכן פעל כתרופה אפקטיבית, ואילו האחר גרם לנזקים.
תרומת המקרה לבטיחות תרופות: מאז המקרה הזה, שמשמש כמקרה לימוד (case study), הבדיקות הבטיחותיות (Safety) של תרופות הפכו להיות הרבה יותר מחמירות.
מקרים מיוחדים של כיראליות
מזו (Meso) תרכובות
מולקולות עם פחמנים כיראליים שאינן כיראליות בגלל מישור סימטריה. במקרה של מזו, הפחמן כיראלי אך המולקולה כולה אינה כיראלית בגלל מישור שיקוף. זהו מקרה חריג ויוצא דופן.
מולקולות כיראליות ללא פחמן אסימטרי
ישנם מקרים בהם מולקולות כיראליות למרות שאין בהן פחמן עם ארבעה מתמירים שונים. באופן כללי, למדנו שבשביל שפחמן יהיה אסימטרי או כיראלי, נדרשים ארבעה מתמירים שונים. אולם, יש מקרים שבהם אין ארבעה מתמירים שונים, אך המולקולה עדיין כיראלית.
הסיבה לכיראליות במקרה זה היא שהקשר הכפול האחד נמצא במישור הלוח, והקשר הכפול השני נמצא בזווית של תשעים מעלות בגלל דחיית אלקטרונים. כתוצאה מכך, המימנים בחלק אחד של המולקולה אינם זהים למימנים בחלק אחר של המולקולה, כי הם נמצאים במקום אחר במרחב בגלל הזווית של תשעים מעלות.
קביעת קונפיגורציה R/S
שיטת קביעת קונפיגורציה R/S
לקביעת הקונפיגורציה של פחמן כיראלי, משתמשים בשיטה המבוססת על דירוג המתמירים:
שלב 1: קביעת סדר עדיפויות למתמירים
מדרגים את המתמירים לפי המספר האטומי. לדוגמה: ברום יהיה 1, מתיל יהיה 2, מתיל נוסף יהיה 3 ומימן יהיה 4.
שלב 2: בחינת כיוון הסיבוב
-
מתבוננים בכיוון הסיבוב מהעדיפות הגבוהה (1) לבינונית (2) לנמוכה (3). מציירים חץ שמורה על כיוון ההליכה מעדיפות גבוהה לנמוכה. העדיפות הנמוכה ביותר (4) אינה רלוונטית לקביעה, תמיד הולכים מ-1 עד 3.
-
קביעת הכיוון: אם הולכים עם כיוון השעון, מסמנים R. אם הולכים נגד כיוון השעון, מסמנים S.
-
מתן שם R או S: R ו-S מציינים אם המתמירים סביב הפחמן הכיראלי מסודרים עם כיוון השעון או נגד כיוון השעון.
חשיבות הקביעה: R ו-S הם סימנים מוסכמים שמאפשרים לדבר באותה שפה. הם מציינים שלחומר יש תכונות מסוימות, תכונות פיזיקליות שגורמות לו לשבור אור בצורה אחרת ותכונות ביולוגיות שונות, כפי שראינו בדוגמת התרופה.
טכניקת הציור בדו-ממד
כדי לפשט את תהליך הציור בדו-ממד, משתמשים בטכניקה שמטרתה להציב את המתמיר בעדיפות הנמוכה ביותר מאחור. כדי להקל על המעבר לדו-ממד, רצוי שהיסוד בעדיפות הנמוכה ביותר יהיה בעמדה האחורית, כלומר “ייכנס” לתוך הלוח.
אם המתמיר אינו בעמדה זו, מחליפים בין מתמיר 3 למתמיר 4.
חשוב לזכור: כאשר עושים החלפה, יש להפוך את התוצאה שהתקבלה. ההחלפה משנה את המבנה של המולקולה, ולכן אחרי קביעת הקונפיגורציה יש להפוך את התוצאה (מ-R ל-S או להיפך).
שיטות הייצוג המרחבי של מולקולות
ייצוג מרחבי של פחמן טטראדרי
כאשר מציירים פחמן טטראדרי, משתמשים במוסכמות הבאות:
כשמסתכלים על מולקולה של פחמן שיש לו ארבעה מתמירים, המבנה יהיה טטראדר. בטטראדר, שני מתמירים יהיו במישור הלוח, אחד ייכנס למישור הלוח ואחד ייצא ממישור הלוח.
המוסכמות לייצוג:
-
קווים ישרים - מתמירים במישור הלוח/הדף המתמירים במישור הלוח מיוצגים על ידי קו רגיל, קו ישר.
-
קו מקווקו - מתמיר נכנס אל תוך הלוח/הדף המתמיר שנכנס לתוך הלוח מסומן בקו מקווקו.
-
משולש מלא/טריז - מתמיר יוצא מהלוח/הדף המתמיר שיוצא מתוך הלוח מסומן במשולש מלא.
אלו סימנים מוסכמים שצריך להכיר ללא הסבר כימי עמוק. במבנה טטראדרי טיפוסי, שני מתמירים נמצאים במישור הדף, מתמיר אחד נכנס לתוך הדף, ומתמיר אחד יוצא מהדף.
דור פסקל