כל התכנים בעמוד אחד
כל סיכומי השיעורים בווירולוגיה זמינים כאן להדפסה מרוכזת או ייצוא כ-PDF (התוכן בקובץ מעודכן ליום 16 בפברואר 2026 - ייתכן שתכני האתר יהיו עדכניים יותר).
התוכן מוצג בסדר כרונולוגי - מהסיכומים המוקדמים ביותר למאוחרים ביותר. למידה מהנה!
תוכן העניינים
- שיעור 1 וירולוגיה - מבוא לוירולוגיה 23/10/2025
- שיעור 2 וירולוגיה - מחזור החיים של וירוסים 30/10/2025
- שיעור 3 וירולוגיה - מבנה וסימטריה של וירוסים 06/11/2025
- שיעור 4 וירולוגיה - מחזור החיים של וירוסים 17/11/2025
- וירולוגיה 5 - רטרו-וירוסים, HIV, ו-HBV 20/11/2025
- וירולוגיה 6 - נגיפי RNA, רפליקציה, בקרת תרגום, הרכבה ויציאה 27/11/2025
- וירולוגיה 7 - מה וירוסים עושים לתא ומה התא עושה בחזרה 07/12/2025
- שיעור 8 - וירולוגיה: עקרונות בתכנון תרופות 11/12/2025
שיעור 1 וירולוגיה - מבוא לוירולוגיה
תאריך: 23/10/2025תוכן עניינים:
- האם וירוס הוא יצור חי?
- היסטוריה של חקר הנגיפים
- מבנה הנגיף
- מחזור חיים של וירוס - דוגמה: SV40
- תכונות משותפות לכל הווירוסים
- סיווג בולטימור (Baltimore Classification)
- DNA לעומת RNA - יציבות והשלכות
- אבולוציה ויראלית
- חיטוי והשמדת וירוסים
- Virion לעומת Virus - ההבדל המהותי
- סיווג וירוסים - קריטריונים
- מגיפות עכשוויות - דוגמת Oropouche Virus
- וירוסים לא תמיד רעים
- שאלות לבדיקה עצמית
האם וירוס הוא יצור חי?
השאלה הזו פותחת את הקורס ומלווה אותו לכל אורכו. התשובה הקצרה היא לא - יצור חי מוגדר ככזה שיש לו מטבוליזם ויכולת התרבות עצמאית, ווירוס אינו עומד בלפחות אחד מהקריטריונים הללו. בשיעור הזה נראה מדוע, ולמרות זאת - מדוע וירוסים הם בין היצירות הביולוגיות המורכבות והמרתקות ביותר בטבע.
משאבים נוספים ללימוד עצמי
This Week in Virology (TWiV) - פודקאסט ובלוג עם ראיונות שבועיים עם וירולוגים על מחקרים חדשים, כולל פודקאסט רפואי על מגיפות.
Virology Blog - חדשות עדכניות בתחום הווירולוגיה.
אתר פרופ’ ג’וני דירשוני - מאגר וירולוגים בישראל; ניתן לחפש לפי אוניברסיטה או לפי וירוס.
היסטוריה של חקר הנגיפים
עדויות עתיקות ומחלות היסטוריות
Smallpox - אבעבועות שחורות
עדויות ל-Smallpox קיימות כבר מלפני 3,500 שנה. מדובר במחלה שבה הווירוס מתרבה בגוף ללא סימנים חיצוניים בימים הראשונים, ואז מופיעות שלפוחיות על העור שבסופו של דבר מתייבשות ונופלות - ומשאירות צלקות, ולעיתים אף גורמות לעיוורון. הנתון המזעזע: 30% מהנדבקים מתו, ובמאה ה-20 לבדה כ-300 מיליון איש נפטרו מהמחלה.
🟢 Variolation - החיסון המוקדם (סין, המאה ה-11). השיטה הייתה פשוטה ומסוכנת בו-זמנית: לקחו חומר משלפוחיות של חולה, שרטו את העור של אדם בריא, והקווה הייתה שההדבקה המקומית דרך העור לא תגרום למחלה מערכתית מלאה. התוצאות: 90% קיבלו חסינות, אך 10% חלו - ומתוכם 30% מתו. כלומר התמותה הכוללת ירדה מ-30% ל-3%. לא אידיאלי, אבל הרבה יותר טוב ממה שהיה.
לידי מרי וורטלי מונטגו, אשת השגריר הבריטי במזרח, נחשפה לשיטה הזו והביאה אותה לאירופה.
🟢 Edward Jenner והמצאת החיסון (1796). ג’נר שם לב שכפריים שעובדים עם פרות לא חלו ב-Smallpox. לפרות הייתה מחלה דומה עם שלפוחיות על העור (Cowpox), והרעיון היה שהכפריים נדבקו מהפרות וקיבלו חיסון טבעי. ג’נר לקח את הווירוס מהפרות, שרט את העור של אנשים, והכניס להם את הווירוס - וזה עבד. זה היה החיסון הראשון בהיסטוריה. Smallpox נשאר הווירוס היחיד עד היום שהוצא מהעולם לחלוטין: ב-1980 ארגון הבריאות העולמי הכריז על חיסולו. לצערנו, עם וירוסים אחרים לא הצלחנו להשיג תוצאה דומה.
Rabies - כלבת
מחלה ידועה כבר 4,000 שנה מכתבים עתיקים, וחשובה לרפואה עד היום. הווירוס מגיע דרך נשיכה, נכנס לגוף, ומתחיל להתקדם לכיוון המוח - מבלי להתרבות בדרך. ברגע שהגיע למוח מופיעות תופעות קליניות, אבל מאותו רגע אין דרך חזרה - גם היום, ב-2025, הגעת הווירוס למוח היא פסק דין.
המטרה היא מניעה. לואי פסטור פיתח חיסון פסיבי: הזריק את הווירוס לארנבות, אסף מהדם שלהן נוגדנים, ומי שנישך קיבל הזרקת נוגדנים. היעילות גבוהה מאוד - בתנאי שהטיפול ניתן לפני שהווירוס הגיע למוח.
פריצות דרך מדעיות
הפילטר של Chamberland (1884) - פילטר עם נקבים כל-כך קטנים שחיידקים לא עוברים. זה אפשר לראשונה לסנן נוזלים ולקבל תמיסה נקייה מחיידקים.
Tobacco Mosaic Virus - TMV (1892) - אדולף מאייר ודמיטרי איבנובסקי הבחינו בכתמים על עלי טבק. הם טחנו עלים נגועים, העבירו את התמיסה דרך פילטר שחיידקים לא עוברים, והדביקו צמח בריא - והכתמים עברו. המסקנה: הגורם למחלה קטן מחיידק. קראו לו “וירוס”, שפירושו “רעל” בלטינית.
Polio וריאת הברזל - בשנות ה-50 מגיפות פוליו פקדו שכונות בקיץ. ילדים שנדבקו איבדו פתאום את יכולת ההליכה. ריאת הברזל הייתה מכשיר שהפעיל את בית החזה מבחוץ, כי שרירי הנשימה לא תפקדו. הפריצה הגיעה ממיפוי: כל השכונות הנגועות קיבלו מים מאותו מקור - והמים היו מזוהמים בווירוס.
המיקרוסקופ האלקטרוני - וירוסים קטנים מאורך הגל של אור נראה, ולכן אי-אפשר לראותם במיקרוסקופ אור רגיל. רק עם המצאת המיקרוסקופ האלקטרוני ניתן היה לראות וירוסים לראשונה.
מבנה הנגיף
זיהוי החומר הגנטי
ניסוי מכונן בווירולוגיה: פירקו את TMV לשני מרכיביו - חלבונים וחומצת גרעין. כשהדביקו עלים רק בחלבונים, לא הייתה הדבקה; כשהדביקו רק בחומצת גרעין - כן הייתה הדבקה. השלב הבא: טיפול באנזים RNase (שמפרק RNA) ביטל את ההדבקה, בעוד DNase (שמפרק DNA) לא השפיע. המסקנה: החומר הגנטי של TMV הוא RNA - שלא כמו בכל היצורים החיים שבהם החומר הגנטי הוא DNA.
ניסוי ה-Reconstitution חיזק את הממצא: לקחו שני זני TMV עם פאטרן כתמים שונה (A ו-B), פירקו כל אחד, והרכיבו וירוס היברידי מחלבון A ו-RNA של B. כשהדביקו עלים - הפאטרן היה של B. כלומר ה-RNA הוא שקובע את התכונות.
רכיבי הנגיף
Capsid (קפסיד) - קופסה חלבונית סימטרית שעוטפת את הגנום. מורכבת מיחידות חוזרות של חלבון אחד או מספר חלבונים. האינטראקציות בין היחידות הן לא-קוולנטיות - כדי שהווירוס יוכל גם להיסגר ולהגן על הגנום, וגם להיפתח כשמגיע לתא חדש. כשהקפסיד מכיל בתוכו חומצת גרעין, הוא נקרא Nucleocapsid.
Envelope (מעטפת) - שכבת שומנים שמקיפה את הקפסיד. הנקודה המרכזית: הווירוס לא מייצר מעטפת - הוא “גונב” אותה מממברנת התא המודבק. אבל בתוך אותה מעטפת שזורים חלבונים ויראליים (כמו חלבון ה-Spike של הקורונה), שהם אלו שמערכת החיסון “רואה”. לא לכל הווירוסים יש מעטפת - יש כאלה שמסתדרים בלעדיה.
שכבת ביניים - בחלק מהווירוסים יש שכבה בין הקפסיד למעטפת: אם היא מסודרת היא נקראת Matrix, ואם היא אמורפית - Tegument.
דוגמאות למבנים
הוירוסים מגוונים מאוד במבנה: Bacteriophage הוא וירוס מורכב עם ראש, זנב ורגליים שמדביק רק חיידקים; TMV הוא בצורת מקל מוארך; HIV הוא כדורי עם קפסיד בצורת קונוס עטוף במעטפת; ו-Herpesvirus הוא וירוס גדול עם מעטפת, טגומנט וקפסיד.
גודל
רוב הווירוסים נעים בין 20 ל-300 ננומטר - קטנים בהרבה מחיידקים (שהם בסדר גודל של מיקרון). אבל קיימים Giant Viruses שמדביקים אמבות: ה-Mimivirus, למשל, גדול כמו חיידק, גנום שלו (2.5 מיליון זוגות בסיסים) גדול יותר מגנום של חיידקים רבים, והוא מקודד לכ-2,500 חלבונים. אפשר אפילו לראות אותו במיקרוסקופ אור רגיל.
יחס זיהומיות
לא כל הווירונים שנוצרים הם בעלי יכולת הדבקה. בשפעת, למשל, רק כ-10% מהווירונים אינפקטיביים; בהרפס - רק אחד מכל אלף. הווירוס מפצה על כך בייצור כמויות עצומות - מעין “הפצצה” בווירונים שמבטיחה שמספיק מהם יצליחו.
מחזור חיים של וירוס - דוגמה: SV40
הדוגמה של SV40 ממחישה עיקרון מרכזי: הווירוס לא מביא כלום חדש - הוא מגייס מערכות קיימות.
התהליך: DNA הוירוסי נכנס לגרעין התא → התא אורז אותו בנוקלאוזומים (בדיוק כמו DNA תאי) → RNA polymerase תאי מבצע טרנסקריפציה → ה-RNA יוצא לציטופלזמה ומתורגם לחלבון ויראלי ← אותו חלבון חוזר לגרעין ← משנה את מערכת הטרנסקריפציה כך שתייצר חלבונים ויראליים נוספים ותשכפל את הגנום ← הקפסידים נבנים, הגנום נארז, ויריונים חדשים משתחררים.
הנקודה: הווירוס מגייס את מערכת הטרנסקריפציה ואת מערכת הרפליקציה של התא - גם לביטוי הגנים שלו וגם להכפלת הגנום.
תכונות משותפות לכל הווירוסים
טפילות מוחלטת (Obligate parasites) - הווירוס תלוי לחלוטין בתא כדי להתרבות. ללא תא מאכסן, הוא חלקיק אינרטי.
גודל קטן ומידע גנטי מצומצם - לבן אדם יש 21,000 גנים ו-3 מיליארד בסיסים; לווירוס רגיל יש 2–200 גנים ו-2,000–300,000 בסיסים. למרות הגודל הזעיר, מספיק לו 2,000 בסיסים כדי לייצר וירוס מתרבה.
גנום RNA או DNA - לא שניהם - שלא כמו כל היצורים החיים שהחומר הגנטי שלהם הוא תמיד DNA.
מבנה פשוט אך ביולוגיה מורכבת - למרות שהמבנה הפיזי פשוט יחסית (מעטפת, קפסיד, חומצת גרעין), הווירוסים מפגינים מורכבות עצומה ביכולתם לשחק עם מערכות תאיות ולגייס אותן לצרכיהם. כל הזמן מגלים שכבות חדשות של מורכבות.
שלושה דברים שווירוסים לא מייצרים
| לא מייצרים | הסבר |
|---|---|
| אנרגיה (ATP) | תלויים לחלוטין בהפקת אנרגיה של התא |
| ריבוזומים | משתמשים בריבוזומים התאיים לתרגום. אפילו Giant Viruses שמייצרים tRNA ספציפיים - לא מייצרים ריבוזומים שלמים |
| ממברנה | חלבונים ויראליים יכולים להשתלב בממברנה, אבל התא מייצר את הממברנה עצמה |
סיווג בולטימור (Baltimore Classification)
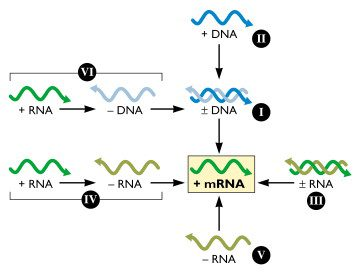
התמונה מתוך virology.ws
הסיווג מבוסס על עיקרון אחד: כל וירוס חייב לייצר mRNA כדי שהריבוזומים יתרגמו אותו לחלבונים. השאלה היא: איך כל סוג של גנום מגיע ל-mRNA?
תזכורת:
RNA+(פלוס) = mRNA = קריא ישירות על-ידי ריבוזומים.RNA-(מינוס) = הגדיל המשלים, לא קריא ישירות.
Class I - dsDNA → mRNA
מערכת הטרנסקריפציה התאית יודעת לעבוד עם dsDNA, אז אין בעיה. דוגמאות: Herpesvirus, Adenovirus.
Class II - ssDNA → dsDNA → mRNA
קודם התא משלים את הגדיל החסר ליצירת dsDNA, ואז מתבצעת טרנסקריפציה רגילה. דוגמאות: Parvovirus.
Class III - dsRNA → (+)RNA
הריבוזום לא יודע לתרגם dsRNA - צריך ליצור (+)RNA מתבנית ה-(-)RNA.
דוגמאות: Reovirus.
Class IV - (+)ssRNA
ה-RNA+ יכול לשמש ישירות כ-mRNA, אבל הכמות לא מספיקה. לכן הווירוס מייצר (-)RNA כתבנית, וממנו מייצר כמויות גדולות של (+)RNA.
דוגמאות: Poliovirus, Coronavirus.
Class V - (-)ssRNA → (+)RNA
ה-RNA- אינו קריא; צריך ליצור ממנו (+)RNA שישמש כ-mRNA.
דוגמאות: Influenza, Measles.
Class VI - Retroviruses: (+)RNA → DNA → mRNA
שלושה שלבים:
- RNA הופך ל-ssDNA (Reverse transcription),
- ssDNA הופך ל-dsDNA,
- ומ-dsDNA מתבצעת טרנסקריפציה רגילה ליצירת mRNA.
ה-mRNA שנוצר הוא (+)RNA - כי מערכת הטרנסקריפציה התאית היא שמייצרת אותו. דוגמאות: HIV.
Class VII - Partially dsDNA → dsDNA → mRNA
הגנום הוא dsDNA חלקי. מערכת התיקון התאית משלימה אותו ל-dsDNA מלא, ואז אפשר לבצע טרנסקריפציה. דוגמאות: Hepatitis B.
DNA לעומת RNA - יציבות והשלכות
DNA יציב יותר מ-RNA, ו-dsDNA יציב יותר מ-ssDNA. לכן גנומים של RNA מוגבלים בגודל (עד כ-40,000 בסיסים), בעוד וירוסי dsDNA יכולים להיות הרבה יותר גדולים (כמו Herpesvirus ו-Poxvirus).
בחיידקים רוב הווירוסים הם בעלי גנום DNA; בצמחים הרבה מאוד וירוסים הם בעלי גנום RNA.
אבולוציה ויראלית
וירוסים כמכונות דרוויניסטיות
אורגניזמים צריכים דורות רבים כדי לעבור שינויים משמעותיים, אבל מחזור החיים של וירוס נמשך ימים בודדים - ולכן קצב האבולוציה שלו מהיר עד להפתעה.
יתרה מכך, בוירוסי RNA אין מנגנון תיקון (proofreading). הפולימרז מכניס מוטציות בכוונה - וזה יתרון, לא חיסרון. כל מחזור שכפול מייצר גיוון גנטי שמאפשר לווירוס לחמוק ממערכת החיסון.
דוגמה קלאסית - שפעת: אנחנו מייצרים נוגדנים נגד חלבוני מעטפת השפעת, אבל הם משתנים כל הזמן. לכן אנחנו נדבקים שוב ושוב, ולכן צריך חיסון שפעת חדש כל שנה.
מעבר למאכסן חדש - דוגמת COVID-19
כשווירוס עובר למאכסן חדש (Zoonosis), קורים שני דברים מקבילים:
בהתחלה - הווירוס לא מותאם למאכסן החדש. הוא לא עובר ביעילות בין בני אדם, אבל הוא גורם למחלה קשה מאוד. במקרה של SARS-CoV-2, הווירוס גרם לחיבור (fusion) של תאי ריאה אחד לשני, יצירת בצקת, וחנק.
עם הזמן - הלחץ האבולוציוני פועל: וירוס שהורג את המאכסן מהר לא מספיק להתפשט; וירוס שגורם למחלה קלה מאפשר למאכסן להמשיך לתפקד ולהדביק אחרים. לכן האבולוציה מובילה לווירוס שעובר טוב יותר בין אנשים אבל גורם למחלה קלה יותר. COVID-19 של היום כמעט לא דומה לזה של ההתחלה - הוא עבר מוטציה בחלבון ממברנה שביטלה את יכולת ה-Fusion.
💡 העיקרון: המטרה של הווירוס היא לעבור ממאכסן למאכסן - לא להרוג. מוות של המאכסן הוא תוצאת לוואי, לא מטרה.
למה בכל זאת קיימים וירוסים קטלניים?
אם האבולוציה מובילה לוירוס “עדין” יותר, למה יש וירוסים שהורגים?
- מעבר טרי בין מאכסנים - בשלבים הראשונים, לפני שהתרחשה התאמה.
- דרך הדבקה שלא תלויה בחיי המאכסן - כלבת עוברת דרך נשיכה: אפילו אם החולה מת, הווירוס כבר הדביק. באותו אופן, וירוסים שעוברים דרך יתושים (Vector) לא תלויים בחיי החולה.
- אנשים מדוכאי חיסון - אצלם הווירוס שוהה חודשים, מתרבה כל הזמן, וצובר מוטציות. כך נוצרים ווריאנטים חדשים - וזה בדיוק מה שקרה עם הווריאנטים החדשים של COVID-19.
חיטוי והשמדת וירוסים
כדי להבין חיטוי, צריך לזכור את שלושת המרכיבים של הווירוס: מעטפת שומנית, קפסיד חלבוני, וחומצת גרעין.
-
סבון פועל על שומנים - ולכן יעיל נגד וירוסים עם מעטפת. הוא פשוט מפרק את המעטפת השומנית.
-
אלכוהול (70%) משפיע גם על המעטפת וגם על מבנה החלבונים (דנטורציה), ולכן יעיל גם נגד וירוסים ללא מעטפת - כי הוא פוגע בקפסיד.
-
אקונומיקה (0.1%) ו-מי חמצן - שניהם מחמצנים חזקים שפוגעים גם בחלבונים וגם בחומצת גרעין. אבל הם דורשים לפחות 10 דקות של מגע עם המשטח כדי להשפיע. חשוב: לשימוש על משטחים בלבד - לא לשתייה.
Virion לעומת Virus - ההבדל המהותי
ההבחנה הזו חשובה מאוד:
- Virion הוא חלקיק הווירוס מחוץ לתא - אינרטי לחלוטין, לא עושה דבר, “מולקולה ביולוגית” סבילה.
- Virus הוא מה שקורה בתוך תא מודבק - המערכת הפעילה שמשתלטת על התא ומייצרת עותקים חדשים.
סיווג וירוסים - קריטריונים
-
לפי מאכסן: וירוסי חיידקים (Bacteriophages), וירוסים של צמחים, בעלי חיים, פטריות ואורגניזמים חד-תאיים.
העיקרון: אין יצור חי על פני כדור הארץ שאין לו וירוס שיכול להדביק אותו. ובמקביל, וירוסים הם ספציפיים מאוד - פאג’ שמדביק חיידקים לא ידביק בן אדם.
קריטריונים נוספים: סוג הגנום (DNA/RNA, חד/דו-גדילי), סימטריה של הקפסיד (Icosahedral או Helical), נוכחות מעטפת, גודל, טווח מאכסנים, ופתוגנזה.
מגיפות עכשוויות - דוגמת Oropouche Virus
מאמר ב-Science (2024) תיאר התפרצות של וירוס Oropouche בברזיל. שני וירוסים שונים, שלא גרמו למחלה בבני אדם, הדביקו את אותו מאכסן. הגנום שלהם מורכב משלושה סגמנטים, והסגמנטים התערבבו - ונוצר וירוס חדש שגורם למחלה בבני אדם.
התסמינים (חום, כאבי ראש, כאבי פרקים) דומים למחלות רבות - כי מדובר בתגובה כללית של הגוף. במקרים חמורים: דלקת מוח, נזק נוירולוגי, מוות. נשים בהריון שנדבקו ילדו תינוקות עם מיקרוצפליה (מוח קטן מהרגיל). הריסוס שנעשה בשטח מכוון נגד היתוש (ה-Vector) ולא נגד הווירוס עצמו.
וירוסים לא תמיד רעים
פאג’ תרפיה - וירוסים נגד חיידקים
אנטיביוטיקה הורגת חיידקים באופן רחב, כולל את הפלורה המועילה. Bacteriophages, לעומת זאת, ספציפיים - אפשר לתכנן פאג’ שיהרוג רק סוג חיידק מסוים.
וירוסים באוקיאנוסים - מנוע אקולוגי
המספרים מרשימים: כפית מי ים מכילה כ-5 מיליון חיידקים, וליטר מי ים מכיל יותר וירוסים מכל בני האדם על פני כדור הארץ. 94% מכל החלקיקים באוקיאנוסים הם וירוסים - כ-$10^{30}$ בסך הכול. כל יום כ-20% מחיידקי האוקיאנוס מתים על-ידי וירוסים, מתפרקים לחומרי הזנה, ומאפשרים גדילה מחדש - מחזור חיים קריטי לאקו-מערכת הימית.
הגנה צולבת - ניסוי בעכברים
עכברים שהודבקו ב-Herpesvirus שרדו בשיעור גבוה בהרבה כשנחשפו בהמשך לחיידקים קטלניים או לשפעת H1N1 - לעומת עכברים שלא נשאו Herpesvirus. ההסבר: הווירוס מעלה את מוכנות המערכת החיסונית באופן כללי (לא ספציפי). אולי ההדבקה הכרונית בהרפס שרוב האנשים נושאים נותנת לנו רמה מסוימת של הגנה.
סימביוזה - צרעה, זחל, ווירוס
דוגמה יפה לקשר בין וירוס ליצור חי: צרעות מטילות ביצים בתוך זחלים, אבל מערכת החיסון של הזחל תוקפת את הביצים. הפתרון: הצרעה מזריקה ביחד עם הביצים וירוס שמשתק את מערכת החיסון של הזחל. הווירוס הזה הוא חלק מהגנום של הצרעה - לא מתבטא בכלל בגוף הצרעה הבוגרת, אלא רק בזמן יצירת ביציות.
שאלות לבדיקה עצמית
- מדוע וירוס אינו נחשב ליצור חי?
- תאר את מחזור החיים של SV40 - אילו מערכות תאיות הוא מגייס?
- מה ההבדל בין RNA+ ל-RNA-? מדוע ההבחנה חשובה?
- מדוע אבולוציה ויראלית מובילה בדרך כלל למחלה קלה יותר? מתי זה לא נכון?
- תן שלוש דוגמאות לווירוסים שיכולים להיות מועילים.
- מדוע סבון יעיל נגד קורונה אבל פחות נגד Adenovirus?
- הסבר את סיווג בולטימור - מה השאלה המרכזית שהוא עונה עליה?
שיעור 2 וירולוגיה - מחזור החיים של וירוסים
תאריך: 30/10/2025מבוא
בשיעור זה נעסוק במחזור החיים של וירוסים, החל מהתהליך שבו הוירוס מדביק תא ועד לשחרור וירוסים חדשים. נדון במושגים חשובים כגון תאים רגישים ומתירניים, דרכי העברה שונות של וירוסים, מדדי הדבקה ($R$), ושיטות זיהוי מעבדתיות מתקדמות.
שלבי מחזור החיים של וירוסים
1. Attachment (היצמדות)
הוירוס צריך להגיע לתא המארח ולהיצמד לרצפטור ספציפי על פני התא. תהליך ההיצמדות הוא ספציפי ביותר – כל וירוס בחר בתהליך האבולוציה רצפטור מסוים.
2. Penetration (חדירה)
לאחר ההיצמדות, הוירוס חודר לתוך התא. תהליך זה יכול להתבצע בדרכים שונות:
- Fusion – התמזגות עם ממברנת התא
- Endocytosis – בליעה לתוך וזיקולה תאית
3. Uncoating (חשיפת החומר הגנטי)
הקפסיד (Capsid) נפתח ומשחרר את החומר הגנטי ($\ce{DNA}$ או $\ce{RNA}$) לתוך התא. תהליך זה מתרחש לרוב בעקבות שינוי ב-pH או פעולת אנזימים תאיים.
4. Expression (ביטוי גנים)
החומר הגנטי הוויראלי מתורגם לחלבונים על ידי מנגנוני התא המארח.
5. Replication (הכפלת הגנום)
הגנום הוויראלי מוכפל באמצעות אנזימים וויראליים ו/או תאיים. תהליך זה תלוי בסוג החומר הגנטי של הוירוס.
6. Assembly (הרכבה)
חלבונים וויראליים וגנומים חדשים מתאספים ליצירת וירוסים שלמים (virions).
7. Maturation (הבשלה)
הווירוסים עוברים שינויים סופיים הנחוצים לתפקודם.
8. Release (שחרור)
הווירוסים החדשים משתחררים מהתא באחת משתי דרכים:
- Lysis – פיצוץ התא
- Budding – שחרור הדרגתי דרך הממברנה
תאים רגישים ומתירניים
הגדרות
- תא רגיש (Susceptible) – תא שיש לו רצפטור שהוירוס יכול להיצמד אליו ולחדור דרכו.
- תא מתירני (Permissive) – תא שמאפשר את התרבות הווירוס בתוכו, כלומר יש בו את כל המנגנונים הנדרשים לשכפול הוויראלי.
דוגמאות
- HIV – מדביק תאי T (CD4+), אך אם מוכנס באופן מלאכותי לתאי עכבר, לא יתרבה שם (לא מתירני).
- Hepatitis B – מדביק רק תאי כבד (הפטוציטים), שהם גם רגישים וגם מתירניים לוירוס זה.
חשיבות: כדי שוירוס יתרבה בתא, התא חייב להיות גם רגיש וגם מתירני.
דרכי העברה של וירוסים
העברה אופקית (Horizontal Transmission)
מעבר של וירוס ממארח למארח באותה הדור:
- אוויר – טיפות רוק (Droplets), אירוסולים
- מגע ישיר – דם, רוק, יחסי מין
- וקטורים – יתושים, קרציות
העברה אנכית (Vertical Transmission)
מעבר מאם לעובר או לתינוק:
- דרך השליה (Transplacental)
- במהלך הלידה
- הנקה
זואונוזות (Zoonotic Diseases)
מחלות שמקורן בבעלי חיים:
- West Nile Virus – מציפורים דרך יתושים
- Rabies – מבעלי חיים נגועים
- Avian Flu (H5N1) – מעופות
- Ebola – מקופים
- SARS-CoV-2 – כנראה מעטלפים
וירמיה (Viremia)
הגדרה: מצב שבו וירוסים נמצאים בזרם הדם.
משמעות: וירמיה מאפשרת לוירוס להתפשט מאיבר ההדבקה הראשוני לאיברים נוספים בגוף, מה שעלול להוביל לסיבוכים מערכתיים.
Entry site is not necessarily the final target!
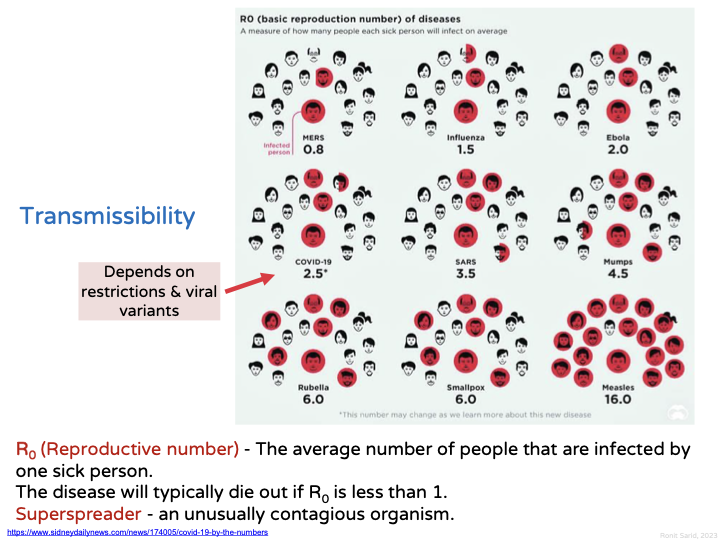
מדדי הדבקה – Reproductive Number ($R$)
הגדרה: מספר האנשים הממוצע שאדם חולה אחד מדביק.
דוגמאות
- $R < 1$ – המחלה אינה מתפשטת (דוגמה: MERS, $R \approx 0.7$)
- $R = 1$ – המחלה יציבה
- $R > 1$ – המחלה מתפשטת באוכלוסייה
- Ebola: $R \approx 2$
- SARS-CoV-2: $R \approx 2-3$ (משתנה לפי וריאנט)
- Measles (חצבת): $R \approx 16$ – אחת המחלות המדבקות ביותר!
חשיבות: ערך $R$ גבוה מחייב אחוזי חיסון גבוהים יותר להשגת חסינות עדר.
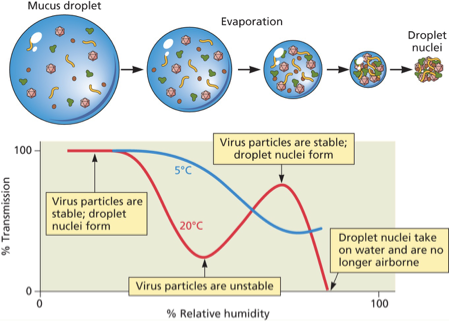
יציבות וירוסים מחוץ לגוף
גורמים המשפיעים על יציבות
- חום – טמפרטורות גבוהות מפרקות חלבונים וויראליים
- לחות – משפיעה על יציבות הקפסיד והממברנה
- קרינת UV – פוגעת בחומר הגנטי
- מעטפת – וירוסים ממוטפים (Enveloped) רגישים יותר לתנאי סביבה
דוגמאות
- HIV – בר-קיימא מספר שעות בלבד מחוץ לגוף
- Hepatitis B – יכול לשרוד שבועות על משטחים
- Norovirus – עמיד מאוד לתנאי סביבה
עקומת יציבות וטמפרטורה-לחות
- לחות נמוכה (<30%) – וירוסים יציבים בכל טמפרטורה
- לחות בינונית (50%) – יציבות גבוהה בטמפרטורות נמוכות (~5°C), יציבות נמוכה בחום (>20°C)
- לחות גבוהה (>80%) – וירוסים מתפרקים במהירות
משמעות קלינית: מרק חם בחורף יכול לעזור – החום והלחות מפחיתים את יציבות הוירוסים בדרכי הנשימה.
התפרצויות עונתיות (Seasonal Outbreaks)
גורמים
- תנאי אקלים – טמפרטורה ולחות מעדיפות
- התנהגות אנושית – שהייה במקומות סגורים בחורף
- מחזורי החיים של וקטורים – פעילות יתושים בקיץ
דוגמאות
- Influenza – פיק בחורף במדינות ממוזגות
- Poliovirus – דווקא בקיץ (תנאים חמים)
- West Nile Virus – קיץ (תלוי בפעילות יתושים)
שיטות זיהוי מעבדתיות
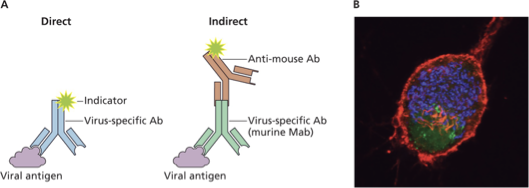
1. Immunofluorescence (אימונופלואורסצנציה)
Direct Method
- נוגדן ספציפי לאנטיגן וויראלי, מסומן בצבע פלואורסצנטי
- קושר ישירות לוירוס בדגימה
Indirect Method
- נוגדן ראשוני (לא מסומן) כנגד הוירוס
- נוגדן משני מסומן (למשל Anti-Mouse Antibody) כנגד הנוגדן הראשוני
- יתרון: חסכוני – נוגדן משני אחד לכל נוגדני העכבר
2. ELISA (Enzyme-Linked Immunosorbent Assay)
עיקרון
- נוגדן קשור למשטח
- הוספת דגימה (עם אנטיגן וויראלי)
- הוספת נוגדן שני מסומן באנזים
- הוספת סובסטרט שמייצר צבע
- מדידת עוצמת הצבע = כמות הוירוס
שימושים
- כימות וירוסים בדגימות
- בדיקות סרולוגיות (נוגדנים בדם)
3. Rapid Antigen Tests (בדיקות אנטיגן מהירות)
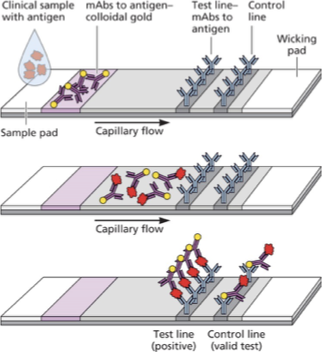
מבנה
- Control Line – נוגדן כנגד הנוגדן המסומן (תמיד חיובי אם הבדיקה תקינה)
- Test Line – נוגדן כנגד אנטיגן וויראלי ספציפי
תוצאות
- קו אחד (Control) – שלילי
- שני קווים (Control + Test) – חיובי
- אין קווים – הבדיקה פגומה
4. PCR (Polymerase Chain Reaction)
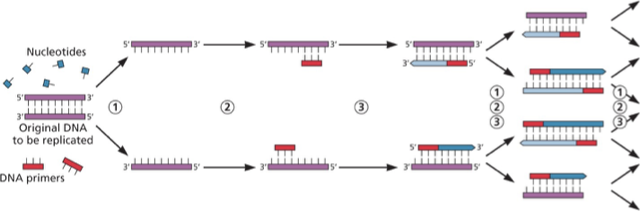
עיקרון בסיסי
PCR מאפשר הכפלה מעריכית של רצף $\ce{DNA}$ ספציפי.
שלבים
- Denaturation (95°C) – הפרדת גדילי $\ce{DNA}$
- Annealing (50-60°C) – היצמדות Primers
- Extension (72°C) – הארכת הגדיל על ידי DNA Polymerase
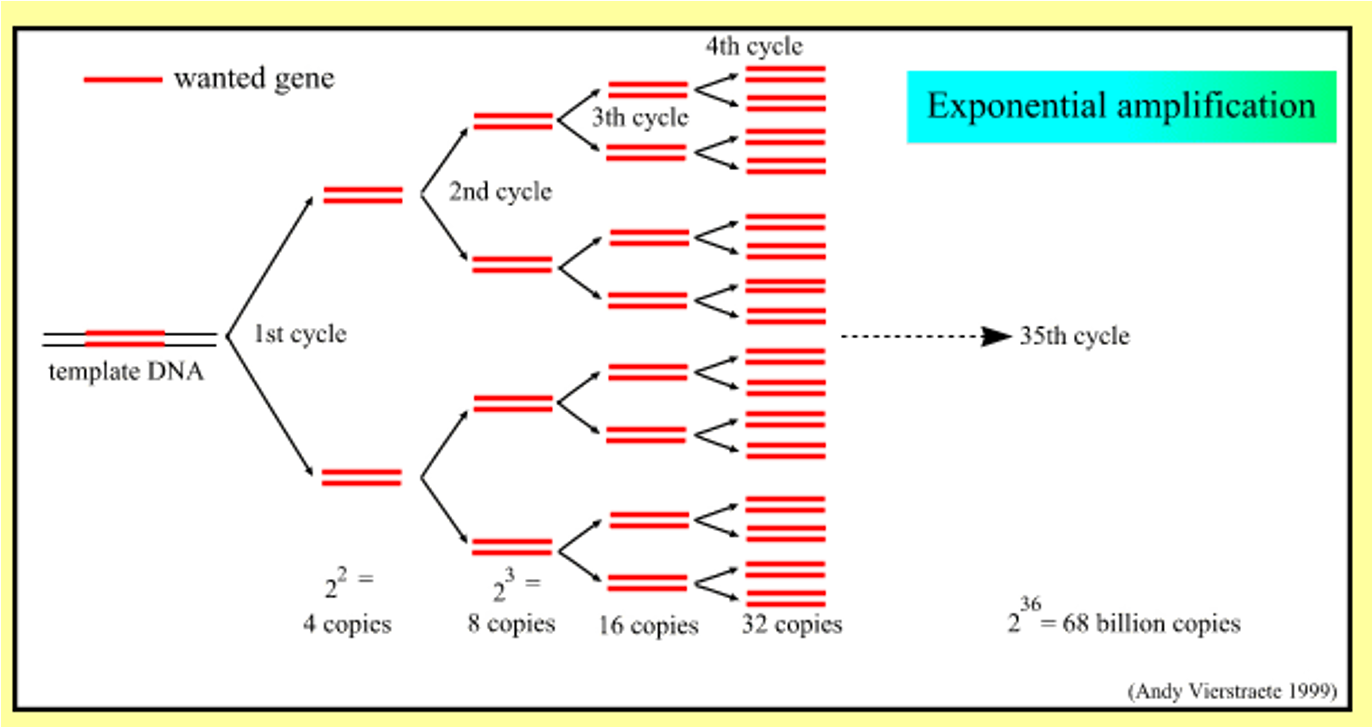
מחזור ההכפלה
- מחזור 1: 2 מולקולות
- מחזור 2: 4 מולקולות
- מחזור n: $2^n$ מולקולות
- 36 מחזורים: כ-68 מיליארד מולקולות
Taq Polymerase
- אנזים מחיידק Thermus aquaticus מעיינות רותחים
- עמיד לטמפרטורות גבוהות (עד 95°C)
- מאפשר ביצוע מחזורים חוזרים ללא הוספת אנזים חדש
5. RT-PCR (Reverse Transcription PCR)
שימוש
זיהוי וירוסי $\ce{RNA}$ (כמו SARS-CoV-2, Influenza)
שלבים
- Reverse Transcription – המרת $\ce{RNA}$ ל-$\ce{cDNA}$ באמצעות Reverse Transcriptase
- PCR רגיל על ה-$\ce{cDNA}$
דוגמה: אבחון COVID-19
- שני זוגות Primers לשני אזורים שונים בגנום
- שני פסים – חיובי
- פס אחד – אפשרי מוטציה באחד האזורים
- אפס פסים – שלילי
חשיבות: Primers הם רצפים ספציפיים לוירוס מסוים. PCR לגילוי קורונה לא יזהה וירוס שפעת!
שיטות תרבית וירוסים
1. תרבית תאים (Cell Culture)
- תאים בתרבית מדוגמה או שרה אחת של תאים
- מאפשרת מחקר ושכפול וירוסים במעבדה
2. ביצים מעוברות (Embryonated Eggs)
- הזרקת וירוס לאזורים שונים בביצה
- שימוש נפוץ בייצור חיסוני שפעת
- בעיה נוכחית (2023): מחסור בביצים בארה”ב בשל Avian Flu – הובילה לעלייה דרמטית במחיר (מדולר אחד, לשבע ולתריסר)
3. מודלים של בעלי חיים
- עכברים, אוגרים, פרימטים
- שימוש במחקר פתוגנזה וחיסונים
- דוגמה: עכברים מהונדסים עם רצפטור ACE2 אנושי למחקר COVID-19
מדידת כמות וירוסים – Plaque Assay
עיקרון
- שכבה של תאים (Monolayer)
- כיסוי בשכבת אגר חצי-מוצקה
- הדבקה בוירוס
- וירוס הורג תאים מקומיים ויוצר “חור” (Plaque)
חישוב
\[\text{Viral titer (PFU/ml)} = \frac{\text{Number of plaques} \times \text{Dilution factor}}{\text{Volume plated (ml)}}\]דוגמה
- דילול $10^{-7}$
- 10 Plaques
- נפח $0.1 \, \mathrm{ml}$
יתרון
מודד רק וירוסים אינפקטיביים – שונה מ-PCR (מודד גם $\ce{DNA}$ של וירוסים מתים) ו-ELISA (מודד גם קפסידים ריקים).
ייצור חיסונים מבוסס ביצים
תהליך
- בידוד זן שפעת מקומי
- שילוב (Reassortment) עם זן מעבדה שגדל היטב בביצים
- גנום שפעת מורכב מ-8 סגמנטים של $\ce{RNA}$
- הדבקת תא בשני זנים גורמת לערבוב סגמנטים
- הדבקת ביצים רבות בזן ההיברידי
- איסוף ווירוסים
- Inactivation (השבתה)
- ניקוי וביקורת איכות
- אריזה להזרקה

Reassortment בשפעת
- 8 סגמנטים של $\ce{RNA}$ בגנום
- מאפשר שילוב מהיר של חומר גנטי בין זנים
- סיבה מרכזית לשונות הגבוהה והצורך בחיסון שנתי
תופעות מיוחדות בדינמיקה של וירוסים
Eclipse Phase
- תקופה שבה אין וירוסים זמינים מחוץ לתא
- הוירוס נמצא בתהליך שכפול בתוך התא
- משך: שעות עד ימים (תלוי בוירוס)
Burst vs. Budding Release
- Burst (Multiple Cycle): נפיחת תא משחררת וירוסים חדשים פתאום ← פיק שני אם לא כל התאים נדבקו בפעם הראשונה
- One-Step Growth: כל התאים נדבקו מלכתחילה ← פיק אחד
נקודות מרכזיות לזכור
- מחזור חיים וויראלי מורכב מ-8 שלבים: Attachment → Penetration → Uncoating → Expression → Replication → Assembly → Maturation → Release
- תא רגיש ≠ תא מתירני – נדרשים שניהם להדבקה מוצלחת
- העברה אופקית (בין אנשים) שונה מהעברה אנכית (אם-עובר)
- $R$ (Reproductive Number) – מדד קריטי להבנת התפשטות מגיפות
- PCR – הכפלה ספציפית של $\ce{DNA}$; עבור וירוסי $\ce{RNA}$ נדרשת RT-PCR
- Plaque Assay – השיטה היחידה למדידת וירוסים אינפקטיביים
- לחות וטמפרטורה משפיעות באופן דרמטי על יציבות וירוסים
- Reassortment בשפעת – מנגנון מרכזי לשונות גנטית מהירה
שיעור 3 וירולוגיה - מבנה וסימטריה של וירוסים
תאריך: 06/11/2025פתיחה - מה בין מבנה לתפקוד בעולם הוירוסים
וירוסים אינם רק “כדורים עם עיניים וידיים” כפי שמציגים בספרי ילדים, או “הרוצח הסדרתי” מהסרט Contagion. וירוסים הם ישויות מורכבות עם מבנה ספציפי שמשפיע ישירות על הפונקציה שלהם. המגוון העצום של מבני וירוסים - מספריים, דרך אובליים ועד צורות מורכבות כמו bacteriophages - נובע מהבדלים בגנום, בגודל ובאסטרטגיות ההדבקה.
וירוסים מדביקים את כל צורות החיים - בני אדם, צמחים, חיידקים ואפילו וירוסים אחרים (satellite viruses). העולם הווירולוגי מגוון להפליא, והמבנה של כל וירוס מותאם במדויק למשימתו.
התפקידים הקריטיים של המבנה הוויראלי
שמירה על הגנום - משימה ראשונה במעלה
האתגר המרכזי: הסביבה שלנו מלאה ב־nucleases - אנזימים המפרקים חומצות גרעין. ״הידיים שלנו מלאות נוקלאזות… אנחנו מפרישים על העור המון המון אנזימים שמפרקים RNA ו־DNA”. זו גם הסיבה שבמעבדה עובדים עם כפפות - כדי לא לפרק את המולקולות.
ה־capsid של הווירוס חייב להגן על החומר הגנטי מהרגע שהוא יוצא מתא נגוע ועד שהוא נכנס לתא הבא. אנחנו מתמודדים עם וירוסים בסביבה שלנו כל הזמן.
קביעת ספציפיות - מי, איפה ומתי
שני מושגי מפתח שמגדירים את היעד הביולוגי של הווירוס:
- Host Range: טווח המארחים שהווירוס יכול להדביק. לדוגמה, וירוס שמדביק גם עופות וגם בני אדם בעל host range רחב.
- טרופיזם (Tropism): אילו רקמות הווירוס מדביק בתוך האורגניזם. Hepatitis C מדביק רק את הכבד (tropism צר), בעוד וירוסים אחרים יכולים להדביק ריאות, מעיים וכבד (tropism רחב).
המבנה - ובמיוחד חלבוני המעטפת (envelope proteins) או ה־capsid - קובע את הספציפיות הזו באמצעות זיהוי receptors ספציפיים על תאי המטרה.
הגישות המדעיות לחקר מבנה וירוסים
פריצת הדרך של רוזלין פרנקלין
תרומתה של רוזלין פרנקלין הודגשה בהערכה: היא לא קיבלה נובל למרות חשיבות עבודתה. פרנקלין הייתה הראשונה שפתרה מבנה של וירוס - Tobacco Mosaic Virus - באמצעות X-ray crystallography. בשיתוף עם הפיזיקאי קספר, הם הגיעו לתובנה מהפכנית: וירוסים אינם ״משהו פרובזורי”, אלא בעלי ״מבנים סדורים”.
ב־crystallography לוקחים גביש של וירוסים, מקרינים קרני X, והן מתפזרות על ידי האלקטרונים. מתבנית הפיזור (diffraction pattern) אפשר לחשב את מפת הצפיפות האלקטרונית (electron density map) ולבנות מודל תלת-ממדי. השיטה חשפה שיש לווירוסים מבנה מסודר עם RNA במרכז וחלבונים שמגנים עליו מסביב.
מהפכת Cryo-EM
כיום, אחת השיטות המתקדמות ביותר היא cryo-electron microscopy (Cryo-EM): ״לוקחים את הוירוס, מקפיאים אותו בשכבת קרח דקה מאוד, פחות ממיקרון… כל פרטיקל יושב קצת אחרת בקרח”. אוספים אלפי תמונות מזוויות שונות ומשחזרים מבנה תלת-ממדי במחשב באמצעות computational reconstruction. זו אחת השיטות המתקדמות ביותר בביולוגיה מבנית כיום.
הארכיטקטורה המגוונת של וירוסים
וירוסים לא עטופים (Non-enveloped Viruses) - פשטות אלגנטית
אלה וירוסים עם capsid בלבד - ״קופסה שבנויה מחלבונים ובתוכה ארוז החומר הגנטי”. דוגמאות: poliovirus ו־rhinovirus ממשפחת Picornaviridae. גם השם עצמו מרמז על המהות: ״פיקו - קטן, RNA - וירוסים קטנים עם RNA, גנום יחסית קצר”.
וירוסים עטופים (Enveloped Viruses) - מורכבות נוספת
כאן מתווספת מעטפת ליפידית (lipid envelope) - ממברנה ביולוגית - עם envelope proteins משולבים בה. בפנים יכול להיות:
- Capsid קלאסי - כמו בזיקה (Zika) ודנגי (Dengue)
- RNP (Ribonucleoprotein complex) - החומר הגנטי עטוף בחלבונים לכל אורכו, כמו באינפלואנזה
המשמעות המבנית: ״הממברנה היא מחסום. מה שבתוך הוירוס צריך לצאת החוצה… צריך לעבור פעמיים ממברנה - של הוירוס ושל התא”. לכן נדרש מנגנון מיוחד של membrane fusion שיידון בהמשך.
עקרון הסימטריה - היופי שבחיסכון
למה סימטריה כל כך חשובה?
סימטריה מופיעה בטבע מעלים של שרך דרך אורביטלים אטומיים ועד וירוסים. בעולם הווירוסים יש לה יתרונות ברורים:
- חיסכון גנטי: זה מאוד חסכוני מבחינה אנרגטית - במקום לייצר 60 חלבונים שונים, יש גן אחד שמקודד לאותו חלבון
- יצירת מבנים גדולים: יחידות חוזרות מאפשרות לייצר סופר-סטרקצ’רים מיחידה שחוזרת על עצמה
- בקרה ואלוסטריות (Allostery): כמו ב־IgM שהוא כמה IgG מחוברים בסימטריה - המבנה יוצר מעין ספירה… עם המון אתרי קישור
הסימטריה האיקוזהדרלית (Icosahedral Symmetry) - הפתרון האידיאלי
Icosahedron הוא polyhedron עם 20 פאות משולשות. בכל icosahedron יש תמיד שלושה צירי סימטריה:
- 5-fold symmetry בקודקודים (vertices): סיבוב של 72° (360÷5)
- 3-fold symmetry במרכזי משולשים (face centers): סיבוב של 120°
- 2-fold symmetry בקצוות (edges): סיבוב של 180°
מושג ה־T number (triangulation number): ככל שה־T יותר גדול, הוירוס יותר גדול. T=1 מכיל 60 subunits, T=3 מכיל 180, וכן הלאה - תמיד כפולות של 60.
הסימטריה ההליקלית (Helical Symmetry) - הפתרון לצורות מוארכות
סימטריה שמשלבת rotation ו־translation לאורך ציר - ״סימטריה של בורג”. דוגמה מ־Tobacco Mosaic Virus: ״כל כמה מעלות בסיבוב ונעלה קצת בציר… נגיע ליחידה הבאה שעוטפת את ה־RNA”. זה מאפיין במיוחד את ה־RNP של וירוסים רבים.
דוגמאות מעולם הוירוסים
HIV - שבירת כללים בצורה אלגנטית
ה־capsid של HIV הוא קונוס (cone shape) ייחודי, בנוי בעיקר ממשושים (hexagons) אך עם מספר קבוע של מחומשים (pentagons) - כ־6. האלגנטיות האבולוציונית היא שאותו חלבון שיוצר משושים יכול לשנות קונפורמציה וליצור גם מחומשים.
עוד נקודה קריטית: מספר העותקים של חלבוני המעטפת על HIV מאוד קטן - עותקים ספורים - קשה מאוד למערכת החיסון לזהות אותו. זו אסטרטגיית immune evasion מתוחכמת.
הרפס (Herpes) - מורכבות במיטבה
וירוס עם כ־100 גנים (להשוואה: לאבולה יש 7–8, לכלבת 5). המבנה רב-שכבתי:
- Capsid איקוזהדרלי
- Tegument - חלל מלא בחלבונים
- Envelope - מעטפת ליפידית עם envelope proteins
בנוסף, מנוע מולקולרי (molecular motor) דוחס DNA לתוך ה־capsid: הצפיפות של DNA בקפסיד הרבה יותר גבוהה מהצפיפות בגרעין התא - זאת ממש דחיסה, compression. זהו packaging mechanism מתוחכם מאוד.
אינפלואנזה (Influenza) - כאוס מאורגן
וירוס pleomorphic: ״ויריון אחד לא דומה לשני”. יכול להיות spherical או מוארך כ״ספגטי”. הגנום מפוצל ל־8 RNA segments, כל אחד עטוף ב־RNP. כל סגמנט מקודד לחלבונים ספציפיים. הסידור של החלבונים על ה־RNA הוא בדרך כלל עם סימטריה הליקלית.
אבולה (Ebola) - פשטות קטלנית
״אחד הוירוסים הנוראים על פני כדור הארץ”, גורם ל־hemorrhagic fever. הצורה bullet-shaped או filamentous - חוט ארוך. למרות הקטלניות - רק 7–8 גנים. להשוואה: ״כלבת… 100% מוות - 5 גנים, 5 חלבונים, זה כל העסק”.
התאמה לסביבה
מקרה לדוגמה: וירוסי Flavivirus
בדנגי וזיקה (וירוסים arboviral שמועברים על ידי יתושים) נמצאה התאמה מבנית תלויה-טמפרטורה:
- ב־28°C (טמפרטורת יתוש): הווירוס בעל משטח חלק (smooth)
- ב־37°C (טמפרטורת אדם): הווירוס הופך spiky - עם בליטות
״זה מדהים איך הוירוס מתאים את עצמו למערכת שבה הוא צריך להשתכפל”. השינוי נובע מ־conformational rearrangement של envelope proteins.
המשמעות הקלינית: אם רוצים לייצר חיסון, חייבים לדעת מה הקונפורמציה הרלוונטית בגוף האדם כדי שהנוגדנים יזהו את האפיטופים הנכונים (ולא את אלה שנחשפים אצל היתוש). זו נקודה קריטית ל־vaccine design.
מנגנון Membrane Fusion - כוריאוגרפיה מולקולרית
תהליך חדירת הווירוס לתא מוצג כמנגנון מדורג:
- כניסה ב־endocytosis: הווירוס נבלע על ידי התא
- החמצה (Acidification): האנדוזום עובר acidification, נכנסים פרוטונים
- שינוי קונפורמציה (Conformational change): ירידת pH גורמת לשינוי קונפורמציה של חלבוני המעטפת
- איחוי ממברנות (Membrane fusion): לוקחים את ממברנת הוירוס ואת ממברנת התא ומאחדים אותן
- יצירת pore: דרכה עובר החומר הגנטי
זהו מנגנון של pH-dependent fusion שמאפשר שחרור (release) של הגנום הווירלי לציטופלזמה של התא המארח.
סיכום
העיקרון המרכזי: וירוסים אינם ״איזה משהו פרובזורי”. הם ישויות מתוכננות להפליא עם מבנים מדויקים המותאמים למשימתם. הסימטריה מאפשרת genetic economy וייצור efficient, המבנה קובע את host range ואת ה־tropism, והיכולת להסתגל לסביבות שונות (כמו מעבר בין יתוש לאדם) מדגימה evolutionary optimization מרשימה.
כל וירוס הוא ישות (Entity) - צריך להסתכל על כל וירוס ולראות מה בדיוק הוא עושה. המבנה מספר את הסיפור של האסטרטגיה - מהגנה על הגנום, דרך זיהוי ספציפי ועד חדירה מתוחכמת לתא. זו לא רק structural biology - זו הבנה של איך הטבע פותר בעיות ״הנדסיות” מורכבות בצורה אלגנטית ויעילה.
שיעור 4 וירולוגיה - מחזור החיים של וירוסים
תאריך: 17/11/2025כניסה לתא ומעבר בציטופלזמה
ניווט תוך-תאי
- הציטופלזמה היא סביבה צפופה מאוד
- דיפוזיה לבדה אינה יעילה למעבר וירוסים
- וירוסים משתמשים במערכות תעבורה תאיות:
- מיקרוטובולים (Microtubules)
- מנגנוני תנועה על גבי הציטושלד
דוגמאות למנגנוני כניסה
Herpes Virus
- עובר fusion עם ממברנת התא
- הקפסיד נקשר לחלבונים מוטוריים
- מועבר לאורך המיקרוטובולים לכיוון הגרעין
Adenovirus
- תהליך אנדוציטוזיס (Endocytosis)
- כל הוזיקולה של האנדוזום מועברת לתוך הציטופלזמה
- הוירוס יוצא מהוזיקולה ומתחיל במחזור החיים
מעבר לגרעין התא
Nuclear Pore Complex (NPC)
- חלבונים דורשים Nuclear Localization Signal (NLS) ספציפי
- ה-NLS נקשר לחלבונים מעבירים המובילים אל הגרעין
אסטרטגיות שונות של וירוסים
Influenza Virus
- גנום RNA מפולח (segmented)
- כל סגמנט עטוף בחלבון עם NLS
- כל הסגמנטים נכנסים לגרעין בנפרד
Herpes Simplex Virus (HSV)
- הגנום ארוז בקפסיד בלחץ של ~20 אטמוספירות (equivalent to 190m underwater pressure)
- הקפסיד מגיע ל-NPC
- רק הפורטל נפתח
- ה-DNA מוזרק לגרעין בלחץ
Adenovirus
- הקפסיד נפתח מחוץ לגרעין
- פורטל חלבון עם NLS
- מכניס את הגנום פנימה
וירוסים קטנים
- עוברים דרך ה-NPC או הממברנה הגרעינית ישירות
סינתזה של חלבונים ושכפול
עקרונות יסוד
- ייצור תבנית RNA
- חייבת להיות ניתנת לתרגום על ידי ריבוזומים תאיים
- סינתזת ה-RNA יכולה להתבצע:
- על ידי אנזים ויראלי
- או באמצעות אנזים תאי
- שכפול הגנום הויראלי
- יכול להתבצע באמצעות חלבון תאי או ויראלי
- חלבוני בקרה
- משנים סיגנלים תאיים
- משנים את התא מתאובה להדבקה
- אנזימים המסייעים בסינתזת הגנום
- ביטוי מדורג
- חלבונים מיוצרים בשלבים שונים:
- Immediate Early - מיד לאחר הדבקה
- Early - חלבוני רפליקציה
- Late - חלבונים מבניים (קפסיד)
- חלבונים מיוצרים בשלבים שונים:
מיקום הגנום בתא
DNA Viruses
- בדרך כלל בגרעין (משתמשים במערכת השעתוק התאית)
- חריגות:
- Poxvirus (כמו Vaccinia) - בציטופלזמה, מביא את כל האנזימים שלו
- Hepadnavirus - הגנום בגרעין אך הרפליקציה בציטופלזמה
RNA Viruses
- בדרך כלל בציטופלזמה (הריבוזומים נמצאים שם)
- חריגות:
- Retrovirus
- Orthomyxovirus (Influenza) - גנום RNA אך נמצא בגרעין
Lytic vs. Latency Cycles
Herpes Virus - שני מסלולים
Lytic Cycle (מחזור ליטי)
- הגנום הליניארי הופך למעגלי בגרעין
- ייצור מסיבי של חלבונים
- יצירת ויריונים חדשים
- התפוצצות התא ושחרור
Latency (חביון)
- הגנום נשמר בתא מארח
- ביטוי מינימלי של חלבונים
- הימנעות מזיהוי חיסוני
- יכול להימשך שנים
מנגנון ההחלטה - דוגמה בבקטריופאג’ λ
חלבוני בקרה מרכזיים
CI (Lambda Repressor)
- מדכא ביטוי של גנים ליטיים
- מפעיל ביטוי של עצמו (positive feedback)
- רגיש לסטרס - מתפרק בנוכחות פרוטאז תאי
Cro Protein
- מעכב ביטוי של CI
- מפעיל את הגנים הליטיים
Superinfection Immunity
- פאג’ בלטנסי מונע כניסת פאג’ים נוספים:
- עיכוב אנזימים המפרקים פפטידוגליקן
- מניעת כניסת DNA ויראלי
Communication Between Cells
- בפאזה ליטית: ייצור חלבון Arbitrium
- Arbitrium מופרש ונקלט על ידי חיידקים אחרים
- ריכוז גבוה של Arbitrium ← כניסה ללטנסי (מניעת הרג כל התאים)
DNA Viruses - מנגנונים מולקולריים
Baltimore Classification
- מבוסס על אופן ייצור mRNA לתרגום
DNA Viruses - גנום כפול
מאפיינים כלליים
- גנום יציב
- גודל: אלפי עד מאות אלפי base pairs
- שכפול ושעתוק דומים למערכת התאית
- בדרך כלל בגרעין
- שיעור טעויות נמוך (בניגוד ל-RNA viruses)
- ביטוי מדורג
RNA Polymerases תאיים
RNA Pol I
- מייצר rRNA (ribosomal RNA)
- tRNA, 5.8S, 18S, 28S
- אין דוגמאות לשימוש ויראלי
RNA Pol II (השימוש הנפוץ ביותר)
- מייצר mRNA
- microRNA
- long non-coding RNA
- לא מדויק בנקודות התחלה וסיום מדויקות
RNA Pol III
- מייצר RNA קצר ומדויק
- tRNA
- 5S rRNA
- חלק מהוירוסים משתמשים לייצור RNA פונקציונלי
SV40 (Simian Virus 40)
מבנה הגנום
- גנום דו-גדילי מעגלי (~5,000 bp)
- ארוז בנוקלאוזומים (גם בתוך הוויריון)
ביטוי מדורג
Early Genes
- Large T-Antigen (LT)
- Small T-Antigen (ST)
- מתבטאים באמצעות מערכת התאית
- LT חוזר לגרעין ומגייס מערכת הרפליקציה התאית
Late Genes
- חלבוני קפסיד מבניים
- מתבטאים רק לאחר רפליקציה של הגנום
מנגנון בקרה
- חלבון תאי: Initiator Binding Protein (IBP)
- ברמה קבועה בתא
- נקשר לאזור רגולטורי ויראלי (3 binding sites)
- כשיש מעט עותקי גנום ← רפרסיה של Late Promoter
- לאחר רפליקציה: יותר גנומים מאשר IBP ← ביטוי Late Genes
Adenovirus
מבנה הגנום
- דו-גדילי ליניארי (~36,000 bp)
- הקפסיד מתפרק מחוץ ל-NPC
- ה-DNA נכנס לגרעין
שלבי ביטוי
Immediate Early: E1A
- Transcription factor
- מפעיל Early Genes
- גורם לרכרום כרומטין
Early Genes
- חלבוני DNA polymerase
- חלבוני רפליקציה
- אנזימים נלווים
Late Genes
- חלבונים מבניים
- הרכבת קפסידים
גילוי Splicing
- Adenovirus היה הראשון בו התגלה splicing
- היברידיזציה של DNA עם mRNA גילתה loops גדולים
- ביטוי מורכב עם alternative splicing
Adenovirus E1A - מנגנון מולקולרי
אינטראקציה עם Retinoblastoma (Rb)
מצב תקין בתא:
- $\text{Rb}$ קושר ומעכב $\text{E2F}$ (transcription factor)
- כדי להיכנס ל-S-phase: פוספורילציה של Rb ← שחרור E2F
אסטרטגיה ויראלית:
E1A → binds Rb → releases E2F → S-phase genes transcription
- E1A קושר את Rb
- E2F משוחרר ופעיל
- מפעיל גם גנים ויראליים וגם דוחף את התא ל-S-phase
- S-phase מספק נוקלאוטידים לרפליקציה ויראלית
קשר לסרטן
- Papillomavirus: E6 ו-E7 מעכבים Rb באופן דומה
- רצף קונסרבטיבי בין וירוסים שונים
- Rb הוא tumor suppressor - מוטציות גורמות לסרטן
רגולציה של ביטוי גנים
Positive Feedback Loop
Gene X → RNA → Protein X
↓
Binds own promoter → Enhanced transcription
Cascade Regulation (מדורג)
Immediate Early Gene X → Protein X
↓
Activates Early Genes → Early Proteins
↓
DNA Replication
↓
Late Genes
פרומוטורים ואנהנסרים (Enhancers)
פרומוטור
- מיקום קבוע לפני הגן
- מכיל TATA box (רצף T-A-T-A)
- TBP (TATA Binding Protein) קושר אותו
- ~50% מהפרומוטורים התאיים מכילים TATA box
אנהנסר
הגדרה: רצף DNA המגביר transcription בצורה position and orientation independent
מאפיינים:
- יכול להיות upstream או downstream לפרומוטור
- יכול להיות במרחק של kb רבים
- פועל באמצעות DNA looping
- יכול לפעול בכיוון הפוך
מנגנון פעולה:
- קושרים transcription factors
- coactivators
- מייצר enhancer RNA (eRNA) - non-coding
- eRNA מסייע ביצירת הקשר עם הפרומוטור
מחקר KSHV (Kaposi’s Sarcoma Herpesvirus):
- זוהו 21 אזורי open chromatin בגנום
- נמצאו 6 enhancers:
- 2 constitutive/latency enhancers
- 1 tissue-specific (endothelial cells)
- 4 lytic-specific enhancers
ניסוי Luciferase Reporter
Promoter → Luciferase gene
↑
Putative enhancer (downstream)
Measure: Light output = transcription activity
פרומוטורים ויראליים בהיסטוריה
- HIV LTR promoter
- Adenovirus Major Late Promoter
- שימשו לגילוי General Transcription Factors (GTFs)
ניסוי קלאסי:
- G-less cassette (ללא גואנין ברצף)
- עצירה בנוכחות G
- הוספה/הסרה של GTFs בודדים
- הוכחת הכרחיות: TFIIB, TFIID, וכו’
Herpes Simplex Virus (HSV-1)
מחזור ליטי
שלבים:
- Fusion עם ממברנת התא
- הקפסיד נכנס עם tegument proteins (שכבת חלבונים בין קפסיד לממברנה)
- הגנום הליניארי נכנס לגרעין והופך למעגלי
Immediate Early: VP16
- חלבון tegument (נכנס עם הוויריון)
- Transcription activator
- לא קושר DNA ישירות
- יוצר קומפלקס עם חלבונים תאיים:
- Oct-1
- HCF (Host Cell Factor)
- מפעיל Immediate Early genes: ICP4, ICP0
Early Genes
- אנזימי רפליקציה
- DNA polymerase
- חלבוני עזר
- רפליקציה של הגנום הויראלי
Late Genes
- חלבוני קפסיד
- tegument proteins
- glycoproteins
- הרכבת ויריונים
Nuclear Egress
- קפסידים גדולים מדי ל-NPC
- קריעת הממברנה הגרעינית
- יציאה לציטופלזמה
- הוספת tegument וממברנה
Latency בנוירונים
מנגנון כניסה ללטנסי:
בתאי אפיתל:
- HCF נמצא בגרעין
-
VP16 + Oct-1 + HCF → Lytic cycle
בנוירונים:
- HCF נמצא בציטופלזמה (לא בגרעין!)
- אין הפעלה של Immediate Early genes
- כניסה ללטנסי
שינויים אפיגנטיים בלטנסי:
- הגנום ארוז ב-repressive chromatin
- מודיפיקציות היסטונים מדכאות
- במצב סטרס: phosphorylation של היסטונים
- שינוי ל-open chromatin ← reactivation
HSV-1 וזיהום קליני:
- הדבקה ראשונית: תאי אפיתל בשפתיים ← lytic cycle
- מעבר לנוירונים ← latency בגנגליון
- reactivation (UV, חום, סטרס) ← נדידה חזרה לשפתיים ← פצעים
- חוזר שוב ושוב לאורך החיים
זיהוי Early vs. Late Genes
שימוש במעכבים
Immediate Early:
- מתבטאים גם בנוכחות מעכבי סינתזת חלבון
- לא תלויים בחלבונים ויראליים
- בדרך כלל transcription factors
Early:
- דורשים חלבונים ויראליים (Immediate Early)
- אינם דורשים רפליקציה
- מתבטאים בנוכחות מעכבי רפליקציה
Late:
- תלויים ברפליקציה
- מעכב רפליקציה ← אין ביטוי
- בדרך כלל חלבונים מבניים
Poxvirus (Vaccinia)
אסטרטגיה ייחודית
- DNA virus בציטופלזמה!
- לא משתמש במערכת השעתוק הגרעינית
- מביא את כל המנגנון שלו:
אנזימים ויראליים:
- Viral DNA-dependent RNA polymerase
- mRNA capping enzyme
- Poly(A) polymerase
- Methyltransferases
שלבים:
- הקפסיד נשאר חלקית סגור
- כניסת נוקלאוטידים ומולקולות קטנות
- transcription בתוך הקפסיד
- mRNA יוצא ועובר translation
- חלבונים חוזרים ומפעילים שאר הגנים
- רפליקציה
- Late genes
- הרכבת ויריונים
Single-Stranded DNA Viruses
Adeno-Associated Virus (AAV)
מבנה:
- גנום ssDNA בוויריון
- נכנס לתא ← המערכת התאית משלימה ל-dsDNA
- מיניסרקל dsDNA בגרעין
תלות בוירוסים אחרים:
- שם: “Adeno-Associated” - התגלה תמיד עם Adenovirus
- לא יעיל ברפליקציה עצמאית
- דורש “helper virus”:
- Adenovirus
- Herpes Simplex Virus
- ה-helper מספק חלבונים לרפליקציה יעילה
שימוש בגנטיקה:
- כלי פופולרי ל-gene therapy
- בטוח יחסית
- יכולת אריזה מוגבלת
סיכום: DNA Viruses Strategy
עקרונות משותפים
- Immediate Early genes
- Transcription factors
- לא תלויים בחלבונים ויראליים חדשים
- דוגמאות: SV40 (Large T), Adenovirus (E1A), HSV (VP16)
- Early genes
- חלבוני רפליקציה
- תלויים ב-Immediate Early
- לפני רפליקציה של הגנום
- DNA replication
- נקודת מפנה במחזור
- מאפשרת ביטוי Late genes
- Late genes
- חלבונים מבניים (קפסיד)
- רק לאחר רפליקציה
- ייצור מסיבי
- לעיתים טוקסיים לתא
אסטרטגיות מיקום
| Virus Type | Location | Reason |
|---|---|---|
| רוב ה-DNA viruses | גרעין | שימוש ב-transcription machinery תאי |
| Poxvirus | ציטופלזמה | מביא מנגנון משלו |
| רוב ה-RNA viruses | ציטופלזמה | קרוב לריבוזומים |
| Influenza (RNA) | גרעין | חריג - גנום RNA בגרעין |
בקרת ביטוי
- רמת פרומוטור: קישור של repressors/activators
- רמת אנהנסר: הגברה מרחוק
- כרומטין: מודיפיקציות היסטונים (במיוחד ב-latency)
- מלאי נוקלאוטידים: דחיפת התא ל-S-phase (E1A, LT)
- ריכוז גנומים: דילול של repressors תאיים
נושאים לשיעורים הבאים:
- Retrovirus (DNA virus עם שלב RNA)
- RNA viruses
- Partially dsDNA viruses
סיכום לשינון
1. כניסת הנגיף לתא המאכסן והובלה תוך-תאית
- הובלה בציטופלזמה: לאחר החדירה לתא, הנגיף אינו מסתמך על דיפוזיה פסיבית בציטופלזמה הצפופה. במקום זאת, נגיפים “תופסים טרמפ” על מערכות ההובלה של התא, בעיקר מערכת ה-Microtubules.
- דוגמאות:
- Herpesvirus: לאחר איחוי (Fusion) עם ממברנת התא, הקפסיד (Capsid) נקשר לחלבונים ומוּבָל לאורך ה-Microtubules לכיוון גרעין התא.
- Adenovirus: נכנס בתהליך אנדוציטוזה (Endocytosis). הוסיקולה (Vesicle) כולה, המכילה את הנגיף, מובלת לאורך ה-Microtubules.
- דוגמאות:
- כניסה לגרעין התא: נגיפים רבים צריכים להכניס את החומר הגנטי שלהם לגרעין. התהליך דורש מנגנונים מיוחדים להתגבר על הממברנה הכפולה של הגרעין.
- Nuclear Localization Signal (NLS): רצף חומצות אמינו ספציפי המאפשר לחלבונים (או לקומפלקסים של חומר גנטי-חלבון) להיות מיובאים לתוך הגרעין דרך ה-Nuclear Pore Complex (NPC).
- אסטרטגיות כניסה לגרעין:
- Influenza Virus: הגנום מסוג
RNAמחולק לסגמנטים. כל סגמנט ארוז עם חלבונים המכיליםNLS, המאפשרים את כניסתם לגרעין. - Adenovirus: הקפסיד מתקרב ל-
NPCונפתח. חלבון טרמינלי הקשור לגנום ה-DNAהלינארי מכילNLSומוביל את הגנום כולו לתוך הגרעין. - Herpesvirus: הקפסיד עוגן ב-
NPC. בשל לחץ אוסמוטי אדיר (שווה ערך ל-20 אטמוספירות) בתוך הקפסיד, ה-DNAמוזרק ישירות לתוך הגרעין דרך חלבון שער (Portal Protein) ייעודי, ללא כניסת הקפסיד כולו. - נגיפים קטנים: יכולים לעבור בשלמותם דרך ה-
NPC.
- Influenza Virus: הגנום מסוג
2. שכפול הגנום וביטוי גנים ויראליים
עקרונות יסוד
- נגיפים הם טפילים תוך-תאיים אובליגטוריים, התלויים לחלוטין במנגנוני התא המאכסן (כגון ריבוזומים) לייצור חלבונים.
- המטרה המרכזית היא לייצר מולקולות
mRNAשיוכלו להיות מתורגמות על ידי ריבוזומי התא. - סינתזת
RNAושכפול הגנום יכולים להתבצע על ידי אנזימים ויראליים או תאיים. - הגנום הנגיפי מקודד לחלבונים מבניים, אנזימים וחלבוני בקרה המשנים את סביבת התא לטובת הנגיף.
מיקום השכפול
- נגיפי
DNA: לרוב משכפלים את עצמם בגרעין, כדי לנצל את מנגנוני השעתוק (כמוRNA \ Polymerase \ II) והשכפול של התא.- יוצאי דופן:
- Poxviruses (כדוגמת Vaccinia): נגיפי
DNAגדולים המשכפלים את עצמם בציטופלזמה. לשם כך, הם מביאים איתם את כל האנזימים הדרושים להם (פולימראזות, אנזימי Capping ו-Polyadenylation).
- Poxviruses (כדוגמת Vaccinia): נגיפי
- יוצאי דופן:
- נגיפי
RNA: לרוב משכפלים את עצמם בציטופלזמה, בסמוך לריבוזומים המתרגמים את תוצריהם.- יוצאי דופן:
- Orthomyxoviruses (כדוגמת Influenza): משכפלים בגרעין.
- Retroviruses: משכפלים בגרעין.
- יוצאי דופן:
3. מחזור ליטי (Lytic) ומחזור לטנטי (Latent)
נגיפים מסוימים יכולים לבחור בין שתי אסטרטגיות הדבקה:
- Lytic Cycle (המחזור הליטי): שכפול פעיל של הנגיף, ייצור מסיבי של ויריונים חדשים, ולבסוף הרס (Lysis) של התא המאכסן ושחרור הצאצאים.
- Latency (לטנטיות / חביון): הנגיף נשאר “רדום” בתא. הגנום הנגיפי נשמר (לעיתים תוך אינטגרציה לגנום המאכסן), אך ביטוי הגנים מופחת למינימום, מה שמאפשר לנגיף לחמוק ממערכת החיסון.
- Reactivation (הפעלה מחדש): בתנאי עקה (Stress) מסוימים, הנגיף הלטנטי יכול לעבור הפעלה מחדש ולחזור למחזור הליטי.
דוגמאות ובקרה
א. בקטריופאג’ למדא ($\lambda$)
- לאחר הזרקת ה-
DNAלחיידק, הגנום הופך למעגלי. - Latency: הגנום עובר אינטגרציה לתוך כרומוזום החיידק באמצעות רקומבינציה.
- Lytic: הגנום משוכפל במנגנון “מעגל מתגלגל” (Rolling Circle Replication), נוצרים ויריונים חדשים והחיידק מפורק.
- ההחלטה בין המסלולים: נשלטת על ידי מאזן בין שני חלבוני מפתח:
cI(Repressor): רמה גבוהה שלו מדכאת את הגנים הליטיים ומקדמת לטנטיות.Cro: רמה גבוהה שלו מדכאת אתcIומפעילה את הגנים הליטיים.- עקה סביבתית גורמת לפירוק
cIומעבר למסלול הליטי.
ב. Herpesvirus
- במחזור הליטי: הגנום הלינארי הופך למעגלי בגרעין, מתרחש ביטוי גנים מדורג, שכפול הגנום, הרכבת ויריונים ושחרורם.
- במחזור הלטנטי: הנגיף נשאר רדום בתאים מסוימים (למשל, נוירונים). ביטוי הגנים מינימלי.
- ההחלטה בין המסלולים: תלויה בסוג התא ובזמינות פקטורי שעתוק תאיים.
- לדוגמה, החלבון הוויראלי
VP16חיוני להפעלת המחזור הליטי. בנוירונים, פקטור תאי חיוני לפעולתVP16(החלבוןHCF) נמצא בציטופלזמה ולא בגרעין, ולכן המחזור הליטי אינו מופעל והנגיף נכנס ללטנטיות.
- לדוגמה, החלבון הוויראלי
4. ביטוי גנים מדורג בנגיפי DNA
ביטוי הגנים בנגיפים אלו מאורגן בקסקדה (Cascade) מבוקרת היטב:
- Immediate Early (IE) Genes: הגנים הראשונים המתבטאים. תוצריהם הם לרוב פקטורי שעתוק המפעילים את השלב הבא. ביטויים אינו דורש סינתזת חלבונים ויראליים חדשים.
- Early (E) Genes: מקודדים לחלבונים הדרושים לשכפול הגנום הוויראלי (למשל,
DNA \ Polymerase) ולשינוי סביבת התא. ביטויים דורש את תוצרי גני ה-IE. - Late (L) Genes: מקודדים לחלבונים מבניים (כמו חלבוני הקפסיד). ביטויים מתרחש לאחר תחילת שכפול הגנום הוויראלי, כדי להבטיח שיש מספיק עותקי גנום לאריזה.
דוגמאות לבקרה
- SV40: חלבון ה-
Large T-Antigen(תוצרEarly) גורם לשכפול ה-DNAהוויראלי ומפעיל את ביטוי גני ה-Late. - Adenovirus: חלבון ה-
E1A(תוצרIE) מפעיל את גני ה-Earlyעל ידי קישור וחסימת החלבון התאיRb(Retinoblastoma), מה שמשחרר את פקטור השעתוקE2Fודוחף את התא לשלבS(סינתזתDNA). - Herpesvirus (HSV-1): החלבון
VP16(מגיע עם הוויריון) מפעיל את גני ה-IE. תוצרי ה-IEמפעילים את גני ה-Early, ולאחר שכפול ה-DNA, מופעלים גני ה-Late.
5. בקרת שעתוק ו-Enhancers
- Promoter: רצף
DNAהממוקם בסמוך לנקודת תחילת השעתוק, אליו נקשרRNA \ Polymerase. מיקומו וכיוונו קריטיים. - Enhancer: רצף
DNAשיכול להגביר משמעותית את רמת השעתוק מה-Promoter. בניגוד ל-Promoter, ה-Enhancer יכול לפעול ממרחק רב, ללא תלות במיקומו (upstream/downstream) או באוריינטציה שלו. הוא פועל באמצעות יצירת לולאה (Looping) ב-DNAהמקרבת אותו פיזית ל-Promoter. - גילויים:
- Splicing: התהליך בו אינטרונים מוסרים מ-pre-
mRNA, התגלה לראשונה במחקר על Adenovirus. - Enhancers: ה-Enhancer הראשון התגלה בנגיף SV40.
- נגיפים רבים, כמו KSHV (סוג של Herpesvirus), משתמשים ב-Enhancers כדי לבקר את ביטוי הגנים שלהם באופן ספציפי לרקמה או לשלב במחזור החיים (ליטי/לטנטי).
- Splicing: התהליך בו אינטרונים מוסרים מ-pre-
וירולוגיה 5 - רטרו-וירוסים, HIV, ו-HBV
תאריך: 20/11/20251) איך התחילו להבין שווירוס יכול לגרום לסרטן (Rous sarcoma virus)
פתחנו בתופעה שנראתה “מוזרה”: בניסוי בתרנגולות הופיע סרטן באופן שנראה מדבק. פייטון ראוס לקח רקמה סרטנית, טחן אותה, וסינן את התמצית בפילטר שלא מעביר תאים וחיידקים. את הנוזל המסונן הוא הזריק לתרנגולות, והן פיתחו סרטן. אחר כך הוא חזר על התהליך שוב ושוב (סרטן ← טחינה ← סינון ← הזרקה) וכל פעם התקבל סרטן. זאת הייתה אחת הפעמים הראשונות שהראו שסרטן יכול “לעבור” בצורה שמרמזת על גורם זיהומי.
2) איך מודדים כמה וירוס מדבק יש במבחנה: Plaque assay
כדי לכמת “כמה וירוס מדבק יש”, משתמשים במבחן הפלאקים:
- מגדלים תאים ב-monolayer, מוסיפים דילולים שונים של הווירוס, ואז מוסיפים שכבת חומר (כמו אגר) שמגבילה את הדיפוזיה כדי שהווירוס לא “ינדוד” חופשי.
- כל חלקיק ויראלי מדבק יתחיל מוקד הדבקה מקומי: הוא ידביק תא, יהרוג אותו, ויתפשט רק לשכנים-עד שרואים חור/אזור מת במונולייר (Plaque).
- ספירת הפלאקים מאפשרת לחשב את כמות הווירוס המדבק.
בווירוס ראוס יש משהו חריג: הוא לא בהכרח הורג תאים, אבל כן גורם שינוי מורפולוגי ואף יכול לקדם תהליך סרטני בתרבית.
3) “מהפכת” הרוורס-טרנסקריפטאז: איך הגיעו לזה שלמרות שהגנום RNA, יש שלב DNA
הפרדוקס: בווירוס ראוס הפיקו גנום RNA, אבל ניסויים הראו תלות בשלבי סינתזת DNA.
ניסוי 1: מעכב סינתזת DNA עוצר יצירת וירוס
תיארו ניסוי שבו הוסיפו מעכב של DNA synthesis בשלב ההדבקה-ואז בהמשך לא נוצר וירוס, למרות שמדובר בווירוס RNA. זה רמז שחייב להיות שלב שבו נוצרת מולקולת DNA.
ניסוי 2: היברידיזציה של RNA ויראלי עם DNA של תא מודבק
סימנו את ה-RNA הוויראלי רדיואקטיבית, ועשו היברידיזציה מול DNA מתאי יעד:
- בתא מודבק התקבלה היברידיזציה (יש רצף משלים ב-DNA).
- בתא לא מודבק לא התקבלה היברידיזציה.
המסקנה: לווירוס יש מעבר שבו הוא “משתלב” איכשהו עם DNA תאי.
ניסוי 3: לא צריך סינתזת חלבון כדי להתחיל את התהליך
פוסט-דוקטור הוסיף Cycloheximide (מעכב סינתזת חלבון), ובכל זאת הווירוס הצליח לבצע את תהליך ההיפוך/ההשתלבות. זה הוביל להצעה שהאנזים הדרוש מגיע כבר בתוך הוויריון (ארוז בקפסיד).
שתי מעבדות במקביל + מבחני אנזים במבחנה
במקביל, הווארד טמין ודיוויד בלטימור הגיעו לאותה תגלית: במערכת in vitro ראו תוצר רדיואקטיבי שמתקבל רק אם יש:
- מגנזיום
- דאוקסי-נוקלאוטידים (dNTPs), ולא מספיק רק rNTPs
וכן, כשהרסו את התוצר עם DNase (אבל לא עם RNase) זה הראה שהתוצר הוא DNA.
מכאן נולד המושג: Reverse transcriptase - אנזים שמייצר DNA על תבנית RNA, ומשנה את הדוגמה הקלאסית.
אפשר לקשר את זה ישירות לטכנולוגיות מודרניות: היום אפשר לקחת RNA (למשל מדם), להפוך אותו ל-cDNA ואז לעשות PCR/RT-PCR וריצוף RNA-וכל זה “יושב” על התגלית הזו.
4) מחזור חיים בסיסי של רטרו-וירוסים: כניסה, יצירת dsDNA, אינטגרציה, יציאה
המהלך הכללי:
- הווירוס נכנס לתא (פיוז’ן לממברנה), נכנס קפסיד.
- Reverse transcriptase מייצר DNA דו-גדילי.
- ה-DNA נכנס לגרעין ומשתלב בגנום התא בעזרת Integrase.
- מרגע שהווירוס משולב (provirus), הוא יכול להישאר כחלק מהגנום ולהתבטא בעת הצורך.
- התא משתמש במנגנוני התא (RNA polymerase II, capping, splicing, polyA) לייצור RNA ויראלי וחלבונים.
- אריזה על הממברנה, יציאה כוויריון חדש.
Simple vs Complex retroviruses
ההבדל:
- Simple retroviruses: מתקשים להיכנס לגרעין בצורה פעילה ← אינטגרציה בעיקר בתאים מתחלקים (כשמעטפת הגרעין “נפתחת” בחלוקה).
- Complex retroviruses (למשל לנטי-וירוסים): יכולים להכניס את ה-DNA גם לתאים לא מתחלקים. זו הסיבה שבמחקר, כשרוצים להכניס גנים לנוירונים משתמשים בלנטי-וירוסים.
5) נקודות שחייבים לזכור על רטרו-וירוסים
- הגנום הוא RNA חיובי.
- הוא דיפלואידי: יש שני עותקים של RNA באותו ויריון (סוג של “גיבוי” אם אחד נשבר).
- הגנום לא משמש ישירות כתבנית לסינתזת DNA תאי; הוא קודם עובר הפיכה ל-DNA דו-גדילי.
- תא שנדבק יכול לשאת את גנום הווירוס לנצח בגלל האינטגרציה.
כמה מהגנום שלנו הוא “עקבות” של רטרו-אלמנטים?
בערך 45% מהגנום שלנו קשור לרטרו-אלמנטים/טרנספוזונים שנכנסו לאורך האבולוציה. דוגמאות:
- בצמחים זה יכול להגיע לכמויות קיצוניות (גם 95% בהקשר מסוים).
- צוין אלמנט בשם LINE-1 שמוערך בכ-17% מהגנום, ומתבטא בעובר; עיכוב הביטוי שלו פוגע בהתפתחות עוברית.
6) שלוש הפעילויות של Reverse transcriptase
שלוש פעילויות אנזימטיות עיקריות:
- RNA-dependent DNA polymerase: יצירת גדיל DNA על תבנית RNA.
- RNase H activity: פירוק ה-RNA מתוך ההיבריד RNA-DNA כדי להשאיר DNA מתאים להמשך.
- DNA-dependent DNA polymerase: סינתזת הגדיל השני לקבלת dsDNA.
פריימר: שימוש ב-tRNA תאי
האנזים צריך primer, וברטרו-וירוסים משתמשים ב-tRNA מהתא כפריימר. לכל רטרו-וירוס יש התאמה לרצף tRNA מסוים (דוגמה: ב-HIV משתמש תמיד באותו סוג tRNA).
בנוסף לכך, “kissing loop” - אזור קומפלימנטרי שמחזיק שני עותקי ה-RNA יחד.
7) “הקפיצות” במנגנון הרוורס-טרנסקריפשן ולמה מכפילים קצוות (LTR)
בחלק המפורט של המנגנון:
- מתחילים מסינתזה על קצה אחד, תוך כדי RNase H מפרק את ה-RNA.
- בגלל שיש רצפים חוזרים בקצוות, ה-DNA שנוצר יכול “לקפוץ” ולהיצמד לקצה השני ולהמשיך סינתזה.
- יש אזור RNA שנשמר (PPT) ומשמש כפריימר לגדיל השני.
- בסוף מתקבל DNA שבו קצוות מסוימים מוכפלים ויוצרים LTR בשני הצדדים.
למה זה קריטי:
ה-RNA הוויראלי שנוצר בתא לא מכיל את כל הרצף הרגולטורי בצורה “כפולה”, ולכן רק דרך מנגנון הקפיצות בהיפוך ל-DNA מתקבל שוב LTR מלא בשני הקצוות-מה שנחוץ לביטוי הווירוס במחזור הבא אחרי אינטגרציה.
8) ביטוי גנים ברטרו-וירוסים: אותו פרומוטר, אותו polyA, הרבה תוצרים
העיקרון:
- כל התעתיקים מתחילים מאזור ה-LTR ומסתיימים באותו polyA,
- אבל מתקבל מגוון תעתיקים ע”י ספלייסינג ו”טריקים” תרגומיים.
דוגמאות לטריקים
- Frameshift בריבוזום: מאפשר מאותו RNA לייצר גם Gag וגם Gag-Pol. זה לא יעיל (סדר גודל ~10%), וזה טוב כי צריך הרבה Gag (מבנה) ומעט אנזימים.
- Alternative initiation: קודון התחלה פחות יעיל גורם לכך שרק חלק קטן מהתרגומים מתחיל שם-כך מווסתים כמויות.
- גם ב-mRNA תאי יש מבנים שניוניים וחלבוני קישור-RNA אף פעם לא “ערום”.
איך יוצא RNA לא מספלייסד החוצה?
יש בעיה: אם תמיד עושים ספלייסינג, לא יהיה RNA גנומי מלא לאריזה. הפתרון שתואר (במיוחד ב-HIV):
- חלבון Rev נקשר לרצף/לופ ב-RNA, מעכב ספלייסינג,
- ומאפשר ייצוא מהגרעין של RNA לא-מספלייסד דרך חלבון שַׁטְּל (Crm) דרך הנקב הגרעיני.
Tat ובקרה על אלונגציה
המרצה תיארה את Tat כרגולטור שמאפשר לפולימראז להמשיך אלונגציה:
- בלי Tat הפולימראז מתחיל תעתוק, יוצר ~50 נוקלאוטידים, נעצר אחרי capping ונשאר “תקוע”.
- Tat מגייס קומפלקס שמבצע פוספורילציה ומסיר עיכובים כדי לאפשר elongation.
אפקט Tat תלוי גם בפקטורים תאיים ספציפיים (הובאה דוגמה להשוואת תאי אדם מול עכבר, ובמיוחד צורך ב-CyclinT אנושי כדי לקבל תגובה חזקה).
9) אונקוגנים: איך וירוסים “גונבים” גן תאִי וגורמים לסרטן
חזרו ל-Rous sarcoma virus:
- לווירוס יש גן בשם src.
- כשעשו היברידיזציה מצאו הומולוגיה גם בגנום תאים לא מודבקים ← כלומר הווירוס גנב גן מהתא.
- Src הוא חלבון שמעורב בבקרה על חלוקת תאים (פוספורילציה).
- בווירוס הוא הגיע בלי הרגולציה / עם מוטציות שמפעילות אותו קבוע ← תאים מתחלקים ללא עצירה ← טרנספורמציה סרטנית.
מושגים:
- אם המקור ויראלי: v-onc
- אם המקור תאי: c-onc
10) HIV/AIDS: מקור, נתונים, הדבקה, מהלך מחלה, אבחון וטיפול
מקור כללי
בקופים יש וירוסים דומים (SIV), ושכנראה חשיפה לדם קופים באפריקה אפשרה מעבר לבני אדם. הוזכר שיש HIV-1 (שכיח יותר) ו-HIV-2 (פחות).
נתונים (בהקשר של 2020)
נתונים מספריים:
- 37 מיליון~ נשאים בעולם.
- 1.5 מיליון~ הדבקות חדשות בשנה.
- 680,000~ נפטרו מאיידס וסיבוכיו.
ריכוז התחלואה והתמותה גבוה באפריקה, גם בגלל זמינות תרופות.
דרכי העברה
הווירוס לא יציב מחוץ לגוף (“כמה שעות”), ולכן ההעברה בעיקר דרך נוזלי גוף:
- מגע מיני
- דם / מוצרי דם (בעבר, לפני בדיקות סקר)
- מחטים מזוהמות (סמים, קעקועים/פירסינג לא סטריליים)
- העברה אנכית אם-לילד (הוזכר)
מהלך מחלה
השלבים:
- הדבקה ראשונית עם וירמיה גבוהה.
- הופעת נוגדנים רק אחרי כמה שבועות (3~ שבועות כאומדן לשלב ללא נוגדנים).
- מעבר לפאזה שקטה יחסית (שנים; סדר גודל 7~ שנים, וגם טווח 10-5 שנים בין הדבקה לאיידס).
- בסוף ירידה מתמשכת ב-תאי CD4 T, ובשלב מסוים מופיעים זיהומים אופורטוניסטיים ותסמיני כשל חיסוני.
הוגדר:
- אדם “נורמלי” סביב 500-1200/1500 CD4
- איידס מוגדר כאשר יש פחות מ-200 תאי CD4 במדידת דם.
למה מתים באיידס?
כי מערכת החיסון לא מצליחה לדכא פתוגנים “רגילים”:
- זיהומים חיידקיים
- פטריות
- פרוטוזואה/טפילים
- וגם וירוסים שבדרך כלל נשלטים (כמו CMV והרפס) יכולים להתפשט לאיברים.
יש גם קשר לסרטנים מסוימים כאשר הבקרה החיסונית נשברת.
אבחון ומעקב
- בדיקות נוגדנים: חיוביות רק שבועות אחרי ההדבקה.
- RT-PCR: מפיקים RNA מהדם, הופכים ל-cDNA בעזרת רוורס-טרנסקריפטאז, ומבצעים PCR.
- Real-time RT-PCR משמש למעקב כמותי אחר “כמה וירוס יש בדם” כדי לבדוק יעילות טיפול.
- אפשר לרצף את הווירוס כדי לזהות מוטציות ועמידות לתרופות.
למה אין חיסון
הרוורס-טרנסקריפטאז עושה הרבה טעויות, והווירוס “נהנה” מזה: האנטיגנים משתנים כל הזמן, ויש שונות בין חולים וגם בתוך אותו חולה (“quasispecies”).
קבוצות תרופות/עיכובים
משפחות עיקריות:
- אנלוגים של נוקלאוזידים/נוקלאוטידים: RT “פרומיסקואי” ומכניס נוקלאוטידים לא טבעיים ← עיכוב סינתזה.
- מעכבי RT (עיכוב אתר פעיל).
- מעכבי פרוטאז: בלי ביקוע פוליפרוטאין לא נוצרים חלבונים/אנזימים פעילים.
- מעכבי כניסה/פיוז’ן.
- מעכבי אינטגראז.
- הוזכרו גם כיוונים כמו נוגדנים מנטרלים/עיכוב הבשלה.
עיקרון הטיפול:
לא נותנים תרופה יחידה אלא קוקטייל (שלוש תרופות/מנגנונים שונים), כי הסיכוי לוירוס עם שלוש מוטציות מתאימות באותו גנום נמוך יותר. עוקבים בדם, ואם העומס הוויראלי עולה עושים ריצוף ומתאימים טיפול.
PrEP / PEP והיבט חברתי
הוזכר שיש:
- Post-exposure prophylaxis
- Pre-exposure prophylaxis
יש דיון/מחלוקת חברתית סביב מתן טיפול מונע לאנשים לא חולים מחשש להשפעה על התנהגות סיכון, לצד מצבים שבהם זה כן מועיל (למשל בני זוג בסיכון).
רצפטורים ומקרה “החולה מברלין”
HIV נקשר ל-CD4 וצריך גם קורצפטור CCR5.
יש אחוז קטן באוכלוסייה עם מוטציה ב-CCR5 שלא מאפשרת הדבקה ביעילות.
“החולה מברלין” (Timothy Ray Brown): חולה HIV שפיתח סרטן דם, עבר הקרנה והשתלת מח עצם מתורם עם מוטציית CCR5; לאחר ההשתלה הוא יצא ללא מחלה פעילה, והרעיון הזה השפיע על כיווני מחקר.
כיוונים מחקריים לריפוי
- עריכת גנום בתאי T של החולה כדי לנטרל CCR5 ולהחזיר תאים עמידים.
- גישה של “להעיר” את הווירוס הרדום (latency) ואז לחסל תאים מודבקים (“להוציא אותו מהשקט ואז להרוג”).
המרצה הדגישה: אין “ריפוי” מלא סטנדרטי, אבל עם תרופות אנשים יכולים לחיות שנים רבות בלי קיצור תוחלת חיים, כל עוד נוטלים טיפול.
עיקרון: Undetectable = Untransmittable (U=U) - עומס ויראלי לא מדיד בדם מקטין מאוד הדבקה.
11) HBV (Hepatitis B virus): וירוס DNA קטן עם שלב RT ותלות במנגנוני תא
בחלק האחרון תואר HBV:
- הגנום בוויריון הוא DNA מעגלית חלקית דו-גדילית (גדיל אחד מלא, השני חסר).
- לאחר כניסה לתא, מערכת תיקון DNA תאית משלימה אותו ל-DNA דו-גדילי מעגלי בשם cccDNA (אפיזום עטוף נוקלאוזומים).
- מ-cccDNA מתבצע תעתוק ע”י המערכת התאית, ונוצר גם pregenomic RNA.
- בתוך הקפסיד הוויראלי, הפולימראז משתמש ב-pregenomic RNA כדי לייצר שוב DNA (כלומר יש כאן שלב RT בתוך הקפסיד).
- תואר מנגנון שבו הקפסיד “ננעל” אחרי התחלת סינתזת DNA ולכן לא נכנסים עוד נוקלאוטידים ← לכן מתקבל שוב DNA חלקי.
- אם יש מספיק חלבוני מעטפת (surface), הוויריון נעטף ויוצא; אחרת הקפסיד יכול לחזור לגרעין ולהגדיל את מאגר ה-cccDNA (בערך עד 10~ אפיזומים בגרעין תא מודבק).
HBV לא הורג תא “ישירות” - הנזק הוא אימוני
הפגיעה בכבד נובעת בעיקר מתגובה חיסונית נגד הפטוציטים מודבקים: זה גורם לדלקת כבד ולהפרעה בתפקוד (צהבת).
ברוב האנשים מערכת החיסון מחסלת את התאים המודבקים והווירוס נעלם, אבל באחוז מסוים (בעיקר בילדים) זה נשאר כרוני. הוזכר סדר גודל 10-15% כרוני.
איך כרוניות מובילה לצירוזיס ולסרטן
תואר מעגל:
הרג הפטוציטים ← רגנרציה + יצירת רקמת חיבור ← שוב פגיעה ← עוד רקמת חיבור. בסוף מתקבלת צירוזיס וכבד לא פונקציונלי עד צורך בהשתלה.
הוזכר גם סיכון ל-HCC (סרטן כבד) בגלל דלקת כרונית, ובמקרים מסוימים גם אינטגרציה “תקלה” של HBV לגנום (לא חלק הכרחי במחזור החיים) יכולה לתרום לסרטן.
למה HBV ספציפי לכבד
יש ב-HBV enhancers שתלויים בפקטורי תעתוק שקיימים בכבד (דוגמאות: HNF3, HNF4). בתאים שאינם כבדיים אין הפעלה מספקת של הפרומוטורים ולכן אין רפליקציה.
קומפקטיות גנומית קיצונית
גודל הגנום הןא: 3.2kb~ בלבד. בגלל הצפיפות:
- יש שימוש בפרומוטורים שונים, כולם מסתיימים באותו polyA.
- קיימות מסגרות קריאה חופפות: אותו רצף DNA מייצר שני חלבונים שונים כאשר קוראים אותו בהיסט (frame) אחר-מה שממחיש כמה מוטציה אחת יכולה לפגוע בשני חלבונים בו-זמנית.
המרצה גם הזכירה מהיכרות אישית/מחקרית: פותח חיסון מודרני שמבוסס על יצירת מעטפת/חלקיקים ללא גנום, ולא רק “חלבון מעטפת יחיד”.
12) משפטי סיכום
- תגלית הרוורס-טרנסקריפטאז שינתה את כל הביולוגיה המולקולרית והאבחון המודרני של RNA.
- רטרו-וירוסים יכולים להיות לטנטיים שנים, ורק חלק מהתאים נכנסים לפרודוקטיביות.
- HIV קשה לחיסון בגלל קצב מוטציות ושינוי אנטיגני.
- HBV הוא וירוס קטן ודחוס מאוד, והנזק בכבד קשור בעיקר לתגובה החיסונית ולכרוניות.
וירולוגיה 6 - נגיפי RNA, רפליקציה, בקרת תרגום, הרכבה ויציאה
תאריך: 27/11/20251) פתיחה בסגנון “שאלות סיווג” - לאיזה קבוצה שייך הנגיף?
אני נגיף שהגנום שלו עובר מ-RNA ל-DNA, ובתוך הוויריון עצמו יש RNA - איזה סוג נגיף אני?
התשובה שניתנה היא: רטרווירוס.
מכאן עברנו לדיון מסודר על נגיפי RNA לפי סוג הגנום, ומה מצפים למצוא בתוך הוויריון (ובעיקר: האם חייבים להביא פולימראז בתוך הקפסיד).
2) מה נמצא בתוך הוויריון לפי סוג הגנום של RNA?
א. נגיף +ssRNA (RNA חיובי)
- הגנום עצמו הוא למעשה כמו mRNA: “איך שהוא ייכנס הוא יקודד לחלבונים”.
- לכן לא חייבים להביא בתוך הוויריון RNA-dependent RNA polymerase, כי אפשר לתרגם מיד חלבונים, ומתוכם ייווצר גם הפולימראז לרפליקציה.
- המרצה הדגיש רעיון מבני: אם רוצים שה-RNA יהיה זמין לריבוזום לתרגום, לרוב הוא לא יהיה עטוף חזק בחלבוני מעטפת גנומית שמונעים תרגום (יש יוצאים מן הכלל).
- דוגמה יוצאת דופן: קורונה-וירוס הוא +RNA אבל הגנום שלו מאוד ארוך (30,000~ בסיסים) ולכן “כנראה” כן יש עטיפה חלבונית כדי להגן עליו.
ב. נגיף −ssRNA (RNA שלילי)
- RNA מינוס לא מתורגם. כדי להגיע לתרגום חייבים להפוך אותו לפלוס.
- לכן בתוך הקפסיד/וויריון חייב להיות האנזים: RNA-dependent RNA polymerase (לא “רוורס טרנסקריפטאז”, כי אין מעבר ל-DNA).
- בנוסף, בדרך כלל הגנום כן עטוף בחלבון (גם לשיקולי יציבות/אריזה, וגם כדי שלא יפגוש את מערכת התרגום כשבכל מקרה אינו מתורגם כמות שהוא).
ג. נגיף dsRNA (RNA דו-גדילי)
- dsRNA לא משמש כתבנית לתרגום.
- כדי לייצר mRNA (RNA פלוס) חייבים פולימראז.
- המרצה הדגיש שבמקרה הזה הגנום לא “משתחרר חופשי” לתוך התא: בדרך כלל הוא נשאר בתוך הקפסיד, והייצור של RNA פלוס מתרחש שם.
| נגיפי רנא חיובי/מקודד (+) | נגיפי רנא שלילי (-) | נגיפי רנא דו-גדילי (dsRNA) |
|---|---|---|
| אין פולימרז בויריון, והגנום אינו עטוף בחלבון (naked genome). exceptions: retrovirus (RT and NP), coronavirus (NP) | נמצא פולימרז (RdRp), הגנום עטוף בחלבון (nucleocapsid). | נמצא פולימרז (RdRp), והגנום אינו עטוף בחלבון (naked genome). |
3) RNA פולימראז נגיפי
“פעילויות” וכללי עבודה כלליים:
- סינתזת RNA מתחילה ומסתיימת באתרים ספציפיים על הגנום.
- התחלה יכולה להיות עם פריימר או בלי פריימר.
- הכיוון הוא תמיד 3’←5’ (כמו ב-DNA).
- נאמר הבדל חשוב מול DNA-polymerase: לא תמיד הסינתזה תלויה בתבנית (דוגמה בהמשך: הוספת poly(A) בלי תבנית בהקשרים מסוימים).
דרכי התחלה
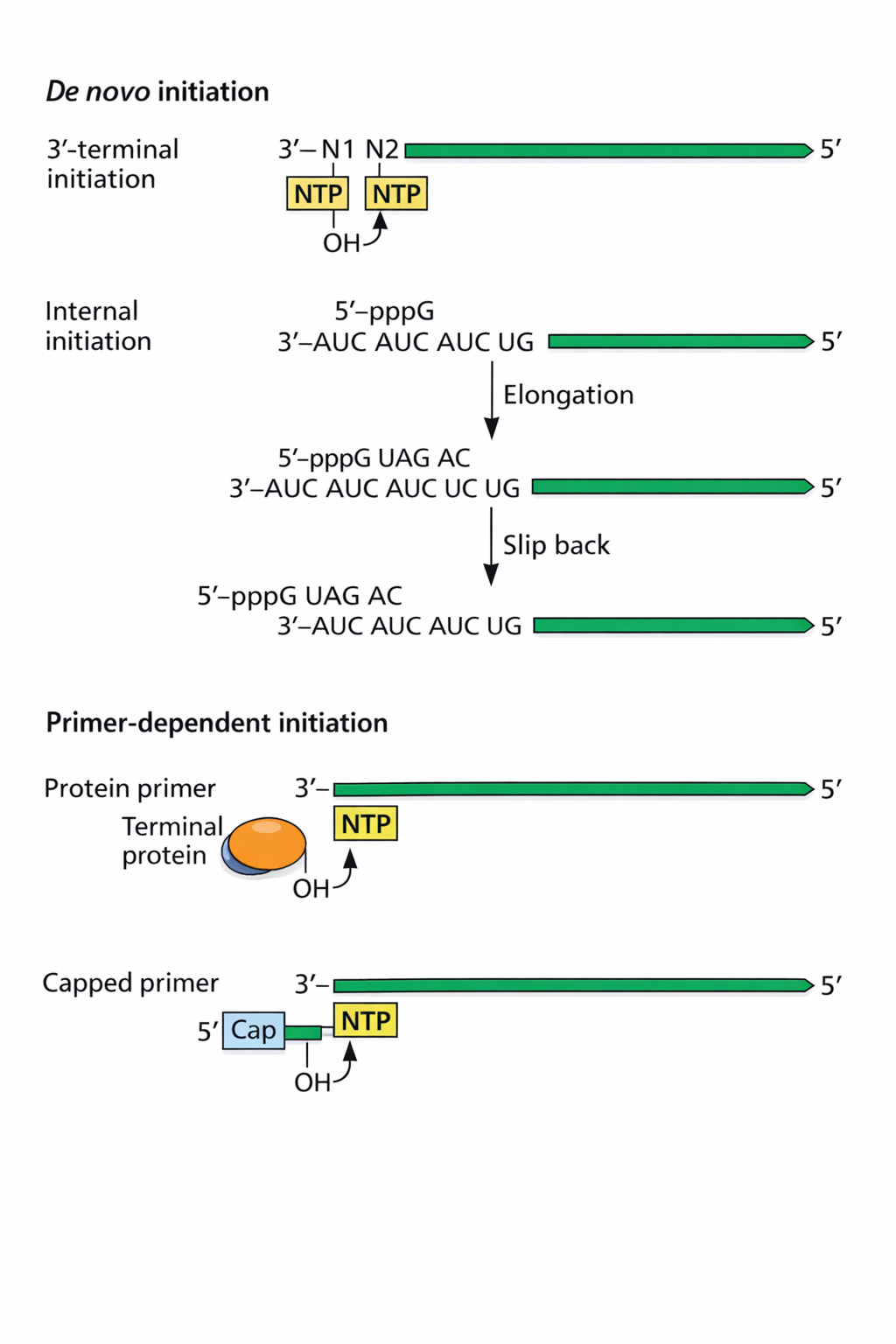
- דה-נובו מהקצה בלי פריימר.
- Slipping (“החלקה”) על רצף חזרתי בקצה: הפולימראז מסנתז כמה נוקלאוטידים, “מחליק אחורה”, וממשיך - וכך מתקבלת התחלה בלי פריימר קלאסי.
- שימוש ב-Terminal protein כפריימר: חלבון בקצה (לעיתים עם טירוזין) שקושר את הנוקלאוטיד הראשון, ולכן החלבון קשור קוולנטית לגנום.
- Cap snatching: “לגנוב” 5’ cap מ-mRNA תאי ולהשתמש בו כפריימר לתחילת הסינתזה.
4) סכמות הרפליקציה לפי סוג הגנום (איך עוברים פלוס↔מינוס)
האיור הבא מסכם את הלוגיקה: מי מייצר קודם mRNA, מתי נוצרת מולקולת המשלים, ומה ההבדל בין גנום רציף/סגמנטלי/דו-גדילי.
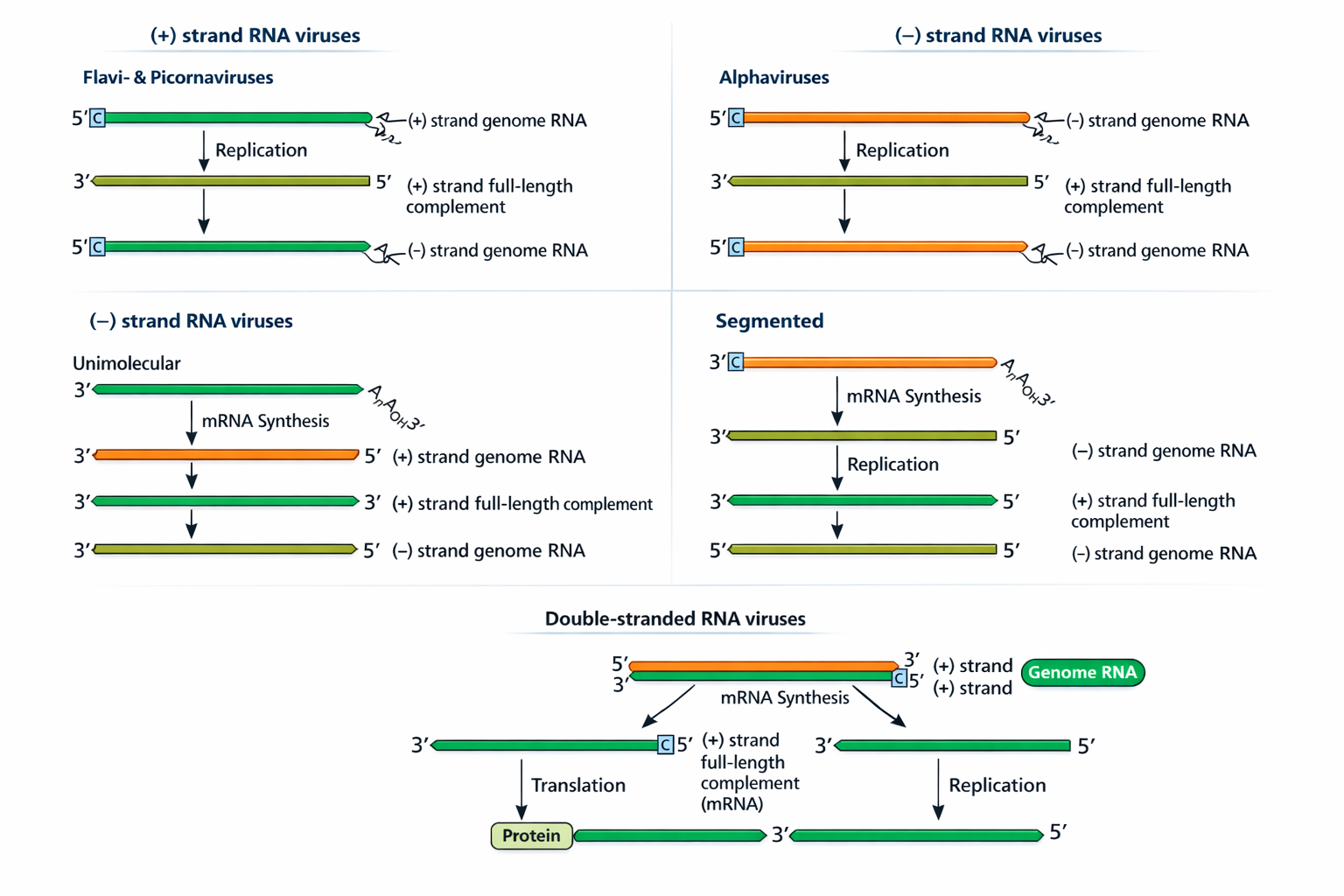
תקריב: ב־ssRNA(−) חייבים קודם ליצור +RNA (mRNA) לתרגום.
הלוגיקה:
- ב-+RNA: ה-RNA נכנס, משמש מיד לתרגום; בהמשך נוצרת מולקולת −RNA כטמפלייט לייצור הרבה +RNA (גם לתרגום וגם כגנומים לאריזה).
- הוא הזכיר מודל שבו ממינוס אפשר לייצר אורכים שונים של +RNA כדי לייצר חלבונים שונים (דוגמת אלפא-וירוס).
- ב-−RNA: קודם כל מייצרים +RNA (mRNA) לתרגום חלבונים; ובהמשך מייצרים +RNA מלא שישמש כתבנית לייצור −RNA חדשים שייארזו. נאמר שגם יכולים להיות גנומים סגמנטליים (כמה מולקולות RNA שונות).
- ב-dsRNA: מייצרים RNA פלוס (mRNA) מתוך ה-dsRNA (בדרך כלל כשהגנום נשאר מוגן בתוך הקפסיד), ובהמשך מסנתזים עליו את הגדיל המשלים ליצירת dsRNA חדש.
| סוג הגנום | מה יש בוויריון? | איך מתחילה רפליקציה? |
|---|---|---|
| +RNA | RNA פלוס (כמו mRNA), בדרך כלל לא עטוף בחלבון, לא חייב פולימראז | RNA נכנס ← מתורגם ← פולימראז מסנתז −RNA ← על תבנית ה−RNA מסנתזים הרבה +RNA |
| −RNA | RNA שלילי, עטוף בחלבון, חייב פולימראז | RNA נכנס ← פולימראז מסנתז +RNA (mRNA) ← מתורגם ← על תבנית ה+RNA מסנתזים הרבה −RNA |
| dsRNA | RNA דו-גדילי, לא עטוף בחלבון, חייב פולימראז | RNA נכנס ← פולימראז מסנתז +RNA (mRNA) מתוך ה-dsRNA ← מתורגם ← על תבנית ה+RNA מסנתזים הרבה dsRNA |
5) +RNA “קלאסי” - דוגמת פוליו-וירוס: פוליפרוטאין ופרוטאז
Group IV:
ssRNA(+)
נגיפים בעלי גנום רנ״א חד-גידלי חיובי. דוגמה מפורטת על פוליו-וירוס:
- מדובר ב-
+ssRNA. הוא “מכניס” RNA אחד, אבל צריך הרבה חלבונים. -
הפתרון: יצירת פוליפרוטאין - חלבון ארוך אחד שבתוכו יש פרוטאז.
הפרוטאז “חותך את עצמו” ואז חותך את שאר החלבון ליחידות פעילות (המרצה הדגיש שזה פרוטאז של הווירוס, לא “של התא”).
- זה טארגט תרופתי טוב, כי זה חלבון שאין לנו בגוף: עיכוב פרוטאז יימנע הבשלה/הדבקה.
התחלת רפליקציה בפוליו - VPg ו-poly(A)
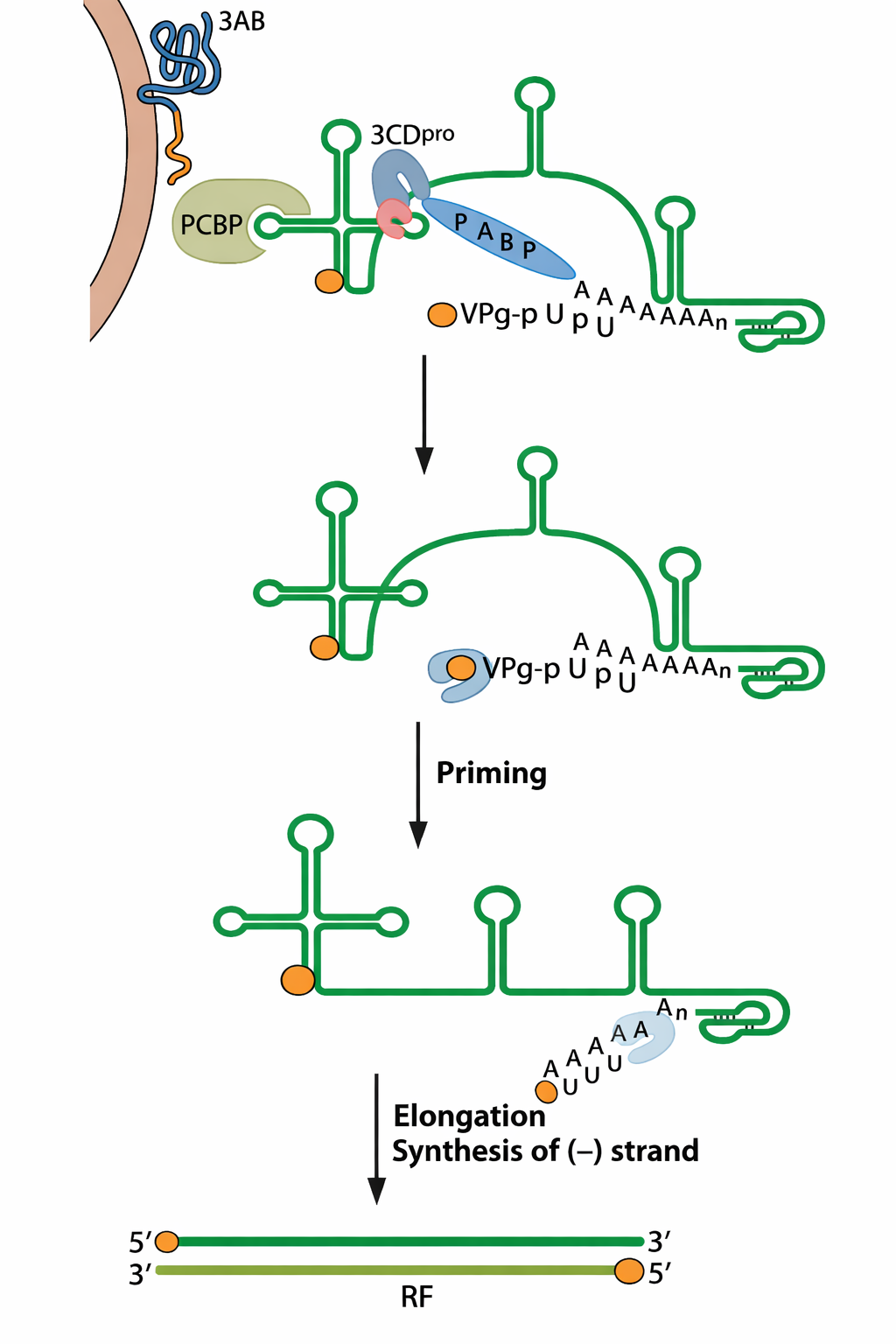
המרצה תיאר מנגנון שבו:
- יש חלבון קצה בשם VPg.
- מוסיפים לו שני U (יו-יו), וזה מאפשר היצמדות לקצה עם poly(A) ולהתחיל סינתזה.
- המרצה הדגיש שה-RNA לא “חוט ישר” אלא מתקפל, ושהקירוב בין קצוות יכול להיתמך ע״י חלבונים (כולל poly(A) binding protein), כדי לאפשר התחלה יעילה.
רצף שלבי ההדבקה של פוליו
- קפסיד נכנס לתא ומשחרר +RNA לציטופלזמה.
- הריבוזומים מתרגמים ← נוצר פוליפרוטאין.
- הפוליפרוטאין נחתך לחלבונים שונים (כולל פולימראז).
- הפולימראז מסנתז −RNA על תבנית ה-+RNA.
- על תבנית ה-−RNA מסנתזים הרבה +RNA: חלק לתרגום וחלק כגנומים לאריזה ושחרור.
כלי מחקר: אפשר לבצע טרנספקציה של RNA לתאים (גם בלי קפסיד), או להפוך RNA ל-cDNA, לקלון בפלסמיד, לשים פרומוטר, ואז התאים ייצרו RNA וממנו ייצרו ויריונים; כך אפשר ליצור מוטציות ולבדוק את השפעתן.
6) קורונה-וירוס (+RNA גדול) - תיקון טעויות, תוצרים באורכים שונים, ותרופות
תכונה ייחודית:
- הגנום ארוך מאוד (30,000~ בסיסים).
- בגלל ש-RNA פולימראז לרוב “לא מדויק”, גנום כזה היה מצטבר בו הרבה טעויות - לכן לקורונה יש אקסונוקלאז ויכולת תיקון (proofreading) שמקטינה טעויות (לא מבטלת לגמרי).
- המרצה הוסיף שזה אחת הסיבות שהוא “לא משתנה כל כך מהר”, והוא קישר זאת לכך ש”אולי” זה תרם ליכולת לפתח חיסון.
בנוסף לכך, דרך יצירת הרבה חלבונים היא לא רק פוליפרוטאין ענק, אלא גם יצירת מולקולות RNA באורכים שונים (באמצעות עצירות/סטופים), שכאשר הופכים אותן חזרה לפלוס מתקבלים mRNA שונים לחלבונים שונים.
תרופות לדוגמה
- Paxlovid: מעכב פרוטאז (המרצה הזכיר שני פרוטאזות חיוניות להבשלה, NSP3 ו-NSP5, ופקסלוביד מעכב פרוטאז וכך מעכב רפליקציה/התרבות).
-
Molnupiravir: נוקלאוטיד אנלוג שיכול “להתחבר גם ל-G וגם ל-A” ולכן משרה הרבה מוטציות עד שלא נוצרים ויריונים פעילים.
הפולימראזות התאית “לא יקפצו” עליו כי הוא שונה, בעוד הפולימראז הנגיפי “פחות אכפת לו” ולכן יכניס אותו.
7) מוטציות ב-RNA וירוסים
אומדן מספרי של מוטציות:
- אם RNA פולימראז נגיפי עושה טעות בערך כל 10,000 בסיסים,
- ואם גודל הגנום הוא בערך 10,000 בסיסים,
- אז בממוצע כל גנום חדש יכיל מוטציה אחת~.
המשמעות:
- “רוב המוטציות” יפגעו בווירוס ולכן הרבה נגיפים לא יהיו טובים,
- אבל חלק עשוי לתת יתרון (למשל התחמקות ממערכת החיסון).
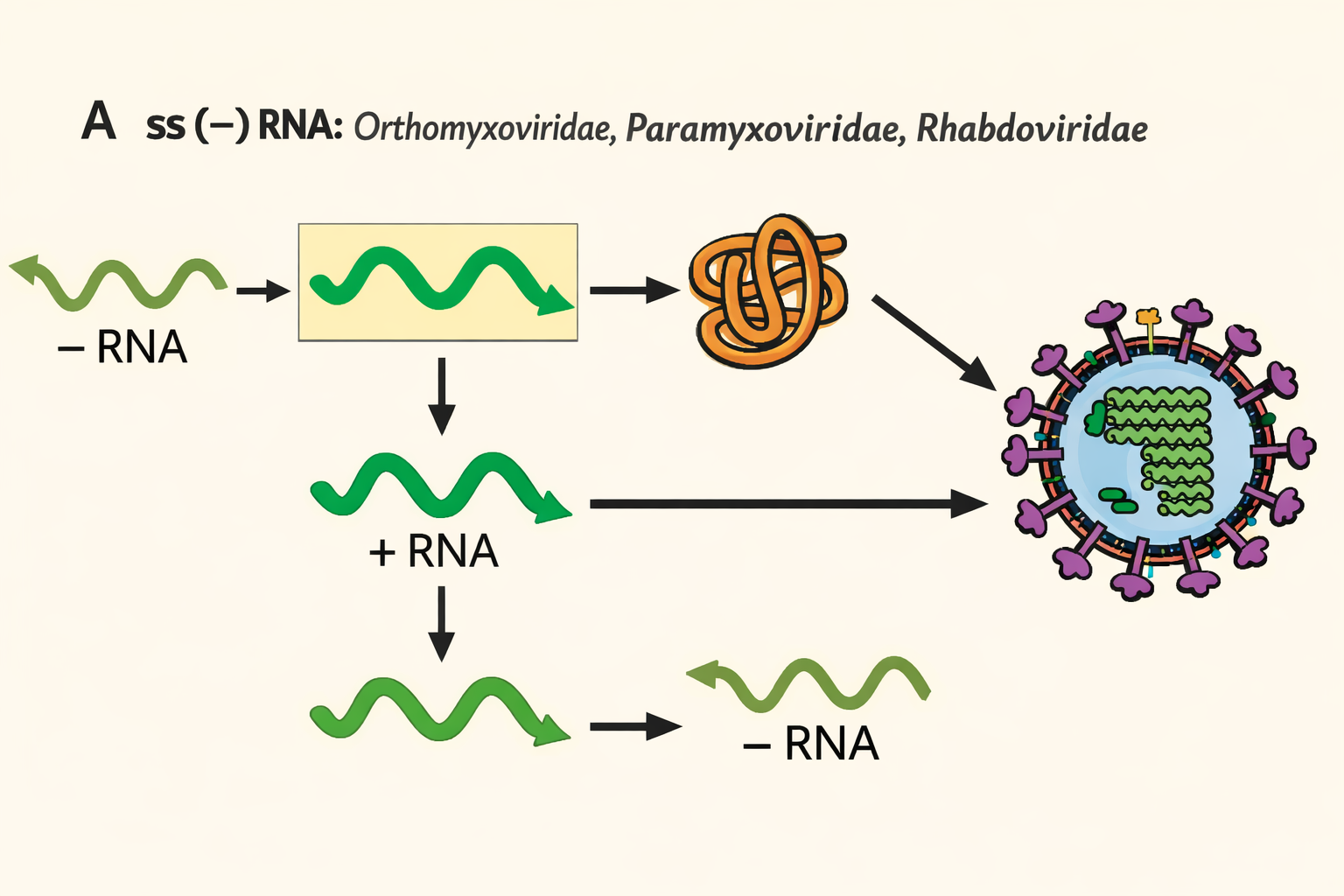
8) ssRNA(-): גנום אחד ארוך מול סגמנטים, ודוגמת אינפלואנזה
−RNA לשתי תצורות:
- מולקולה אחת ארוכה (הוא נתן רשימת דוגמאות כמו חצבת ועוד משפחות).
- סגמנטים: אינפלואנזה - 8 סגמנטים שונים.
הוא תיאר צילום EM שבו “סופרים” 8 סגמנטים בתוך ויריון, וגם אמר במפורש:
- האריזה היא אקראית, ולכן רק בערך 1 מתוך 400 ויריונים שיוצאים מכיל את כל הסט הנדרש כדי להיות אינפקטיבי.
9) איך −RNA מייצר כמה mRNA שונים? (עצירה, poly(A), ולא עוזבים את הטמפלייט)
המרצה תיאר מנגנון שבו הפולימראז:
- מתחיל מהקצה ומסנתז mRNA ראשון.
- מגיע לאזור intergenic עם רצף poly(U) שגורם לו לעצור.
- אז הוא מבצע polyadenylation “ללא תבנית”: חוזר/מחליק ומוסיף הרבה A עד סדר גודל של ~200 A.
- משחרר את ה-mRNA, אבל נשאר על אותו טמפלייט, ומתחיל את ה-mRNA הבא.
הוא קשר זאת לרעיון רגולטורי: קיים חלבון (המרצה כינה אותו “N”) שקושר את הגנום. כשהרמה שלו נמוכה, נוטים יותר לייצר תוצרים קצרים (mRNA לחלבונים); כשהרמה עולה, עוברים יותר לכיוון של שכפול גנום מלא.
10) אינפלואנזה - למה נכנסת לגרעין ומה זה Cap snatching בפועל?
למרות שברוב וירוסי RNA- “הכול קורה בציטופלזמה”, אינפלואנזה נכנסת לגרעין.
מחזור החיים של אינפלואנזה כולל את השלבים הבאים:
- הגנומים משתחררים בציטופלזמה כשהם עטופים בחלבון עם NLS שמכניס אותם לגרעין.
- בגרעין הווירוס עושה cap snatching: לוקח mRNA תאי, חותך ממנו את ה-cap עם רצף קצר, ומשתמש בו כפריימר ליצירת mRNA ויראלי.
- ה-mRNA יוצא לציטופלזמה לתרגום.
- חלבונים חוזרים לגרעין לעטוף גנומים חדשים ולהרכבה.
יש בקרות כדי שהחיתוך לא יקרה “סתם”: רק כאשר גם קצוות הגנום הוויראלי (5’ וגם 3’) נמצאים בקומפלקס, אז מתאפשר זיהוי הקאפ וחיתוך.
לבסוף ה-mRNA הוויראלי מקבל:
- cap שנגנב מהתא,
- וגם poly(A) שנוסף כשמגיעים לרצף poly(U) שמעודד polyadenylation.
ייצוא גנומים מהגרעין
- החלבון שעוטף את הגנום מכיל NLS (כניסה),
- ובהמשך שני חלבונים נקשרים אליו, ממסכים את ה-NLS, ולשניהם יש NES ← כך נוצר נוקלר אקספורט.
11) אנטיגנים של אינפלואנזה ושני סוגי שינוי עיקריים: Drift ו-Shift
מערכת החיסון “רואה” בעיקר את חלבוני הממברנה - אלו האנטיגנים שמאפיינים זני שפעת (H/N):
- HA (המגלוטינין)
- NA (נויראמינידאז)
שלוש דרכי שינוי עיקריות, עם דגש על השתיים הראשונות:
- Antigenic drift - שינוי איטי מצטבר ממוטציות.
- Antigenic shift - בגלל שיש 8 סגמנטים: הדבקה של שני וירוסים שונים באותו תא ← אריזה אקראית ← קומבינציה חדשה לגמרי.
- הוא הזכיר גם אפשרות של קפיצה/רקומבינציה במהלך רפליקציה.
חזירים הם ”מערבבים” אפשריים (יכולים להידבק גם בעופות וגם בבני אדם), אבל לא רק.
12) היסטוריה קצרה: השפעת הספרדית 1918 ומה הדיון סביב פרסום הרצף
לכאורה ”פחות חשוב לזכור היסטוריה”, אבל צריך לדעת מה זאת השפעת הספרדית:
- 1918: סדר גודל של חצי מיליון בארה״ב ו-20-50 מיליון בעולם
- ייחוד: פגעה קשה גם בצעירים, לא רק באוכלוסיות סיכון רגילות.
לאחר מכן:
- הפיקו רצפים מגופות בקבורה, עשו ריצוף, והיה דיבייט האם לפרסם (חשש מביו-טרור מול צורך מדעי).
- הרצף פורסם, וב-CDC יצרו את הווירוס מחדש באמצעות הזמנת הרצף כ-DNA, בניית פלסמידים, ואז יצירת הווירוס במעבדה; בניסויי עכברים הוא היה קטלני מאוד.
13) dsRNA - “לא לחשוף” כדי לא להפעיל מיד את ההגנה התאית
dsRNA “מיד מפעיל” מנגנוני הגנה תאיים, ולכן:
- הווירוסים הללו לרוב לא חושפים את הדאבל-סטרנד לתא.
- לאחר כניסה: המעטפת החיצונית יורדת, אבל נשאר קפסיד חלקית פתוח שמאפשר כניסת נוקלאוטידים.
- בתוך הקפסיד פולימראז מייצר +RNA,
- וה-mRNA יוצא דרך “חורים” בקפסיד לציטופלזמה.
היתרונות של הגישה הזו:
- ריכוז המערכת סביב הגנום בתוך הקפסיד (הפולימראז לא “מחפש” RNA בתא),
- והתחמקות מהפעלת ההגנה לפני שיש לווירוס חלבונים שמסוגלים לעכב אותה.
14) בקרה ופירוק של mRNA בתא (כדי להבין למה cap חשוב)
סקירה כללית של פירוק mRNA בתא:
- אם מסירים cap (decapping) ← קומפלקס Xrn1 מפרק מ-5’ ל-3’.
- בצד 3’ poly(A) מתקצר עם הזמן; כשהוא קצר מספיק ← exosome מפרק מ-3’ ל-5’.
המטרה כאן הייתה להראות ש-cap מגן על RNA בסיטופלזמה.
דוגמאות לווירוסים שמתערבים:
- חלבון שמזהה רצף אחרי cap בתאי ומוביל לחיתוך/דגרדציה.
- ב-Vaccinia virus תואר חלבון שעושה decapping ל-mRNA תאיים.
15) “Host shutoff” בפוליו - איך הווירוס מכבה תרגום תאי ומשאיר רק את שלו
ניסוי תיוג חלבונים לאחר הדבקה בפוליו:
- לפני הדבקה יש הרבה חלבונים תאיים.
- לאחר 7-5 שעות: כמעט לא נוצרים חלבונים תאיים, ונוצרים בעיקר חלבוני וירוס.
המנגנון:
- תרגום תאי תלוי cap דורש initiation factor שמכיר את ה-cap.
- 2A protease של פוליו חותך את הפקטור הזה ← אין יותר cap-dependent translation.
- לפוליו יש רצף/מבנה בשם IRES שמאפשר גיוס ריבוזום ללא תלות בקאפ.
- המרצה ציין ש-IRES פחות יעיל מהתחלה רגילה מה-cap, אבל אם אין cap-dependent בכלל, אז הווירוס “מנצח”.
גם ב-Hepatitis C יש מנגנון דומה (מבנה שמאפשר תרגום בלי cap).
16) מעבר ל-DNA viruses: רפליקציית DNA, מי משתמש במערכת התאית ומי מביא מערכת משלו
לעקרונות DNA polymerase:
- התחלה באתרי Origin of replication.
- DNA סינתזה תמיד עם פריימר (למעט חריג בבקטריופאג’ים שלא נכנס אליו).
- כיוון 5’←3’, מנגנון semi-conservative, ותמיד תלוי תבנית.
עקרון ארגוני:
- DNA viruses קטנים משתמשים במערכת הרפליקציה של התא, אבל מספקים חלבון שמגייס אותה לגנום שלהם. דוגמה: SV40 עם Large T antigen.
- DNA viruses גדולים (כמו הרפס) מביאים יותר מרכיבים של המערכת שלהם כשהם בליטיק סייקל.
הרעיון הוא “מפעלי וירוס”/אזורים מרוכזים בתא שבהם נוצרת רפליקציה ויראלית.
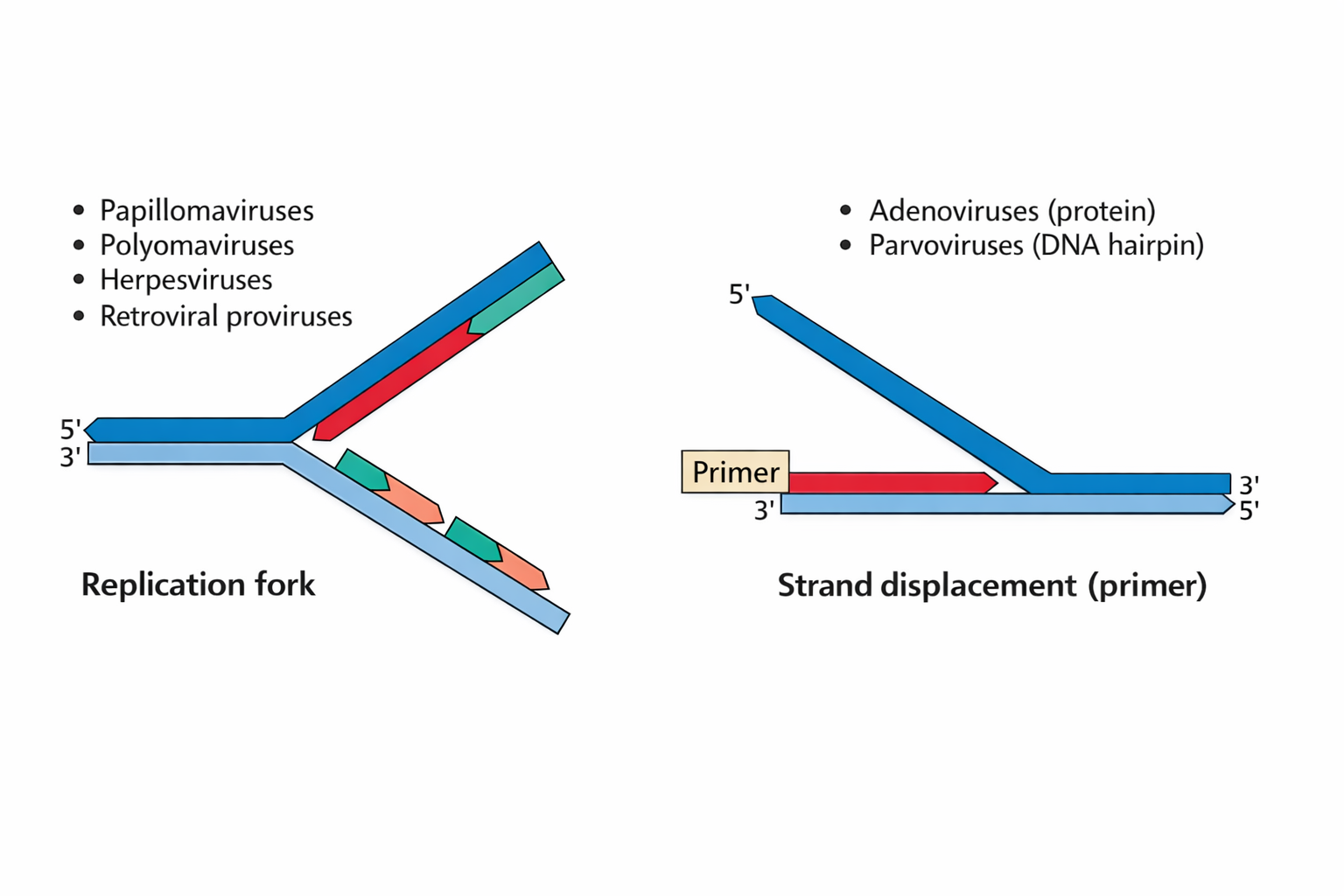
17) שני מודלים לרפליקציית DNA ויראלית: Replication fork מול Strand displacement
שני מודלים עיקריים לרפליקציה של DNA ויראלי:
-
Replication fork: כמו ברפליקציה תאית (leading/lagging, קטעי אוקזאקי).
דוגמאות: Papilloma, Polyoma (SV40), Herpes, וגם רטרווירוס “אחרי אינטגרציה” כי אז הוא משתכפל עם הגנום התאי.
-
Strand displacement: מסנתזים גדיל אחד והגדיל השני “נדחף הצידה”.
דוגמאות: Adenovirus ו-Adeno-associated virus (AAV).
SV40 - Large T antigen
Large T antigen:
- נקשר ל-Origin,
- פותח תגדילים,
- RPA נקשר ל-ssDNA,
- ואז מגויסת מערכת הרפליקציה התאית.
AAV - המנגנון הייחודי עם hairpin ends
כאן הטריק הוא שקצוות ה-ITR מתקפלים ל-hairpin ויוצרים 3’OH שמתפקד כמו פריימר.
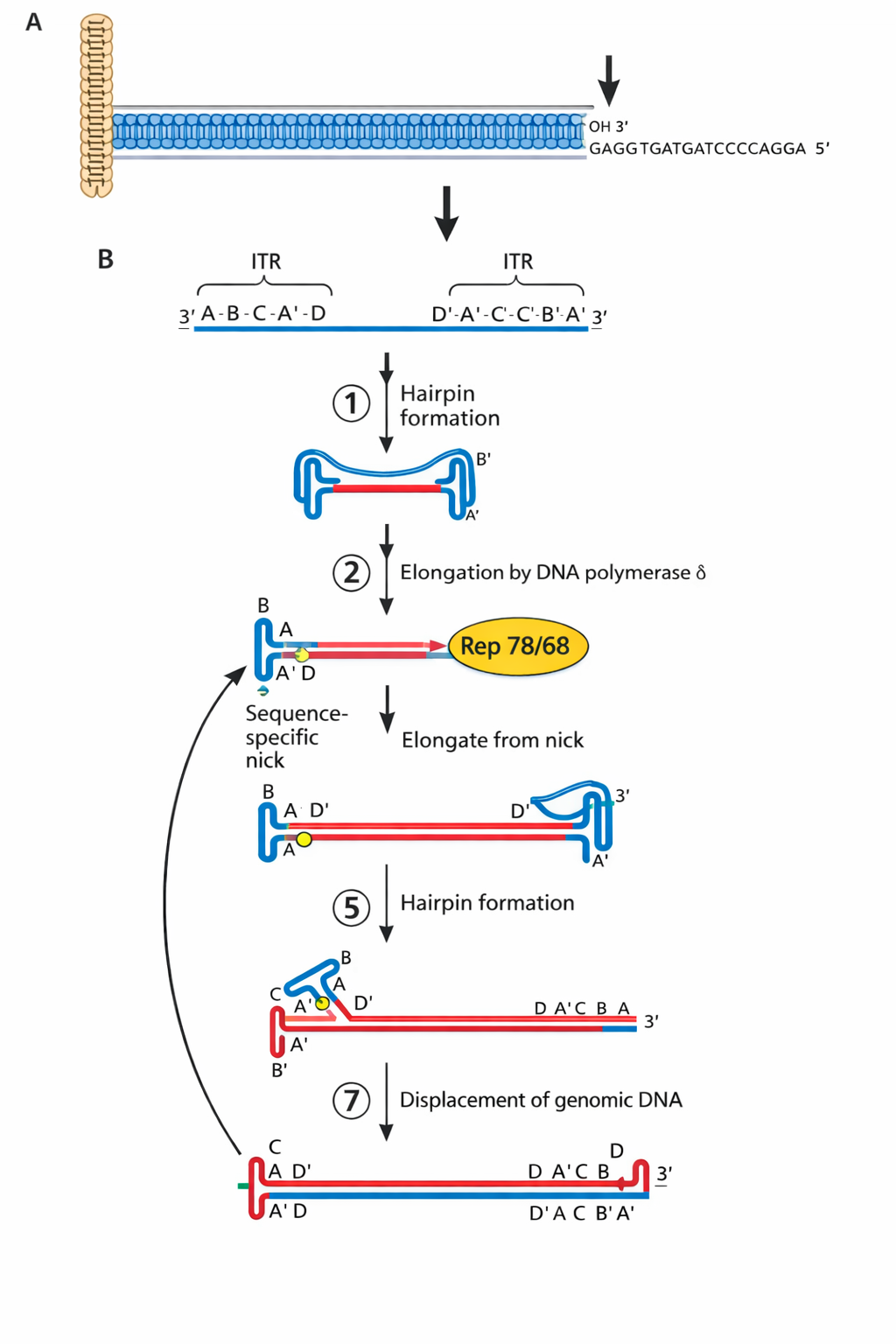
המנגנון:
- הגנום נכנס כ-ssDNA עם stem-loop/hairpin בקצוות שיוצרים קצה 3’ שנראה כמו פריימר ← הפולימראז התאי יכול להאריך ולהפוך ל-dsDNA.
- לרפליקציה הווירוס מקודד שני חלבונים (Rep 78/68) עם שתי פעילויות:
- אנדונוקלאז (חותך ליד ה-stem-loop),
- הליקאז (פותח את המבנה).
- לאחר חיתוך מתקבל קצה 3’ ← הפולימראז התאי מסנתז, תוך strand displacement, וחוזר חלילה.
- המרצה הדגיש שאין צורך בפריימר חיצוני כי ה-hairpin מספק קצה 3’ מתאים.
שאלה מסכמת: AAV הוא ssDNA virus, רפליקציה ב-strand displacement.
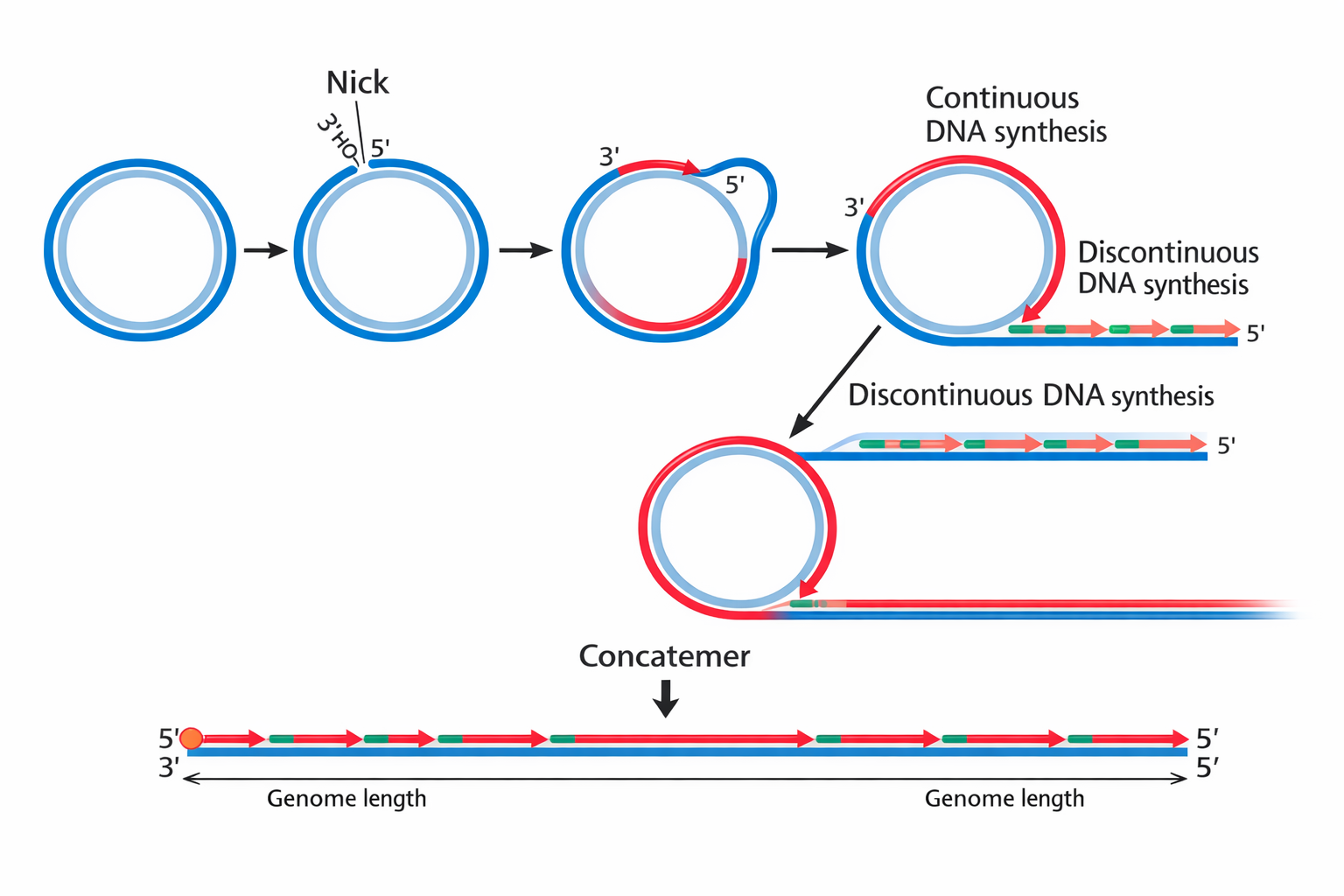
Rolling circle (הרפס)
מנגנון נוסף:
- חלבון עושה “nick” בגדיל אחד,
- הפולימראז מאריך סביב מעגל שוב ושוב,
- נוצר concatemer ארוך עם הרבה עותקים של הגנום ברצף.
18) הרכבה (Assembly), הבשלה (Maturation), ואריזת גנום
עוברים מהעתקה לבנייה של ויריונים.
שתי גישות להרכבה
- Assembly line (כמו מפעל): מרכיבים תתי-מבנים בסדר מוגדר עם “בקרת איכות”; אם שלב לא תקין - לא מתקדמים.
- Capsid self-assembly: בריכוז גבוה חלבונים מתארגנים לבד; אם אין גנום מתקבל קפסיד ריק, ואם יש גנום הוא נארז.
שימוש בצ’פרונים ופיגומים
- המרצה אמר שווירוסים משתמשים ב-chaperones תאיים לקיפול נכון.
- בקפסידים גדולים (הרפס) יש חלבוני פיגום בתוך הקפסיד. אחרי שהקפסיד שלם:
- פרוטאז מפרק את הפיגומים,
- מתפנה מקום לגנום להיכנס.
פוליפרוטאין והבשלה מאוחרת (דוגמת רטרווירוס/דמוי-HIV)
העיקרון:
- רכיבים מגיעים לממברנה כ-פוליפרוטאין (ככה “חבילה אחת” מביאה הרבה פונקציות).
- יש סיגנל מיקוד לממברנה כמו myristoylation שמביא את הפוליפרוטאין לאזור ההרכבה.
- הוויריון יוצא עדיין “לא בשל”, ורק לאחר השחרור הפרוטאז מופעל, חותך, ואז מתקבלת הבשלה והווירוס הופך אינפקטיבי.
- בנוסף כך מבטיחים שגם אנזימים חיוניים (כמו רוורס טרנסקריפטאז/אינטגראז בהקשר הזה) יהיו בפנים כי הם היו חלק מהפוליפרוטאין.
אריזת DNA בהרפס - Portal protein ולחץ גבוה
במנגנון של הרפס:
- יש portal protein בקפסיד שדרכו מכניסים DNA.
- הגנום מגיע כ-concatemer; מזהים terminal repeats:
- פעם אחת כסימן “כאן מתחיל גנום”,
- ופעם נוספת כסימן “הגענו לאורך של גנום אחד” ואז חותכים.
- המרצה אמר שה-DNA נדחס בלחץ של בערך 20 אטמוספרות, וזה דורש אנרגיה תאית.
19) יציאה מהתא - אינפלואנזה, הרפס, ווקסיניה
אינפלואנזה
- חלבוני מעטפת (כמו HA) נכנסים ל-ER עם סיגנל, עוברים קשרי SS ומודיפיקציות, עוברים גולג’י ומגיעים לממברנה.
- הגנום עטוף בחלבון, מצטרפים מטריקס וממברנה, וב-budding משתחרר הוויריון.
הרפס - Nuclear egress
המרצה הדגיש שהקפסיד גדול מדי כדי לצאת דרך nuclear pore, לכן:
- הקפסיד “קורע”/עובר תהליך יציאה אגרסיבי דרך מעטפת הגרעין (nuclear egress),
- עובר דרך ER ואז גולג’י,
- מצטרפים חלבוני tegument (בין קפסיד לממברנה),
- משתחרר בבועית החוצה.
Vaccinia
- הגנום בציטופלזמה; הווירוס יכול להשתחרר עם ממברנה אחת או לעבור דרך גולג’י ולקבל עוד ממברנה.
- ייחודי: גורם לתא ליצור “זרוע” מבוססת אקטין שמקדמת שחרור ויריונים מקצה הזרוע.
20) לא כל ויריון הוא אינפקטיבי
בסוף המרצה חזר על הרעיון שהאריזה לא תמיד מושלמת:
- בצילומי EM של אינפלואנזה רואים שלפעמים נארזים פחות מ-8 סגמנטים.
- לכן רק חלק קטן מהחלקיקים שיוצאים הם באמת אינפקטיביים (המרצה נתן 1/400).
נקודות עיקריות לסיכום
שלושה עוגנים חשובים:
- חובה/לא חובה להביא פולימראז בתוך הוויריון נקבע בעיקר לפי סוג הגנום (פלוס/מינוס/dsRNA).
- טריקים של וירוסים לשלוט בתרגום (Host shutoff, IRES, cap snatching) - זה כלי קריטי לשרוד בתוך התא.
- הרכבה/אריזה/הבשלה הן שלבים “מכניים” אבל עם רגולציה, בקרת איכות, ולעיתים הבשלה תלויה פרוטאז - וזה גם בסיס לתרופות.
וירולוגיה 7 - מה וירוסים עושים לתא ומה התא עושה בחזרה
תאריך: 07/12/20251) רעיון־על: מי “מטיס” את התא?
המרצה תיאר את התא כמו מערכת עם “טייס אוטומטי” שמחזיק הומאוסטזיס: התא קולט את הסביבה ומשנה ביטוי גנים בהתאם. כשהווירוס נכנס, הוא מנסה “להשתלט על ההגה”: הוא מפעיל סיגנלים שמתאימים לו, מדכא סיגנלים שמפריעים לו, ומכוון את התא לשרת את צרכי ההתרבות הוויראלית.
2) מה הווירוס משנה בתא (הצד של הווירוס)
א. סיגנלינג ותא-מחזור
מיד אחרי הדבקה מתרחש cell signaling. הווירוס:
- ידחוף סיגנלים שעוזרים לו (למשל כאלה שמקדמים חלוקה).
- יעכב סיגנלים שלא טובים לו, במיוחד מוות תאי מתוכנן (Apoptosis).
ב. שינוי ביטוי גנים
המרצה הבחין בין שני מצבים:
-
Lytic infection (מחזור ליטי):
הווירוס “מכבה” את התא לטובת עצמו:
- עוצר/מקטין סינתזות תאיות.
- יכול למנוע יציאת mRNA מהגרעין לציטופלזמה.
- יכול לקדם דגרדציה של mRNA.
-
Latency (לטנטיות): כאן הווירוס רוצה להישאר לאורך זמן, ולכן לא מכבה את התא באופן גורף, אלא עושה שינויי ביטוי גנים ממוקדים: חלק עולים וחלק מושתקים, כדי להתאים את התא ל”אירוח” ממושך.
ג. מטבוליזם ותשתיות שעתוק/רפליקציה
הווירוס יכול לשנות:
- צריכת גלוקוז.
- ליפיד מטבוליזם. מטרת השינויים: יותר אנרגיה ומשאבים, יצירת replication centers / replication factories, ייצור ויריונים והרכבה/שחרור בהמשך.
ד. ארגון הגרעין והציטופלזמה
הווירוס מסוגל “לשפץ” את מבנה התא והגרעין כדי לבנות “מפעלים” לרפליקציה.
3) למה הדבקה לא תמיד נראית אותו דבר?
המרצה הדגיש שכל הדבקה “חדשה” לא צפויה, כי היא תלויה ב:
- איזה נגיף הגיע.
- דרך החדירה (עור / עיניים / נשימה וכו’).
- מינון נגיפי (כמה חלקיקים הגיעו).
- מי המאכסן (מבוגר עם מערכת חלשה, ילד עם מערכת לא בשלה).
4) דוגמת מסלול הדבקה: Ectromelia virus בעכבר
המרצה נתן דוגמה למהלך הדבקה מדורג:
- כניסה דרך חתך בכפות הרגליים (פצע).
- רפליקציה מקומית.
- מעבר לבלוטת לימפה קרובה.
- וירמיה ראשונית (דם) ← הגעה לאיברים כמו כבד וטחול.
- רפליקציה באיברים.
- וירמיה שניונית בכמות גבוהה.
- הגעה לעור ← פצעים/כיבים שיכולים לגדול ולהוביל למוות בעכבר.
הוא ציין שזה poxvirus, מאותה “משפחה” כללית בהקשר של smallpox/vaccinia. זה DNA virus גדול שנשאר בציטופלזמה.
5) למה הדבקה יכולה “להיכשל”?
המרצה מנה כמה סיבות אפשריות:
- הגיעו מעט נגיפים, ומתוך כלל החלקיקים רק חלק קטן באמת אינפקטיבי.
- הנגיף נשאר מחוץ למאכסן ולא “הצליח לתפוס”.
- הוא נספח אבל לתאים מתים (אין רפליקציה).
- הוא נקשר לתא לא רגיש.
- הוא נכנס לתא אבל מתפרק בליזוזום.
6) שכבות ההגנה של הגוף/התא (הצד של המאכסן)
שכבה 1: מחסומים פיזיים-כימיים (Holistic barriers)
- עור כמחסום.
- מוקוס (לוכד פתוגנים; יש בו גם נוגדנים ואנזימים).
- דמעות (הוזכר ליזוזים).
- קיבה: pH נמוך + אנזימים שמפרקים.
שכבה 2: Intrinsic immunity (מוכנה מיד)
המרצה הזכיר מערכות תאיות כמו:
- microRNA / siRNA / CRISPR (הוזכרו כמערכות מורכבות שיילמדו בהמשך).
- Apoptosis
- Autophagy
- אנטי-ויראל פרוטאינס (בהמשך נתן דוגמאות ספציפיות כמו ZAP, PKR ועוד).
שכבה 3: Innate response (דורשת “התחממות”)
זו תגובה של דקות-שעות, כי צריך ביטוי גנים. כאן נכנסים בעיקר:
- Interferons (ציטוקינים שמשרים מצב אנטי-ויראלי בתא ובשכנים).
שכבה 4: Adaptive immunity (איטית יותר)
מעורבים תאי B ו-T ונוגדנים, אך זה לוקח שבועות עד שנבנית תגובה מלאה.
7) דוגמה שמדגישה “דרך הדבקה משנה הכול”: Vaccinia בארנבות
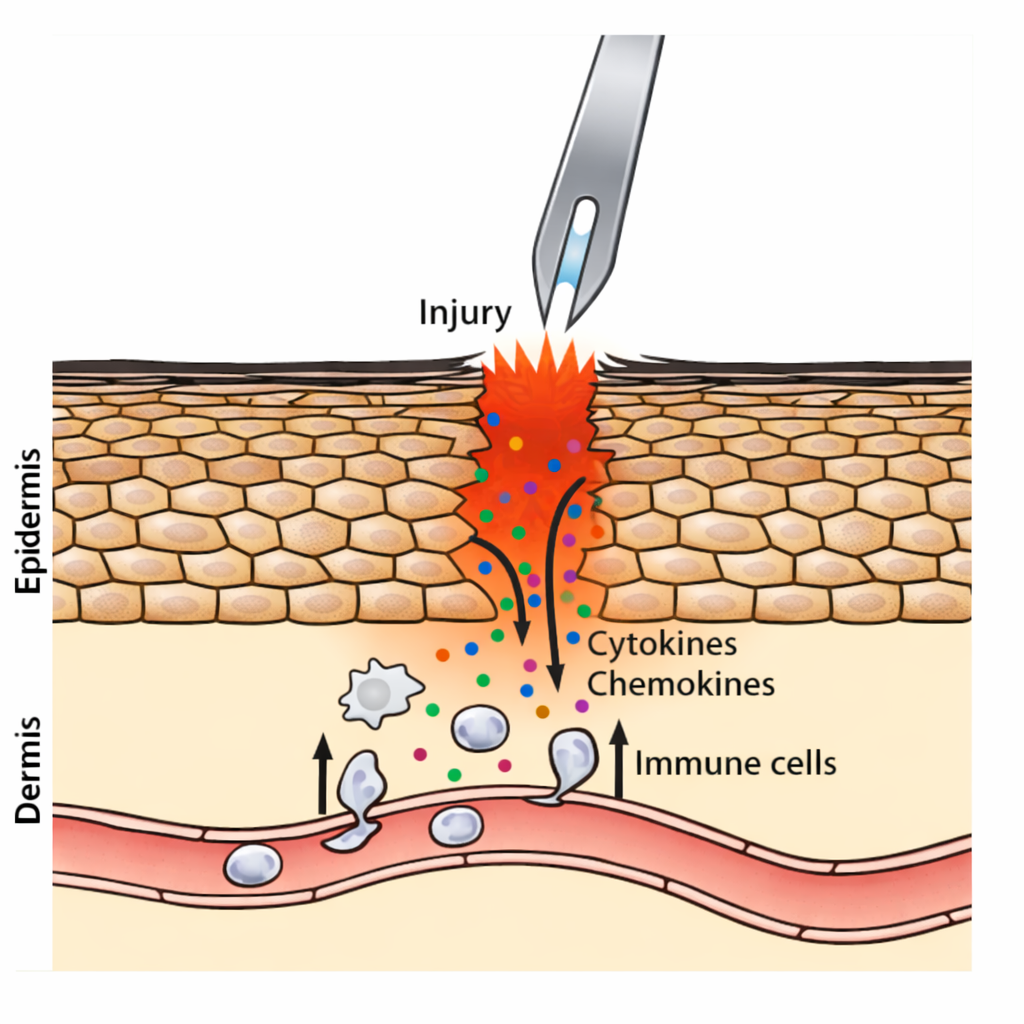
השוואה בין שתי דרכי חשיפה לאותו נגיף:
- הזרקה תת-עורית ← אחרי 8~ ימים כל הארנבות מתות.
- כניסה דרך פציעה בעור ← נוצרת דלקת מקומית, קרישה וסגירת כלי דם, תאים בולעניים מגיעים, מציגים אנטיגן בלימפה ← הארנבות לא מתות ואף מפתחות חיסון להמשך.
המסר: פצע יוצר גם בידוד של ההתפשטות וגם הפעלה יעילה של מערכת החיסון.
8) ספציפיות של שפעת: למה בעיקר בדרכי הנשימה העליונות?
המרצה חזר על מנגנון סביב חלבון המעטפת HA:
- כשהנגיף יוצא מהתא, HA הוא במצב לא פעיל (הוזכר כ-HA0).
- כדי להפוך פעיל, צריך חיתוך ע”י אנזים.
- רק בתאים מסוימים בדרכי הנשימה העליונות (Club cells) יש הפרשה של האנזים הזה.
לכן השפעת לרוב נשארת ממוקדת שם ולא מתפשטת לכל הגוף.
המרצה גם תיאר מצב מסוכן:
- מוטציה בשפעת שהכניסה שיירים בסיסיים כך שהחיתוך מתבצע ע”י אנזים נפוץ בהרבה תאים ← הנגיף נמצא גם בטחול/כבד/ריאות/כליות/מוח. הוא תיאר אירוע בלול תרנגולות שהוביל להשמדה מחשש להדבקה בבני אדם.
9) איך התא “מבין” שיש הדבקה ומדליק אזעקה?
המרצה נתן שתי דרכים עיקריות:
א. “משהו לא לפי התוכנית”
שינויים ב:
- מטבוליזם
- סינתזת חלבון
- cell cycle
התא “מרגיש” שזה לא הרוטינה התקינה.
ב. חיישנים שמזהים “לא-עצמי” (Pattern Recognition Receptors)
המרצה הדגיש בעיקר:
- TLRs: על ממברנת התא או בתוך אנדוזום (רלוונטי כי הרבה וירוסים נכנסים באנדוציטוזיס). הדגש היה לא על לזכור מספרים, אלא להבין שיש חישה של חלבונים ונוקלאיק אסידס ויראליים.
- RIG-I (ציטופלזמי): מזהה למשל dsRNA או RNA בלי cap/עם קצה 5’ פוספט.
- cGAS-STING: DNA בציטופלזמה מפעיל cGAS ← יצירת שליח שניוני (cGAMP) ← STING נע ל-Golgi ומפעיל מסלולי תגובה.
- הוזכרו גם חיישנים נוספים (כולל כאלה יותר “חיידקים/פטריות” בהקשר CLR).
מה יוצא מהחישה? המסר הקריטי: זה מוביל להפעלת טרנסקריפשן פקטורס (הוזכרו IRF3/IRF7 וגם NF-κB) ← ביטוי אינטרפרונים.
10) אינטרפרון (Interferon): איך זה עובד ולמה זה גם “עונש” לתא?
מה זה אינטרפרון? (IFN)
קבוצת ציטוקינים שמופרשים מתאים מודבקים (וגם ממערכת החיסון), נקלטים באותו תא ובתאים סמוכים, ומפעילים כמעט 1000~ גנים (“interferon-stimulated genes”). המרצה הדגיש שאי אפשר לבטא אותם תמיד כי זה רעיל לתא (toxic).
הניסוי ההיסטורי שהוביל לגילוי אינטרפרון
תצפית משנות ה-50:
- מדביקים תאים בווירוס שעבר UV inactivation (לא יכול להתרבות אבל עדיין “נראה” לתא).
- לוקחים את המדיום שבו התאים היו (רק מה שהתאים הפרישו).
- מעבירים את המדיום לתאים אחרים, נותנים זמן (כי צריך ביטוי גנים), ואז מדביקים.
- התאים החדשים מוגנים ← היה “משהו שמפריע להדבקה” ← Interferon.
סוגי אינטרפרונים
- Type I: IFN-α (בעיקר מתאים של מערכת החיסון כמו דנדריטיים), IFN-β (יכול להיות מהרבה תאים מודבקים).
- Type II: IFN-γ (הוזכר שמופרש ע”י NK ותאי T מופעלים, וגם בהקשר מקרופגים).
- Type III: הוזכר שיש גם קבוצה כזו (בלי להיכנס לפרטים).
מסלול האיתות (העיקר)
קישור לרצפטור ← דימריזציה ← JAK1 ← פוספורילציה של STAT ← כניסה לגרעין ← הפעלת ISGs.
מטפורה: “כיבוי שריפה”
המרצה תיאר את זה כמו ליצור “אזור חיץ” סביב מוקד ההדבקה: התאים מסביב נכנסים למצב אנטי-ויראלי כדי לעצור התפשטות.
למה זה גורם לנו להרגיש חולים?
אינטרפרונים/ציטוקינים גורמים:
- חום, צמרמורות, הרגשה רעה (“flu-like symptoms”).
דגש: לא הנגיף עצמו “עושה” את התחושה, אלא תגובת הגוף.
בעבר, היו טיפולים באינטרפרון חודשים ארוכים עם סבל משמעותי.
איך הגוף “מוריד את הווליום” אחרי שהכול נגמר?
הוזכר גן כמו SOCS (interferon-responsive) שתפקידו לעכב את סיגנל האינטרפרון כדי לחזור לשגרה.
11) דוגמאות לכלים אנטי-ויראליים שהאינטרפרון מעלה (ISGs)
המרצה נתן קשת של “נקודות עצירה”:
- חסימת כניסה או חסימת כניסת הגנום לגרעין.
- יצירת מוטציות בווירוס: APOBEC.
- עיכוב תרגום: PKR ← פוספורילציה של eIF2 ← עצירת cap-dependent translation.
- דגרדציה של RNA חריג: ZAP (זיהוי CpG גבוה ב-RNA).
- עיכוב assembly ושחרור: Tetherin (דוגמה מרכזית).
- זיהוי החלבון: האיור מתמקד בחלבון PKR (שמופיע בכותרות ובתוך השרטוט).
- המנגנון: האיור מראה כיצד PKR, שהוא בדרך כלל לא פעיל (Inactive), מזהה dsRNA (רנ”א דו-גדילי, סימן מובהק לנוכחות נגיפית) או מופעל ע”י חלבון עקה (PACT).
- התוצאה: האיור מראה שבסוף התהליך ה-PKR עובר זרחון (הוספת P, או Autophosphorylation). זהו בדיוק השלב ש”דורך את הנשק” ומאפשר ל-PKR לבצע את מה שכתוב בסיכום: לעצור את ייצור החלבונים בתא כדי למנוע מהווירוס להתרבות.
Tetherin + דוגמה עם HIV
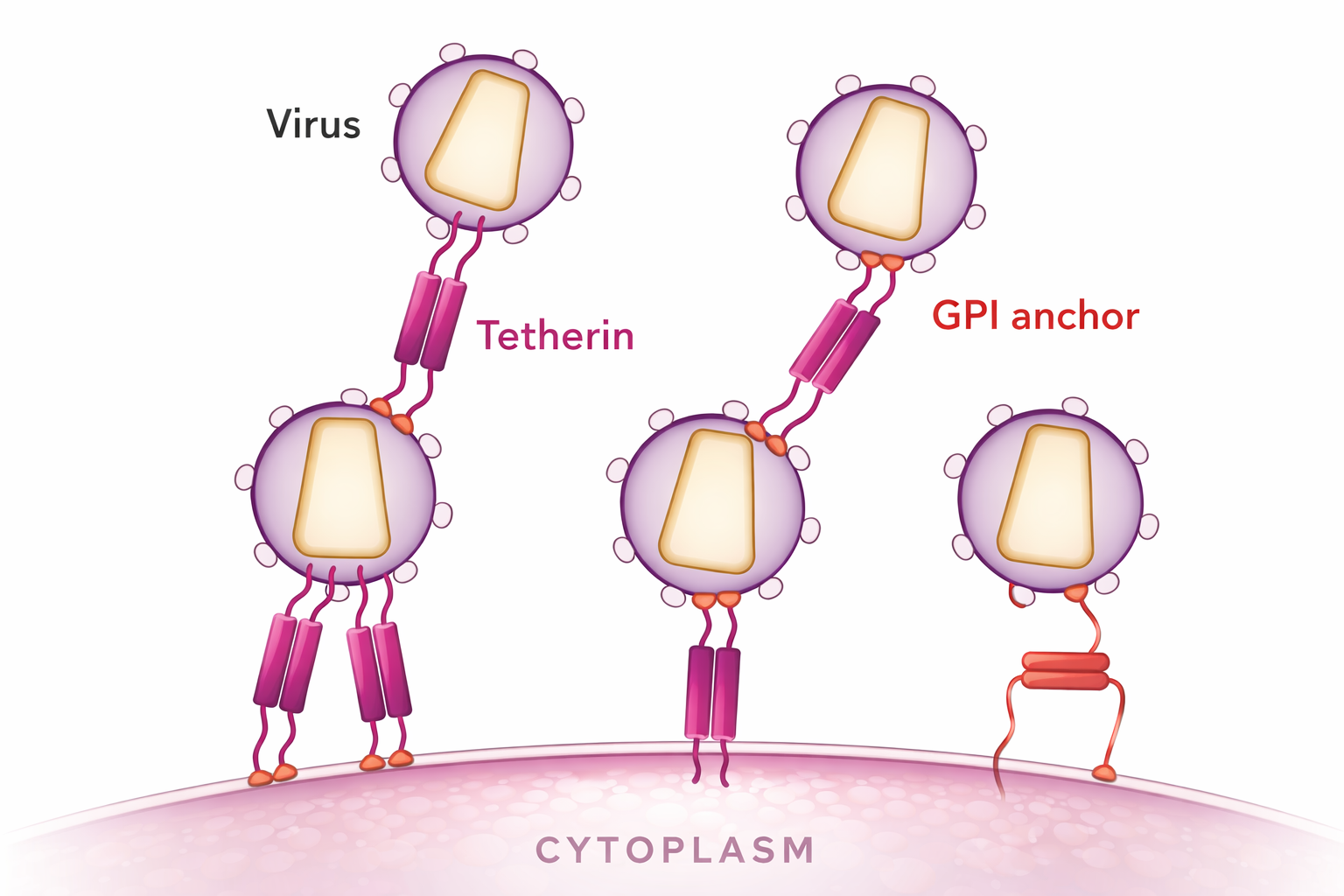
Tetherin “קושר” את הוויריון לממברנת התא ומונע שחרור. המרצה תיאר ניסויים שבהם:
- בלי Vpu (חלבון HIV שמעכב tetherin) ← הרבה ויריונים “תקועים” על הממברנה.
- גם כשהעלו מאוד tetherin, הווירוס לא תמיד מצליח לעכב את כולו.
מסר: יש “משיכת חבל” אבולוציונית - התא מפתח חסימה והווירוס מפתח אנטגוניסטים.
דוגמת APOBEC מול HIV
APOBEC עושה דה-אמינציה של ציטוזין וגורם להמון מוטציות, כך שנוצר וירוס לא אינפקטיבי.
HIV משתמש ב-Vif:
- שולח APOBEC לדגרדציה באמצעות יוביקוויטין.
- וגם יכול למנוע ממנו להיכנס לקפסיד.
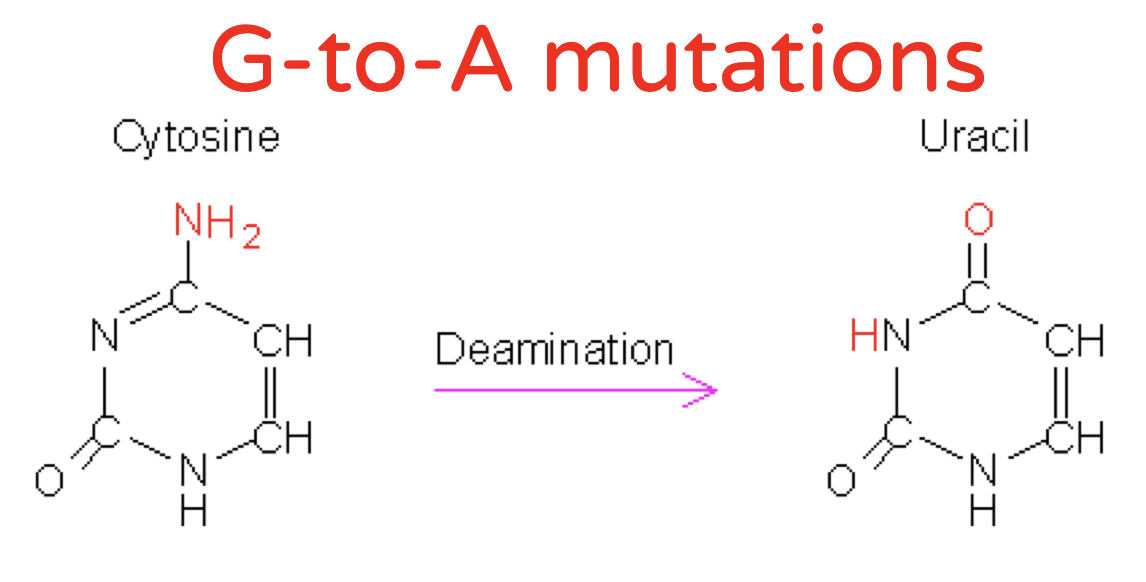
12) עוד מנגנונים תאיים שהוזכרו
Apoptosis
המרצה הסביר שזה “לטובת הגוף השלם”: התא מתפרק בצורה מבוקרת ונבלע ע”י מקרופגים. הוא הדגיש שווירוסים רבים מעכבים אפופטוזיס, אבל לפעמים דווקא מפעילים אותו בשלב מאוחר - ייתכן כדי לעזור להפצה (הועלו רעיונות בכיתה).
Autophagy
התא יכול “לעטוף” מרכיבים בעייתיים (כולל וירוסים) בממברנה, להתאחות עם ליזוזום ולפרק.
וירוסים (למשל הרפסים) יכולים לקודד הרבה חלבונים שמעכבים אוטופאג’י.
השתקת DNA ויראלי ככרומטין
הוזכר: התא יכול “לארוז” DNA ויראלי ולהפוך אותו להטרוכרומטין כדי להשתיק. קומפלקסים כמו PML bodies מעורבים, ורמת PML עולה בתגובה לאינטרפרון.
דוגמה: ב-EBV (הרפס) יש חלבונים שיכולים לפרק/לשנות את PML כדי לאפשר מעבר לליטי, בעוד שבלטנטיות הווירוס יכול “ליהנות” מהשתקה.
13) וירוסים לא נשארים חייבים: אנטגוניזם למסלולים
לכל מסלול הגנה תאית (RIG-I, MAVS, cGAS-STING, IRF/NF-κB, tetherin וכו’) וירוסים רבים מקודדים חלבוני עיכוב:
- קישור שמונע הפעלה,
- דה-יוביקוויטינציה שמונעת סיגנלינג,
- דגרדציה של רכיבי המסלול,
- או “הומולוגים” ויראליים שמתחרים על DNA בלי יכולת להפעיל שעתוק.
לכאורה, לא צריך לזכור שמות (מניסיון - קחו זאת בערבון מוגבל) - כן צריך להבין את עקרון “שחמט” של מהלכים ומהלכי-נגד.
14) שונות גנטית במאכסן ורזרבוארים
המרצה ציין:
- בזני עכברים שונים יש תגובה שונה לאינפלואנזה, בגלל הבדלים (כמו SNPs) ברצפטורים/מסלולים (TLR וכד’).
- גם באוכלוסייה האנושית יש וריאנטים (הוזכרו IFITM, TLR3) שיכולים להעלות רגישות לשפעת.
- הטלפים הוצגו כ”אלופים”: חיים שנים רבות, חיים בצפיפות, ויש אצלם מערכת אינטרפרון פעילה מאוד באופן קבוע, ולכן הם יכולים לשמש רזרבואר לנגיפים בלי לחלות, אך להעביר לאחרים.
15) המסר המסכם של השיעור
מערכת האינטרפרון היא נשק חזק נגד וירוסים, אבל אם לא מווסתים אותה נכון, היא יכולה להזיק ואף לתרום למצבים פתולוגיים (המרצה הזכיר גם אוטואימוניות כעיקרון כללי של “תגובה לא מבוקרת”).
שאלה לדוגמה: על אילו תאים משפיע האינטרפרון?
התשובה: גם על התאים המודבקים וגם על התאים הסמוכים.
נקודות חשובות
- לא לזכור מספרי TLR/רשימות ארוכות של חלבונים ויראליים מעכבים.
- כן להבין: שכבות ההגנה, לוגיקת החישה, אינטרפרון ← JAK/STAT ← ISGs, והרעיון של מרוץ חימוש (host vs virus).
שיעור 8 - וירולוגיה: עקרונות בתכנון תרופות
תאריך: 11/12/2025זאת ההרצאה המסכמת של החלק בווירולוגיה. כעת, אחרי שלמדנו את מחזור החיים של הווירוס ואת תגובות התא, אפשר לעשות שני דברים מרכזיים:
- להבין איך מתכננים תרופות אנטי-ויראליות ע”י מיקוד בשלבים שונים במחזור החיים;
- להבין שיש נגיפים/כלים ויראליים שיכולים להיות מועילים, למשל בהנדסה גנטית, בפאג’-תרפיה, ובאונקוליטיק-וירוס.
בסוף חזרנו על המסרים הגדולים של הקורס: וירוסים אמיתיים, משתנים כל הזמן באבולוציה, וכדאי להתחסן.
1) מחזור החיים של וירוס כ”מפת מטרות” לתרופות
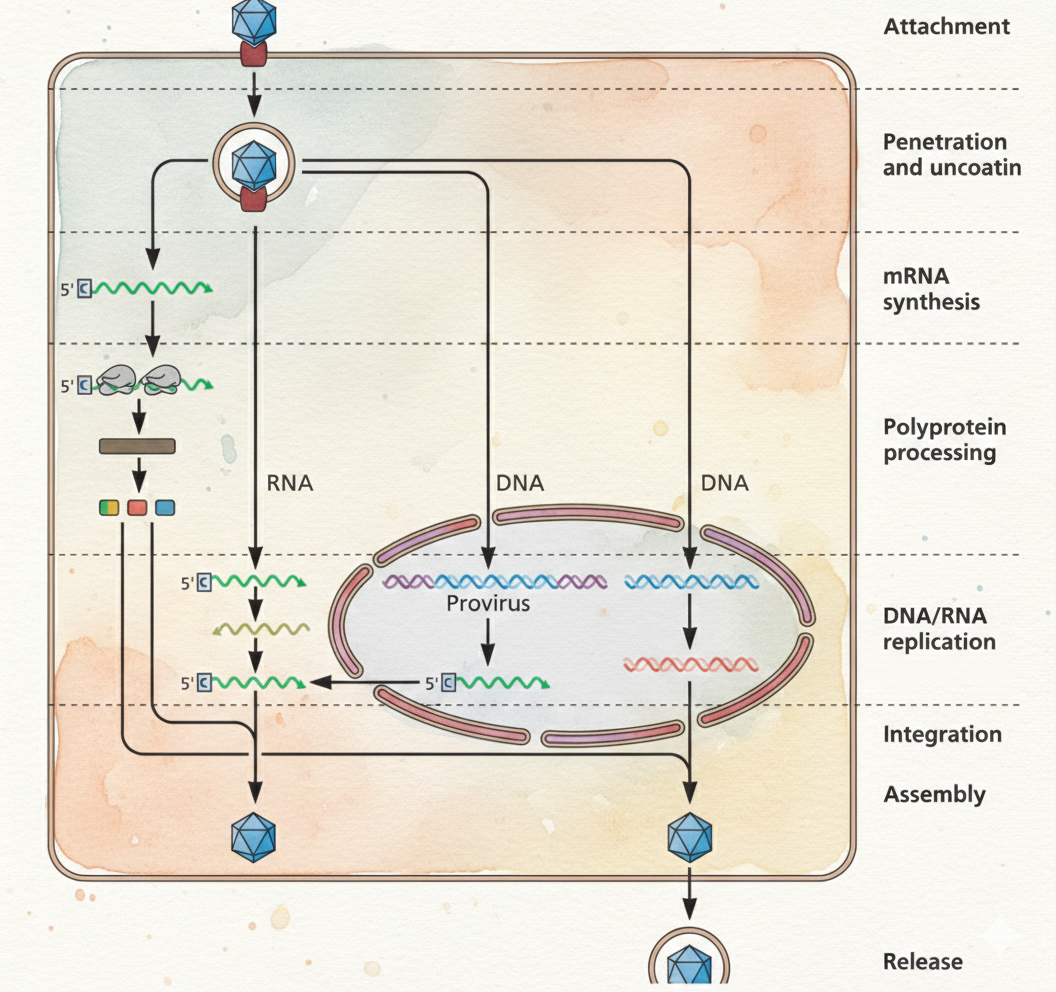
חזרה שלבי ההדבקה שראינו בקורס:
- Attachment (היצמדות)
- Entry (כניסה)
- Uncoating (שחרור הגנום)
- mRNA synthesis (יצירת mRNA)
- Protein synthesis & processing (תרגום ועיבוד חלבונים; כולל פוליפרוטאין ופרוטאז במקרים מסוימים)
- Replication (רפליקציה של הגנום)
- Integration (אינטגרציה - רלוונטי בעיקר לרטרו-וירוסים)
- Assembly & Release (הרכבה ושחרור)
הרעיון: אם עוצרים את הווירוס בכל אחד מהשלבים האלה, הוא כבר לא יוכל להשלים ריבוי, ולכן לא יתפשט.
2) שתי אסטרטגיות למטרה תרופתית: ויראלית מול תאית
הוצגו שתי אפשרויות בסיסיות לתכנון תרופה:
- לכוון למטרה נגיפית (חלבון נגיפי/מרכיב נגיפי).
- לכוון למטרה תאית (חלבון/מנגנון של התא המאחסן שהווירוס תלוי בו).
יתרון/חיסרון במטרה נגיפית
- יתרון: יותר ספציפי לנגיף ← פחות סיכון לפגיעה בתהליכים תאיים ולכן פחות תופעות לוואי.
- חיסרון מרכזי: הווירוס משתנה. בשימוש ממושך/תחת לחץ תרופתי יכולה להתפתח עמידות.
יתרון/חיסרון במטרה תאית
- יתרון: פחות סיכוי לעמידות (לא אפס, אבל נמוך יותר), כי התא פחות “מתחלף” מהר כמו הווירוס.
- חיסרון: יותר סיכון לתופעות לוואי, כי פוגעים במנגנון של התא. המרצה ציין שגם כאן עמידות אפשרית: וירוס יכול אבולוציונית למצוא דרך עקיפה (למשל להשתמש במסלול/קישור חלופי).
| אסטרטגיה | יתרונות | חסרונות |
|---|---|---|
| מטרה נגיפית | ספציפיות גבוהה לנגיף ← פחות תופעות לוואי | סיכון גבוה לעמידות בגלל שינוי וירוס |
| מטרה תאית | פחות סיכון לעמידות (תא פחות משתנה) | יותר סיכון לתופעות לוואי (פגיעה בתא) |
3) למה בדרך כלל מכוונים לאנזימים ולא לחלבוני קפסיד
המרצה שאל מה עדיף כמטרה: אנזימים או חלבונים מבניים (קפסיד), והדגיש שאנזימים לרוב עדיפים:
- לאנזימים יש אתר פעיל - נוח לעיכוב (אם עיכבת את האתר הפעיל, עצרת פונקציה קריטית).
- חלבוני קפסיד נמצאים בכמויות מאוד גדולות. לכן גם אם יש מעכב, צריך כמויות גדולות מאוד כדי “לכסות” מספיק מהם. בנוסף לכך, אם עיכבת רק חלק מהקפסיד (המרצה נתן דוגמה של 20%~), זה לא בהכרח יעצור את ההרכבה.
חזר בשאלה לדוגמה בסוף השיעור: מי לא מטרה (target) טוב? - קפסיד.
4) איך בונים Screen יעיל לפני שסורקים 200,000 תרכובות
לא מתחילים ישר עם הדבקות וניסויי תרבית ענקיים לכל תרכובת, אלא קודם, בונים סקרין שנותן Readout מהיר.
דוגמת פוליו-וירוס: פרוטאז כטארגט וסקרין פלואורסצנטי
המרצה חזר לפוליו-וירוס כוירוס +RNA שמייצר פוליפרוטאין. בגלל שפוליפרוטאין חייב להיחתך כדי ליצור חלבונים פעילים, הפרוטאז חיוני.
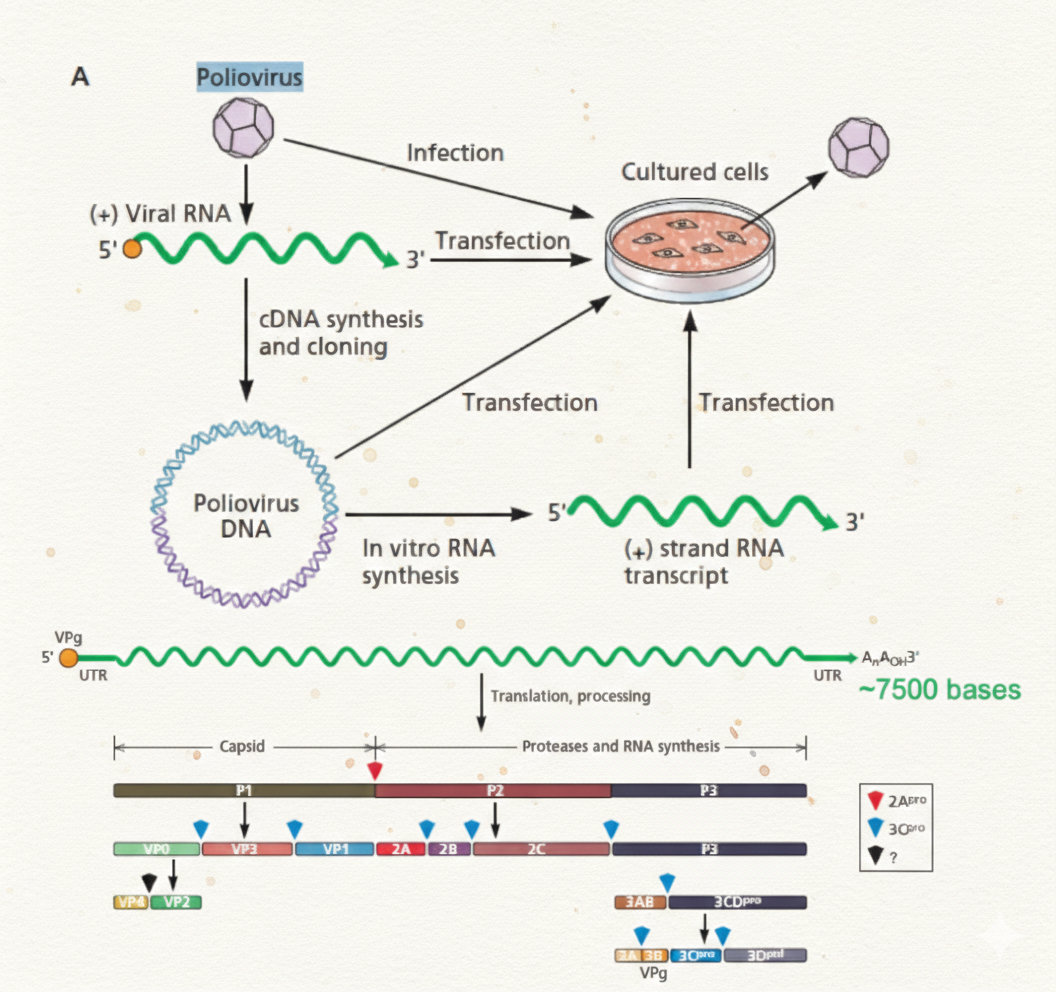
השלבים לבניית סקרין:
- משחזרים/משכפלים את הגנום כקלון בפלסמיד כדי לאפשר מוטציות וסריקה של חיוניות חלבונים (איזה מוטציות משביתות רפליקציה).
- מזהים רצף חיתוך שהפרוטאז מזהה (הוא ציין רצף ספציפי שהפרוטאז מזהה וחותך).
- בונים assay:
- מחברים פלואורופור לפפטיד שמכיל את רצף החיתוך, ומחברים אותו ל-bead.
- כל עוד הפלואורופור קשור ל-bead והוא שוקע - אין אור בתמיסה.
- אם הפרוטאז חותך - הפלואורופור משתחרר לתמיסה ← יש אור.
- אם שמים מעכב פרוטאז - פחות חיתוך ← פחות אור.
- כך אפשר לעשות המון בארות במקביל: בכל באר תרכובת אחרת, ולפי האות הפלואורסצנטי מוצאים מועמדים.
דגש עקרוני: בתרופות אנטי-ויראליות לרוב מכוונים לנגיף ספציפי, לא “תרופה כללית לכל וירוס”.
דוגמת “סלקציה” בחיידקים למציאת מעכבי HIV פרוטאז
דוגמה נוספת של סקרין עקיף:
- יש חלבון ממברנלי שמקנה עמידות לטטרציקלין בחיידקים.
- מכניסים בלולאה תוך-תאית שלו רצף חיתוך שמוכר ע”י HIV פרוטאז.
- אם HIV פרוטאז פעיל - הוא חותך ← החלבון לעמידות נהרס ← החיידקים לא גדלים בנוכחות טטרציקלין.
- אם מוסיפים מעכב HIV פרוטאז - אין חיתוך ← החלבון נשאר שלם ← החיידקים גדלים. כאן ה-readout הוא פשוט “יש/אין גדילה”, סלקציה חזקה.
העמידות לטטרציקלין במקרה הזה היא רק כלי ניסויי (לא קשורה ישירות לתרופה הסופית), כדי להפעיל מערכת סלקציה פשוטה.
5) גישה מבנית: תכנון תרופה לפי מבנה חלבון
מעבר לסקרינים, קיימת תיאר גישה נוספת:
- לזהות את המבנה התלת-ממדי של החלבון (קריסטלוגרפיה או כיום גם חיזוי/כלים כמו AlphaFold),
- למצוא כיס פעיל,
- לתכנן מולקולה שנכנסת לכיס ומעכבת (הוא תיאר זאת “כמו סובסטרט” שנקשר אבל נתקע ולא מאפשר המשך פעילות).
אחרי שמוצאים “Hit” ראשוני, תמיד ממשיכים אופטימיזציה: פעילות בריכוזים נמוכים יותר, יציבות גבוהה יותר בתאים, ועוד.
6) ריכוז תרופה ועמידות: למה מינון לא אופטימלי מסוכן
הסיכון לעמידות עולה כאשר הריכוז לא אופטימלי:
- בריכוז אופטימלי: הווירוס נעצר מוקדם ולא מתרבה ← סיכוי נמוך מאוד להופעת זנים עמידים.
- בריכוז נמוך מדי: חלק מהווירוסים “שורדים” ומתרבים בנוכחות התרופה ← נוצרת סלקציה לזנים עמידים, ובהמשך העמידים משתלטים.
מדובר בנושא נפרד מהנושא של “משך טיפול”: כאן הדגש היה כמות/מינון של המעכב.
כדי להקטין עמידות בנגיפים משתנים במיוחד, משתמשים לעיתים בקוקטייל של כמה מעכבים במקביל, כדי שהנגיף יצטרך לפתח עמידות בכמה מטרות שונות בבת אחת.
7) דוגמאות קונקרטיות לתרופות לפי שלב במחזור חיים
(א) עיכוב Attachment ב-HIV
נזכיר את התיאור של HIV:
- gp120 (חלבון נגיפי) נקשר ל-CD4 ואז לרצפטור משני (הוזכר CCR5).
- הוזכר מעכב שמפריע לקישור לרצפטור המשני.
(ב) עיכוב Uncoating באינפלואנזה A דרך M2
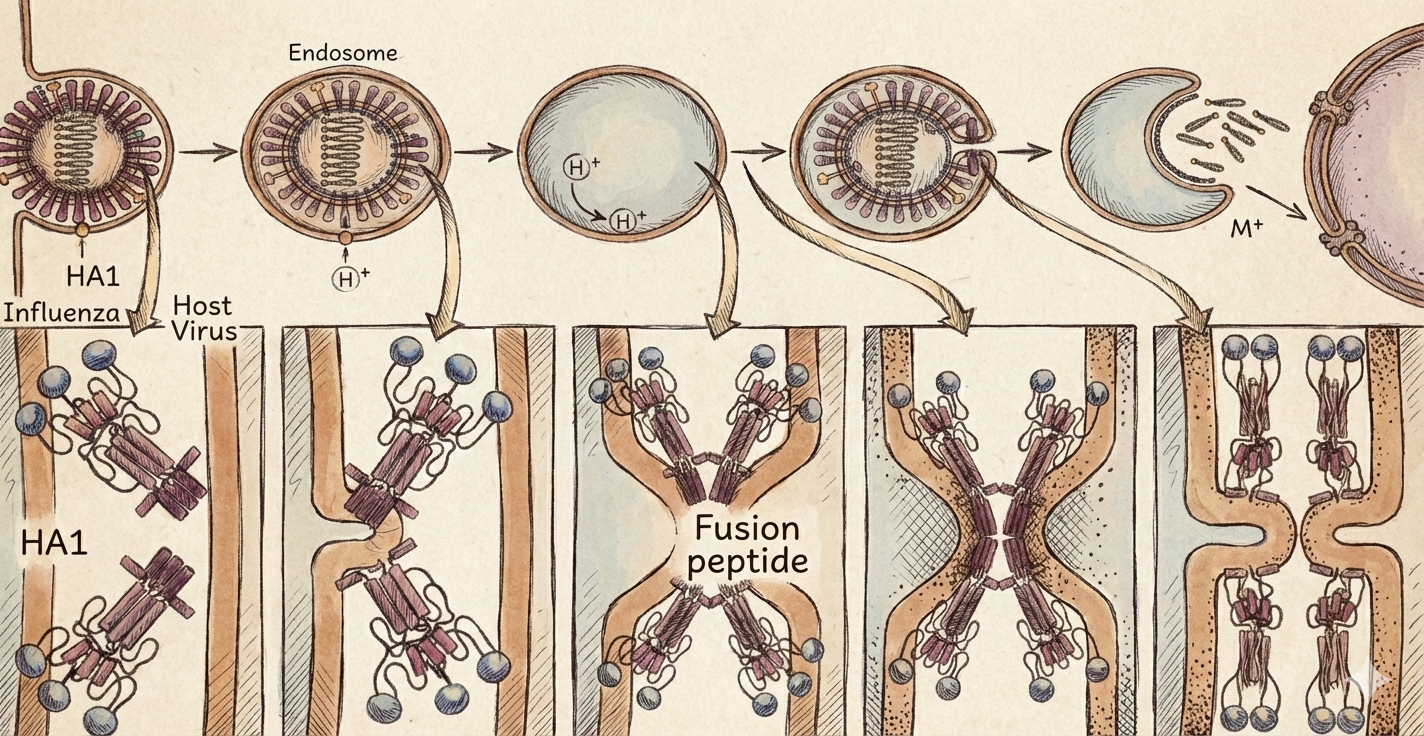
האיור ממחיש את המנגנון המולקולרי המדויק שמתואר בטקסט לגבי חדירת נגיף השפעת (Influenza) לתא:
- שלב ה-Entry והאנדוזום: באיור רואים את הנגיף נכנס אל התא בתוך שלפוחית (Endosome). בטקסט מצוין: “הווירוס נכנס באנדוציטוזה”.
- ירידת ה-pH (כניסת פרוטונים ): באיור מופיעים סימוני שנכנסים לתוך האנדוזום ולאחר מכן לתוך חלקיק הנגיף עצמו. הטקסט מסביר: “ה-pH באנדוזום יורד… חלבון M2 הוא תעלת יונים שמכניסה פרוטונים”.
- שינוי קונפורמציה ב-HA (המולין): החלק התחתון של האיור מציג תקריב של חלבון ה-HA (המחולק ל-HA1 ופפטיד פיוז’ן). ניתן לראות כיצד החלבון “נפתח” ומשנה את צורתו בעקבות החומציות כדי לאפשר את איחוי הממברנות (Fusion).
- שחרור הגנום (Uncoating): בשלב האחרון באיור (צד ימין למעלה), רואים את הממברנות מתאחות ואת המקטעים הגנטיים של הווירוס משתחררים לתוך הציטופלזמה. בטקסט נכתב: “החמצה גורמת לשחרור קומפלקסים/גנום (uncoating)”.
למה זה חשוב מבחינה תרופתית?
כפי שמוסבר בסעיף 7 בסיכום, האיור הזה הוא ה”מפה” להבנת הפעילות של תרופות כמו אמנטדין (Amantadine). התרופה חוסמת את תעלת ה-M2 (החצים של ה- באיור), מונעת את החמצת פנים הנגיף, ובכך עוצרת את כל התהליך שרואים באיור – הנגיף נשאר “כלוא” ולא יכול לשחרר את הגנום שלו.
באינפלואנזה (Influenza):
- הווירוס נכנס באנדוציטוזה, ה-pH באנדוזום יורד וזה קריטי ל-fusion.
- חלבון M2 הוא תעלת יונים שמכניסה פרוטונים, והחמצה גורמת לשחרור קומפלקסים/גנום (uncoating) כדי שיגיעו לגרעין.
- אם חוסמים את M2 (למשל אמנטדין): אין כניסת פרוטונים ← אין uncoating ← אין הדבקה.
הערות:
- התרופה הזאת קיימת שנים, יעילה מול אינפלואנזה A.
- אינפלואנזה B “אסטרטגיה אחרת” ולכן לא אותו עיכוב.
- בגלל שימוש ממושך, קיימת גם עמידות.
- לא מפזרים/לא נותנים לכל אחד כדי לא להגביר עמידות; נותנים בעיקר במקרים קשים כדי להקל ולקצר מחלה.
יש גם להבדיל בין תרופה לבין חיסון: חיסון לא דורש להבין מנגנונים, אלא חושף חלבון מעטפת כדי שמערכת החיסון תייצר נוגדנים לעתיד.
(ג) Prodrug: אציקלוביר והרפס סימפלקס
נסביר את מושג ה-Prodrug דרך אציקלוביר:
- נוקלאוזיד = בלי פוספט; נוקלאוטיד = עם פוספט.
- בהרפס סימפלקס יש Thymidine kinase ויראלי שמסוגל לבצע פוספורילציה ראשונית.
- התאים לבד לא מבצעים את הזרחון הראשון באותה תרופה ← לכן התרופה “מופעלת” בעיקר בתאים שבהם הווירוס נמצא במצב ליטי ומבטא TK.
- אחרי הפוספורילציה הראשונה, אנזימי התא יכולים להשלים לשני/שלישי ← מתקבל נוקלאוטיד פעיל שמעכב פולימראז של הרפס ולכן רפליקציה. המרצה הוסיף שימוש רעיוני נוסף: אם מכריחים תא סרטני לבטא TK, אפשר להפוך את זה לכלי שממית תאים מסוימים (הוא הזכיר שמשתמשים בזה גם בהקשרים אנטי-סרטניים/אונקוליטיים בהמשך).
(ד) נוקלאוטידים אנלוגיים ועיכוב רפליקציה
המרצה חזר על עיקרון רחב: רפליקציה היא שלב קריטי ולכן הרבה תרופות מכוונות ל-פולימראז/RT. הוא הסביר שווירוסים “פחות בררנים” (הוא השתמש במושג פרומיסקואס) ולכן לפעמים משלבים נוקלאוטידים “לא מושלמים” שמכניסים שגיאה/עוצרים הארכה. הוא הדגיש את העיקרון של חוסר OH בעמדה 3’ ← chain termination (אי אפשר להאריך).
8) למה אין “תרופה אחת לכל הווירוסים”, אבל יש לפעמים לקבוצות
המרצה הדגיש שברוב המקרים אין תרופה כללית לכל הווירוסים כי לכל וירוס חלבונים ואסטרטגיות שונים. עם זאת, הוא ציין שכן קיימות תרופות שיכולות לעבוד על קבוצה של וירוסים דומים אם אנזים מרכזי (כמו פולימראז/פרוטאז) שמור יחסית.
9) שימושים “מועילים” בנגיפים
(א) וקטורים ל-Gene therapy וביטוי ממושך
המרצה השווה:
- טרנספקציה בפלסמיד: ביטוי זמני (כמה ימים) ואז הפלסמיד הולך לאיבוד.
- רטרו/לנטי-וירוס: נכנס דרך אינטגרציה ל-DNA ← ביטוי ארוך טווח.
אבל הוא הדגיש בעיה קשה בג’ין-תרפיה עם רטרו-וירוסים: אינטגרציה ליד אונקוגן עלולה לגרום בהמשך ללוקמיה; מספיק אירוע נדיר בתא אחד מתוך מיליונים כדי שבמשך שנים התא ישגשג ויהפוך לסרטן.
לכן עוברים יותר ל-AAV (וירוס קטן, ssDNA), שבדרך כלל לא עושה אינטגרציה; ואם יש אינטגרציה - זה באזור ספציפי רחוק מגנים, ולכן נחשב בטוח יותר יחסית.
(ב) Phage therapy (בקטריופאג’ים) לטיפול בזיהומי חיידקים
בקטריופאג’ים הם וירוסים שמדביקים חיידקים. המרצה תיאר את הרעיון של פאג’-תרפיה:
- פאג’ים מדביקים חיידקים ספציפיים והורגים אותם, בניגוד לאנטיביוטיקה שמחסלת גם חיידקים טובים.
- אפשר להשתמש בזה גם כדי להשפיע על המיקרוביום: להפחית חיידקים “רעים” בלי לפגוע בשאר.
יש כבר טיפולים וניסויים קליניים, שמאפשרים מתן פאג’ים במגוון דרכים:
- קפסולה דרך הפה, אינהלציה, טיפות עיניים, זריקה לשריר/לאזור נגוע/לדם, או מריחה על פצע.
איך מוצאים פאג’ לחולה ספציפי (גישה פרסונלית)
המרצה תיאר תהליך:
- לוקחים מהחולה את החיידק הפתוגני ומגדלים תרבית.
- מחפשים פאג’ים שיכולים להרוג אותו - ממאגר/סטוקים, וגם ממקור עשיר כמו ביוב (שם יש מגוון פאג’ים גדול).
- עושים מבחן פלאקים: יוצרים שכבת חיידקים (monolayer), מוסיפים פאג’ים, מזהים פלאק (אזור הרג).
- מבודדים את הפאג’ מהפלאק, מרבים אותו, ואז משתמשים לטיפול.
המרצה הדגיש שזה כיום חסם כי זה לוקח זמן, ולכן מתאים במיוחד לזיהומים כרוניים (כמו פצעים כרוניים) ולא למצבי חירום אקוטיים.
יתרונות וחסרונות של Phage therapy
יתרונות:
- ספציפיים לזנים מסוימים, לא פוגעים בשאר החיידקים הטובים.
- מתרבים רק על המאחסן: כשנגמרים החיידקים - הפאג’ים מפסיקים להתרבות ונעלמים.
- עמידות יכולה להתרחש, אבל הוצגה כסיכוי יחסית נמוך.
חסרונות/דאגות:
- זמן אפיון החיידק ומציאת/הנדסת הפאג’ מתאים.
- פאג’ים (במיוחד ליזוגניים) עלולים לשאת/להעביר גנים, כולל כאלה שמקנים עמידות לאנטיביוטיקה. המרצה אמר שאחד הפתרונות הוא ריצוף של הפאג’ שנבחר כדי לוודא שאין גנים בעייתיים, למרות שזה מוסיף זמן.
- אם הורגים חיידקים בתוך הדם, החיידקים מתפרקים/”מתפוצצים” ומשחררים תכולה שעלולה לגרום לתגובה מערכתית קשה (המרצה הזכיר חשש להלם).
- שימוש חוזר יכול ליצור תגובה חיסונית נגד הפאג’ים עצמם.
פתרון שהוזכר: להשתמש רק בחלבונים שהפאג’ים מייצרים לפירוק דופן החיידק (אנזימים שמפרקים פפטידוגליקן) במקום בכל הפאג’.
המרצה גם הזכיר טכנולוגיה חדשה (מאמר “מהשנה”) שבה משתמשים בבקטריופאג’ כדי להכניס גן ש”מרפא” בתוך המעי ע”י הדבקת חיידקים וגרימה לביטוי גן ספציפי - אבל הדגיש שזה כבר נכנס להנדסה מולקולרית.
10) וירוסים אונקוליטיים (Oncolytic viruses) - וירוסים שמחסלים סרטן
המרצה הסביר את האתגר: סרטן הוא “התאים שלנו” שעברו שינוי, ולכן קשה להבדיל. כימותרפיה רגילה פוגעת בכל תא מתחלק ולכן יש תופעות לוואי (עור, ריריות, שיער וכו’). האונקוליטיק-וירוס נועד להיות ספציפי לתאים סרטניים.
עיקרון הספציפיות
- ספציפיות בשלב הכניסה: הווירוס דורש רצפטור. אם גידול מבטא אנטיגן/חלבון ייחודי, אפשר לכוון אליו. המרצה נתן דוגמה לפרוסטט: PSA.
- ספציפיות אחרי כניסה (פרמיסיביות): גם אם הווירוס נכנס, הוא לא תמיד יכול להתרבות בכל תא. אפשר לנצל את זה כדי שיתרבה בעיקר בתאים סרטניים.
- אם הווירוס מתרבה בתא הסרטני ← הוא גורם ל-lysis ← משתחררים וירוסים חדשים שמדביקים עוד תאי סרטן.
דוגמת אדנו-וירוס עם deletion של E1B (מנצל p53)
המרצה תיאר:
- לאדנו-וירוס יש גנים שדוחפים תא להתחלק (E1A), ואז התא מגיב עם p53 שעוצר חלוקה/משרה מוות כדי להגן על הגנום.
- לוירוס יש E1B שמדכא p53 כדי לאפשר רפליקציה.
- אם עושים דלישן ל-E1B:
- בתא נורמלי: p53 פעיל ← עוצר את הווירוס ← הווירוס לא מתרבה.
- בתא סרטני שבו p53 פגום/מוטנטי (המרצה ציין שכ~50% מהסרטנים): אין בלם ← הווירוס מתרבה והורג את התא הסרטני.
לפי ההרצאה, טיפול כזה מאושר במדינות מסוימות, אבל לרוב לא עובד “מאה אחוז”, ולכן הכיוון כיום הוא שילובים (אונקוליטיק + טיפולים אחרים).
נקודה פרקטית מניסויים: בסין אישרו מוקדם טיפולים כאלה; בארה”ב לעיתים מפסיקים ניסויים עם עליית חום, בעוד שבגישה שתיאר בסין לא בהכרח מפסיקים - והמרצה אמר שחום יכול להיות “טוב” כי הוא מעיד על הפעלת מערכת החיסון, שהיא חלק מהאפקט נגד הגידול.
טבעיים מול מהונדסים
יש שני סוגים עיקריים של וירוסים אונקוליטיים (Oncolytic Viruses):
- וירוסים טבעיים שמעדיפים תאים סרטניים בלי הנדסה (דוגמאות כלליות שהביא).
- וירוסים מהונדסים (למשל אדנו, HSV) שמסירים מהם גנים מסוימים כדי להחליש פתוגניות ולהגביר ספציפיות.
דוגמות לשימושים/אישורים
- “Rigvir” (לטביה): אנטרו-וירוס שמצאו שמעדיף להרוג תאים סרטניים; אושר בלטביה (2004), בגאורגיה (2015), ובארמניה (2016).
- אדנו-וירוס עם דלישן: אושר בסין (המרצה תיאר למה תהליך האישור שונה בין ארה”ב לסין).
- הרפס סימפלקס אונקוליטי: המרצה אמר שאושר ע”י ה-FDA “לפני כמה שנים” לטיפול בסרטן (ועדיין לא שגרתי/בסל, אך צפוי להתרחב בעתיד).
איך מהנדסים HSV להיות אונקוליטי
כמה דוגמאות לשינויים:
- מחיקות שמקטינות טוקסיות/יכולת רפליקציה בתאים נורמליים/נוירונים.
- מחיקה של מנגנוני התחמקות חיסונית (כדי שהמערכת החיסונית “תראה” את ההדבקה).
- הוספת גן אנושי שמושך מערכת חיסון, GM-CSF, כדי לחזק תגובה נגד הטומור.
11) מסרים מסכמים של הקורס
- וירוסים קיימים - והמרצה אמר שהוא מקווה שהקורס שכנע גם את מי שצחק בתחילת הקורס על “אי אפשר לראות וירוס”.
- כדאי להתחסן.
- וירוסים לא “חושבים” - הם פועלים לפי אבולוציה דרוויניסטית: מוטציות + סלקציה. המרצה נתן דוגמה מקורונה: בתחילה זן שגרם מחלה קשה יותר ופחות מדבק; בהמשך עבר אבולוציה לכיוון מדבק יותר ומחלה קלה יותר.
- המטרה בקורס הייתה להבין מנגנונים מולקולריים של וירוסים, לא להעמיס מחלות ספציפיות (את המחלות תלמדו בהמשך בקורסים הקליניים).