הקדמה
בשיעור הקודם התחלנו לדבר על אלקנים וללמוד כיצד לתת שמות לאלקנים ולאלקנים מהמשפחות השונות. היום נמשיך ללמוד את השפה של הכימיה האורגנית כדי שבהמשך נוכל לעבוד איתה. השיעור יהיה מחולק לשני חלקים:
- החלק הראשון יהיה טכני יותר ויתמקד בהשלמת הלימוד של משפחות התרכובות
- בחלק השני נתקדם לנושאים מעניינים יותר
נומנקלטורה (שמות) של תרכובות
אלקאנים
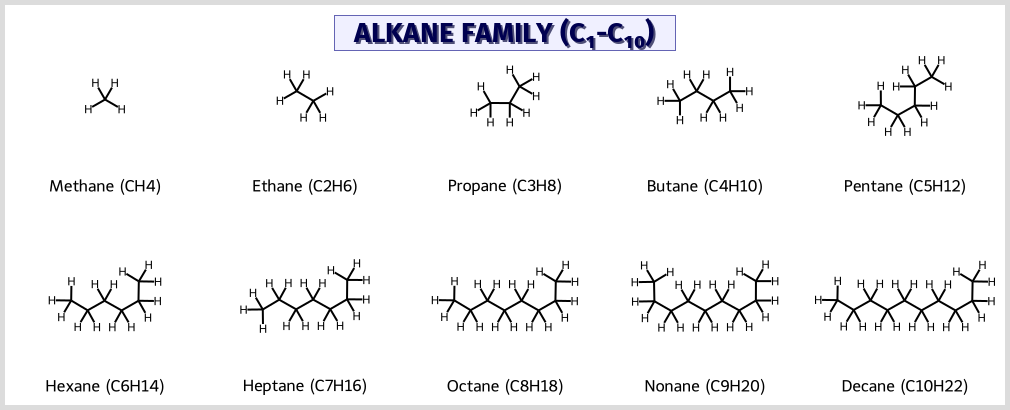
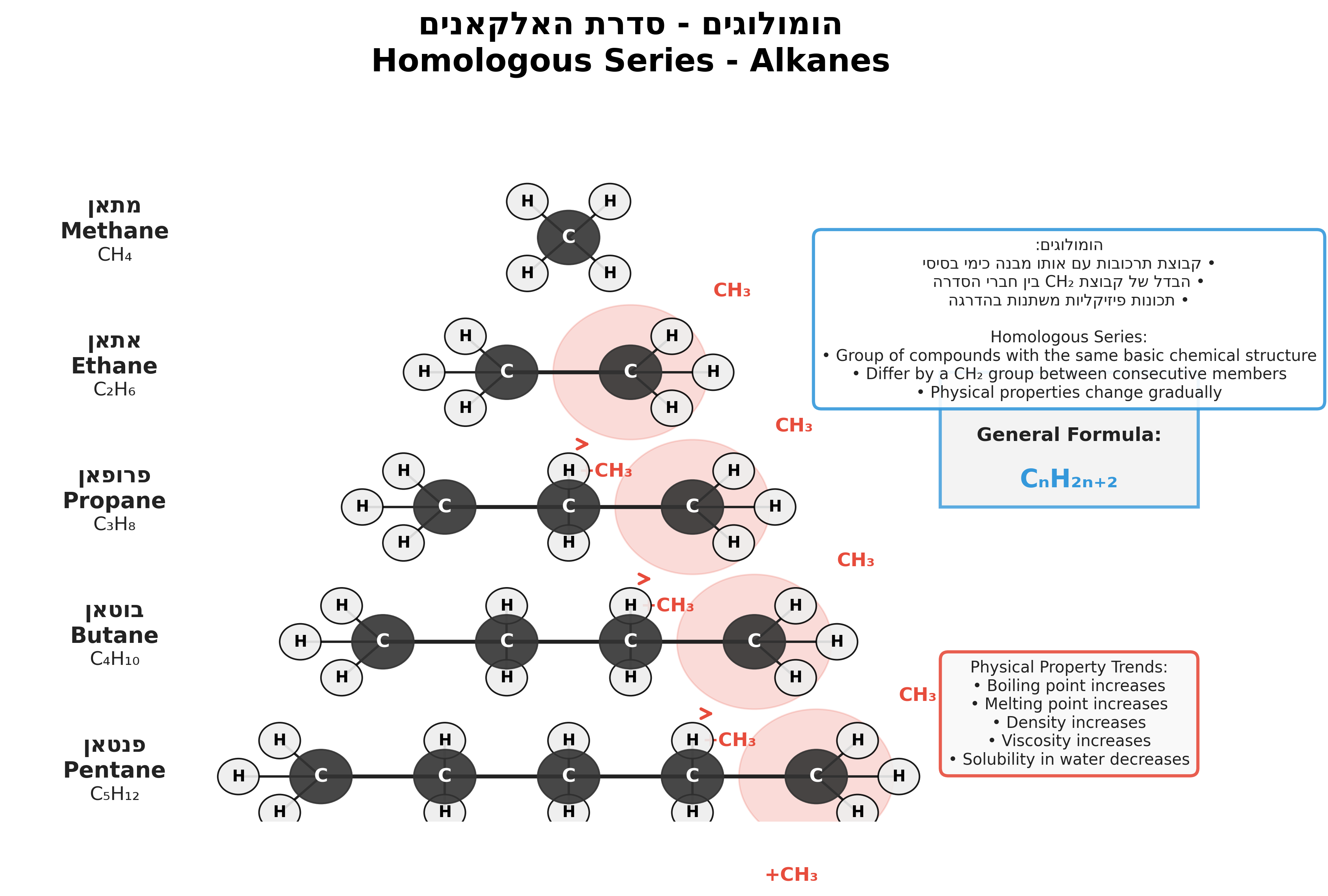
הומולוגים
בקצרה על הומולוגים שהוזכרו בשיעור הקודם:
- לפי הספר של פאולה (ספר הלימוד שלכם), הומולוגים מוגדרים כמולקולות עם הבדל של קבוצת מתיל אחת ביניהן.
- כלומר,
מתאןואתאןנחשבים הומולוגים לפי ההגדרה, אך מתאן ופרופאן לא (כי יש הבדל של שני פחמנים ביניהם). - ברמת הקורס שלנו, אנו מתייחסים גם למתאן ופרופאן כהומולוגים - כל תרכובות הפחמן שנראות אותו דבר כאשר ההבדל היחיד הוא מספר הפחמנים.
 |
|---|
| הומולוגים |
מתן שמות לאלקאנים
כללים בסיסיים
- מחפשים את שרשרת הפחמנים הארוכה ביותר
- אם יש שתי שרשראות באותו אורך, בדרך כלל נבחר את השרשרת הישרה מטעמי נוחות
- לאחר מציאת השרשרת הארוכה, ממספרים את הפחמנים כך שהמתמירים יקבלו את המספרים הנמוכים ביותר
- לפי יופ”ק (IUPAC) - הסיסטמה לתת שמות למולקולות
סדר קדימויות במתמירים
כאשר יש מספר מתמירים על המולקולה:
- מסדרים את המתמירים לפי סדר אלפביתי באנגלית (ethyl לפני methyl)
- אם יש מספר מתמירים מאותו סוג, מציינים את מספרם בקידומת (di-, tri-, tetra- וכו’)
- מציינים את מיקום המתמירים לפי המספרים שניתנו לפחמנים בשרשרת הראשית
דוגמה
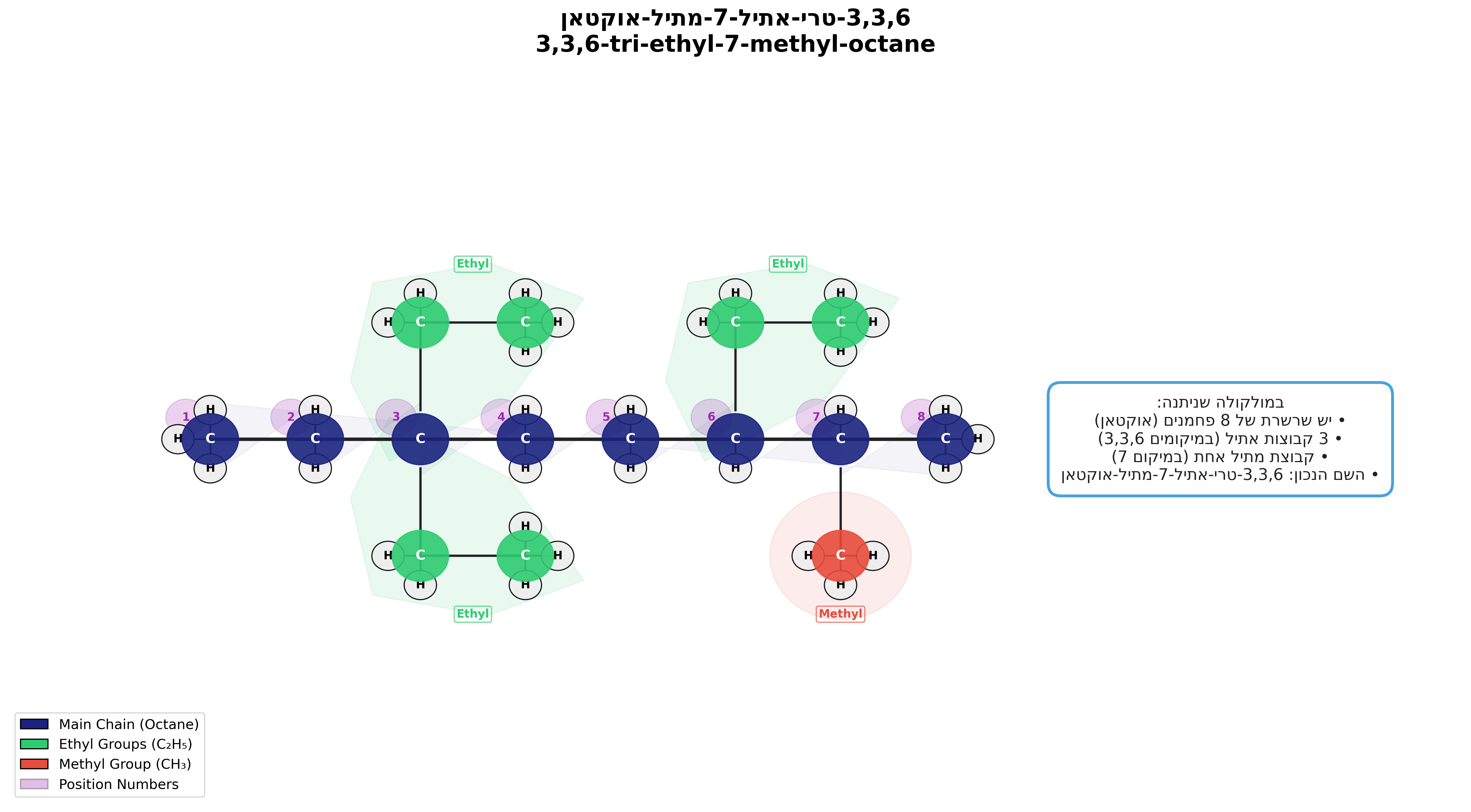 |
|---|
| $\text{3,3,6-triethy-7-methyloctane}$ |
במולקולה שניתנה:
- יש שרשרת של 8 פחמנים (אוקטאן)
- 3 קבוצות אתיל (במיקומים 3,3,6)
- קבוצת מתיל אחת (במיקום 7)
- השם הנכון: 3,3,6-טרי-אתיל-7-מתיל-אוקטאן
מתמירים מסתעפים (ברנצ’)
כאשר המתמיר עצמו מכיל מתמירים:
- עדיין מחפשים את השרשרת הארוכה ביותר
- המתמיר המסתעף מקבל שם בהתאם לשרשרת שלו עצמו
- מציינים את מיקום המתמיר על השרשרת הראשית
בחירה בין שרשראות באותו אורך
אם יש שתי שרשראות באותו אורך:
- בוחרים את השרשרת עם יותר מתמירים
- אם מספר המתמירים זהה, מעדיפים את השרשרת שבה המתמירים פשוטים יותר (לא מסתעפים)
- מספרים את השרשרת כך שהמתמיר הראשון יקבל את המספר הנמוך ביותר
אלקאנים ציקליים
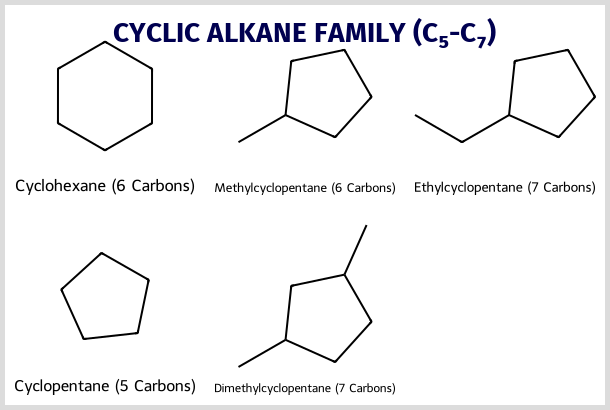 |
|---|
| אלקאנים ציקליים |
- שרשרת פחמנים שסגורה במעגל
- מוסיפים את הקידומת “ציקלו” לשם האלקאן המתאים
-
דוגמאות:
- 3 פחמנים: ציקלופרופאן
- 4 פחמנים: ציקלובוטאן
- 5 פחמנים: ציקלופנטאן
- 6 פחמנים: ציקלוהקסאן (נפוץ כממס בכימיה אורגנית)
מתן שמות לאלקנים ציקליים עם מתמירים
- אם יש רק מתמיר אחד, אין צורך לתת מספר (למשל: מתיל-ציקלופנטאן)
- אם יש יותר ממתמיר אחד:
- בוחרים פחמן מותמר כפחמן מספר 1
- ממשיכים לספור בכיוון שייתן את המספרים הנמוכים ביותר למתמירים האחרים
- מסדרים את המתמירים לפי סדר אלפביתי
דוגמאות
- מולקולה עם קבוצת מתיל וקבוצת פרופיל על ציקלופנטאן:
- השם הנכון: 1-מתיל-3-פרופיל-ציקלופנטאן
- ולא: 1-פרופיל-4-מתיל-ציקלופנטאן (למרות שכימית זה אותו חומר)
- מולקולה עם שתי קבוצות מתיל על ציקלוהקסאן:
- השם: 1,3-די-מתיל-ציקלוהקסאן
הערה חשובה: כאשר יש שתי קבוצות זהות, לא משנה מאיזה כיוון סופרים, כל עוד המספרים יוצאים זהים (למשל 1,3 בשתי הספירות).
סיכום נומנקלטורה של אלקנים
הכללים שלמדנו לגבי מתן שמות לאלקנים תקפים גם לקבוצות אחרות (אלקנים, אלכוהולים, אתרים, אמינים וכו’) עם שינויים קטנים בלבד. כעת נעבור לקבוצות נוספות.
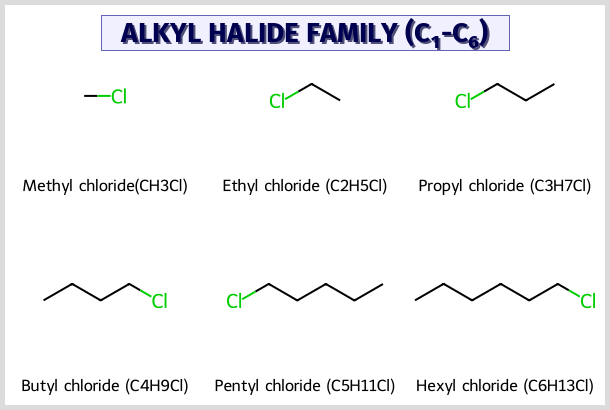
אלקיל הלידים
 |
|---|
| אלקיל הלידים |
אלקיל הלידים הם קבוצה של חומרים שיש עליהם הלוגן - פלואור, כלור, ברום או יוד. ההלוגן יכול להיות מחובר לפחמן:
- ראשוני (פחמן המחובר לפחמן אחד נוסף)
- שניוני (פחמן המחובר לשני פחמנים)
- שלישוני (פחמן המחובר לשלושה פחמנים)
מיקום ההלוגן על סוג הפחמן משפיע על שם האלקיל הליד:
- פריימרי (primary) אלקיל הליד
- סקנדרי (secondary) אלקיל הליד
- טרשיארי (tertiary) אלקיל הליד
דוגמאות נפוצות של אלקיל הלידים
- מתיל כלוריד (או כלורומתאן) - ריאגנט שימושי בכימיה אורגנית
- אתיל פלואוריד
- איזופרופיל יודיד
- סק-בוטיל ברומיד
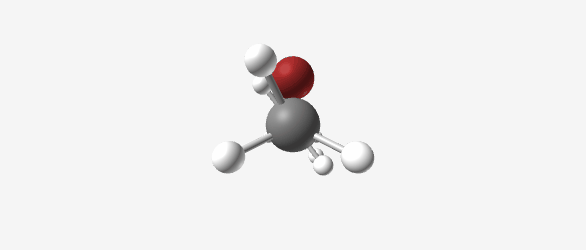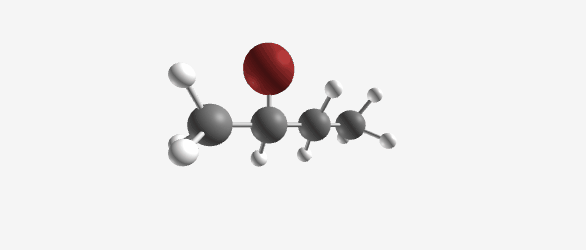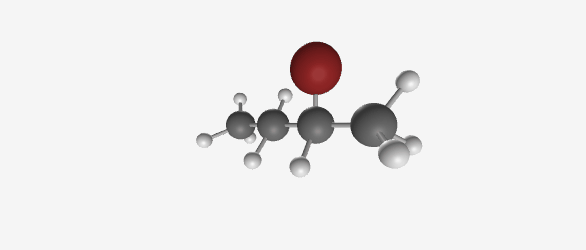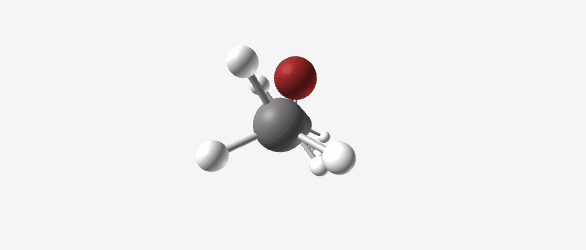
איזו (iso) וסק (sec)
איזו (iso): מציין שהמתמיר יושב על אותו פחמן שעליו יושב גם ההלוגן.
סק (sec): מציין שהמתמיר יושב על הפחמן שהוא אחד לפני האחרון (בכיוון ההפוך מהמתמיר השני).
במקרה של פרופיל (שרשרת של 3 פחמנים), איזו וסק הם למעשה אותו מבנה, אך מוסכם להשתמש בשם איזו.
לדוגמה:
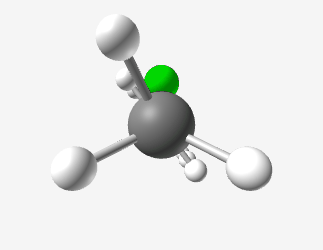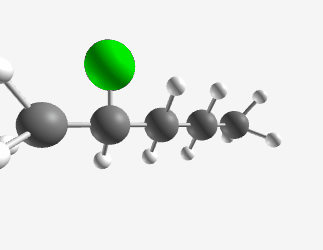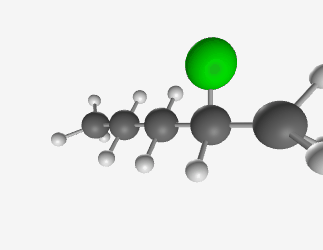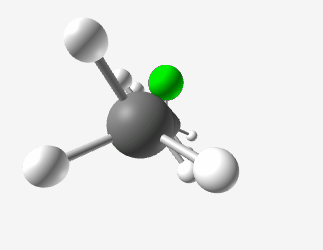
- אם יש לנו שרשרת של 5 פחמנים (פנטן) עם כלור כהלוגן:
- אם המתיל ($\ce{CH3}$) יושב על אותו פחמן שעליו יושב הכלור, זה יהיה איזו-פנטיל כלוריד
 למשל עם אלכוהול:
למשל עם אלכוהול: 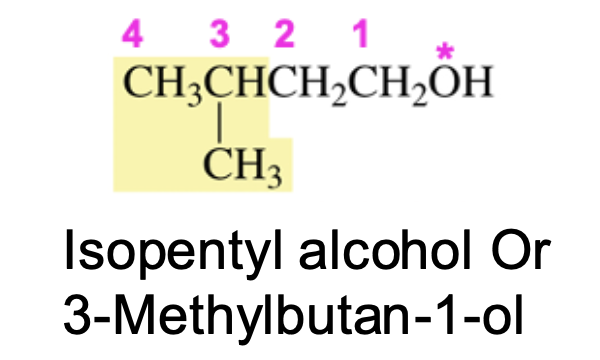
- אם המתיל ($\ce{CH3}$) יושב על הפחמן אחד לפני האחרון, זה יהיה סק-פנטיל כלוריד

- אם המתיל ($\ce{CH3}$) יושב על אותו פחמן שעליו יושב הכלור, זה יהיה איזו-פנטיל כלוריד
חשוב לציין שאפשר גם להשתמש בשמות סיסטמטיים (מספריים) כמו “4-מתיל-פנטיל כלוריד”.
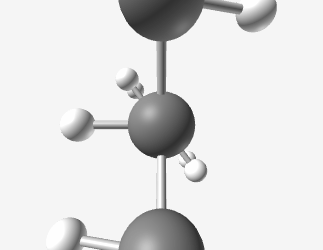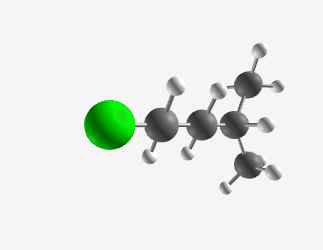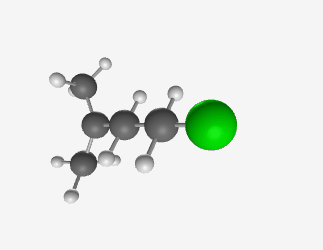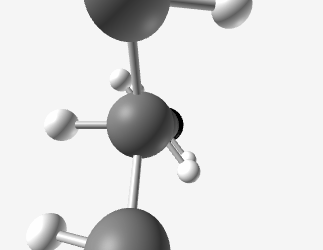 |  |
|---|---|
| איזו-פנטיל כלוריד | סק-פנטיל כלוריד |
אתרים
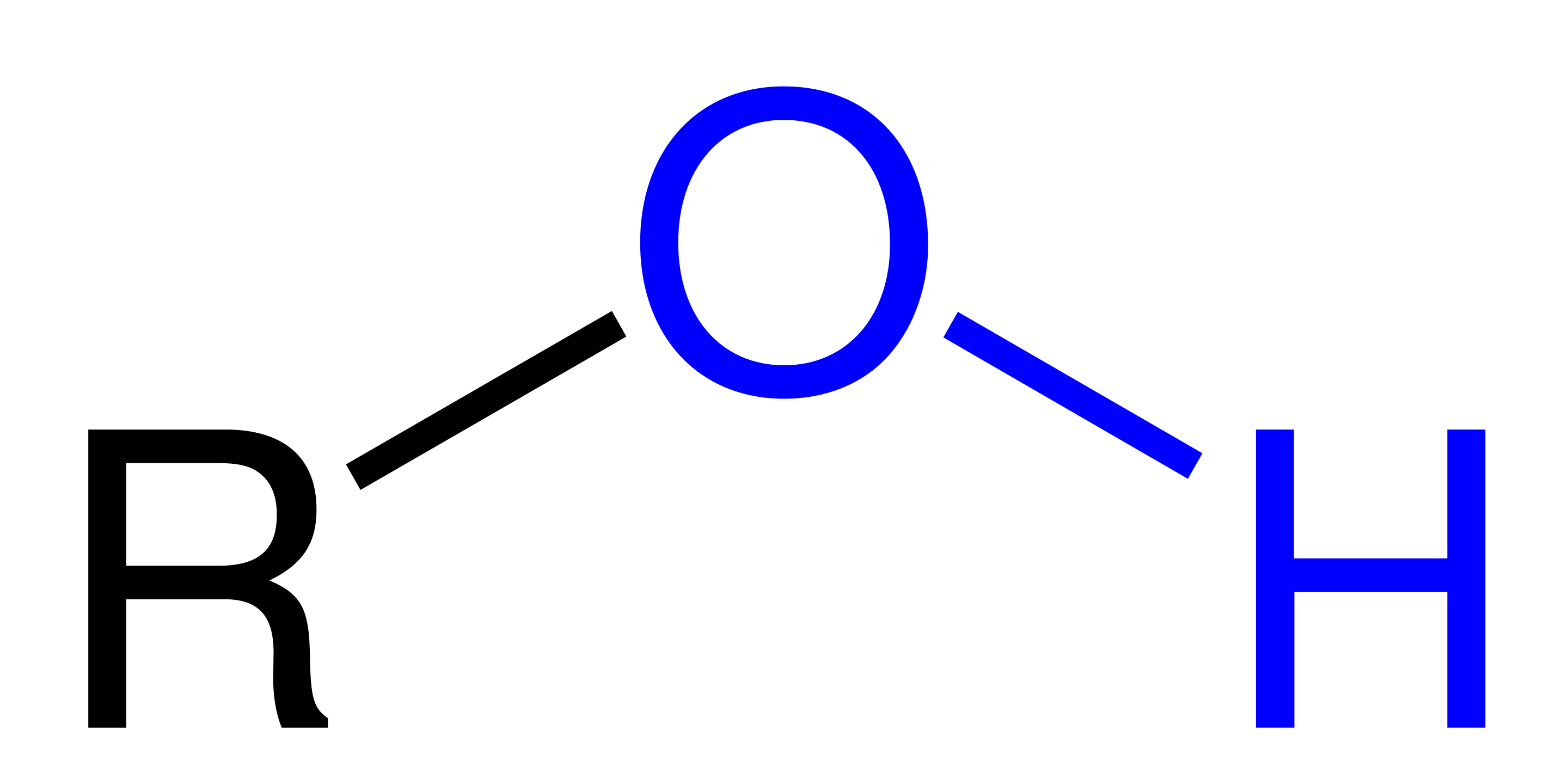
אתרים הם קבוצה של חומרים שיש בהם חמצן המחובר לשני פחמנים (R-O-R). אלכוהול הוא מקרה פרטי של אתר, כאשר אחד הקבוצות היא H (R-O-H).
שימושים
- בעבר השתמשו באתרים (בעיקר די-אתיל אתר) כחומר הרדמה ברפואה במאה ה-19
- לאתר יש טמפרטורת רתיחה נמוכה יחסית
- כיום משתמשים פחות באתר כחומר הרדמה בגלל רעילותו (טוקסיות)
דוגמאות לאתרים
- אתיל מתיל אתר (השם מתחיל ב-אתיל כי לפי א”ב באנגלית E קודם ל-M)
- די-אתיל אתר (חומר ההרדמה הקלאסי)

- טרץ-בוטיל איזו-בוטיל אתר
הסבר השמות
- טרץ-בוטיל: מציין בוטיל (4 פחמנים) שבו יש פחמן שלישוני - כלומר פחמן המחובר לשלושה מתמירים
- איזו-בוטיל: מציין בוטיל (4 פחמנים) שבו המתיל ($\ce{CH3}$) יושב על הפחמן השני
שמות סיסטמטיים לאתרים
ניתן לתת לאתרים שמות בדרך נוספת באמצעות הסיומת “-אוקסי”:
- מתוקסי (מ-מתן)
- אתוקסי (מ-אתן)
לדוגמה: 2-מתוקסי-בוטאן - שרשרת של ארבעה פחמנים עם קבוצת אתר (OCH₃) על הפחמן השני.
הערה: סדר השמות בטרץ-בוטיל-איזו-בוטיל-אתר נקבע לפי סדר אלפביתי באנגלית. ה-“טרץ” וה-“איזו” הם חלק מהמילה המציינת את סוג הקבוצה.
אלכוהולים
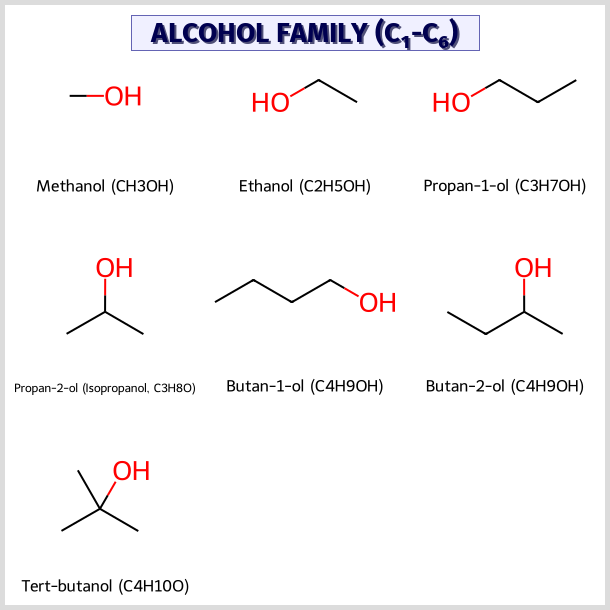
אלכוהולים הם תרכובות המכילות קבוצת הידרוקסיל (OH) המחוברת לפחמן. בדומה לאלקיל הלידים, סיווג האלכוהולים נקבע לפי סוג הפחמן שקבוצת ה-OH מחוברת אליו:
- אלכוהול ראשוני: קבוצת OH מחוברת לפחמן ראשוני (פחמן המחובר לפחמן אחד נוסף)
- אלכוהול שניוני: קבוצת OH מחוברת לפחמן שניוני (פחמן המחובר לשני פחמנים)
- אלכוהול שלישוני: קבוצת OH מחוברת לפחמן שלישוני (פחמן המחובר לשלושה פחמנים)
דוגמאות נפוצות של אלכוהולים
- מתנול (CH₃OH): אלכוהול רעיל - לעתים מוסיפים אותו באחוז קטן לאתנול במעבדות כדי למנוע שתייה
- אתנול (C₂H₅OH): האלכוהול הנמצא במשקאות אלכוהוליים
- פרופנול או פרופיל אלכוהול
- איזופרופיל אלכוהול
- איזובוטיל אלכוהול
כללי נומנקלטורה לאלכוהולים
קבוצת OH נחשבת קבוצה פונקציונלית (functional group) ולא רק מתמיר (substituent). הבדל חשוב בנומנקלטורה:
כאשר יש קבוצה פונקציונלית במולקולה, אנחנו לא בהכרח בוחרים את השרשרת הארוכה ביותר של פחמנים, אלא את השרשרת הארוכה ביותר שעליה יושבת הקבוצה הפונקציונלית.
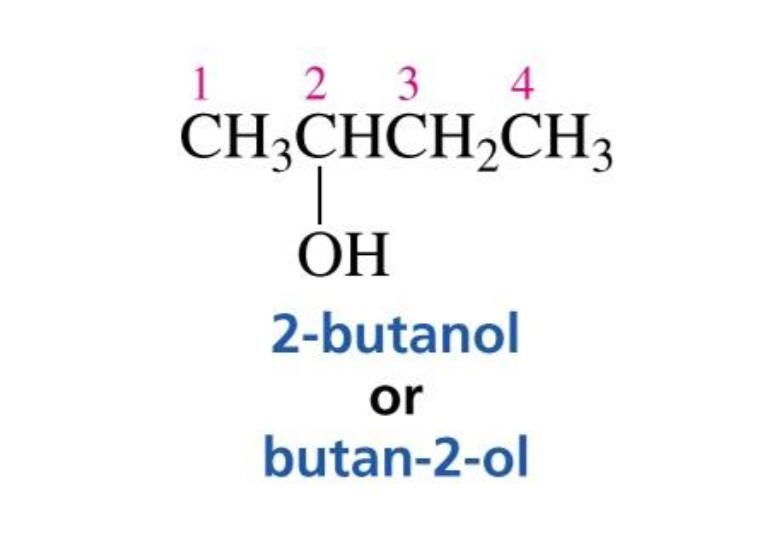
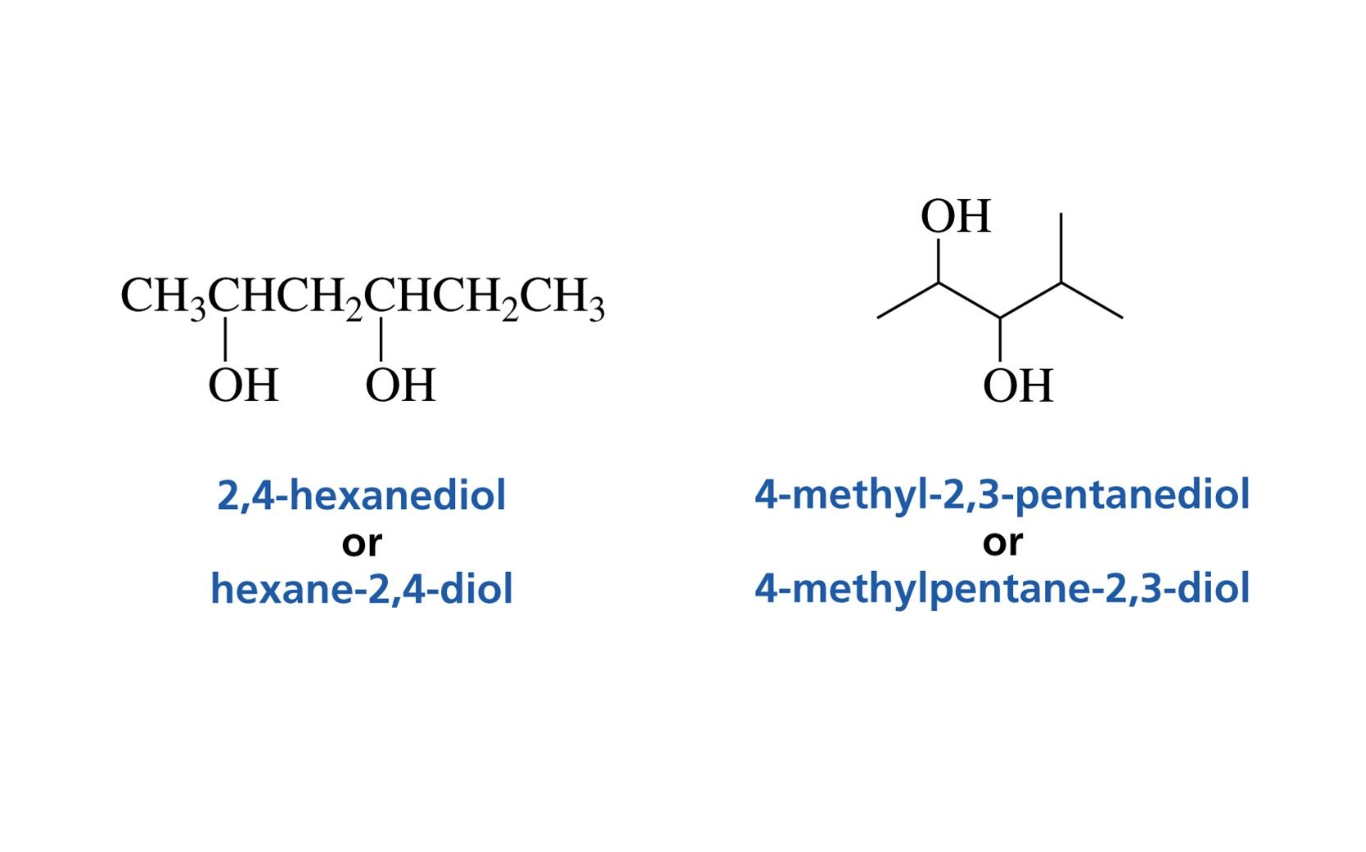
סיומת השם של אלכוהול היא -ול (-ol). לדוגמה:
- שרשרת של 4 פחמנים עם קבוצת OH על פחמן 2:
מספר קבוצות הידרוקסיל
- אם יש שתי קבוצות OH: די-אול (diol)
קבוצות פונקציונליות נוספות
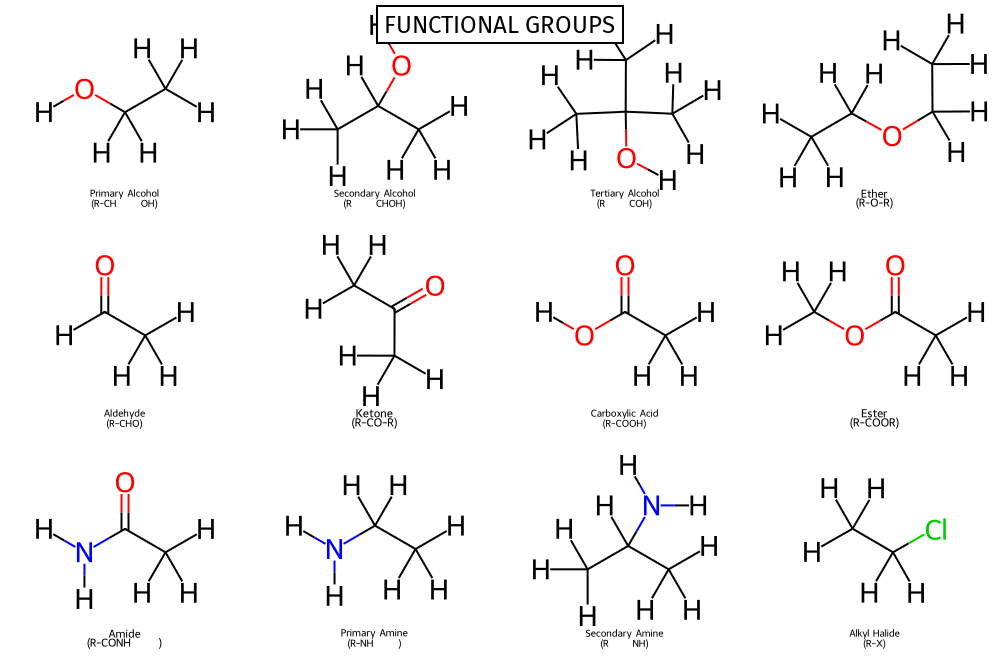
-
$\ce{-O-}$ Ether
-
$\ce{-CHO}$ קבוצת אלדהיד (aldehyde) זה בעצם כוהל נטול מימן (לא נכתב כמו קבוצת הידרוקסיל, קרי OH - המימן מופיע לפני החמצן)
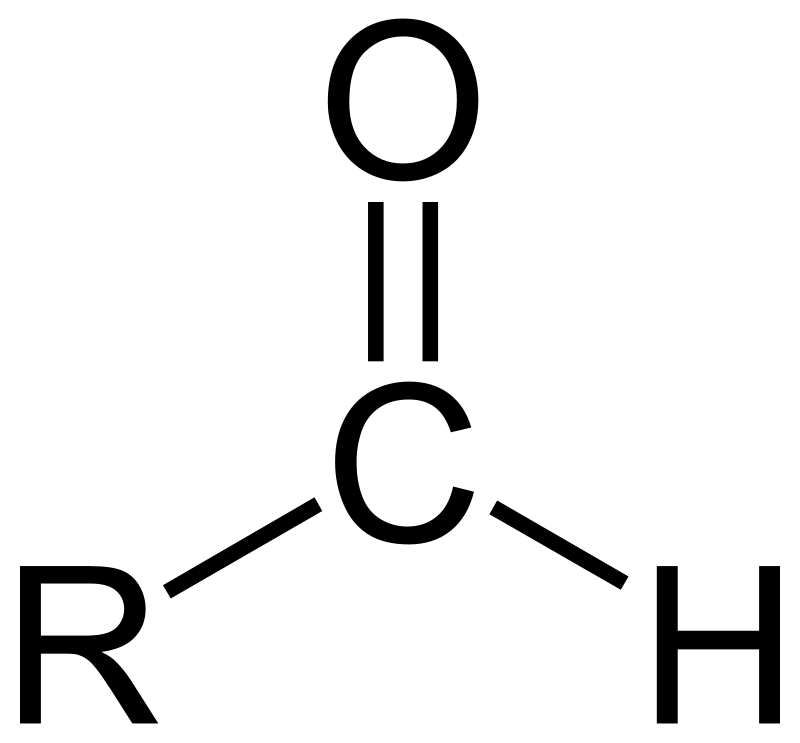
אלדהיד הידרוקסיל -
$\ce{-C=O}$ קבוצת קטון (ketone)
-
$\ce{-COOH}$ קבוצת קרבוקסיל (carboxyl) - חומצה קרבוקסילית
-
$\ce{-COO-}$ Ester (אסטר)
- $\ce{-NH2}$ קבוצת אמין (Amino)
- במקרה שיש חיבור לחמצן, זה נקרא אמיד (Amide) $\ce{-C(=O)NH2}$
- במקרה שיש חיבור לחמצן, זה נקרא אמיד (Amide) $\ce{-C(=O)NH2}$
-
$\ce{-NO2}$ Nitro
-
$\ce{-SH}$ Thiol
- $\ce{-SO3H}$ Sulfonic acid
מולקולות עם קבוצות פונקציונליות שונות
כאשר יש גם קבוצה פונקציונלית (כמו OH) וגם מתמיר אחר (כמו הלוגן), הקבוצה הפונקציונלית מקבלת עדיפות במספור. סדר השמות נקבע לפי א׳-ב׳ (באנגלית).
דוגמה:
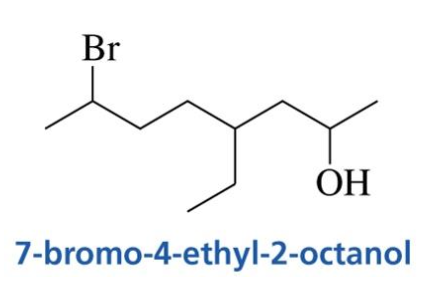
אלכוהולים ציקליים (כמו ציקלוהקסנול) נקראים באותו אופן, כאשר קבוצת ה-OH מקבלת את מספר 1 לצורך המספור, אך לא תמיד חייבים לציין את המספר:
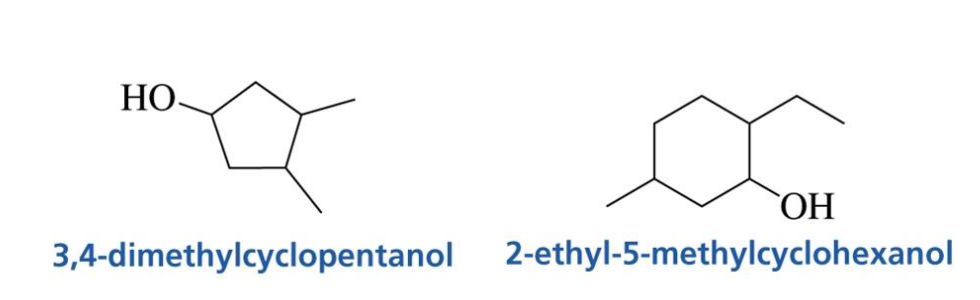 \[\underbrace{\left[\text{substituent}\right]}_{\text{methyl, ethoxy, chloro, etc.}} \; \left[\text{parent hydrocarbon}\right] \; \underbrace{\left[\text{functional group}\right]}_{\text{ol}}\]
\[\underbrace{\left[\text{substituent}\right]}_{\text{methyl, ethoxy, chloro, etc.}} \; \left[\text{parent hydrocarbon}\right] \; \underbrace{\left[\text{functional group}\right]}_{\text{ol}}\] אמינים
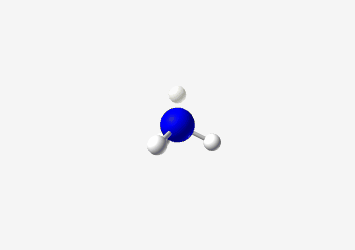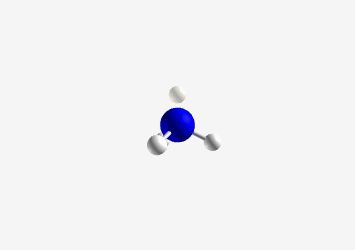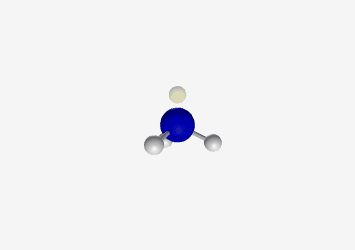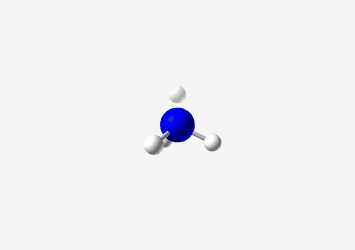 |
|---|
| אמוניה |
אמינים הם תרכובות המכילות חנקן (Nitrogen). האמין הבסיסי ביותר הוא אמוניה (NH₃).
סיווג אמינים
-
אמין ראשוני: חנקן מחובר לפחמן אחד (ושני מימנים)
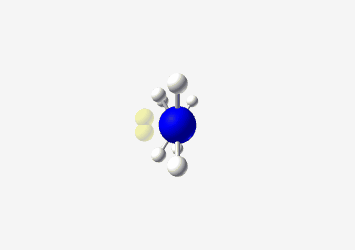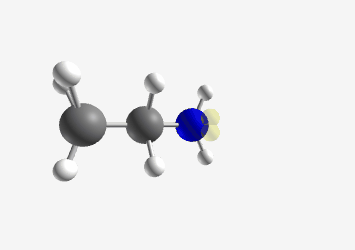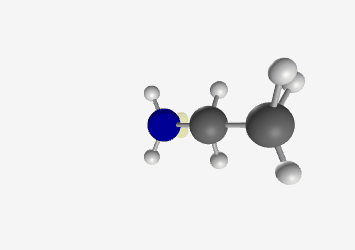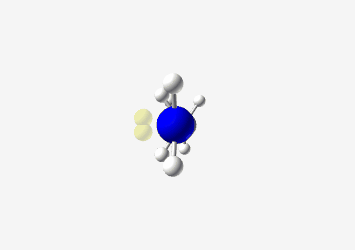
אתיל אמין $\ce{C2H5NH2}$ - אמין שניוני: חנקן מחובר לשני פחמנים (ומימן אחד)
- אמין שלישוני: חנקן מחובר לשלושה פחמנים
חשוב לציין: בניגוד לאלכוהולים ואלקיל הלידים, בהם הסיווג נקבע לפי הפחמן שהקבוצה מחוברת אליו, באמינים הסיווג נקבע לפי החנקן עצמו - כמה קבוצות פחמן מחוברות אליו.
נומנקלטורה של אמינים
- מתיל אמין: אמין עם קבוצת מתיל
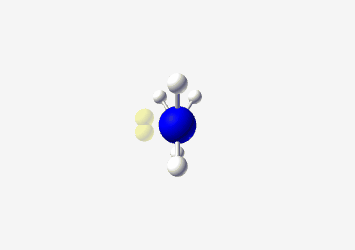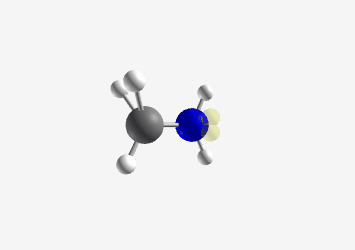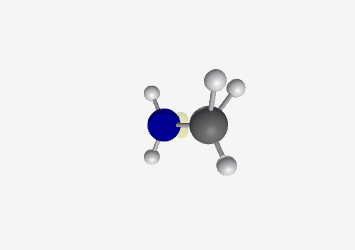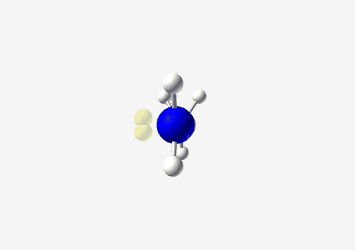 |
|---|
| מתיל אמין $\ce{CH3NH2}$ |
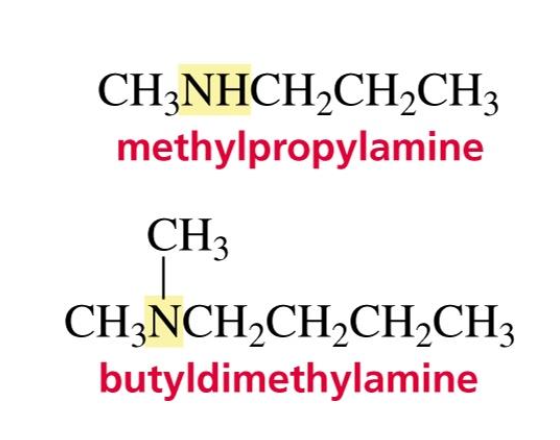
- מתיל פרופיל אמין: אמין שניוני עם קבוצות מתיל ופרופיל:
כאשר האמין הוא חלק ממולקולה גדולה יותר, משתמשים בסימן “N-“ לפני שם המתמיר כדי לציין שהמתמיר מחובר לחנקן:
לדוגמה:
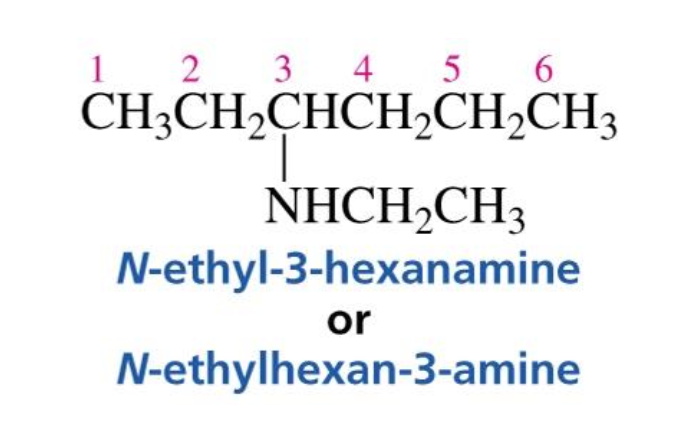
התוספת החדשה והחשובה בנושא האמינים היא הסימן “N-“, המציין שהמתמיר (substitution) יושב על האמין (חנקן), ולא על הפחמן.
תרגול נומנקלטורה של תרכובות אורגניות
תרגול מתן שמות למולקולות
כדי לוודא שהחומר על נומנקלטורה (מתן שמות) הובן כראוי, נעבור לתרגול. להלן דוגמאות מהספר של ברוס (Bruce) שכולל ספר שאלות ותשובות הזמין בספרייה.
תרגיל ראשון
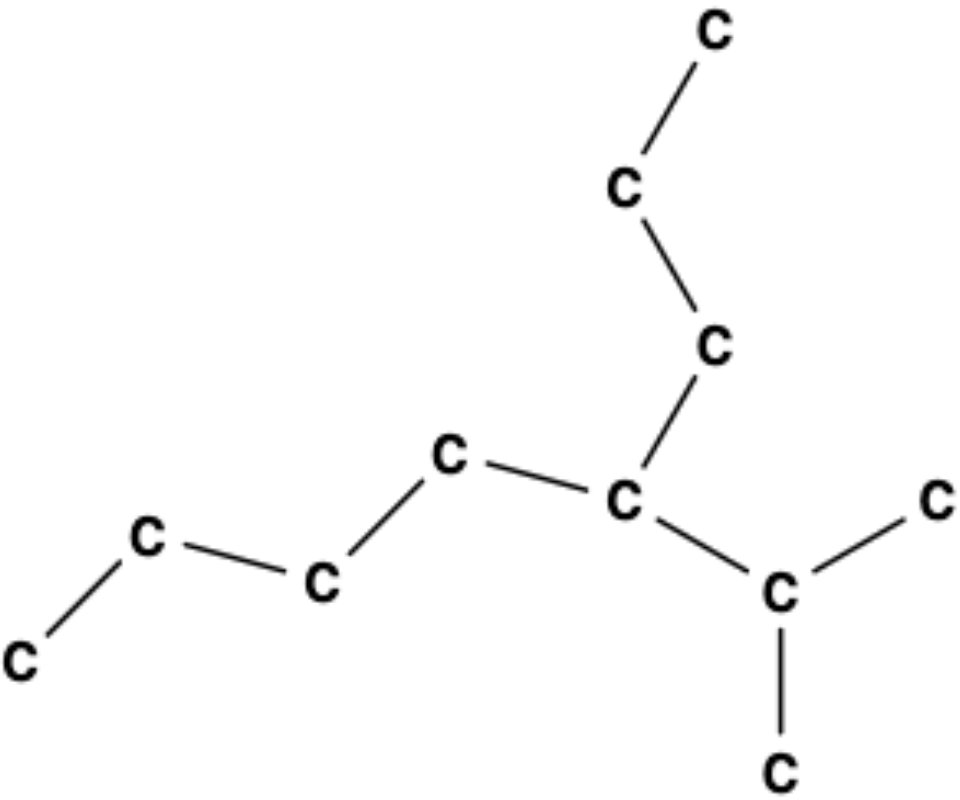
גישת פתרון שיטתית:
- זיהוי השרשרת הארוכה ביותר:
- במקרה זה, השרשרת הארוכה ביותר מכילה 8 פחמנים
- מיד ניתן לפסול שלוש תשובות עם “הפטה” (7 פחמנים) ולהתמקד בתשובות עם “אוקטה” (8 פחמנים)
- בחירת כיוון המספור:
- מתחילים למספר מהכיוון שייתן את המספרים הנמוכים ביותר למתמירים
- אם נתחיל מצד אחד, המתמיר יושב על פחמן 4
- אם נתחיל מהצד השני, הוא יושב על פחמן 5
- לכן נתחיל מהצד שנותן את פחמן 4
- זיהוי המתמירים:
- על פחמן 4 יש קבוצת איזופרופיל (יש שלושה פחמנים עם פיצול בשרשרת)
התשובה הנכונה היא: 4-איזופרופיל-אוקטאן
$\text{4-Isopropyloctane}$
הערות חשובות
- הקידומת “איזו” (iso) מציינת שהשרשרת אינה ישרה אלא מפוצלת
- אם היו יותר מתמירים, היינו נותנים שמות סיסטמטיים ולא משתמשים בקידומת “איזו”
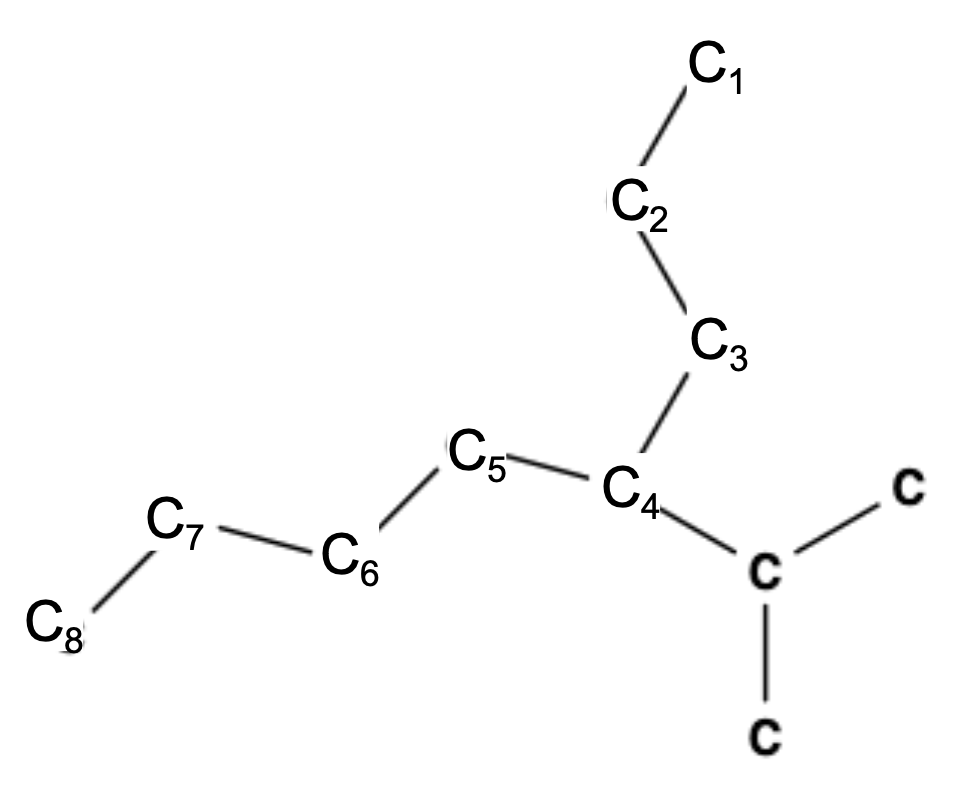
תרגיל שני
-
זיהוי שרשרת הפחמן הרציפה הארוכה ביותר
- מצא את השרשרת הישרה הארוכה ביותר של אטומי פחמן.
- זה יקבע את שם האב (לדוגמה, הפטאן עבור שרשרת של 7 פחמנים).
-
מספור שרשרת הפחמן
- מספר את אטומי הפחמן מהקצה הקרוב ביותר למחליף הראשון (הלוגן או קבוצת אלקיל).
- זה מבטיח את המספרים הנמוכים ביותר האפשריים למחליפים.
-
זיהוי ושיום מתמירים
- חפש כל הלוגן (Cl, Br, F, I) או קבוצות אלקיל (מתיל, אתיל, וכו’).
- במקרה זה:
- שני אטומי ברום (Br) על פחמן 3 ← “3,3-דיברומו”
- אטום כלור אחד (Cl) על פחמן 1 ← “1-כלורו”
-
סידור המתמירים לפי סדר אלפביתי
- הלוגנים וקבוצות אלקיל מפורטים בסדר אלפביתי, תוך התעלמות מקידומות מספריות (די-, טרי-, וכו’).
- “ברומו” בא לפני “כלורו” ← “3,3-דיברומו-1-כלורוהפטאן”
$\text{3,3-Dibromo-1-Chloroheptane}$
תרגיל שלישי
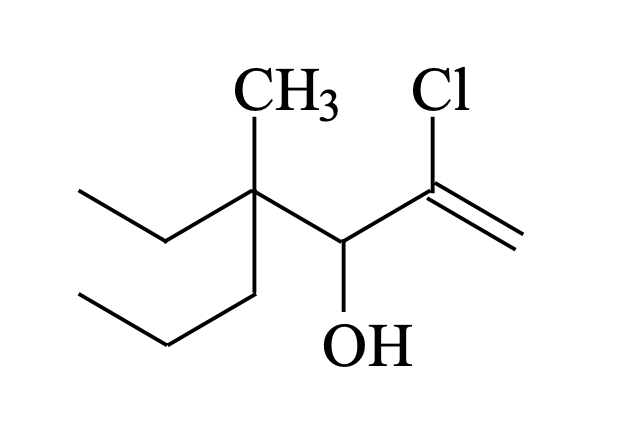
גישת פתרון:
- זיהוי השרשרת הארוכה ביותר:
- במקרה זה השרשרת הארוכה ביותר מכילה 7 פחמנים (הפטן)
- בחירת כיוון המספור:
- נתחיל מהצד הימני כי כל המתמירים מרוכזים בצד זה
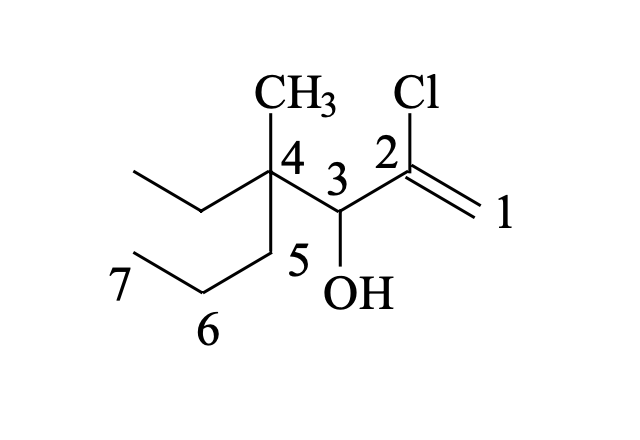
- זיהוי המתמירים וקבוצות פונקציונליות:
- פחמן 2: כלור
- פחמן 3: קבוצת הידרוקסיל (OH)
- פחמן 4: קבוצות מתיל ואתיל
- פחמן 1: קשר כפול
- בניית השם:
- 2-כלורו (כלור על פחמן 2)
- 4-אתיל (אתיל על פחמן 4, נרשם לפני מתיל לפי סדר א׳-ב׳)
- 4-מתיל (מתיל על פחמן 4)
- 1-הפטן (שרשרת של 7 פחמנים עם קשר כפול בעמדה 1)
- 3-אול (קבוצת הידרוקסיל בעמדה 3)
השם המלא: 2-כלורו-4-אתיל-4-מתיל-1-הפטן-3-אול
\[\text{2-Chloro-4-Ethyl-4-Methyl-1-Hepten-3-ol}\]או
\[\text{2-Chloro-4-Ethyl-4-MethylHept-1-en-3-ol}\]
הערות חשובות
- אפשר היה לכתוב גם “הפטנול”, אך הפרדת הסיומות עוזרת להבהיר שיש גם קשר כפול וגם קבוצת הידרוקסיל
- הקבוצות נכתבות לפי סדר אלפביתי באנגלית
- המספרים מציינים את מיקום הקבוצות על השרשרת
- “1-הפטן” מציין שהקשר הכפול נמצא בעמדה 1 של שרשרת בת 7 פחמנים
- “3-אול” מציין שקבוצת ההידרוקסיל נמצאת בעמדה 3
בתרגילים אלה ניתן לראות יישום של כל הכללים שנלמדו לגבי נומנקלטורה של תרכובות אורגניות.
הבהרות לגבי סיומות ומספור
- סיומות כמו “-אן”, “-אן” ו”-אול” מתייחסות לשרשרת הפחמנים וצריכות להופיע בסוף השם
- במקרה של מולקולה עם קשר כפול וקבוצת הידרוקסיל (OH):
- ניתן לכתוב “הפטנול” אך זה פחות ברור
- עדיף לכתוב “1-הפטן-3-אול” כך שברור שיש קשר כפול בעמדה 1 וקבוצת OH בעמדה 3
- המספרים מציינים את המיקום של הקבוצות הפונקציונליות על השרשרת
מבנה מרחבי של תרכובות אורגניות
אלקיל הלידים (C-X, כאשר X הוא הלוגן)
- במתאן (CH₄), הפחמן הוא בהיברידיזציה sp³ עם מבנה טטראהדרלי (ארבעה קדקודים)
- הזווית בין המתמירים היא 109.5°
- אורך הקשר C-H הוא 1.1 אנגסטרום
באלקיל הלידים:
- נשמר המבנה הטטראהדרלי (sp³)
- מה שמשתנה הוא אורך הקשר בין הפחמן להלוגן:
- C-F: הקשר הקצר ביותר (קשר חזק)
- C-Cl: קשר ארוך יותר
- C-Br: קשר ארוך יותר
- C-I: הקשר הארוך ביותר (קשר חלש)
חשוב להבין: ככל שהקשר קצר יותר, הוא גם חזק יותר. לכן, יוד יעזוב את הקשר בקלות רבה יותר מפלואור. זה יהיה חשוב בהמשך כאשר תלמדו על תגובות החלפה (SN1, SN2, E1, E2).
אלכוהולים (C-OH)
- גם באלכוהולים הפחמן בהיברידיזציה sp³
- אך הזווית מעט קטנה יותר מ-109.5° (בסביבות 104°)
- הסיבה לכך היא שזוגות אלקטרונים לא קושרים דוחפים בצורה חזקה יותר לעומת מתמירים
אתרים (C-O-C)
- מבנה מרחבי דומה לאלכוהולים
- החמצן בהיברידיזציה sp³
אמינים (C-N)
- אמין ראשוני: חנקן מחובר לפחמן אחד
- אמין שניוני: חנקן מחובר לשני פחמנים
- אמין שלישוני: חנקן מחובר לשלושה פחמנים
- גם כאן מבנה טטראהדרלי (sp³)
אינטראקציות בין מולקולות
בטבע, רוב התגובות הכימיות מתרחשות בתמיסה עם מספר עצום של מולקולות (מספר אבוגדרו), ולכן חשוב להבין גם את האינטראקציות בין המולקולות.
ישנם שלושה סוגים עיקריים של קשרים בין-מולקולריים, מסודרים מהחלש לחזק:
1. כוחות לונדון (London Forces)
- נוצרים כתוצאה מדיפול רגעי במולקולה
- גם במולקולות סימטריות כמו מתאן (CH₄) יכולים להיווצר דיפולים רגעיים
- למתאן אין מומנט דיפול קבוע (הווקטור השקול הוא אפס), אבל יש לו כושר ליצור דיפולים רגעיים
- קשרים חלשים מאוד וזמניים בטבעם
- השפעתם זניחה במערכות ביולוגיות
2. קשרי דיפול-דיפול (Dipole-Dipole)
- נוצרים בין מולקולות בעלות דיפול קבוע
- לדוגמה: במתנול (CH₃OH) יש דיפול קבוע בגלל קבוצת OH
- חזקים יותר מכוחות לונדון
3. קשרי מימן (Hydrogen Bonds)
- הקשרים הבין-מולקולריים החזקים ביותר
- מאוד משמעותיים בהשפעתם על תכונות חומרים ובמערכות ביולוגיות
- ניתן למדוד ולראות את השפעתם באופן ישיר
האינטראקציות הבין-מולקולריות משפיעות על תכונות פיזיקליות רבות, כגון נקודת רתיחה - ככל שהמולקולה פחות מסועפת (“branched”), היא יכולה ליצור קשרים בין-מולקולריים בצורה טובה יותר.
כוחות לונדון ונקודת רתיחה
- כאשר המולקולה בעלת מבנה ישר (לא מסועף), היא יכולה ליצור יותר קשרי לונדון עם מולקולות אחרות
- מולקולה מסועפת (עם מתמירים רבים, כמו טרץ-בוטיל) תיצור פחות קשרי לונדון
- השפעה על נקודת רתיחה: ככל שיש יותר קשרים בין-מולקולריים, יש להשקיע יותר אנרגיה כדי להפריד בין המולקולות
- לכן, נקודת הרתיחה של פנטן (שרשרת ישרה) גבוהה יותר מנקודת הרתיחה של מולקולה מסועפת עם אותו מספר פחמנים
מגמות בנקודת רתיחה
- לאורך השרשרת (מצוין בחץ כחול):
- ככל שהשרשרת ארוכה יותר, נקודת הרתיחה עולה (יותר קשרי לונדון)
- חל על אלקנים, אתרים, אלכוהולים ואמינים
- השפעת המתמירים (מצוין בחץ ירוק):
- ככל שהמולקולה יותר פולארית, נקודת הרתיחה עולה
- לדוגמה, באלקיל הלידים: מ-H לפלואור, כלור, ברום ויוד
- למרות שפלואור יותר אלקטרושלילי, הגודל של היסוד משפיע יותר (יוד גדול יותר, לכן יכול להתמודד טוב יותר עם המטען)
קשרי מימן
קשרי מימן הם הקשרים הבין-מולקולריים החזקים ביותר. נוצרים בין מימן לאטומי NOF (חנקן, חמצן, פלואור).
דוגמה משמעותית: ההבדל בין מתאן (CH₄) למים (H₂O)
- שתי מולקולות קטנות ודומות מבחינה כימית
- ההבדל בנקודת הרתיחה: מעל 200 מעלות!
- הסיבה: קשרי מימן במים מייצבים את המולקולות זו לזו
באמינים:
- אמין ראשוני: יש לו שני מימנים שיכולים ליצור קשרי מימן
- אמין שניוני: יש לו מימן אחד שיכול ליצור קשרי מימן
- אמין שלישוני: אין לו מימנים, לכן אינו יכול ליצור קשרי מימן
- לכן נקודת הרתיחה יורדת כשעוברים מאמין ראשוני לשלישוני
חשיבות קשרי מימן במערכות ביולוגיות
מבני חלבונים
- קשרי מימן מייצבים מבנים של חלבונים, כגון מבנה אלפא-הליקס
- אלפא-הליקס: סיבוב אחד מכיל כ-3.6 חומצות אמינו
- דוגמה: חלבון ציקלואוקסגנז 1 (COX-1) - כולל מספר מבני אלפא-הליקס
ציקלואוקסגנז (COX)
- אנזים שמייצר ליפידים בגוף
- כאשר הגוף בסטרס או בתגובה דלקתית, האנזים עובד ביתר
- תוצאה: ייצור מוגבר של ליפידים הגורמים לתגובות דלקתיות (חום, כאבים)
תרופות נוגדות דלקת
איבופרופן (נמצא ב-Advil):
- נקשר לאנזים COX-1 באמצעות קשרי מימן
- מעכב את פעילות האנזים ומפחית תגובות דלקתיות
- שייך לקבוצת NSAID (Non-Steroidal Anti-Inflammatory Drugs)
- אינו סלקטיבי לחלוטין - נקשר גם לאנזימים אחרים, מה שגורם לתופעות לוואי
סוגי תרופות ומנגנון פעולתן
שלוש קבוצות עיקריות של תרופות
- מולקולות קטנות (Small Molecules):
- כ-85% מהתרופות הקיימות
- יתרון: חודרות לתא בקלות
- חיסרון: פחות ספציפיות (יותר תופעות לוואי)
- תרופות ביולוגיות (Biological Drugs / Antibodies):
- כ-5% מהתרופות
- יתרון: ספציפיות מאוד
- חיסרון: אינן חודרות לתא בקלות, יקרות
- פפטידים (Peptides):
- באמצע בין שתי הקבוצות הקודמות
- יתרון: ספציפיות יותר ממולקולות קטנות וחודרות לתא
- דוגמה: אינסולין (פפטיד של 51 חומצות אמינו)
- עד 1982 הופק מלבלבים של פרות וחזירים, ומאז מיוצר במעבדה
דינמיות של חלבונים
- חלבונים אינם סטטיים אלא דינמיים - המבנה שלהם משתנה כל הזמן
- שינויים קונפורמציונליים (במבנה) חשובים לפעילות החלבון
- בפתרון מבנה חלבון (ע”י X-ray או NMR) רואים רק תמונת מצב אחת
- המבנים העיקריים בחלבונים: אלפא-הליקס (המוצג בדוגמה) ובטא-שיט
- על פיענוח מבנה הדנ”א (Picture 51) קיבלו ווטסון וקריק פרס נובל ב-1955 (תוך התעלמות מתרומתה של רוזלינד פרנקלין)
AlphaFold וניבוי מבנה חלבונים
- AlphaFold: תוכנה שפיתחה גוגל לניבוי מבנה תלת-ממדי של חלבונים
- מובילי התחום בניבוי מבנה חלבונים הם שני מדענים ישראלים (אחד בסטנפורד ואחד בסן-דייגו)
- לפני AlphaFold, ניבויי מבנה חלבונים היו מוצלחים רק בכ-30% מהמקרים
- AlphaFold הביאה לפריצת דרך משמעותית בתחום, אך עדיין יש טעויות בניבויים
עקרון “like dissolves like” (דומה ממס דומה)
- חומרים נוטים להתמוסס בחומרים דומים להם
- חומרים פולאריים מתמוססים בממסים פולאריים (כמו מים)
- חומרים לא פולאריים (הידרופוביים) מתמוססים בממסים לא פולאריים (ממסים אורגניים)
מונחים חשובים
- הידרופילי: אוהב מים, מתמוסס במים
- הידרופובי: דוחה מים, לא מתמוסס במים, מתמוסס בממסים אורגניים
- BBB (Blood-Brain Barrier): מחסום דם-מוח, מונע כניסת חומרים רבים למוח
מסיסות במים והיחס בין חמצן לפחמן
- כדי שחומר יתמוסס במים, היחס בין חמצן לפחמן צריך להיות לפחות 1:3
- דוגמאות:
- חמצן אחד ושני פחמנים: מתמוסס במים
- חמצן אחד ושלושה פחמנים: מתמוסס במים
- חמצן אחד וארבעה פחמנים: כבר לא מתמוסס במים
- ככל שהמולקולה מכילה יותר פחמנים ביחס לחמצן, המסיסות במים יורדת
תכנון תרופות וחדירות לתאים
אתגרים בתכנון תרופות
- התרופה צריכה להגיע לאיבר המטרה (למשל המוח)
- התרופה צריכה לחדור לתא
- התרופה צריכה להתקשר לחלבון המטרה
דוגמה: חומרים שפועלים במוח
- THC (החומר הפעיל בקנאביס): חודר למוח בזכות “זנב” הידרופובי
- לעתים מוסיפים “זנב” הידרופובי לתרופות כדי לאפשר להן לחצות את מחסום דם-מוח
שיטות סינתזה כימית להוספת קבוצות
- מוסיפים קבוצה פונקציונלית שניתן להחליף בקלות
- נדרשת “קבוצה עוזבת טובה” - יסוד שיודע להסתדר עם המטען שלו כשהוא עוזב
- דוגמה: יוד (I) - קבוצה גדולה עם הרבה אורביטלות שיכולה להסתדר עם המטען שלה ויש לה קשר חלש
- בתגובת החלפה נוקלאופילית (SN1/SN2) ניתן להכניס קבוצה חדשה במקום הקבוצה העוזבת
ממברנות תאים ומעבר תרופות
מבנה ממברנת התא
- שכבה כפולה של ליפידים
- ראש פולארי (פונה החוצה לממס)
- זנב הידרופובי (פונה פנימה)
האתגר בהעברת תרופות דרך ממברנות
- הממברנה היא גם פולארית וגם לא פולארית
- התרופה צריכה להיות בעלת שתי תכונות: גם פולארית וגם לא פולארית
- דוגמה מחיי היומיום לחומר כזה: סבון (המסוגל להמיס שמן ולהתמוסס במים)
גורמים המשפיעים על חדירת תרופות
- ריכוז התרופה משפיע על מנגנון החדירה
- במחלות נוירודגנרטיביות (כמו פרקינסון, ALS) מחסום דם-מוח נפגם
- בחולים עם BBB פגום, גם תרופות שבדרך כלל לא חודרות למוח יכולות לעבור
- זה מקשה על ניסויים קליניים כי החולים נמצאים במצבים שונים של המחלה
טכניקות להעברת תרופות
- צירוף רצף של 11 חומצות אמינו (TAT) הנגזר מחלבון של HIV
- HIV יודע לחדור לתאים, והשתמשו ברצף ספציפי שמסוגל לחדור דרך ממברנת התא
- מצרפים את הרצף הזה למולקולות קטנות, לחלבונים או לפפטידים כדי להעבירם לתא
היטלי ניומן (Newman Projections)
היטלי ניומן הם שיטה חשובה לתיאור מבנה מרחבי של מולקולות, במיוחד כשמתבוננים במולקולה לאורך ציר קשר בין שני פחמנים.
שיטת הייצוג בהיטל ניומן
- הפחמן הקדמי (הקרוב אלינו) מיוצג כעיגול
- הפחמן האחורי מיוצג כנקודה
- המתמירים (כמו מימנים) מיוצגים כקווים היוצאים מהעיגול או מהנקודה
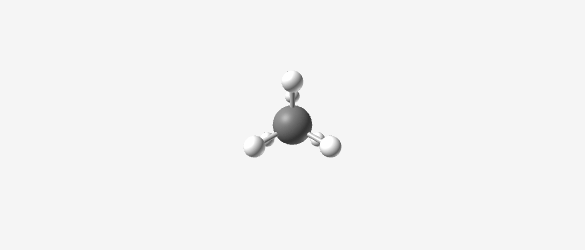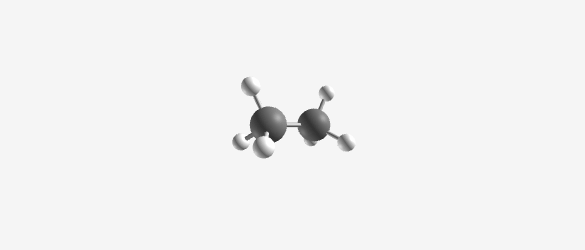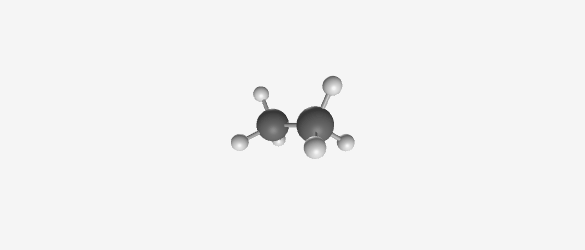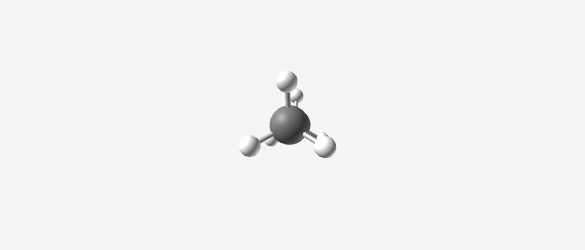
דוגמה: אתאן (C₂H₆)
- מורכב משני פחמנים ושישה מימנים
- בהיטל ניומן:
- פחמן אחד מיוצג כעיגול עם שלושה מימנים (מסודרים במרווחים של 120°)
- הפחמן השני מיוצג כנקודה עם שלושה מימנים
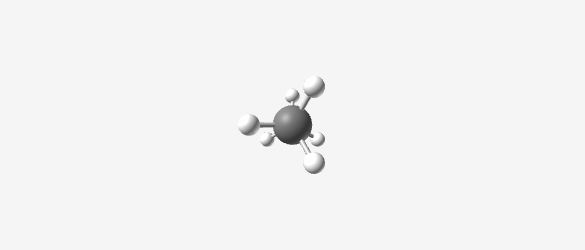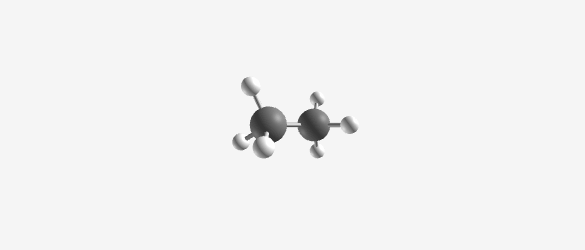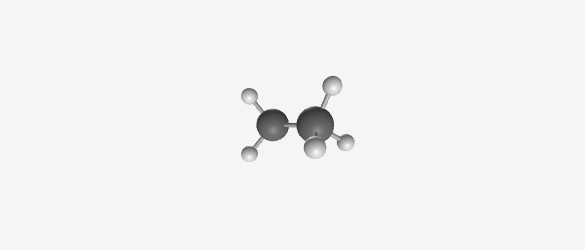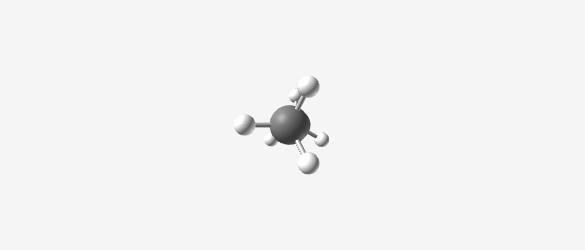 |  |
|---|---|
| היטל ניומן של אתאן (C₂H₆) - מבנה מדורג | היטל ניומן של אתאן (C₂H₆) - מבנה חופף |
צורות קונפורמציוניות (מצבי סיבוב)
בהיטל ניומן ניתן לראות שתי צורות קונפורמציוניות עיקריות:
 |  |
|---|---|
| היטל ניומן של אתאן (C₂H₆) | היטל ניומן של אתאן (C₂H₆) |
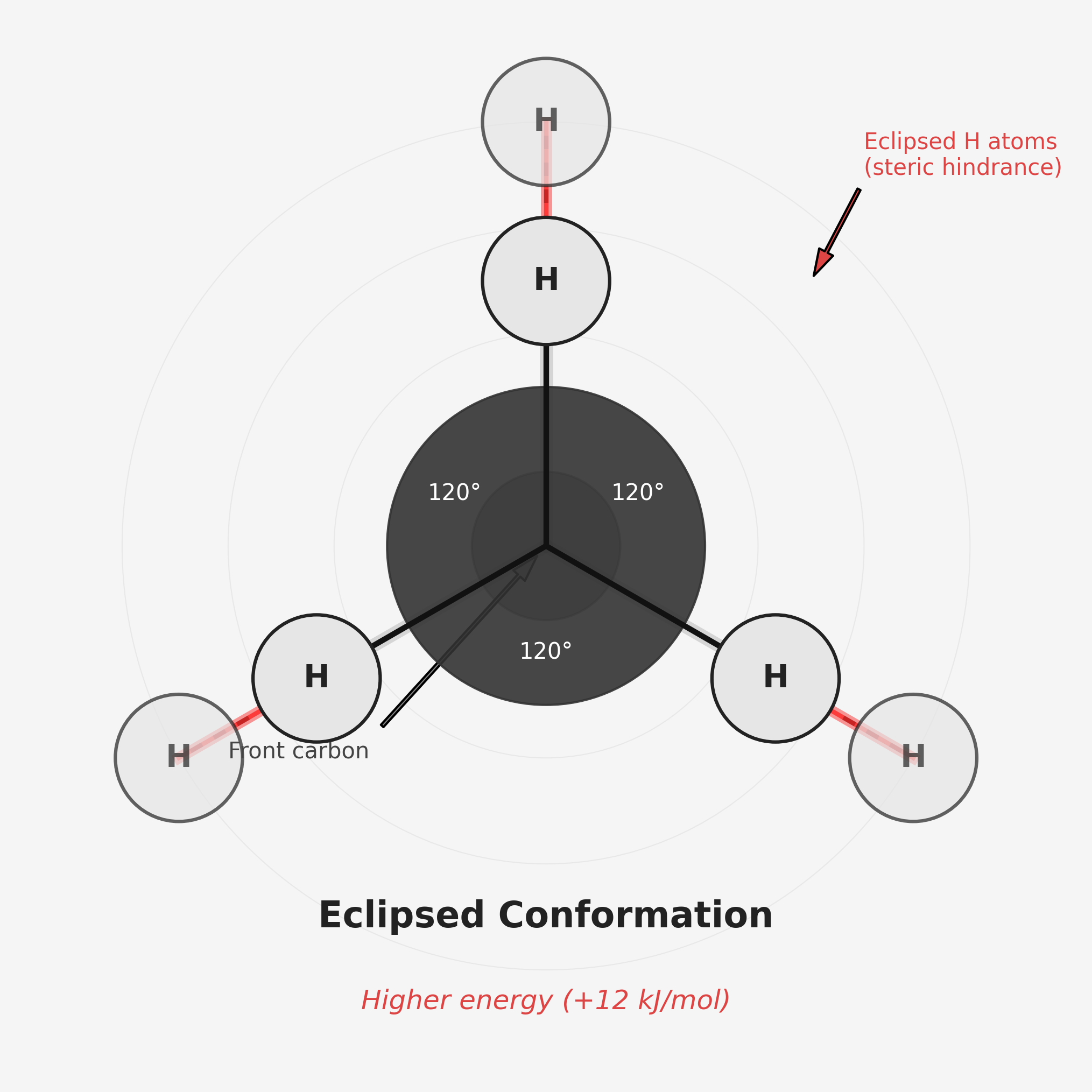
- אקליפסד (Eclipsed): המתמירים מהפחמן הקדמי והאחורי מיושרים זה מעל זה
- פחות יציבה אנרגטית
- גורמת לדחייה בין ענני האלקטרונים של המתמירים
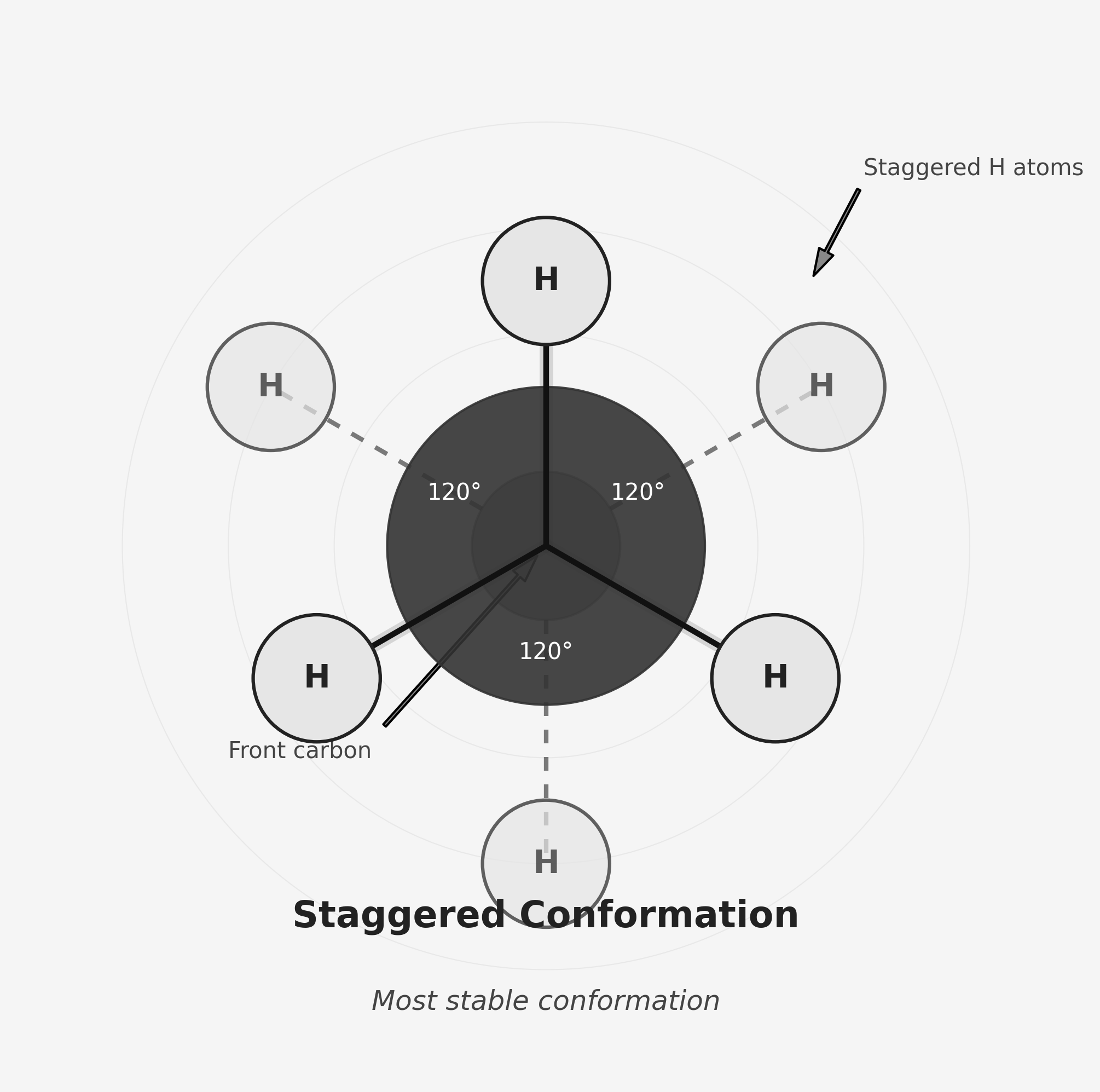
- סטגרד (Staggered): המתמירים מסודרים בזוויות שונות (מוסטים ב-60° זה מזה)
- יציבה יותר מבחינה אנרגטית
- המתמירים רחוקים יותר זה מזה, ולכן פחות דחייה
המחסום האנרגטי
- המעבר בין צורת אקליפסד לסטגרד דורש כ-3 קילוקלוריות למול
- המולקולה “מסתובבת” סביב ציר הקשר ועוברת בין מצבים אלה
- סיבוב מלא (360°) יוצר דפוס חוזר שבו המולקולה עוברת דרך 3 מצבי סטגרד ו-3 מצבי אקליפסד
הסיבה ליציבות הסטגרד
האקליפסד פחות יציב בגלל דחייה בין ענני האלקטרונים:
- למרות שהאלקטרונים של הקשר C-H נמצאים בקשר קוולנטי, יש עדיין ענן אלקטרונים מסביב
- כאשר שני מימנים נמצאים זה מעל זה (אקליפסד), ענני האלקטרונים שלהם קרובים וגורמים לדחייה
- בסטגרד, המימנים רחוקים יותר זה מזה, והדחייה קטנה
ייצוג מולקולות ארוכות יותר
- בשרשרת של יותר משני פחמנים, מסתכלים בכל פעם על זוג פחמנים סמוכים
- בשרשרת כמו בוטאן (4 פחמנים), ניתן לבחור להסתכל על:
- הקשר בין פחמן 1 ופחמן 2, כאשר פחמנים 3 ו-4 הם מתמירים על פחמן 2
- הקשר בין פחמנים אחרים, תלוי במה רוצים להדגיש
הבדלים בין קונפורמציות שונות
- כאשר כל המתמירים הם מימנים (כמו באתאן), כל צורות הסטגרד הן זהות (וכל צורות האקליפסד זהות)
- כאשר יש מתמירים שונים (כמו CH₃, Br, I וכד’), המצבים השונים של סטגרד יהיו שונים זה מזה מבחינה אנרגטית
חשיבות הבנת המבנה המרחבי היא שזה מסביר מדוע אנחנו מציירים שרשראות פחמן בצורת “זיגזג” ולא כקו ישר - המבנה ה”זיגזגי” משקף את העובדה שהפחמנים מעדיפים להיות במצב סטגרד זה ביחס לזה.
היטלי ניומן עם מתמירים שונים
כאשר המתמירים על שני פחמנים סמוכים אינם זהים, המשמעות האנרגטית של קונפורמציות שונות הופכת משמעותית יותר:
- במבחן אמריקאי (מולטי צ’ויס) תידרשו לבחור את הקונפורמציה הנכונה מבין מספר אפשרויות
השפעת גודל המתמירים על אנרגיית הדחייה
- דחייה בין קבוצות CH₃-CH₃ (מתיל-מתיל) גדולה יותר מדחייה בין CH₃-H (מתיל-מימן)
- דחייה בין קבוצות גדולות יוצרת מתח מרחבי גדול יותר ומעלה את האנרגיה של המולקולה
- ככל שהדחייה גדולה יותר:
- החומר פחות יציב
- האנרגיה שלו גבוהה יותר
סדר יציבות לדוגמה
- קונפורמציה A (אקליפסד עם CH₃-CH₃): הכי גבוהה באנרגיה (הכי פחות יציבה)
- קונפורמציה B: פחות אנרגיה מ-A כי המתיל ($\ce{CH3}$)ים רחוקים זה מזה (סטגרד)
- קונפורמציה C: יש בה דחייה בין מתיל-מימן (ולא מתיל-מתיל), לכן האנרגיה נמוכה יותר
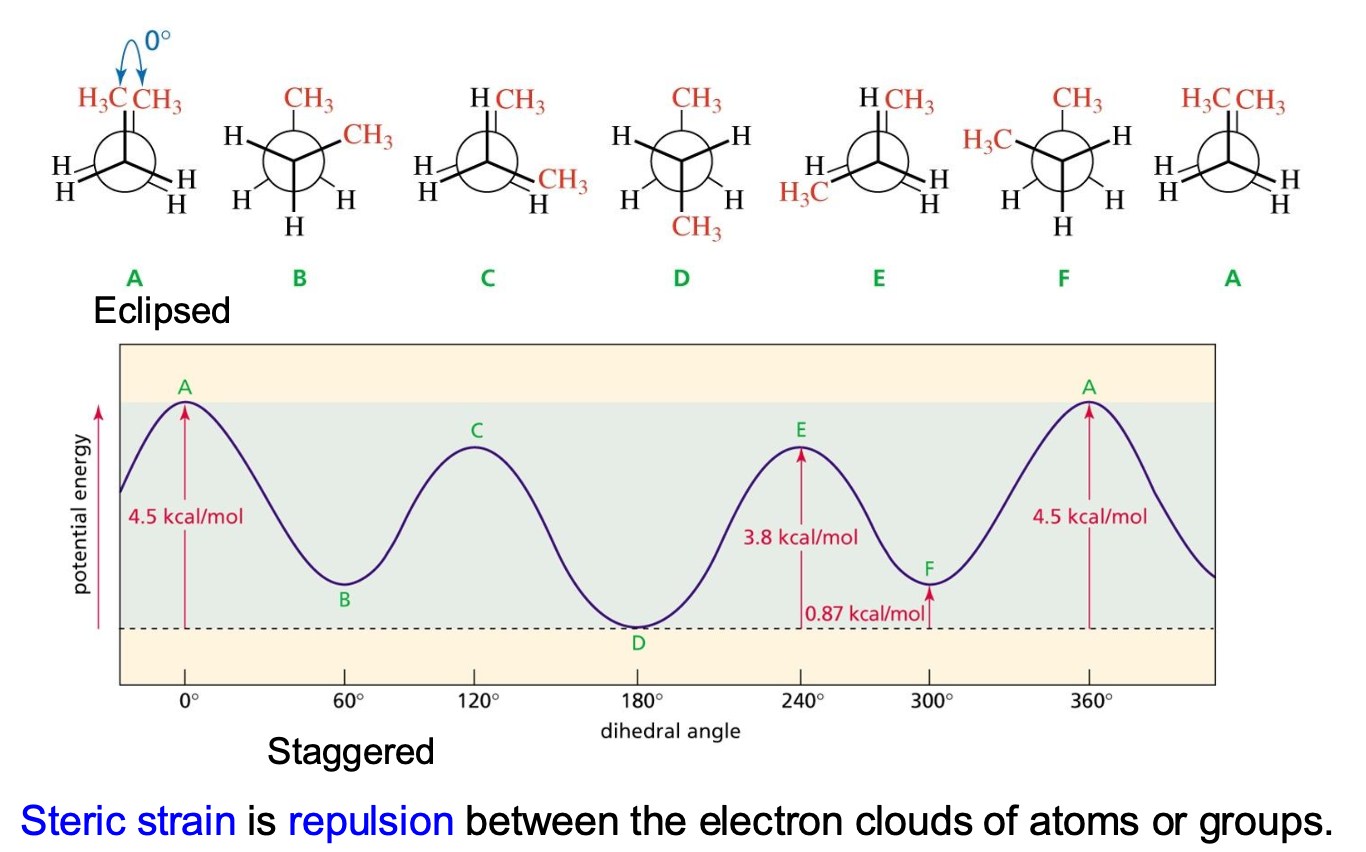
הדינמיות של מולקולות
מולקולות הן דינמיות - מה שאנו מציירים הם בעצם מצבי קיצון:
- האקליפסד והסטגרד הם מצבי קיצון
- המולקולה עוברת ממצב למצב באופן דינמי (מתנדנדת)
- המולקולה מתייצבת בדרך כלל במצב הסטגרד (60° בין המתמירים) כי זה המצב היציב ביותר
הסיבה לצורת “זיגזג” בשרשראות פחמן
עכשיו ברור למה אנחנו מציירים שרשראות פחמן בצורת זיגזג:
- המבנה הסטגרד, שבו המתמירים נמצאים בזווית של 60° אחד ביחס לשני, הוא המצב היציב ביותר
- צורת הזיגזג בייצוג פחמנים מחקה את המבנה האמיתי של השרשרת
- יתרון נוסף: קל יותר לספור את מספר הפחמנים במולקולה
מולקולות טבעתיות (ציקליות)
במבנים טבעתיים (ציקלים) נוסף מימד אחר - אילוץ הזווית במבנה הטבעת.
אילוץ הזווית בטבעות שונות
- ציקלופרופאן (3 פחמנים):
- הזוויות נאלצות להיות 60° במקום 109.5° (הזווית האידיאלית של sp³)
- אילוץ חזק מאוד - חוסר יציבות גבוה
- ציקלובוטאן (4 פחמנים):
- הזוויות נאלצות להיות 90° במקום 109.5°
- אילוץ חזק, אך פחות מציקלופרופאן - יציב יותר מציקלופרופאן אך עדיין לא יציב
- ציקלופנטאן (5 פחמנים):
- הזוויות קרובות ל-108° (קרוב לזווית האידיאלית)
- יציבות גבוהה יחסית
- ציקלוהקסאן (6 פחמנים):
- הזוויות קרובות לזווית האידיאלית
- יציבות גבוהה
- צורה נפוצה בטבע (למשל, חלת דבורים בצורת משושים)
הקשר בין זווית ויציבות
- ככל שהזווית בטבעת מתרחקת מהזווית האידיאלית (109.5°), כך הטבעת פחות יציבה
- טבעות בנות 5-6 פחמנים הן הנפוצות והיציבות ביותר בטבע
הבנת המבנה המרחבי של מולקולות וטבעות חשובה מאוד להבנת תכונות החומרים ויכולת התגובה שלהם בתהליכים כימיים וביולוגיים.
ציקלוהקסאן: טבעת שישה פחמנים
חשיבות המיוחדת של ציקלוהקסאן
- מקרה קלאסי ללימוד המבנה המרחבי של טבעות
- הבנה לגבי חומרים ביולוגיים חשובים כמו סוכרים, שבנויים על טבעות דומות
ייצוג ציקלוהקסאן בהיטל ניומן
- בייצוג רגיל: מולקולה טבעתית עם 6 פחמנים ו-12 מימנים
- בהיטל ניומן: צריך שני היטלים כדי להראות את המבנה הציקלי
- היטל אחד: פחמנים 4+5
- היטל שני: פחמנים 1+2
- באמצע: פחמנים 3+6
- המימנים על פחמנים 3+6 לא מצוירים כדי לפשט את התמונה
עמדות המימנים בציקלוהקסאן
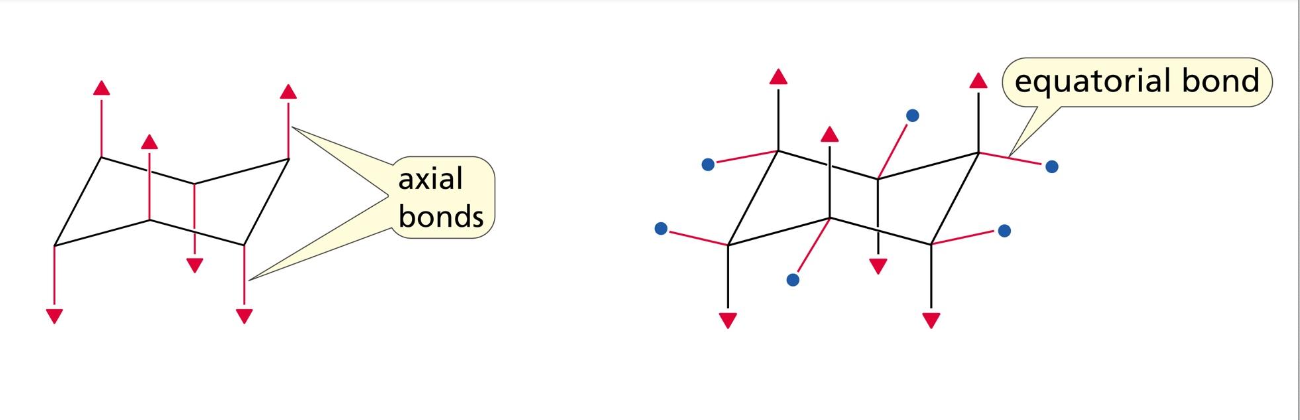
קיימות שתי עמדות אפשריות למימנים ומתמירים:
- אקסיאלי (Axial): המתמיר ניצב למישור הטבעת (עולה למעלה או יורד למטה)
- אקווטוריאלי (Equatorial): המתמיר בהמשך למישור הטבעת (כמו קו המשווה)
יציבות העמדות
- עמדה אקווטוריאלית יציבה יותר כי המתמיר רחוק יותר ממתמירים אחרים
- עמדה אקסיאלית פחות יציבה כי יכולה להיות דחייה (תחיה) עם מתמירים אחרים
- ככל שהמתמיר גדול יותר, חשוב יותר שיהיה בעמדה אקווטוריאלית
קונפורמציות של ציקלוהקסאן
שתי הקונפורמציות העיקריות
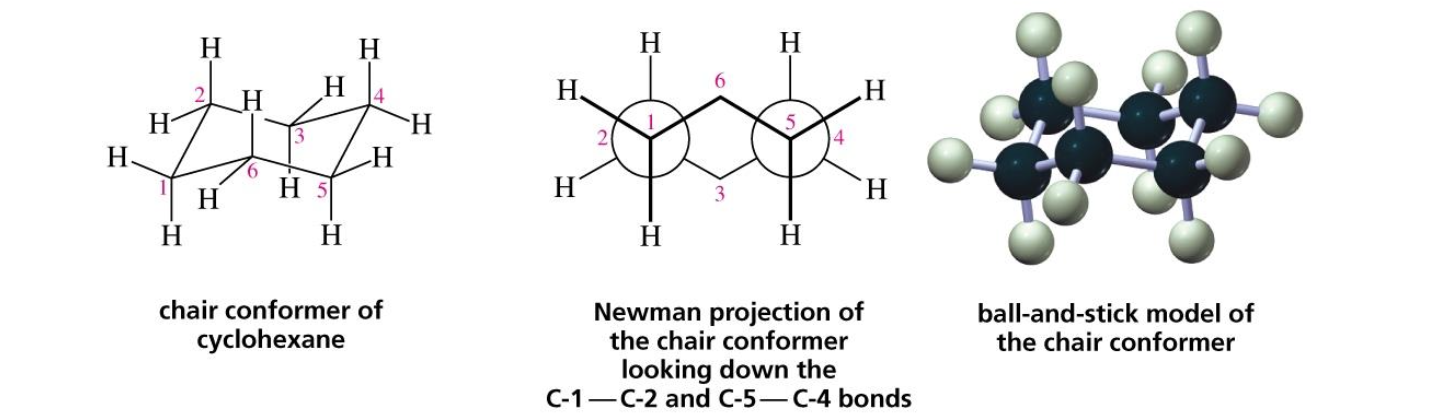
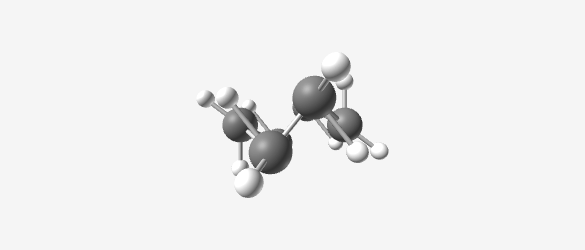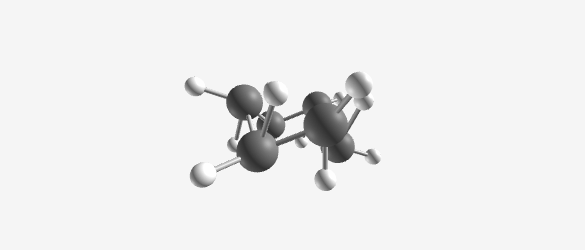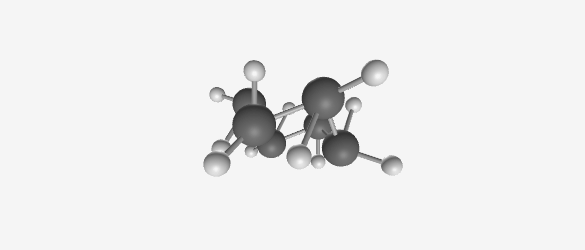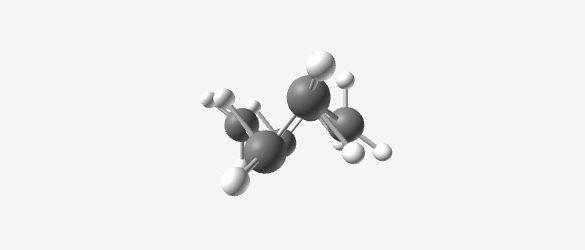
- כיסא (Chair):
- פחמנים 1 ו-4 רחוקים זה מזה
- צורה שנראית כמו כיסא נוח עם “ראש” ו”רגליים”
- הקונפורמציה היציבה ביותר
- היטל ניומן בצורת סטגארד
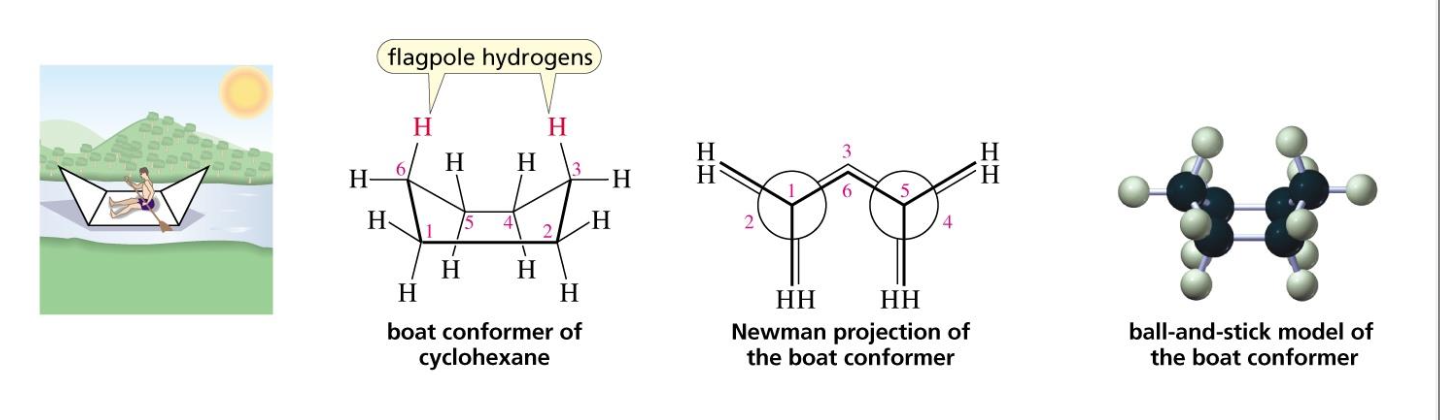
- סירה (Boat):
- פחמנים 1 ו-4 קרובים זה לזה
- פחות יציבה בשל דחייה בין מתמירים
- ערך אנרגטי גבוה יותר מהכיסא בכ-5.5 kcal/mol
 |  |
|---|---|
| קונפורמציית כיסא של ציקלוהקסאן (C₆H₁₂) | קונפורמציית סירה של ציקלוהקסאן (C₆H₁₂) |
“פליפ רינג” (Flip Ring)
- המולקולה יכולה להפוך מצורת כיסא אחת לאחרת
- בתהליך זה, כל המתמירים שהיו בעמדה אקסיאלית עוברים לעמדה אקווטוריאלית ולהיפך
- במולקולה עם מתמיר גדול אחד (כמו מתיל), הקונפורמציה היציבה תהיה זו שבה המתמיר בעמדה אקווטוריאלית
קונפורמציות בבוטאן (שרשרת של 4 פחמנים)
סובב סביב הקשר בין פחמן 2 ופחמן 3
- על כל פחמן: מימן, מימן, ומתיל
הקונפורמציות העיקריות של בוטאן
- אנטי (Anti):
- קבוצות המתיל ($\ce{CH3}$) רחוקות זו מזו ככל האפשר
- הקונפורמציה היציבה ביותר
- המתיל ($\ce{CH3}$) מרוחק מהמתיל ($\ce{CH3}$) השני
- גוש (Gauche):
- קבוצות המתיל ($\ce{CH3}$) בזווית של 60° זו מזו
- יציבות בינונית
- יש דחייה מסוימת בין קבוצות המתיל ($\ce{CH3}$)
- אקליפסד (Eclipsed):
- קבוצות המתיל ($\ce{CH3}$) קרובות זו לזו (מיושרות)
- הקונפורמציה הכי פחות יציבה
- דחייה חזקה בין קבוצות המתיל ($\ce{CH3}$)
העיקרון הכללי: ככל שקבוצות המתמירים (במקרה זה מתיל) רחוקות יותר זו מזו, המולקולה יציבה יותר.
הבנת מבנים מרחביים והקונפורמציות של מולקולות חשובה מאוד, במיוחד להבנת התנהגות מולקולות ביולוגיות כמו סוכרים. תכונות אלו משפיעות על האופן שבו החומרים מגיבים ונקשרים למולקולות אחרות בתהליכים כימיים וביולוגיים.
דור פסקל