1) פתיחה בסגנון “שאלות סיווג” - לאיזה קבוצה שייך הנגיף?
אני נגיף שהגנום שלו עובר מ-RNA ל-DNA, ובתוך הוויריון עצמו יש RNA - איזה סוג נגיף אני?
התשובה שניתנה היא: רטרווירוס.
מכאן עברנו לדיון מסודר על נגיפי RNA לפי סוג הגנום, ומה מצפים למצוא בתוך הוויריון (ובעיקר: האם חייבים להביא פולימראז בתוך הקפסיד).
2) מה נמצא בתוך הוויריון לפי סוג הגנום של RNA?
א. נגיף +ssRNA (RNA חיובי)
- הגנום עצמו הוא למעשה כמו mRNA: “איך שהוא ייכנס הוא יקודד לחלבונים”.
- לכן לא חייבים להביא בתוך הוויריון RNA-dependent RNA polymerase, כי אפשר לתרגם מיד חלבונים, ומתוכם ייווצר גם הפולימראז לרפליקציה.
- המרצה הדגיש רעיון מבני: אם רוצים שה-RNA יהיה זמין לריבוזום לתרגום, לרוב הוא לא יהיה עטוף חזק בחלבוני מעטפת גנומית שמונעים תרגום (יש יוצאים מן הכלל).
- דוגמה יוצאת דופן: קורונה-וירוס הוא +RNA אבל הגנום שלו מאוד ארוך (30,000~ בסיסים) ולכן “כנראה” כן יש עטיפה חלבונית כדי להגן עליו.
ב. נגיף −ssRNA (RNA שלילי)
- RNA מינוס לא מתורגם. כדי להגיע לתרגום חייבים להפוך אותו לפלוס.
- לכן בתוך הקפסיד/וויריון חייב להיות האנזים: RNA-dependent RNA polymerase (לא “רוורס טרנסקריפטאז”, כי אין מעבר ל-DNA).
- בנוסף, בדרך כלל הגנום כן עטוף בחלבון (גם לשיקולי יציבות/אריזה, וגם כדי שלא יפגוש את מערכת התרגום כשבכל מקרה אינו מתורגם כמות שהוא).
ג. נגיף dsRNA (RNA דו-גדילי)
- dsRNA לא משמש כתבנית לתרגום.
- כדי לייצר mRNA (RNA פלוס) חייבים פולימראז.
- המרצה הדגיש שבמקרה הזה הגנום לא “משתחרר חופשי” לתוך התא: בדרך כלל הוא נשאר בתוך הקפסיד, והייצור של RNA פלוס מתרחש שם.
| נגיפי רנא חיובי/מקודד (+) | נגיפי רנא שלילי (-) | נגיפי רנא דו-גדילי (dsRNA) |
|---|---|---|
| אין פולימרז בויריון, והגנום אינו עטוף בחלבון (naked genome). exceptions: retrovirus (RT and NP), coronavirus (NP) | נמצא פולימרז (RdRp), הגנום עטוף בחלבון (nucleocapsid). | נמצא פולימרז (RdRp), והגנום אינו עטוף בחלבון (naked genome). |
3) RNA פולימראז נגיפי
“פעילויות” וכללי עבודה כלליים:
- סינתזת RNA מתחילה ומסתיימת באתרים ספציפיים על הגנום.
- התחלה יכולה להיות עם פריימר או בלי פריימר.
- הכיוון הוא תמיד 3’←5’ (כמו ב-DNA).
- נאמר הבדל חשוב מול DNA-polymerase: לא תמיד הסינתזה תלויה בתבנית (דוגמה בהמשך: הוספת poly(A) בלי תבנית בהקשרים מסוימים).
דרכי התחלה
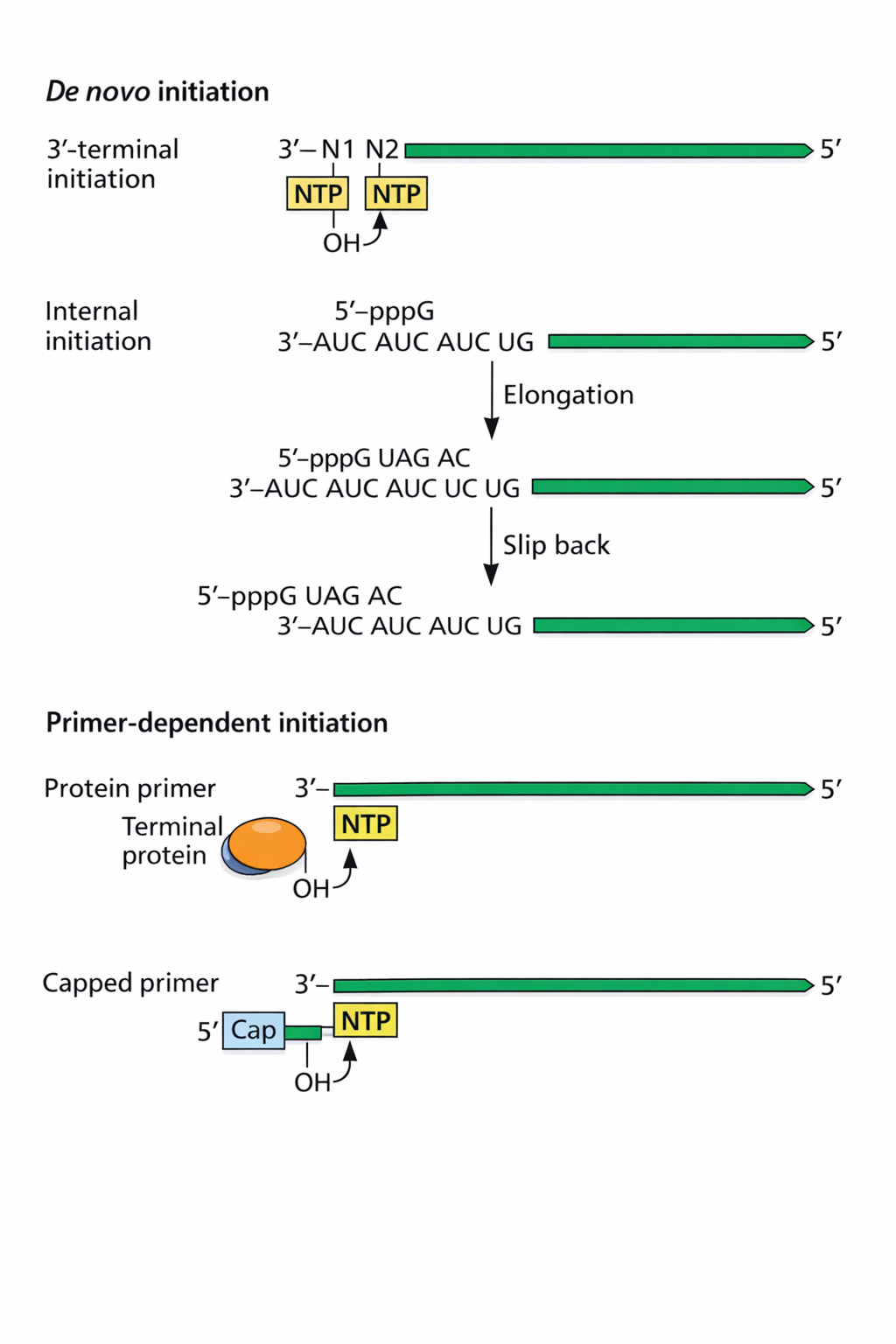
- דה-נובו מהקצה בלי פריימר.
- Slipping (“החלקה”) על רצף חזרתי בקצה: הפולימראז מסנתז כמה נוקלאוטידים, “מחליק אחורה”, וממשיך - וכך מתקבלת התחלה בלי פריימר קלאסי.
- שימוש ב-Terminal protein כפריימר: חלבון בקצה (לעיתים עם טירוזין) שקושר את הנוקלאוטיד הראשון, ולכן החלבון קשור קוולנטית לגנום.
- Cap snatching: “לגנוב” 5’ cap מ-mRNA תאי ולהשתמש בו כפריימר לתחילת הסינתזה.
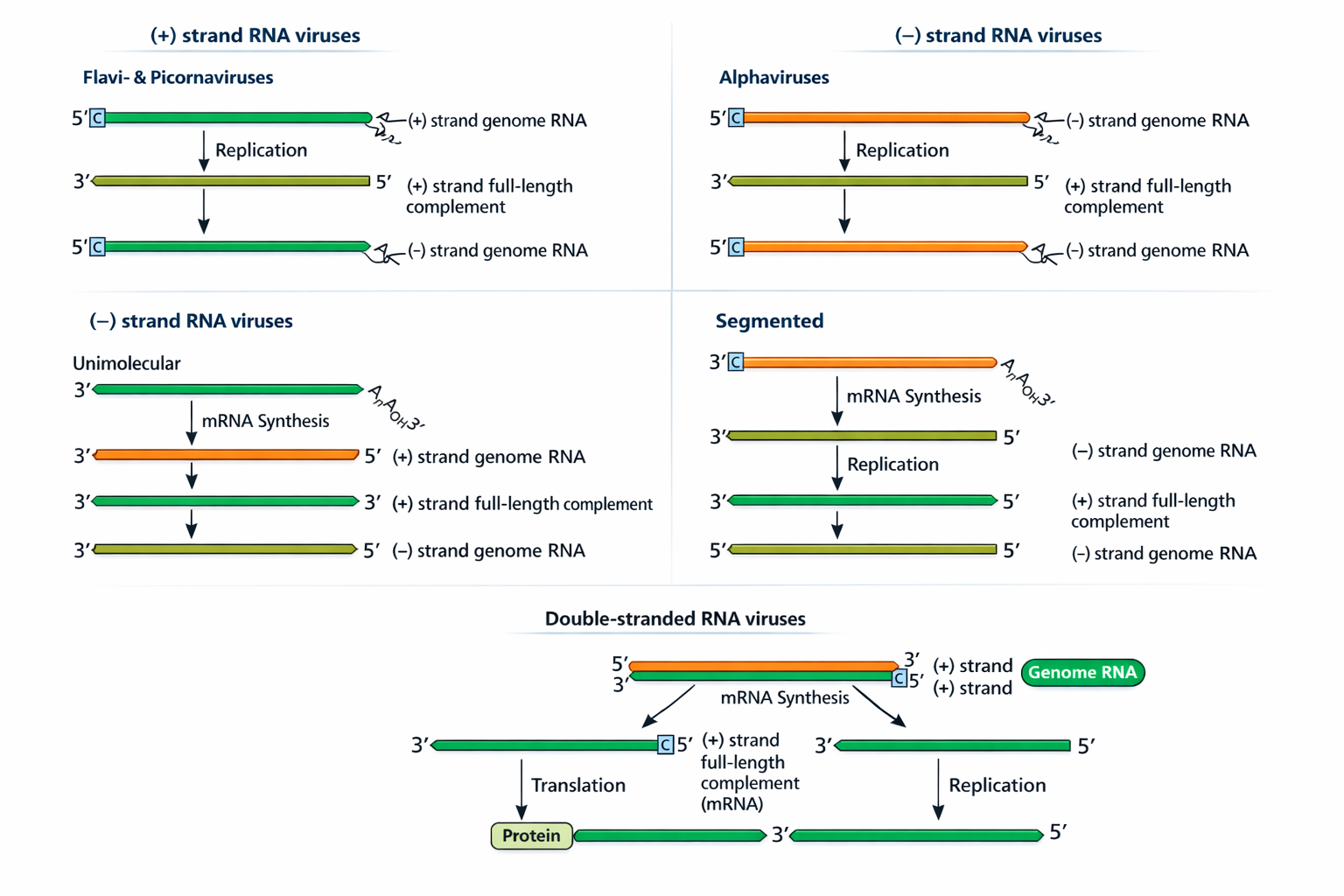
4) סכמות הרפליקציה לפי סוג הגנום (איך עוברים פלוס↔מינוס)
האיור הבא מסכם את הלוגיקה: מי מייצר קודם mRNA, מתי נוצרת מולקולת המשלים, ומה ההבדל בין גנום רציף/סגמנטלי/דו-גדילי.
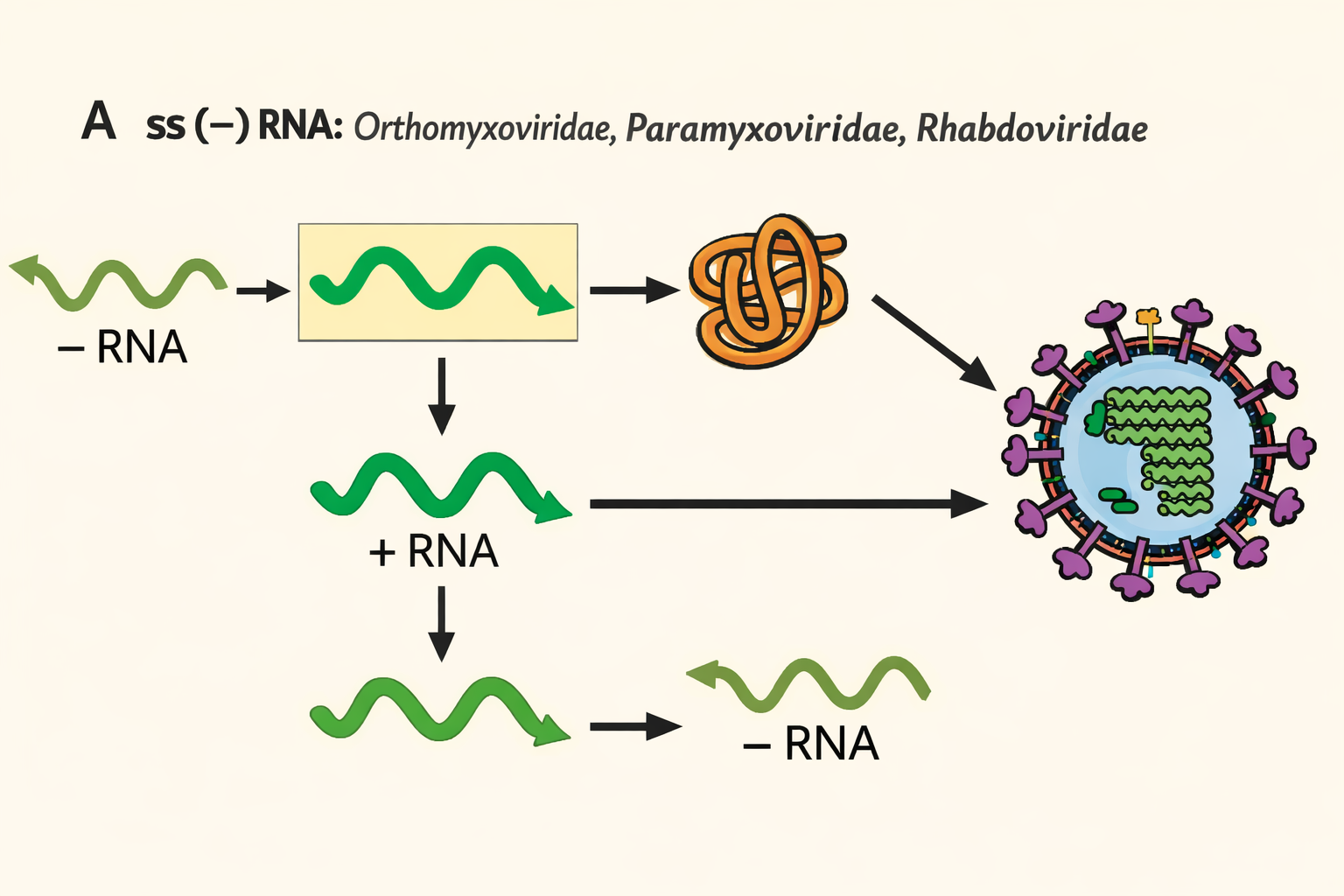
תקריב: ב־ssRNA(−) חייבים קודם ליצור +RNA (mRNA) לתרגום.
הלוגיקה:
- ב-+RNA: ה-RNA נכנס, משמש מיד לתרגום; בהמשך נוצרת מולקולת −RNA כטמפלייט לייצור הרבה +RNA (גם לתרגום וגם כגנומים לאריזה).
- הוא הזכיר מודל שבו ממינוס אפשר לייצר אורכים שונים של +RNA כדי לייצר חלבונים שונים (דוגמת אלפא-וירוס).
- ב-−RNA: קודם כל מייצרים +RNA (mRNA) לתרגום חלבונים; ובהמשך מייצרים +RNA מלא שישמש כתבנית לייצור −RNA חדשים שייארזו. נאמר שגם יכולים להיות גנומים סגמנטליים (כמה מולקולות RNA שונות).
- ב-dsRNA: מייצרים RNA פלוס (mRNA) מתוך ה-dsRNA (בדרך כלל כשהגנום נשאר מוגן בתוך הקפסיד), ובהמשך מסנתזים עליו את הגדיל המשלים ליצירת dsRNA חדש.
| סוג הגנום | מה יש בוויריון? | איך מתחילה רפליקציה? |
|---|---|---|
| +RNA | RNA פלוס (כמו mRNA), בדרך כלל לא עטוף בחלבון, לא חייב פולימראז | RNA נכנס ← מתורגם ← פולימראז מסנתז −RNA ← על תבנית ה−RNA מסנתזים הרבה +RNA |
| −RNA | RNA שלילי, עטוף בחלבון, חייב פולימראז | RNA נכנס ← פולימראז מסנתז +RNA (mRNA) ← מתורגם ← על תבנית ה+RNA מסנתזים הרבה −RNA |
| dsRNA | RNA דו-גדילי, לא עטוף בחלבון, חייב פולימראז | RNA נכנס ← פולימראז מסנתז +RNA (mRNA) מתוך ה-dsRNA ← מתורגם ← על תבנית ה+RNA מסנתזים הרבה dsRNA |
5) +RNA “קלאסי” - דוגמת פוליו-וירוס: פוליפרוטאין ופרוטאז
Group IV:
ssRNA(+)
נגיפים בעלי גנום רנ״א חד-גידלי חיובי. דוגמה מפורטת על פוליו-וירוס:
- מדובר ב-
+ssRNA. הוא “מכניס” RNA אחד, אבל צריך הרבה חלבונים. -
הפתרון: יצירת פוליפרוטאין - חלבון ארוך אחד שבתוכו יש פרוטאז.
הפרוטאז “חותך את עצמו” ואז חותך את שאר החלבון ליחידות פעילות (המרצה הדגיש שזה פרוטאז של הווירוס, לא “של התא”).
- זה טארגט תרופתי טוב, כי זה חלבון שאין לנו בגוף: עיכוב פרוטאז יימנע הבשלה/הדבקה.
התחלת רפליקציה בפוליו - VPg ו-poly(A)
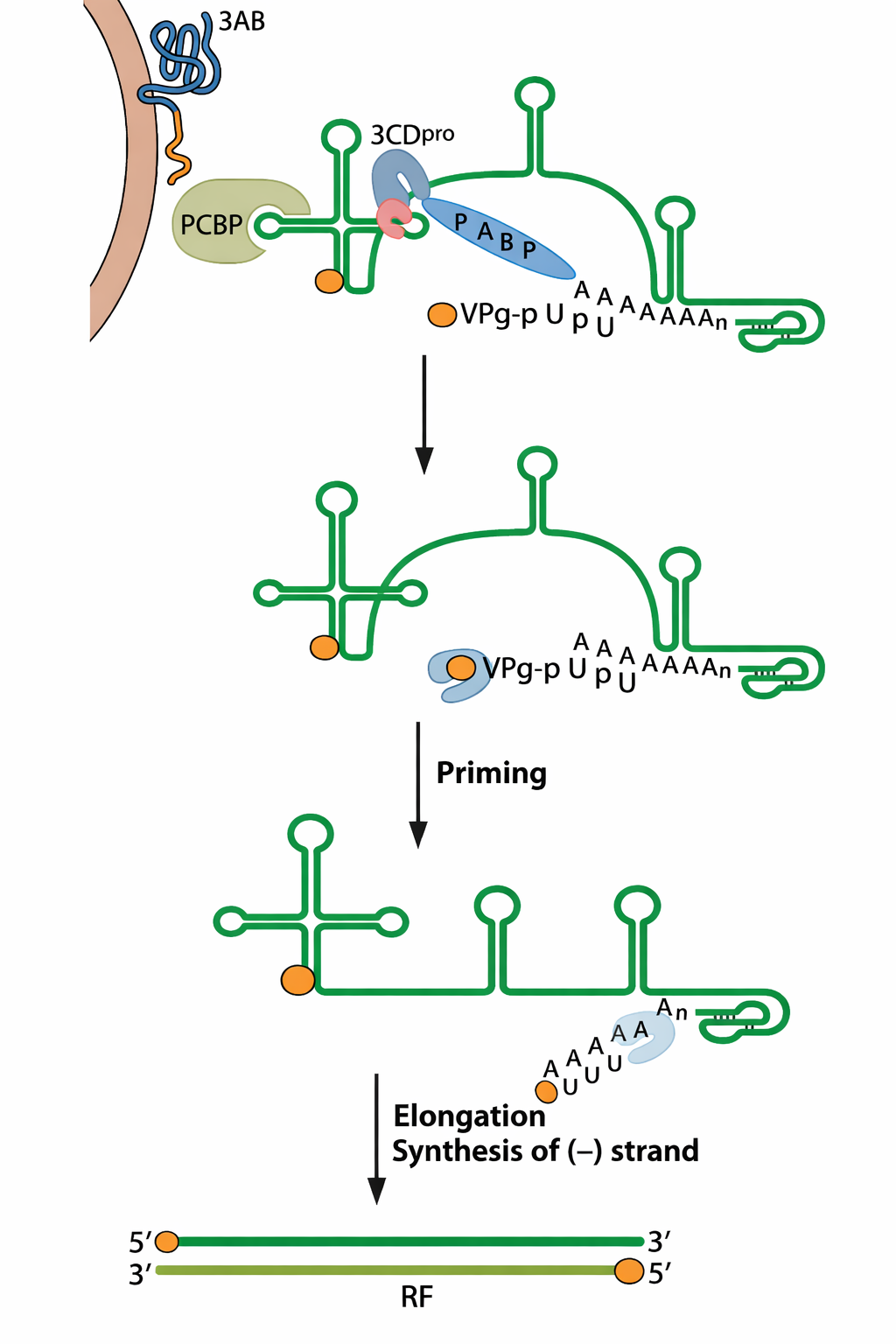
המרצה תיאר מנגנון שבו:
- יש חלבון קצה בשם VPg.
- מוסיפים לו שני U (יו-יו), וזה מאפשר היצמדות לקצה עם poly(A) ולהתחיל סינתזה.
- המרצה הדגיש שה-RNA לא “חוט ישר” אלא מתקפל, ושהקירוב בין קצוות יכול להיתמך ע״י חלבונים (כולל poly(A) binding protein), כדי לאפשר התחלה יעילה.
רצף שלבי ההדבקה של פוליו
- קפסיד נכנס לתא ומשחרר +RNA לציטופלזמה.
- הריבוזומים מתרגמים ← נוצר פוליפרוטאין.
- הפוליפרוטאין נחתך לחלבונים שונים (כולל פולימראז).
- הפולימראז מסנתז −RNA על תבנית ה-+RNA.
- על תבנית ה-−RNA מסנתזים הרבה +RNA: חלק לתרגום וחלק כגנומים לאריזה ושחרור.
כלי מחקר: אפשר לבצע טרנספקציה של RNA לתאים (גם בלי קפסיד), או להפוך RNA ל-cDNA, לקלון בפלסמיד, לשים פרומוטר, ואז התאים ייצרו RNA וממנו ייצרו ויריונים; כך אפשר ליצור מוטציות ולבדוק את השפעתן.
6) קורונה-וירוס (+RNA גדול) - תיקון טעויות, תוצרים באורכים שונים, ותרופות
תכונה ייחודית:
- הגנום ארוך מאוד (30,000~ בסיסים).
- בגלל ש-RNA פולימראז לרוב “לא מדויק”, גנום כזה היה מצטבר בו הרבה טעויות - לכן לקורונה יש אקסונוקלאז ויכולת תיקון (proofreading) שמקטינה טעויות (לא מבטלת לגמרי).
- המרצה הוסיף שזה אחת הסיבות שהוא “לא משתנה כל כך מהר”, והוא קישר זאת לכך ש”אולי” זה תרם ליכולת לפתח חיסון.
בנוסף לכך, דרך יצירת הרבה חלבונים היא לא רק פוליפרוטאין ענק, אלא גם יצירת מולקולות RNA באורכים שונים (באמצעות עצירות/סטופים), שכאשר הופכים אותן חזרה לפלוס מתקבלים mRNA שונים לחלבונים שונים.
תרופות לדוגמה
- Paxlovid: מעכב פרוטאז (המרצה הזכיר שני פרוטאזות חיוניות להבשלה, NSP3 ו-NSP5, ופקסלוביד מעכב פרוטאז וכך מעכב רפליקציה/התרבות).
-
Molnupiravir: נוקלאוטיד אנלוג שיכול “להתחבר גם ל-G וגם ל-A” ולכן משרה הרבה מוטציות עד שלא נוצרים ויריונים פעילים.
הפולימראזות התאית “לא יקפצו” עליו כי הוא שונה, בעוד הפולימראז הנגיפי “פחות אכפת לו” ולכן יכניס אותו.
7) מוטציות ב-RNA וירוסים
אומדן מספרי של מוטציות:
- אם RNA פולימראז נגיפי עושה טעות בערך כל 10,000 בסיסים,
- ואם גודל הגנום הוא בערך 10,000 בסיסים,
- אז בממוצע כל גנום חדש יכיל מוטציה אחת~.
המשמעות:
- “רוב המוטציות” יפגעו בווירוס ולכן הרבה נגיפים לא יהיו טובים,
- אבל חלק עשוי לתת יתרון (למשל התחמקות ממערכת החיסון).
8) ssRNA(-): גנום אחד ארוך מול סגמנטים, ודוגמת אינפלואנזה
−RNA לשתי תצורות:
- מולקולה אחת ארוכה (הוא נתן רשימת דוגמאות כמו חצבת ועוד משפחות).
- סגמנטים: אינפלואנזה - 8 סגמנטים שונים.
הוא תיאר צילום EM שבו “סופרים” 8 סגמנטים בתוך ויריון, וגם אמר במפורש:
- האריזה היא אקראית, ולכן רק בערך 1 מתוך 400 ויריונים שיוצאים מכיל את כל הסט הנדרש כדי להיות אינפקטיבי.
9) איך −RNA מייצר כמה mRNA שונים? (עצירה, poly(A), ולא עוזבים את הטמפלייט)
המרצה תיאר מנגנון שבו הפולימראז:
- מתחיל מהקצה ומסנתז mRNA ראשון.
- מגיע לאזור intergenic עם רצף poly(U) שגורם לו לעצור.
- אז הוא מבצע polyadenylation “ללא תבנית”: חוזר/מחליק ומוסיף הרבה A עד סדר גודל של ~200 A.
- משחרר את ה-mRNA, אבל נשאר על אותו טמפלייט, ומתחיל את ה-mRNA הבא.
הוא קשר זאת לרעיון רגולטורי: קיים חלבון (המרצה כינה אותו “N”) שקושר את הגנום. כשהרמה שלו נמוכה, נוטים יותר לייצר תוצרים קצרים (mRNA לחלבונים); כשהרמה עולה, עוברים יותר לכיוון של שכפול גנום מלא.
10) אינפלואנזה - למה נכנסת לגרעין ומה זה Cap snatching בפועל?
למרות שברוב וירוסי RNA- “הכול קורה בציטופלזמה”, אינפלואנזה נכנסת לגרעין.
מחזור החיים של אינפלואנזה כולל את השלבים הבאים:
- הגנומים משתחררים בציטופלזמה כשהם עטופים בחלבון עם NLS שמכניס אותם לגרעין.
- בגרעין הווירוס עושה cap snatching: לוקח mRNA תאי, חותך ממנו את ה-cap עם רצף קצר, ומשתמש בו כפריימר ליצירת mRNA ויראלי.
- ה-mRNA יוצא לציטופלזמה לתרגום.
- חלבונים חוזרים לגרעין לעטוף גנומים חדשים ולהרכבה.
יש בקרות כדי שהחיתוך לא יקרה “סתם”: רק כאשר גם קצוות הגנום הוויראלי (5’ וגם 3’) נמצאים בקומפלקס, אז מתאפשר זיהוי הקאפ וחיתוך.
לבסוף ה-mRNA הוויראלי מקבל:
- cap שנגנב מהתא,
- וגם poly(A) שנוסף כשמגיעים לרצף poly(U) שמעודד polyadenylation.
ייצוא גנומים מהגרעין
- החלבון שעוטף את הגנום מכיל NLS (כניסה),
- ובהמשך שני חלבונים נקשרים אליו, ממסכים את ה-NLS, ולשניהם יש NES ← כך נוצר נוקלר אקספורט.
11) אנטיגנים של אינפלואנזה ושני סוגי שינוי עיקריים: Drift ו-Shift
מערכת החיסון “רואה” בעיקר את חלבוני הממברנה - אלו האנטיגנים שמאפיינים זני שפעת (H/N):
- HA (המגלוטינין)
- NA (נויראמינידאז)
שלוש דרכי שינוי עיקריות, עם דגש על השתיים הראשונות:
- Antigenic drift - שינוי איטי מצטבר ממוטציות.
- Antigenic shift - בגלל שיש 8 סגמנטים: הדבקה של שני וירוסים שונים באותו תא ← אריזה אקראית ← קומבינציה חדשה לגמרי.
- הוא הזכיר גם אפשרות של קפיצה/רקומבינציה במהלך רפליקציה.
חזירים הם ”מערבבים” אפשריים (יכולים להידבק גם בעופות וגם בבני אדם), אבל לא רק.
12) היסטוריה קצרה: השפעת הספרדית 1918 ומה הדיון סביב פרסום הרצף
לכאורה ”פחות חשוב לזכור היסטוריה”, אבל צריך לדעת מה זאת השפעת הספרדית:
- 1918: סדר גודל של חצי מיליון בארה״ב ו-20-50 מיליון בעולם
- ייחוד: פגעה קשה גם בצעירים, לא רק באוכלוסיות סיכון רגילות.
לאחר מכן:
- הפיקו רצפים מגופות בקבורה, עשו ריצוף, והיה דיבייט האם לפרסם (חשש מביו-טרור מול צורך מדעי).
- הרצף פורסם, וב-CDC יצרו את הווירוס מחדש באמצעות הזמנת הרצף כ-DNA, בניית פלסמידים, ואז יצירת הווירוס במעבדה; בניסויי עכברים הוא היה קטלני מאוד.
13) dsRNA - “לא לחשוף” כדי לא להפעיל מיד את ההגנה התאית
dsRNA “מיד מפעיל” מנגנוני הגנה תאיים, ולכן:
- הווירוסים הללו לרוב לא חושפים את הדאבל-סטרנד לתא.
- לאחר כניסה: המעטפת החיצונית יורדת, אבל נשאר קפסיד חלקית פתוח שמאפשר כניסת נוקלאוטידים.
- בתוך הקפסיד פולימראז מייצר +RNA,
- וה-mRNA יוצא דרך “חורים” בקפסיד לציטופלזמה.
היתרונות של הגישה הזו:
- ריכוז המערכת סביב הגנום בתוך הקפסיד (הפולימראז לא “מחפש” RNA בתא),
- והתחמקות מהפעלת ההגנה לפני שיש לווירוס חלבונים שמסוגלים לעכב אותה.
14) בקרה ופירוק של mRNA בתא (כדי להבין למה cap חשוב)
סקירה כללית של פירוק mRNA בתא:
- אם מסירים cap (decapping) ← קומפלקס Xrn1 מפרק מ-5’ ל-3’.
- בצד 3’ poly(A) מתקצר עם הזמן; כשהוא קצר מספיק ← exosome מפרק מ-3’ ל-5’.
המטרה כאן הייתה להראות ש-cap מגן על RNA בסיטופלזמה.
דוגמאות לווירוסים שמתערבים:
- חלבון שמזהה רצף אחרי cap בתאי ומוביל לחיתוך/דגרדציה.
- ב-Vaccinia virus תואר חלבון שעושה decapping ל-mRNA תאיים.
15) “Host shutoff” בפוליו - איך הווירוס מכבה תרגום תאי ומשאיר רק את שלו
ניסוי תיוג חלבונים לאחר הדבקה בפוליו:
- לפני הדבקה יש הרבה חלבונים תאיים.
- לאחר 7-5 שעות: כמעט לא נוצרים חלבונים תאיים, ונוצרים בעיקר חלבוני וירוס.
המנגנון:
- תרגום תאי תלוי cap דורש initiation factor שמכיר את ה-cap.
- 2A protease של פוליו חותך את הפקטור הזה ← אין יותר cap-dependent translation.
- לפוליו יש רצף/מבנה בשם IRES שמאפשר גיוס ריבוזום ללא תלות בקאפ.
- המרצה ציין ש-IRES פחות יעיל מהתחלה רגילה מה-cap, אבל אם אין cap-dependent בכלל, אז הווירוס “מנצח”.
גם ב-Hepatitis C יש מנגנון דומה (מבנה שמאפשר תרגום בלי cap).
16) מעבר ל-DNA viruses: רפליקציית DNA, מי משתמש במערכת התאית ומי מביא מערכת משלו
לעקרונות DNA polymerase:
- התחלה באתרי Origin of replication.
- DNA סינתזה תמיד עם פריימר (למעט חריג בבקטריופאג’ים שלא נכנס אליו).
- כיוון 5’←3’, מנגנון semi-conservative, ותמיד תלוי תבנית.
עקרון ארגוני:
- DNA viruses קטנים משתמשים במערכת הרפליקציה של התא, אבל מספקים חלבון שמגייס אותה לגנום שלהם. דוגמה: SV40 עם Large T antigen.
- DNA viruses גדולים (כמו הרפס) מביאים יותר מרכיבים של המערכת שלהם כשהם בליטיק סייקל.
הרעיון הוא “מפעלי וירוס”/אזורים מרוכזים בתא שבהם נוצרת רפליקציה ויראלית.
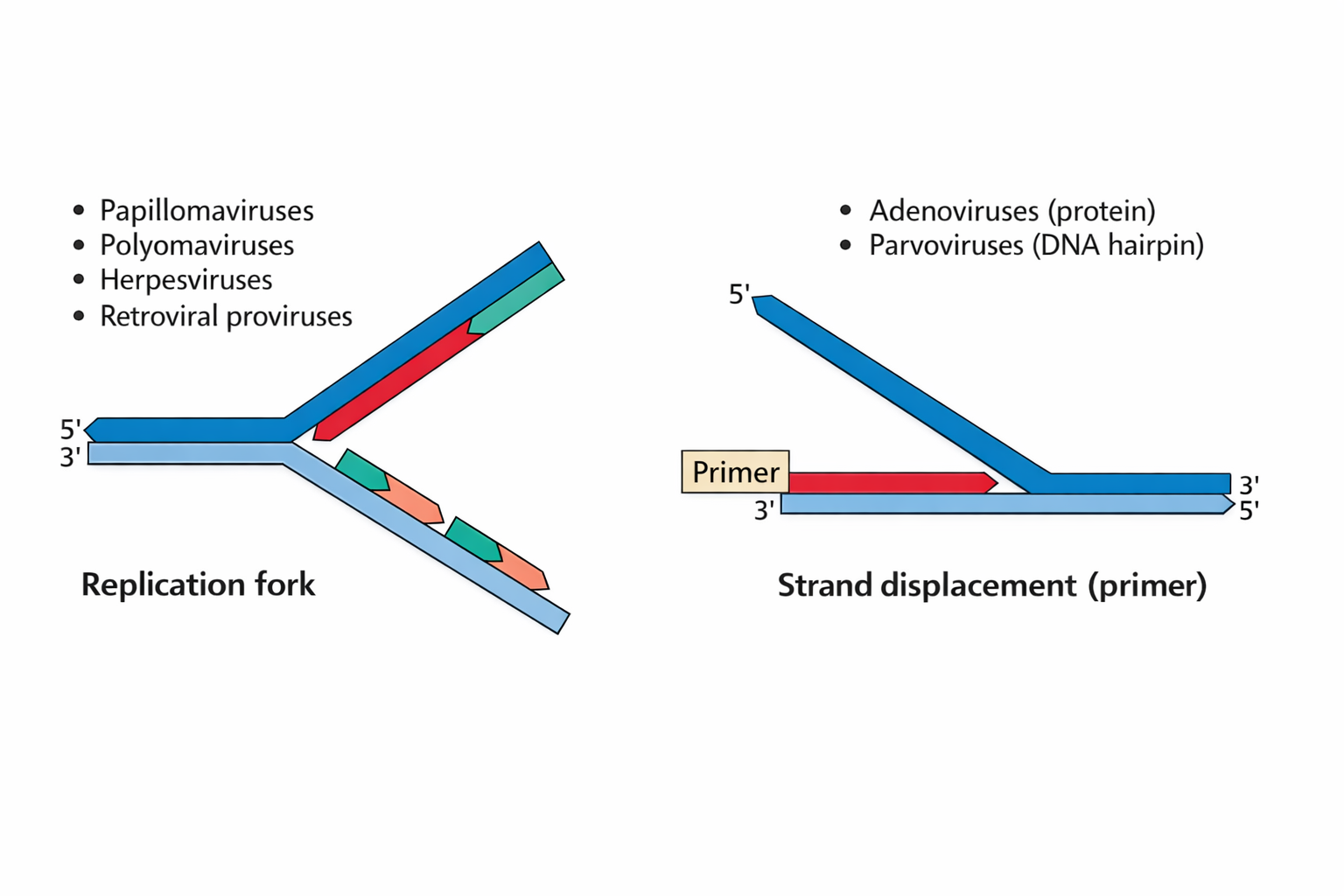
17) שני מודלים לרפליקציית DNA ויראלית: Replication fork מול Strand displacement
שני מודלים עיקריים לרפליקציה של DNA ויראלי:
-
Replication fork: כמו ברפליקציה תאית (leading/lagging, קטעי אוקזאקי).
דוגמאות: Papilloma, Polyoma (SV40), Herpes, וגם רטרווירוס “אחרי אינטגרציה” כי אז הוא משתכפל עם הגנום התאי.
-
Strand displacement: מסנתזים גדיל אחד והגדיל השני “נדחף הצידה”.
דוגמאות: Adenovirus ו-Adeno-associated virus (AAV).
SV40 - Large T antigen
Large T antigen:
- נקשר ל-Origin,
- פותח תגדילים,
- RPA נקשר ל-ssDNA,
- ואז מגויסת מערכת הרפליקציה התאית.
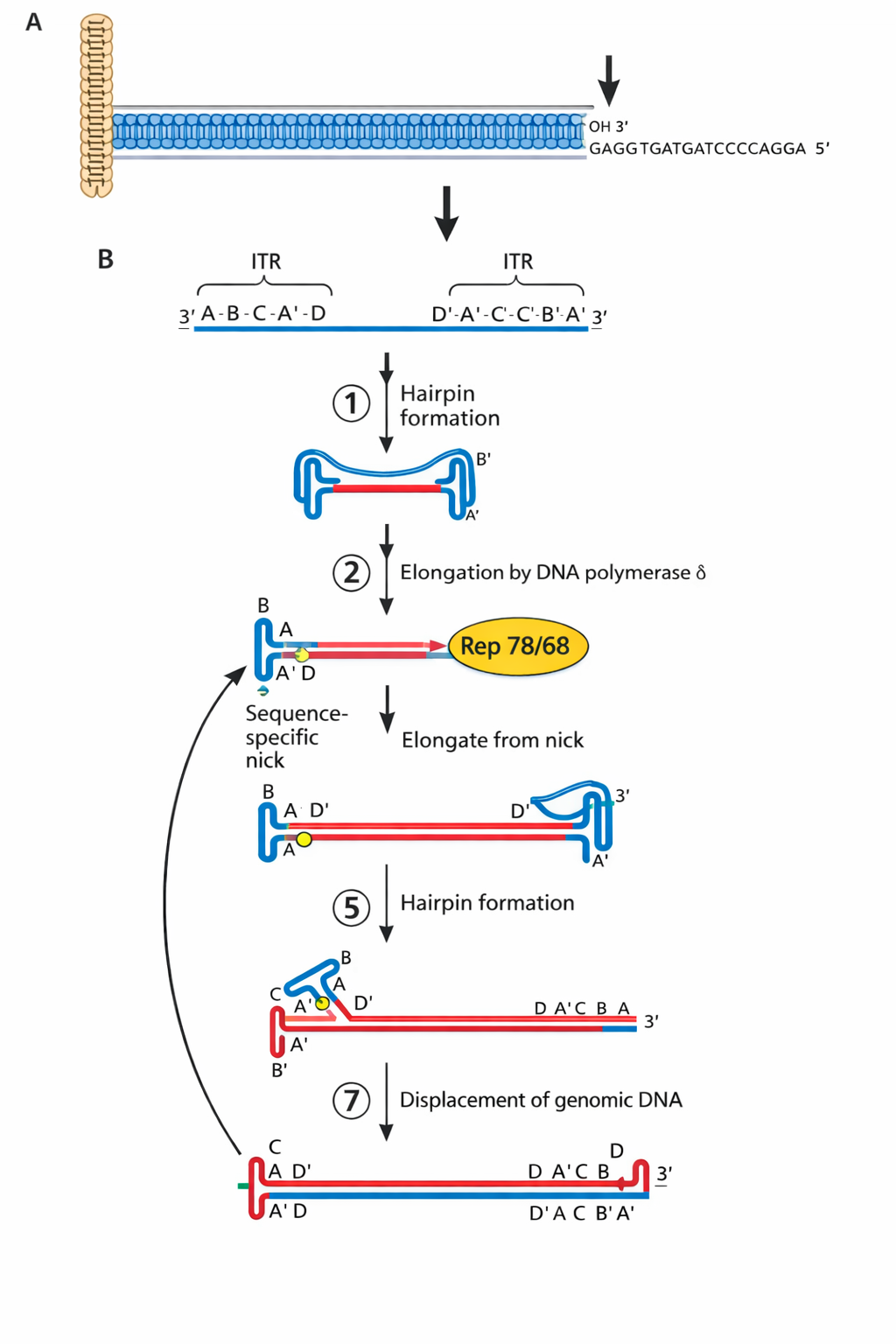
AAV - המנגנון הייחודי עם hairpin ends
כאן הטריק הוא שקצוות ה-ITR מתקפלים ל-hairpin ויוצרים 3’OH שמתפקד כמו פריימר.
המנגנון:
- הגנום נכנס כ-ssDNA עם stem-loop/hairpin בקצוות שיוצרים קצה 3’ שנראה כמו פריימר ← הפולימראז התאי יכול להאריך ולהפוך ל-dsDNA.
- לרפליקציה הווירוס מקודד שני חלבונים (Rep 78/68) עם שתי פעילויות:
- אנדונוקלאז (חותך ליד ה-stem-loop),
- הליקאז (פותח את המבנה).
- לאחר חיתוך מתקבל קצה 3’ ← הפולימראז התאי מסנתז, תוך strand displacement, וחוזר חלילה.
- המרצה הדגיש שאין צורך בפריימר חיצוני כי ה-hairpin מספק קצה 3’ מתאים.
שאלה מסכמת: AAV הוא ssDNA virus, רפליקציה ב-strand displacement.
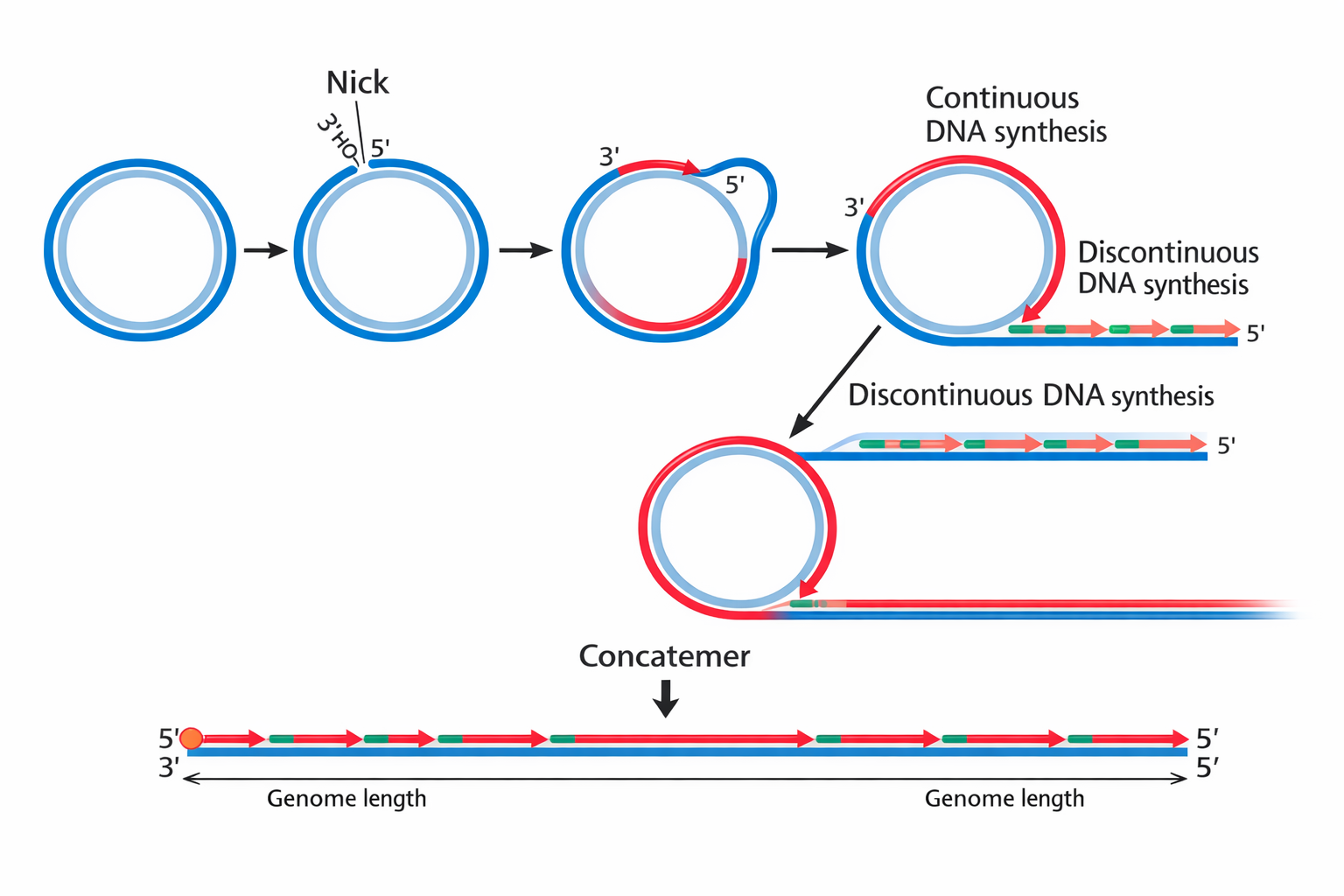
Rolling circle (הרפס)
מנגנון נוסף:
- חלבון עושה “nick” בגדיל אחד,
- הפולימראז מאריך סביב מעגל שוב ושוב,
- נוצר concatemer ארוך עם הרבה עותקים של הגנום ברצף.
18) הרכבה (Assembly), הבשלה (Maturation), ואריזת גנום
עוברים מהעתקה לבנייה של ויריונים.
שתי גישות להרכבה
- Assembly line (כמו מפעל): מרכיבים תתי-מבנים בסדר מוגדר עם “בקרת איכות”; אם שלב לא תקין - לא מתקדמים.
- Capsid self-assembly: בריכוז גבוה חלבונים מתארגנים לבד; אם אין גנום מתקבל קפסיד ריק, ואם יש גנום הוא נארז.
שימוש בצ’פרונים ופיגומים
- המרצה אמר שווירוסים משתמשים ב-chaperones תאיים לקיפול נכון.
- בקפסידים גדולים (הרפס) יש חלבוני פיגום בתוך הקפסיד. אחרי שהקפסיד שלם:
- פרוטאז מפרק את הפיגומים,
- מתפנה מקום לגנום להיכנס.
פוליפרוטאין והבשלה מאוחרת (דוגמת רטרווירוס/דמוי-HIV)
העיקרון:
- רכיבים מגיעים לממברנה כ-פוליפרוטאין (ככה “חבילה אחת” מביאה הרבה פונקציות).
- יש סיגנל מיקוד לממברנה כמו myristoylation שמביא את הפוליפרוטאין לאזור ההרכבה.
- הוויריון יוצא עדיין “לא בשל”, ורק לאחר השחרור הפרוטאז מופעל, חותך, ואז מתקבלת הבשלה והווירוס הופך אינפקטיבי.
- בנוסף כך מבטיחים שגם אנזימים חיוניים (כמו רוורס טרנסקריפטאז/אינטגראז בהקשר הזה) יהיו בפנים כי הם היו חלק מהפוליפרוטאין.
אריזת DNA בהרפס - Portal protein ולחץ גבוה
במנגנון של הרפס:
- יש portal protein בקפסיד שדרכו מכניסים DNA.
- הגנום מגיע כ-concatemer; מזהים terminal repeats:
- פעם אחת כסימן “כאן מתחיל גנום”,
- ופעם נוספת כסימן “הגענו לאורך של גנום אחד” ואז חותכים.
- המרצה אמר שה-DNA נדחס בלחץ של בערך 20 אטמוספרות, וזה דורש אנרגיה תאית.
19) יציאה מהתא - אינפלואנזה, הרפס, ווקסיניה
אינפלואנזה
- חלבוני מעטפת (כמו HA) נכנסים ל-ER עם סיגנל, עוברים קשרי SS ומודיפיקציות, עוברים גולג’י ומגיעים לממברנה.
- הגנום עטוף בחלבון, מצטרפים מטריקס וממברנה, וב-budding משתחרר הוויריון.
הרפס - Nuclear egress
המרצה הדגיש שהקפסיד גדול מדי כדי לצאת דרך nuclear pore, לכן:
- הקפסיד “קורע”/עובר תהליך יציאה אגרסיבי דרך מעטפת הגרעין (nuclear egress),
- עובר דרך ER ואז גולג’י,
- מצטרפים חלבוני tegument (בין קפסיד לממברנה),
- משתחרר בבועית החוצה.
Vaccinia
- הגנום בציטופלזמה; הווירוס יכול להשתחרר עם ממברנה אחת או לעבור דרך גולג’י ולקבל עוד ממברנה.
- ייחודי: גורם לתא ליצור “זרוע” מבוססת אקטין שמקדמת שחרור ויריונים מקצה הזרוע.
20) לא כל ויריון הוא אינפקטיבי
בסוף המרצה חזר על הרעיון שהאריזה לא תמיד מושלמת:
- בצילומי EM של אינפלואנזה רואים שלפעמים נארזים פחות מ-8 סגמנטים.
- לכן רק חלק קטן מהחלקיקים שיוצאים הם באמת אינפקטיביים (המרצה נתן 1/400).
נקודות עיקריות לסיכום
שלושה עוגנים חשובים:
- חובה/לא חובה להביא פולימראז בתוך הוויריון נקבע בעיקר לפי סוג הגנום (פלוס/מינוס/dsRNA).
- טריקים של וירוסים לשלוט בתרגום (Host shutoff, IRES, cap snatching) - זה כלי קריטי לשרוד בתוך התא.
- הרכבה/אריזה/הבשלה הן שלבים “מכניים” אבל עם רגולציה, בקרת איכות, ולעיתים הבשלה תלויה פרוטאז - וזה גם בסיס לתרופות.