חלק א’: התמרה סרטנית
תהליך ההתפתחות הסרטנית
התפתחות סרטן היא תהליך רב-שלבי - גם בסרטנים שמתפתחים במהירות, מדובר בסדרה של נזקי DNA באתרים שונים ובגנים שונים. הסיבה לכך היא שפגיעה בגן בודד או באתר בודד בדרך כלל לא מספיקה: קיימים גיבויים בגנום, גנים נוספים שיכולים לפצות, מנגנוני תיקון, ודרכים לנטרל את הנזק.
אפשר לדמות את התהליך לכדור שלג שהולך ומצטבר - כל שלב מוסיף נזקים, וככל שמצטברים יותר נזקים, הסיכוי לנזקים נוספים עולה.
שלבי ההתפתחות הסרטנית
-
שלב 1 - חלוקה בלתי מבוקרת: תא סומטי רגיל צובר נזק ומתחיל להתחלק ללא בקרה - גם כשה-DNA שלו אינו תקין לחלוטין, וגם כשאין סיגנל מהסביבה שמורה על חלוקה. חשוב להבין: בשלב הזה עדיין לא מדובר בסרטן אלא בגידול שפיר - תאים שגדלים במקום או בזמן לא מתאימים, אבל טרם נחשבים סרטניים.
-
שלב 2 - כשל במנגנוני תיקון: הכרנו חמישה מנגנוני תיקון DNA. הבעיה מתחילה כאשר יש פגיעה באחד הרכיבים של מנגנוני התיקון עצמם - אז הנזקים אינם מתוקנים כראוי.
-
שלב 3 - כשל באפופטוזיס: במצב תקין, תא שלא מצליח לתקן את הנזקים שלו אמור לעבור אפופטוזיס - מוות תאי מתוכנת. באפופטוזיס הוא תהליך מסודר שבו התא שובר את ה-DNA שלו, מתכווץ, מוציא נוזלים, ומתפרק לגופיפים קטנים שנבלעים על ידי תאי מערכת החיסון. כשגם מנגנון האפופטוזיס נפגע, נשארים ברקמה תאים פגומים שהיו אמורים להיות מסולקים.
-
שלב 4 - התחמקות ממערכת החיסון: קיימים במערכת החיסון מנגנונים שמזהים תאים עצמיים שמתנהגים באופן חריג. בשלב הזה, התאים הסרטניים צוברים מוטציות נוספות שמאפשרות להם להתחמק גם ממנגנונים אלה.
-
שלב 5 - אנגיוגנזה: הגידול זקוק לאספקת דם, חמצן וסוכר כדי להתקיים. התאים הסרטניים מתחילים ליצור כלי דם חדשים משלהם (שונים במקצת מכלי דם רגילים) כדי לספק אנרגיה לגידול.
-
שלב 6 - גרורות: כשאין מספיק מקום פיזי, הגידול יוצר גרורות במקומות אחרים בגוף.
ככל שהשלבים מתקדמים, חומרת המצב הסרטני עולה. חשוב להבין שתהליכים רבים מתחילים ונעצרים בשלבים שונים - עוד לפני שאנחנו בכלל מודעים אליהם.
מחזור התא ונקודות בקרה
שלבי מחזור התא
G1 (גדילה) → S (סינתזת DNA) → G2 (בדיקה) → M (מיטוזה)
↑
G0 (מנוחה - התא אינו מתחלק כרגע)
- G1 - שלב גדילה, קליטת חומרים, ביטוי גנים וחלבונים
- G0 - שלב מנוחה; התא לא מתחלק אך ממשיך לפעול
- S - סינתזה/רפליקציה של DNA (יצירת עותק נוסף)
- G2 - בדיקה שה-DNA החדש תקין
- M - מיטוזה, חלוקה לשתי תאי בת זהות
תנאים לחלוקת תא
כדי שתא יתחלק, נדרשים מספר תנאים:
- גודל מספיק - התא חייב להיות גדול דיו
- נוטריאנטים - חומרי הזנה זמינים בסביבה
- פקטורי גדילה - קבלת סיגנל מולקולרי מהסביבה החיצונית המורה “התחלק”
- היעדר צפיפות - התאים חשים לחץ ומתח מתאים שכנים; אם צפוף, אין סיבה להתחלק (חלוקה נדרשת כשתאים מתים ויש להשלים את החסר)
שלוש נקודות בקרה מרכזיות
המעבר משלב לשלב במחזור התא אינו אוטומטי - אנזימים וחלבונים בודקים אם התא השלים את משימותיו בשלב הקודם.
| נקודת בקרה | מיקום | השאלה המרכזית |
|---|---|---|
| G1 | בין G1 ל-S | האם התא גדול מספיק? האם יש מספיק נוטריאנטים? |
| G2 | בין G2 ל-M | האם ה-DNA החדש תקין? |
| M | במהלך המיטוזה | האם הכרומטידות נקשרו כראוי למיקרוטובולים? |
נקודת הבקרה G2 היא הקריטית ביותר - זאת הבקרה העיקרית על הצטברות מוטציות ושינויים נוספים. כישלון בנקודה זו מאפשר לתאים להמשיך להתחלק עם DNA פגום.
כיצד תאים סרטניים עוקפים את מנגנוני הבקרה
-
ייצור עצמי של פקטורי גדילה: במצב תקין, התא צריך לקבל פקטורי גדילה מהסביבה. תאים סרטניים עשויים לצבור מוטציה שגורמת להם לייצר בעצמם פקטורי גדילה, ואז “במפתיע” יש פקטורי גדילה בסביבה והתא מתחלק.
-
התעלמות מצפיפות: פגיעה במנגנון שחש צפיפות - התאים מתחלקים למרות שצפוף.
-
דילוג על נקודות בקרה: מוטציה שגורמת להתעלמות מאחת משלוש נקודות הבקרה, במיוחד G2.
טומור סופרסורים ואונקוגנים
ניתן לחלק את הגנים שמעורבים בבקרת חלוקת תאים לשתי קבוצות עיקריות:
טומור סופרסורים (Tumor Suppressors)
- תפקיד: עצירת חלוקה כשאין בה צורך
- סוג מוטציה: Loss of Function (אובדן פעילות)
- אופי תורשה: רצסיבי - נדרשת פגיעה בשני האללים
ההיגיון: כל עוד אלל אחד תקין, הוא מייצר מספיק חלבון כדי לעצור חלוקה בלתי מבוקרת. רק כששני האללים פגומים אין מי שיעצור.
פרוטו-אונקוגנים / אונקוגנים
- תפקיד רגיל: עידוד חלוקה בזמנים מתאימים (כשיש סיגנל)
- סוג מוטציה: Gain of Function (עודף פעילות)
- אופי תורשה: דומיננטי - מספיקה פגיעה באלל אחד
ההבחנה: פרוטו-אונקוגן הוא הגן במצב תקין; אונקוגן הוא אותו גן לאחר שצבר מוטציה של Gain of Function.
ההיגיון: מספיק שאלל אחד פעיל ביתר כדי לעודד חלוקה בלתי מבוקרת, גם אם האלל השני תקין.
שני דימויים להבנת ההבדל
דימוי המתג: פרוטו-אונקוגן הוא מי שמדליק את האור, טומור סופרסור הוא מי שמכבה.
- אונקוגן שנתקע במצב “דלוק” = האור דולק כל הזמן = חלוקה מתמדת
- טומור סופרסור שאינו מתפקד = לא משנה כמה פעמים מורידים את המתג, האור נשאר דולק
דימוי האוטו: אונקוגן הוא דוושת הגז, טומור סופרסור הוא דוושת הבלמים. נניח שיש שתי דוושות גז ושתי דוושות בלמים:
- דוושת גז אחת תקועה למטה ← התקדמות בלתי נשלטת (מספיק פגיעה באלל אחד)
- דוושת בלמים אחת לא עובדת ← האוטו עדיין יאט (יש עוד בלם)
- שתי דוושות הבלמים לא עובדות ← התקדמות בלתי נשלטת (צריך פגיעה בשני האללים)
סיכום ההבדלים
| טומור סופרסור | אונקוגן | |
|---|---|---|
| תפקיד | עצירת חלוקה | עידוד חלוקה |
| מוטציה | Loss of Function | Gain of Function |
| אופי | רצסיבי | דומיננטי |
| נדרש לפגיעה | שני אללים | אלל אחד |
| דימוי | בלמים | גז |
דוגמאות לגנים מרכזיים
P53 - “שומר הגנום”
P53 הוא טומור סופרסור מרכזי שיושב על צומת ההחלטות של התא. תפקידיו כוללים:
- עצירה של מחזור התא כשמזוהה נזק
- גיוס מנגנוני תיקון DNA
- הובלת תאים לאפופטוזיס כשתיקון נכשל
- התערבות בתהליכי אנגיוגנזה
חשיבות קלינית: P53 מופיע כמעט בכל סוגי הסרטן בשלב כלשהו של ההתפתחות הסרטנית. הסיבה היא שהוא מעורב בשלושת המנגנונים המרכזיים להגנה מסרטן (עצירת מחזור, תיקון DNA, אפופטוזיס), וכמעט כל מוטציה לאורך הגן תשבש את תפקודו.
אנקדוטה: לפילים יש כחמישה עותקים של P53, והם כמעט לא חולים בסרטן - למרות שהם גדולים וחיים שנים רבות.
מה הסיכוי למוטציה ב-P53? לכאורה, הסיכוי שיהיו שתי מוטציות נפרדות באותו גן, באותו תא, הוא נדיר ביותר - נדרשים שני אירועים בלתי תלויים. אך למרות שזה נדיר ברמת התא הבודד, יש לנו מיליארדי תאים ומיליארדי חלוקות, כך שבאחוז מסוים מהמקרים אכן יכולה להתרחש מוטציה ב-P53.
תסמונת Li-Fraumeni ו-Loss of Heterozygosity
במקרים נדירים, מורשת מוטציה באלל אחד של P53 דרך תאי הזרע או הביצית. במצב הזה:
- כל תאי הגוף של הצאצא מכילים כבר מוטציה אחת ב-P53
- לא נדרשות שתי מוטציות חדשות - מספיקה רק מוטציה אחת נוספת באלל השני
- מצב זה נקרא Loss of Heterozygosity - אובדן ההטרוזיגוטיות
התוצאה: סיכון מוגבר משמעותית לסרטן, כי “חצי מהדרך” כבר נעשתה מלידה.
Retinoblastoma (RB)
- טומור סופרסור
- קשור לסרטן נדיר ברשתית העין
- מופיע בעיקר בילדים
- ברוב המקרים - אלל אחד מורש פגום (Loss of Heterozygosity)
- שיעור הישרדות גבוה בגלל גילוי מוקדם (נראה מבחוץ)
- שכיחות: 1:18,000 לידות
BRCA1 ו-BRCA2
טומור סופרסורים שקשורים למנגנון תיקון Homologous Recombination.
למה דווקא סרטן שד ושחלות? רקמות השד והשחלה מושפעות מאוד מהורמונים, ויש בהן ריבוי של שברים דו-גדיליים המצריכים את מנגנון ה-HR. לכן, פגיעה ב-BRCA מתבטאת קודם כל ברקמות אלו.
נתונים קליניים חשובים:
| פרמטר | ערך |
|---|---|
| שכיחות נשאות באוכלוסייה האשכנזית | 2.5% |
| הגברת סיכון לסרטן | 30-70% (לא 100%!) |
| אחוז מקרי סרטן השד הקשורים ל-BRCA | 12% |
| מספר מוטציות נפוצות באשכנזים | 3 |
נקודות חשובות:
- מוטציה ב-BRCA מגבירה סיכון אך אינה מבטיחה התפתחות סרטן
- בדיקה שלילית ל-BRCA לא שוללת סרטן שד - יש גנים רבים נוספים
- הבדיקה בארץ פשוטה וזולה כי בודקים במסגרתה רק שלוש מוטציות נפוצות
- באוכלוסיות אחרות (למשל צפון אפריקה) המוטציות הנפוצות שונות - צריך בדיקות מותאמות
המלצות מעקב: מומלץ לנשאיות להיות במעקב צמוד יותר, ולפעמים יש המלצות להתערבות מונעת בהתאם לגורמים נוספים.
RAS - דוגמה לאונקוגן
RAS הוא חלק ממסלול הרצפטור טירוזין קינאז - המסלול שמעביר את הסיגנל מפקטורי גדילה חיצוניים לתוך התא.
במצב תקין: נקלט סיגנל ברצפטור ← RAS מעביר את המסר פנימה ← התא מתחלק.
במוטציית Gain of Function: RAS מסמל כל הזמן “התחלק!” - גם ללא סיגנל חיצוני.
שכיחות: בכ-90% מהמקרים של סרטן הלבלב יש מוטציה ב-RAS. נמצא גם בסוגי סרטן רבים נוספים.
למה סרטנים קשורים לרקמות ספציפיות? בדרך כלל, הגן ייפגע קודם ברקמה שעושה בו את השימוש המרכזי - שם הוא הכי פעיל ושם הפגיעה תורגש ראשונה.
כרומוזום פילדלפיה ו-BCR-ABL
טרנסלוקציה בין כרומוזום 9 לכרומוזום 22 יוצרת מצב חריג:
- גן BCR (בדרך כלל על כרומוזום 22) מתחבר לגן ABL (בדרך כלל על כרומוזום 9)
- ABL הוא פרוטו-אונקוגן
- שני הגנים לא היו אמורים להיפגש לעולם
- החיבור יוצר חלבון היברידי BCR-ABL שפעיל תמידית
- קשור לסרטן CML (לוקמיה מיאלואידית כרונית)
טיפול - Gleevec (Imatinib):
- תרופה שמעכבת ספציפית את BCR-ABL
- הכפילה את תוחלת החיים של החולים
- יתרון מרכזי: החלבון BCR-ABL לא קיים בתאים תקינים, לכן התרופה פוגעת רק בתאים סרטניים ויש פחות תופעות לוואי
- זו הייתה פריצת דרך גדולה - הבנת המנגנון אפשרה פיתוח טיפול ממוקד
האם סרטן הוא מחלה תורשתית?
לא במובן הקלאסי:
- מחלות תורשתיות קלאסיות = גן יחיד או מספר גנים ידועים
- סרטן = עשרות עד מאות גנים מעורבים
- רק כ-10% מהסרטנים הם “משפחתיים”
תנאים להורשה:
- המוטציה חייבת להיות בתאי הזרע או הביצית
- מוטציות בתאים סומטיים (למשל בריאה) לא עוברות לצאצאים
- גם כשיש רכיב מורש, הוא מגביר סיכון אך לא בהכרח מכתיב התפתחות סרטן
סיכום: יותר מ-500 גנים ידועים כמעורבים בסוגי סרטן שונים. מכאן הצורך בהמשך מחקר, להבנת המוטציות והמנגנונים ולפיתוח טיפולים ממוקדים.
חלק ב’: רקומבינציה ותאחיזה
רקע - רקומבינציה הומולוגית
נתקלנו ברקומבינציה הומולוגית בשני הקשרים במהלך הקורס:
-
במיוזה - שחלוף (Crossing Over) בפרופאזה I, שבו כרומטידות לא אחיות (אחת ממקור אימהי, אחת ממקור אבהי) מחליפות מקטעים גנטיים. המטרה: הגברת המגוון הגנטי.
-
בתיקון DNA - מנגנון HR לתיקון שברים דו-גדיליים, שבו הכרומוזום ההומולוגי משמש כתבנית להשלמת המקטע החסר (HR - Homologous Recombination).
היום נסתכל על רקומבינציה מזווית חדשה - נבחן מה קורה כשגנים קרובים מאוד מבחינה פיזית.
מעבר מתורשה של 2 גנים בלתי תלויים לגנים תלויים
עד עתה התייחסנו לתורשה של 2 גנים מנדליים (A+B) ככבלתי תלויים זה בזה.
נניח הכלאה בדור ההורים:
\[\textcolor{red}{\text{AABB}} \times \textcolor{blue}{\text{aabb}}\]הצאצא ההטרוזיגוט: כפי שרשמנו אותו עד עתה:
\[\textcolor{red}{\text{A}}\textcolor{blue}{\text{a}} \quad \textcolor{red}{\text{B}}\textcolor{blue}{\text{b}}\]אפשר לעקוב אחרי המקור של כל אלל - על כרומוזום אחד יש A ו-B (מהורה אחד), ועל הכרומוזום ההומולוגי יש a ו-b (מההורה השני):
\[\frac{\textcolor{red}{\text{A}}\quad \textcolor{red}{\text{B}}}{\textcolor{blue}{\text{a}} \quad \textcolor{blue}{\text{b}}}\]אם הגנים בלתי תלויים - שילובי הגמטות האפשריים הם $\textcolor{red}{\text{AB}}, \textcolor{red}{\text{A}}\textcolor{blue}{\text{b}}, \textcolor{blue}{\text{a}}\textcolor{red}{\text{B}}, \textcolor{blue}{\text{ab}}$ עם סיכוי שווה של 25% לכל אחד.
אבל למעשה: כששני הגנים קרובים פיזית על אותו כרומוזום, הם נוטים להישאר יחד - כלומר, הגמטות הנפוצות יהיו בעיקר $\textcolor{red}{\text{AB}}$ ו$\textcolor{blue}{\text{ab}}$ (מההורים), ופחות יופיעו הגמטות $\textcolor{red}{\text{A}}\textcolor{blue}{\text{b}}$ ו$\textcolor{blue}{\text{a}}\textcolor{red}{\text{B}}$ (שדורשות שחלוף).
| שילוב | סוג | הסבר |
|---|---|---|
| $\textcolor{red}{\text{AB}}$ | הורי | נשאר כפי שהתקבל מההורה - ללא שחלוף |
| $\textcolor{blue}{\text{ab}}$ | הורי | נשאר כפי שהתקבל מההורה - ללא שחלוף |
| $\textcolor{red}{\text{A}}\textcolor{blue}{\text{b}}$ | רקומביננטי | דורש שחלוף בין הגנים כדי להיווצר |
| $\textcolor{blue}{\text{a}}\textcolor{red}{\text{B}}$ | רקומביננטי | דורש שחלוף בין הגנים כדי להיווצר |
הבהרה: “רקומביננטי” אינו קשור לדומיננטיות או רצסיביות - זה מתאר שהשילוב נוצר כתוצאה משחלוף, ולא התקבל “כמות שהוא” מאחד ההורים.
מה הסיכוי לכל שילוב? אם שני הגנים בלתי תלויים (רחוקים זה מזה או על כרומוזומים שונים), הסיכוי לכל אחד מארבעת השילובים הוא שווה - 25%. במצב זה, 50% הוריים ו-50% רקומביננטיים.
תאחיזה (Linkage)
תומאס הנט מורגן, שחקר זבובי פירות (Drosophila), הבחין שיש שילובי תכונות שמופיעים יחד בשכיחות גבוהה מהצפוי: זבובים עם גוף כהה נטו להיות גם עם כנפיים כהות, וזבובים עם גוף בהיר נטו להיות גם עם כנפיים בהירות. הוא קרא לתופעה הזאת תאחיזה (Linkage) - התכונות “אחוזות” זו בזו.
תנאים לתאחיזה:
- שני הגנים נמצאים על אותו כרומוזום
- שני הגנים נמצאים במרחק פיזי קרוב זה לזה
ההיגיון: הרקומבינציה יכולה להתרחש בנקודות שונות לאורך הכרומוזום (לא בנקודה קבועה אחת). ככל ששני הגנים קרובים יותר מבחינה פיזית, כך הסיכוי שדווקא ביניהם תהיה נקודת שחלוף קטן יותר.
המחשה: אפשר לדמיין שני אנשים עומדים בחדר, ומישהו שלישי שצריך לעבור ביניהם. אם הם רחוקים זה מזה - קל לעבור ביניהם פעמים רבות. אם הם צמודים - כמעט אי אפשר לעבור ביניהם.
התוצאה: כשגנים קרובים מאוד, רוב הצאצאים יקבלו צירופים הוריים, ומעט יקבלו צירופים רקומביננטיים.
חישוב מרחק גנטי
מורגן פיתח נוסחה לכימות המרחק בין גנים, ביחידות שנקראות סנטימורגן (cM) על שמו:
\[\text{Genetic distance (cM)} = \frac{\text{number of recombinant individuals}}{\text{total number of offspring}} \times 100\]פירוש התוצאה:
| מרחק | משמעות |
|---|---|
≥50 cM | אין תאחיזה - הגנים בלתי תלויים (רחוקים מדי או על כרומוזומים שונים) |
<50 cM | יש תאחיזה - ככל שהמספר נמוך יותר, התאחיזה חזקה יותר |
המרה ליחידות פיזיות: 1 סנטימורגן ≈ 1 מיליון זוגות בסיסים (1 Mb). נשמע הרבה, אבל מתוך 3 מיליארד bp בגנום - זה מרחק קצר יחסית.
דוגמה מחושבת - נוצות בעופות
\[\frac{\text{I}\quad \text{F}}{\text{i} \quad \text{f}} \times \frac{\text{i}\quad \text{f}}{\text{i} \quad \text{f}}\]
- $\text{I}$ - נוצות לבנות, $\text{i}$ - נוצות צבעוניות
- $\text{F}$ - נוצות ישרות, $\text{f}$ - נוצות מסולסלות
- מה הפנטופים של ההורים?
- האם אלה שילובים רקומביננטיים או הוריים?
- מה הפנטופים של הצאצאים הפוטנציאלים?
ההורים:
- הורה 1: הטרוזיגוט לשתי התכונות (I i, F f) ← פנוטיפ: לבן וישר
- הורה 2: הומוזיגוט רצסיבי (i i, f f) ← פנוטיפ: צבעוני ומסולסל
ניתוח: ההורה הרצסיבי תמיד נותן i f. ההורה ההטרוזיגוט יכול לתת ארבעה שילובים, ולכן הפנוטיפ של הצאצא מעיד ישירות על מה שהתקבל מההורה ההטרוזיגוט:
| פנוטיפ הצאצא | מה התקבל מההטרוזיגוט | סוג |
|---|---|---|
| לבן ישר | I F | הורי |
| צבעוני מסולסל | i f | הורי |
| לבן מסולסל | I f | רקומביננטי |
| צבעוני ישר | i F | רקומביננטי |
תוצאות מ-200 צאצאים:
| פנוטיפ | כמות | סוג |
|---|---|---|
| לבן ישר | 83 | הורי |
| צבעוני מסולסל | 87 | הורי |
| לבן מסולסל | 18 | רקומביננטי |
| צבעוני ישר | 12 | רקומביננטי |
חישוב:
\[\frac{18 + 12}{200} \times 100 = 15 \text{ cM}\]מסקנה: 15 < 50, כלומר יש תאחיזה. הגנים I ו-F קרובים זה לזה על אותו כרומוזום.
יתרון הדוגמה: בזכות ההורה ההומוזיגוט הרצסיבי, ניתן לזהות את הגנוטיפ לפי הפנוטיפ בלבד, ללא צורך בבדיקה גנטית.
שחלוף כפול (Double Crossover)
לעיתים מתרחש שחלוף כפול - החלפה בנקודה אחת ואז החלפה חזרה בנקודה שנייה. התוצאה נראית כמו צירוף הורי, למרות שהתרחשו שני אירועי רקומבינציה.
הבעיה: קשה לזהות מצב כזה, עלולים לפספס אירועי רקומבינציה ולהעריך בחסר את המרחק הגנטי האמיתי.
הערה: שחלוף כפול הוא מצב יחסית נדיר, ובחישובים בסיסיים מתעלמים ממנו.
חלק ג’: סמנים גנטיים ובדיקות גנטיות
מהו סמן גנטי?
סמן גנטי הוא רצף DNA קצר וייחודי שמופיע פעם אחת בגנום, במיקום ספציפי. הוא לא חייב להיות חלק מגן מקודד - יכול להיות באזור בין-גני או באזור ללא תפקיד ידוע.
שימושים:
- מיפוי גנטי (קביעת מיקום גנים על כרומוזומים)
- זיהוי פלילי
- בדיקת הורות
- בדיקת נשאות למחלות
- מחקר אנתרופולוגי
רקע היסטורי: לפני שהגנום האנושי רוצף במלואו, חוקרים בנו מפות של סמנים גנטיים - חישבו מרחקים בין סמנים, זיהו אילו נמצאים על אותו כרומוזום, ובנו בהדרגה תמונה של ארגון הגנום.
שונות גנטית באוכלוסייה
כ-99% מהגנום זהה בין כל בני האדם. השונות הגנטית (פחות מ-1%) היא הבסיס לבדיקות גנטיות - באזורים אלה אנו שונים זה מזה.
סוגי פולימורפיזם
SNP (Single Nucleotide Polymorphism)
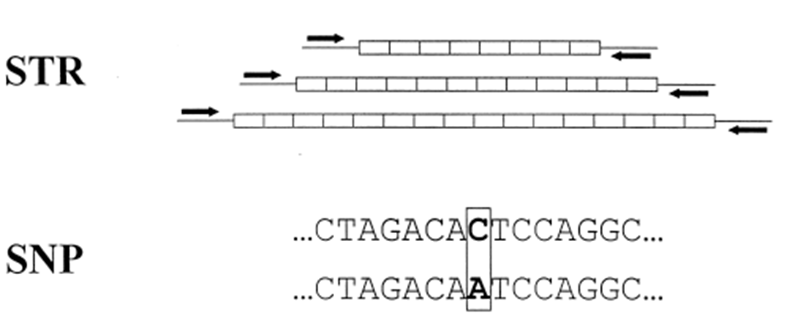
שונות בנוקלאוטיד בודד בנקודה ספציפית בגנום:
- מקסימום ארבע אפשרויות (A, T, G, C)
- לרוב רק שני וריאנטים קיימים באוכלוסייה
- יכול להיות באזור מקודד (עשוי להשפיע על פנוטיפ) או באזור לא מקודד (משמש כסמן בלבד)
VNTR (Variable Number Tandem Repeats)
אזורים בגנום שבהם רצף קצר (10-60 נוקלאוטידים) חוזר על עצמו, כאשר מספר החזרות משתנה בין פרטים:
- אצל אחד: 7 חזרות
- אצל אחר: 10 חזרות
- אצל שלישי: 12 חזרות
התוצאה: אורכים שונים של המקטע - קל לזהות בג’ל אלקטרופורזה.
VNTR דומה למוטציות הרחבה (כמו בפרגיל X), אך כאן מדובר באזורים שאינם בתוך גנים מקודדים ולכן אינם גורמים לפנוטיפ - משמשים רק כסמנים.
אנזימי רסטריקציה
מהם?
אנדונוקליאזות (חותכות DNA מהאמצע, לא מהקצוות) שמזהות רצף קצר וספציפי (10-6 נוקלאוטידים) וחותכות בנקודה מדויקת.
מקור: התגלו בחיידקים כמנגנון הגנה מפני DNA ויראלי. החיידק מגן על ה-DNA שלו מפני האנזימים, וחותך DNA זר שנכנס.
סוגים:
- Blunt ends - חיתוך ישר
- Sticky ends - חיתוך בזיגזג, משאיר קצוות בולטים
תכונה קריטית: ספציפיות גבוהה מאוד. שינוי של נוקלאוטיד אחד ברצף ההכרה מונע חיתוך.
שימוש לזיהוי SNP
אם נבחר אנזים רסטריקציה שאתר ההכרה שלו כולל את ה-SNP:
- רצף תקין ← האנזים מזהה וחותך ← שני מקטעים קצרים
- רצף עם מוטציה ← האנזים אינו מזהה, אינו חותך ← מקטע ארוך אחד
דוגמה - אנמיה חרמשית:
| רצף | חומצה אמינית | |
|---|---|---|
| תקין | GAG | גלוטמין |
| מוטנטי | GTG | ואלין |
אנזים רסטריקציה שמזהה GAG יחתוך רק את הרצף התקין.
תוצאות בג’ל:
- פס קצר בלבד = הומוזיגוט תקין (שני האללים נחתכו)
- פס ארוך בלבד = הומוזיגוט מוטנטי/חולה (אף אלל לא נחתך)
- שני פסים = הטרוזיגוט/נשא (אלל אחד נחתך, אחד לא)
זיהוי VNTR
שתי שיטות עיקריות:
- אנזימי רסטריקציה: חיתוך משני צידי האזור החזרתי (לא בתוכו) ← מקטעים באורכים שונים
- PCR: הגברה עם פריימרים משני צידי האזור ← תוצרים באורכים שונים
בשתי השיטות, הרצה בג’ל אלקטרופורזה מראה פסים בגבהים שונים לפי מספר החזרות.
טביעת אצבע גנטית וזיהוי
העיקרון
בדיקת מספר רב של סמנים גנטיים (20-15 ויותר) והשוואת פרופילים. כל סמן בודד מספק מידע מוגבל, אך שילוב של סמנים רבים יוצר “טביעת אצבע” ייחודית.
סטטיסטיקה: ב-15 אתרים שונים, הסיכוי ששני אנשים אקראיים יהיו זהים הוא כ-10⁻¹¹ (אחד לעשרה טריליון).
יישומים
זיהוי פלילי:
- השוואת DNA מזירת פשע לחשודים
- בישראל: לא מספיק להרשעה כראיה יחידה - נדרשות ראיות נוספות
- הסיבה: למרות הסיכוי הנמוך לטעות, היו מקרים נדירים של טעויות (הערה: אני לא בטוח שזאת הסיבה, מוזמנים להתעמק במשפט פלילי).
בדיקות הורות:
- ילד חייב לקבל אללים מהוריו
- קל יותר לשלול הורות מאשר להוכיח (אם אלל לא מתאים לאף הורה - ברור שמשהו לא מסתדר)
- סמן אחד לא מספיק - בודקים סמנים רבים
מאגרים גנטיים:
- צבא ארה”ב - זיהוי נופלים
- מחקר אנתרופולוגי - מיפוי שבטים ואוכלוסיות
דוגמה לבדיקת הורות:
נניח שבדקנו סמן אחד ומצאנו:
- אמא: אללים 1, 4
- אבא לכאורה: אללים 3, 5
- ילד: אללים 1, 3
הילד קיבל אלל 1 (יכול להיות מהאמא) ואלל 3 (יכול להיות מהאבא) - מתאים. אבל זה סמן אחד בלבד! צריך לבדוק עוד רבים.
בדיקות גנטיות לסרטן
שני סוגים עיקריים
1. בדיקות נשאות: האם ירשתי מוטציה?
- נעשות מכל תא בגוף (בדרך כלל דם)
- דוגמה: BRCA1/2
- מטרה: להעריך סיכון עתידי
2. בדיקות גידול: מה המצב הגנטי של הגידול?
- נעשות מדגימת הגידול עצמו
- מאפיינות את המוטציות שהצטברו בגידול
- מטרה: התאמת טיפול אישי
דוגמה - Mammaprint: בודקת ביטוי של 70 גנים בגידול, מעריכה סיכון להתפשטות וגרורות, עוזרת להחליט על אסטרטגיית טיפול.
רמות בדיקה - מה לבדוק?
| רמה | מה נבדק | יתרונות | חסרונות |
|---|---|---|---|
| גנום מלא | כל ה-DNA | מידע מקסימלי | יקר, איטי, הרבה VUS, ממצאים לא צפויים |
| גנים רלוונטיים | כל הגנים הקשורים למחלה | מאוזן | עדיין יקר |
| גן ספציפי | כל הגן הרלוונטי | ממוקד | עלול לפספס מוטציות בגנים אחרים |
| מוטציות נפוצות | רק המוטציות השכיחות באוכלוסייה | זול, מהיר, תשובות חד-משמעיות | מפספס מוטציות נדירות |
בדיקות סקר (לאוכלוסייה הכללית) משתמשות ברמה האחרונה - רק מוטציות נפוצות. הסיבה: צריך משהו זול ופשוט לבדיקת אוכלוסייה שלמה.
סוגי תשובות
| תשובה | משמעות |
|---|---|
| חיובי | נמצאה מוטציה ידועה כפתוגנית |
| שלילי | לא נמצאה מוטציה (במה שנבדק!) |
| VUS | Variant of Uncertain Significance - נמצא שינוי, לא ידוע אם פתוגני |
VUS היא התשובה המבלבלת ביותר - יש שינוי גנטי, אבל אין מספיק מידע בשביל לדעת אם הוא גורם למחלה או שהוא וריאציה תקינה.
נקודה קריטית: בדיקה גנטית לא בודקת “הכל”. תמיד צריך לשאול מה בדיוק נבדק. אם בדקו 3 מוטציות נפוצות ב-BRCA, ייתכן שיש מוטציה רביעית נדירה שלא נבדקה.
שאלות אתיות - האנטינגטון
מחלת האנטינגטון היא מחלה גנטית (מוטציית הרחבה) שמתפתחת בגיל מבוגר יחסית (40-50+) ומקצרת משמעותית את תוחלת החיים. אין לה טיפול.
הדילמה: האם להציע בדיקה גנטית לגילוי מוקדם?
| עמדה | נימוקים |
|---|---|
| כן, לבדוק | לתכנן את החיים, לקבל החלטות מודעות, להיערך |
| לא, לא לבדוק | אין מה לעשות עם המידע, למה לחיות עם הצל הזה |
אין תשובה נכונה - זו החלטה אישית. הבדיקה קיימת, אך לא מוצעת כסקר לאוכלוסייה הכללית.
סיכום לבחינה
התמרה סרטנית
- תהליך רב-שלבי: חלוקה בלתי מבוקרת ← כשל בתיקון ← כשל באפופטוזיס ← התחמקות מחיסון ← אנגיוגנזה ← גרורות
- טומור סופרסור: רצסיבי, Loss of Function, צריך פגיעה בשני אללים (דימוי: בלמים)
- אונקוגן: דומיננטי, Gain of Function, מספיק פגיעה באלל אחד (דימוי: גז)
- P53: מופיע כמעט בכל סוגי הסרטן
- BRCA1/2: 2.5% נשאות באשכנזים, מגביר סיכון 30-70% (לא מבטיח!), 12% ממקרי סרטן שד
- Loss of Heterozygosity: אלל אחד פגום מלידה, צריך רק עוד מוטציה אחת
- ~10% מהסרטנים משפחתיים, >500 גנים מעורבים
רקומבינציה ותאחיזה
- צירוף הורי: כמו שהתקבל מההורה, ללא שחלוף
- צירוף רקומביננטי: נוצר משחלוף
- תאחיזה: גנים קרובים על אותו כרומוזום, פחות רקומביננטים מהצפוי
- נוסחה: מרחק (cM) = (רקומביננטים / סה”כ) × 100
- פרשנות: ≥50 cM = אין תאחיזה; <50 cM = יש תאחיזה
- 1 cM ≈ 1 מיליון bp
סמנים גנטיים ובדיקות
- SNP: שונות בנוקלאוטיד בודד (מקס’ 4 אפשרויות, לרוב 2)
- VNTR: שונות במספר חזרות → אורכים שונים בג’ל
- אנזימי רסטריקציה: חותכים ברצף ספציפי, שינוי של נוקלאוטיד אחד מונע חיתוך
- ~99% מהגנום זהה בין בני אדם
- 15 סמנים ← סיכוי לזהות מקרית ~10⁻¹¹
- בדיקת נשאות vs בדיקת גידול
- רמות בדיקה: גנום מלא ↔ מוטציות נפוצות (יקר/מקיף ↔ זול/ממוקד)
- VUS: וריאנט בעל משמעות לא ודאית
- בדיקה גנטית לא בודקת הכל - תמיד לברר מה נבדק
לקסיקון מונחים
| מונח | הגדרה |
|---|---|
| אונקוגן | פרוטו-אונקוגן שצבר מוטציית Gain of Function ומעודד חלוקה בלתי מבוקרת |
| אפופטוזיס | מוות תאי מתוכנת |
| אנגיוגנזה | יצירת כלי דם חדשים |
| טומור סופרסור | גן שתפקידו לעצור חלוקת תאים; דורש פגיעה בשני אללים |
| רקומבינציה | החלפת מקטעים בין כרומוזומים הומולוגיים |
| תאחיזה (Linkage) | נטייה של גנים קרובים לעבור יחד בתורשה |
| סנטימורגן (cM) | יחידת מרחק גנטי; 1 cM ≈ 1 Mb |
| SNP | Single Nucleotide Polymorphism - שונות בנוקלאוטיד בודד |
| VNTR | Variable Number Tandem Repeats - שונות במספר חזרות |
| Loss of Function | מוטציה הגורמת לאובדן פעילות הגן |
| Gain of Function | מוטציה הגורמת לפעילות יתר של הגן |
| Loss of Heterozygosity | מצב שבו אלל אחד כבר פגום מלידה |
| VUS | Variant of Uncertain Significance - שינוי בעל משמעות לא ודאית |
| אנזים רסטריקציה | אנדונוקליאז החותך DNA ברצף ספציפי |