לשנן
רדיקלים והלוגנציה רדיקלית
מושגי יסוד
- רדיקל = אלקטרון בודד, לא יציב, “רדיקלי/משוגע”
- יציבות רדיקלים: שלישוני > שניוני > ראשוני (כמו קרבוקטיונים)
- רדיקל ליד קשר כפול = יציב בגלל רזוננס
- רדיקל ליד טבעת ארומטית = עוד יותר יציב

מנגנון הלוגנציה רדיקלית
- “רדיקל זה אלקטרון בודד. למה קוראים לו רדיקל? כי הוא משוגע. הוא רדיקלי”
- “רדיקל רוצה מאוד לחזור להיות ניטרלי”
- “ככל שהרדיקל יותר מותמר ← יותר יציב”
- “שלב ראשון זה ליצור את הרדיקל הראשוני. שלב שני, הרדיקל הולך לעבור ממולקולה למולקולה”
3 שלבים תמיד:
- התחלה: יצירת רדיקל ראשוני (קרינה/חום) - $\ce{X2 -> 2X\bullet}$
- המשכיות (פרופגציה): רדיקל עובר ממולקולה למולקולה
- סיום: שני רדיקלים נפגשים ונסגרים
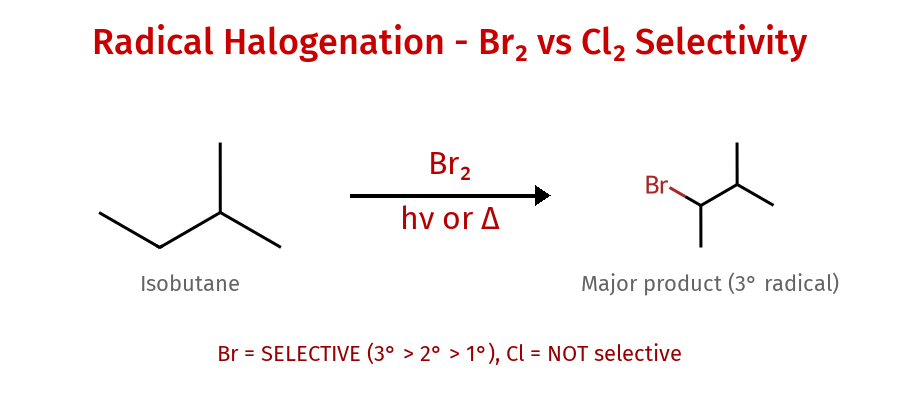
סלקטיביות הלוגנים
- כלור = לא סלקטיבי, תוקף כל מימן שרואה
- ברום = סלקטיבי, משאיר רק את הרדיקל היציב ביותר
-
כלל: אם המולקולה סימטרית ← רק תוצר אחד במונוכלורינציה
- “ברום זה חומר הרבה יותר סלקטיבי, והוא כן מעניין לו מה הוא משאיר מאחוריו”
- “כלור מחליף כל מימן שהוא רואה, בכמות כמעט שווה אחד לשני”
- אם המולקולה סימטרית ← תוצר יחיד
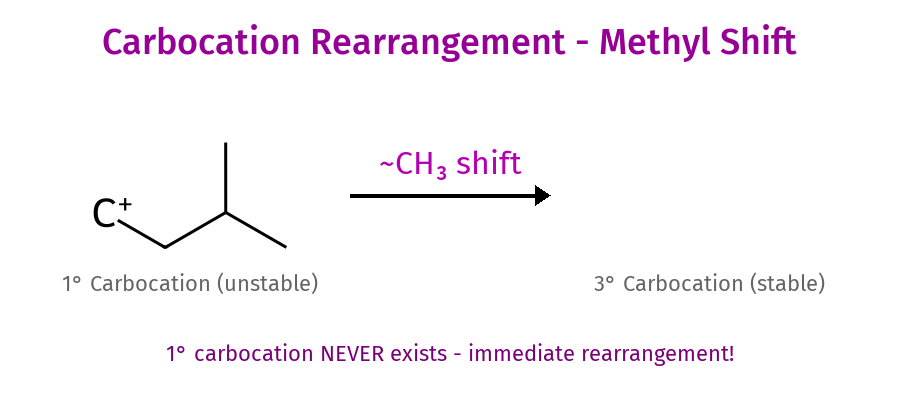
קרבוקטיונים ויציבותם
יציבות קרבוקטיון
- ככל שהקרבוקטיון יותר מותמר, הוא יותר יציב
- רזוננס חזק מייצוב אינדוקטיבי
- אין קרבוקטיון ראשוני - תמיד שחלוף מיידי!
שחלופים
- מטיל ומימן יכולים להשתחלף
- אם יש קרבוקטיון ← יכול להיות שחלוף
- ברגע שיש שחלוף, זה הקובע
סיפוחים לקשר כפול
כללי יסוד
- קשר כפול = נוקלאופיל (מלא אלקטרונים)
- סיפוח = הוספת מולקולה לקשר כפול
- תמיד מקבלים אלקאן (חוץ ממקרים מיוחדים, כמו קרבונילים)
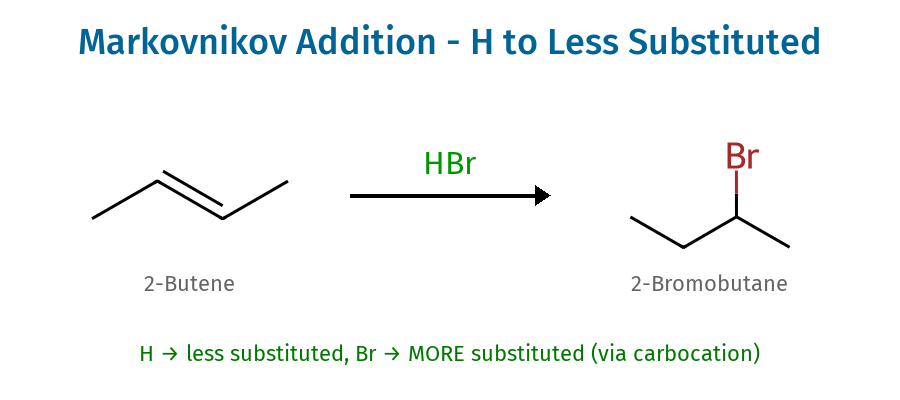
כלל מרקובניקוב
“מימן לפחות מותמר, נוקלאופיל למותמר יותר”
- המימן ייכנס לפחות מותמר, הנוקלאופיל ייכנס למותמר יותר
- “מימן לפחות מותמר כדי ליצור קרבוקטיון מותמר יותר”
- מטרה: ליצור את הקרבוקטיון היציב ביותר
- אם יש שחלוף ← השחלוף קובע את התוצר הסופי
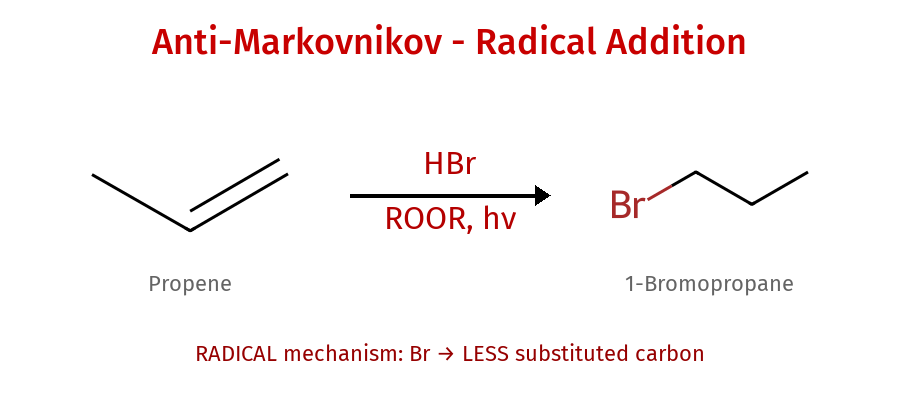
אנטי-מרקובניקוב (רדיקלי)
- עם פרוקסיד: הברום הולך לפחות מותמר
- מנגנון רדיקלי - לא דרך קרבוקטיון
מנגנון 1: דרך קרבוקטיון
תגובות עיקריות
- סיפוח חומצה הלוגנית ($\ce{HBr}$, $\ce{HCl}$)
- הידרציה ($\ce{H2O}$ + $\ce{H2SO4}$ קטליזה)
- “מים לא מספיק חומציים בשביל הקשר הכפול, ולכן צריך קטליזה חומצית”
- סיפוח אלכוהול ($\ce{ROH}$ + $\ce{H2SO4}$ קטליזה)
נקודות חשובות
- “מים לא מספיק חומציים בשביל הקשר הכפול, ולכן צריך קטליזה חומצית”
- כמות קטליטית = מחזור בתהליך
- קרבוקטיון מישורי ← יכולה להיות תקיפה מעל או מתחת (אם הפחמן כיראלי - תערובת רצמית)
מנגנון 2: דרך יון מגשר
תגובות עיקריות דרך יון מגשר
- ברומינציה ($\ce{Br2}$)
- הלוהידרין ($\ce{Br2}$ + $\ce{H2O}$)
מאפיינים מיוחדים - חיבור שני הלוגנים אנטי
- גשר ברומוניום - ברום מחובר לשני פחמנים
- סיפוח אנטי - תמיד 180 מעלות
- “גשר = תמיד אנטי (180 מעלות)”
- אין שחלופים - אין קרבוקטיון אמיתי
- “הברום השני בהכרח ייכנס 180 מעלות לגשר”
הלוהידרין - חיבור מים לפחמן היותר מותמר
- “המים הם גם הממס. באמת אפשר להגיד שאין סוף מולקולות מים ביחס לברום”
- במים: מים מנצחים סטטיסטית (יש הרבה יותר מולקולות)
- $\ce{Br^-}$ מסולבט במים ← פחות נוקלאופילי
- תמיד: $\ce{OH}$ במותמר יותר, $\ce{Br}$ במותמר פחות
- תמיד אנטי אחד לשני
- “המים הם גם הממס. באמת אפשר להגיד שאין סוף מולקולות מים ביחס לברום”
- “תגובה רגיו סלקטיבית - הנוקלאופיל רואה את הפחמן הזה כיותר אלקטרופילי”
מנגנון 3: מנגנונים מיוחדים
- סיפוח רדיקלי
- הידרוגנציה H2
- KMnO4
- אוזונוליזה
- יצירת אפוקסיד
רדיקלים לאלקאן
מבוא - האתגר הכימי של אלקאנים
אלקאנים מהווים את הבסיס הבנייני של הכימיה האורגנית, אך הם מציגים אתגר ייחודי מבחינה תגובתית. בניגוד למולקולות המכילות קבוצות פונקציונליות פעילות, אלקאנים כגון מתאן ($\ce{CH_4}$), אתאן ($\ce{C_2H_6}$), ופנטאן ($\ce{C_5H_{12}}$) הם כימית אינרטיים בתנאים רגילים. האינרטיות הזו נובעת מהעובדה שאלקאנים מכילים רק קשרי פחמן-פחמן וקשרי פחמן-מימן יציבים, ללא קבוצות עוזבות או מרכזי אלקטרופיליים שיכולים להשתתף בתגובות נוקלאופיליות או אלקטרופיליות מסורתיות.
מנקודת מבט תרמודינמית, קשרי $\ce{C-H}$ ו-$\ce{C-C}$ באלקאנים הם חזקים יחסית (כ-410 ו-350 קילוג׳ול/מול בהתאמה), מה שמונע שבירה ספונטנית בטמפרטורת החדר. בנוסף, המימן אינו יכול לפעול כקבוצה עוזבת במנגנוני $\ce{S_N1}$ או $\ce{S_N2}$ מכיוון שיון $\ce{H^-}$ הוא בסיס חזק ביותר ולכן קבוצה עוזבת גרועה.
עקרונות יסוד ברדיקלים חופשיים
הגדרה ומאפיינים
רדיקל חופשי הוא מין כימי המכיל אלקטרון בודד לא מזווג, המסומן בנקודה (•). רדיקלים אלו הם בעלי אנרגיה גבוהה ולכן מאוד ריאקטיביים, שכן הם שואפים להשלים את מעטפת האלקטרונים שלהם על ידי יצירת קשר חדש או שבירת קשר קיים.
יציבות הרדיקלים תלויה בגורמים דומים לאלו המשפיעים על יציבות קרבוקטיונים:
השפעות אינדוקטיביות: קבוצות אלקיל תורמות צפיפות אלקטרונית לפחמן הרדיקלי דרך היפר-קונג׳וגציה, מה שמייצב את הרדיקל. לכן, סדר היציבות הוא:
\[\text{Tertiary radical} > \text{Secondary radical} > \text{Primary radical} > \text{Methyl radical}\]ייצוב רזוננטי: רדיקלים הסמוכים למערכות π-אלקטרונים (רדיקלים אליליים ובנזיליים) מקבלים ייצוב משמעותי דרך דלוקליזציה של האלקטרון הבודד. לדוגמה, ברדיקל אלילי:
\[\ce{CH_2=CH-\dot{C}H_2 <-> \dot{C}H_2-CH=CH_2}\]הדלוקליזציה הזו מפזרת את הצפיפות הרדיקלית על פני מספר אטומים, מה שמקטין את האנרגיה הכוללת של המערכת.
שבירה הומוליטית לעומת הטרוליטית
בכימיה אורגנית קונבנציונלית, קשרים נשברים בצורה הטרוליטית, כאשר זוג האלקטרונים עובר במלואו לאחד האטומים:
\[\ce{A-B -> A^+ + B^-}\]לעומת זאת, ברדיקלים השבירה היא הומוליטית, כאשר כל אטום מקבל אלקטרון אחד:
\[\ce{A-B -> A\bullet + B\bullet}\]השבירה ההומוליטית דורשת בדרך כלל אנרגיה חיצונית (חום או קרינה) ומתרחשת עבור קשרים חלשים יחסית או במולקולות דו-אטומיות של הלוגנים.
מנגנון ההלוגנציה הרדיקלית
ההלוגנציה הרדיקלית של אלקאנים מתבצעת במנגנון תלת-שלבי קלאסי שכולל את השלבים הבאים:
שלב א׳: התחלה (Initiation)
בשלב זה נוצרים הרדיקלים הראשוניים על ידי שבירה הומוליטית של מולקולת ההלוגן:
\[\ce{X_2 ->[h \nu or \Delta] 2X\bullet}\]עבור כלור: $\ce{Cl_2 \xrightarrow{h\nu} 2Cl\bullet}$
עבור ברום: $\ce{Br_2 \xrightarrow{h\nu} 2Br\bullet}$
אנרגיית הקשר של $\ce{Cl-Cl}$ היא כ-240 קילוג׳ול/מול ושל $\ce{Br-Br}$ כ-190 קילוג׳ול/מול, מה שמאפשר שבירה בתנאי חימום מתון או קרינה UV.
שלב ב׳: התמשכות (Propagation)
זה השלב המרכזי שבו מתרחשת התגובה הכימית בפועל. השלב מורכב משני צעדים:
צעד 1: רדיקל ההלוגן תוקף קשר $\ce{C-H}$ באלקאן:
\[\ce{R-H + X\bullet -> R\bullet + H-X}\]צעד 2: הרדיקל האלקילי המתקבל מגיב עם מולקולת הלוגן נוספת:
\[\ce{R\bullet + X_2 -> R-X + X\bullet}\]שני הצעדים יוצרים מחזור רדיקלי שבו כל רדיקל הלוגן שנצרך בצעד הראשון מתחדש בצעד השני. המחזור ממשיך כל עוד קיימים רדיקלים במערכת וחומרי מוצא זמינים.
שלב ג׳: סיום (Termination)
כאשר מפסיקים את החימום או הקרינה, הרדיקלים הנותרים במערכת מתחברים זה לזה ויוצרים מולקולות יציבות:
\[\ce{X\bullet + X\bullet -> X_2}\] \[\ce{R\bullet + R\bullet -> R-R}\] \[\ce{R\bullet + X\bullet -> R-X}\]תגובות הסיום יוצרות תערובת מורכבת של תוצרי לוואי, מה שהופך את ההלוגנציה הרדיקלית לפחות סלקטיבית מתגובות אחרות.
סלקטיביות ברדיקלים: כלור לעומת ברום
כלורינציה - ריאקטיביות גבוהה, סלקטיביות נמוכה
רדיקל הכלור ($\ce{Cl\bullet}$) הוא מאוד ריאקטיבי ולא סלקטיבי. הוא תוקף כמעט כל קשר $\ce{C-H}$ ללא התחשבות משמעותית ביציבות הרדיקל המתקבל. למשל, בכלורינציה של 2-מתילפרופאן:
\[\ce{(CH_3)_3CH + Cl_2 \xrightarrow{h\nu} (CH_3)_3CCl + (CH_3)_2CHCl + Additional Products}\]היחס בין התוצרים קרוב ל-1:1, למרות שהרדיקל השלישוני יציב יותר מהרדיקל הראשוני.
הסבר קינטי: הכלורינציה היא תגובה אקסותרמית מאוד עם מחסום אנרגיית הפעלה נמוך. לפי עקרון האמונד-פוסטולטה, כאשר מחסום האנרגיה נמוך, ההבדלים ביציבות בין מצבי המעבר השונים קטנים, מה שמוביל לסלקטיביות נמוכה.
ברומינציה - ריאקטיביות מתונה, סלקטיביות גבוהה
רדיקל הברום ($\ce{Br\bullet}$) פחות ריאקטיבי מהכלור אך הרבה יותר סלקטיבי. הוא מעדיף לתקוף מימנים הנמצאים על פחמנים שלישוניים, ובהעדר כאלה - על פחמנים שניוניים. למשל:
\[\ce{(CH3)3CH + Br2 ->[h\nu] CH33CBr Primary product}\]הסבר קינטי: הברומינציה היא תגובה פחות אקסותרמית עם מחסום אנרגיית הפעלה גבוה יותר. במצב כזה, ההבדלים ביציבות בין הרדיקלים השונים באים לידי ביטוי מלא במצבי המעבר, מה שמוביל לסלקטיביות גבוהה לטובת הרדיקל היציב ביותר.
שיקולים תרמודינמיים וקינטיים
אנרגיות קשר והשפעתן על התגובה
הבנת אנרגיות הקשר חיונית להבנת מדוע תגובות הלוגנציה מסוימות מתאפשרות ואחרות לא:
- קשר $\ce{C-H}$ ראשוני: ~410 קילוג׳ול/מול
- קשר $\ce{C-H}$ שניוני: ~395 קילוג׳ול/מול
- קשר $\ce{C-H}$ שלישוני: ~380 קילוג׳ול/מול
- קשר $\ce{H-Cl}$: ~430 קילוג׳ול/מול
- קשר $\ce{H-Br}$: ~365 קילוג׳ול/מול
לכלורינציה של פחמן שלישוני:
\[\Delta H = [380 + 240] - [430 + 240] = -50 \mathrm{KJ/mol}\]לברומינציה של פחמן שלישוני:
\[\Delta H = [380 + 190] - [365 + 190] = +15 \mathrm{KJ/mol}\]התגובה אקסותרמית עבור כלור ואנדותרמית עבור ברום, מה שמסביר את ההבדל בריאקטיביות.
יישומים סינתטיים
הכנת אלקיל הלידים
ההלוגנציה הרדיקלית היא שיטה חשובה להכנת אלקיל הלידים, במיוחד כאשר הדרישה היא לקבל אלקיל הליד שלישוני או שניוני ברגיוסלקטיביות גבוהה. השיטה מועדפת כאשר:
- המולקולה סימטרית (למניעת תערובת איזומרים)
- רוצים אלקיל הליד שלישוני (באמצעות ברומינציה)
- אין דרכים אחרות זמינות (למשל, אין קבוצה עוזבת מתאימה)
סינתזה מדורגת - שילוב עם תגובות אלימינציה
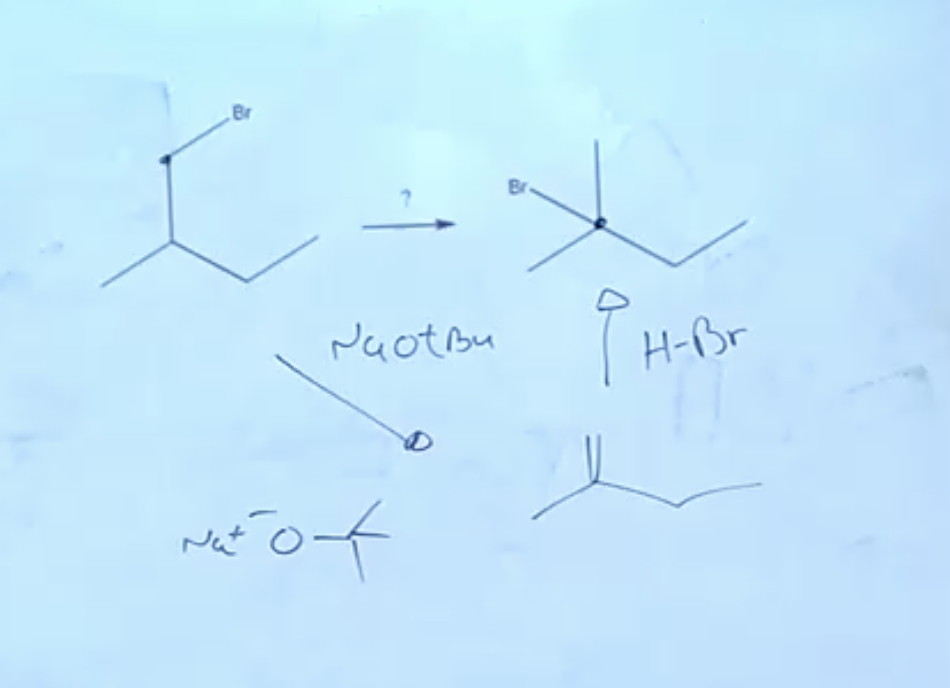
דוגמה קלאסית לשימוש בהלוגנציה רדיקלית כחלק מרצף סינתטי:
מטרה: הכנת 1-ברומו-1-מתילציקלוהקסן מציקלוהקסן
שלב א׳: הלוגנציה רדיקלית
\[\ce{C_6H_{12} + Br_2 \xrightarrow{h\nu} C_6H_{11}Br + HBr}\]הברום נכנס באופן סלקטיבי לעמדה שתיתן את הרדיקל השניוני היציב ביותר.
שלב ב׳: אלימינציה בתנאי $\ce{E_2}$
\[\ce{C_6H_{11}Br + NaO^tBu \xrightarrow{\Delta} C_6H_{10} + NaBr + ^tBuOH}\]שלב ג׳: הלוגנציה רדיקלית נוספת
\[\ce{C_6H_{10} + Br_2 \xrightarrow{h\nu} C_6H_9Br}\]הברום נכנס לעמדה האלילית (ליד הקשר הכפול) בשל הייצוב הרזוננטי.
בעיות ואתגרים בהלוגנציה רדיקלית
רגיוסלקטיביות מוגבלת עם כלור
בשל הריאקטיביות הגבוהה של רדיקל הכלור, קשה לשלוט במיקום ההלוגן במולקולות אסימטריות. זה מוביל לתערובות מורכבות הדורשות הפרדה יקרה.
תגובות מתחרות
נוכחות קבוצות פונקציונליות אחרות במולקולה עלולה להוביל לתגובות לוואי לא רצויות. למשל, קשרים כפולים עלולים לעבור תגובות סיפוח רדיקליות במקום הלוגנציה באלפא לקשר.
שליטה סטריאוכימית
רדיקלים הם מינים שטוחים (היברידיזציית $sp^2$) ולכן אינם שומרים על המידע הסטריאוכימי. זה מגביל את השימוש בתגובה כאשר נדרשת שליטה סטריאוכימית מדויקת.
מסקנות ומגמות עכשוויות
ההלוגנציה הרדיקלית של אלקאנים מהווה כלי חשוב בארסנל הסינתטי, במיוחד להכנת חומרי מוצא לסינתזות מורכבות יותר. הבנת העקרונות הקינטיים והתרמודינמיים העומדים בבסיס הסלקטיביות מאפשרת חיזוי ושליטה בתוצאות התגובה.
בכימיה עכשווית, חוקרים מפתחים שיטות מתקדמות יותר לפונקציונליזציה סלקטיבית של קשרי $\ce{C-H}$, כולל שימוש בקטליזטורים מתכתיים ובתנאי פוטוכימיה מבוקרים. עם זאת, ההלוגנציה הרדיקלית הקלאסית ממשיכה להיות רלוונטית כשיטה פשוטה ויעילה, במיוחד בתעשייה הכימית לייצור בקנה מידה גדול.
מעבר מכימיה רדיקלית לכימיה יונית קלאסית
לאחר השלמת הלימוד של תגובות רדיקליות, אנחנו חוזרים למסגרת הכימיה האורגנית הקונבנציונלית. בניגוד לתגובות רדיקליות המתאפיינות בשבירה הומוליטית וחצי-חצים, תגובות האלקנים עוברות במנגנונים יוניים הכוללים נוקלאופילים, אלקטרופילים וקבוצות עוזבות. המעבר הזה מסמל חזרה לעולם של חצים שלמים המייצגים תנועה של זוגות אלקטרונים.
אלקנים מהווים קבוצה פונקציונלית בעלת ריאקטיביות עשירה ומגוונת. הקשר הכפול ($\ce{C=C}$) משמש כנוקלאופיל בזכות הצפיפות האלקטרונית הגבוהה שלו, במיוחד באלקטרוני ה-π הזמינים להתקפה. יכולת זו הופכת את האלקנים למטרה אטרקטיבית עבור מגוון רחב של אלקטרופילים, ומאפשרת ביצוע תגובות סיפוח מגוונות.
סיפוחים לקשר כפול
סיווג מנגנוני סיפוח לאלקנים
תגובות הסיפוח לאלקנים מתחלקות לשלוש קבוצות מרכזיות לפי המנגנון שלהן:
-
קבוצה א׳: סיפוחים שעוברים דרך קרבוקטיון
- תגובות שעוברות דרך קרבוקטיון כוללות את המנגנונים של סיפוח חומצות הלוגניות ($\ce{H-Br}$, $\ce{H-Cl}$), הידרציה בקטליזה חומצית, וסיפוח כוהלים בקטליזה חומצית.
- כל התגובות שעוברות דרך קרבוקטיון מקיימות את כלל מרקובניקוב ועלולים להתרחש בהן שחלופי קרבוקטיון.
-
קבוצה ב׳: סיפוחים שעוברים דרך יון מגשר
- קבוצה זו כוללת הלוגנציה ($\ce{Br_2}$, $\ce{Cl_2}$) ויצירת הלוהידרינים. המנגנון מתאפיין ביצירת יון מגשר ציקלי המוביל לסיפוח אנטי.
-
קבוצה ג׳: מנגנונים מיוחדים או לא ידועים
- תגובות כגון הידרוגנציה קטליטית (עם מתכות) ואוקסימרקורציה-דמרקורציה, שבהן המנגנון מורכב מדי או לא מובן במלואו.
קבוצה א׳: סיפוחים שעוברים דרך קרבוקטיון
אם הפחמן כיראלי ייתכנו תוצרים שונים (כתלות בכיוון התקפת הנוקלאופיל):
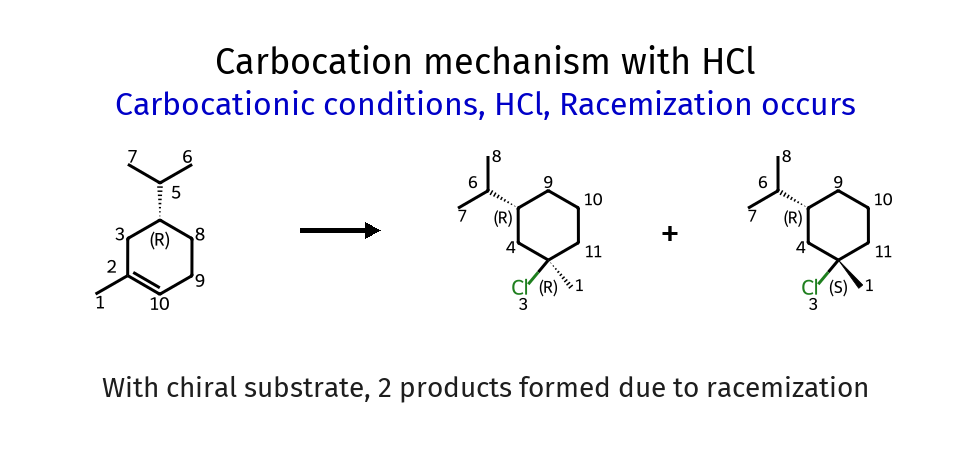
דוגמה לשחלוף קרבוקטיון:
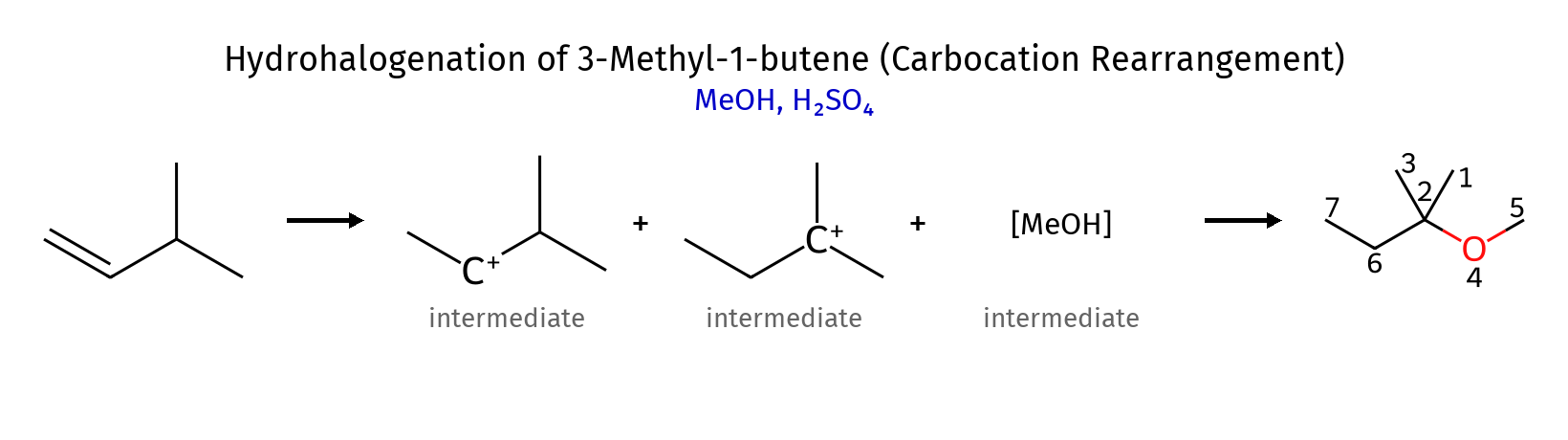
דוגמה לשאלה עם מנגנון דו שלבי:
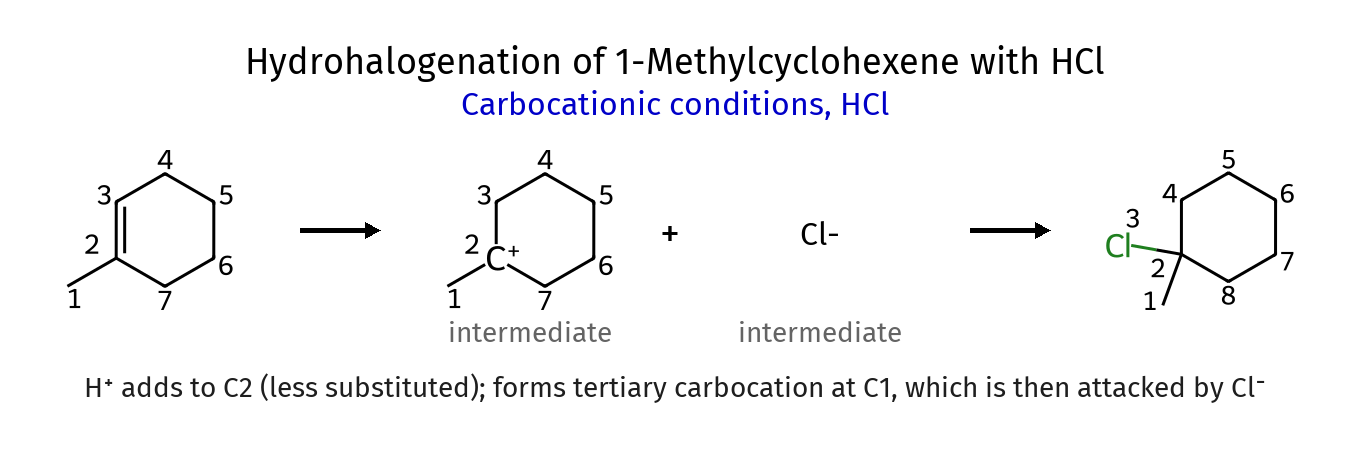
סיפוח חומצות הלוגניות: יסודות כלל מרקובניקוב
המנגנון הבסיסי
סיפוח חומצה הלוגנית ($\ce{HBr}$, $\ce{HCl}$ למשל) לאַלקֵן מתבצע במנגנון דו-שלבי העובר דרך קרבוקטיון:
שלב א׳: התקפה אלקטרופילית של הפרוטון
\[\ce{C=C + H-X -> C-C^+ + X^-}\]הקשר הכפול, הפועל כנוקלאופיל, תוקף את הפרוטון החומצי של חומצת ההלוגן. הפולאריות של הקשר $\ce{H-X}$ ($\delta^+\ce{H}-\delta^-\ce{X}$) הופכת את המימן לאלקטרופיל מתאים. התקפה זו מובילה לפרוטונציה של אחד הפחמנים ויצירת קרבוקטיון על הפחמן השני.
המימן מצטרף לפחמן שיש עליו יותר מימנים (פחמן פחות מוצמד), מה שמוביל ליצירת קרבוקטיון על הפחמן המוצמד יותר (פחמן עם מטען חיובי).
שלב ב׳: התקפה נוקלאופילית של האניון
\[\ce{C-C^+ + X^- -> C-C-X}\]יון ההליד ($\ce{X^-}$), שנוצר בשלב הראשון, פועל כנוקלאופיל ותוקף את הקרבוקטיון החיובי. התקפה זו משלימה את תגובת הסיפוח.
כלל מרקובניקוב: היגיון תרמודינמי
כלל מרקובניקוב קובע כי “המימן מצטרף לפחמן הפחות מוצמד, והנוקלאופיל מצטרף לפחמן המוצמד יותר”. העיקרון העומד מאחורי כלל זה הוא השאיפה ליצור את הקרבוקטיון היציב ביותר.
הסבר מבני: יציבות קרבוקטיונים נקבעת על ידי מספר קבוצות האלקיל המחוברות אליהם. סדר היציבות הוא:
\[\text{Tertiary} > \text{Secondary} > \text{Primary} > \text{Methyl}\]יציבות זו נובעת מהיפר-קונג׳וגציה - תרומת אלקטרונים מקשרי $\ce{C-H}$ ו-$\ce{C-C}$ הסמוכים אל האורביטל הריק של הקרבוקטיון. כאשר הפרוטון מצטרף לפחמן הפחות מוצמד, נוצר הקרבוקטיון המוצמד והיציב ביותר.
דוגמה מחשבית: בתגובה של 2-מתילפרופן עם $\ce{HBr}$:
\[\ce{(CH_3)_2C=CH_2 + HBr -> (CH_3)_2CHCHBr}\]אם הפרוטון היה מצטרף לפחמן המוצמד, היינו מקבלים קרבוקטיון ראשוני לא יציב. במקום זאת, הפרוטון מצטרף לפחמן הטרמינלי, יוצר קרבוקטיון שלישוני יציב.
שחלופי קרבוקטיון ומשמעותם
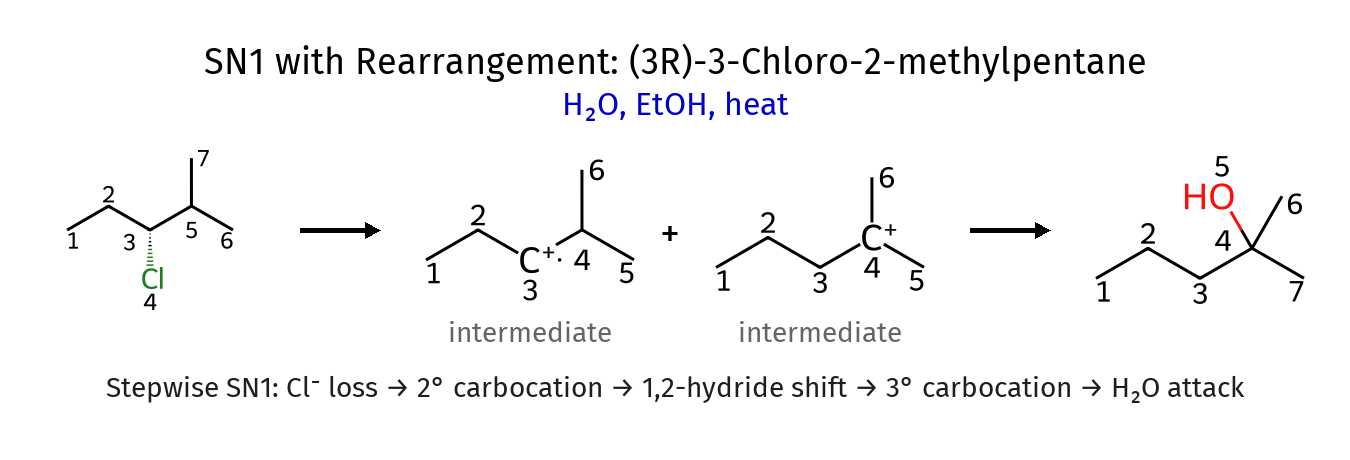
מנגנון השחלוף
כאשר נוצר קרבוקטיון בעל יציבות נמוכה סמוך למיקום שבו יכול להיווצר קרבוקטיון יציב יותר, עלול להתרחש שחלוף. השחלופים הנפוצים ביותר הם:
שחלוף מימן (1,2-היסט מימן):
\[\ce{R_2CH-\stackrel{+}{C}H_2 -> R_2\stackrel{+}{C}-CH_3}\]שחלוף אלקיל (1,2-היסט אלקיל):
\[\ce{R_3C-CH_2-\stackrel{+}{C}H_2 -> R_3\stackrel{+}{C}-CH_2-CH_3}\]השלכות סינתטיות של שחלופים
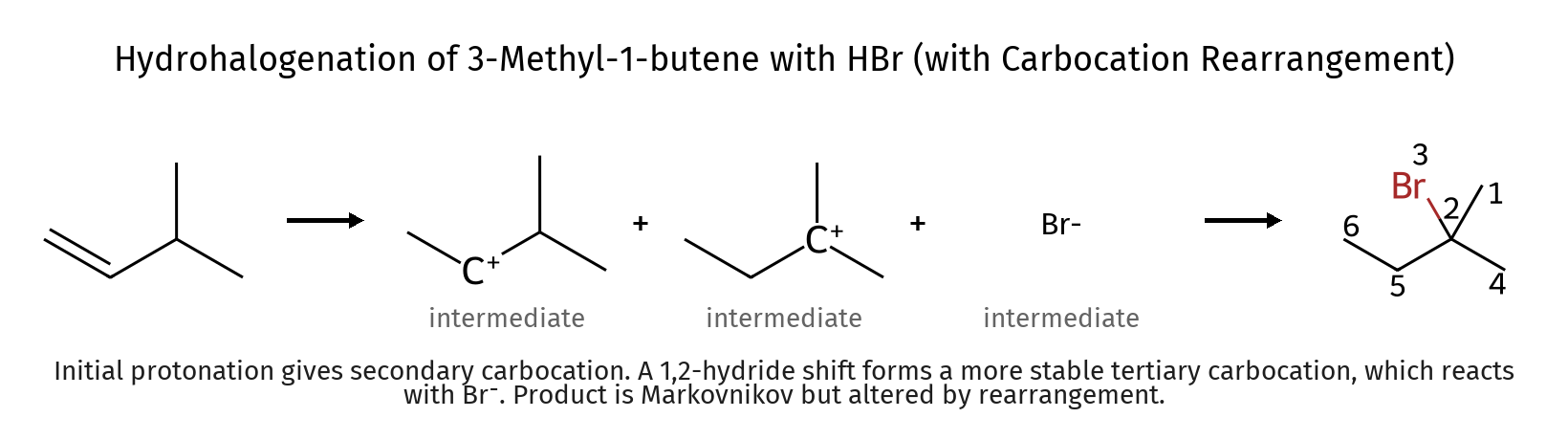
שחלופי קרבוקטיון יכולים לשנות באופן מהותי את התוצר הסופי של התגובה. לדוגמה, בסיפוח $\ce{HBr}$ ל-3-מתיל-1-בוטן:
\[\ce{(CH_3)_2CHCH=CH_2 ->[HBr] (CH_3)_2CHCHBrCH_3}\]על פי מרקובניקוב, הפרוטון אמור להצטרף לפחמן הטרמינלי, ליצור קרבוקטיון שניוני. אולם, קרבוקטיון זה יכול לעבור שחלוף מימן ליצור קרבוקטיון שלישוני יציב יותר, מה שמוביל לתוצר שונה מהצפוי.
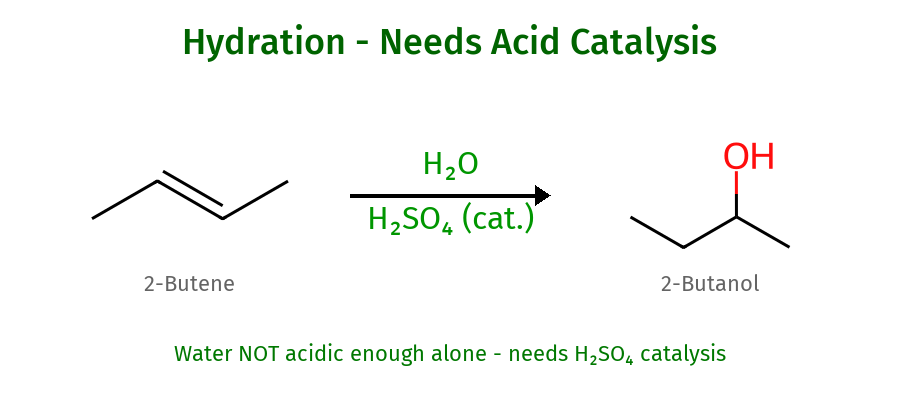
הידרציה ואלכוהוליזה בקטליזה חומצית
הבעיה הבסיסית והפתרון
מים לבדם אינם מסוגלים לבצע סיפוח לקשר כפול בתנאים רגילים, מכיוון שהפרוטונים במים אינם חומציים מספיק כדי לאפשר להם לשמש כאלקטרופילים יעילים. הפתרון הוא שימוש בקטליזה חומצית, בדרך כלל $\ce{H_2SO_4}$ או $\ce{H_3O^+}$.
מנגנון ההידרציה
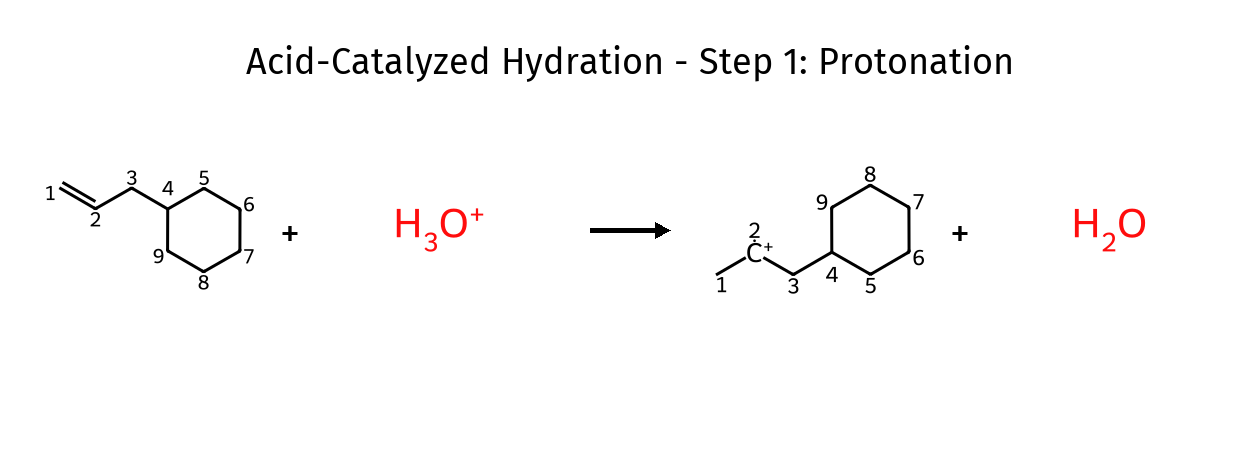
שלב א׳: פרוטונציה של הקשר הכפול
\[\ce{C=C + H_3O^+ -> C-C^+ + H_2O}\]הקטליזטור החומצי מספק פרוטונים חומציים מספיק כדי שהקשר הכפול יוכל לתקוף אותם.
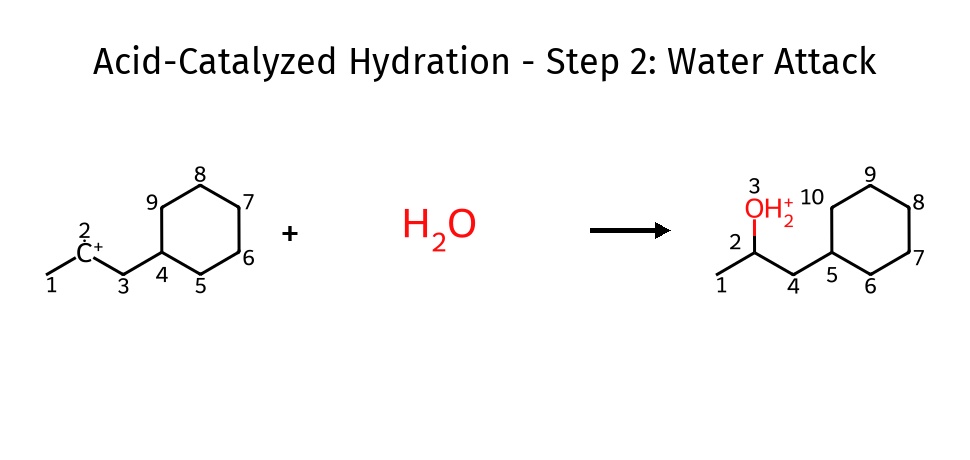
שלב ב׳: התקפת המים
\[\ce{C-C^+ + H_2O -> C-C-OH_2^+}\]מולקולת מים תוקפת את הקרבוקטיון, יוצרת יון אוקסוניום.
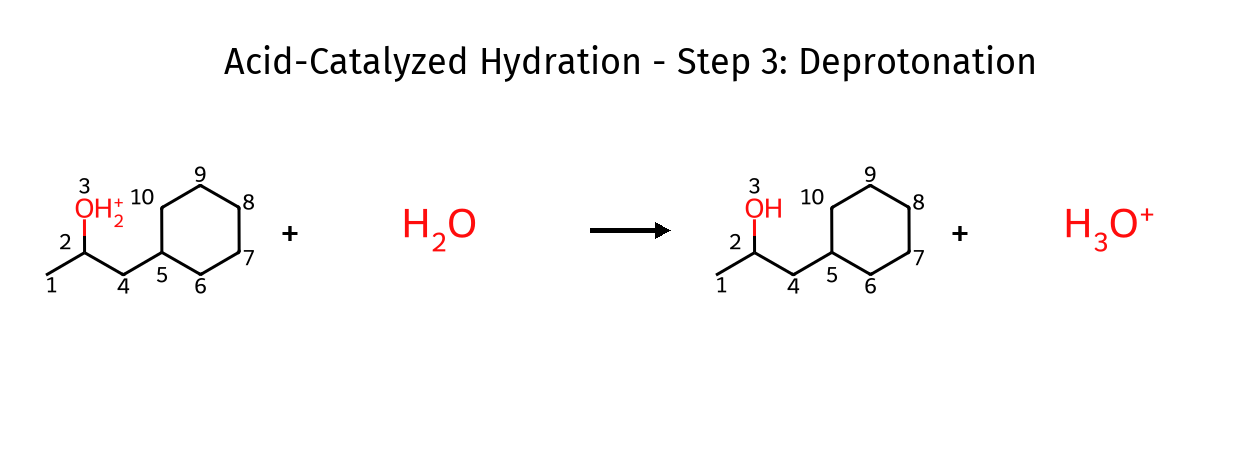
שלב ג׳: דהפרוטונציה
\[\ce{C-C-OH_2^+ + H_2O -> C-C-OH + H_3O^+}\]מולקולת מים נוספת פועלת כבסיס, מסירה פרוטון ומשחררת את הקטליזטור.
מאפיינים קטליטיים
הקטליזטור החומצי מתחדש בשלב האחרון, מה שמאפשר שימוש בכמות קטליטית בלבד. מחזור זה מסביר מדוע די בכמות קטנה של חומצה כדי לקדם את התגובה בצורה יעילה.
התגובה עוקבת אחר כלל מרקובניקוב ועלולה להציג שחלופי קרבוקטיון, בדיוק כמו בסיפוח חומצות הלוגניות.
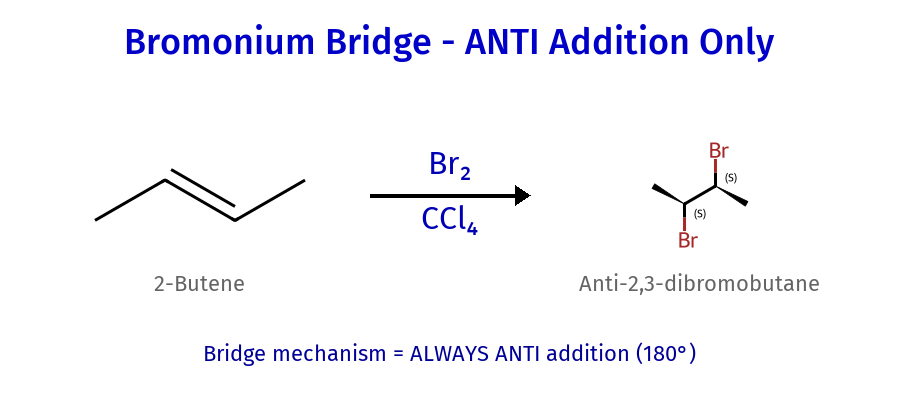
קבוצה ב’: הלוגנציה דרך יון מגשר
המנגנון הייחודי
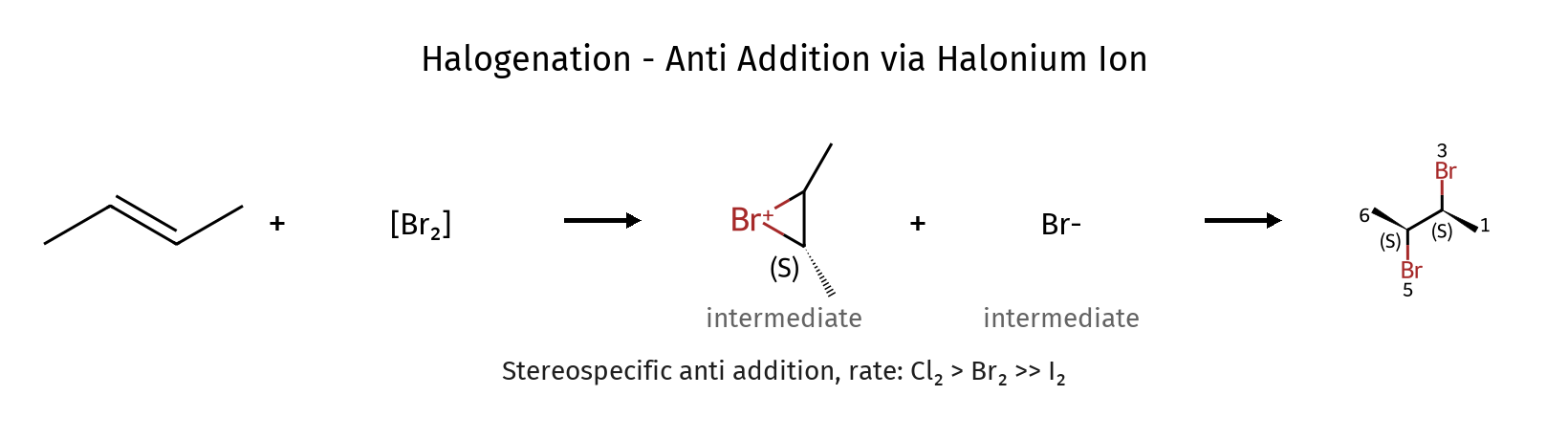
הלוגנציה של אלקנים עם $\ce{Br_2}$ או $\ce{Cl_2}$ מתבצעת במנגנון שונה מהותית מזה של סיפוח חומצות הלוגניות (כגון $\ce{HBr}$). במקום יצירת קרבוקטיון ביניים קלאסי, נוצר יון הלוגוניום מגשר (ברומוניום או כלורוניום), שהוא טבעת תלת-חברית חיובית.
שלב א׳ – יצירת יון מגשר:
\[\ce{R_2C=CR_2 + Br2 ->[\text{electrophilic addition}][R_2C(-)–CR_2(+)-Br] + Br^-}\]אחד מאטומי הברום מתקרב לקשר הכפול, והאלקטרונים של הקשר $\pi$ נעים לעברו ויוצרים קשר חדש. בו־זמנית, הקשר $\ce{Br–Br}$ נחתך, ואטום הברום השני משתחרר כ-$\ce{Br^-}$. נוצר יון ברומוניום מגשר – טבעת תלת-חברית חיובית הכוללת את שני אטומי הפחמן ואת הברום.
שלב ב׳ – התקפה נוקלאופילית:
\[\ce{[R_2C(-)–CR_2(+)-Br] + Br^- -> R_2CBr–CR_2Br}\]הברומיד ($\ce{Br^-}$) תוקף נוקלאופילית את אחד מאטומי הפחמן בטבעת המגשרת (לרוב את הפחמן הפחות מותמר), פותח את הטבעת ומוביל ליצירת דיברומיד ויצינאלי – שני אטומי ברום קשורים לשני פחמנים סמוכים.
מאפיינים מבניים ואנרגטיים
היון המגשר הוא מבנה ציקלי תלת-חברי עם מטען חיובי על הברום. מבנה זה יוצר מתח זוויתי משמעותי ומרכז אלקטרופילי חזק מאוד. הברום החיובי מושך אלקטרונים מהפחמנים, יוצר עליהם מטען חלקי חיובי ($\delta^+$).
רגיוסלקטיביות בהתקפה הנוקלאופילית
כאשר שני הפחמנים במגשר אינם זהים מבחינת הצמדה, הנוקלאופיל יעדיף לתקוף את הפחמן המוצמד יותר. העיקרון דומה לכלל מרקובניקוב: הפחמן המוצמד יותר נושא מטען חלקי חיובי גדול יותר בגלל יכולתו הטובה יותר לייצב מטען חיובי.
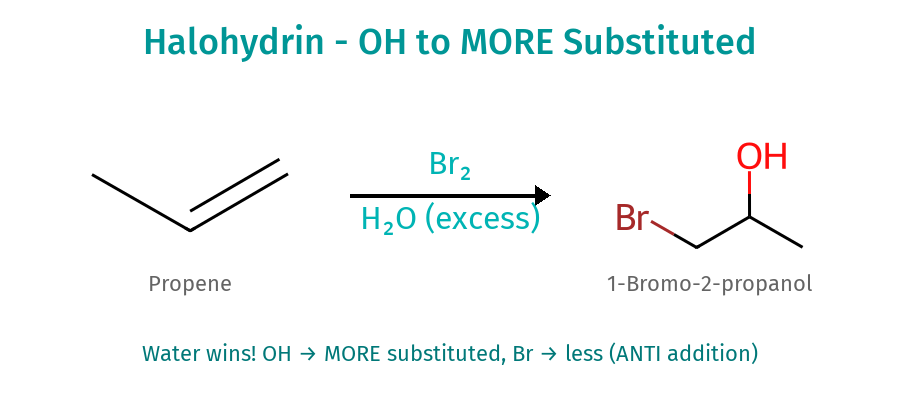
יצירת הלוהידרינים: תחרות נוקלאופילית
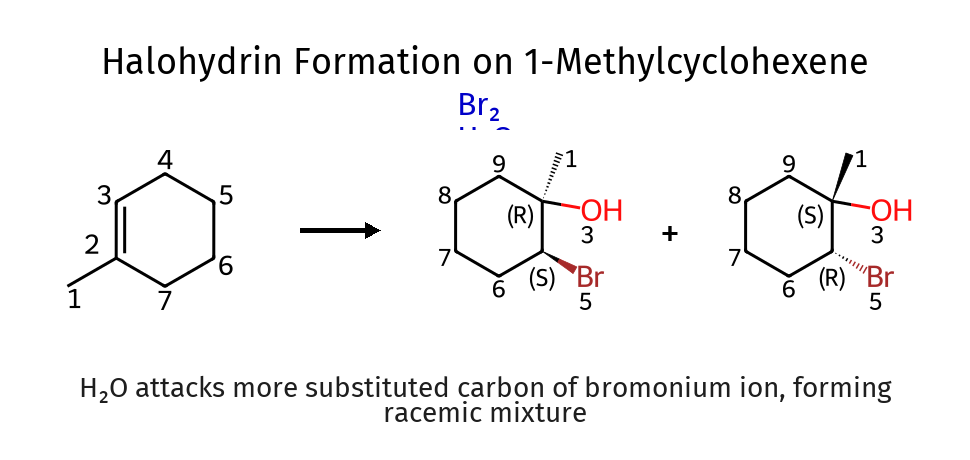
התגובה ותנאיה
כאשר מבצעים הלוגנציה במים כממס, נוצרת תחרות בין יון ההליד למים על התקפת היון המגשר:
\[\ce{C=C + Br_2 ->[H_2O] Br-C-C-OH}\]התוצר הוא הלוהידרין - מולקולה המכילה הן הלוגן והן קבוצת הידרוקסיל.
גורמים הקובעים סלקטיביות
גורם כמותי: במים כממס, יחס המולקולות מים:ברום הוא כ-55:1, מה שנותן יתרון סטטיסטי עצום למים.
גורם תרמודינמי: במים (ממס פולארי פרוטי), יון הברומיד עובר סולבציה משמעותית. המעטפת ההידרציה מקטינה את הנוקלאופיליות האפקטיבית של הברומיד ומונעת ממנו להתחרות ביעילות עם המים.
סטריאוכימיה: סיפוח אנטי
הלוגנציה והלוהידרין מתאפיינים בסיפוח אנטי-סטריאוספציפי. הנוקלאופיל תמיד תוקף מהצד הנגדי למגשר, במרחק של 180° מהברום. התופעה הזו נובעת מהמבנה הגיאומטרי של היון המגשר, המונע גישה מאותו צד.
במולקולות ציקליות, הסטריאוספציפיות האנטי מובילה לתוצרים טראנס בלבד. למשל, בהלוגנציה של ציקלוהקסן, שני הברומים יתמקמו תמיד במיקומים אקסיאלי-אקוויטוריאלי, ולעולם לא באותו צד של הטבעת.
השוואה בין מנגנוני הסיפוח
מאפיינים מבחינים
| מאפיין | מנגנון קרבוקטיון | מנגנון יון מגשר |
|---|---|---|
| שחלופים | אפשריים | לא מתרחשים |
| סטריאוכימיה | לא מוגדרת | אנטי-סטריאוספציפי |
| רגיוסלקטיביות | לפי מרקובניקוב | לפי יציבות מטען |
| יציב ביניים | קרבוקטיון מישורי | יון מגשר ציקלי |
קריטריונים לחיזוי מנגנון
המנגנון נקבע לפי טבע האלקטרופיל:
- פרוטונים וקטיונים קטנים: מנגנון קרבוקטיון
- הלוגנים מולקולריים: מנגנון יון מגשר
- אלקטרופילים מתכתיים או מורכבים: מנגנונים מיוחדים
יישומים סינתטיים ושיקולים מעשיים
בחירת תנאי תגובה
סלקטיביות התגובה תלויה בתנאים:
- לדיהלוגנציה: השתמש בממס לא פולארי ללא נוקלאופילים מתחרים
- להלוהידרין: השתמש במים או תערובת מים-ממס אורגני
- לשליטה רגיוסלקטיבית: בחר בין חומצות הלוגניות (מרקובניקוב) להלוגנציה במים (אנטי-מרקובניקוב ביעילות)
אסטרטגיות סינתטיות
תגובות הסיפוח מהוות כלי חיוני בסינתזה אורגנית:
- יצירת קבוצות פונקציונליות: הפיכת אלקנים לאלקיל הלידים, כוהלים או הלוהידרינים
- בניית מורכבות סטריאוכימית: ניצול הסטריאוספציפיות של ההלוגנציה
- הכנת חומרי מוצא: הלוהידרינים יכולים לשמש לסינתזת אפוקסידים ודיאולים