שאלה קלינית - פתיחה
תרחיש
מטופל מגיע לבדיקה שגרתית. בדיקות מעבדה מראות ריכוזים גבוהים של ציטראט בדם.
משמעות
- ציטראט הוא תוצר ביניים של מעגל קרבס
- ריכוז גבוה מעיד על פעילות טובה של מעגל קרבס
- מעידה על מאגרי אנרגיה מלאים
השפעה על גליקוליזה
ציטראט מעכב את הגליקוליזה (נראה בהמשך כיצד).
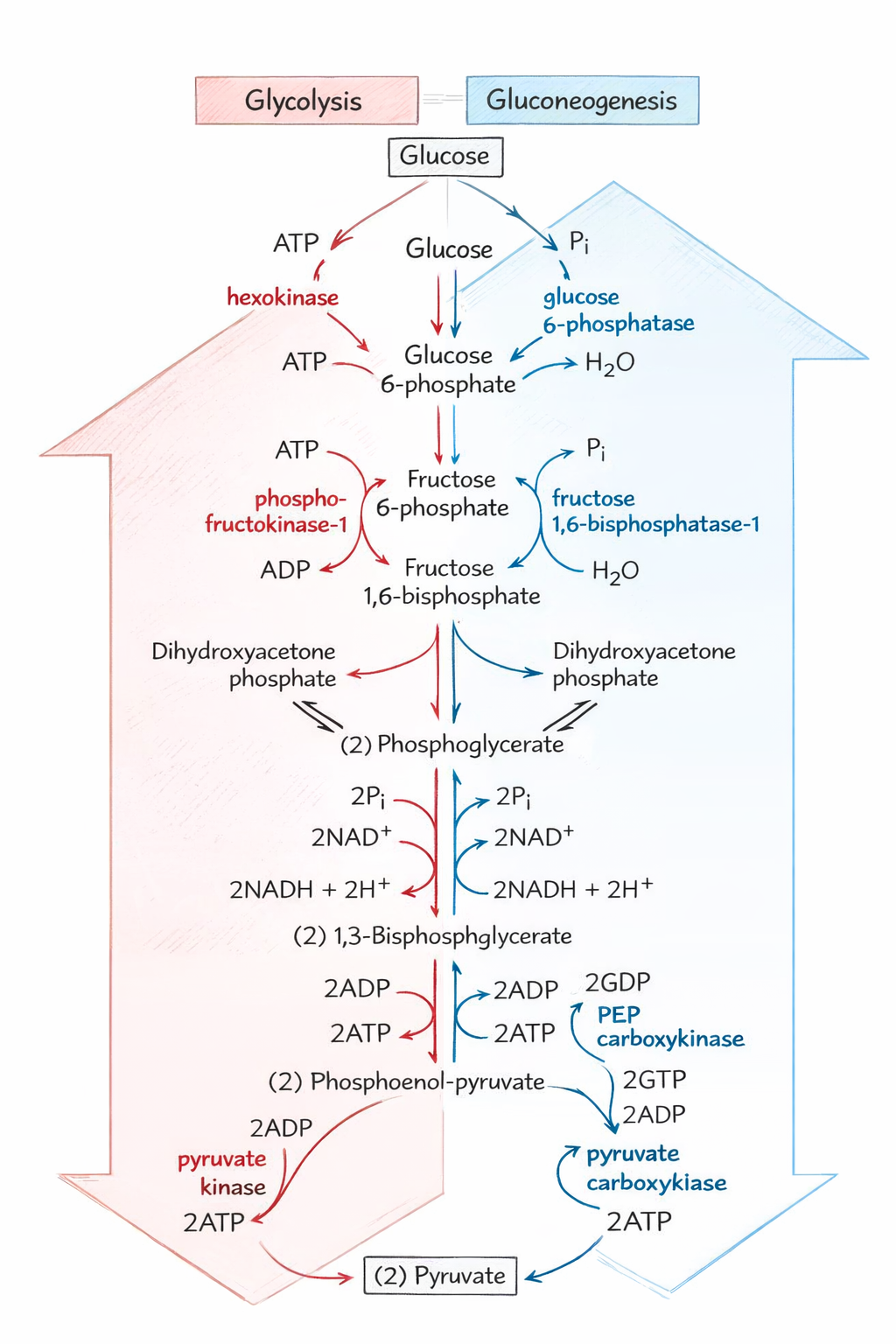
גלוקונאוגנזה - יצירת גלוקוז
הגדרה
גלוקונאוגנזה = יצירת גלוקוז ממקורות שאינם פחמימות.
מתי צריך?
- במצבי רעב/צום
- המוח דורש גלוקוז באופן קבוע
- שמירה על רמות גלוקוז בדם
היחס לגליקוליזה
בגליקוליזה יש שלושה שלבים חד-כיווניים שדורשים מעקפים:
| שלב בגליקוליזה | אנזים | מעקף בגלוקונאוגנזה |
|---|---|---|
| 10 | Pyruvate Kinase | Pyruvate Carboxylase + PEPCK |
| 3 | PFK-1 | FBPase-1 |
| 1 | Hexokinase | Glucose-6-phosphatase |
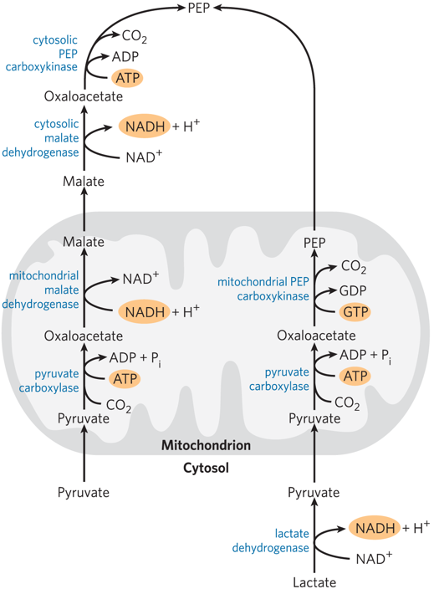
מעקף 1: מפירובט ל-PEP
שלב א’: פירובט לאוקסלואצטט
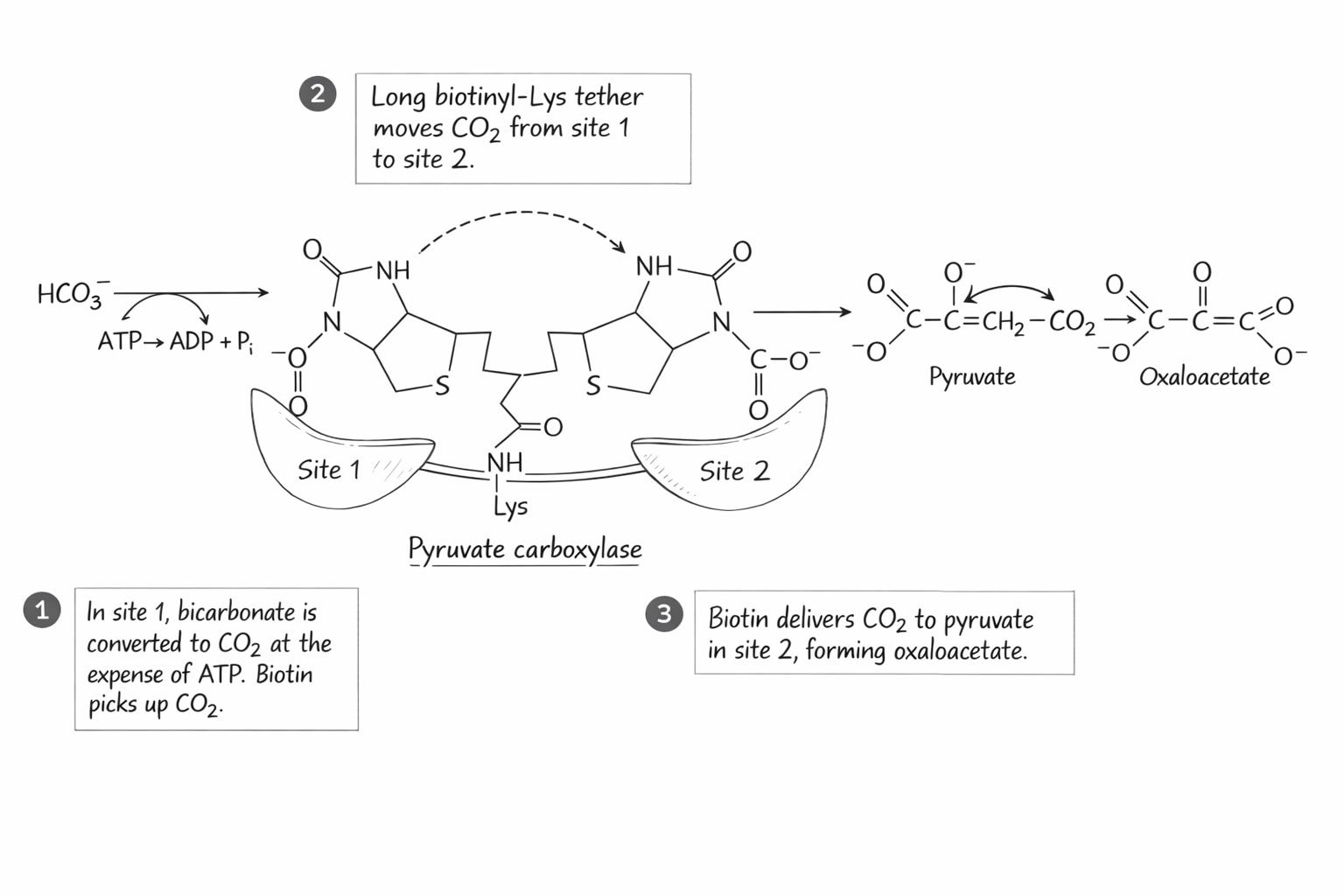
אנזים: Pyruvate Carboxylase (פירובט קרבוקסילאז)
מאפיינים:
- דורש ביוטין (קו-פקטור)
- מתרחש במיטוכונדריה
- הביוטין קושר $\ce{CO2}$ ומעביר אותו פיזית לפירובט
בעיה: אוקסלואצטט לא יכול לצאת מהמיטוכונדריה
פתרון - מעבר דרך מלאט:
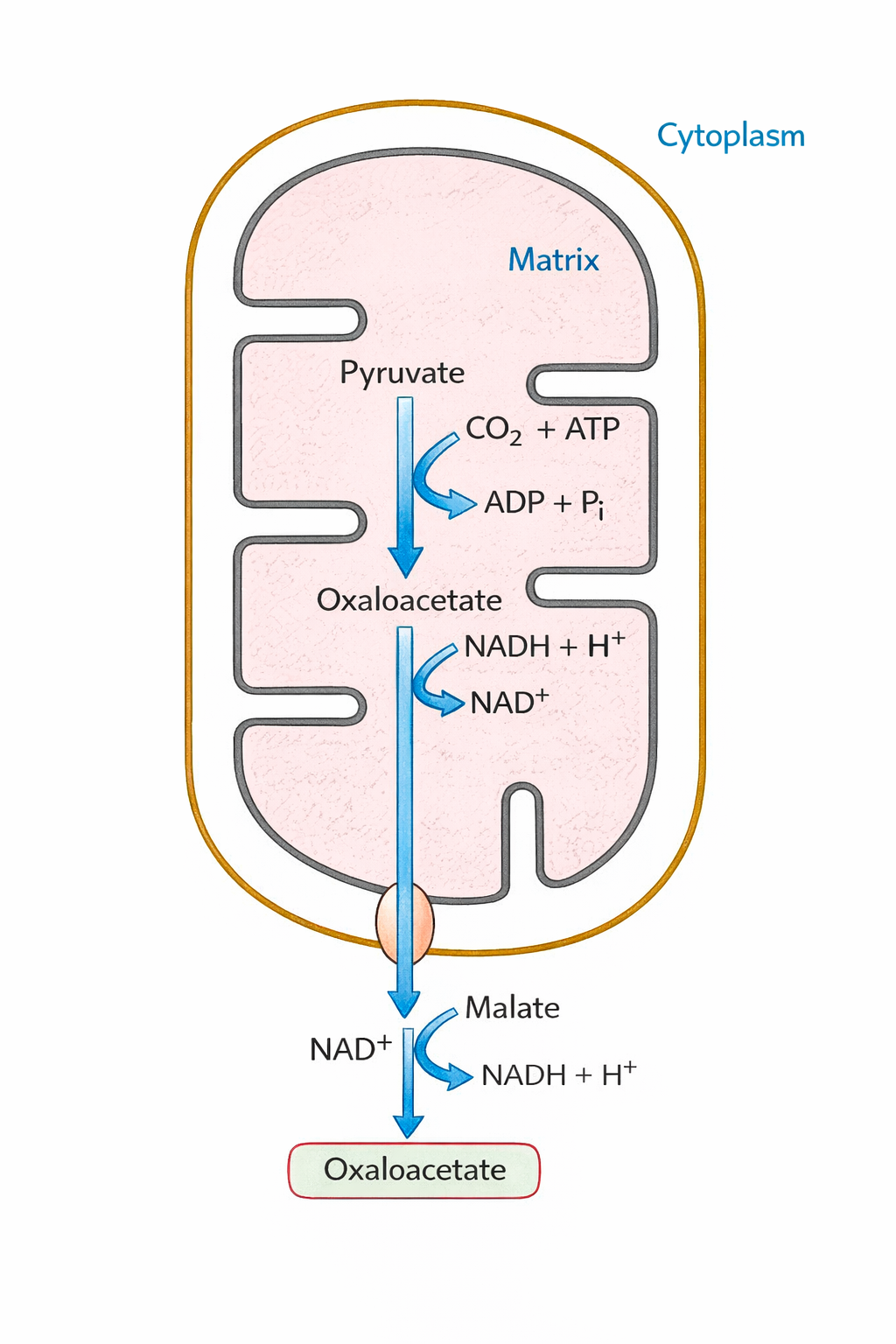
במיטוכונדריה:
\[\ce{Oxaloacetate + NADH -> Malate + NAD+}\]למלאט יש טרנספורטר (Malate-Aspartate Shuttle) ← יוצא לציטוזול
בציטוזול:
\[\ce{Malate + NAD+ -> Oxaloacetate + NADH}\]חשוב: התהליך הזה מעביר כוח מחזר (
NADH) מהמיטוכונדריה לציטוזול - נדרש לגלוקונאוגנזה!
שלב ב’: אוקסלואצטט ל-PEP
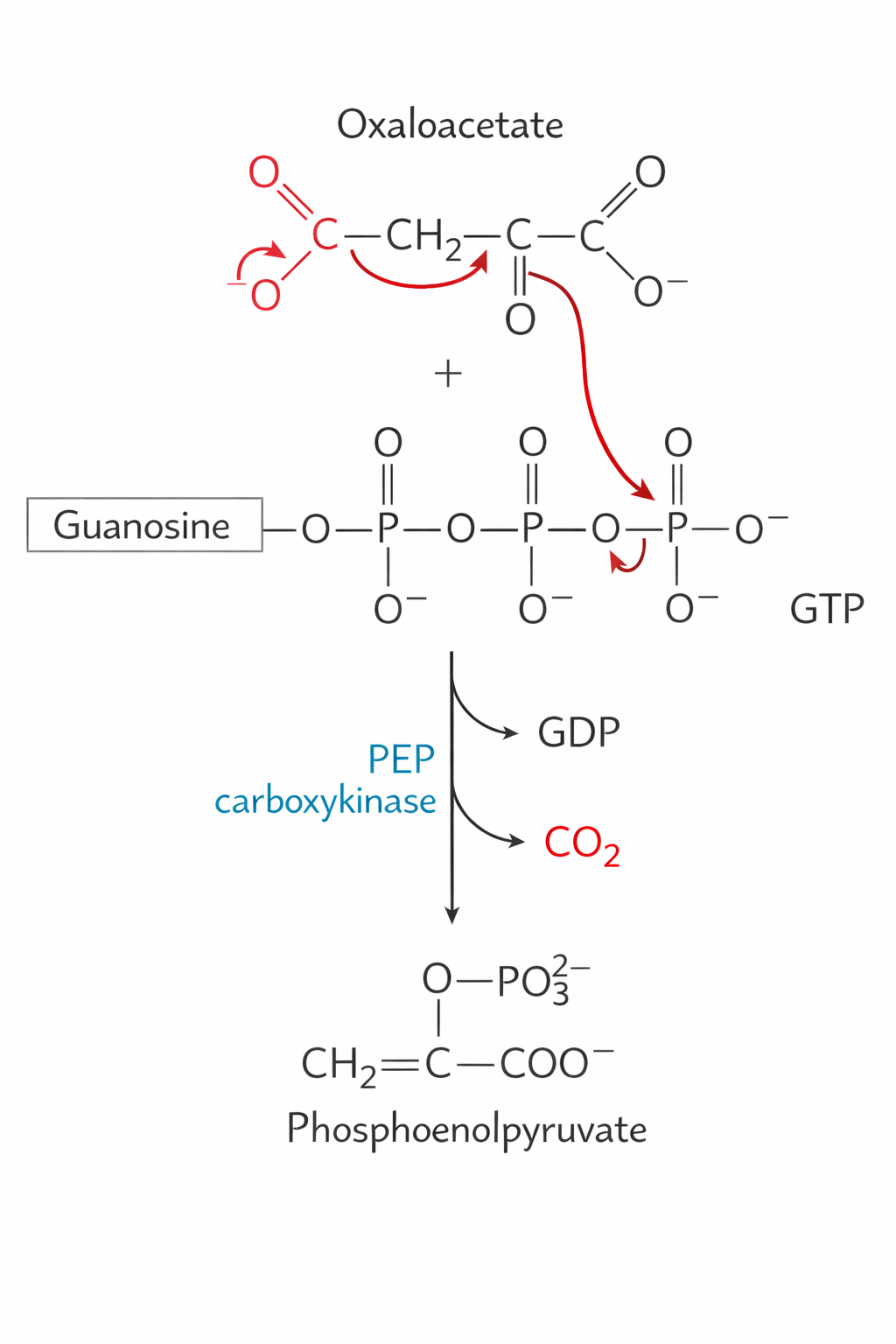
אנזים: PEP Carboxykinase (PEPCK)
מאפיינים:
- משתמש ב-GTP (לא ATP!)
- פוספורילציה + דקרבוקסילציה
- מתרחש בציטוזול
מצב מיוחד: כשיש לקטט
כאשר יש חוסר בחמצן ונוצר לקטט:
\[\ce{Lactate + NAD+ ->[LDH] Pyruvate + NADH}\]במקרה הזה, PEPCK פועל בתוך המיטוכונדריה (לא בציטוזול).
מעקף 2: F-1,6-BP ל-F-6-P
אנזים: Fructose-1,6-bisphosphatase-1 (FBPase-1)
הסרת פוספט (הידרוליזה).
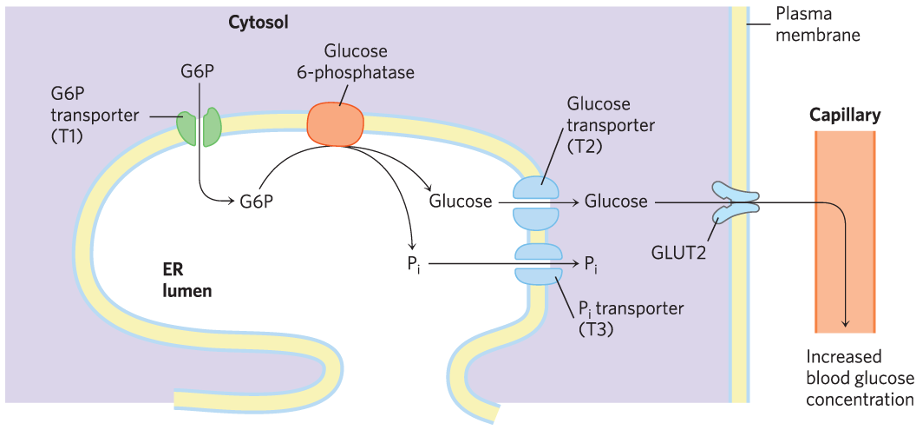
מעקף 3: G-6-P לגלוקוז
אנזים: Glucose-6-phosphatase
מיקום: ב-ER של תאי כבד, כליות ומעי בלבד!
חשוב: האנזים הזה קיים רק בכבד, כליות ומעי. לכן גלוקונאוגנזה מתרחשת רק שם!
הגלוקוז שנוצר יוצא לדם ומגיע לאיברים אחרים (כמו המוח).
עלות אנרגטית של גלוקונאוגנזה
ליצירת מולקולת גלוקוז אחת נדרשים:
- 2 מולקולות פירובט
- $\ce{4 ATP}$
- $\ce{2 GTP}$
- $\ce{2 NADH}$
תהליך יקר מאוד! אבל הכרחי - “מוח ללא סוכר = מוח לא פעיל”
רגולציה של גליקוליזה
עקרון מנחה
שלושת השלבים החד-כיווניים הם נקודות הרגולציה העיקריות:
- Hexokinase (שלב 1)
- PFK-1 (שלב 3)
- Pyruvate Kinase (שלב 10)
רגולציה של Hexokinase
איזואנזימים
יש בגוף ארבעה איזואנזימים של Hexokinase:
| איזואנזים | מיקום | $K_M$ | מאפיינים |
|---|---|---|---|
Hexokinase 1-2 | שריר | נמוך $(\sim 0.1 \, \mathrm{mM})$ | אפיניות גבוהה לגלוקוז |
Hexokinase 4 (Glucokinase) | כבד | גבוה $(\sim 10 \, \mathrm{mM})$ | אפיניות נמוכה לגלוקוז |
Hexokinase 2 (בשריר)
- $K_M$ נמוך ← מגיע ל-$V_{max}$ בריכוזי גלוקוז נמוכים
- מעוכב על ידי התוצר: $\ce{Glucose-6-phosphate}$
- כשיש הרבה G-6-P ← האנזים מעוכב ← מאט את הקצב
Hexokinase 4 (Glucokinase) (בכבד)
- $K_M$ גבוה $(\sim 10 \, \mathrm{mM})$ ← פעיל רק בריכוזי גלוקוז גבוהים
- מווסת על ידי ריכוז הגלוקוז בדם (לא על ידי
G-6-P)
מנגנון רגולציה מיוחד:
בנוכחות Fructose-6-phosphate (תוצר גליקוליזה):
- חלבון רגולטורי (GKRP) קושר את
Hexokinase 4 - מושך אותו לתוך גרעין התא
- הפרדה פיזית מהמסלול ← עיכוב הגליקוליזה
בנוכחות גלוקוז גבוה:
- האפיניות בין GKRP ל-
Hexokinase 4יורדת - האנזים חוזר לציטוזול ← גליקוליזה פעילה
רגולציה של PFK-1
מעכבים (תוצרים = “יש מספיק אנרגיה”)
| מעכב | משמעות |
|---|---|
| ATP (ריכוז גבוה) | יש מספיק אנרגיה |
| ציטראט | מעגל קרבס פעיל, מאגרי אנרגיה מלאים |
מעודדים (מגיבים = “צריך אנרגיה”)
| מעודד | משמעות |
|---|---|
| AMP | מחסור ב-ATP |
| ADP | מחסור ב-ATP |
| Fructose-2,6-bisphosphate | רגולטור מפתח! |
ATP - תפקיד כפול
ATPהוא מצע שלPFK-1(נדרש לריאקציה)ATPהוא גם מעכב אלוסטרי (בריכוז גבוה)
יש שני אתרי קישור ל-ATP על האנזים!
Fructose-2,6-bisphosphate - רגולטור המפתח
מה זה?
- לא חלק ממסלול הגליקוליזה!
- מולקולה רגולטורית בלבד
- נוצרת מ-
Fructose-6-phosphate
הבדל מ-F-1,6-BP
| מולקולה | תפקיד | אנזים יוצר |
|---|---|---|
Fructose-1,6-bisphosphate | תוצר ביניים בגליקוליזה | PFK-1 |
Fructose-2,6-bisphosphate | רגולטור של PFK-1 | PFK-2 |
פעולה
- מעודד את
PFK-1(גליקוליזה) - מעכב את
FBPase-1(גלוקונאוגנזה)
← קובע את האיזון בין צריכת גלוקוז לייצורו!
יצירה ופירוק
PFK-2 (Phosphofructokinase-2):
FBPase-2 (Fructose-2,6-bisphosphatase):
שני האנזימים נמצאים על אותו חלבון! (Bifunctional enzyme)
רגולציה הורמונלית של PFK-2/FBPase-2
אינסולין (גלוקוז גבוה בדם)
- אינסולין מופרש
- מפעיל Protein Phosphatase
- מסיר פוספט מהאנזים הדו-תפקודי
PFK-2פעיל ← נוצרF-2,6-BPF-2,6-BPמעודדPFK-1← גליקוליזה פעילה
גלוקגון (גלוקוז נמוך בדם)
- גלוקגון מופרש
- מפעיל
cAMP←PKA(Protein Kinase A) PKAמוסיף פוספט לאנזים הדו-תפקודיFBPase-2פעיל ←F-2,6-BPמפורקPFK-1לא מעודד +FBPase-1פעיל ← גלוקונאוגנזה פעילה
סיכום
| הורמון | מצב גלוקוז | אנזים פעיל | תוצאה |
|---|---|---|---|
| אינסולין | גבוה | PFK-2 | גליקוליזה ↑ |
| גלוקגון | נמוך | FBPase-2 | גלוקונאוגנזה ↑ |
רגולציה של Pyruvate Kinase
בכבד - רגולציה הורמונלית
גלוקגון (מחסור בגלוקוז):
- מפעיל
PKA PKAמבצע פוספורילציה עלPyruvate Kinase L- האנזים מעוכב
- גליקוליזה מואטת ← גלוקונאוגנזה מועדפת
מצב תקין:
Protein Phosphataseמסיר את הפוספטPyruvate Kinaseפעיל
בתאים אחרים - רגולציה אלוסטרית
מעכבים:
- Acetyl-CoA - תוצר, מעיד על מאגרי אנרגיה מלאים
- חומצות שומן - מקור אנרגיה חלופי
- ATP - יש מספיק אנרגיה
- Alanine - חומצת אמינו שמעידה על זמינות חומרי גלם
מעודד:
Fructose-1,6-bisphosphate- מגיב, דוחף את התהליך קדימה
גורל הפירובט
לפירובט יש שני מסלולים אפשריים:
1. גלוקונאוגנזה
\[\ce{Pyruvate ->[Pyruvate Carboxylase] Oxaloacetate -> ... -> Glucose}\]2. מעגל קרבס
\[\ce{Pyruvate ->[PDH Complex] Acetyl-CoA -> Krebs Cycle}\]Acetyl-CoA:
- תוצר של הכניסה למעגל קרבס
- מעכב גליקוליזה (
Pyruvate Kinase) - מעודד גלוקונאוגנזה (
Pyruvate Carboxylase)
מעגל הפנטוזות
Pentose Phosphate Pathway
מטרות המסלול
- יצירת NADPH - לסביבה מחזרת ולסינתזה של חומצות שומן
- יצירת Ribose-5-phosphate - לסינתזת נוקלאוטידים (DNA, RNA)
הריאקציה הכללית
\[\ce{Glucose-6-phosphate + 2NADP+ + H2O -> Ribose-5-phosphate + 2NADPH + 2H+ + CO2}\]מבנה המסלול
שלב חמצוני (בלתי הפיך):
\[\ce{Glucose-6-phosphate ->[G6PD] 6-phosphoglucono-\delta-lactone ->[...] Ribose-5-phosphate}\]- יוצר שני NADPH לכל גלוקוז
- יוצר Ribose-5-phosphate
שלב לא-חמצוני (הפיך):
- אם אין צורך ב-Ribose ← המולקולה מוחזרת ל-Glucose-6-phosphate
- אנזימים: Transketolase, Transaldolase
רגולציה
NADPH מעכב את המסלול (עיכוב על ידי תוצר).
G6PD Deficiency - מחסור באנזים
הרקע
G6PD (Glucose-6-phosphate Dehydrogenase) - האנזים הראשון במעגל הפנטוזות.
תפקיד NADPH
NADPH נדרש לשמירה על סביבה מחזרת בתא:
\[\ce{H2O2 ->[Glutathione Peroxidase] H2O}\]הריאקציה דורשת גלוטתיון מחוזר (GSH):
\[\ce{GSSG + NADPH ->[Glutathione Reductase] 2GSH + NADP+}\]מה קורה במחסור?
- אין מספיק NADPH
- לא ניתן לחזר גלוטתיון
- הצטברות של רדיקלים חופשיים ($\ce{H2O2}$)
- נזק לתאי דם אדומים ← המוליזה (התפרקות כדוריות)
פאביזם (Favism)
- רגישות לפול (Fava beans)
- הפול מכיל Vicine - חומר שיוצר רדיקלים
- אנשים עם מחסור ב-G6PD לא יכולים לנטרל את הרדיקלים
- גורם להמוליזה חריפה
סיכום - נקודות מפתח
גלוקונאוגנזה
- שלושה מעקפים לשלבים החד-כיווניים
- מתרחשת בכבד, בכליות ובמעי בלבד
- עלות: $4 \ce{ATP} + 2 \ce{GTP} + 2 \ce{NADH}$
רגולציה - גליקוליזה
- תוצרים מעכבים (
ATP, ציטראט,Acetyl-CoA) - מגיבים מעודדים (
AMP,ADP,F-1,6-BP) F-2,6-BP- רגולטור מפתח בין גליקוליזה לגלוקונאוגנזה- רגולציה הורמונלית: אינסולין vs גלוקגון
מעגל הפנטוזות - נקודות מפתח
- מייצר
NADPHו-Ribose-5-phosphate - חיוני לסביבה מחזרת
- מחסור ב-
G6PD← המוליזה
עיקרון מנחה
איזון עדין בין מגיבים לתוצרים קובע את כיוון המטבוליזם!
הכל מבוסס על:
- רמות
ATP/AMP/ADP - זמינות גלוקוז
- הורמונים (אינסולין/גלוקגון)
- תוצרי ביניים (ציטראט,
Acetyl-CoA)
שאלות מהתרגול
שאלה 2: רגולציה של גליקוליזה
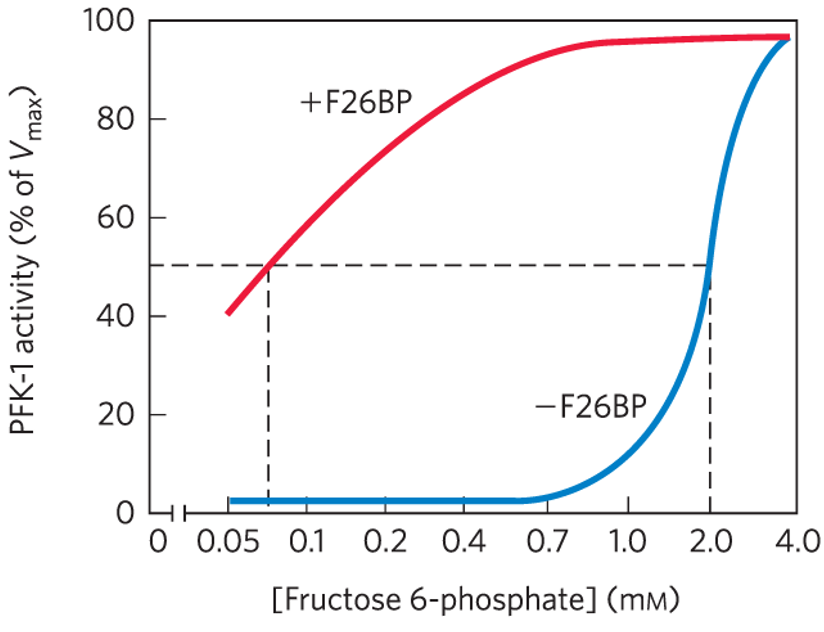
כיצד Fructose 2,6-bisphosphate מזרז את תהליך הגליקוליזה:
- העלאת Km של PFK-1
- הורדת Km של PFK-1
- העלאת Vmax של PFK-1
- אף תשובה לא נכונה
תשובה
2. הורדת Km של PFK-1
Fructose 2,6-bisphosphate הוא אלוסטרי חיובי של האנזים Phosphofructokinase-1 (PFK-1), שהוא אנזים המפתח בגליקוליזה. כאשר Fructose 2,6-bisphosphate נקשר ל-PFK-1, הוא גורם לירידה ב-Km של האנזים לסובסטרט שלו (Fructose-6-phosphate). זה אומר שהאנזים יכול לפעול ביעילות גבוהה יותר גם בריכוזים נמוכים של הסובסטרט, מה שמזרז את קצב הגליקוליזה.
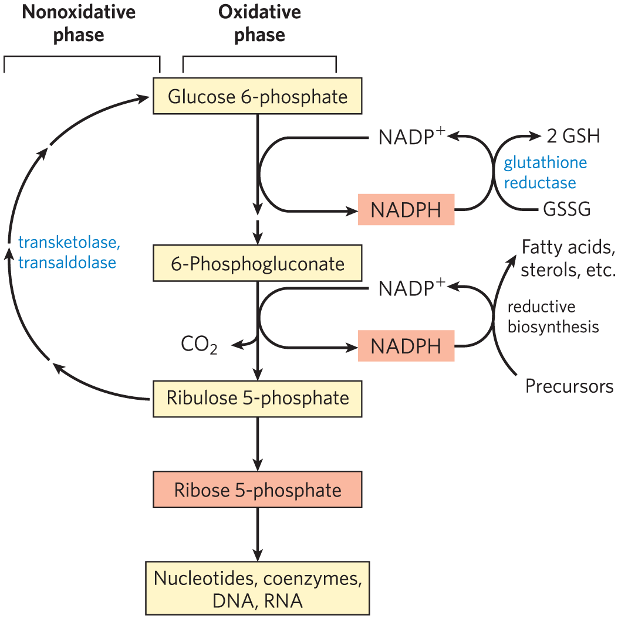
שאלה 3: מעגל הפנטוזות
באילו תאים תהיה פעילות מוגברת של מעגל הפנטוזות?
- בתאי שומן.
- בתאים סרטניים.
- תאי דם.
- כל התשובות נכונות.
תשובה
4. כל התשובות נכונות.
מעגל הפנטוזות (Pentose Phosphate Pathway) הוא מסלול מטבולי חשוב שמספק NADPH וריבוז-5-פוספט. NADPH חיוני לתהליכים ביוכימיים רבים, כולל סינתזת חומצות שומן, תיקון נזקי חמצון, וסינתזת נוקלאוטידים.
- תאי שומן: NADPH דרוש לסינתזת חומצות שומן.
- תאים סרטניים: תאים סרטניים זקוקים ל-NADPH לתיקון נזקי חמצון ולסינתזת נוקלאוטידים לצורך חלוקה מהירה.
- תאי דם: NADPH חיוני לשמירה על סביבה מחזרת ולמניעת נזקי חמצון.
- לכן, כל סוגי התאים הללו יראו פעילות מוגברת של מעגל הפנטוזות בהתאם לצרכיהם המטבוליים.
שאלה 4: מטבוליזם של פרוקטוז
באיזה אברון אצפה לראות רמה גבוה של Glutathione?
- מיטוכנדריה.
- ER.
- גולג’י.
- אף תשובה אינה נכונה.
תשובה
התשובה: א - מיטוכונדריה.
במיטוכונדריה יש עומס גבוה של ROS (תוצרי־לוואי של שרשרת מעבר האלקטרונים), ולכן “מצופה” לראות שם רמות גבוהות של Glutathione (GSH) כדי לנטרל חמצון ולהגן על חלבונים/ליפידים/mtDNA.
למה לא ER/גולג׳י?
- ER הוא סביבה מחמצנת יותר (מתאימה ליצירת קשרים דיסולפידיים בחלבונים), ולכן יחס GSH:GSSG שם נמוך יותר.
- Golgi לא נחשב מוקד עיקרי לעומס ROS או למאגר GSH.
שאלה 5: מסלולים בציטופלזמה
איזה מסלול/ים מתרחש/ים אך ורק בציטופלזמה?
- גליקוליזה.
- גלוקונאוגנזה.
- מעגל הפנטוזות.
- 1
- 2
- 3
- 1+2
- 1+3
- 2+3
תשובה
5. 1+3
גליקוליזה ומעגל הפנטוזות מתרחשים אך ורק בציטופלזמה. גלוקונאוגנזה, לעומת זאת, כוללת שלבים שמתרחשים במיטוכונדריה (כגון המרת פירובט לאוקסלואצטט).
שאלה 6: אנזים בראקציה הפוכה בגליקוליזה
איזה אנזים יכול לקטלז ראקציה הפוכה בגליקוליזה תחת תנאים “טבעיים” בתא?
- phosphofructokinase-1.
- phosphoglycerate kinase.
- hexokinase.
- pyruvate kinase.
תשובה
2. phosphoglycerate kinase.
Phosphoglycerate kinase (PGK) הוא אנזים בגליקוליזה שמקטלז את ההמרה של 1,3-bisphosphoglycerate ל-3-phosphoglycerate תוך יצירת ATP. ראקציה זו היא הפיכה, ולכן PGK יכול לפעול גם בכיוון ההפוך תחת תנאים מתאימים בתא, כמו במהלך גלוקונאוגנזה.
שאר האנזימים ברשימה מקטלזים שלבים חד-כיווניים בגליקוליזה:
- Phosphofructokinase-1 (PFK-1): שלב חד-כיווני, לא הפיך.
- Hexokinase: שלב חד-כיווני, לא הפיך.
- Pyruvate kinase: שלב חד-כיווני, לא הפיך.
שאלה 7: אפקט ורבורג
למה תא סרטני הופך פירובט לחומצה לקטית?
- לתאים סרטנים אין מיטוכונדריה ולכן אי אפשר להמשיך לפרק פירובט לצורך אנרגיה.
- אחד התוצרים של הראקציה חיוני לתהליך הגליקוליזה.
- ע”מ להוריד את ה-pH של התא.
- כל התשובות נכונות.
תשובה
2. אחד התוצרים של הראקציה חיוני לתהליך הגליקוליזה.
תאים סרטניים נוטים לפרק פירובט לחומצה לקטית גם בנוכחות חמצן (אפקט ורבורג). הסיבה לכך היא שגליקוליזה מייצרת ATP מהר יותר מאשר מעגל קרבס, וזו דרך מהירה לספק אנרגיה לתאים שמתחלקים במהירות. בנוסף, התהליך מייצר $\ce{NAD+}$, שהוא חיוני להמשך הגליקוליזה.
שאלות נוספות
שאלה 8: השפעת גליקוגון על PFK-2
כיצד משפיעה עלייה ברמות הגלוקגון על פעילות האנזים PFK-2?
- מגבירה את פעילות האנזים PFK-2.
- מעכבת את פעילות האנזים PFK-2.
- אינה משפיעה על פעילות האנזים PFK-2.
- גורמת לפירוק האנזים PFK-2.
תשובה
2. מעכבת את פעילות האנזים PFK-2.
גלוקגון מפעיל את PKA (Protein Kinase A), אשר מפעיל פוספורילציה על האנזים הדו-תפקודי PFK-2/FBPase-2. הפוספורילציה גורמת להפעלת FBPase-2 ולעיכוב PFK-2, מה שמוביל לירידה ברמות Fructose-2,6-bisphosphate ולקידום גלוקונאוגנזה במקום גליקוליזה.
התייחסות הבינה:
כן - זה נכון (בהקשר של כבד).
- $\text{Glucagon} \uparrow \to \text{cAMP} \uparrow \to \text{PKA} \uparrow$
- PKA מזרחן את PFK-2/FBPase-2 (האנזים הדו־תפקודי)
- בכבד: הזרחון מעכב את פעילות PFK-2 (החלק שמייצר F-2,6-BP) ומפעיל יחסית את FBPase-2
- לכן Fructose-2,6-bisphosphate יורד ← פחות הפעלה של PFK-1 ויותר עיכוב של FBPase-1 משתחרר ← גליקוליזה יורדת וגלוקונאוגנזה עולה
⚠️ הערת דיוק חשובה: יש איסופורמים שונים של PFK-2/FBPase-2 ברקמות שונות, ובחלקן (למשל לב) האפקט יכול להיות שונה. אבל לשאלות קלאסיות על גלוקגון/צום-מדברים על כבד, ושם התשובה שלך 2 נכונה.
שאלה: ציטראט גבוה בכבד והשפעה על גליקוליזה
מטופל מגיע לבדיקה שגרתית. בדיקות מעבדה מראות רמות גבוהות של ציטראט בתאי הכבד - מצב המעיד על פעילות טובה של מעגל קרבס ועל מאגרי אנרגיה מלאים. כיצד מצב זה צפוי להשפיע על קצב הגליקוליזה בכבד?
- קצב הגליקוליזה לא ישתנה כי ציטראט אינו משפיע על מסלול זה.
- הגליקוליזה תואץ כדי לנצל את עודפי הסוכר.
- הגליקוליזה תואט משום שהצטברות ציטראט מאותתת שתא אינו זקוק לעוד אנרגיה.
- הגליקוליזה תוגבר משום שהציטראט יהפוך לגלוקוז בחזרה.
תשובה
3. הגליקוליזה תואט משום שהצטברות ציטראט מאותתת שתא אינו זקוק לעוד אנרגיה.
ציטראט הוא סמן ל”מצב אנרגטי גבוה” ומעכב אלוסטרית את PFK-1, האנזים הקובע קצב בגליקוליזה בכבד. לכן כשהציטראט גבוה - הגליקוליזה מואטת ומוסטת רגולציה לכיוונים אנאבוליים/גלוקונאוגנזה לפי הצורך.
שאלה: תינוק בן יומיים עם היפוגליקמיה ולקטט גבוה מאוד
תינוק בן יומיים מגיע עם ישנוניות, הקאות ורמת גלוקוז נמוכה. רמת הלקטט גבוהה מאוד. מהו ההסבר לממצאים?
- פירובט לא יכול להתקדם במסלול ולכן מצטבר ונהפך ללקטט.
- השרירים לא מצליחים לפרק גלוקוז ולכן נוצר לקטט.
- לקטט הופך לגלוקוז מהר יותר ולכן רמתו עולה.
- הגליקוליזה לא פעילה ולכן נוצר לקטט.
תשובה
1. פירובט לא יכול להתקדם במסלול ולכן מצטבר ונהפך ללקטט.
כשפירובט לא יכול להמשיך למסלולים אירוביים (למשל להיכנס למיטוכונדריה/להפוך לאצטיל-CoA), הוא מצטבר ומוסט ליצירת לקטט דרך LDH כדי למחזר $\ce{NAD+}$. התוצאה היא לקטט גבוה (חמצת לקטית), ולעיתים גם היפוגליקמיה בגלל תלות גבוהה בגליקוליזה/פגיעה במסלולים מטבוליים נוספים.
למה האחרות לא נכונות בקצרה:
- 2 אם שריר “לא מצליח לפרק גלוקוז” ← דווקא תהיה פחות גליקוליזה ופחות לקטט, לא יותר.
- 3 אם לקטט הופך לגלוקוז מהר יותר ← לקטט היה אמור לרדת, לא לעלות.
- 4 לקטט נוצר מגליקוליזה אנאירובית; אם גליקוליזה “לא פעילה” לא אמור להיווצר לקטט.