רגולציה של חמצון חומצות שומן
Fatty Acid Oxidation is Tightly Regulated
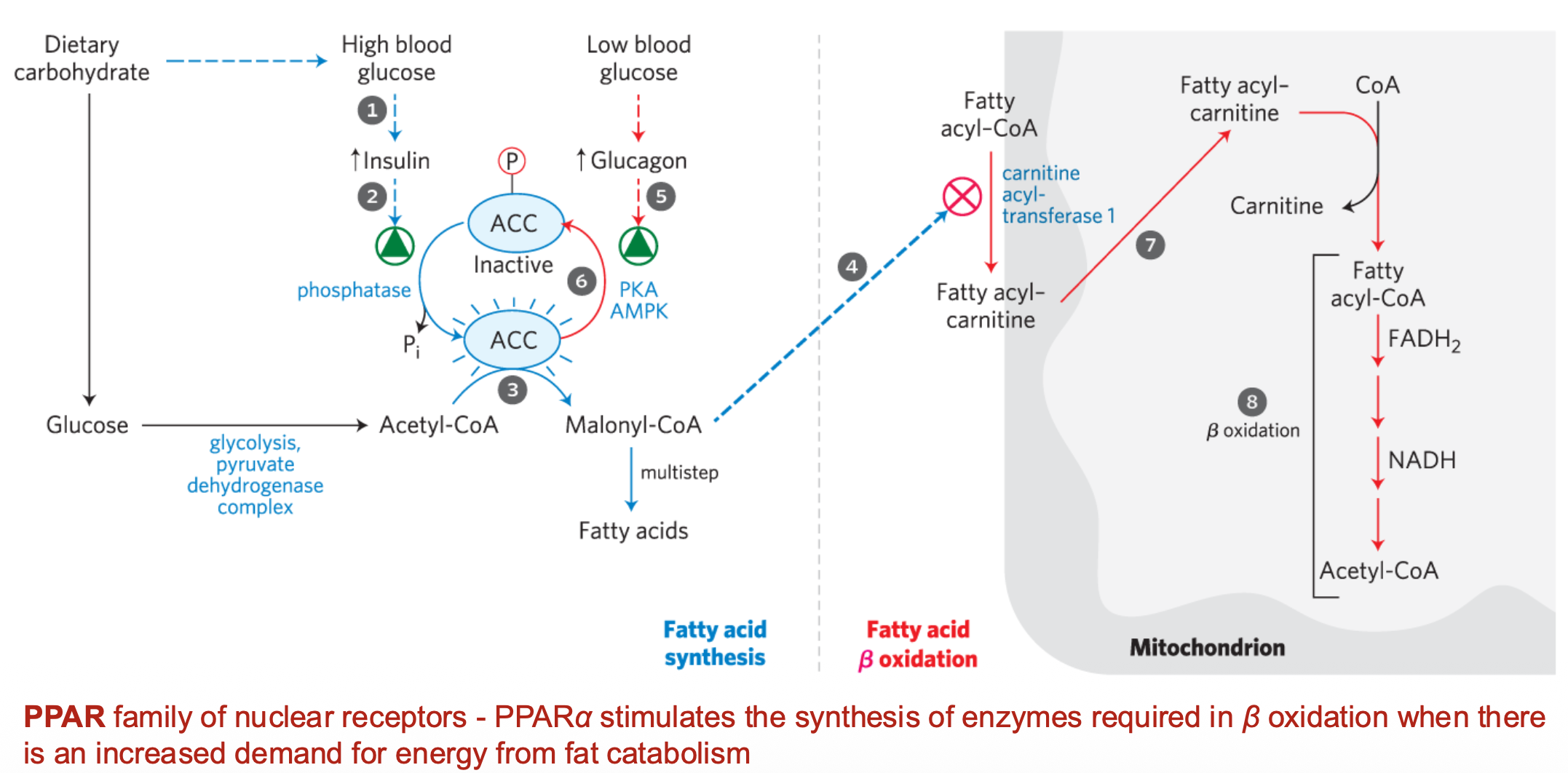
מצב שובע (גלוקוז גבוה)
- שחרור אינסולין
- אינסולין מפעיל פוספטאז (אנזים שמסיר קבוצות פוספט)
- הפוספטאז מפעיל את האנזים ACC (Acetyl-CoA Carboxylase)
- ACC מזרז Acetyl-CoA שמוביל ליצירת Malonyl-CoA
- Malonyl-CoA ← סינתזה של חומצות שומן
מצב רעב (מחסור בגלוקוז)
- שחרור גלוקגון (הורמון הרעב)
- גלוקגון מפעיל קינאז שמזרחן ומכבה את ACC
- עצירת סינתזה של חומצות שומן ← מעבר לפירוק חומצות שומן
תפקיד נוסף של Malonyl-CoA
Malonyl-CoA מעכב את CPT-I (Carnitine Palmitoyltransferase I) - האנזים שמכניס חומצות שומן למיטוכונדריה לחמצון בטא.
לוגיקה מטבולית: כשמסנתזים חומצות שומן (יש Malonyl-CoA), אין טעם לפרק אותן במקביל, לכן הכניסה למיטוכונדריה נחסמת.
חמצון בטא בפרוקסיזומים
Peroxisomes also Carry Out Beta Oxidation
התהליך מתרחש גם בפרוקסיזום - אברון (אורגנלה) בעל ממברנה.

תפקיד הפרוקסיזום: קיצור חומצות שומן ארוכות מאוד (Very Long Chain Fatty Acids - VLCFA) לפני שהן יכולות להיכנס למיטוכונדריה.
תסמונת Zellweger: מחלה גנטית הנגרמת מפגם בגנים מסוג PEX (גנים האחראים על יצירת פרוקסיזומים). תסמינים: הצטברות של חומצות שומן ארוכות מאוד, פגיעה במיאלין של הנוירונים.
גופי קטו
גופי קטו הם מקור אנרגיה מסיס במים שנוצר בעת צום או רעב. כשאין מספיק גלוקוז, הגוף מפרק חומצות שומן ומייצר גופי קטו.
שלושת גופי הקטו
| גוף קטו | תפקיד |
|---|---|
| Acetone (אצטון) | תוצר לוואי, משתחרר בנשימה |
| Acetoacetate (אצטואצטט) | מקור אנרגיה |
| D-β-Hydroxybutyrate | מקור אנרגיה (היציב ביותר) |
יתרון חשוב: גופי קטו יכולים לעבור את מחסום הדם-מוח (BBB - Blood Brain Barrier) כי הם מסיסים במים, בניגוד לחומצות שומן.
ביוסינתזה של גופי קטו
השלבים
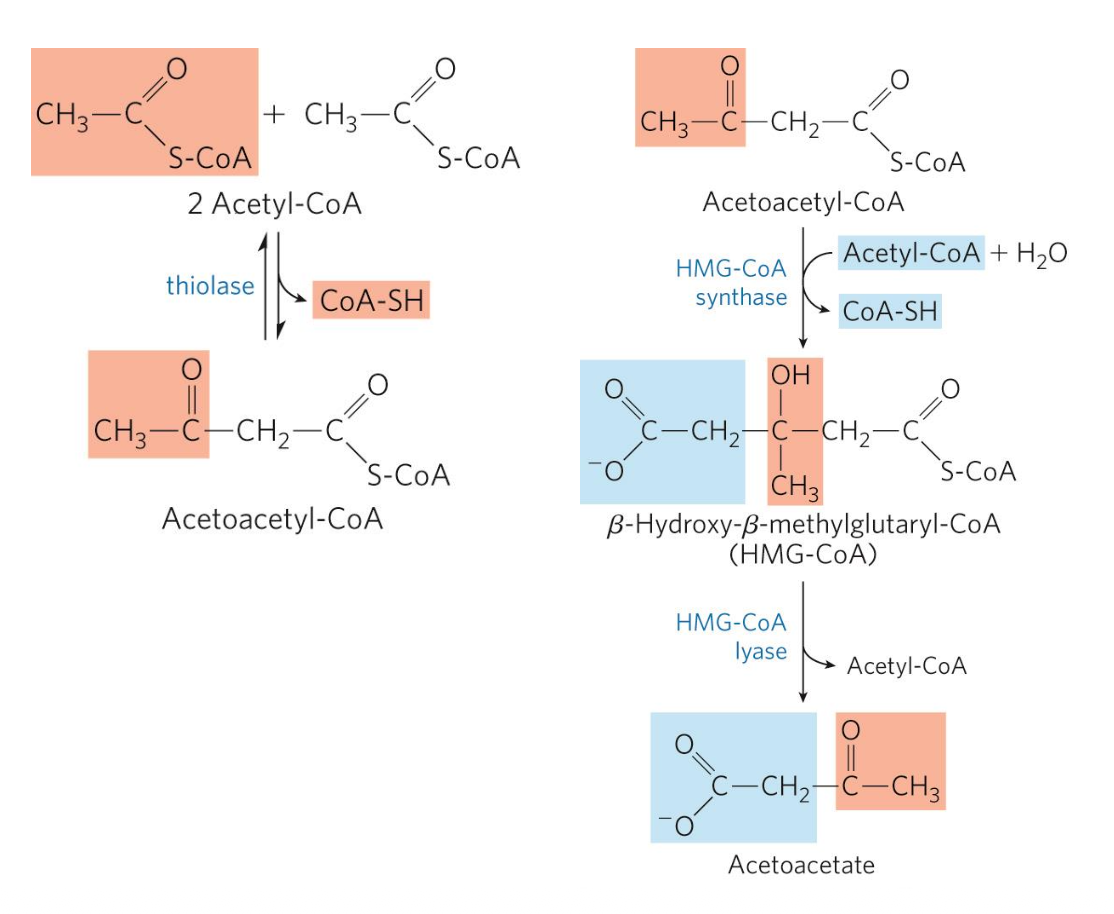
-
שלב 1: שתי מולקולות Acetyl-CoA מתאחדות באמצעות האנזים Thiolase ליצירת Acetoacetyl-CoA
-
שלב 2: הוספת Acetyl-CoA נוסף ליצירת HMG-CoA (β-Hydroxy-β-Methylglutaryl-CoA)
-
שלב 3: האנזים HMG-CoA Lyase חותך ויוצר Acetoacetate
-
שלב 4 - שתי אפשרויות:
- שחרור CO₂ ← יצירת Acetone (משתחרר בנשימה)
- חיזור ← יצירת D-β-Hydroxybutyrate

שימוש בגופי קטו כדלק
D-β-Hydroxybutyrate as Fuel
באתר היעד (שרירים, מוח, לב):
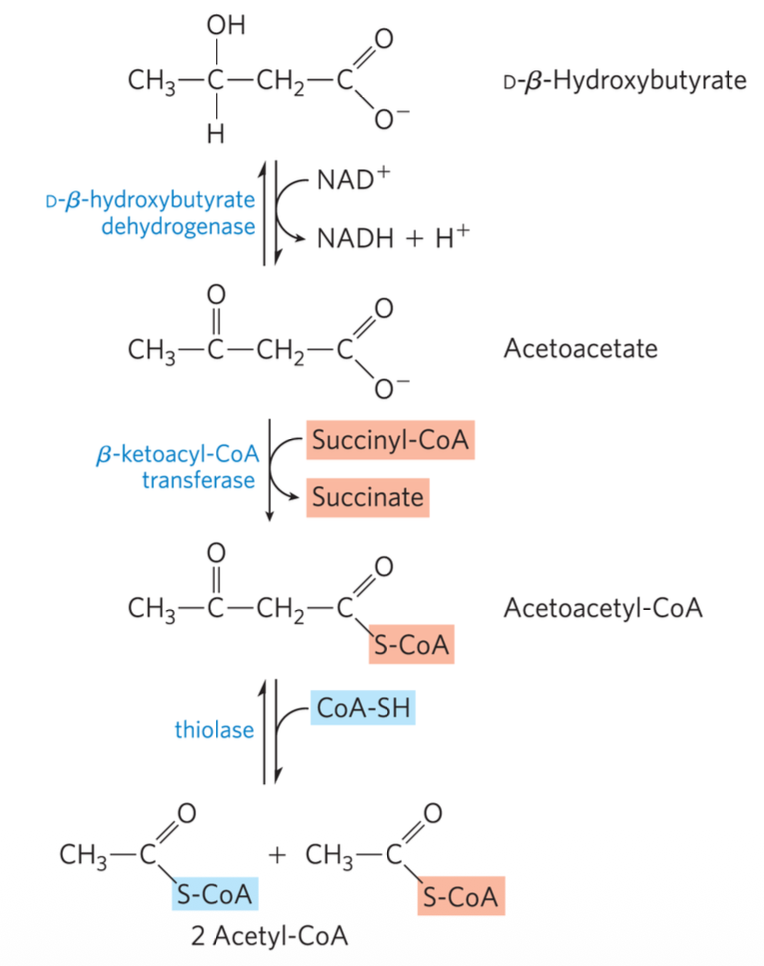
- D-β-Hydroxybutyrate מחומצן חזרה ל-Acetoacetate
- האנזים β-Ketoacyl-CoA Transferase (נקרא גם Thiophorase) מעביר CoA מ-Succinyl-CoA
- נוצר Acetoacetyl-CoA
- Thiolase מפרק לשתי מולקולות Acetyl-CoA שנכנסות למעגל קרבס
חשוב: גופי קטו נוצרים בכבד אך לא נצרכים בו. הסיבה: האנזים β-Ketoacyl-CoA Transferase לא קיים בכבד, ולכן הכבד לא יכול לפרק גופי קטו.
תפקיד הכבד ברעב
בעת רעב, תפקיד הכבד הוא לשמור על הומאוסטזיס. הוא מפרק חומצות שומן ויוצר גופי קטו כדרך לשלוח אנרגיה לאיברים מרוחקים (מוח, שרירים, לב).
ייצור יתר של גופי קטו
Ketone Bodies are Overproduced in Diabetes and During Starvation
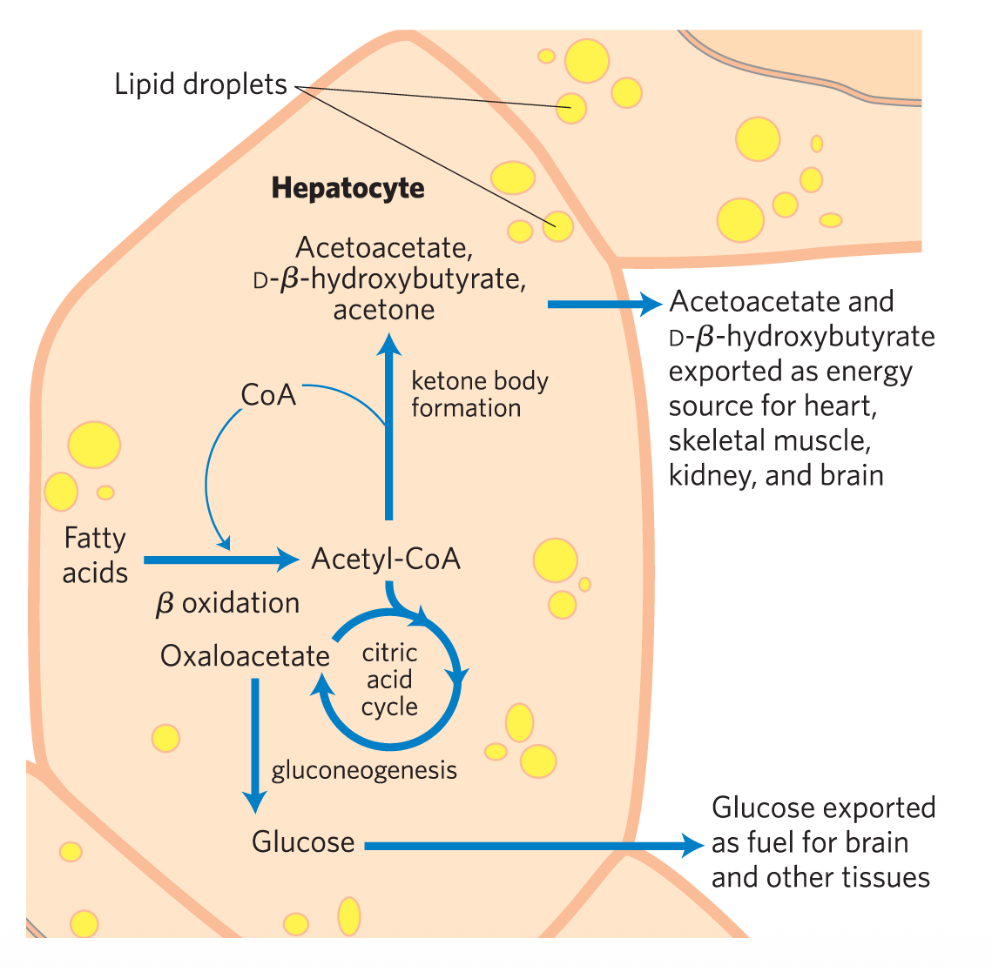
בסוכרת או ברעב ממושך:
- ייצור מוגבר של גופי קטו
- ירידת pH בדם ← מצב הנקרא קטואצידוזיס (Ketoacidosis)
- סימן אופייני: ריח אצטון בנשימה
חמצון חומצות אמינו ומעגל האוריאה
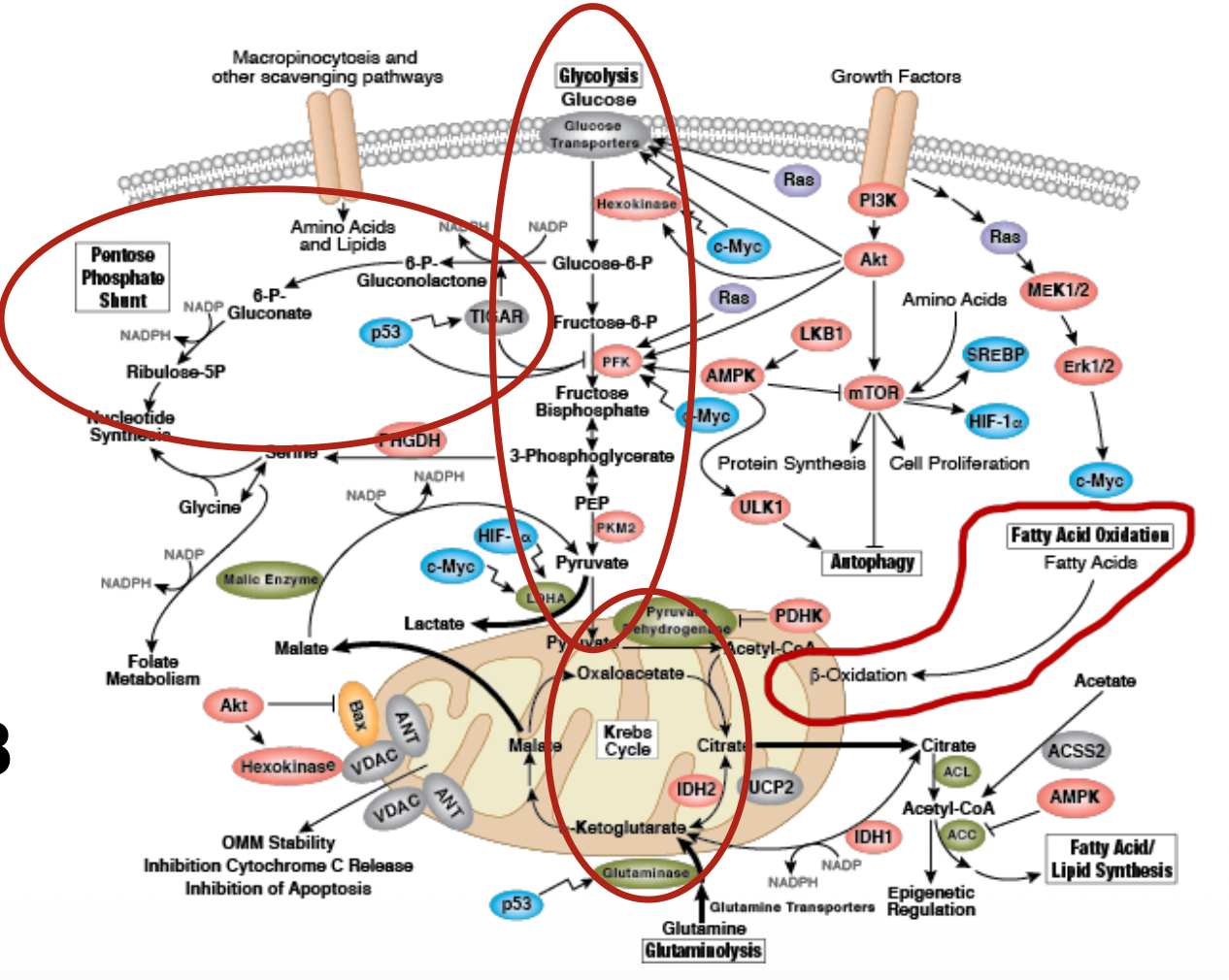
נשימה תאית

שלושה מצבים בהם חומצות אמינו עוברות חמצון
- תהליך טבעי: חידוש חלבונים - פירוק חלבונים ישנים ובניית חדשים
- עודף חומצות אמינו: כשצריכת החלבון עולה על הצורך, העודף מפורק כמקור אנרגיה
- היעדר פחמימות: ברעב או בדיאטה דלת פחמימות, חומצות אמינו משמשות כמקור אנרגיה
קטבוליזם של חומצות אמינו ביונקים

- יש חפיפה בין מעגל האוריאה למעגל קרבס
- לכל חומצת אמינו מסלול קטבולי ייחודי
- בסופו של דבר, כל המסלולים מתכנסים לשישה תוצרים שנכנסים למעגל קרבס:
- Pyruvate
- Acetyl-CoA
- Acetoacetyl-CoA
- α-Ketoglutarate
- Succinyl-CoA
- Fumarate / Oxaloacetate
קטבוליזם של קבוצות אמינו
הפרשת אמוניה בבעלי חיים שונים
| קבוצה | צורת ההפרשה | מקום ההפרשה |
|---|---|---|
| יונקים (חולייתנים) | אוריאה | שתן |
| ציפורים וזוחלים | חומצה אורית | צואה (הנוזל הלבן) |
| דגים | אמוניה ישירות | נמהלת במים |
עיקרון הפירוק
פירוק חומצות אמינו מבוסס על הפרדה ל:
- שלד פחמני ← נכנס למעגל קרבס או לגלוקונאוגנזה
- קבוצת אמינו ← הופכת לאמוניום ומופרשת כאוריאה
פירוק חלבונים מהמזון
Dietary Protein is Enzymatically Degraded to Amino Acids
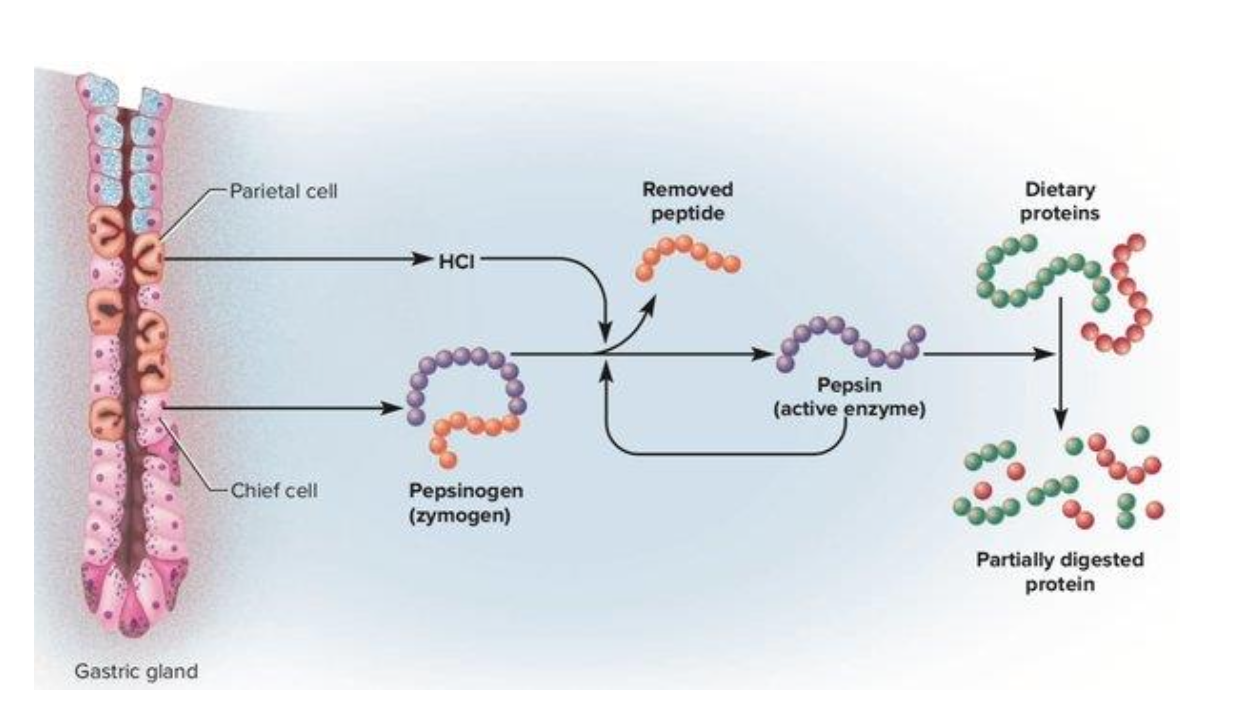
התהליך בקיבה
- פפסינוגן (Pepsinogen) - זימוגן (צורה לא פעילה של אנזים)
- ב-pH חומצי בקיבה, הפפסינוגן חותך את עצמו (אקטיבציה עצמית)
- נוצר פפסין - האנזים הפעיל שמפרק חלבונים
למה זימוגנים? הפרשת פרוטאזות בצורה לא פעילה מגנה על דופן הקיבה והמעיים מפני עיכול עצמי.
למה פפסינוגן פעיל רק ב-pH חומצי? כדי להבטיח שהאנזים יהיה פעיל רק בקיבה ולא במקומות אחרים בגוף.
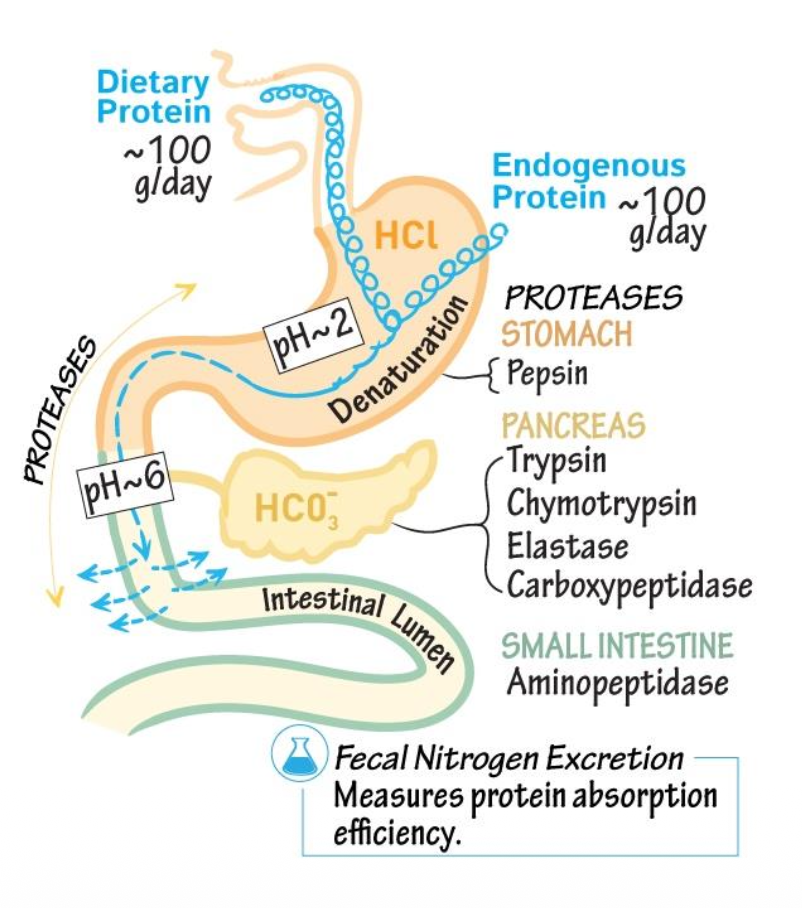
ההורמון סקרטין משוחרר ומנטרל את ה-pH במעי הדק.
טרנסאמינציה - העברת קבוצות אמינו
התהליך המרכזי לפירוק חומצות אמינו הוא טרנסאמינציה (Transamination) - העברת קבוצת אמינו מחומצת אמינו לשלד פחמני α-Ketoglutarate. השלבים:
- חומצת אמינו מעבירה את קבוצת האמינו שלה ל-
α-Ketoglutarate - נוצרים:
גלוטמט(מקבל את קבוצת האמינו)α-Keto Acid(השלד הפחמני של חומצת האמינו המקורית)
הקו-אנזים PLP
PLP(Pyridoxal Phosphate) - נגזרת של ויטמין B6- קשור קוולנטית לאנזימי
Aminotransferase - חיוני להעברת קבוצות אמינו
Pyridoxal Phosphate Participates in the Transfer of α-Amino Group to α-Ketoglutarate

דוגמאות לטרנסאמינציה
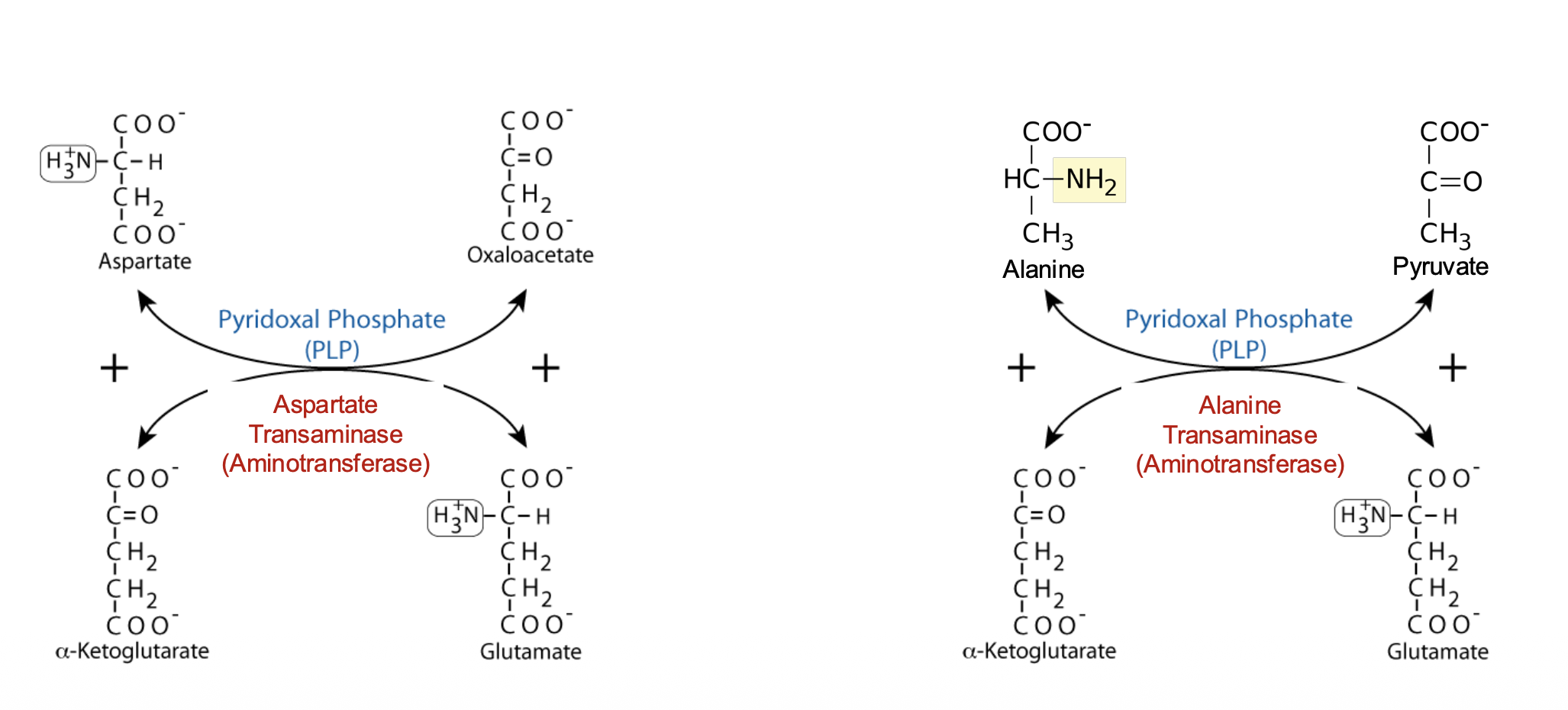
דוגמה 1: אספרטט
\[\text{Aspartate} + \alpha\text{-Ketoglutarate} \rightarrow \text{Glutamate} + \text{Oxaloacetate}\]דוגמה 2: אלנין
\[\text{Alanine} + \alpha\text{-Ketoglutarate} \rightarrow \text{Glutamate} + \text{Pyruvate}\]השלד הפחמני (α-Keto Acid) יכול להיכנס למעגל קרבס או לשמש לגלוקונאוגנזה.
שחרור אמוניה מגלוטמט בכבד
Glutamate Releases Its Amino Group as Ammonia in the Liver

בכבד, האנזים Glutamate Dehydrogenase מזרז:
\[\text{Glutamate} \rightarrow \alpha\text{-Ketoglutarate} + \text{NH}_4^+\]ה-α-Ketoglutarate יכול:
- להיכנס למעגל קרבס
- לשמש לגלוקונאוגנזה (סינתזת גלוקוז)
גלוטמין כמשלוח אמוניה בדם
Glutamine Transports Ammonia in the Bloodstream

בעיה: אמוניום ($\ce{NH₄⁺}$) רעיל ולא יכול לעבור חופשי בזרם הדם.
הפתרון - גלוטמין
- ברקמות הפריפריות: גלוטמט + $\ce{NH₄⁺}$ ← גלוטמין (על ידי Glutamine Synthetase)
- גלוטמין עובר בזרם הדם לכבד
- בכבד: גלוטמין ← גלוטמט + $\ce{NH₄⁺}$ (על ידי Glutaminase)
- האמוניום נכנס למעגל האוריאה
הבהרה: קודם דיברנו על פירוק חלבונים בקיבה. כאן מדובר על שילוח אמוניה שנוצרת ברקמות רחוקות (לא מעיכול).
מעגל הגלוקוז-אלנין
דרך נוספת לשילוח אמוניה, בעיקר מהשרירים:
בשריר
\[\text{Pyruvate} + \text{Glutamate} \rightarrow \text{Alanine} + \alpha\text{-Ketoglutarate}\]בכבד (התהליך ההפוך)
\[\text{Alanine} + \alpha\text{-Ketoglutarate} \rightarrow \text{Pyruvate} + \text{Glutamate}\]- האלנין עובר בזרם הדם מהשריר לכבד
- הגלוטמט בכבד משחרר אמוניום שנכנס למעגל האוריאה
- הפירובט יכול לשמש לגלוקונאוגנזה
הבהרה: שתי הדרכים (גלוטמין ואלנין) פותרות את אותה הבעיה - העברת אמוניה רעילה בצורה בטוחה בזרם הדם.
מעגל האוריאה
מתרחש בכבד, מתחיל במיטוכונדריה ומסתיים בציטוזול.
שלב מקדים - יצירת Carbamoyl Phosphate
\[\ce{CO2 + NH4+ + 2ATP ->[CPS I] Carbamoyl\ Phosphate}\] CPS I(Carbamoyl Phosphate Synthetase I) - אנזים רגולטורי- זהו שלב קובע מהירות (Rate-Limiting Step)
- השקעה של $\ce{2 ATP}$ - הגוף משקיע אנרגיה כדי להיפטר מאמוניה רעילה
שלבי מעגל האוריאה
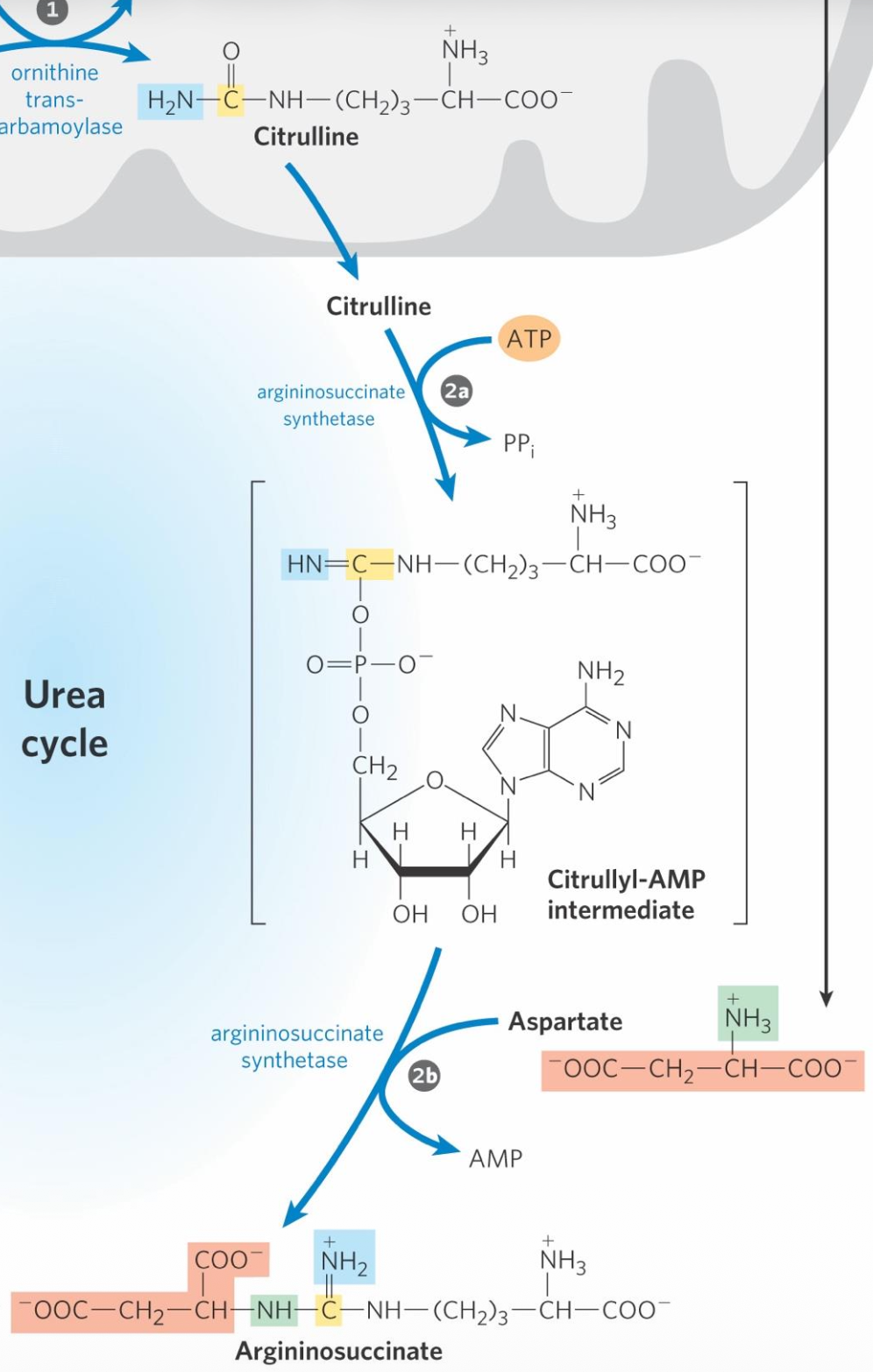
שלב 1: יצירת ציטרולין (Citrulline)
במיטוכונדריה:
\[\ce{Carbamoyl\ Phosphate + Ornithine -> Citrulline}\]אנלוגיה למעגל קרבס: אורניטין במעגל האוריאה דומה לאוקסלואצטט במעגל קרבס - שניהם מתחדשים בכל סיבוב.
הציטרולין יוצא מהמיטוכונדריה לציטוזול.
שלב 2: יצירת ארגינינוסוקסינאט (Argininosuccinate)
בציטוזול:
\[\ce{Citrulline + Aspartate + ATP -> Argininosuccinate}\]- כאן נכנסת קבוצת אמינו שנייה (מאספרטט)
- השקעה של
ATPנוסף
שלב 3: יצירת ארגינין (Arginine)
\[\ce{Argininosuccinate ->[ Argininosuccinase] Arginine + Fumarate}\]- הפומראט יכול להיכנס למעגל קרבס (כאן החיבור בין שני המעגלים)
שלב 4: יצירת אוריאה
\[\ce{Arginine + H2O ->[ Arginase] Urea + Ornithine}\]- האוריאה מופרשת בשתן
- האורניטין חוזר למיטוכונדריה להתחלת מחזור חדש
סך הכל ההשקעה האנרגטית במעגל האוריאה היא 3 ATP לכל מולקולת אוריאה שנוצרת?
הקשר בין מעגל האוריאה למעגל קרבס
שני המעגלים חולקים מטבוליטים משותפים:
- פומראט נוצר במעגל האוריאה ויכול להיכנס למעגל קרבס כמאלט
- אספרטט (שנוצר מאוקסלואצטט במעגל קרבס) נכנס למעגל האוריאה