תזכורת - תכונות בסיסיות של חומצות אמינו
סיווג לפי תכונות פיזיקליות
חומצות אמינו מסווגות לפי תכונות שונות:
- לא פולאריות / אליפטיות (7)
- ארומטיות (3)
- חומצות פולריות - בעלות מטען חלקי, לא טעונות (5)
- חומצות עם מטען חיובי מלא (3) (ב-pH פיזיולוגי)
- חומצות עם מטען שלילי מלא (2) (ב-pH פיזיולוגי)
תכונות אופטיות
- חומצות אמינו הן כיראליות (למעט גליצין)
- בעלות יכולת סיבוב מישור הקיטוב של האור (לא קשור לסיבוב מישור הכיתוב)
חומצות אמינו לא סטנדרטיות
חומצות אמינו שאינן בונות חלבונים
לא כל חומצות האמינו משתתפות בבניית חלבונים. דוגמאות:
אורניתין (Ornithine)
- בעלת שרשרת צד ארוכה יחסית
- חומר ביניים חשוב במעגל האוריאה
- נלמד עליה עם פרופ׳ רון אורבך
ציטרולין (Citrulline)
- גם היא חלק ממעגל האוריאה
- נוצרת מאיחוי של אספרטט עם חומצת אמינו נוספת
חומצות אלו הן חלק מהמטבוליטים שלנו - חומרים חשובים למטבוליזם אך לא בונים חלבונים.
תכונות חומצה-בסיס של חומצות אמינו
התנהגות כחומצות/בסיסים חלשים
חומצות אמינו יכולות להתנהג כחומצות חלשות או בסיסים חלשים:
- הקצה הקרבוקסילי ($\ce{COOH}$) יכול לתרום פרוטון
- הקצה האמיני ($\ce{NH3+}$) יכול לקבל/לתרום פרוטון
משוואת הנדרסון-האסלבלך
\[\boxed{\text{pH} = \text{p}K_a + \log_{10}\frac{[\ce{A-}]}{[\ce{HA}]}}\]כאשר:
- $[\ce{A-}]$ - ריכוז המלח המצומד (הצורה הדה-פרוטונית)
- $[\ce{HA}]$ - ריכוז החומצה
- בפועל, $\ce{H+}$ מופיע כ-$\ce{H3O+}$
עקומת טיטרציה ו-$\text{p}K_a$
בטיטרציה של חומצה חלשה עם בסיס:
- בנקודה שבה 50% מהחומצה עברה דה-פרוטונציה - זו נקודת ה-$\text{p}K_a$
- באזור זה השינוי ב-pH הוא מינימלי - זהו אזור החיץ (Buffer Zone)
- לכל חומצה חלשה יש את אזור החיץ המאפיין שלה
חומצה חזקה לעומת חומצה חלשה:
- חומצה חזקה: עוברת פירוק מלא בבת אחת, קפיצה חדה ב-pH
- חומצה חלשה: נמצאת בשיווי משקל, שינוי הדרגתי ב-pH
$\text{p}K_a$ של חומצות אמינו
שתי מערכות חומצה-בסיס בחומצת אמינו בסיסית
לכל חומצת אמינו יש לפחות שתי קבוצות שיכולות לעבור פרוטונציה/דה-פרוטונציה:
- קצה קרבוקסילי: $\ce{COOH <=> COO- + H+}$
- $\text{p}K_a \approx 2-3$
- קצה אמיני: $\ce{NH3+ <=> NH2 + H+}$
- $\text{p}K_a \approx 8-10$
צוויטריון (Zwitterion)
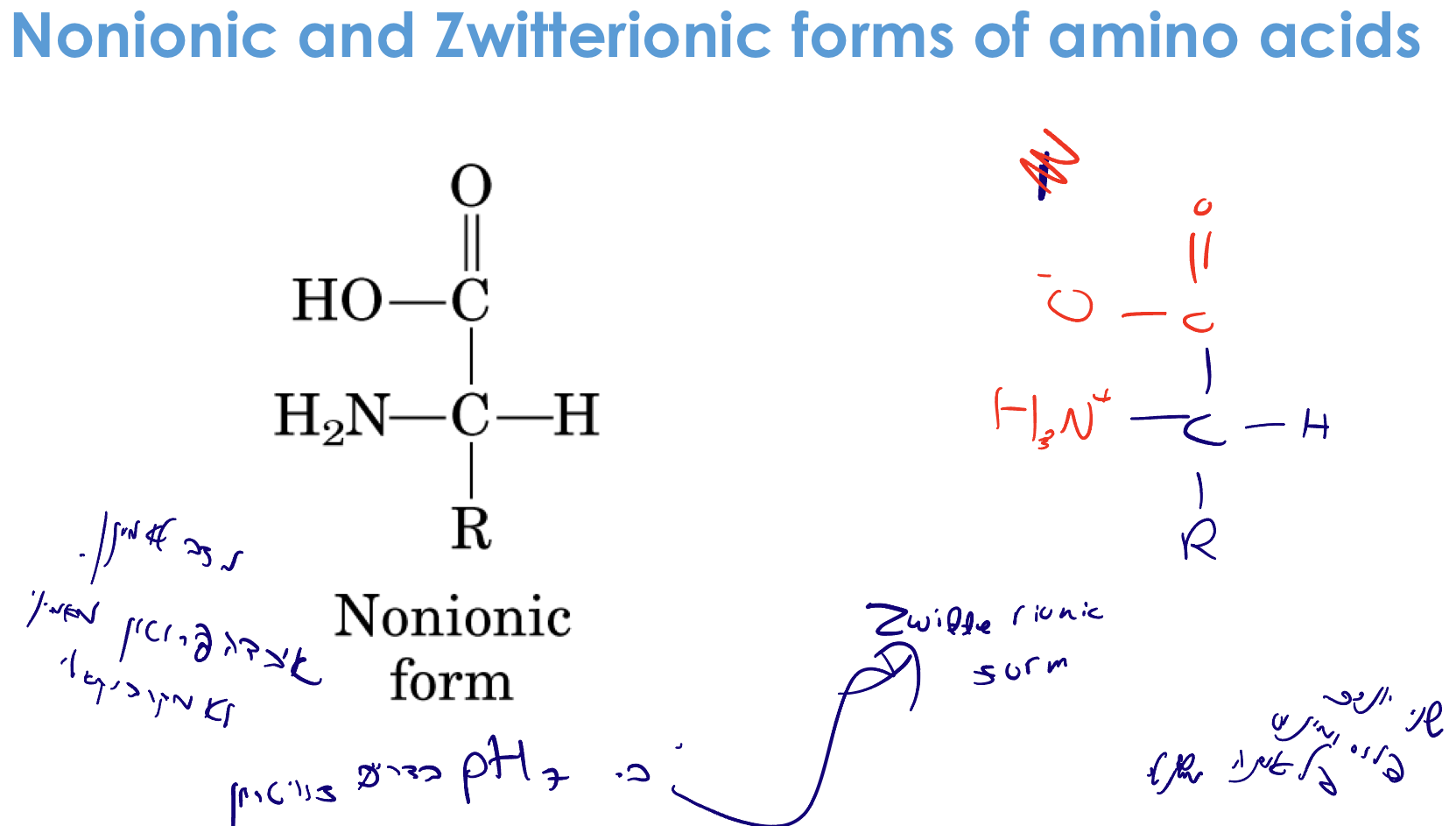
ב-pH 7 (ניטרלי), רוב חומצות האמינו נמצאות בצורת צוויטריון:
- הקצה האמיני: $\ce{NH3+}$ (פרוטונטי - מטען חיובי)
- הקצה הקרבוקסילי: $\ce{COO-}$ (דה-פרוטונטי - מטען שלילי)
- מטען כולל: 0 (אך המולקולה מיוננת!)
הגדרה: צוויטריון = מולקולה עם שני יונים (חיובי ושלילי) על אותה מולקולה
הסיבה לכך:
- $\text{p}K_a$ של $\ce{COOH} \approx 2-3$ ← ב-pH 7 כבר עבר דה-פרוטונציה
- $\text{p}K_a$ של $\ce{NH3+} \approx 8-9$ ← ב-pH 7 עדיין לא עבר דה-פרוטונציה
שלוש קבוצות עיקריות שעוברות דה-פרוטונציה
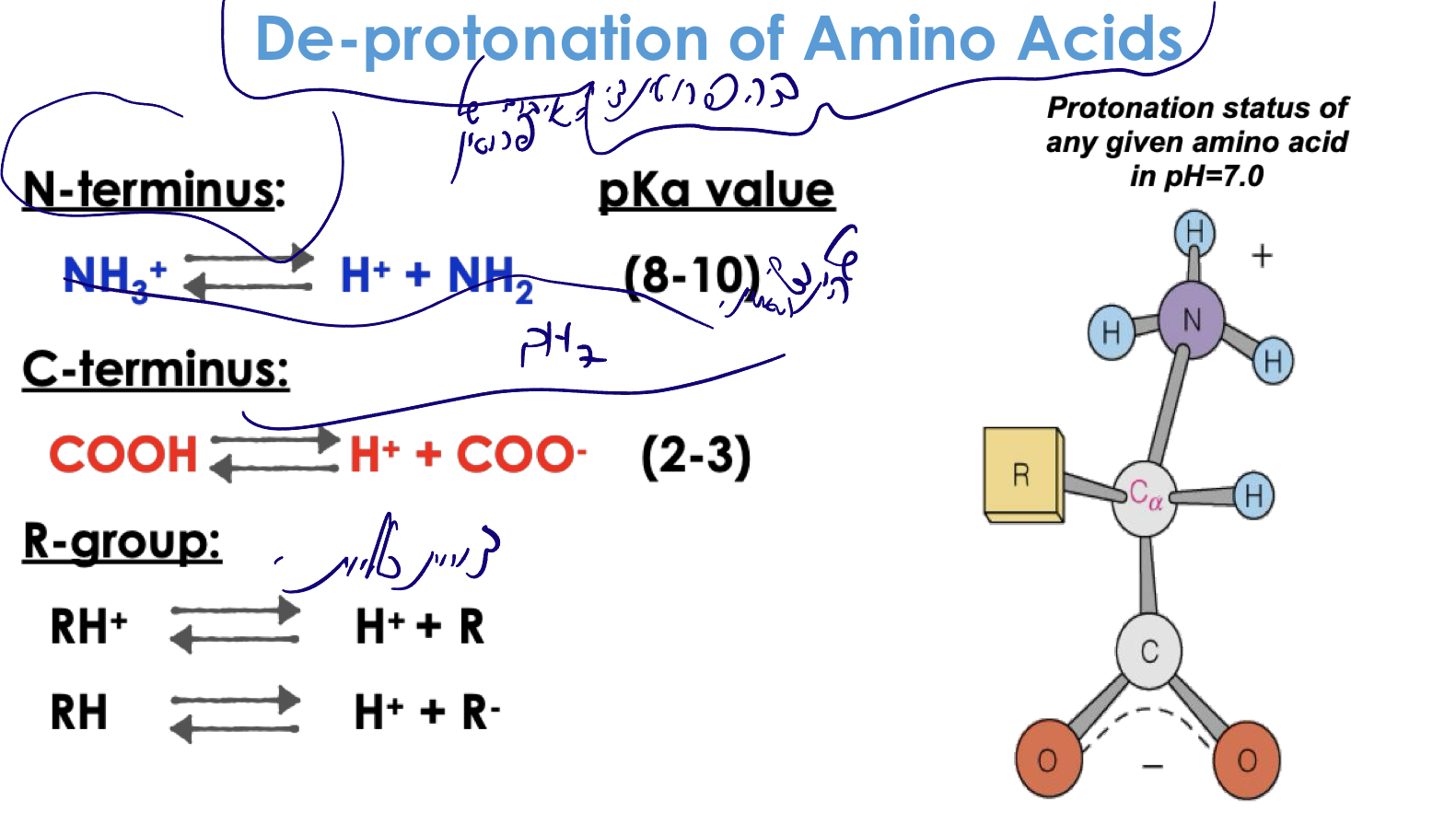
- N-terminus (קצה אמיני): $\ce{NH3+ -> NH2 + H+}$
- $\text{p}K_a \approx 8-9$
- C-terminus (קצה קרבוקסילי): $\ce{COOH -> COO- + H+}$
- $\text{p}K_a \approx 2-3$
- R group (שרשרת צד): משתנה בהתאם לחומצת האמינו
- יכול להיות: $\ce{R-H+ -> R + H+}$ או $\ce{R-H -> R- + H+}$
חשוב: התהליך נקרא דה-פרוטונציה (ולא יינון), כי לא תמיד נוצר מטען חדש
נקודה איזואלקטרית ($\text{p}I$)
הגדרה
הנקודה האיזואלקטרית ($\text{p}I$) היא הנקודה על סקלת ה-pH שבה:
- המטען הכולל (נטו) של המולקולה הוא אפס
- זה לא אומר שאין מטענים על המולקולה!
- זה אומר: סכום כל המטענים = 0
דוגמה: גליצין
| \(\begin{array}{ccc}& \text{Low pH} & \\[6pt]& \quad\quad\ce{N+H3} & \\[-2pt]& \vert \\[-2pt]& \quad \ce{CH2} & \\[-2pt]& \vert \\[-2pt]& \quad \quad \ce{COOH} &\end{array}\) | \(\begin{array}{ccc}& \text{Glycine} & \\[6pt]& \quad\quad\ce{N+H3} & \\[-2pt]& \vert \\[-2pt]& \quad \ce{CH2} & \\[-2pt]& \vert \\[-2pt]& \quad \quad \ce{COO-} &\end{array}\) | \(\begin{array}{ccc}& \text{High pH} & \\[6pt]& \quad\ce{NH2} & \\[-2pt]& \vert \\[-2pt]& \quad \ce{CH2} & \\[-2pt]& \vert \\[-2pt]& \quad \quad \ce{COO-} &\end{array}\) |
חישוב $\text{p}I$ לגליצין:
\[\text{p}I = \frac{\text{p}K_{a1} + \text{p}K_{a2}}{2} = \frac{2.34 + 9.6}{2} = 5.97\]כלל: $\text{p}I$ הוא תמיד הממוצע בין שני ה-$\text{p}K_a$ שמעבירים את המולקולה מ-מטען $+1$ למטען $-1$
דוגמה: היסטידין (חומצת אמינו עם R מתיינן)
היסטידין בעלת שלושה $\text{p}K_a$:
- קצה קרבוקסילי: $\text{p}K_a \approx 1.8$
- שרשרת צד (R): $\text{p}K_a \approx 6.0$
- קצה אמיני: $\text{p}K_a \approx 9.17$
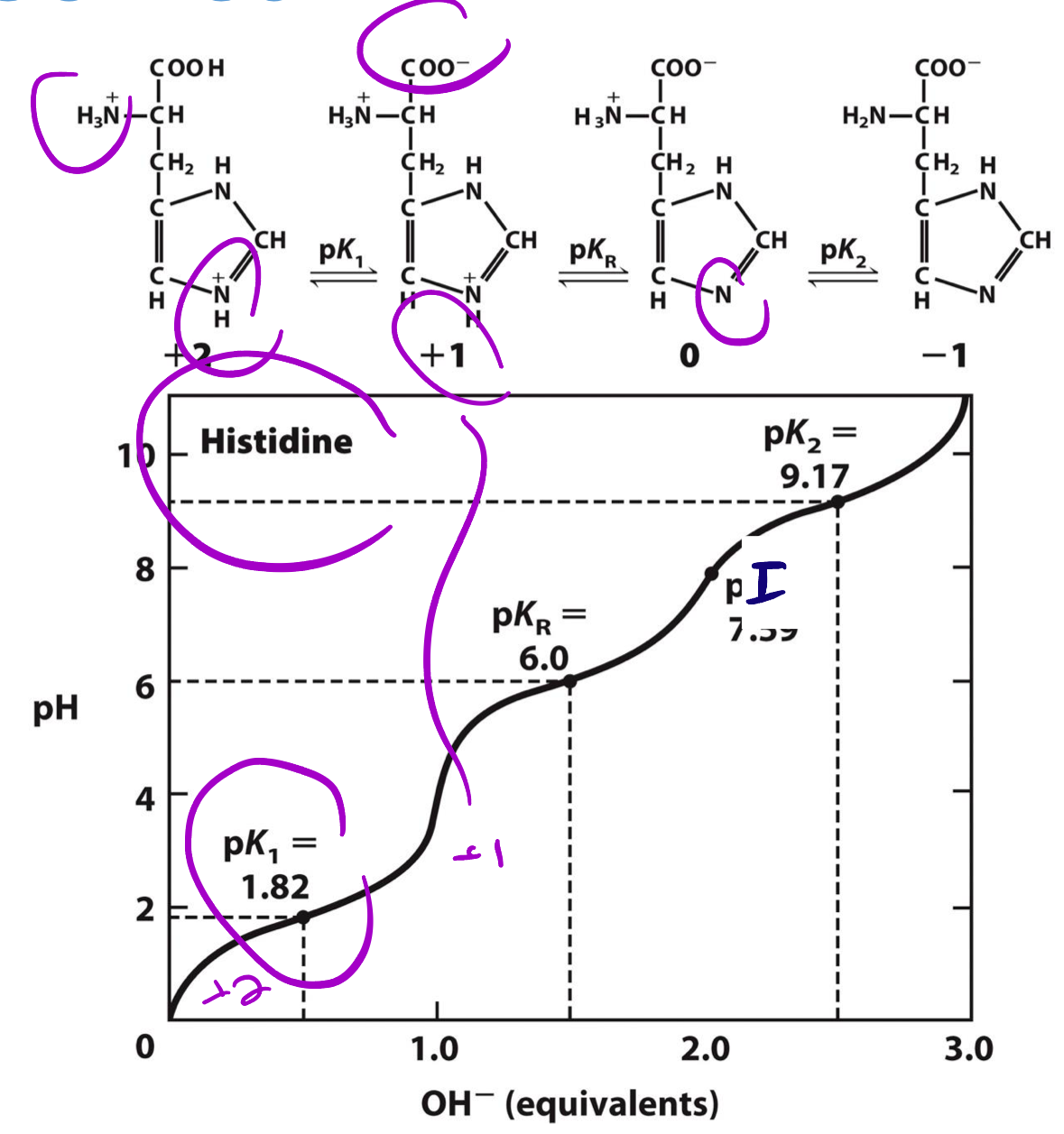
חישוב $\text{p}I$:
\[\text{p}I = \frac{6.0 + 9.17}{2} = 7.59\]נשתמש בשני ה-$\text{p}K_a$ שבינהם המטען הכולל = 0
סיווג חומצות אמינו לפי תכונות כימיות
1. חומצות אמינו הידרופוביות (אליפטיות)
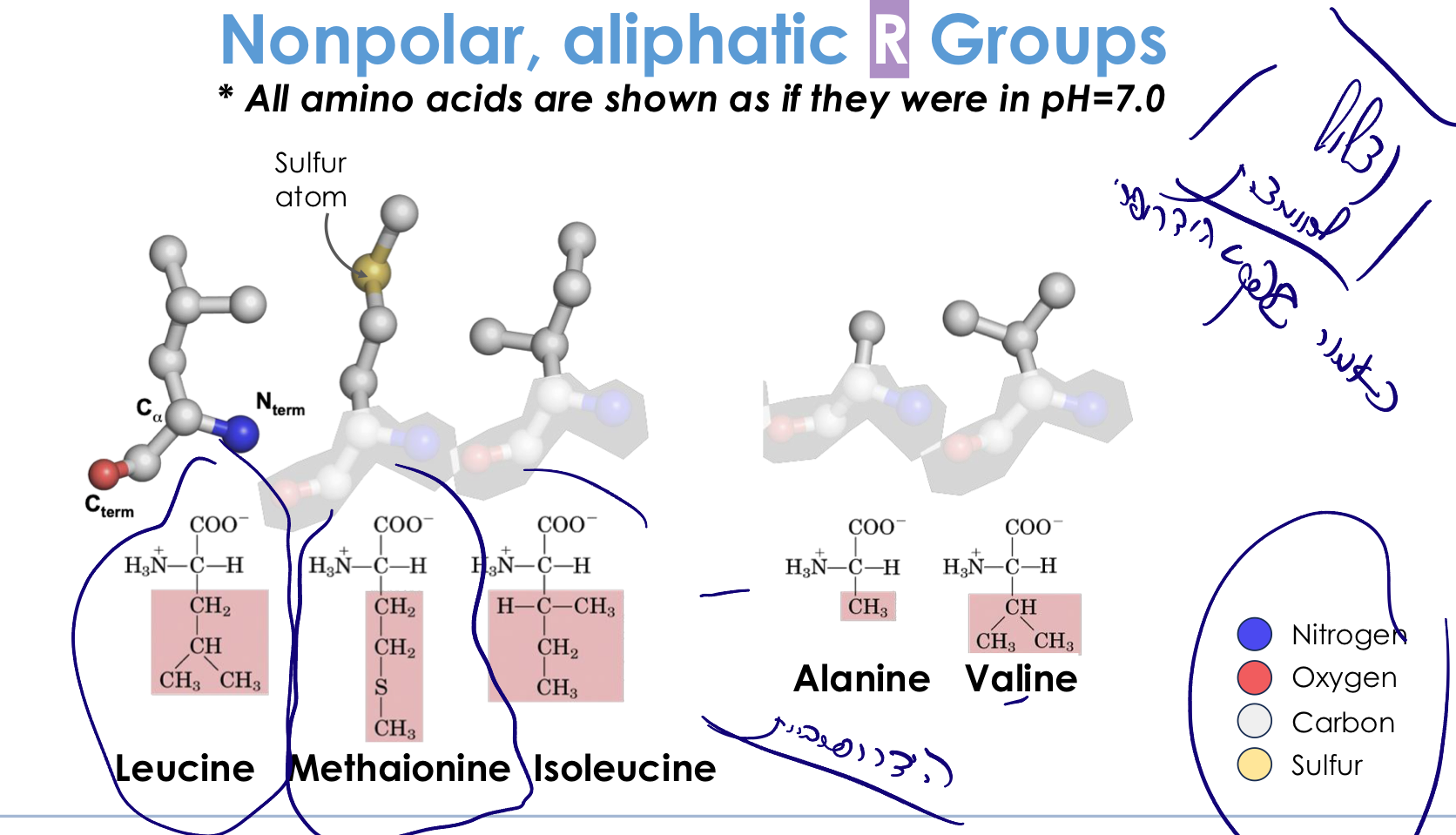
מאפיינים:
- שרשרות צד המורכבות בעיקר מפחמנים
- לא אוהבות מים
- נמצאות בדרך כלל בתוך ליבת החלבון (ליבה הידרופובית)
- שומרות על יציבות החלבון דרך אינטראקציות ואן-דר-ואלס
דוגמאות:
- לאוצין (Leucine)
- איזולאוצין (Isoleucine)
- ואלין (Valine)
- אלנין (Alanine)
- מתיונין (Methionine) - מכילה גופרית (S), יכולה להראות ריאקטיביות מסוימת
2. חומצות אמינו ארומטיות
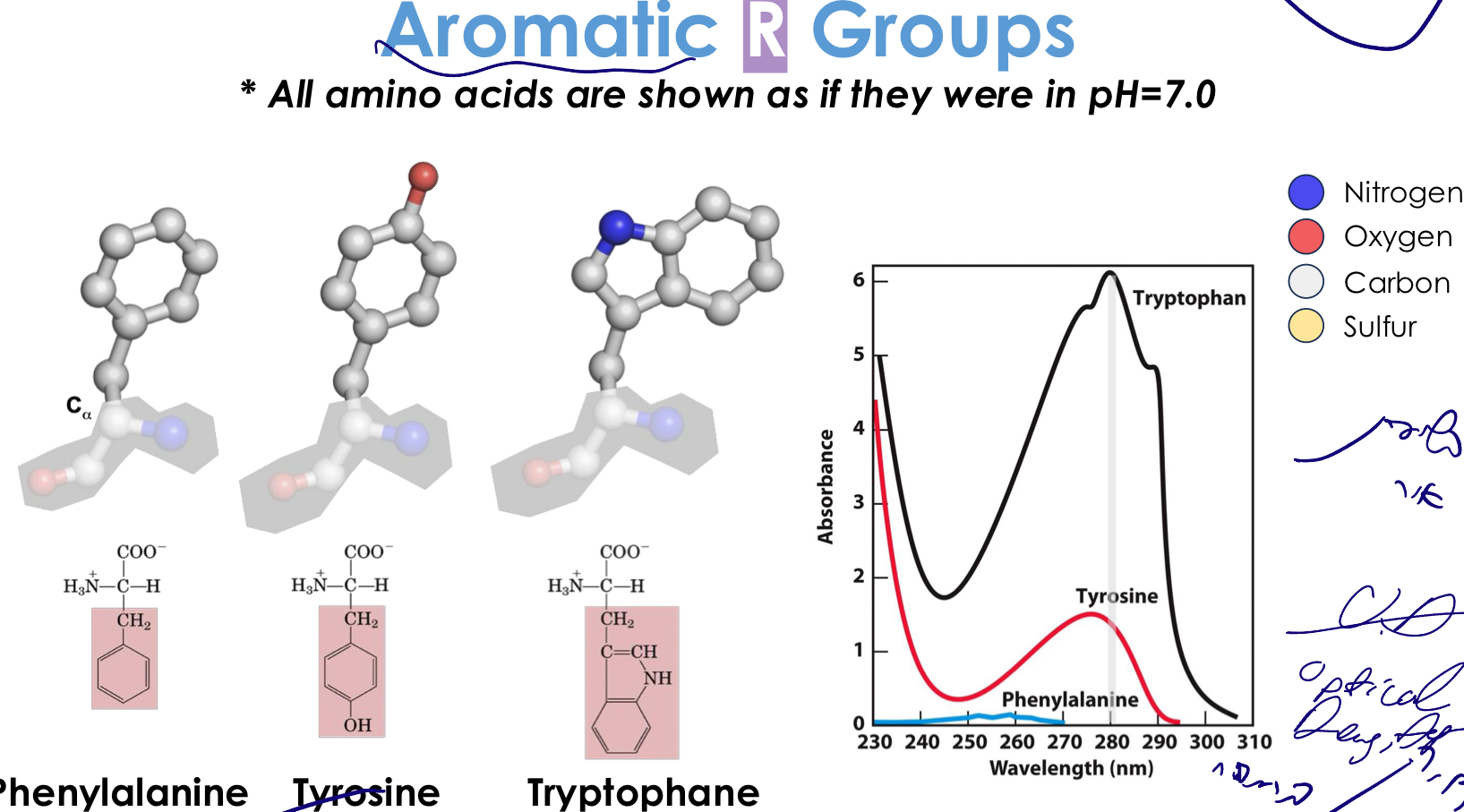
מאפיינים:
- מכילות טבעות בנזן
- ענני אלקטרונים π מעל ומתחת למישור הטבעת
- בעלות תכונות בליעת אור ייחודיות - חשוב למחקר!
- בעיקר הידרופוביות, אך יש להן גם תכונות פולריות מסוימות
החומצות הארומטיות:
- פנילאלנין (Phenylalanine) - טבעת בנזן פשוטה
- טירוזין (Tyrosine) - טבעת בנזן + קבוצת OH
- טריפטופן (Tryptophan) - שתי טבעות (אינדול)
בליעת אור של חומצות ארומטיות
חומצות ארומטיות בולעות אור באזור ה-UV (~280 nm):
| חומצת אמינו | אורך גל מקסימלי | בליעה יחסית |
|---|---|---|
| טריפטופן | $280 \, \mathrm{nm}$ | הכי גבוהה (×6) |
| טירוזין | $280 \, \mathrm{nm}$ | בינונית (×1) |
| פנילאלנין | $260 \, \mathrm{nm}$ | נמוכה מאוד |
יחס בליעה: 6 טירוזינים ≈ 1 טריפטופן (ב-$280 \, \mathrm{nm}$)
חוק באר-למברט (Beer-Lambert)
\[A = \varepsilon \cdot l \cdot c\]כאשר:
- $A$ = Absorbance (בליעה)
- $\varepsilon$ = מקדם הבליעה (תכונה של החומר)
- $l$ = אורך מסלול האור (בדרך כלל $1 \, \mathrm{cm}$)
- $c$ = ריכוז החומר
שימוש מעשי:
- מדידת ריכוז חלבון ב-$280 \, \mathrm{nm}$
- אם יודעים כמה טריפטופנים יש בחלבון ← אפשר לחשב את $\varepsilon$
- משם אפשר למדוד ריכוז מדויק
פלואורסצנציה
טריפטופן גם מראה פלואורסצנציה:
- עירור: $\sim 279 \, \mathrm{nm}$
- פליטה: $\sim 330 \, \mathrm{nm}$
- שימושי למחקר חלבונים
3. חומצות אמינו פולריות (לא טעונות)
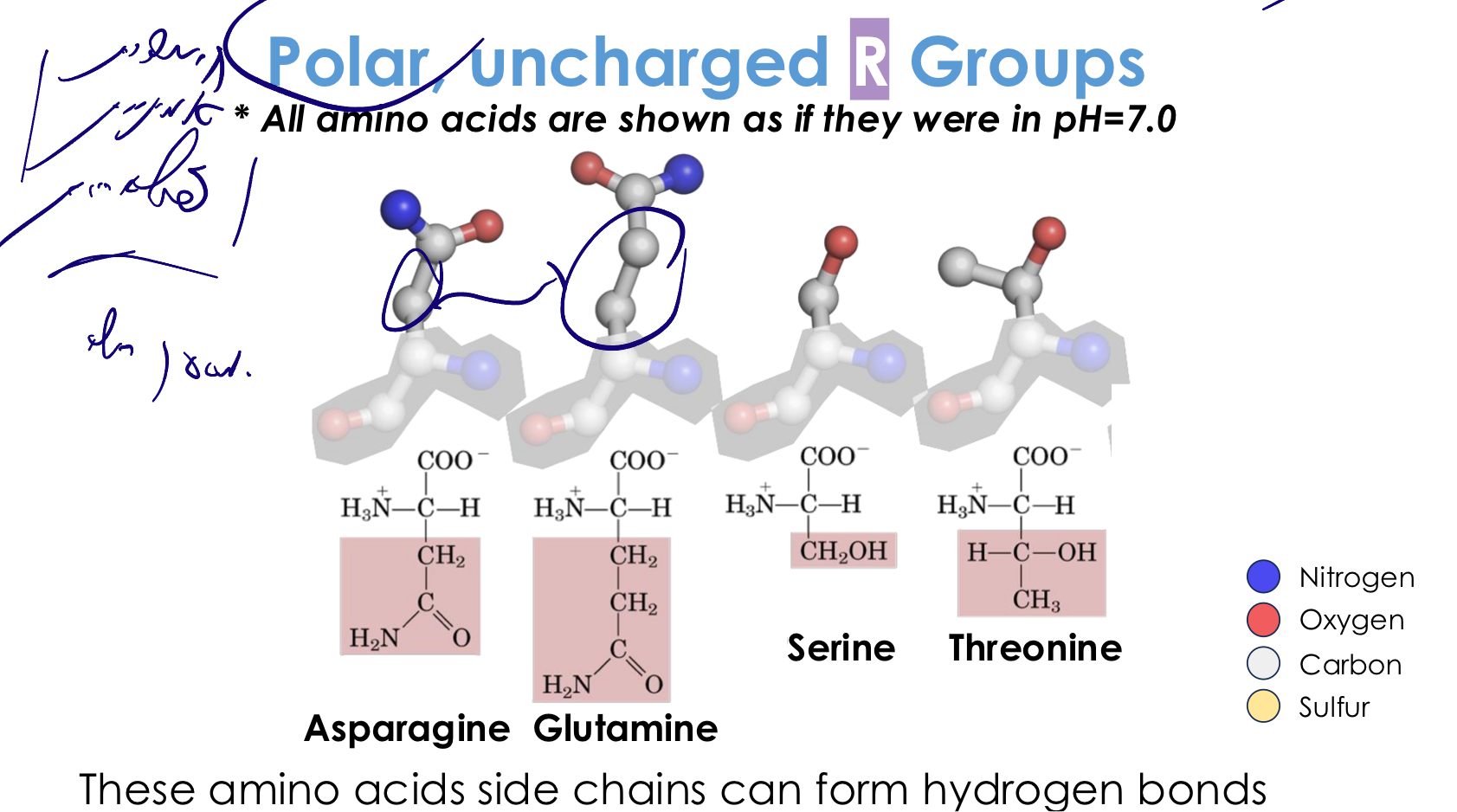
מאפיינים:
- מכילות קבוצות שיכולות ליצור קשרי מימן
- אוהבות סביבה הידרופילית
- בדרך כלל על פני השטח של החלבון
החומצות הפולריות:
- סרין (Serine) - $\ce{-CH2-OH}$
- קבוצת הידרוקסיל
- חשובה מאוד כשריר קטליטי באנזימים רבים
- מבצעת התקפות נוקלאופיליות
- תריאונין (Threonine) - $\ce{-CH(OH)-CH3}$
- דומה לסרין + קבוצת מתיל
- אספרגין (Asparagine) - $\ce{-CH2-CO-NH2}$
- קבוצת אמיד
- שים לב: לא אספרגוס! (טעות נפוצה בתקשורת)
- גלוטמין (Glutamine) - $\ce{-CH2-CH2-CO-NH2}$
- כמו אספרגין + פחמן נוסף
חשיבות סרין ותריאונין:
- טרגט למודיפיקציות פוסט-טרנסלציוניות
- פוספורילציה על Ser/Thr ← בקרה על תהליכים תאיים
- חלק ממערכות קינאזות רבות
4. חומצות אמינו טעונות שלילית (חומציות)
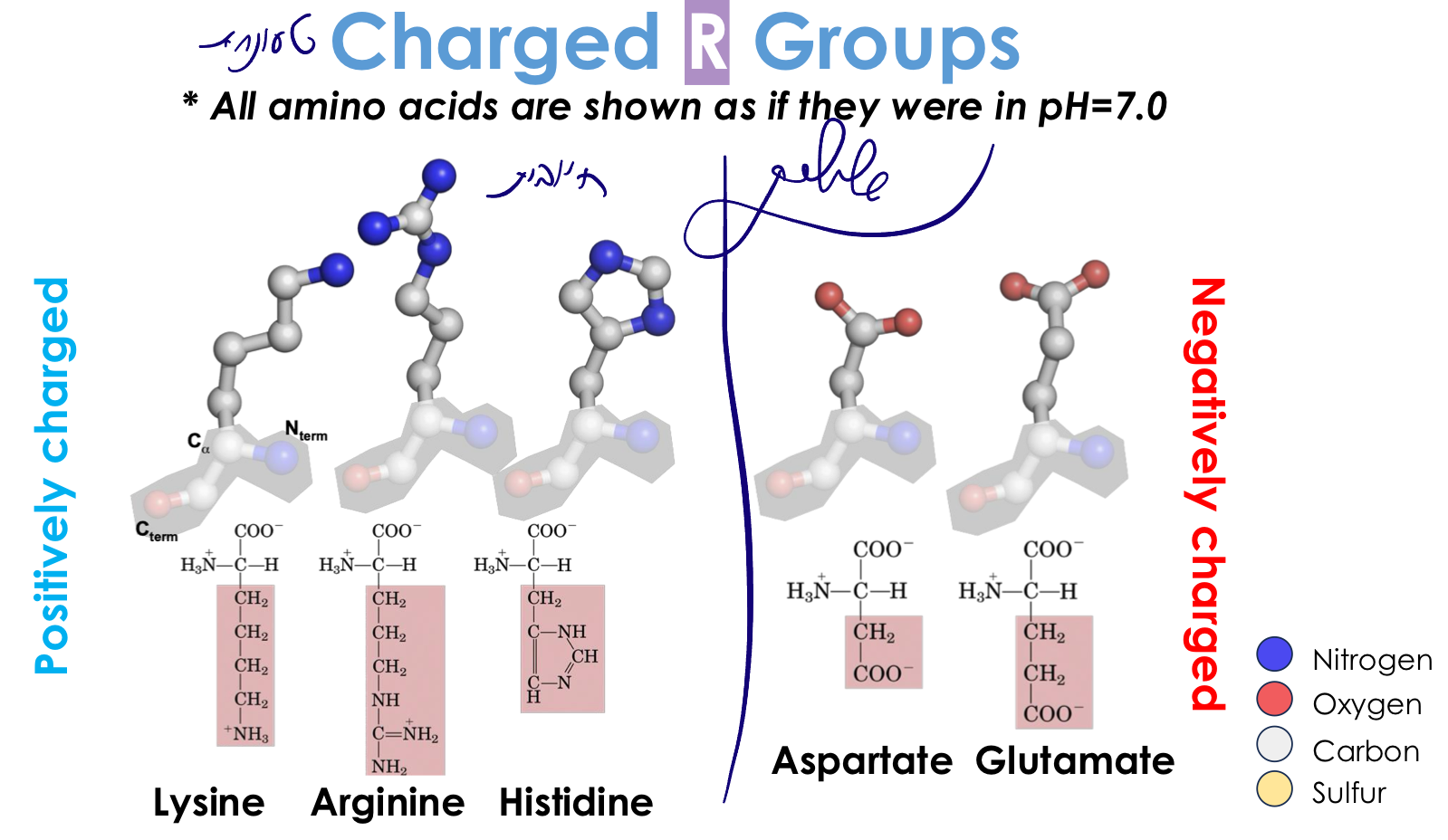
מאפיינים:
- מכילות קבוצת קרבוקסיל נוספת: $\ce{-COOH}$
- $\text{p}K_a \approx 3-4$ ← ב-pH 7 תמיד טעונות שלילית ($\ce{COO-}$)
החומצות החומציות:
- אספרטט (Aspartate) - $\ce{-CH2-COO-}$
- שרשרת קצרה
- גלוטמט (Glutamate) - $\ce{-CH2-CH2-COO-}$
- שרשרת ארוכה יותר
יש רזוננס בין קבוצת הקרבוניל ל-OH ← מייצב את המטען השלילי
5. חומצות אמינו טעונות חיובית (בסיסיות)
מאפיינים:
- בעלות קבוצות שיכולות לקבל פרוטון
- $\text{p}K_a$ גבוה ← ב-pH 7 תמיד טעונות חיובית
החומצות הבסיסיות:
- ליזין (Lysine) - $\ce{-(CH2)4-NH3+}$
- שרשרת ארוכה עם קבוצת אמין
- $\text{p}K_a \approx 10$
- ארגינין (Arginine) - $\ce{-(CH2)3-NH-C(NH2)2+}$
- קבוצת גואנידיניום
- מטען חיובי מפוזר (רזוננס) ← יציב מאוד
- $\text{p}K_a \approx 12$
- היסטידין (Histidine) - טבעת אימידזול
- מיוחדת! $\text{p}K_a \approx 6$ (קרוב ל-pH 7)
- יכולה להיות טעונה או לא ב-pH פיזיולוגי
- חשובה מאוד לבקרת pH בחלבונים
- נמצאת באתרים פעילים שצריכים רגישות ל-pH
מדוע היסטידין מיוחדת?
- ב-pH 6: $\ce{Imidazole-H+ <=> Imidazole + H+}$
- יכולה לעבור פרוטונציה/דה-פרוטונציה בקלות ב-pH פיזיולוגי
- משמשת כחומצה/בסיס כללי בתגובות אנזימטיות
6. חומצות אמינו מיוחדות
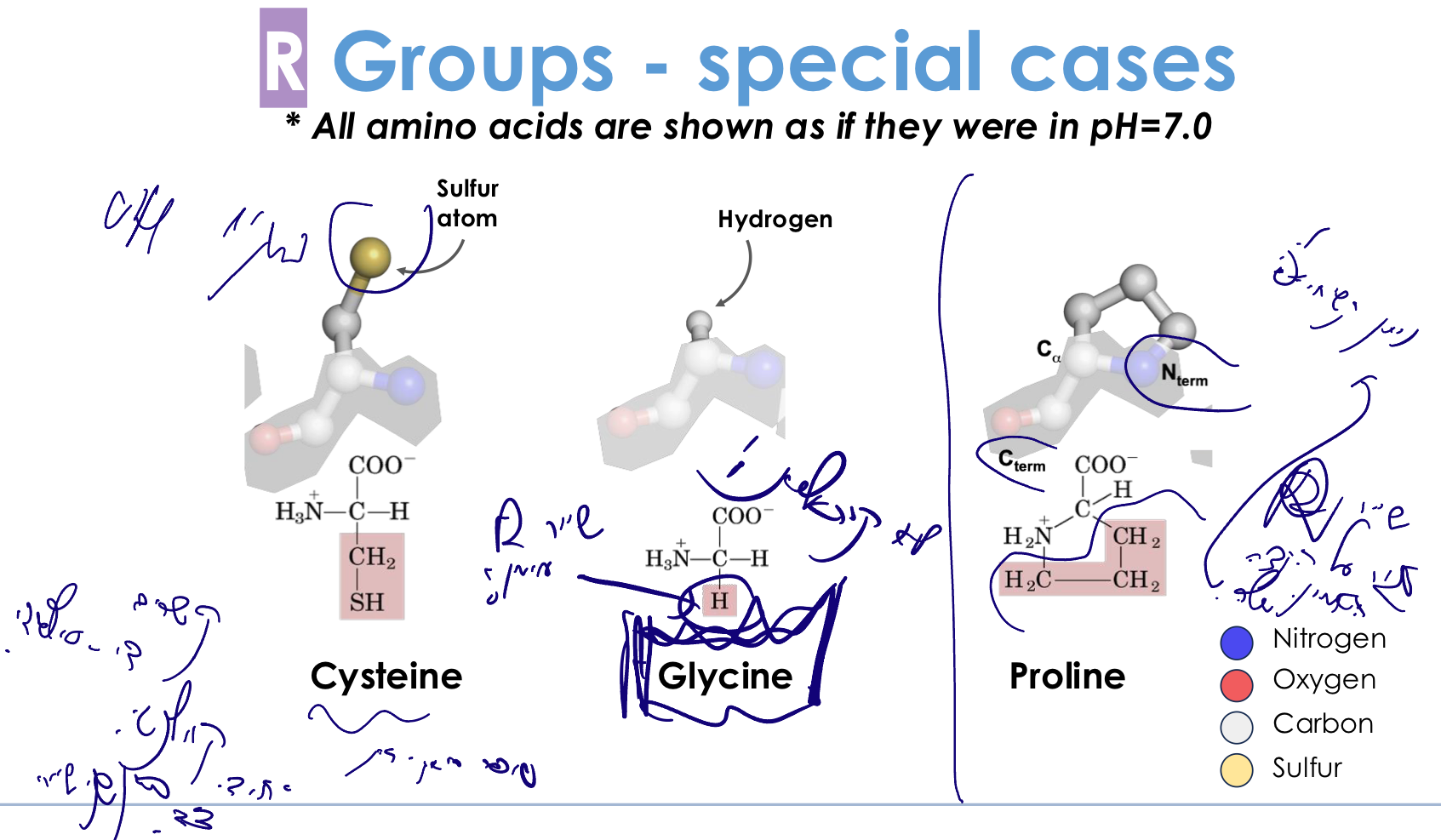
ציסטאין (Cysteine) - $\ce{-CH2-SH}$
מאפיינים:
- דומה לסרין, אך במקום $\ce{-OH}$ יש $\ce{-SH}$ (קבוצת תיול)
- יכולה ליצור קשרי דיסולפיד: $\ce{2 Cys -> Cys-S-S-Cys}$
- הקשר הקוולנטי היחידי בין שרשרות צד!
תנאים ליצירת קשרי דיסולפיד:
- נדרשת סביבה מחמצנת (לא מחזרת)
- יכול להיות בין שני ציסטאינים באותו חלבון
- יכול להיות בין שני חלבונים שונים
חשוב: הקשר נקרא “דיסולפידי”, החומצה נקראת “ציסטאין” כאשר שני ציסטאינים מחוברים: ציסטין (Cystine)
גליצין (Glycine) - $\ce{-H}$
מאפיינים מיוחדים:
- השרשרת הצדדית: מימן בלבד
- החומצת האמינו היחידה שאינה כיראלית!
- פחמן α אינו פחמן אסימטרי
- השרשרת הקטנה ביותר ← גמישות מקסימלית
חשיבות:
- מאפשרת זוויות סיבוב שחומצות אמינו אחרות לא יכולות
- חיונית למבני חלבון מורכבים
- נמצאת לעיתים קרובות בסיבובים חדים של שרשרת הפפטיד
פרולין (Proline)
מאפיינים מיוחדים:
- השרשרת הצדדית סגורה על הקצה האמיני
- יוצרת מבנה ציקלי (טבעת 5 חברים)
- הפוכה מגליצין ← קשיחות מקסימלית
השפעה על מבנה חלבון:
- מגבילה מאוד את זוויות הסיבוב
- משבשת מבני α-helix
- יוצרת סיבובים/כיפופים בשרשרת הפפטיד
- נפוצה בcollagen (כל שלישי שריר!)
משמעות התכונות למבנה חלבון
המגוון הקומבינטורי
השוואה לשפה:
| שפה | מספר “אותיות” | מספר אפשרויות (לרצף באורך 8) |
|---|---|---|
| DNA | 4 (A,T,G,C) | $4^8 = 65,536$ |
| אנגלית | 26 | $26^8 \approx 2.1 \times 10^{11}$ |
| חלבונים | 20 | $20^8 = 2.56 \times 10^{10}$ |
המסקנה: 20 חומצות אמינו נותנות גיוון עצום של אפשרויות!
ה-One Letter Code
חומצות האמינו מקודדות באות אחת (A-Z ללא B, J, O, U, X, Z בשימוש סטנדרטי):
- נוח לכתיבה ולניתוח ביואינפורמטי
- מקל על השוואת רצפים
משמעות אבולוציונית
שימור רצף = שימור פונקציה
דוגמה: המוגלובין
- המוגלובין של סוס vs. בן אדם: >80% זהות
- חלבונים בסיסיים (כמו ציטרט סינתאז): שימור גבוה מאוד בין מינים רחוקים
כלל: חלבונים עם פונקציה דומה יש להם רצפים דומים
מודיפיקציות פוסט-טרנסלציוניות (PTM)
מהן מודיפיקציות?
הוספת קבוצות כימיות לחומצות אמינו לאחר התרגום, על ידי אנזימים ספציפיים.
סוגי מודיפיקציות נפוצות
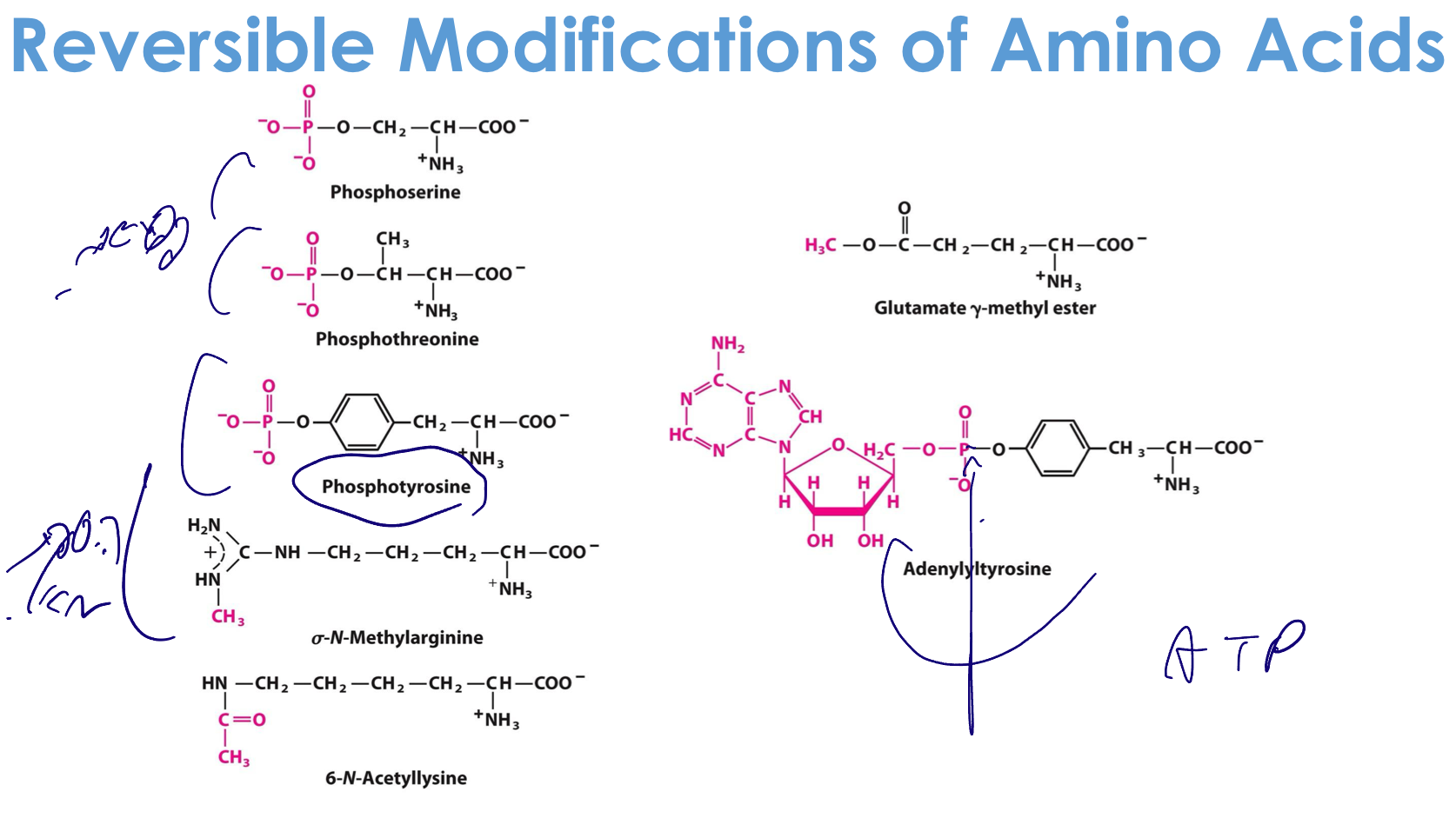
1. פוספורילציה (Phosphorylation)
הוספת קבוצת פוספט ($\ce{-PO4^2-}$) על:
- Ser (סרין)
- Thr (תריאונין)
- Tyr (טירוזין)
חשיבות:
- בקרה על פעילות חלבונים
- אותות תאיים (קינאזות/פוספטאזות)
- ריברסיבילית (ניתנת להסרה)
שינוי מינוח: האקדמיה מעדיפה “זירחון” (הוספת קבוצה זרחתית) על “זרחון”
2. מתילציה (Methylation)
הוספת קבוצת מתיל ($\ce{-CH3}$) על:
- ליזין
- ארגינין
- היסטידין
חשיבות:
- רגולציה אפיגנטית (על היסטונים)
- סימון חלבונים
3. אצטילציה (Acetylation)
הוספת קבוצת אצטיל ($\ce{-CO-CH3}$) על:
- ליזין (בעיקר)
- N-terminus
חשיבות:
- רגולציה של מבנה כרומטין
- בקרת שעתוק
4. מודיפיקציות נדירות יותר
- γ-קרבוקסי-גלוטמט - גלוטמט עם $\ce{-COOH}$ נוספת
- קישור דיסולפידי (Cys-Cys)
- אדנילציה - הוספת קבוצת אדנוזין (דרך הפוספט)
- דסמוזין - מודיפיקציה מורכבת המחברת מספר ליזינים (באלסטין)
חשיבות ה-PTM
- שינוי פעילות החלבון
- שינוי מיקום בתא
- שינוי אינטראקציות עם חלבונים אחרים
- בקרה זמנית על פונקציות
- יצירת מגוון פונקציונלי מאותו גן
חומצת אמינו נוספת: סלנוציסטאין
קידוד יוצא דופן
סלנוציסטאין (Selenocysteine, Sec, U):
- דומה לציסטאין, אך במקום S יש Se (סלניום)
- נקראת “חומצת האמינו ה-21”
- אינה מקודדת בקוד הגנטי הסטנדרטי!
מנגנון הקידוד
קידוד מיוחד דרך קודון STOP:
- קודון $\ce{UGA}$ (בדרך כלל קודון עצירה)
- רצף SECIS במבנה ה-mRNA (stem-loop ב-3’ UTR)
- הרכבה ייחודית בריבוזום
- ← הכנסת Sec במקום עצירה
mRNA: 5' --- UGA --- [SECIS element] --- poly(A) 3'
↓
Selenocysteine
דרישות:
- מבנה מרחבי ספציפי ב-mRNA
- אנזימים ייעודיים
- tRNA מיוחד (tRNA[Ser]Sec)
תפקידים ביולוגיים
- אנזימי חיזור (Glutathione peroxidase)
- פונקציות אנטי-אוקסידטיביות
- נדיר יחסית (25 חלבונים בבני אדם)
כללי חשיבות
1. אינטראקציות ביולוגיות הן סטריאו-ספציפיות
כלל הזהב: אינטראקציות בין מולקולות ביולוגיות דורשות התאמה מרחבית מדויקת
דוגמאות:
ציטרט במעגל קרבס
- האנזים מזהה רק L-ציטרט
- D-ציטרט לא מזוהה ולא מעובד
- חוסר התאמה תלת-ממדית למקום הפעיל
D-אמינו חומצות בחיידקים
- דופן התא החיידקי מכיל D-אמינו חומצות
- מערכת החיסון שלנו בדרך כלל לא מזהה D-peptides
- מנגנון הגנה של החיידק
- (אבל אכן התפתחו אנזימים שמפרקים גם D-peptides)
2. ב-pH פיזיולוגי רוב החלבונים כ-Zwitterions
- בגוף (pH ≈ 7.4): רוב חומצות האמינו בצורת צוויטריון
- חשוב לתכונות מסיסות ולאינטראקציות
3. טבלת עזר
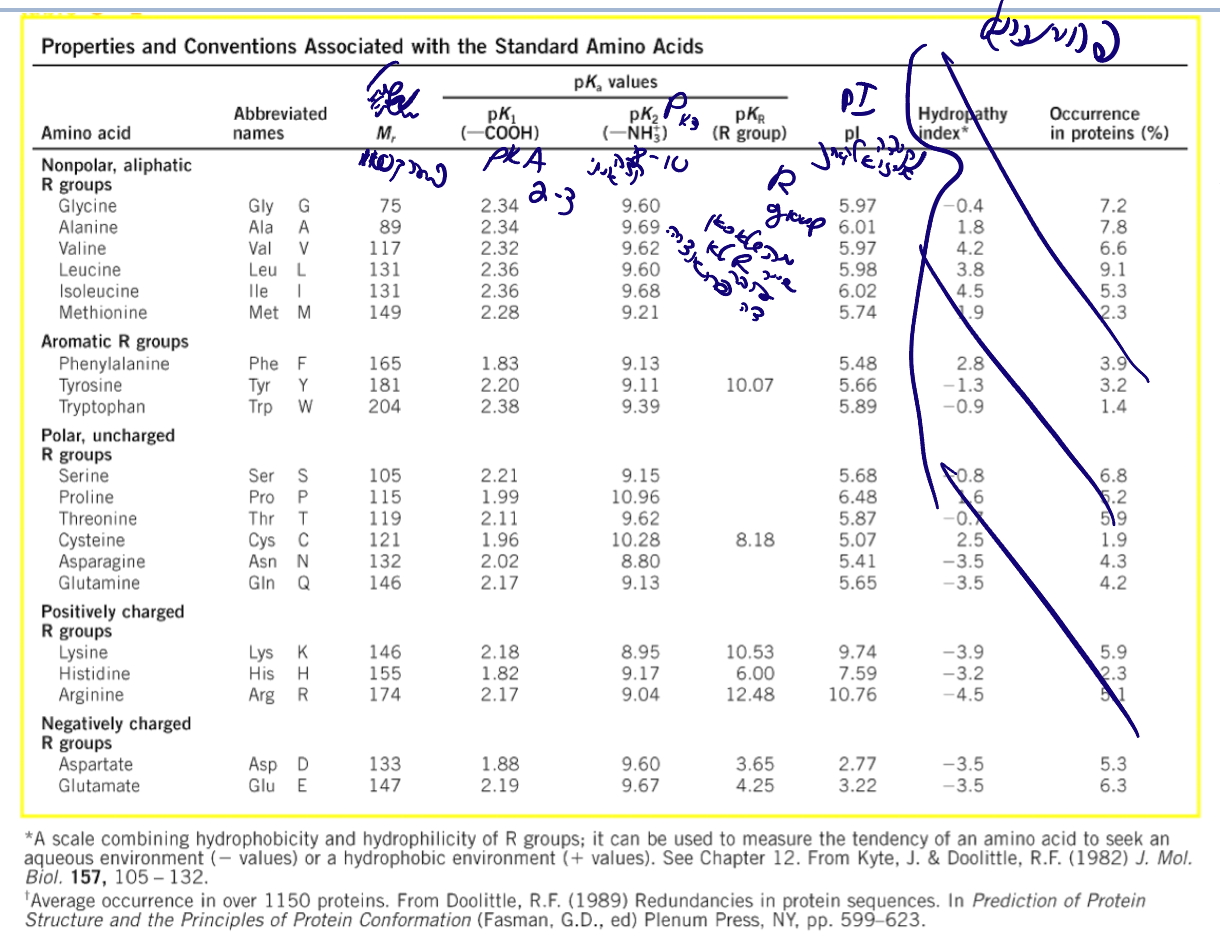
בכל בחינה/תרגיל תקבלו:
- מבנה כל 20 חומצות האמינו
- One-letter code
- Three-letter code
- $\text{p}K_a$ של כל קבוצה מתיינת
- $\text{p}I$ (נקודה איזו-אלקטרית)
- משקל מולקולרי
משקל ממוצע: $\approx 110 \, \mathrm{Da}$ (דלטון)
4. נוסחאות שימושיות
חוק באר-למברט:
\[A_{280} = \varepsilon_{280} \cdot l \cdot c\]נקודה איזו-אלקטרית:
\[\text{p}I = \frac{\text{p}K_{a,i} + \text{p}K_{a,i+1}}{2}\]כאשר $i$ ו-$i+1$ הם שני ה-$\text{p}K_a$ שבינהם מטען נטו = 0
סיכום טרמינולוגיה
| מונח | הגדרה |
|---|---|
| דה-פרוטונציה | אובדן פרוטון ($\ce{-H+}$) |
| יינון | יצירת מטען (לא תמיד מדויק!) |
| $\text{p}K_a$ | pH שבו 50% מהמולקולות עברו דה-פרוטונציה |
| $\text{p}I$ | pH שבו מטען נטו = 0 |
| Zwitterion | מולקולה עם מטען + ומטען - |
| Buffer zone | אזור שבו שינוי pH מינימלי (ליד $\text{p}K_a$) |
מה הלאה?
בשיעור הבא (יום חמישי):
- הקשר הפפטידי - מבנה ותכונות
- תחילת מבני חלבונים (מבנה ראשוני, שניוני, שלישוני, רביעוני)
- איך חומצות האמינו השונות משפיעות על מבנה ופונקציה
זכרו:
- כל מה שנלמד = חשוב לבחינה
- התרגול מחר יעסוק בחישובי $\text{p}I$ ו-$\text{p}K_a$
- הגיעו בזמן (10:00)!